大泷六线鱼(Hexagrammos otakii)隶属于鲉形目六线鱼科六线鱼属,富含不饱和脂肪酸、氨基酸及微量元素,主要分布在山东、辽宁等地沿海的多岩礁海域,是中国北部沿海地区的重要经济鱼类,具备较高的经济价值[1]。
鱼肉在贮藏过程中,脂质和蛋白质发生氧化是鱼肉品质下降的主要原因之一,Robinson1924年首次提出血红蛋白能诱导脂质和蛋白氧化[2]。与绝大多数的畜牧动物相比,仅有个别种类的鱼在宰杀加工前通过放血方式移除部分血红蛋白,但在国内零售市场流通中大多仍习惯于整鱼出售。在冷藏条件下,鱼肉中残留的血红蛋白作为脂质和蛋白质的促氧化因子参与氧化反应,加快了鱼肉脂质和蛋白质氧化造成的鱼肉品质劣变速度。
鱼类的血液包含血浆和血细胞,血细胞内的血红蛋白是一种结合蛋白,是由血红素和珠蛋白构成的近似球形的缀合蛋白质,分子量约为6.2×104,具有异源四聚体结构。血红蛋白四聚体的每个亚基都结合有一个血红素配基并具有一个氧结合部位,血红素分子的中心是一个铁离子,使其具备携氧的功能[3]。血红蛋白作为一种含血红素的蛋白质,极易发生降解和自氧化。血红蛋白在储存过程中可降解生成珠蛋白和血红素,血红素在氧化剂的作用下可进一步降解形成原卟啉并释放出游离的铁离子。血红素和游离的铁原子已被证实对蛋白质氧化和脂质氧化具有促进作用,对肉品的质构、保水性和色泽等品质指标均具有显著影响。游离铁离子具有很强的催化活性,引发脂质过氧化链式反应,生成大量的氧化产物,不仅导致鱼肉的酸价升高,还会产生不良气味,严重影响鱼肉的品质。同时鱼肉在铁离子的催化下还会发生蛋白质氧化,自由基会使蛋白质分子发生交联、降解及氨基酸残基的修饰,造成蛋白质的结构改变,进而丧失原有的功能特性,降低了鱼肉的加工性能和食用品质。血红蛋白自氧化途径主要是血红蛋白与氧气结合,Fe2+被氧化成Fe3+,形成高铁血红蛋白,进而影响鱼肉的颜色,并对品质造成影响[4]。
鱼类放血处理能够减少鱼肉中血红蛋白的含量,对脂质氧化和蛋白质氧化具有明显的抑制作用。与不放血处理的肉品相比,经过放血的肉品因颜色更鲜红更受欢迎。尽管血红蛋白对肉制品的氧化作用已有相关报道,但血红蛋白参与鱼肉氧化的具体作用机制尚不清晰。因此,通过放血和不放血两种方法处理,探究冷藏过程中鱼肉血红蛋白的变化对鱼肉品质、脂质和蛋白氧化的影响,明确其引起鱼肉氧化变化的机制,对优化大泷六线鱼的保鲜和加工工艺、延长其货架期有着重要的现实意义。
1 材料与方法
1.1 材料
试验鱼:大泷六线鱼购自当地市场,平均体长为(25±2)cm,平均体质量为(450±50)g,取样时间为鱼致死后0、1、2、3、4、5 d。 氯化血红素,连二硫酸钠,柠檬酸钠,碳酸氢钠溶液,醋酸铵溶液,氯化铁,氯仿,甲醇,硫氰酸铵,氢氧化钠,丙酮,三氯乙酸,抗坏血酸,硝酸,氯化钠,盐酸羟胺,乙酸钠,邻菲罗啉等试剂均为分析纯,购自天津市科密欧化学试剂有限公司、国药集团化学试剂有限公司等。
试验仪器:数显恒温水浴锅(SYG-2,常州朗越仪器制造有限公司),涡旋混合器(VORTEX-5,江苏其林贝尔仪器制造有限公司),数显高速分散均质机(FZ3000-SH,上海标本制造厂),台式离心机(TG16-WS,湘仪离心机仪器有限公司),多功能酶标仪(Synergy HT,美国伯腾仪器有限公司),紫外可见分光光度计(Lambda 35,上海天美科学仪器有限公司)等。
1.2 方法
1.2.1 样品制备 试验分放血组和不放血组,放血组大泷六线鱼脑干抽血致死,不放血组大泷六线鱼敲击头部致死。之后将大泷六线鱼去除头、尾、鳞、内脏,流水冲洗后沿脊背剖成两片,将鱼肉分割成规格(2 cm×2 cm×2 cm) 一致的方块,冰水漂洗3次,将样品封装后冷藏于4 ℃条件下,于第0、1、2、3、4、5 天取样,测定相关品质指标。
1.2.2 血红蛋白含量的测定 参考![]() 等[5]方法并略作修改。称取鱼肉10.0 g,加入10.0 mL生理盐水均质20 s,加入1.7%NaCl 2.0 mL,Tris(0.1 mol/L,pH 8.0) 2.0 mL,然后进行离心(4 000 r/min,10 min,4 ℃),取上清,加入1.7%NaCl 2.0 mL、Tris(1.0 mol/L,pH 8.0) 2.0 mL,加入2-亚硫酸钠(0.5 mol/L) 10.0 mL,硫氰酸铵(1.0 mol/L)5.0 mL,反应2 h,在415 nm处测定吸光度,血红蛋白含量的计算公式为
等[5]方法并略作修改。称取鱼肉10.0 g,加入10.0 mL生理盐水均质20 s,加入1.7%NaCl 2.0 mL,Tris(0.1 mol/L,pH 8.0) 2.0 mL,然后进行离心(4 000 r/min,10 min,4 ℃),取上清,加入1.7%NaCl 2.0 mL、Tris(1.0 mol/L,pH 8.0) 2.0 mL,加入2-亚硫酸钠(0.5 mol/L) 10.0 mL,硫氰酸铵(1.0 mol/L)5.0 mL,反应2 h,在415 nm处测定吸光度,血红蛋白含量的计算公式为
血红蛋白含量![]()
(1)
式中:n为稀释倍数;64 450为血红蛋白的摩尔质量;4 400为摩尔吸光系数[L/(mol·cm)-1];A为样品的吸光度测定值。
1.2.3 血红素含量的测定 参考Wheal等[6]的方法并略作修改。取鱼肉10.0 g,加入生理盐水5.0 mL、乙醇(50%)5.0 mL均质20 s,搅拌30 min,离心(4 000 r/min,10 min,4 ℃),使血红蛋白游离,向其中加入氯仿10 mL,4 ℃下以6 000 r/min离心10 min,搅拌15 min,从而得到血红蛋白沉淀物。随后用5.0 mL浓度为0.15%的NaHCO3溶液溶解沉淀,再加入20.0 mL丙酮、1.0 mol/L的盐酸,pH调节至2.0,充分搅拌均匀,浸提20 min后,4 ℃下以8 000 r/min离心10 min,最终得到血红素丙酮溶液。在515 nm处测定吸光度。标准曲线计算公式为
y=4.2×10-3x+0.002 3, R2=0.999 6。
(2)
1.2.4 游离铁含量的测定 参考Nazari等[7]的方法并略作修改。称取鱼肉10.0 g,加入生理盐水10.0 mL均质20 s,加入0.9% NaCl 2.0 mL,过滤,收集滤液,加入乙醇(50%)10.0 mL,加入2%抗坏血酸、HCl(0.2 mol/L) 0.5 mL,加入 2-亚硫酸钠(0.5 mol/L)10.0 mL、柠檬酸钠(10%)5.0 mL,水浴加热10 min,以Fe标准溶液做标准曲线,在520 nm处测吸光度。标准曲线计算公式为
y=-2.9×10-3x+0.256 5, R2=0.999 7。
(3)
1.2.5 游离Fe2+含量测定 参考Harrington等[8]的方法并略作修改。称取鱼肉10.0 g,切碎后加入生理盐水10.0 mL均质20 s,离心(5 000 r/min,10 min,4 ℃),加入邻菲罗啉指示剂2.0 mL,摇匀,放置10 min,以Fe标准溶液做标准曲线,在510 nm处测吸光度,得总铁含量,在520 nm处测吸光度,得游离Fe2+含量。标准曲线计算公式为
y=5.9×10-3x+0.638 2, R2=0.999 7。
(4)
1.2.6 游离 Fe3+含量测定 参考Harrington等[8]的方法并略作修改。称取鱼肉10.0 g,切碎后加入生理盐水10.0 mL均质20 s,离心(5 000 r/min,10 min,4 ℃),加盐酸羟胺(1.0 mol/L) 5.0 mL,加入邻菲罗啉指示剂2.0 mL,摇匀,放置10 min,以Fe标准溶液做标准曲线,在515 nm处测吸光度,根据总铁含量-游离Fe2+含量计算游离Fe3+含量。
1.2.7 氧合血红蛋白、高铁血红蛋白含量的测定 参考Cao等[9]的方法并略作修改。用三波长法测定氧合血红蛋白、高铁血红蛋白的含量。利用双光束分光光度计对血红蛋白溶液进行全波长扫描,扫描范围为 500~700 nm,分别通过 560、576、630 nm 处的吸光度,代入以下公式进行计算
[OxyHb]=(-0.729 2A560+1.009 8A576-0.372 2A630)×10-4,
(5)
[MetHb]=(0.385 4A560+0.185 6A576+2.860 9A630)×10-4。
(6)
式中:0.729 2为OxyHb 560 nm处结合氧常数;1.009 8为OxyHb 576 nm处结合氧常数;0.372 2为OxyHb 630 nm处结合氧常数;0.385 4为MetHb 560 nm处结合氧常数;0.186 5为MetHb 576 nm处结合氧常数;2.860 9为MetHb 560 nm处结合氧常数;A560、A576、A630分别为560、576、630 nm处吸光度。
1.2.8 色差测定 色差仪型号为Ggilent 725,选取鱼肉腹部用色差仪进行在0、1、2、3、4、5 d进行分析。
1.2.9 过氧化值(peroxide value,POV)测定 取鱼肉样品5.0 g,加入冷氯仿-甲醇(V/V,1∶1)溶液20.0 mL 混合,以5 500 r/min均质1 min。加入0.5% NaCl溶液5.0 mL混合均匀,4 ℃下以5 500 r/min离心10 min,使之分为两相。吸取下层氯仿相3.0 mL,加入上述氯仿-甲醇混合溶液3.0 mL,再依次加入硫氰酸铵溶液(3 mol/L)100.0 μL 和氯化亚铁溶液(0.018 mol/L) 100.0 μL混匀,25 ℃下避光反应 20 min,吸取红色层溶液,测定其在500 nm处的吸光度。采用过氧化氢异丙苯标准液绘制标准曲线。标准曲线计算公式为
y=0.537 5x+0.262,R2=0.999 5。
(7)
1.2.10 TBARS含量测定 取鱼肉样品5.0 g置于容器中,加入浓度为10%的三氯乙酸(TCA)溶液20.0 mL,之后进行均匀混合。在混合均匀后,将总体积定容至25.0 mL。分别取出样品液2.0 mL和三正丁胺(TBA)溶液2.0 mL,将它们置于同一个容器中搅拌均匀。之后将混合物放入沸水中煮沸并加热60 min,然后让其冷却至室温。最后,通过分光光度计测量其在532 nm波长处冷却后溶液的吸光度。请使用1,1,3,3-四甲氧基丙烷(TMP)制备标准曲线。标准曲线计算公式为
y=0.025 38 x+0.003,R2=0.999 8。
(8)
1.2.11 羰基含量测定 将鱼肉1.0 g切碎后称取到50.0 mL的离心管中,向离心管倒入浓度为0.15 mol/L的KCl溶液10.0 mL。以10 000 r/min的速度匀浆,每次10 s,重复匀浆3次。沉淀蛋白质:将100 μL混合物吸取至2.0 mL离心管中,加入10%的三氯乙酸(TCA)溶液1.0 mL,以2 000 g下离心10 min,倒掉上层液体,留下沉淀。进行衍生反应:室温下避光条件下,向沉淀中分别加入浓度为0.2%的2,4-二硝基苯肼(DNPH,溶解在2 mol/L HCl中) 1.0 mL和2 mol/L HCl 1.0 mL,并静置1 h,每20 min涡旋振荡一次,每次持续30 s。再次冷藏并清洗:在光反应结束后,加入浓度为10%的TCA溶液 1.0 mL,用涡流器振荡30 s,随后在2 000 g的离心力下离心10 min,然后倒掉上清液。将沉淀用1.5 mL混合了乙醇和乙酸乙酯(比例为1∶1)的洗涤液进行洗涤,混匀后以15 000 g的离心力离心5 min,再重复洗涤操作两次。将沉淀重新悬浮并混合后,接种6 mol/L盐酸胍溶液(该溶液以20 mol/L KH2PO4为溶剂,pH为6.5) 1.5 mL,随后以4 000 g的离心力进行3 min的离心处理,最后测定在370 nm处的吸光度数值。计算公式为
羰基含量![]()
(9)
式中:A为370 nm 处吸光度,22 000 L/(mol·cm)-1 为摩尔吸光系数。
1.2.12 巯基含量测定 取切碎后鱼肉1.0 g与9.0 mL 0.6 mol/L KCl溶液进行匀浆(10 000 r/min,3×10 s),用双层脱脂棉纱布进行过滤,取100.0 μL滤液,加入磷酸盐缓冲液(0.1 mol/L KH2PO4,1 mol/L EDTA,pH 8.0,含8 mol/L尿素) 2.5 mL、10 mol/L DTNB 50.0 μL,涡旋混匀,避光放置15 min后,离心(4 500 g,5 min),取上清液,于412 nm 处测定吸光度值。计算公式为
总巯基含量![]()
(10)
式中:A为412 nm处吸光度;C为蛋白质浓度;13 600 L/(mol/cm)-1为摩尔吸光系数。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用IBM SPSS 26软件独立样本t检验进行显著性分析,差异性水平设为0.05。采用OriginPro2021(OriginLab Corporation,Massachusetts,US)附带相关图软件进行相关分析。
2 结果与分析
2.1 冷藏期间放血处理鱼肉血红蛋白变化
2.1.1 血红蛋白含量的变化 血红蛋白作为一种内源促氧化剂,是引发脂质氧化和蛋白氧化的诱因之一。根据文献报道,鱼肉的血红蛋白含量范围为2.87~22.63 mg/kg[10]。本试验两组鱼肉血红蛋白含量如图1所示,从图1可见,在5 d的冷藏过程中,两组鱼肉血红蛋白含量均呈下降趋势,放血组和不放血组血红蛋白含量分别从12.25、16.35 mg/kg减少到3.01、4.85 mg/kg,通过放血降低鱼肉中约30%的血红蛋白,且不放血组鱼肉血红蛋白含量显著高于放血组(P<0.05),这与Aranda等[11]在研究青鱼(Mylopharyngodon piceus)鱼肉血红蛋白在冷藏过程中的变化趋势一致。朱永宁[12]研究3种糖类物质对血红蛋白在冷冻贮藏中的影响时发现,蛋白质在低温下保存,经一定时间后会出现活性丧失且发生分解现象,推测在冷藏过程中鱼肉中残留的血红蛋白发生了分解,并生成了珠蛋白和血红素。
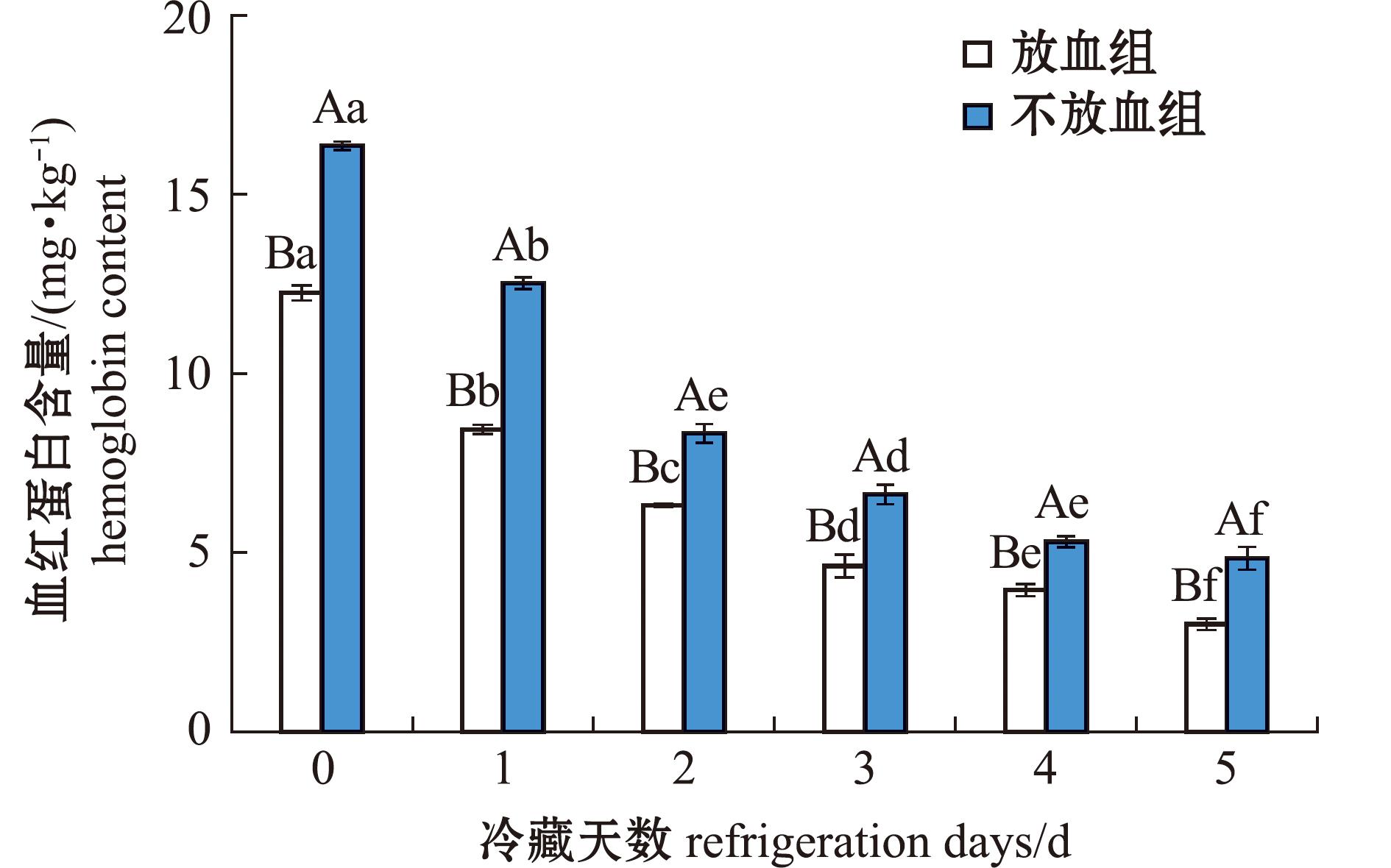
标有不同大写字母者表示组间有显著性差异(P<0.05),标有不同小写字母者表示组内有显著性差异(P<0.05),标有相同小写字母者表示组内无显著性差异(P>0.05),下同。
The means with different capital letters are significantly different among the groups at the 0.05 probability level,with different letters being significantly different at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 鱼肉冷藏期间血红蛋白含量的变化
Fig.1 Change of hemoglobin in frozen fish meat
2.1.2 血红素含量的变化 鱼肉中血红素主要来源于血红蛋白的降解。血红素是由一个Fe2+镶嵌在原卟啉环中构成的铁卟啉化合物,当卟啉环上的铁离子处于还原态(Fe2+)时,卟啉铁称为血红素。本试验两组鱼肉血红素含量如图2所示,从图2可见,在5 d冷藏过程中,两组鱼肉血红素含量均呈上升趋势,而后随冷藏时间延长逐渐下降,且放血组血红素含量显著低于不放血组(P<0.05)。结合图1结果,说明在鱼肉冷藏过程中血红蛋白发生了降解,生成了血红素,并导致血红素含量上升,这与Zhang等[13]在研究鱼肉中血红素在贮藏过程中会发生分解的研究结论一致,研究证实,血红蛋白降解成血红素后,血红素加氧酶会降解血红素释放出亚铁离子[14]。推测随冷藏时间延长,血红素再次发生了降解,并释放出游离的铁离子,血红素含量下降。
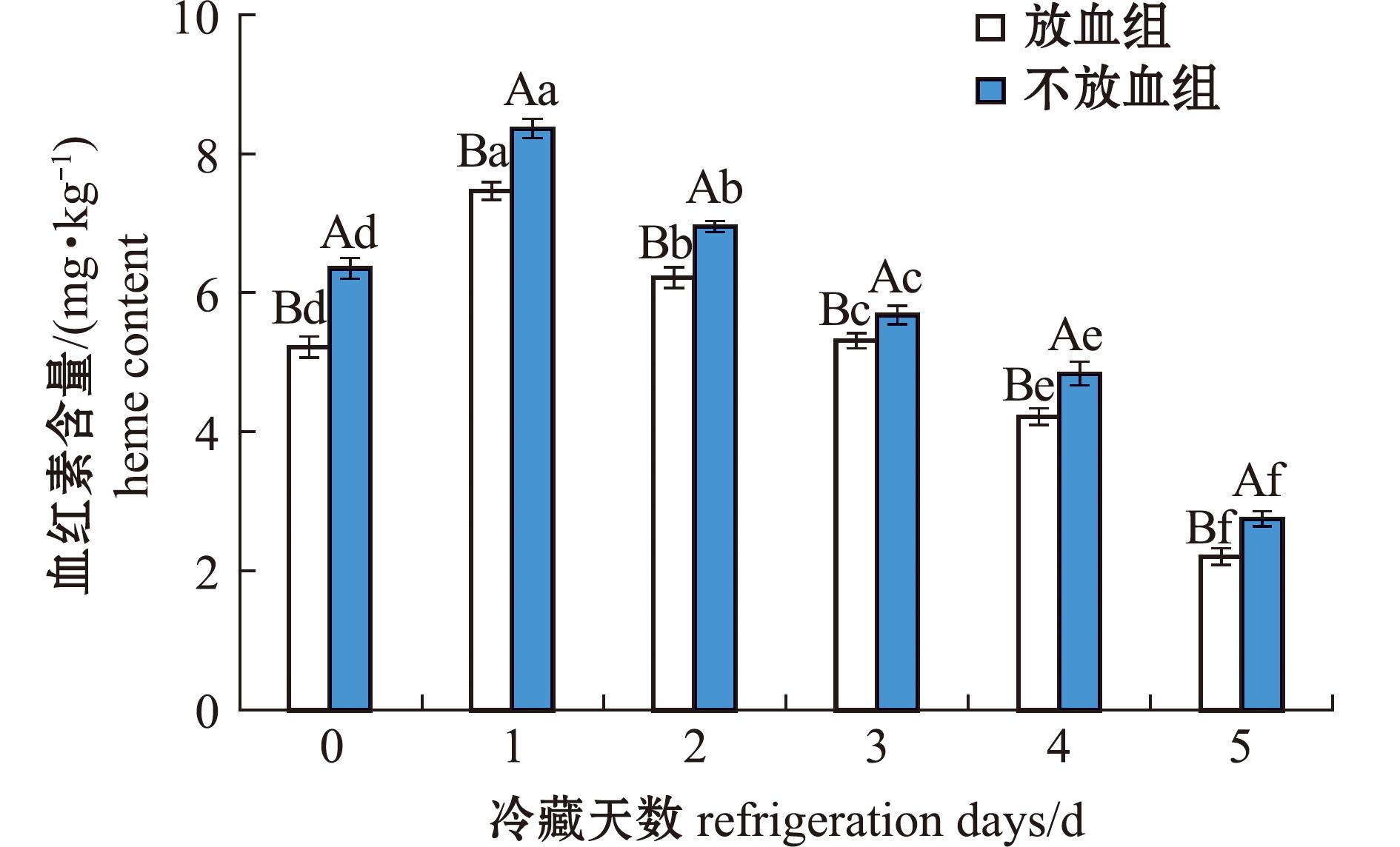
图2 鱼肉冷藏期间血红素含量的变化
Fig.2 Change of heme in frozen fish meat
2.1.3 游离铁含量的变化 血红素和游离的铁离子已被证实对肉类蛋白质氧化和脂质氧化具有促进作用[15]。根据文献报道,游离铁离子比血红素更能促进鱼肉发生脂质氧化[16]。游离铁主要来源于卟啉铁中脱离的二价铁和二价铁被氧化形成的三价铁。冷藏期间鱼肉游离铁变化如图3所示,从图3可见,在冷藏过程中,两组鱼肉游离铁含量均呈上升趋势,放血组和不放血组游离铁含量分别从0.62、0.84 mg/kg上升到1.75、2.56 mg/kg,且放血组游离铁含量显著低于不放血组(P<0.05)。结合图1和图2的结果,说明在冷藏0~1 d,血红蛋白被分解,而后血红素被分解,血红素的构象改变,释放出大量游离铁离子。魏怡凡等[17]研究证实,血红素降解释放游离铁离子,可以参与氧化进程。推测通过放血处理,可以降低游离铁含量,且延缓鱼肉氧化的发生。
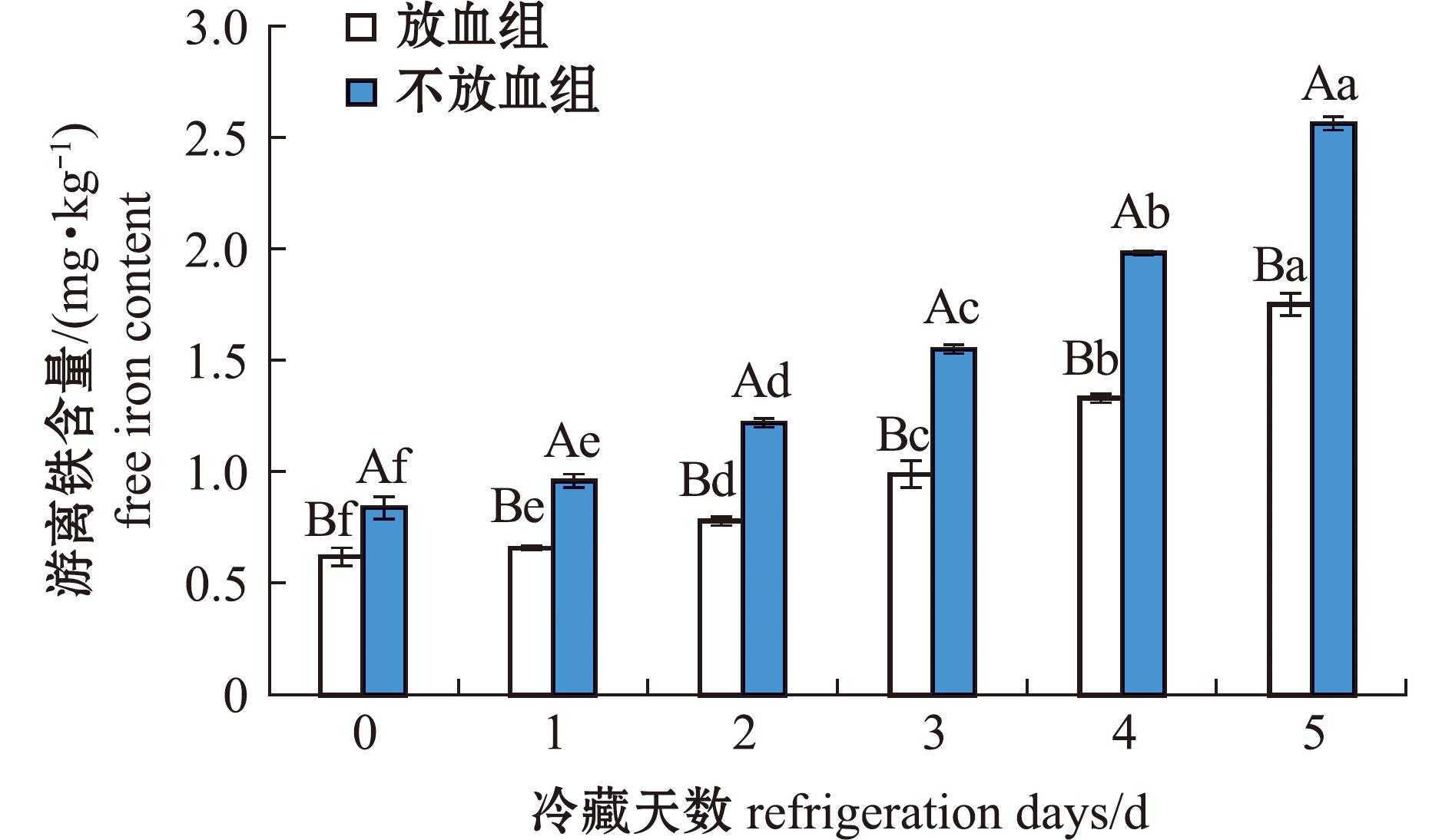
图3 鱼肉冷藏期间游离铁含量的变化
Fig.3 Change of free iron content in frozen fish meat
2.1.4 游离Fe2+、Fe3+含量的变化 在鱼肉中,铁元素主要以结合态的形式存在于各类生物大分子中,游离铁离子含量较低,但是游离的Fe2+和Fe3+对鱼肉具有促氧化作用[18]。近年来的研究发现,在鱼肉冷藏过程中,结合态的铁会逐渐转变为游离态的铁,这一转变过程可能是导致鱼肉品质劣变的重要原因[19]。两组鱼肉游离Fe2+含量如图4(a)所示,在冷藏过程中两组鱼肉游离Fe2+含量呈下降趋势,放血组和不放血组游离Fe2+含量分别从3.65、4.09 mg/kg减少到0.67、0.93 mg/kg,且放血组游离Fe2+含量显著低于不放血组(P<0.05)。在冷藏0~1 d时,两组鱼肉游离Fe2+的下降幅度相对较小,部分Fe2+被氧化生成了Fe3+。Shi等[20]研究发现,在新鲜宰杀的鱼肉中,含铁蛋白的结构破坏程度有限,鱼肉内的一些保护机制仍在发挥作用,使得游离Fe2+的释放过程较为缓慢。而后在冷藏3~5 d,随着卟啉铁的大量降解,游离Fe2+被氧化,两组鱼肉的游离Fe2+含量下降趋势增大。放血处理总体可以减少游离Fe2+含量,且延缓鱼肉氧化的发生。
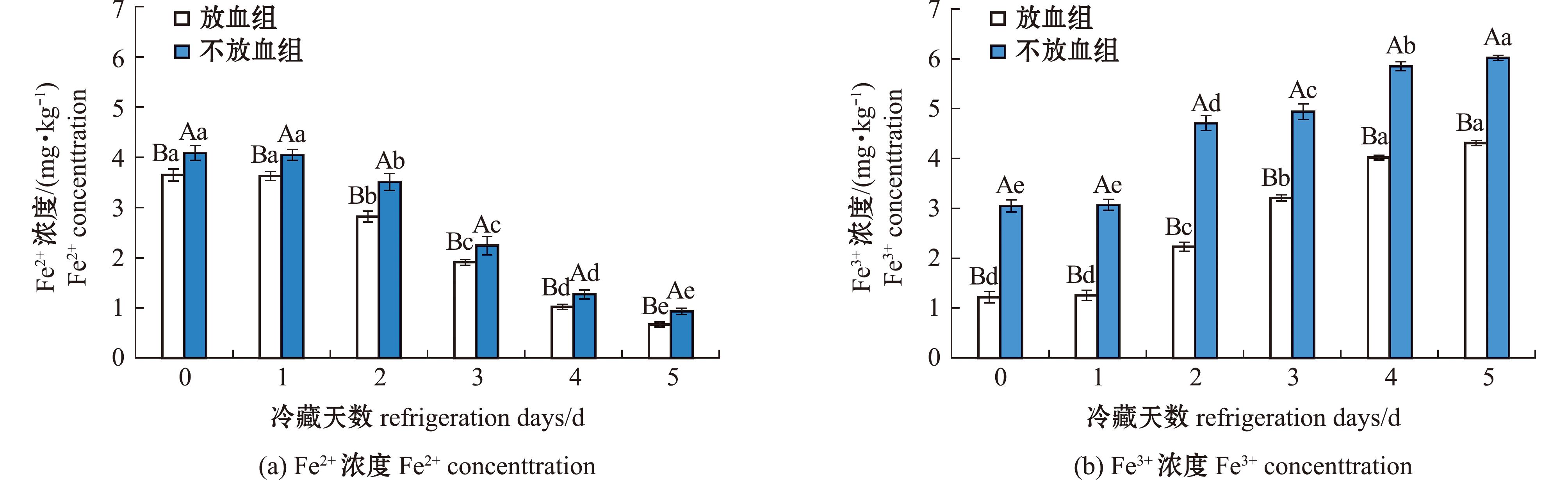
图4 鱼肉冷藏期间游离Fe2+、Fe3+含量的变化
Fig.4 Change of Fe2+ ,Fe3+content in frozen fish meat
两组鱼肉游离的Fe3+含量如图4(b)所示。在冷藏过程中,两组鱼肉游离Fe3+含量呈上升趋势,放血组和不放血组游离Fe3+含量分别从1.22、3.05 mg/kg上升到4.31、6.02 mg/kg,这与上述所测游离Fe2+含量变化相互印证。说明大量的Fe2+转换为了Fe3+,不放血组Fe3+显著高于放血组(P<0.05)。游离Fe3+在肉类蛋白质氧化和脂质氧化过程中具有促进作用[21],推测放血处理能够减少游离Fe3+的含量,进而延缓鱼肉发生氧化。
2.1.5 氧合血红蛋白、高铁血红蛋白含量变化 血红蛋白变化包括降解途径和氧化途径,氧化比例约占总血红蛋白含量的20%[21]。氧合血红蛋白是一种含有亚铁离子的蛋白,其结构较稳定。氧合血红蛋白向高铁血红蛋白的转变是一个复杂且受多因素影响的生化过程,可影响鱼肉品质的变化[22]。冷藏条件下,鱼肉中产生的一些活性氧物质,会加速亚铁离子的氧化过程;鱼肉自身存在的血红蛋白氧化酶等氧化还原相关酶类在氧气的催化下,加速氧合血红蛋白向高铁血红蛋白转化[23]。冷藏期间大泷六线鱼肉氧合血红蛋白含量和高铁血红蛋白含量如图5所示,从图5可见,鱼肉中存在的大量氧合血红蛋白,随冷藏时间的延长,氧合血红蛋白含量逐渐减少,放血组和不放血组氧合血红蛋白含量分别从14.75%、16.75%减少到0.56%、1.12%;高铁血红蛋白含量逐渐增加,放血组和不放血组高铁血红蛋白含量分别从10.25%、14.31%上升到24.01%、25.86%,Fe2+转换成Fe3+,说明氧合血红蛋白转化为高铁血红蛋白。放血组鱼肉的氧合血红蛋白和高铁血红蛋白含量显著低于不放血组(P<0.05)。说明放血可以减少氧合血红蛋白和高铁血红蛋白含量,有利于延缓鱼肉氧化。
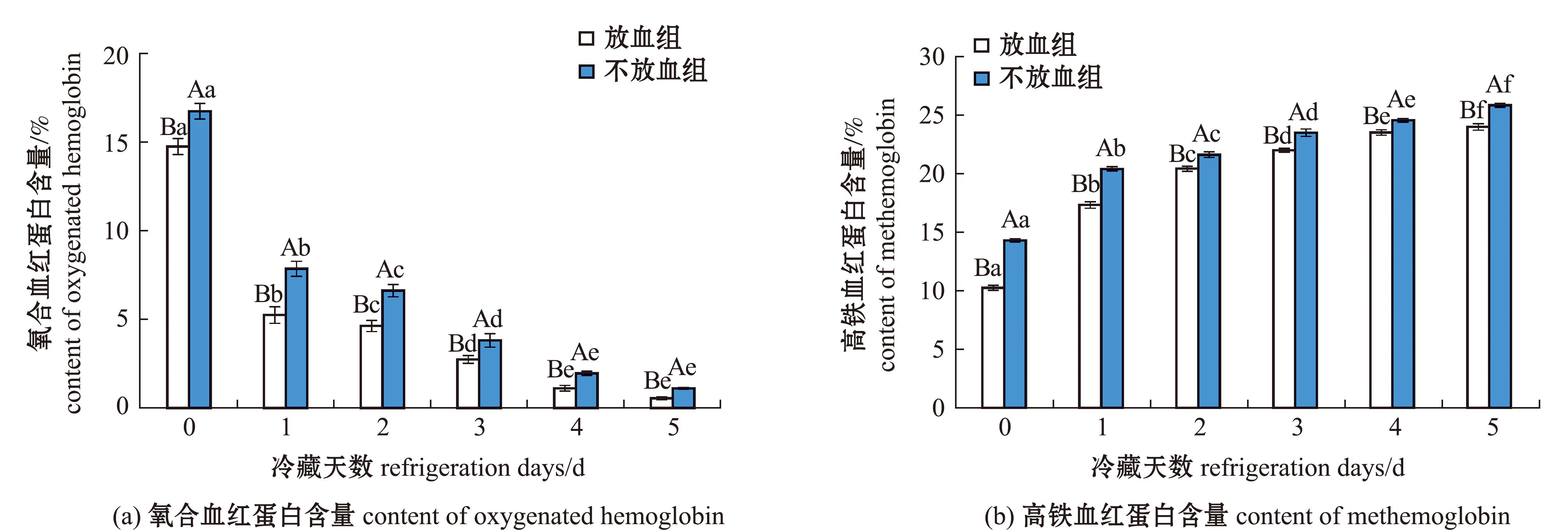
图5 鱼肉冷藏期间氧合血红蛋白和高铁血红蛋白含量的变化
Fig.5 Change of oxygenated hemoglobin and methemoglobin content in frozen fish meat
2.2 放血处理对冷藏鱼肉品质变化
从表1得出,在整个冷藏过程中,两组鱼肉的L*、b*值呈上升趋势,a*值呈下降趋势,不放血组鱼肉L*、a*和b*值显著高于放血组鱼肉。L*反映鱼肉颜色亮度的变化,a*反映鱼肉颜色红度的变化,b*值反映了鱼肉颜色黄度值的变化。本试验研究结果表明,放血处理延缓了L*值和b*值的上升,延缓了a*值的下降。研究发现,鱼肉中红色的变化与a*值成线性相关[24]。导致红度值下降的主要原因是含有二价铁离子的氧合血红蛋白和脱氧血红蛋白会自动氧化成含有三价铁离子的褐色高铁血红蛋白,这与苗麒[25]在研究鲈冷藏过程中红度值下降研究一致。b*值的升高反映了脂质发生了氧化反应。在整个冷藏过程中,随时间的延长,鱼肉b*值上升,说明鱼肉中残留的血液会加速脂质氧化,导致b*值上升,推测放血会延缓脂质氧化的发生。
表1 鱼肉冷藏期间色差的变化
Tab.1 Change of colour of frozen fish meat

指标 index 冷藏天数refrigerationdays/d 0 1 2 3 4 5 L* 放血组 56.10±0.36Bf 57.86±0.55Be 59.14±0.28Bd 60.41±0.97Bc 61.81±1.40Bb 63.84±0.32Ba 不放血组 58.45±0.99Af 58.88±0.62Ae 60.24±0.40Ad 61.53±0.40Ac 63.05±0.21Ab 65.15±0.84Aa a* 放血组 10.75±1.23Ba 9.49±0.21Bb 8.26±0.04Bc 7.07±0.22Bd 7.19±0.50Be 6.76±0.10Bf 不放血组 10.96±0.48Aa 9.65±0.18Ab 8.84±0.37Ac 7.86±0.06Ad 7.50±0.59Ae 6.90±0.85Af b* 放血组 2.59±0.15Bf 2.92±0.04Be 3.08±0.04Bd 3.35±0.63Bc 3.37±0.60Bb 4.20±0.03Ba 不放血组 2.74±0.18Af 3.12±0.3Ae 3.24±0.09Ad 3.88±0.04Ac 3.96±0.04Ab 4.71±0.07Aa
注:标有不同大写字母者表示组间有显著性差异(P<0.05),标有不同小写字母者表示组内有显著性差异(P<0.05),标有相同小写字母者表示组内无显著性差异(P>0.05)。
Note:The means with different capital letters are significantly different among the groups at the 0.05 probability level,with different letters being significantly different at the 0.05 probability level,and the means with the same letter are not significant differences.
2.3 冷藏放血处理鱼肉脂质氧化变化
氢过氧化物是脂质氧化初级产物,标志了脂质氧化的程度[22]。通过测定POV值,可以判断脂质氧化的情况。血红蛋白会加快鱼肉的氧化过程。本试验中,两组鱼肉POV值如图6所示,5 d冷藏期间,大泷六线鱼肉POV值变化如图6(a)所示,放血组和不放血组鱼肉中的POV值均随着冷藏时间的延长显著增加,放血组POV值上升0.86 μg/100 g,不放血组上升了1.14 μg/100 g,不放血组POV值显著高于放血组鱼肉,这与楼丹露等[22]在研究熟制鲣鱼暗色肉脂质变化一致,其发现鱼肉富含血红素铁,冷藏导致血红素铁等促氧化物质释放,加速脂质氧化,使得POV值随冷藏时间增加而逐渐上升。本研究发现,与不放血组相比,放血鱼肉中脂质氧化程度更低。Cooper等[26]发现,槲皮素与血红蛋白结合减少血红素释放和且与脂质氧化具有良好的相关性,说明放血处理能有效延缓鱼肉脂质氧化进程。
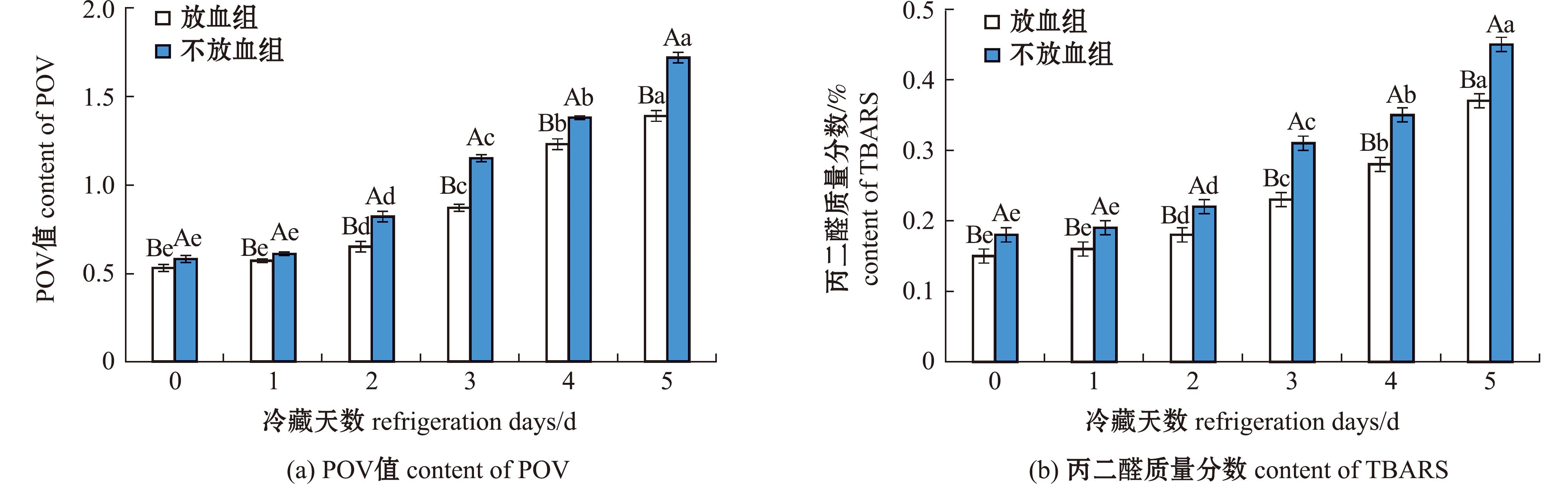
图6 鱼肉冷藏期间POV值和TBARS值变化
Fig.6 Change of POV and TBARS in frozen fish meat
冷藏期间,大泷六线鱼肉TBARS变化如图6(b)所示,在冷藏过程中两组鱼肉丙二醛质量分数显著升高,放血组丙二醛质量分数上升了0.22 μg/100 g,不放血组上升了0.27 μg/100 g,不放血组丙二醛质量分数显著高于放血组鱼肉,说明随冷藏时间的延长脂肪氧化程度显著增加。放血处理会降低鱼肉脂质氧化的发生。Tian等[27]研究证实鱼肉在低温贮藏过程中,脂肪氧化是造成冷藏过程中鱼肉色泽变化的原因之一。而血红蛋白受光照后可将基态氧转变为激发态氧,不饱和脂肪酸的双键与激发态氧形成六元过渡态,然后双键位移形成反式构型的氢过氧化物,从而引发脂肪氧化。脂肪氧化会产生丙二醛等小分子化合物,因此可以推断血红蛋白残留会通过促进脂肪氧化而使丙二醛含量增加。
2.4 冷藏期间放血处理鱼肉蛋白氧化变化
随着冷藏时间的延长,血红蛋白会发生氧化分解,降低蛋白质发生氧化反应所需要的活化能。在这种催化作用下,鱼肉蛋白质的氧化速度加快,更多的氨基酸残基被氧化形成羰基,进一步推动了鱼肉羰基含量的快速上升[28]。5 d冷藏期间,大泷六线鱼肉羰基含量变化如图7(a)所示,放血组和不放血组鱼肉中的羰基含量均随着冷藏时间的延长显著增加,放血组羰基含量上升了3.58 nmol/mg,不放血组上升了6.34 nmol/mg,不放血组羰基含量显著高于放血组,表明鱼肉冷藏期间蛋白质发生氧化。与不放血组相比,放血处理显著降低了羰基含量(P<0.05),说明放血处理降低了鱼肉蛋白氧化程度。Vavlukis等[29]以草鱼为研究对象,发现在冷藏过程中血液残留会使鱼肉羰基含量显著上升。这是因为血液中的血红蛋白含有铁离子,会催化脂质氧化,产生的醛类等物质会与蛋白质反应生成羰基化合物,同时也会直接引发蛋白质的氧化,导致羰基含量增加[30]。
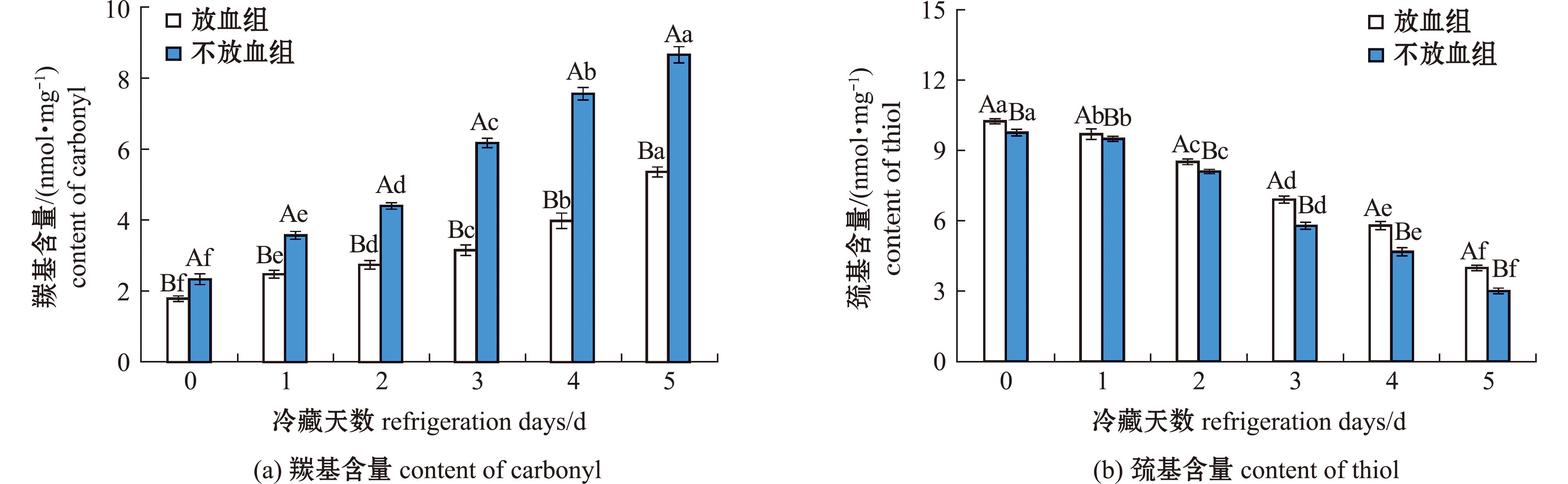
图7 鱼肉冷藏期间羰基含量变化
Fig.7 Change of carbonyl and sulfhydryl content in frozen fish meat
冷藏期间大泷六线鱼肉巯基含量变化如图7(b)所示,在冷藏过程中,两组鱼肉巯基含量均显著下降,且放血组和不放血组鱼肉巯基含量存在显著性差异(P<0.05)。在5 d的冷藏过程中,放血组巯基含量下降了6.26 nmol/mg,不放血组下降了6.76 nmol/mg,两组鱼肉巯基含量均在第3天出现明显下降,不放血组鱼肉巯基下降速率相较于放血组更快,推测血红蛋白促进了鱼肉发生蛋白质氧化。陈慧等[31]发现,在对卵形鲳鲹鱼片在微冻结合气调包装下的肌肉组织结构及蛋白质特性变化研究时,鱼肉中残留血液会使总巯基含量随贮藏时间延长而显著降低,进一步说明血红蛋白会加速蛋白质发生氧化。
2.5 鱼肉冷藏期间相关性热力图
结合冷藏过程中大泷六线鱼肉羰基、巯基、POV和TBARS值等氧化指标的变化,进行冷藏期间血红蛋白变化对蛋白质氧化和脂质氧化影响的相关性分析。鱼肉冷藏期间各项指标相关性热力图如图8所示,从图8可见,血红蛋白含量与POV、TBARS、羰基含量呈负相关,与巯基含量呈正相关。说明随冷藏时间的延长,血红蛋白降低促进了鱼肉发生氧化。罗云龙等[32]在海藻酸钠覆膜革胡子鲶鱼肉冷藏期间品质变化及与微生物多样性间相关性分析中得出,乳球菌属数量和血红蛋白含量与鱼肉指标TBARS等值具有相关性,这与上述结论一致。血红蛋白含量与游离铁含量r值为-0.99,呈显著负相关(P<0.05);游离铁离子含量与POV、TBARS、羰基r值分别为0.99、0.99、0.97,呈显著正相关(P<0.05),与巯基含量r值为-0.98,呈显著负相关(P<0.05)。Fe3+与游离铁r值为0.97,呈显著正相关(P<0.05),与Fe2+r值为-0.98,呈显著负相关,与POV、TBARS、羰基r值分别为0.97、0.98、0.96,呈显著正相关(P<0.05),与巯基含量r值为-0.99,呈显著负相关。说明血红蛋白氧化分解释放出大量游离铁,二价游离铁转换成三价状态,促进鱼肉发生氧化。陈方雪等[33]在研究超高压和辐照杀菌对鲈冷藏期间品质的影响时表明,超高压处理在一定条件下破坏红细胞促使血红蛋白释放铁离子,会加剧脂肪氧化,造成TBARS值变化。氧合血红蛋白与高铁血红蛋白r值为-0.99,呈显著负相关,说明随冷藏时间延长,氧合血红蛋白转化为高铁血红蛋白,加速了鱼肉氧化的发生。研究表明,通过放血处理,可延缓鱼肉氧化。

图8 鱼肉冷藏期间各项指标相关性热力图
Fig.8 Correlation analysis of indicators of fish without bloodletting during cold storage
3 讨论
3.1 血红蛋白变化与鱼肉氧化的关联
在水产品的品质研究领域,鱼肉氧化是影响其食用价值和经济价值的关键因素。在鱼肉的品质劣变过程中,血红蛋白的变化与鱼肉氧化存在着紧密且复杂的联系。从化学角度来看,血红蛋白中的血红素含有铁离子,这成为了引发鱼肉氧化的关键因素之一。在有氧环境下,尤其是当鱼肉储存条件不佳时,血红素铁能够催化脂质氧化反应。脂质氧化是鱼肉氧化的重要过程,不饱和脂肪酸在氧气、光、热和酶等因素的影响下发生羟基化,并产生大量自由基和醛类物质[10]。而血红蛋白的存在加速了这一进程,铁离子通过价态变化,从亚铁离子转变为高铁离子,在此过程中传递电子,促使脂质分子中的氢原子被夺取,从而引发自由基链式反应,产生更多的活性氧物质(ROS),如过氧基、羟基自由基(·OH)和烷氧基等。这些自由基极具活性,会进一步攻击脂质分子,使氧化反应持续进行,导致水产品产生腐败性酸臭味,同时也会造成必需脂肪酸及微量元素流失,严重影响鱼肉的营养价值和风味。
血红蛋白还能与鱼肉中的蛋白质相互作用,间接影响蛋白质的氧化过程。蛋白质氧化是指氨基酸残基受到氧化因子的影响,发生羰基化、硫氧化、羟基化和交联等改变,进而影响蛋白质的结构、溶解性和酶活性等性质。在血红蛋白引发的氧化环境中,产生的自由基可以攻击蛋白质分子,使蛋白质结构发生改变,导致蛋白质变性。如自由基可能夺取蛋白质分子中的氢原子,形成碳中心自由基,使其功能丧失[34]。蛋白质的氧化又会进一步影响鱼肉的质地和口感,使鱼肉变得粗糙且失去弹性,降低其食用品质。
在实际的贮藏和加工过程中,温度、光照等环境因素也会对血红蛋白介导的鱼肉氧化产生影响。较高的温度会加快化学反应速率,使血红蛋白的氧化催化作用更为显著,加速鱼肉氧化变质;光照则可能激发血红蛋白中的某些成分,引发光化学反应,进一步促进自由基的产生,加剧鱼肉的氧化。通过深入了解血红蛋白在鱼肉氧化过程中的作用机制和影响因素,可以采取有效的控制策略来延缓鱼肉的氧化变质,提高鱼肉产品的质量和安全性。未来研究可以进一步探索血红蛋白与鱼肉中其他成分的相互作用,以及开发更加高效、安全的抗氧化技术,为鱼肉加工和贮藏提供更有力的支持。
3.2 引起鱼肉血液残留的因素
捕捞方式和操作环节是导致鱼肉血液残留的重要外部因素。拖网捕捞、围网捕捞等大规模捕捞方式,在操作过程中会使鱼体受到较大机械损伤和强烈应激。鱼群在网具中相互挤压、碰撞,导致鱼体肌肉组织受损,血管破裂出血,这些血液在后续处理前就已渗透至肌肉内部,加大了放血难度,造成血液残留。此外,从捕捞上岸到放血处理的时间间隔也是关键因素。若处理不及时,随着时间推移,血液会在鱼体内发生凝固,进一步阻碍血液排出,最终导致鱼肉中血液残留量增加[35]。
当鱼被捕捞离开水体后,其所处环境会发生急剧改变,从而引发鱼体强烈的应激反应。在这种情况下,鱼体的交感神经系统会处于兴奋状态,体内会大量分泌肾上腺素,进而致使血压急剧上升,心率加快。这种生理变化使得鱼的血管承受巨大压力,一些原本就较为脆弱的微血管,容易破裂出血,血液中的皮质醇含量会显著上升,进而导致鱼鳃部和肌肉中的微血管破裂,血液残留于鱼体组织中[36]。此外,鱼在离水后的挣扎行为也会加剧体内器官的晃动和摩擦,进一步损伤血管,增加血液残留的可能性。
放血是减少鱼肉血液残留的关键步骤,但在实际加工中,放血操作往往存在诸多问题。放血切口位置不准确是常见问题之一,切口过浅或位置偏离主要血管,均无法有效切断鱼体的血液循环通路,导致放血不彻底。放血时间不足也会影响效果,血液未能充分流出鱼体。此外,放血过程中的水温、水质等环境因素也会对放血效果产生影响。水温过高会加速鱼体的新陈代谢和血液凝固,不利于血液流出;水质不洁则可能导致鱼体伤口感染,影响放血的顺畅性。
从鱼类生物学特性角度来看,鱼类独特的生理结构与血液循环系统是血液残留的内在基础。不同种类的鱼在生理结构和血液生理特性上存在显著差异,这会导致它们血液残留情况有所不同。如鳜、青鱼等血管较细且血流量小,放血难度相对较大,若放血操作稍有不当,就容易造成血液残留[37]。体表有黏液且身体细长的鱼类,如刀鱼,其血管分布较为复杂,放血时难以完全排空血液。此外,深海鱼类由于生活在高压环境中,体内血压较高,被捕捞后压力骤变,更容易出现血管破裂和血液残留问题。鱼类心脏结构相对简单,属于一心房一心室,这种结构使得其血液循环动力相对较弱。在捕捞后的处理过程中,难以像哺乳动物凭借较强的心脏泵血能力将血液完全从组织中排出。同时,鱼类的血管系统分布广泛且复杂,细小血管深入肌肉组织,在捕捞应激状态下,血管收缩反应可能导致血液在这些细小分支中淤积,增加了血液残留的几率。
3.3 优化及规范放血操作过程
在鱼类加工过程中,有效减少鱼肉血液残留对提升鱼肉品质、延长鱼肉产品货架期至关重要,可从宰杀方式、放血操作及后续处理环节实施针对性措施。优化宰杀方式能从源头减少血液残留。传统宰杀方法易使鱼体产生应激反应,致血管收缩,阻碍血液排出。采用电击晕或二氧化碳麻醉等方式,可使鱼在无痛苦状态下迅速失去知觉,避免应激。电击晕通过特定电流刺激鱼的神经系统,使其瞬间昏迷,肌肉松弛,利于放血;二氧化碳麻醉则是让鱼吸入高浓度二氧化碳,进入麻醉状态,放血时血液更易流出,显著降低鱼肉的初始血液含量。规范放血操作是关键环节,放血时,切口位置和深度要精准,在鱼鳃后缘或尾柄处切开放血口,此处血管丰富,能保证血液快速流出;操作时要控制切口深度避免过深损伤内脏,影响鱼肉品质。放血时间也需严格把控,根据鱼的种类、大小设定适宜时长,小型鱼放血3~5 min,大型鱼5~10 min,使血液充分排出。同时,放血过程中可轻轻挤压鱼体,促进血液流动。放血后的清洗和浸泡处理进一步降低血液残留,用流动清水冲洗鱼体表面,去除附着血液。将鱼浸泡在低温含盐水溶液中,盐水浓度为2%~4%,温度为0 ℃~4 ℃,浸泡15~30 min。盐水的渗透压作用可使鱼肉组织内残留血液渗出。
4 结论
1)血红蛋白残留量对冷藏的大泷六线鱼鱼肉品质有显著影响。血红蛋白在冷藏过程中会被降解氧化,生成血红素和珠蛋白;血红素会进一步分解生成原卟啉并释放出游离的铁原子;少部分的血红蛋白被氧化生成了高铁血红蛋白。
2)在冷藏期间,放血组和不放血组的鱼肉品质逐渐下降。鱼肉内血红蛋白残留量越多,大泷六线鱼鱼肉在冷藏期间感官品质下降越快,羰基、巯基、POV和TBARS等理化指标的变化更剧烈,整体品质下降速度加快。
3)相关性分析表明,在鱼肉冷藏过程中血红蛋白氧化降解加剧了鱼肉脂质氧化和蛋白氧化的发生。
因此,在大泷六线鱼的冷藏保鲜及加工处理过程中,应采取合理措施尽量减少血红蛋白残留,从而有效延长其产品的货架期,维持良好的产品品质。
[1] 张弼,蒲红宇.我国大泷六线鱼增养殖现状分析及发展建议[J].中国水产,2024(3):53-54.
ZHANG B,PU H Y.Analysis on the current situation of increasing culture of hexaploid fish in China and its development suggestions[J].China Fisheries,2024(3):53-54.(in Chinese)
[2] 徐坤华,廖明涛,林森森,等.蓝鳍金枪鱼脂质和肌红蛋白的氧化动力学研究[J].中国食品学报,2015,15(2):64-71.
XU K H,LIAO M T,LIN S S,et al.Kinetics study of lipid oxidation and myoglobin oxidation on bluefin tuna[J].Journal of Chinese Institute of Food Science and Technology,2015,15(2):64-71.(in Chinese)
[3] SIL R,CHAKRABORTI A S.Major heme proteins hemoglobin and myoglobin with respect to their roles in oxidative stress - a brief review[J].Frontiers in Chemistry,2025,13:1543455.
[4] SONG J L,LI N J,YANG Y,et al.Cell-free hemoglobin released from hemolysis induces programmed cell death through iron overload and oxidative stress in grass carp (Ctenopharyngodon idella)[J].Fish &Shellfish Immunology,2025,157:110106.
[5] ![]() E.Red blood cell indices of rainbow trout Oncorhynchus mykiss (Walbaum) in aquaculture[J].Aquaculture Research,2004,35(6):529-546.
E.Red blood cell indices of rainbow trout Oncorhynchus mykiss (Walbaum) in aquaculture[J].Aquaculture Research,2004,35(6):529-546.
[6] WHEAL M S,DECOURCY-IRELAND E,BOGARD J R,et al.Measurement of haem and total iron in fish,shrimp and prawn using ICP-MS:Implications for dietary iron intake calculations[J].Food Chemistry,2016,201:222-229.
[7] NAZARI KHORASGANI Z,RAESI VANANI A,KHODAYAR M J,et al.Determination of iron and chromium levels in canned fish produced in factories of khuzestan province,southwest of Iran[J].Iranian Jornal of Toxicology,2017,11(6):37-41.
[8] HARRINGTON C F,ELAHI S,MERSON S A,et al.A method for the quantitative analysis of iron speciation in meat by using a combination of spectrophotometric methods and high-performance liquid chromatography coupled to sector field inductively coupled plasma mass spectrometry[J].Analytical Chemistry,2001,73(18):4422-4427.
[9] CAO J R,YAN H X,YE B,et al.The inhibitory effect of Maillard reaction products on fish and chicken muscle oxidation[J].Journal of Food Measurement and Characterization,2025,19(1):108-117.
[10] 郑娅,胡生海,何元翔,等.牛肉肌红蛋白提纯及其协同脂质氧化效应分析[J].食品科技,2019,44(12):111-116.
ZHENG Y,HU S H,HE Y X,et al.Extractation and purification of myoglobin in beef and its synergistic oxidation effect with lipid[J].Food Science And Techonlogy.2019,44(12):111-116.(in chinese)
[11] ARANDA R,CAI H,WORLEY C E,et al.Structural analysis of fish versus mammalian hemoglobins:effect of the heme pocket environment on autooxidation and hemin loss[J].Proteins:Structure,Function,and Bioinformatics,2009,75(1):217-230.
[12] 朱永宁.关于血红蛋白(Hb)低温稳定性的研究[J].大连大学学报,2001,22(6):42-46.
ZHU Y N.Study on the stability of Hemoglobin during freezing[J].Journal of Dalian University,2001,22(6):42-46.(in Chinese)
[13] ZHANG Y F,TIAN X J,JIAO Y Z,et al.Free iron rather than heme iron mainly induces oxidation of lipids and proteins in meat cooking[J].Food Chemistry,2022,382:132345.
[14] WANG Z Y,WU C,YIN D,et al.Ferroptosis:mechanism and role in diabetes-related cardiovascular diseases[J].Cardiovascular Diabetology,2025,24(1):60.
[15] 吴海舟.肌内血红蛋白诱导脂质氧化机理及抑制方法研究[D].南京:南京农业大学,2017.
WU H Z.Study on mechanism and inhibition method of lipid oxidation induced by intramuscular hemoglobin[D].Nanjing:Nanjing Agricultural University,2017.(in Chinese)
[16] 常显志,吴志强,黄亮亮,等.漓江5种常见食用经济鱼类重金属含量分析[J].环境科学与技术,2017,40(9):203-208.
CHANG X Z,WU Z Q,HUANG L L,et al.Analysis of heavy metal content in five kinds of common edible economic fish species of Lijiang River[J].Environmental Science &Technology,2017,40(9):203-208.(in Chinese)
[17] 魏怡凡,包雅丽.铁死亡在细胞代谢发生机制及其在心肌病中潜在特征的研究进展[J].中国医药导报,2024,21(30):55-59.
WEI Y F,BAO Y L.Research progress on the mechanism of ferroptosis in cell metabolism and its potential characteristics in cardiomyopathy[J].China Medical Herald,2024,21(30):55-59.(in Chinese)
[18] 孟晓华.亚铁离子对罗非鱼片细菌生长的影响[J].肉类研究,2023,37(10):16-21.
MENG X H.Influence of ferrous ions on bacterial growth on Tilapia fillets[J].Meat Research,2023,37(10):16-21.(in Chinese)
[19] FERNANDES C M,SVEINSD TTIR H I,T
TTIR H I,T MASSON T,et al.Influence of hot-smoking on the stability of fresh and frozen-thawed deep-skinnedAtlantic mackerel fillets during cold storage[J].Food Science &Nutrition,2024,12(7):4849-4864.
MASSON T,et al.Influence of hot-smoking on the stability of fresh and frozen-thawed deep-skinnedAtlantic mackerel fillets during cold storage[J].Food Science &Nutrition,2024,12(7):4849-4864.
[20] SHI M J,WANG F,JIANG H,et al.Effect of enzymatic degraded polysaccharides from Enteromorpha prolifer a on the physical and oxidative stability of fish oil-in-water emulsions[J].Food Chemistry,2020,322:126774.
[21] 岑剑伟,胡庆蓉,魏涯,等.复合酶水解法从罗非鱼血液中提取血红素及其性质研究[J].食品工业科技,2016,37(19):58-61.
CEN J W,HU Q R,WEI Y,et al.Characterization of heme from tilapias blood extracted by protamex hydrolysis[J].Science and Technology of Food Industry,2016,37(19):58-61.(in Chinese)
[22] 楼丹露,王清政,邹祖全,等.冻融循环对熟制鲣鱼暗色肉脂质变化的影响[J].食品科学,2022,43(13):177-183.
LOU D L,WANG Q Z,ZOU Z Q,et al.Lipid changes in dark meat of cooked bonito during multiple freeze-thaw cycles[J].Food Science,2022,43(13):177-183.(in Chinese)
[23] 唐宁莉,蒙华毅,李欣,等.牛血红蛋白催化分光光度法测定过氧化氢[J].理化检验-化学分册,2014,50(2):191-194.
TANG N L,MENG H Y,LI X,et al.Spectrophotometric determination of hydrogen peroxide with bovine hemoglobin as catalyst[J].Physical Testing and Chemical Analysis (PartB(Chemical Analysis)),2014,50(2):191-194.(in Chinese)
[24] 王培.血红蛋白与红细胞释氧速率与自氧化速率的研究[D].天津:天津工业大学,2016.
WANG P.Study on hemoglobin and oxygen release rate and self-oxidation rate of red blood cells[D].Tianjin:Tianjin Polytechnic University,2016.(in Chinese)
[25] 苗麒.毛霉发酵鳙鱼肉的品质变化及贮藏性分析[D].上海:上海海洋大学,2024.
MIAO Q.Quality change and storage analysis of bighead carp meat fermented by Mucor[D].Shanghai:Shanghai Ocean University,2024.(in Chinese)
[26] COOPER C E,SIMONS M,DYSON A,et al.Taming hemoglobin chemistry-a new hemoglobin-based oxygen carrier engineered with both decreased rates of nitric oxide scavenging and lipid oxidation[J].Experimental &Molecular Medicine,2024,56(10):2260-2270.
[27] TIAN R,ZHOU L,LU N H.Binding of quercetin to hemoglobin reduced hemin release and lipid oxidation[J].Journal of Agricultural and Food Chemistry,2022,70(40):12925-12934.
[28] LEI X Q,QIN Z W,YE B,et al.Interaction between secondary lipid oxidation products and hemoglobin with multi-spectroscopic techniques and docking studies[J].Food Chemistry,2022,394:133497.
[29] VAVLUKIS A,VAVLUKIS M,MLADENOVSKA K,et al.Antioxidative effects of rosuvastatin in low-to-moderate cardiovascular risk subjects[J].Prilozi,2022,43(1):65-75.
[30] LEI X Q,QIN Z W,YE B,et al.Effect of pH on lipid oxidation mediated by hemoglobin in washed chicken muscle[J].Food Chemistry,2022,372:131253.
[31] 陈慧,葛迎港,周德庆,等.预制水产品加工技术研究进展[J].食品研究与开发,2024,45(14):179-186.
CHEN H,GE Y G,ZHOU D Q,et al.Research progress in processing technology of prepared aquaticproducts[J].Food Research and Development,2024,45(14):179-186.(in Chinese)
[32] 罗云龙,王洋,刘义,等.海藻酸钠覆膜革胡子鲶鱼肉冷藏期间品质变化及与微生物多样性间相关性分析[J].肉类研究,2022,36(1):41-48.
LUO Y L,WANG Y,LIU Y,et al.Quality change of sodium alginate-coated Clarias gariepinus during cold storage and its correlation with microbial diversity[J].Meat Research,2022,36(1):41-48.(in Chinese)
[33] 陈方雪,王世哲,邱文兴,等.超高压和辐照杀菌对鲈鱼冷藏期间品质的影响[J].肉类研究,2023,37(6):34-40.
CHEN F X,WANG S Z,QIU W X,et al.Effect of ultra-high pressure versus irradiation sterilization on the quality of largemouth bass(Micropterus salmoides) during refrigerated storage[J].Meat Research,2023,37(6):34-40.(in Chinese)
[34] 王婧.预包装烤鱼贮藏期间品质变化规律与保鲜剂研发[D].重庆:重庆三峡学院,2024.
WANG J.Quality change law of prepackaged grilled fish during storage and research and development of preservative[D].Chongqing:Chongqing Three Gorges University,2024.(in Chinese)
[35] 曹涵锦,曹英楠,马良,等.瘦身养殖过程中草鱼质构品质变化规律及其机制[J].食品与发酵工业,2024,50(19):216-222.
CAO H J,CAO Y N,MA L,et al.Patterns of texture quality changes in grass carp during slimming aquaculture process and their mechanisms[J].Food and Fermentation Industries,2024,50(19):216-222.(in Chinese)
[36] 李鸣泽,李晴,谭雨青,等.低盐腌制草鱼肉各分割部位蒸制过程品质变化规律[J].肉类研究,2023,37(11):1-7.
LI M Z,LI Q,TAN Y Q,et al.Quality changes during thesteaming process of different cut-up parts of low-salt brined grass carp(Ctenopharyngodon idellus)[J].Meat Research,2023,37(11):1-7.(in Chinese)
[37] 彭月敏.肌红蛋白和血红蛋白的氧化还原性质和类酶活性的电化学研究[D].武汉:华中师范大学,2007.
PENG Y M.Electrochemical study on redox properties and enzyme-like activities of myoglobin and hemoglobin[D].Wuhan:Central China Normal University,2007.(in Chinese)