球等鞭金藻(Isochrysis galbana)因其高蛋白质含量和丰富的DHA、EPA等不饱和脂肪酸,成为贝类、甲壳类幼苗的理想“开口饵料”,其无细胞壁的特性更易于消化吸收,显著提升了养殖效率[1-2]。相较于三角褐指藻(Phaeodactylum tricornutum),球等鞭金藻投喂可使贻贝(Mytilus edulis)苗生长速度提高32%~42%,在海湾扇贝(Argopecten irradians)、对虾、刺参及牡蛎等幼苗的培养中也表现出显著效果[3],然而,传统微藻培养模式存在生产效率低、易受天气影响等问题,难以保障水产养殖高峰期对饵料的稳定需求[4-5]。
近年来,管道式光生物反应器的发展为微藻高效规模化培养提供了新思路[6]。封闭式培养系统通过可控的环境条件(如光照、温度、CO2供应等)显著提高了微藻的生物质产量和培养效率[7-8]。已有研究发现,管道式光生物反应器培养湛江等鞭金藻(Isochrysis zhanjiangensis)的生产力(0.054 3 g/L/d)和最高藻细胞密度(3.70×106 cells/mL)显著优于聚乙烯桶和水泥池培养模式[9]。尽管如此,在实际应用中仍存在若干关键技术问题亟待解决。目前,利用人工光源为管道式生物反应器补充光照的做法已被广泛接受,然而光照条件未经优化,大多使用恒定光强,基于藻种的动态光照调控策略尚未充分挖掘[10-11]。在规模化培养过程中,CO2供给与pH调控难以动态匹配,容易造成碳源不足或pH失衡,影响培养系统的稳定性[12-13]。此外,半连续培养作为工业化生产的常用模式,既维持了藻细胞对数期的代谢活性,又避免了批次培养的频繁重启成本,但其在管道式光生物反应器中的最佳更新率等关键参数仍需系统优化[14-15]。现有研究多聚焦单一参数在实验室规模的优化,而针对多参数协同调控的中试研究相对较少,尤其在球等鞭金藻等经济藻种的规模化培养中,环境波动问题仍未得到有效解决,制约了生产效率的进一步提升。
针对上述问题,本研究中以250 L中试规模管道式光生物反应器为研究对象,系统优化球等鞭金藻培养的光照策略、CO2补充策略及半连续培养模式的关键参数[16],通过梯度补光试验探究动态光照对微藻生长的调控作用,结合CO2通气和pH动态监测优化碳源供给,比较不同更新量下半连续培养的效果,旨在为微藻的工业化生产提供参数依据。这些研究不仅有助于提升球等鞭金藻的培养效率,降低生产成本,还可为其他经济微藻的规模化培养提供技术参考。
1 材料与方法
1.1 材料
本研究以球等鞭金藻为试验材料,该藻种由宁波大学徐教授赠予。采用F/2培养基培养,所用海水经0.45 μm滤膜过滤、121 ℃高压灭菌后使用。一级藻种在5 L锥形瓶中扩培,二级藻种在20 L的内置光源柱型反应器中培养,培养过程维持温度为25 ℃±2 ℃,光强为150 μmol/m2/s,光周期12L∶12D,通入含2% CO2空气的混合气体。
试验使用管道式光生物反应器中试系统,体积为250 L,管道由高透光玻璃制成,直径为6 cm。反应器选用灯具为佛山照明有限公司定制的LED微藻专用灯具,每台反应器配备1 m长灯条56条。此外,反应器还配备了光强、温度、pH和浊度传感器,用于关键参数的实时监测与智能控制。每台250 L反应器需接种40 L密度为7×106~9×106 cells/mL的藻种(图1)。

图1 管道式光生物反应器运行现场
Fig.1 Operation site of tubular photobioreactors
1.2 方法
1.2.1 补光策略试验 本研究通过以下试验优化球等鞭金藻的补光策略:1)开展人工补光与自然光照对比试验,人工补光组每日19:00—次日7:00进行补光(光强150 μmol/m2/s);2)设置恒定补光和梯度补光对比试验,恒定补光组每日光强均为150 μmol/m2/s,梯度补光组每日光强递增(60、90、120、150、180、210、240 μmol/m2/s),平均光强为150 μmol/m2/s;3)梯度补光基础上设置不同平均光强,平均光强分别为250、150 μmol/m2/s。每个试验周期为7 d,每天监测藻细胞密度、干质量及系统pH值变化。
1.2.2 CO2补充策略试验 在管道式光生物反应器中进行球等鞭金藻的CO2供应策略优化试验:设置不同通气量试验(含2% CO2空气的混合气体通量分别为400、200 mL/min);设置恒定通气与梯度通气对比试验,恒定通气组固定300 mL/min通气量不变,梯度通气组每日通气量递增(0、100、200、300、400、500、600、700 mL/min),平均通气量为300 mL/min。每个试验周期为7 d,每天监测细胞密度、干质量及pH值变化。
1.2.3 半连续培养更新量试验 在管道式光生物反应器中进行球等鞭金藻的半连续培养更新量优化试验。当微藻生长至平台期后进行微藻部分采收(更新量分别为20%和40%),并加入等量的灭菌海水和相应比例培养基继续培养。试验持续14 d,每天监测反应器运行情况,取样并记录生长数据和pH。
1.3 数据处理
根据细胞密度-光密度标准曲线(Y=5.835 1x-0.188 8,R2=0.998),每日测定藻液在OD680 nm处的吸光值,计算细胞密度。根据公式计算指数生长期的比生长速率μ。
μ=(lnN2-lnN1)/(t2-t1)。
(1)
式中:t1和t2分别为接种的第0天和第3天的时间(d);N1和N2分别为t1和t2时刻微藻的细胞密度(cells/mL)。
取50 mL藻液,以6 000 r/min离心5 min,收集藻细胞。用0.5 mol/L碳酸氢铵溶液洗涤,随后离心,设置两次重复。将洗涤后的藻细胞转移至预先称重的培养皿(m1)中,置于105 ℃烘箱中干燥6 h,冷却后称重(m2)。各处理组细胞干质量的计算公式为
WDCW=(m2-m1)/50×1 000。
(2)
式中:WDCW为细胞干质量(g/L)。
2 结果与分析
2.1 光照策略对球等鞭金藻生长的影响
本研究系统评估了管道式光生物反应器中人工光源补加策略对球等鞭金藻生长和生物量积累的影响。试验结果表明,夜间进行额外的人工补光可提升藻细胞密度和干质量(图2(a)、(d))。在培养第7天,人工补光组球等鞭金藻细胞密度达到3.2×106 cells/mL,是自然光照组的1.16倍;同时,人工补光组干质量达到0.27 g/L,是后者的1.15倍。在日平均光强均为150 μmol/m2/s情况下,梯度补光模式优于恒定补光模式(图2(b)、(e))。培养7 d后,藻细胞密度达到4.54×106 cells/mL,是恒定补光组的1.11倍;梯度补光组干质量达到0.38 g/L,是恒定补光组的1.10倍。进一步探究在梯度补光模式下不同光照强度对球等鞭金藻生长的影响。研究发现,250 μmol/m2/s光强组初期生长效率低于150 μmol/m2/s光强组,可能存在光抑制作用,但最终两组细胞密度和干质量无显著性差异(图2(c)、(f))。
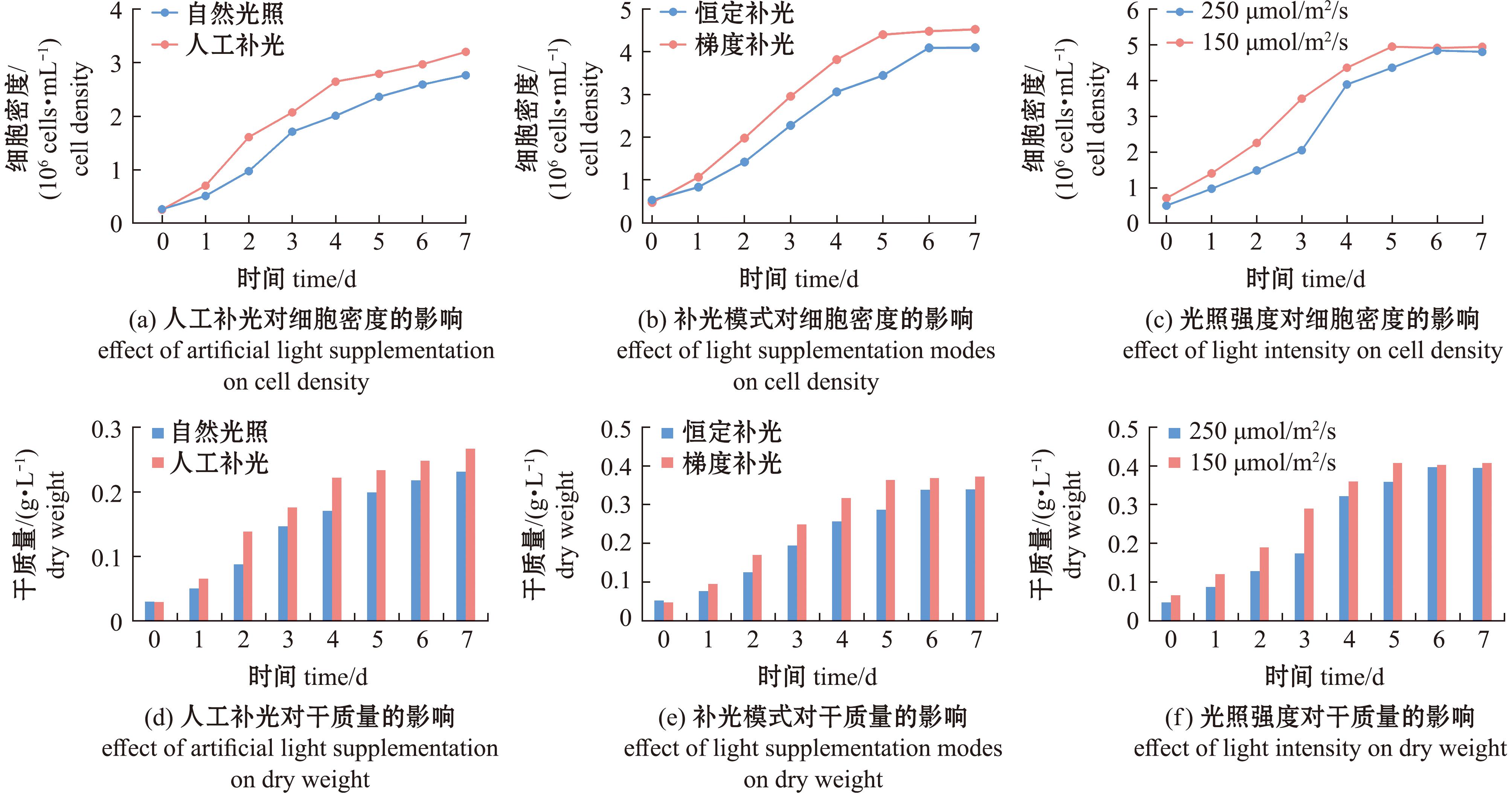
图2 不同光照策略对球等鞭金藻生长情况的影响
Fig.2 Effects of different light strategies on the growth of Isochrysis galbana
不同光照策略下球等鞭金藻在指数生长期的比生长速率存在差异(图3(a))。人工补光组的比生长速率为0.54 d-1,是自然光照组的1.13倍。梯度补光模式的比生长速率达0.51 d-1,是恒定补光组的1.26倍。值得注意的是,150 μmol/m2/s组的比生长速率是250 μmol/m2/s组的1.2倍。这一结果与pH变化及生物量积累趋势高度吻合,提示可通过光照策略调控球等鞭金藻的光合效率。培养体系的pH值变化进一步验证了不同光照策略的效果(图3(b))。在光生物反应器培养过程中,pH变化与藻细胞密度相关,高pH环境明显抑制藻细胞生长。250 μmol/m2/s光强组因光合活性更强导致pH快速上升,仅通入空气会造成碳源供给不足,光合作用消耗![]() 导致OH-积累,而空气中的CO2补充速率远低于藻群需求,最终形成严重的碳限制环境抑制生长。这一结果证实必须采用CO2调控策略将pH控制在适宜范围内,以维持藻细胞的正常生长代谢。
导致OH-积累,而空气中的CO2补充速率远低于藻群需求,最终形成严重的碳限制环境抑制生长。这一结果证实必须采用CO2调控策略将pH控制在适宜范围内,以维持藻细胞的正常生长代谢。
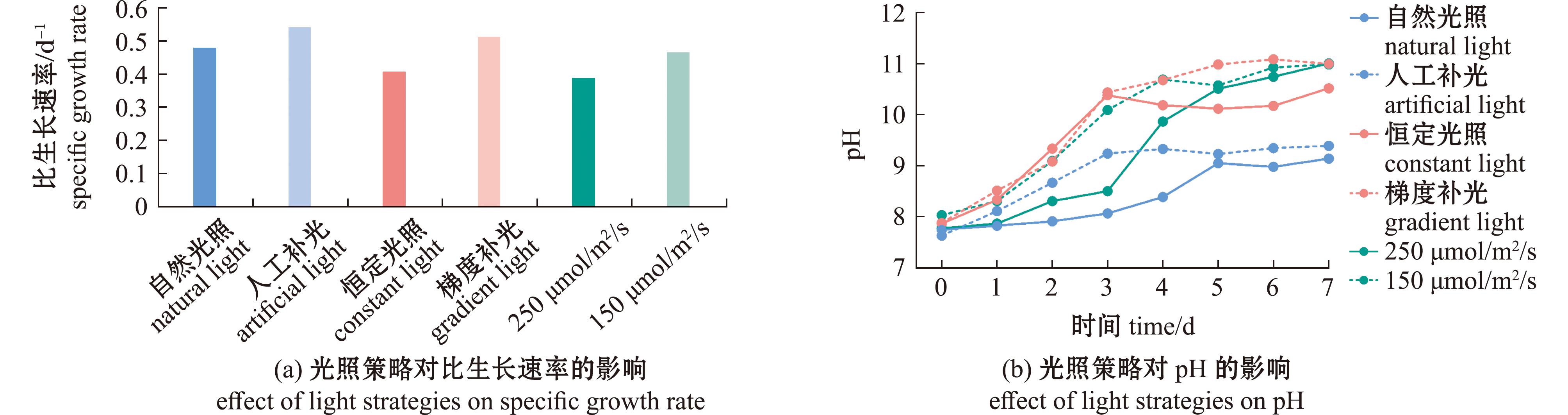
图3 不同光照策略下球等鞭金藻的比生长速率和pH值
Fig.3 Effects of different light strategies on specific growth rate and pH value on Isochrysis galbana
2.2 CO2补充策略对球等鞭金藻生长的影响
本研究进一步探究了不同CO2补充策略对球等鞭金藻生长和生物量积累的影响(图4)。结果表明,400 mL/min通气组细胞密度高于200 mL/min通气组(图4(a));400 mL/min通气组最终干质量达0.48 g/L,是200 mL/min通气组的1.09倍(图4(c))。在总通气量一致的条件下,梯度通气组表现出更优的培养效果,其细胞密度和干质量均高于恒定通气组(图4(b)、(d))。虽然前3天恒定通气模式显示出较好的适应性,但从整体培养周期来看,梯度通气模式通过动态调节通气量,更有效地维持了培养系统的稳定性,最终实现了更高的生物量积累。
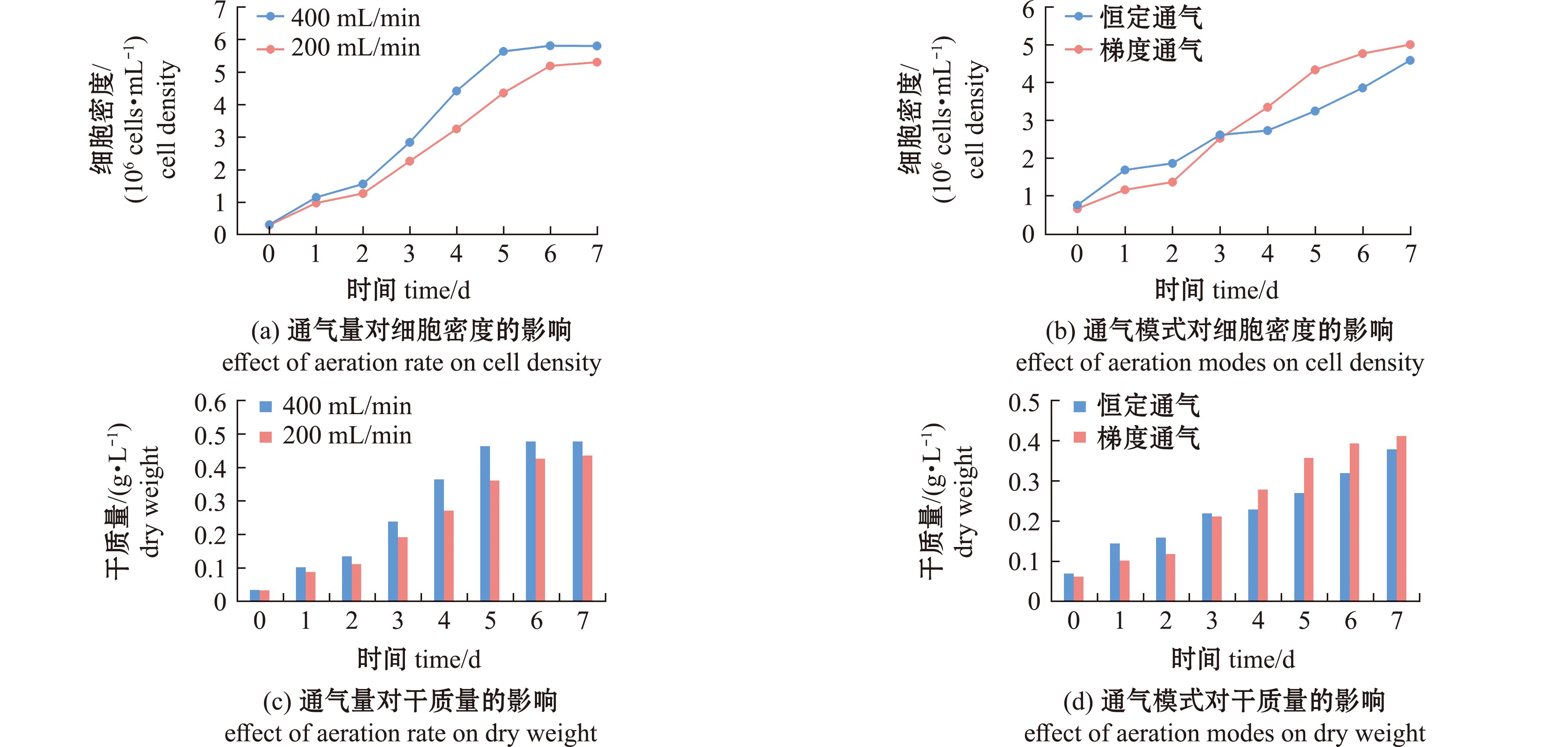
图4 不同CO2补充策略对球等鞭金藻生长情况的影响
Fig.4 Effects of different CO2 supplementation strategies on the growth of Isochrysis galbana
不同CO2补充策略下,球等鞭金藻的比生长速率存在差异(图5(a))。400 mL/min通气组在指数生长期(前3天)的比生长速率达到0.60 d-1,高于200 mL/min通气组,但两组pH调控效果均不理想,培养后期pH值快速上升至9.5左右;相比之下,梯度通气模式通过动态调节通气量,不仅比生长速率略高于恒定通气组,更重要的是在保证较高生物量的同时实现了更优的pH控制,最终将pH值稳定在更适宜的8.5左右,有效平衡了微藻生长与环境稳定性,证实了动态调节通气策略在微藻培养中的综合优势。
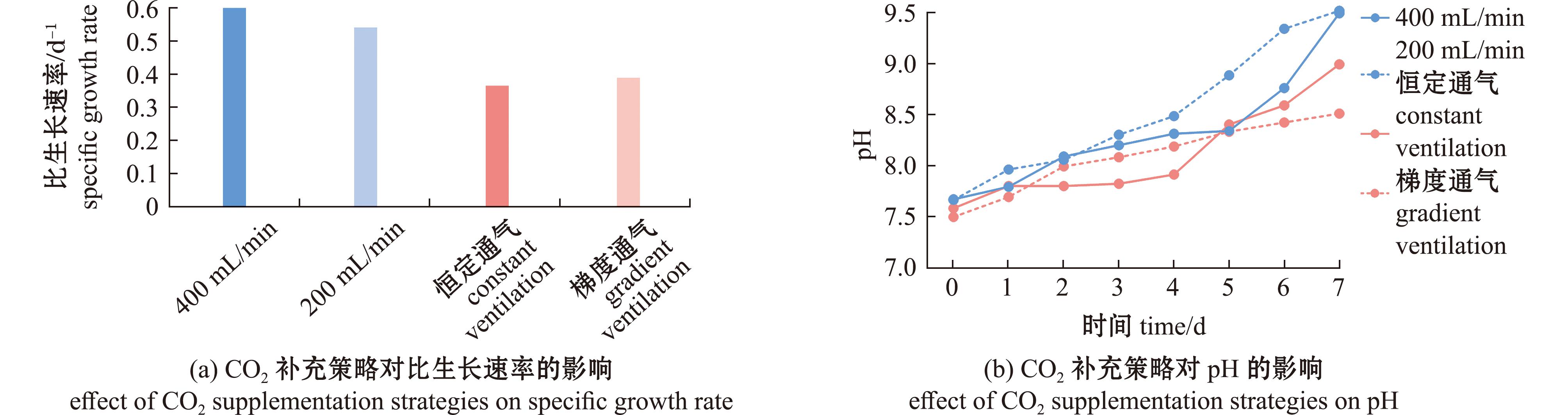
图5 不同CO2补充策略下球等鞭金藻的比生长速率和pH值
Fig.5 Effects of different CO2 supplementation strategies on specific growth rate and pH value in Isochrysis galbana
2.3 管道反应器半连续培养更新量对球等鞭金藻生长的影响
在上述试验的基础上(平均光强150 μmol/m2/s,平均通气量300 mL/min),比较管道式光生物反应器半连续培养模式下20%与40%两种更新量对球等鞭金藻生长的影响(图6)。在14 d的试验内,20%更新量组实现了4次采收(更新周期为3 d),细胞密度稳定在(8.4~11.2)×106 cells/mL;40%更新量组进行了3次采收(更新周期为4 d),细胞密度为(7.2~11.3)×106 cells/mL。然而,40%更新量组的采收总体积为550 L,总生物质干质量达488.32 g,较20%更新量组的总体积提高22.22%,总生物质干质量提升20.13%(表1)。
表1 不同更新量下半连续培养模式的最终生物质干质量产量
Tab.1 Final biomass dry weight yield of semi continuous cultivation mode under different renewal levels

更新量/% renewalrate 更新次数 timesofrenewal 采收平均干质量/ (g·L-1) averageharvesteddryweight 采收总体积/L totalharvestedvolume 实际采收总生物质干质量/g totalharvestedbiomass 20 4 0.90 450 406.48 40 3 0.89 550 488.32
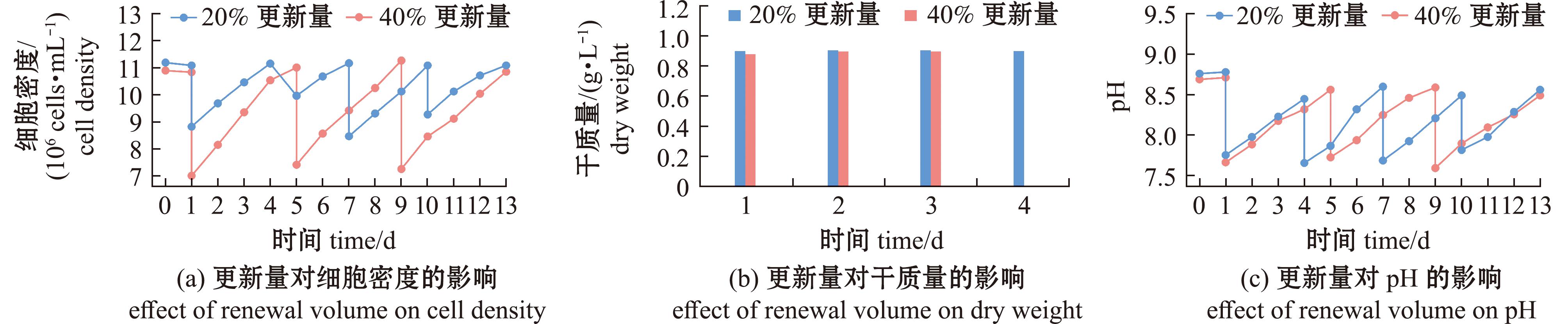
图6 半连续培养模式下不同更新量对球等鞭金藻生长情况的影响
Fig.6 Effects of different renewal volumes on the growth of Isochrysis galbana in semi-continuous culture mode
3 讨论
3.1 光环境优化对微藻生长的影响
本研究中在管道式光生物反应器中培养球等鞭金藻,夜间补光策略提高了藻细胞密度和干质量,梯度补光模式较恒定补光模式更具优势[17]。梯度补光组在培养7 d后干质量达到0.38 g/L,较恒定补光组提升11%,表明动态调整光强更符合微藻不同生长阶段的需求。这一结果与Liu等[18]的研究一致,证实了梯度光照策略可提高光能利用效率,避免培养初期藻细胞密度较低引起的光损伤,以及培养后期光照不足的问题[18-19]。值得注意的是,150 μmol/m2/s的日平均光强在生物量积累和能耗之间取得了较好平衡,虽然250 μmol/m2/s光强组在试验结束时与150 μmol/m2/s光强组生物量相近,但其初期生长受到抑制,比生长效率较低,同时能耗更高,在实际生产中需综合考虑光强与经济效益。然而,陈建楠[20]通过试验证实,该藻种在120 μmol/m2/s时表现出最优生长速率。这种差异可能与光谱组成、温度或营养条件等环境因子的协同作用有关。
3.2 CO2供应对微藻生长的影响
微藻规模化培养中精准调控pH至关重要,其直接影响微藻的光合作用、呼吸代谢等过程。CO2可被微藻直接吸收利用,实现高效碳源供给、精准pH调节,比碳酸氢钠作为碳源更适用于规模化培养[21]。CO2供应策略对球等鞭金藻的生长效率和系统稳定性具有影响[21]。本研究发现,400 mL/min的通气量提升了藻细胞密度和干质量,而梯度通气模式在维持pH稳定性方面表现更优。梯度通气组通过动态调节CO2通量,将pH稳定在8.5左右,较恒定通气组更有利于藻细胞生长。这一结果与Sutherland等[22]的研究一致,表明CO2供应需与藻细胞代谢需求动态匹配,以避免碳限制或pH失衡。值得注意的是,CO2通入量的选择需兼顾微藻培养效果与运行成本,而梯度通气模式与微藻生长过程相耦合,在保证生物量积累的同时减少了CO2浪费,结合实时pH监测与智能调控技术,可进一步优化CO2供给策略,为规模化培养中的碳源管理提供了可行方案。此外,在微藻规模化培养过程中,可结合电厂烟气CO2循环再利用,为工业固碳应用提供可行策略[23]。
3.3 采收模式对微藻生长的影响
半连续培养模式的优化是微藻工业化生产的关键,可极大缩减批次培养中消毒过程所需的时间成本[24-25]。本研究中发现,球等鞭金藻半连续培养模式更新量为40%时,总生物质产量高于20%更新量组,14 d培养后总干质量达488.32 g,提升幅度达20%。这一结果与Tavares等[26]研究相吻合,证实适当提高更新量对维持系统稳定性和提升生产效率具有重要意义。值得注意的是,40%更新量组虽表现出更高的生物质产量,但其采收周期相对较长(4 d),而20%更新量组则需更频繁地采收操作(3 d)。这一发现表明,提高更新量不仅提升了生产效率,还能通过减少采收操作频率进一步降低人工与能耗成本,这对工业化应用具有重要价值。本研究中还观察到,在整个培养过程中pH值随采收更新呈现规律性波动,但始终稳定维持在7.6~8.6的适宜范围内,这一现象表明半连续培养模式能够有效缓解代谢产物积累对藻细胞生长的抑制作用[27]。未来研究可进一步探索培养基补充策略与更新量的动态耦合,以期在保证生物质产量的同时,延长培养系统的稳定运行时间,为微藻的工业化生产提供更完善的技术方案。
4 结论
1)梯度补光策略可提高球等鞭金藻的细胞密度和生物量干质量,有效避免光抑制,并提升光能利用效率。
2)通过动态调整CO2通量,梯度通气模式能够维持培养体系pH稳定,促进光合作用,从而提高生物量积累效率。
3)在相同培养周期内,40%培养液更新量组的生物质总产量较20%更新量组提高20.13%,表明较高的更新率更有利于规模化培养。
[1] COLANTONI E,PALONE F,CESI V,et al.Innovative method to grow the probiotic Lactobacillus reuteri in the omega3-rich microalga Isochrysis galbana[J].Scientific Reports,2022,12(1):3127.
[2] 李道贵,陈娜,洪育翎,等.等鞭金藻培养方式及其应用研究进展[J].渔业研究,2022,44(3):294-300.
LI D G,CHEN N,HONG Y L,et al.Research progress in culture modes and applications of Isochrysis galbana[J].Journal of Fisheries Research,2022,44(3):294-300.(in Chinese)
[3] 丛超.球等鞭金藻的遗传多样性与高DHA和EPA品系的定向选育[D].上海:上海海洋大学,2017.
CONG C.Genetic diversity of Isochrysis globosa and directional breeding of high DHA and EPA strains[D].Shanghai:Shanghai Ocean University,2017.(in Chinese)
[4] VUPPALADADIYAM A K,PRINSEN P,RAHEEM A,et al.Sustainability analysis of microalgae production systems:a review on resource with unexploited high-value reserves[J].Environmental Science &Technology,2018,52(24):14031-14049.
[5] LAM T P,LEE T M,CHEN CY,et al.Strategies to control biological contaminants during microalgal cultivation in open ponds[J].Bioresource Technology,2018,252:180-187.
[6] 韩炜.生物能源微藻的快速筛选及大规模培养[D].上海:上海交通大学,2011.
HAN W.Rapid screening and large-scale culture of bioenergy microalgae[D].Shanghai:Shanghai Jiao Tong University,2011.(in Chinese)
[7] RODR GUEZ-MIRANDA E,GUZM
GUEZ-MIRANDA E,GUZM N J L,ACI
N J L,ACI N F G,et al.Indirect regulation of temperature in raceway reactors by optimal management of culture depth[J].Biotechnology and Bioengineering,2021,118(3):1186-1198.
N F G,et al.Indirect regulation of temperature in raceway reactors by optimal management of culture depth[J].Biotechnology and Bioengineering,2021,118(3):1186-1198.
[8] KUO C M,JIAN J F,SUN Y L,et al.An efficient photobioreactors/raceway circulating system combined with alkaline-CO2 capturing medium for microalgal cultivation[J].Bioresource Technology,2018,266:398-406.
[9] 吕布,杨守国,ELY V H,等.3种不同规模化培养模式对湛江等鞭金藻生产力及色素含量的影响[J].渔业现代化,2022,49(1):11-17.
LÜ B,YANG S G,ELY V H,et al.Effects of three different culture modes on productivity and pigment concentration of Isochrysis zhanjiangensis[J].Fishery Modernization,2022,49(1):11-17.(in Chinese)
[10] WAHIDIN S,IDRIS A,SHALEH S R M.The influence of light intensity and photoperiod on the growth and lipid content of microalgae Nannochloropsis sp.[J].Bioresource Technology,2013,129:7-11.
[11] VEJRAZKA C,JANSSEN M,STREEFLAND M,et al.Photosynthetic efficiency of Chlamydomonas reinhardtii in flashing light[J].Biotechnology and Bioengineering,2011,108(12):2905-2913.
[12] KIM G Y,HEO J,KIM H S,et al.Bicarbonate-based cultivation of Dunaliella salina for enhancing carbon utilization efficiency[J].Bioresource Technology,2017,237:72-77.
[13] XIA Y J,SEKINE M,HIRAHARA M,et al.Effects of concentration and frequency of CO2 supply on productivity of marine microalga Isochrysis galbana[J].Algal Research,2023,70:102985.
[14] FENG P Z,YANG K,XU Z B,et al.Growth and lipid accumulation characteristics of Scenedesmus obliquus in semi-continuous cultivation outdoors for biodiesel feedstock production[J].Bioresource Technology,2014,173:406-414.
[15] ASHOKKUMAR V,AGILA E,SALAM Z,et al.A study on large scale cultivation of Microcystis aeruginosa under open raceway pond at semi-continuous mode for biodiesel production[J].Bioresource Technology,2014,172:186-193.
[16] BARBOZA-RODR GUEZ R,RODR
GUEZ R,RODR GUEZ-JASSO R M,ROSERO-CHASOY G,et al.Photobioreactor configurations in cultivating microalgae biomass for biorefinery[J].Bioresource Technology,2024,394:130208.
GUEZ-JASSO R M,ROSERO-CHASOY G,et al.Photobioreactor configurations in cultivating microalgae biomass for biorefinery[J].Bioresource Technology,2024,394:130208.
[17] 王莎,张华,程海翔.自然光照下补光策略对Chlamydomonas sp.JSC4生物膜除污固碳的影响[J].可再生能源,2022,40(6):743-750.
WANG S,ZHANG H,CHENG H X.The effect of light supplementing strategy on pollution removal and carbon sequestration of Chlamydomonas sp.JSC4biofilm under sunlight[J].Renewable Energy Resources,2022,40(6):743-750.(in Chinese)
[18] LIU F C,GAUL L,SHU F,et al.Microscope-based light gradient generation for quantitative growth studies of photosynthetic micro-organisms[J].Lab on a Chip,2022,22(17):3138-3146.
[19] 朱飞霞.光质对铜绿微囊藻细胞大小及生理活性的影响[D].大连:大连海洋大学,2024.
ZHU F X.Effect of light quality on cell size and physiological activity of Microcystis aeruginosa[D].Dalian:Dalian Ocean University,2024.(in Chinese)
[20] 陈建楠.球等鞭金藻生产岩藻黄素和油脂的研究[D].福州:福建师范大学,2018.
CHEN J N.Study on the production of fucoxanthin and oil by Isochrysis globosa[D].Fuzhou:Fujian Normal University,2018.(in Chinese)
[21] 刘洪霞.环境因子对球等鞭金藻胞外碳酸酐酶活性的影响[D].烟台:烟台大学,2007.
LIU H X.Effects of environmental factors on extracellular carbonic anhydrase activity of Isochrysis globosa[D].Yantai:Yantai University,2007.(in Chinese)
[22] SUTHERLAND D L,HOWARD-WILLIAMS C,TURNBULL M H,et al.The effects of CO2 addition along a pH gradient on wastewater microalgal photo-physiology,biomass production and nutrient removal[J].Water Research,2015,70:9-26.
[23] WANG Z Y,CHENG J,SONG W L,et al.CO2 gradient domestication produces gene mutation centered on cellular light response for efficient growth of microalgae in 15% CO2 from flue gas[J].Chemical Engineering Journal,2022,429:131968.
[24] 朱艺峰,林霞,徐同成,等.光、氮和半连续培养更新率对微绿球藻生长与采收量的影响[J].中国水产科学,2004,11(2):159-165.
ZHU Y F,LIN X,XU T C,et al.Effects of light intensity,concentration of nitrogen and renewal rate in semicontinuous cultures on growth and recovery yield of Nannochloropsis oculata (Droop) Hibberd[J].Journal of Fishery Sciences of China,2004,11(2):159-165.(in Chinese)
[25] FERREIRA M,SEIXAS P,COUTINHO P,et al.Effect of the nutritional status of semi-continuous microalgal cultures on the productivity and biochemical composition of Brachionus plicatilis[J].Marine Biotechnology,2011,13(6):1074-1085.
[26] TAVARES J,SILVA T P,PAIX O S M,et al.Development of a bench-scale photobioreactor with a novel recirculation system for continuous cultivation of microalgae[J].Journal of Environmental Management,2023,332:117418.
O S M,et al.Development of a bench-scale photobioreactor with a novel recirculation system for continuous cultivation of microalgae[J].Journal of Environmental Management,2023,332:117418.
[27] 徐志标,裴鲁青,骆其君,等.绿色巴夫藻的光生物反应器半连续培养研究[J].海洋水产研究,2005,26(4):64-69.
XU Z B,PEI L Q,LUO Q J,et al.Studies on the semi-continuous culture of Pavlova viridis in photobioreactor[J].Marine Fisheries Research,2005,26(4):64-69.(in Chinese)