中华绒螯蟹(Eriocheir sinensis),俗称“河蟹”“毛蟹”“大闸蟹”,隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)弓蟹科(Varunidae)[1],是中国重要的淡水养殖名特优水产品,2023年中国中华绒螯蟹养殖总产量为88.86万t[2]。随着中华绒螯蟹养殖规模的扩大和养殖密度的提高,池塘养殖病害问题时常发生,如颤抖病、肝胰腺白化和“水瘪子”病等[3-5],导致养殖死亡率增加,养殖效益下滑。
中华绒螯蟹“水瘪子”疾病是2014年以来在江苏兴化等地新出现的病害,外形干瘪是其明显特征,故被养殖户称为“水瘪子”[6],发病高峰期为每年6月—7月,发病蟹主要症状为肝胰腺发白、腹部和附肢肌肉萎缩、头胸甲内存在大量积水等,个别池塘发病率高达30%~40%,造成了巨大的经济损失[7]。有关中华绒螯蟹“水瘪子”病害的发病原因已有较多研究,但尚未达成共识,其病因主要有四类:1)养殖环境存在菊酯、阿维菌素和敌百虫等药物残留胁迫中华绒螯蟹肝胰腺坏死[8];2)水体低溶解氧和高pH胁迫[9-10];3)饲料中营养不平衡,存在氧化脂肪和抗营养因子等[11-12];4)中华绒螯蟹存在微孢子虫[13]、病毒[14]和放线菌门的致病菌等病原体[15]。可见,中华绒螯蟹“水瘪子”病害的形成可能是多种生物因素和非生物因素共同作用的结果[16-17],探明其具体成因并寻找防治办法还需要大量细致的研究工作。
中华绒螯蟹的主要可食部分为肝胰腺、肌肉和性腺[18]。迄今为止,尚不清楚“水瘪子”蟹和正常商品蟹的性腺指数、可食率及生化组成存在哪些差异,这不利于解析“水瘪子”疾病的形成原因和可食用价值评估。鉴于此,本研究在发生“水瘪子”病养殖池塘随机选择具有“水瘪子”症状的成蟹和正常商品蟹,通过解剖和生化分析,比较“水瘪子”蟹和正常蟹两种成蟹的性腺指数、肝胰腺指数、出肉率、总可食率、色泽参数及可食组织生化组成,以期了解“水瘪子”病蟹的形态特点与生化特征,同时为养殖中华绒螯蟹“水瘪子”病的营养防控提供思路。
1 材料与方法
1.1 材料
试验蟹于2020年11月取自浙江某中华绒螯蟹养殖场。为了消除饵料和养殖环境对成蟹生化组成的影响,“水瘪子”蟹和正常蟹均取自发生“水瘪子”病害的3个成蟹养殖池塘,两种成蟹的数量、体质量范围和平均体质量见表1。样品活体运输至上海海洋大学营养繁殖实验室,用于解剖和组织取样。
表1 “水瘪子” 蟹和正常蟹样品
Tab.1 Samples of abnormal and normal adults of Chinese mitten crabs

组别 group 采样数量/只 numberofsamples 体质量范围/g bodyweightrange 平均体质量/g averageweight “水瘪子”雄蟹 abnormalmalecrab 17 141.90~347.60 204.79±56.42 正常雄蟹 normalmalecrab 12 178.08~271.40 221.32±29.22 “水瘪子”雌蟹 abnormalfemalecrab 12 101.90~230.46 147.11±23.26 正常雌蟹 normalfemalecrab 12 121.83~139.67 131.91±5.67
1.2 方法
1.2.1 组织系数测定 称重前用吸水纸吸干中华绒螯蟹甲壳及附肢上的水分,使用精确度为0.01 g的电子天平称量,并记录蟹的体质量(M)。冰上麻醉后进行活体解剖,观察并记录各组织的外部特征,将蟹体内的肝胰腺和性腺全部取出准确称量并记录其质量mH、mG,计算肝胰腺指数(HSI,%)和性腺指数(GSI,%);取出全部肌肉(腹部和附肢中的肌肉),准确称量并记录肌肉质量为mM,计算出肉率(MY,%)和总可食率(TEY,%),称量后的所有组织样品保存于-40 ℃冰箱待生化检测。各组织系数、出肉率和总可食率计算公式为
IHSI=mH/M×100%,
(1)
IGSI=mG/M×100%,
(2)
YMY=mM/M×100%,
(3)
YTEY=HSI+GSI+MY。
(4)
1.2.2 色泽参数测定及外观拍照 使用色差仪(CE-400,Konica Minolta,Marunouchi,Tokyo,Japan)对蟹壳冻干样、肝胰腺湿样和卵巢冻干样的色泽参数进行测定。蟹壳色泽的测定参考Wu等[18]方法,选取蟹壳上相对平整的3个固定点测定明度值(L*)、红度值(a*)、黄度值(b*)和色差(ΔE*)[19]。随机挑取 “水瘪子” 蟹与正常蟹的肝胰腺鲜样各5只,卵巢干样各3只,分别装入透明密封袋,用玻璃棒搅拌均匀后密封袋子,分别平铺置桌面上,为防止反光,制做了图1式的拍照模型,采用数码相机尼康D90拍照。
A—相机位置;B—内部光源;C—样品摆放位置。
A—position of camera;B—light source inside;C—the position where the samples are placed.
图1 拍照装置
Fig.1 Photo-taking device
1.2.3 类胡萝卜素含量及组成测定 蟹壳(剔除内膜)和卵巢样品需要先冻干后再进行研磨,肝胰腺样品采用湿样直接提取。总类胡萝卜素的提取和测定参考Long等[20]方法,使用80%丙酮溶液(丙酮∶去离子水的体积比=8∶2)和纯丙酮溶液进行提取,定容后的提取液密封保存于-40 ℃冰箱待用。使用紫外分光光度计(型号:T6新世纪,北京普析通用仪器有限责任公司)测定吸光度,检测波长设定为478 nm,采用虾青素作标准品制备标准曲线,依据标准曲线计算总类胡萝卜素含量。提取过程均在避光条件下进行,防止类胡萝卜素见光分解及氧化。
采用高效液相色谱法(HPLC)分析测定类胡萝卜素的组成及含量,提取液测定前采用0.2 μm的有机相微孔滤膜过滤。使用安捷伦1260 HPLC系统(Agilent Technologies Inc.,CA,USA)进行类胡萝卜素分离和定量分析,具体参数设置参考李清清[21]方法。由于肝胰腺和卵巢中部分类胡萝卜素的存在形式为酯化类型,故对提取液进行皂化处理,具体参考孙伟红等[22]方法。采用6种类胡萝卜素标准品(虾青素、叶黄素、玉米黄素、角黄素、海胆烯酮、β-胡萝卜素)进行类胡萝卜素定性和定量分析,依据标准品的出峰时间确定样品所含类胡萝卜素种类,依据峰面积百分比,定量计算每种类胡萝卜素的相对含量(mg/kg)。
1.2.4 常规生化成分测定 为防止105 ℃烘干造成营养物质的氧化和挥发损失,采用冷冻干燥法测定水分含量[23],采用AOAC [24]标准方法测定粗蛋白质含量(凯氏定氮法)和灰分含量(550 ℃灼烧至恒重);采用Folch等[25]氯仿/甲醇法(V/V=2∶1) 测定总脂含量,每种组织重复3~4次。
1.2.5 脂肪酸组成测定 参考Morrison等[26]方法,采用14%的三氟化硼-甲醇溶液对已提取的总脂进行甲酯化处理,使用美国Agilent 7890气相色谱仪进行脂肪酸分析,分离色谱柱为Omegawax-320毛细管柱(30.0 m×0.32 mm×0.25 μm;美国 Supelco公司),具体分析程序和参数设置参考Zhang等[27]的方法。参考Supelco-37脂肪酸甲酯混合标准品(货号:47885-U,美国Supelco公司)进行脂肪酸定性分析,采用面积百分比法对脂肪酸百分比含量进行定量计算。
1.3 数据处理
所有数据均采用平均值±标准误(mean±S.E.)表示,采用SPSS 26.00软件进行统计分析,采用Excel 2019软件绘制图表。采用Levene法对试验数据进行方差齐性检验,采用独立样本T检验进行两组数据之间的显著性分析,显著性差异设为0.05,极显著性差异设为0.01。
2 结果与分析
2.1 组织指数和总可食率
“水瘪子”蟹和正常蟹的肝胰腺指数(hepatosomatic index,HSI)、性腺指数(gonadosomatic index,GSI)、出肉率(meat yield,MY)和总可食率(total edible yield,TMY)数据如图2所示。无论雌蟹与雄蟹,“水瘪子”蟹组的HSI、GSI、MY和TMY均极显著低于正常蟹组 (P<0.01)。就雄体而言,正常组HSI超过5%,而“水瘪子”蟹组HSI和GSI均低于5%,正常蟹组MY超过25%,TMY接近35%。
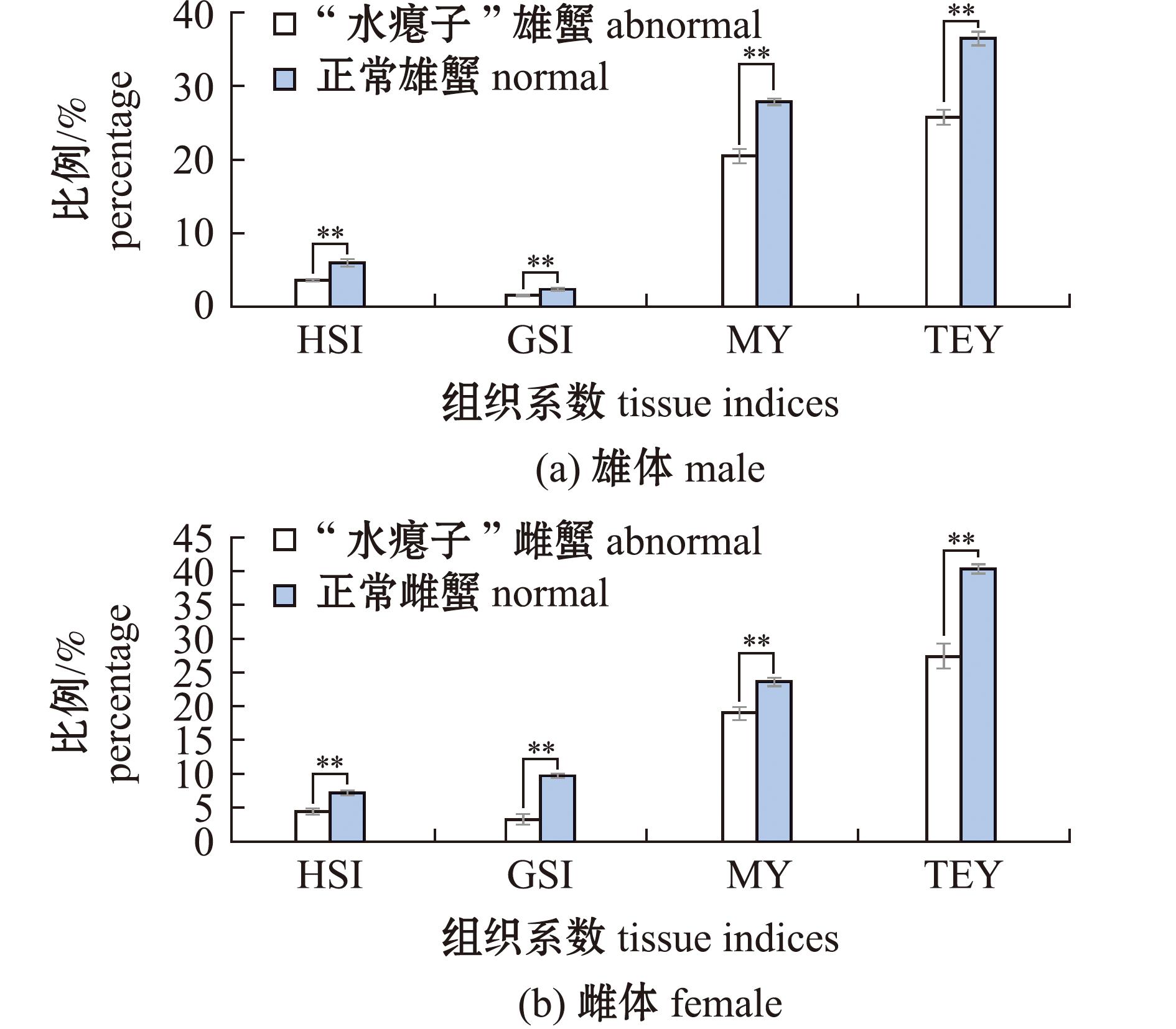
**表示两组间有极显著性差异(P<0.01)。
** means very significantly different between the two groups (P<0.01).
图2 “水瘪子”蟹和正常蟹的组织系数和可食率比较
Fig.2 Comparison of tissue indices and TEY between abnormal and normal adults of Eriocheir sinensis
2.2 色泽参数和类胡萝卜素含量
“水瘪子”蟹和正常蟹的色泽参数和类胡萝卜含量分别见表2和表3。就冻干蟹壳而言,“水瘪子”雌蟹L*值和b*值显著高于正常雌蟹(P<0.05,表2),“水瘪子”蟹组和正常蟹组的色泽参数均无显著性差异;无论雄蟹还是雌蟹,两组蟹壳中的总类胡萝卜素、虾青素、叶黄素和玉米黄素含量均无显著性差异。就肝胰腺而言,“水瘪子”蟹组的肝胰腺湿样L*值、a*值、b*值均极显著低于正常蟹组(P<0.01,表2),这与雄蟹及雌蟹的肝胰腺外观拍照结果一致(图3);“水瘪子”蟹组的肝胰腺中总类胡萝卜素和β-胡萝卜素含量均明显低于正常蟹组,但仅“水瘪子”雄蟹肝胰腺中的β-胡萝卜素含量显著性低于正常雄蟹(P<0.05,表3)。就雌体卵巢而言,“水瘪子”雌蟹的卵巢冻干样品a*值和b*值均显著低于正常雌蟹(P<0.05,表2),这与两组雌蟹卵巢外观的拍照结果一致(图3);“水瘪子”雌蟹卵巢中的总类胡萝卜素、叶黄素、玉米黄素、海胆烯酮和β-胡萝卜素含量均低于正常雌蟹,其中,两者卵巢中仅叶黄素和β-胡萝卜素含量存在显著性差异(P<0.05,表3)。
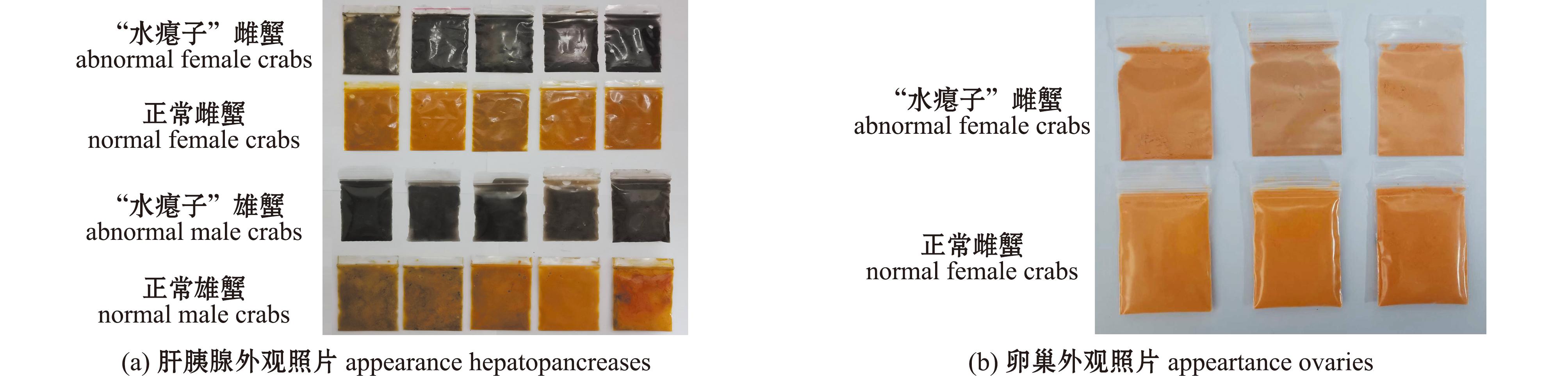
图3 “水瘪子”蟹和正常蟹的肝胰腺和卵巢的外观照片
Fig.3 Appearance of hepatopancreases and ovaries of abnormal and normal adults of Eriocheir sinensis
表2 “水瘪子”蟹和正常蟹的色泽参数
Tab.2 Color parameters of carapace,hepatopancreas and gonads of abnormal and normal adults of Eriocheir sinensis

组织 tissue 色泽参数 colorparameters “水瘪子”雄蟹 abnormalmalecrab 正常雄蟹 normalmalecrab “水瘪子”雌蟹 abnormalfemalecrab 正常雌蟹 normalfemalecrab 头胸甲 (冻干样) carapace(driedsamples) L* 55.27±1.69 55.07±1.43 54.51±0.68* 50.73±1.24 a* 15.21±0.77 15.10±0.55 17.89±0.88 15.60±0.69 b* 22.43±1.10 21.97±0.66 23.15±0.47** 20.31±0.72 ΔE* 46.64±1.68 44.89±0.99 46.74±0.82 47.96±0.99 肝胰腺 (湿样) hepatopancreas(wetsamples) L* 29.27±0.86 53.43±2.35** 36.03±1.34 55.28±1.08** a* 2.65±0.57 12.52±0.76** 6.23±0.88 18.40±0.69** b* 4.63±0.77 27.91±1.58** 12.56±1.55 30.43±0.79** ΔE* 62.91±0.97** 48.88±1.30 58.26±1.05** 49.91±0.56 性腺 (冻干样) gonads(driedsamples) L* ND ND 61.04±1.06 64.97±0.89 a* ND ND 16.26±1.27 21.94±0.35* b* ND ND 23.22±1.28 30.39±0.49* ΔE* ND ND 40.92±1.02 44.60±0.45
注:*表示两组间有显著性差异(P<0.05);**表示两组间有极显著性差异(P<0.01);ND—未检测,下同。
Note:* means significant effect (P<0.05);** means very significant effect (P<0.01);ND—not detected,et sequentia.
表3 “水瘪子”蟹和正常蟹头胸甲、肝胰腺和性腺中主要类胡萝卜素含量
Tab.3 Content of major carotenoids in carapace,hepatopancreas and gonads of abnormal and normal adults of Eriocheir sinensis mg/kg

组织 tissue 类胡萝卜素 carotenoids “水瘪子”雄蟹 abnormalmalecrabs 正常雄蟹 normalmalecrabs “水瘪子”雌蟹 abnormalfemalecrabs 正常雌蟹 normalfemalecrabs 总类胡萝卜素totalcarotenoids 69.95±1.65 71.99±4.40 87.47±8.93 70.49±9.99 虾青素 astaxanthin 59.29±1.28 59.97±3.33 68.37±5.28 58.86±7.98 叶黄素lutein 9.09±1.11 10.50±0.99 16.90±4.45 10.18±1.91 玉米黄素zeaxanthin 1.57±0.33 1.52±0.34 2.19±0.35 1.45±0.26 总类胡萝卜素totalcarotenoids 214.44±27.05 418.92±43.80* 224.61±86.27 316.82±10.08 头胸甲 carapace 虾青素 astaxanthin 17.75±0.83 15.08±0.31 15.27±1.06 16.64±0.33 叶黄素lutein — 4.49±0.83 — 3.13±0.29 玉米黄素zeaxanthin 1.05±0.09 0.89±0.03 — — 角黄素 canthaxanthin 17.52±0.01 — — — 海胆烯酮 echinenone 1.94±0.93 0.95±0.13 1.51±0.03 1.56±0.51 β-胡萝卜素 β-carotene 189.66±25.80 399.31±43.12* 206.67±86.21 295.50±9.30 总类胡萝卜素totalcarotenoids ND ND 370.16±66.31 645.66±17.69 虾青素 astaxanthin ND ND 115.64±4.04 99.34±11.36 叶黄素lutein ND ND 43.13±8.18 178.66±27.57** 性腺 gonads 玉米黄素zeaxanthin ND ND 3.70±0.23 20.01±7.03 角黄素 canthaxanthin ND ND 28.61±0.63 26.66±1.40 海胆烯酮 echinenone ND ND 32.92±9.38 36.40±7.77 β-胡萝卜素 β-carotene ND ND 82.79±9.89 284.61±28.49**
注:—未测出。Note:—not measured.
2.3 常规营养成分比较
“水瘪子”蟹和正常蟹的常规营养成分见表4。就肝胰腺而言,无论雌雄,“水瘪子”蟹组水分含量显著高于正常蟹组,但其总脂含量显著低于正常蟹组(P<0.05)。然而,“水瘪子”雌蟹肝胰腺中粗蛋白质和灰分含量均显著高于正常蟹(P<0.05)。就性腺而言,“水瘪子”蟹组的水分含量极显著高于正常蟹组,但其粗蛋白质含量极显著低于正常蟹组(P<0.01)。此外,正常雌蟹卵巢中总脂和正常雄蟹性腺中的灰分均显著高于“水瘪子”蟹组(P<0.05)。就肌肉而言,“水瘪子”蟹组的水分含量显著高于正常蟹组,粗蛋白质含量显著低于正常蟹组(P<0.05),此外,正常雌蟹肌肉中总脂含量显著高于“水瘪子”蟹(P<0.05)。
表4 “水瘪子”蟹和正常蟹的常规营养成分
Tab.4 Proximate composition in hepatopancreas,gonads and muscle of abnormal and normal adults of Eriocheir sinensis %wet weight

组织 tissue 营养成分 proximatecomposition “水瘪子”雄蟹 abnormalmalecrabs 正常雄蟹 normalmalecrabs “水瘪子”雌蟹 abnormalfemalecrabs 正常雌蟹 normalfemalecrabs 水分 moisture 85.58±1.35** 57.70±3.46 81.36±1.05** 45.13±1.10 肝胰腺 hepatoancreas 粗蛋白质 crudeprotein 8.87±0.70 9.90±0.77 9.97±0.23* 8.50±0.22 总脂totallipids 3.04±0.18 31.77±2.96* 4.88±0.81 48.36±1.86** 灰分 ash 1.78±0.18 1.57±0.15 2.33±0.15** 0.99±0.05 水分 moisture 78.00±0.72** 73.46±0.30 69.67±2.18** 50.05±0.22 性腺 gonads 粗蛋白质 crudeprotein 12.84±0.45 15.44±0.23** 15.79±0.47 26.53±0.05** 总脂totallipids 0.65±0.04 0.55±0.05 8.91±0.96 17.93±0.23** 灰分 ash 1.79±0.07 2.18±0.02* 1.29±0.11 1.64±0.01 水分 moisture 85.23±0.77* 80.67±1.00 87.07±0.47* 75.04±1.94 肌肉 muscle 粗蛋白质 crudeprotein 10.73±0.58 14.05±0.54* 9.23±0.20 17.95±1.64* 总脂totallipids 0.78±0.02 0.88±0.05 0.73±0.04 1.17±0.10* 灰分 ash 1.89±0.11 1.75±0.11 1.82±0.08 1.98±0.13
2.4 脂肪酸组成比较
“水瘪子”蟹和正常蟹肝胰腺中的脂肪酸组成见表5。就雄体而言,“水瘪子”蟹组的C17:0、C18:0、C20:2n6和C20:5n3百分比含量均显著高于正常蟹组,但其C16:1n7显著低于正常蟹组(P<0.05);就雌体而言,“水瘪子” 蟹组的C20:1n9、C22:1n9、C20:2n6、C20:4n6、C20:5n3和C22:5n3百分含量均极显著高于正常蟹组(P<0.01),但其C15:0、C16:1n7、C17:1n、C18:2n6和C18:3n3百分比含量均显著低于正常蟹组(P<0.05)。整体上,“水瘪子”蟹组和正常蟹组肝胰腺中的总饱和脂肪酸(SFA)、总单不饱和脂肪酸(MUFA)、总多不饱和脂肪酸(PUFA)相对百分含量接近(P>0.05),“水瘪子”蟹组的长链多不饱和脂肪酸 (LC-PUFA)均高于正常蟹组,但仅雌蟹组存在极显著性差异(P<0.01),无论雌雄,“水瘪子”蟹组的DHA/EPA比值均显著低于正常蟹组(P<0.05)。
表5 “水瘪子”蟹和正常蟹肝胰腺的脂肪酸组成
Tab.5 Fatty acid composition in the hepatopancreas of abnormal and normal adults of Eriocheir sinensis %

脂肪酸 fattyacid “水瘪子”雄蟹 abnormalmalecrabs 正常雄蟹 normalmalecrabs “水瘪子”雌蟹 abnormalfemalecrabs 正常雌蟹 normalfemalecrabs C14:0 0.89±0.25 1.06±0.11 1.81±0.29 2.13±0.21 C15:0 0.54±0.05 0.53±0.03 0.63±0.03 0.77±0.02* C16:0 16.98±1.24 18.92±1.06 18.00±0.78 18.18±0.65 C17:0 2.39±0.23** 1.15±0.17 1.80±0.23 1.40±0.19 C18:0 5.20±0.40* 2.58±0.04 3.69±0.51 2.27±0.04 SFA 26.00±1.43 24.23±0.94 25.93±1.15 24.75±0.84 C16:1n7 3.56±0.51 9.21±1.72* 4.06±0.22 9.17±0.67** C17:1n 0.42±0.12 0.53±0.06 0.39±0.09 0.76±0.06* C18:1n 23.38±0.86 24.93±0.93 24.25±0.64 26.39±1.25 C20:1n9 4.28±0.56 2.89±0.80 9.26±0.47** 3.98±0.42 C22:1n9 3.10±0.79 2.98±1.67 5.23±0.39** 2.00±0.26 MUFA 34.80±2.21 39.11±1.85 43.20±1.16 42.70±2.04 C18:2n6 4.68±1.86 9.60±1.76 3.30±0.53 9.13±1.43* C18:3n3 2.31±1.09 3.24±0.48 0.66±0.01 3.39±0.51* C20:2n6 3.10±0.46* 1.62±0.18 2.84±0.25** 1.01±0.06 C20:4n6 5.11±1.37 1.95±0.60 2.94±0.07** 1.06±0.08 C20:5n3 4.90±0.95* 1.79±0.47 3.47±0.19** 2.33±0.25 C22:5n3 1.17±0.30 0.64±0.20 4.12±0.34** 0.63±0.08 C22:6n3 4.57±0.66 3.77±1.15 5.18±0.53 6.34±0.83 PUFA 24.69±3.72 21.18±2.11 22.07±1.16 23.90±2.42 LC-PUFA 18.86±2.85 9.16±2.49 18.55±0.52** 11.37±1.12 n-3PUFA 11.81±1.44 8.51±1.37 12.99±0.82 12.69±1.48 n-6PUFA 12.89±2.32 12.67±1.50 9.08±0.34 11.21±1.57 n-3PUFA/n-6PUFA 0.98±0.10 0.71±0.16 1.43±0.04 1.19±0.18 DHA/EPA 1.00±0.16 2.01±0.18* 1.53±0.22 2.71±0.10**
“水瘪子”蟹与正常蟹性腺中的脂肪酸组成见表6。就雄体而言,“水瘪子”蟹组的C20:4n6百分比含量显著高于正常蟹组,但其C14:0、C16:0和C22:5n3百分比含量显著低于正常蟹组(P <0.05);就雌体而言,“水瘪子”蟹组的C18:1n百分比含量均显著高于正常蟹组,但其C20:1n9、C18:2n6和C18:3n3的百分含量显著低于正常蟹组(P<0.05)。整体上,“水瘪子”蟹组和正常蟹组性腺中的SFA、MUFA、PUFA和LC-PUF百分比含量接近(P>0.05)。
表6 “水瘪子”蟹和正常蟹性腺的脂肪酸组成
Tab.6 Fatty acid composition in the gonads of abnormal and normal adults of Eriocheir sinensis %

脂肪酸 fattyacid “水瘪子”雄蟹 abnormalmalecrabs 正常雄蟹 normalmalecrabs “水瘪子”雌蟹 abnormalfemalecrabs 正常雌蟹 normalfemalecrabs C14:0 0.14±0.02 0.25±0.01** 1.20±0.08 1.12±0.08 C16:0 5.81±0.75 9.03±0.35* 14.02±0.39 12.68±0.21 C17:0 0.76±0.10 0.88±0.05 0.73±0.13 0.74±0.04 C18:0 8.19±0.58 8.75±0.80 4.90±1.22 3.05±0.05 ΣSFA 16.19±1.71 19.14±0.44 21.15±0.97 18.08±0.33 C16:1n7 1.14±0.19 2.51±0.66 7.34±0.73 9.57±0.50 C17:1n 0.36±0.03 0.35±0.05 0.92±0.02 0.86±0.02 C18:1n 18.16±1.40 20.58±0.70 28.47±0.32* 25.18±0.42 C20:1n9 4.92±1.00 3.89±0.68 2.36±0.14 3.23±0.08* C22:1n9 3.68±0.29 3.61±0.52 1.24±0.18 0.87±0.15 ΣMUFA 28.30±0.66 29.09±2.13 40.45±0.73 39.82±0.80 C18:2n6 3.30±0.39 4.65±0.84 5.64±0.53 9.11±0.49* C18:3n3 1.50±0.13 1.87±0.16 1.33±0.25 4.29±0.42* C20:2n6 4.91±0.76 2.87±0.19 1.07±0.16 0.93±0.02 C20:4n6 14.85±1.04* 10.27±1.00 2.65±0.24 1.89±0.64 C20:5n3 11.46±0.94 8.71±0.77 8.66±0.87 7.66±0.43 C22:5n3 0.31±0.04 0.48±0.02* 0.54±0.07 0.63±0.03 C22:6n3 5.64±0.61 4.79±0.49 11.98±1.71 11.42±0.66 ΣPUFA 37.89±4.75 31.74±3.89 31.87±1.33 35.93±0.30 ΣLC-PUFA 33.46±4.19 25.68±2.80 24.89±2.12 22.53±1.02 n-3PUFA 18.54±1.83 15.38±1.40 22.51±2.26 24.00±1.02 n-6PUFA 19.35±2.97 16.36±2.55 9.36±0.93 11.93±0.73 n-3PUFA/n-6PUFA 1.01±0.09 0.99±0.09 2.50±0.49 2.05±0.20 DHA/EPA 0.49±0.02 0.55±0.03 1.37±0.06 1.49±0.01
“水瘪子”蟹与正常蟹肌肉中的脂肪酸组成见表7。就雄体而言,“水瘪子”蟹组的C18:0、C20:4n6和C20:5n3显著高于正常蟹组(P <0.05),但其C16:1n7、C22:5n3和C22:6n3的百分比含量显著低于正常蟹组(P<0.05);就雌体而言,“水瘪子”蟹组的C20:2n6和C20:5n3的百分比含量均显著高于正常蟹组,但其C16:0、C16:1n7和C17:1n的百分含量显著低于正常蟹组(P<0.05)。整体上,“水瘪子”雄蟹肌肉中的总饱和脂肪酸(ΣSFA)含量显著高于正常雄蟹,但其DHA/EPA比例显著低于正常雄蟹(P<0.05)。
表7 “水瘪子”蟹和正常蟹肌肉的脂肪酸组成
Tab.7 Fatty acid composition in the muscle of abnormal and normal adults of Eriocheir sinensis %

脂肪酸 fattyacid “水瘪子”雄蟹 abnormalmalecrabs 正常雄蟹 normalmalecrabs “水瘪子”雌蟹 abnormalfemalecrabs 正常雌蟹 normalfemalecrabs C16:0 9.64±0.15 9.86±0.15 9.22±0.08 10.18±0.07** C17:0 0.71±0.03 0.61±0.04 0.53±0.08 0.72±0.02 C18:0 8.05±0.23* 6.92±0.15 6.52±0.37 6.22±0.11 SFA 20.73±0.57* 18.00±0.35 16.74±0.49 17.6±0.04 C16:1n7 1.53±0.06 2.72±0.33* 1.76±0.08 2.57±0.28* C17:1n 0.40±0.08 0.36±0.10 0.26±0.01 0.56±0.02* C18:1n 20.49±0.35 19.82±0.58 20.17±0.47 19.76±0.32 C20:1n9 2.52±0.67 2.97±0.23 4.06±0.56 3.47±0.28 MUFA 24.95±0.85 25.87±0.98 26.25±1.11 27.11±0.29 C18:2n6 4.73±0.50 7.94±0.93 3.68±0.32 6.94±0.34 C18:3n3 1.13±0.17 2.46±0.45 0.87±0.05 1.91±0.20 C20:2n6 3.16±0.51 2.95±0.33 3.64±0.03* 2.77±0.05 C20:4n6 7.83±0.48* 5.79±0.42 7.02±0.59 4.62±0.22 C20:5n3 17.79±0.57* 14.23±1.09 17.39±0.19** 14.25±0.68 C22:5n3 0.22±0.02 0.33±0.02** 0.31±0.02 0.43±0.04 C22:6n3 10.66±0.48 12.78±0.56* 11.12±1.73 15.00±0.21 PUFA 45.52±0.69 46.48±0.27 44.03±1.61 45.90±0.81 LC-PUFA 39.66±0.35 36.08±1.24 39.49±1.34 37.06±0.68 n-3PUFA 29.81±1.08 29.80±1.28 29.70±1.85 31.58±0.78 n-6PUFA 15.71±0.57 16.68±1.39 14.33±0.25 14.33±0.38 n-3PUFA/n-6PUFA 1.92±0.13 1.88±0.28 2.08±0.17 2.21±0.08 DHA/EPA 0.60±0.02 0.91±0.03** 0.64±0.09 1.05±0.04
3 讨论
3.1 组织系数和色泽
中华绒螯蟹最主要的可食用部位为肝胰腺、性腺和肌肉,这3种组织的组织系数之和即为总可食率,这3种组织系数及总可食率常作为评价中华绒螯蟹食用价值的重要参考指标[27-28]。本研究结果表明,“水瘪子”雌蟹的性腺指数显著低于正常蟹,这主要是因为肝胰腺是中华绒螯蟹对饵料中营养物质的消化吸收、储存和转运中心[29],中华绒螯蟹卵巢发育过程中需要在卵母中积累大量卵黄蛋白和甘油三酯,肝胰腺是其卵黄蛋白原和甘油三酯的主要合成场所[30],由于“水瘪子”蟹的肝胰腺已经发生病变(如肝胰腺中出现大量空泡,大量细胞坏死或脱落)[16],其吸收和储存营养物质的功能已部分或全部丧失[31],故“水瘪子”蟹组的肝胰腺指数、性腺指数和出肉率均低于正常蟹组,可见其可食用率极低。
甲壳动物色泽不仅会直接影响消费者接受度和产品价格,还对其生长、交配和信息交流等方面具有重要影响[32]。甲壳动物活体色泽通常与其类胡萝卜素组成、光照颜色及光周期等多种因素有关[33]。本研究中“水瘪子”雌蟹的亮度值 (L*) 和黄度值 (b*)显著高于正常雌蟹,但是这两组雌蟹甲壳中的类胡萝卜素含量和组成并无显著性差异,这可能因为“水瘪子”雌蟹易爬边、上岸且活力差,受到的光照时间及强度大于正常雌蟹,所以其L*值和b*值相对较高。无论雌蟹还是雄蟹,“水瘪子”蟹组肝胰腺湿样的L*值、a*值和b*值均低于正常蟹组,这是由于“水瘪子”蟹组肝胰腺中的β-胡萝卜素和叶黄素显著低于正常蟹;值得一提的是,“水瘪子”蟹肝胰腺外观呈现褐色或黄褐色,这可能是因为“水瘪子”蟹在环境或病原体胁迫条件下,肝胰腺和淋巴液中的酪氨酸经过多次氧化、脱羧和聚合等反应最终生产的黑色素物质[34]。究竟何种原因导致“水瘪子”蟹肝胰腺黑化尚有待进一步研究。
3.2 常规生化和脂肪酸组成
水产动物的营养价值评价常用可食组织的常规生化成分作为重要参考指标,高蛋白和低脂肪含量是水产品营养价值的重要优势[27]。本研究结果表明,“水瘪子”蟹组肝胰腺中的总脂含量仅为正常蟹组的10%左右,这是因为肝胰腺是中华绒螯蟹最主要的甘油三酯合成和储存场所[35],“水瘪子”蟹肝胰腺组织受到损伤或肝细胞坏死,其甘油三酯合成和储存能力较正常蟹显著下降,导致肝胰腺和卵巢中的总脂含量变低。本研究中,性腺和肌肉中蛋白质含量也比正常蟹低,说明肝胰腺损伤对性腺和肌肉的蛋白质合成和积累能力也存在较大影响。前期研究表明,“水瘪子” 蟹通常表现为“附肢发软少肉、肌肉萎缩、腹部和附肢肌肉有部分积液”[16],这与本研究中“水瘪子”蟹肌肉中水分含量较高的结果吻合。
甲壳动物肝胰腺中脂肪酸组成通常受其饵料和生理代谢水平的影响,且肝胰腺中的脂肪酸主要作为能量物质储存在甘油三酯中[36]。本研究结果表明,“水瘪子”蟹组肝胰腺中C16:1n7、C18:2n6和C18:3n3百分含量均低于正常蟹组,但其C20:2n6、C20:4n6、C20:5n3和C22:5n3百分含量高于正常蟹组,造成这种差异的可能原因如下:1) C16:1n7是重要的能量型脂肪酸,主要储存在肝胰腺的甘油三酯,正常蟹肝胰腺具有脂肪酸消化吸收、甘油三酯合成和储存功能,因此正常蟹肝胰腺中的甘油三酯和C16:1n7含量较高;2)正常蟹肝胰腺中的C18:2n6和C18:3n3百分含量较高,可能与其饵料富含这两种脂肪酸有关;3)“水瘪子”蟹的肝胰腺严重损伤,导致肝胰腺中的脂肪滴和甘油三酯含量显著下降[31]。因此“水瘪子”蟹肝胰腺中的磷脂相对含量较高,磷脂是肝胰腺细胞膜的主要组成部分,通常含有较高含量的C20:4n6、C20:5n3和C22:5n3才能保持细胞膜流动性;4)中华绒螯蟹具备将C18:2n6转化为C20:4n6的能力[37],C20:4n6 是合成前列腺素2(PGE2)的前体物质和炎症因子[38-39],“水瘪子”蟹肝胰腺具有一定的炎症反应,病蟹可能把肝胰腺中较多C18:2n6转化为C20:4n6,用于合成PGE2,故其肝胰腺中的C18:2n6百分含量相对较低,而C20:4n6含量相对较高。整体而言,“水瘪子”蟹和正常蟹性腺和肌肉中的大部分脂肪酸百分含量较为相似,这可能是因为中华绒螯蟹性腺和肌肉中的脂肪酸含量虽然受饵料影响,但是影响程度小于肝胰腺[37]。
4 结论
1)“水瘪子”蟹肝胰腺指数、性腺指数和出肉率均显著低于正常成蟹。
2)“水瘪子”蟹肝胰腺发生病变,导致其肝胰腺颜色异常,β-胡萝卜素和叶黄素显著低于正常蟹。
3)“水瘪子”蟹可食组织存在高水分、低蛋白质和脂肪酸组成不平衡的问题,营养价值较低,因此今后可围绕营养调控深入研究中华绒螯蟹“水瘪子”病的防治。
[1] 冯杨,黄小丽,汪开毓,等.中华绒螯蟹“水瘪子” 病的主要体征指标[J].水产学报,2020,44(5):858-869.
FENG Y,HUANG X L,WANG K Y,et al.Evaluation of the leading physical indicators of hepatopancreatic necrosis disease of Chinese mitten crab(Eriocheir sinensis)[J].Journal of Fisheries of China,2020,44(5):858-869.(in Chinese)
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2024中国渔业统计年鉴[M].北京:中国农业出版社,2024.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2024 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2024.(in Chinese)
[3] 方敏,金卫中,宋林生,等.中华绒螯蟹颤抖病组织病理学研究[J].海洋与湖沼,2003,34(3):322-328.
FANG M,JIN W Z,SONG L S,et al.Histopathological study on “appendage shivering disease” of Eriocheir sinensis[J].Oceanologia et Limnologia Sinica,2003,34(3):322-328.(in Chinese)
[4] 宋学宏,朱茂晓,王永玲,等.中华绒螯蟹肝胰腺白化症组织病理变化[J].水产学报,2007,31(2): 257-263.
SONG X H,ZHU M X,WANG Y L,et al.The histopathological changes in tissues of Eriocheir sinensis with hepatopancreas albinism[J].Journal of Fisheries of China,2007,31(2):257-263.(in Chinese)
[5] 刘力硕,杨宗英,张一柳,等.2016年河蟹“水瘪子” 疫情及病理研究进展[J].科学养鱼,2017(4):61-62.
LIU L S,YANG Z Y,ZHANG Y L,et al.Research progress on the epidemic situation and pathology of Eriocheir sinensis in 2016[J].Scientific Fish Farming,2017(4):61-62.(in Chinese)
[6] 杨宗英,曾柳根,王玉兰,等.中华绒螯蟹“水瘪子” 病超微病理和病理生理研究[J].浙江农业学报,2018,30(7):1137-1148.
YANG Z Y,ZENG L G,WANG Y L,et al.Ultramicroscopical histopathology and pathophysiology of “Shuibiezi” disease of Eriocheir sinensis[J].Acta Agriculturae Zhejiangensis,2018,30(7):1137-1148.(in Chinese)
[7] 杨宗英,张一柳,刘力硕,等.2015—2016年河蟹“水瘪子” 病发病情况[J].科学养鱼,2016(10):54-55.
YANG Z Y,ZHANG Y L,LIU L S,et al.Incidence of Eriocheir sinensis “water shrimp” disease in 2015-2016[J].Scientific Fish Farming,2016(10):54-55.(in Chinese)
[8] 刘力硕.中华绒螯蟹肝胰腺坏死症病因筛查及阿维菌素诱导致病可能性机制分析的研究[D].上海:上海海洋大学,2019.
LIU L S.Study on etiological screening of hepatopancreatic necrosis in Eriocheir sinensis and mechanism analysis of avermectin-induced pathogenicity[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[9] 朱健明,王志,蔡春芳,等.中华绒螯蟹“水瘪子” 的诱因及防治技术[J].科学养鱼,2016(6):13-14.
ZHU J M,WANG Z,CAI C F,et al.Causes and control techniques of “water shrinkage” of Eriocheir sinensis[J].Scientific Fish Farming,2016(6):13-14.(in Chinese)
[10] 龚志,蔡春芳,朱健明,等.高pH值对中华绒螯蟹抗氧化能力及虾青素沉积的影响[J].淡水渔业,2015,45(1):20-24.
GONG Z,CAI C F,ZHU J M,et al.Effects of high pH on antioxidant capacity and astaxanthin content in Eriocheir sinensis[J].Freshwater Fisheries,2015,45(1):20-24.(in Chinese)
[11] 宋学宏,杨彩根,程建新,等.不同营养供给模式对中华绒螯蟹生长及肝胰腺白化症发病率的影响[J].水产学报,2007,31(4):496-503.
SONG X H,YANG C G,CHENG J X,et al.Effects of different feeding models on growth of Chinese mitten crabs and their relation to its incidence of hepatopancreas albinism[J].Journal of Fisheries of China,2007,31(4):496-503.(in Chinese)
[12] SONG X H,YANG C G,TANG J,et al.A combination of vitamins C and E alleviates oxidized fish oil-induced hepatopancreatic injury in juvenile Chinese mitten crab Eriocheir sinensis[J].Aquaculture Research,2019,50(6):1585-1598.
[13] DING Z,MENG Q,LIU H,et al.First case of hepatopancreatic necrosis disease in pond-reared Chinese mitten crab,Eriocheir sinensis,associated with microsporidian[J].Journal of Fish Diseases,2016,39(9):1043-1051.
[14] 崔龙波,唐绍林,戚瑞荣,等.河蟹(Eriocheir sinensis)“水瘪子” 病的病理学研究[J].烟台大学学报(自然科学与工程版),2017,30(4):313-316.
CUI L B,TANG S L,QI R R,et al.Pathologicalstudy on “shuibiezi” disease of crab Eriocheir sinensis[J].Journal of Yantai University (Natural Science and Engineering Edition),2017,30(4):313-316.(in Chinese)
[15] SHEN H S,ZANG Y N,SONG K,et al.A meta-transcriptomics survey reveals changes in the microbiota of the Chinese mitten crab Eriocheir sinensis infected with hepatopancreatic necrosis disease[J].Frontiers in Microbiology,2017,8:732.
[16] 杨宗英,张一柳,胡鲲,等.中华绒螯蟹肝胰腺坏死综合症病原及病理学研究[J].水生生物学报,2018,42(1):17-25.
YANG Z Y,ZHANG Y L,HU K,et al.Etiological and histopathological study on hepatopancreatic necrosis syndrome in Eriocheir sinensis[J].Acta Hydrobiologica Sinica,2018,42(1):17-25.(in Chinese)
[17] 陆宏达,田全全,贾相相,等.中华绒螯蟹水瘪子病不同发病阶段的病理变化特点[J].水生生物学报,2017,41(6):1242-1250.
LU H D,TIAN Q Q,JIA X X,et al.Pathological changes of Shui-Bie-zi diseased Chinese mitten crab Eriocheir sinensis in the different stages of disease[J].Acta Hydrobiologica Sinica,2017,41(6):1242-1250.(in Chinese)
[18] WU X G,ZHAO L,LONG X W,et al.Effects of dietary supplementation of Haematococcus pluvialis powder on gonadal development,coloration and antioxidant capacity of adult male Chinese mitten crab (Eriocheir sinensis)[J].Aquaculture Research,2017,48(10):5214-5223.
[19] International Commission on Illumination (CIE) .CIE 15.3:2004[S]. 3rd ed.Vienna:Commission Internationale De L'eclairage Cie Central Bureau,2004:16-18.
[20] LONG X W,WU X G,ZHAO L,et al.Effects of dietary supplementation with Haematococcus pluvialis cell powder on coloration,ovarian development and antioxidation capacity of adult female Chinese mitten crab,Eriocheir sinensis[J].Aquaculture,2017,473:545-553.
[21] 李清清.中华绒螯蟹色泽遗传参数评估及色泽形成机制研究[D].上海:上海海洋大学,2019.
LI Q Q.Evaluation of genetic parameters of color and study on color formation mechanism of Eriocheir sinensis[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[22] 孙伟红,邢丽红,冷凯良,等.高效液相色谱法测定南极磷虾及其制品中虾青素的含量[J].食品安全质量检测学报,2017,8(4):1248-1253.
SUN W H,XING L H,LENG K L,et al.Determination of astaxanthin in Antarctic krill and its products by high performance liquid chromatography[J].Journal of Food Safety& Quality,2017,8(4):1248-1253.(in Chinese)
[23] SAHIN S,KARABEY Y,KAYNAK M S,et al.Potential use of freeze-drying technique for estimation of tissue water content[J].Methods and Findings in Experimental and Clinical Pharmacology,2006,28(4):211-215.
[24] AOAC. Official methods of analysis of the Association of official analytical chemists international[M]. 16th ed. Arlington: Association of Official Analytical Chemists, 1995: 1298.
[25] FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Biological Chemistry,1957,226(1):497-509.
[26] MORRISON W R,SMITH L M.Preparation of fatty acid methyl esters and dimethylacetals from lipids with boron fluoride-methanol[J].Journal of Lipid Research,1964,5(4):600-608.
[27] ZHANG D D,JIANG X D,ZU L,et al.A comparative evaluation of the nutritional quality of three wild populations of female mitten crabs (Eriocheir sensu stricto) in northern China[J].Crustaceana,94(3):309-324.
[28] 刘晓辰,侯鑫,张振,等.向阳湖中华绒螯蟹越冬前后品质及肠道菌群差异分析[J].大连海洋大学学报,2024,39(5):811-818.
LIU X C,HOU X,ZHANG Z,et al.Nutrient quality and gut microbiota of Chinese mitten handed crab (Eriocheir sinensis) in Xiangyang Lake before and after overwintering[J].Journal of Dalian Ocean University,2024,39(5):811-818.(in Chinese)
[29] CHANG GL,PAN J,ZHANG Q Q,et al.Biochemical composition of the hepatopancreas from the Chinese mitten crab Eriocheir sinensis with different signs of hepatopancreatic necrosis disease (Brachyura,Varunidae)[J].Crustaceana,95(8/9):985-1004.
[30] ZHU W L,GUO Q,CHENG Y X,et al.Identification and functional expression of two subtypes of glycerol-3-phosphate acyltransferase differently regulating triacylglyceride synthesis during ovary development in Chinese mitten crab,Eriocheir sinensis[J].Journal of Experimental Zoology Part A:Ecological and Integrative Physiology,2019,331(9):494-505.
[31] 常国亮,成永旭,吴旭干,等.中华绒螯蟹白化症、正常肝胰腺组织结构及脂肪酸组成的比较研究[J].水生生物学报,2008,32(5):687-693.
CHANG G L,CHENG Y X,WU X G,et al.Comparative studies ofmicro-ultrastructure and fatty acid composition of normal and albino hepatopancreas of Chinese mitten crab Eriocheir sinensis[J].Acta Hydrobiologica Sinica,2008,32(5):687-693.(in Chinese)
[32] BALDWIN J,JOHNSEN S.The male blue crab,Callinectes sapidus,uses both chromatic and achromatic cues during mate choice[J].Journal of Experimental Biology,2012,215(7):1184-1191.
[33] MELVILLE-SMITH R,CHENG Y W,THOMSON A W.Factors affecting colour change in “white” western rock lobsters,Panulirus cygnus[J].Journal of Experimental Marine Biology and Ecology,2003,291(1):111-129.
[34] FU LL,GAO T H,JIANG H C,et al.Staphylococcus aureus causes hepatopancreas browned disease and hepatopancreatic necrosis complications in Chinese mitten crab,Eriocheir sinensis[J].Aquaculture International,2019,27(5):1301-1314.
[35] LI Z,ZHANG G B,PAN K W,et al.Functional transcriptome reveals hepatopancreatic lipid metabolism during the molting cycle of the Chinese mitten crab Eriocheir sinensis[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2023,284:111474.
[36] 成永旭,堵南山,赖伟.不同阶段中华绒螯蟹肝胰腺的脂类及脂肪酸组成[J].动物学报,1998,44(4):420-429.
CHENG Y X,DU N S,LAI W.Lipid composition in hepatopancreas of Chinese mitten crab Eriocheir sinensis at different stages[J].Current Zoology,1998,44(4):420-429.(in Chinese)
[37] WU X,CHANG G,CHENG Y,et al.Effects of dietary phospholipid and highly unsaturated fatty acid on the gonadal development,tissue proximate composition,lipid class and fatty acid composition of precocious Chinese mitten crab,Eriocheir sinensis[J].Aquaculture Nutrition,2010,16(1):25-36.
[38] YANG H,CHEN X L,LI Z,et al.Genome-wideanalysis indicates a complete prostaglandin pathway from synthesis to inactivation in Pacific white shrimp,Litopenaeus vannamei[J].International Journal of Molecular Sciences,2022,23(3):1654.
[39] CAO Y,PEARMAN A T,ZIMMERMAN G A,et al.Intracellular unesterified arachidonic acid signals apoptosis[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(21):11280-11285.