凡纳滨对虾(Litopenaeus vannamei)作为全球重要的水产养殖品种,因其营养价值高、生长速度快和适应能力强等特点,被广泛养殖,具有重要的经济价值[1]。随着养殖技术的提高,凡纳滨对虾养殖逐渐向高密度、集约化模式发展。目前,工厂化养殖凡纳滨对虾作为饲料驱动高密度养殖的代表,饲料中一般需要保证较高水平的优质蛋白质以满足其快速生长需要[2]。相比之下,糖类物质价格相对低廉,适当提高饲料中糖的比例可以起到节约蛋白质的作用,从而降低饲料成本,同时减少氨、氮的排放,减轻水体污染[3]。凡纳滨对虾对糖的需求量占饲料摄入量的10%~20%,摄入过量会导致凡纳滨对虾出现生长缓慢、脂肪沉积等情况[4-5]。为了缓解高糖饲料对水产动物的负面影响,一些具有显著促生长作用且可提高糖类物质利用的饲料添加剂受到广泛关注[6-7]。
β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate,HMB)是L-亮氨酸在动物体内代谢的中间产物。HMB具有多种有益作用,包括提高生长性能、促进蛋白质合成、抑制脂肪沉积、提高肌肉品质等[8-11]。在水产动物中,饲料中添加0.1% HMB时显著增加大菱鲆(Scophthalmus maximus L.)[12]和大黄鱼(Larimichthys crocea)[13]的增重率和特定增长率,且未显著影响其存活率。除此之外,HMB还具有改善水产动物肌肉品质的作用。饲料中添加适量的HMB能够提高日本囊对虾(Marsupenaeus japonicas)肌肉硬度和持水力[14],在大黄鱼中也有相似的研究结果[13]。在畜禽动物中,HMB通过调节肠道菌群和激活AMPKα通路,可抑制脂肪酸合成,促进脂肪分解和脂肪酸氧化,减少动物脂肪沉积[10]。显然,HMB对许多动物的生长代谢具有调控作用,然而,目前其在甲壳动物中的研究却鲜有报道。
鉴于HMB在水产和畜禽动物研究中的积极作用,推测在高糖饲料中添加适量的HMB可能会减轻高糖饲料对凡纳滨对虾生长代谢造成的不利影响,并提升其肌肉品质。本试验中以凡纳滨对虾为研究对象,探究了高糖饲料中添加HMB对凡纳滨对虾生长、糖脂代谢及肌肉品质的影响,以期为HMB对甲壳动物的生理作用提供有益参考,并推动凡纳滨对虾功能性饲料的开发。
1 材料与方法
1.1 材料
试验用凡纳滨对虾购自天津立达海水资源开发有限公司。选取初始体质量为(0.28±0.01)g的凡纳滨对虾为试验对象。
1.2 方法
1.2.1 试验饲料 以鱼粉、豆粕和血粉为主要蛋白质来源,小麦淀粉为主要糖源,鱼油和豆油为主要脂肪源,配制蛋白质含量为35%、无氮浸出物含量为30%和脂肪含量为8%的高糖基础饲料;高糖基础饲料中分别添加0、0.25、0.5、1、2、4 g/kg的β-羟基-β-甲基丁酸钙(纯度≥97%,上海源业生物技术有限公司),配置成6种等氮和等脂高糖试验饲料,分别命名为HMB0、HMB0.25、HMB0.5、HMB1、HMB2和HMB4。饲料所用原料用粉碎机粉碎后过180 μm网筛,根据表1配方混合均匀,用双螺杆压条机(F-26,华南理工大学科技实业总厂,广东)挤压成直径为1.2 mm的饲料,出料温度控制为70 ℃,切碎后于恒温干燥箱中60 ℃熟化30 min,冷却后封装保存于-20 ℃冰箱中备用。试验饲料配方营养成分见表1。
表1 试验饲料组成及营养水平(风干基础)
Tab.1 Composition and nutrient levels of experimental diets (air-dry matter) %

组别 group HMB0 HMB0.25 HMB0.5 HMB1 HMB2 HMB4 鱼粉fishmeal 230 230 230 230 230 230 豆粕 soybeanmeal 150 150 150 150 150 150 血粉 bloodmeal 120 120 120 120 120 120 小麦淀粉 wheatmeal 325 325 325 325 325 325 豆油 soybeanoil 25 25 25 25 25 25 鱼油fishoil 25 25 25 25 25 25 卵磷脂lecithinoil 10 10 10 10 10 10 胆碱 cholinechloride 10 10 10 10 10 10 磷酸二氢钙 Ca(H2PO4)2 20 20 20 20 20 20 VC磷酸酯 VitaminCphosphateester 10 10 10 10 10 10 黏合剂 adhesive 20 20 20 20 20 20 预混料 premix* 20 20 20 20 20 20 微晶纤维 cellulose 35 34.75 34.50 34 33 31 β-羟基-β-甲基丁酸钙 CaHMB 0 0.25 0.50 1 2 4 合计total 1000 1000 1000 1000 1000 1000 营养水平 nutrientlevel 水分 moisture 5.31 5.86 5.57 5.64 5.38 6.05 粗脂肪 EE 8.21 8.1 8.1 8.21 8.3 8.21 粗蛋白质 CP 35.70 35.60 35.40 35.40 35.60 35.21 无氮浸出物 NFE 30.25 30.13 30.13 30.17 30.21 30.11 粗灰分 ash 13.76 13.7 13.79 13.68 13.06 13.28
注:预混料为每千克饲料提供VA 10 mg,VB1 6 mg,VB2 5 mg,VB6 7.5 mg,VB12 4 mg,烟酰胺50 mg,抗坏血酸500 mg,泛酸钙20 mg,生物素2.5 mg,叶酸5 mg,VE 200 mg,VK3 10 mg,VD3 5 mg,肌醇100 mg,玉米麸粉75 mg,五水硫酸铜 10 mg,一水硫酸亚铁 300 mg,一水硫酸锌 200 mg,一水硫酸锰 100 mg,碘酸钾80 mg,亚硒酸钠 67 mg,六水氯化钴5 mg,沸石638 mg。
Note:The premix provided the following per kg of diets,VA 10 mg,VB1 6 mg,VB2 5 mg,VB6 7.5 mg,VB12 4 mg,niacinamide 50 mg,ascorbic acid 500 mg,calcium pantothenate 20 mg,biotin 2.5 mg,folic acid 5 mg,VE 200 mg,VK3 10 mg,VD3 5 mg,inositol 100 mg,corn gluten meal 75 mg,CuSO4·5H2O 10 mg,FeSO4·H2O 300 mg,ZnSO4·H2O 200 mg,MnSO4·H2O 100 mg,KIO3 80 mg,Na2SeO3 67 mg,CoCl2·6H2O 5 mg,zeolite 638 mg.
1.2.2 试验动物与饲养管理 试验严格遵循有关试验动物管理及使用国家标准,并通过河北农业大学实验动物伦理委员会的审查,批准编号为2022090。将购买的同一批次的虾苗暂养于河北农业大学海洋学院育苗基地,使用过滤除菌后盐度为30±1的天然海水,暂养2周,期间投喂基础饲料,使其完全适应养殖环境。随后,将虾苗禁食24 h,随机选取平均体质量为(0.28±0.01)g的健康虾苗720 尾,以40 尾/缸均匀分配至18个玻璃缸(0.4 m×0.5 m×0.6 m,100 L),并进行为期8周的养殖试验。试验期间,每2周进行称重,根据对虾体质量6%~8%的日投喂量,每天定时投喂4次(07:00、11:00、15:00和19:00),24 h持续充氧、每天更换1/3~1/2的新鲜海水,并测定每天pH、温度和溶解氧,每周测定氨氮和亚硝酸盐含量等指标。试验期间,温度保持在26 ℃左右,溶解氧含量为(7.3±0.5)mg/L,pH为 8.0~8.5,氨氮含量为(0.6±0.1)mg/L,亚硝酸盐含量低于0.1 mg/L。
1.2.3 样品采集与处理 8周养殖试验结束,禁食24 h后用丁香酚(50 mg/L)麻醉,将每缸中的凡纳滨对虾称重并统计数量。每缸随机选择12尾凡纳滨对虾,测定体长、体质量,并用1 mL无菌注射器采集血淋巴,4 ℃静置过夜,以3 000 r/min离心10 min,分离上层血清保存在-20 ℃待测。采血后解剖,收集肝胰腺和肌肉组织,保存于-80 ℃待进一步分析。另取10 mg肌肉和肝胰腺组织,提取总RNA,用于检测基因mRNA的表达。每缸再随机取3尾凡纳滨对虾,麻醉后解剖,收集新鲜肌肉组织,用于分析肌肉的硬度、内聚性和弹性等指标。每个试验缸另取6尾凡纳滨对虾,用于全虾体成分分析。
1.2.4 饲料和虾体营养成分 饲料和对虾的营养成分按照以下方法测定:采用105 ℃恒重法测定(GB/T 6435—2014)水分,采用微量凯氏定氮法(GB/T 6432—2018)测定粗蛋白质;采用索氏抽提法(GB/T 6433—2018)测定粗脂肪;采用马弗炉灰化法(550 ℃)(GB/T 6438—2007)测定粗灰分;无氨浸出物=(100%-水分%-粗蛋白质%-粗脂肪%-粗灰分%-粗纤维%)。
1.2.5 生长性能 凡纳滨对虾的增重率(weight gain rate,WGR,%)、饲料系数(feed conversion ratio,FCR)、特定生长率(specific growth rate,SGR,%/d)、肝体比(hepatopancreas somatic index,HSI,%)、出肉率(meat percentage,MR,%)和存活率(survival rate,SR,%)计算公式为
(1)
(2)
RSGR=![]() ×100%,
×100%,
(3)
(4)
(5)
(6)
1.2.6 肌肉结构分析 每个试验缸随机选择3尾凡纳滨对虾,采集第一胸节位置的新鲜肌肉组织,切成大小均匀的1 cm3组织块,利用质构分析仪(TMS-Pro,FTC,VA,USA)进行肉质测定。测量选择5 mm圆柱探头,条件设置为双压缩循环试验,参数设置恒定速度为30 mm/min,原厚度变形量60%,初始力为0.1 N。每个平行的所有测量结果取平均值后用于数据统计分析。
1.2.7 代谢物和代谢酶活分析 血清中的甘油三酯、总胆固醇、葡萄糖、高密度脂蛋白质和低密度脂蛋白质含量,肝胰腺中的磷酸果糖激酶(phosphofructokinase,PFK)、己糖激酶(hexokinase,HK)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxylase kinase,PEPCK)活性和甘油三酯、糖原含量均采用南京建成生物工程研究所试剂盒进行测定。肝胰腺中的6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6PGD)、葡萄糖6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)、异柠檬酸脱氢酶(isocitrate dehydrogenase,ICDH)和苹果酸脱氢酶(malic enzyme,ME)活性根据文献[15]中报道的方法测定。肌肉中的羟脯氨酸(Hyp)含量采用南京建成生物工程研究所试剂盒测定,总胶原含量通过Hyp含量进行计算获得。
1.2.8 基因表达检测 采用Trizol试剂(Thermo Fisher Scientific,USA)提取总RNA,经琼脂糖凝胶电泳和超微量紫外分光光度计(Nanodrop 2000,Thermo Fisher Scientific,USA)检测其完整性和浓度。然后取1 μL RNA,使用Hifair® Ⅱ Q RT SuperMix for qPCR将其逆转录为cDNA。肝胰腺中以EF1-α和18S rRNA为内参基因,肌肉中以TBP和18S rRNA为内参基因,利用合成的引物序列(生工生物工程(上海)股份有限公司)(表2)进行实时定量PCR。qPCR检测方法是将0.1 μL逆转录合成的cDNA用3.6 μL的无菌水稀释后,加入上下游引物各0.2 μL和5 μL的2×SYBR Premix Ex TaqTM Ⅱ(Vazyme Biotech),混匀后于荧光定量PCR仪(CFX 96 Touch,Bio-Rad,USA)中检测基因mRNA的表达。qPCR反应条件:95 ℃下预变性10 min;95 ℃下变性5 s,60 ℃下退火15 s,共进行40个循环,每个循环均采集荧光信号。qPCR结果使用2-ΔΔCt 法计算,目标基因和内参基因的扩增效率为98%~102%。
表2 实时荧光定量PCR引物序列
Tab.2 Primer sequence used in qPCR analysis

基因名称 genename 引物序列 (5'-3') primersequences (5'-3') NCBI序列号 NCBIaccessionNo. 18SrRNA F:TAAATCGGCGCAATCTGGTG R:TTGGGGCTTGCAAATGTTCC AF186250.1 ef1α F:ACATTTCCATCGTGGTGGTG R:TGCCACCGCATTTGTAGATG GU136229.1 tbp F:GACAACAAGGAGTGGTTTG- GAG R: AGGAGCACACCACATTGT- TG XM _027352221.1 pk F:ATGCTGTCTGGTGAAACTGC R:AGCTTCACGTGCAATGTTGG XM _027381853.1 hk F: GCAATTGCAAAGAGAGGG- GATG R: AGCAAGCATTTGTGC- CAGTG XM _027356090.1 g6pc F:TTCAGGCAAGCTTTCCGAAG R: AAGGGCAAGGCAACGTTA- AG XM _027351517.1 pepck F:ACAACACCGCCAACAATCTG R: AAAGTTTGCCATGGGT- GACG XM _027371589.1 fbp F:AAACTGCTGTCAAGGCCATC R: AAAAGGTCATTGGCCAG- CAC KP057246.1 gsk-3β F:TGTTGTGTTCCAAGCCAAGC R:AAGCGTTTGTCCTGAAGCAC XM _027362481.1 srebp-1 F:ACAGCAAACCACAGCCATTC R:TGTCTGTGGCTGCAATTGAC XM _027382974.1 fas F:TTTGTTTGCCGAAGCCCTTG R: AGGATGGCTTGCAA- CAAACC HM595630.1 acc1 F:TTTGTTGGGCAGGCATATGC R:TCGCCAGCATTGAGAATTGC XM _027360190.1 hsl F:TGACATTTTGGAGCGCCTTC R:AGCCTTGCAATGTGTGTTCG XM _027370379.1 foxo1 F:AAACCCTGCAGACTTCAAGC R: ACATTGGCGAGGT- GTTTTCG XM _027360438.1 cpt-1 F:AGTTTTCGCGGCCTATGTTG R: AGAGCCAAATTCTGCAT- GCG XM _027361886.1 akt F: AAACCGAGTGTTG- CAAAGGG R: ACAGGCGGTCATTTGTTT- GG KF163129.1 pi3k F:ACCGTTTATTGCGTCGTGAG R:CGAACTGCACAAATCCATGC XM _027359988.1 mtor F:TTGAACATGCGCTCGAACAC R: AGTTTGTACGGCGGT- CAAAC XM _027372359.1 s6k1 F:TGTGAACCGCCTTTCAAACC R: AACAACTGGTGAGCATTG- GC XM _027359033.1 eif4e2 F:ACAAACCACTGCCACAAGTG R:TGTGTTGTTGCCTGTTTGCC XM _027354394.1 myhc F:TCCGCCGTGAAAACAAGAAC R:TGCAACTCTTTTGGGCTTCG XM _027383150.1 mylc F: TCCAAGAAGGC- CAAGAAGACG R: ATCTGGAAGCCCTCCTT- GAAC XM _027376218.1 tnnc F: TGGAATTCAGGAGT- TCGTCGAG R: ATAACGAAAAGCCTCCCCT- GAG XM _027381668.1 tpm1 F: AAAGGCCTTGCAGAAT- AGCG R:TTCAGCAAGGATTCCTGCAC XM _027373345.1 tgf-β F: TGCCCAGGTG- CAAGAAAATG R: GGCCTCTTTCTCTGCT- TCAAAC XM _027353723.1
1.3 数据处理
所有数据采用平均值±标准误(mean±S.E.)表示,采用SPSS Statistics软件(Version 18.0,IBM,USA)进行分析,根据Dun-can’s法多重比较进行组间差异分析,通过单因素方差分析(ANOVA)检测各组之间差异性,显著性水平设为0.05。
2 结果与分析
2.1 高糖饲料添加HMB对凡纳滨对虾生长性能的影响
从表3可知,各组之间凡纳滨对虾的SR无显著性差异(P>0.05)。随着高糖饲料中HMB水平的升高,凡纳滨对虾的WGR、SGR和MR显著升高,当HMB添加量为1~4 g/kg时,凡纳滨对虾的WGR、SGR和MR显著高于HMB0组(P<0.05)。同时,随着高糖饲料中HMB水平的升高,FCR逐渐降低;当HMB添加量为0.5~4 g/kg时,凡纳滨对虾的FCR显著低于HMB0组(P<0.05)。当HMB添加量为0.25 g/kg时,凡纳滨对虾的HSI显著低于其他组。根据增重率和饲料系数的二次曲线回归分析可知,最适的HMB添加水平分别为2.58、2.71 g/kg (图1和图2)。
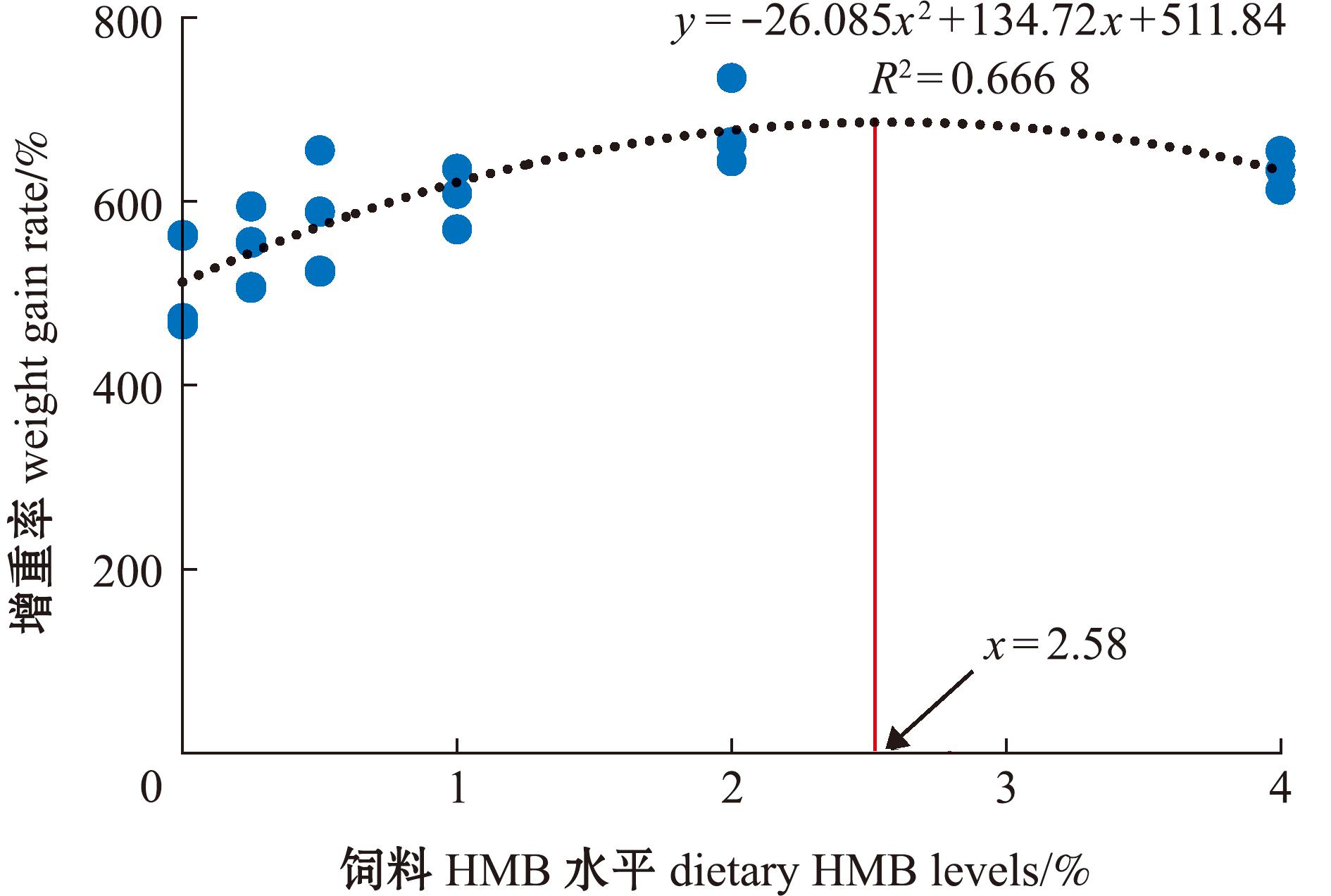
图1 高糖饲料HMB添加水平对凡纳滨对虾增重率的回归计算分析
Fig.1 Regression analysis of HMB level in high-carbohydrate diet on the weight gain rate of Litopenaeus vannamei
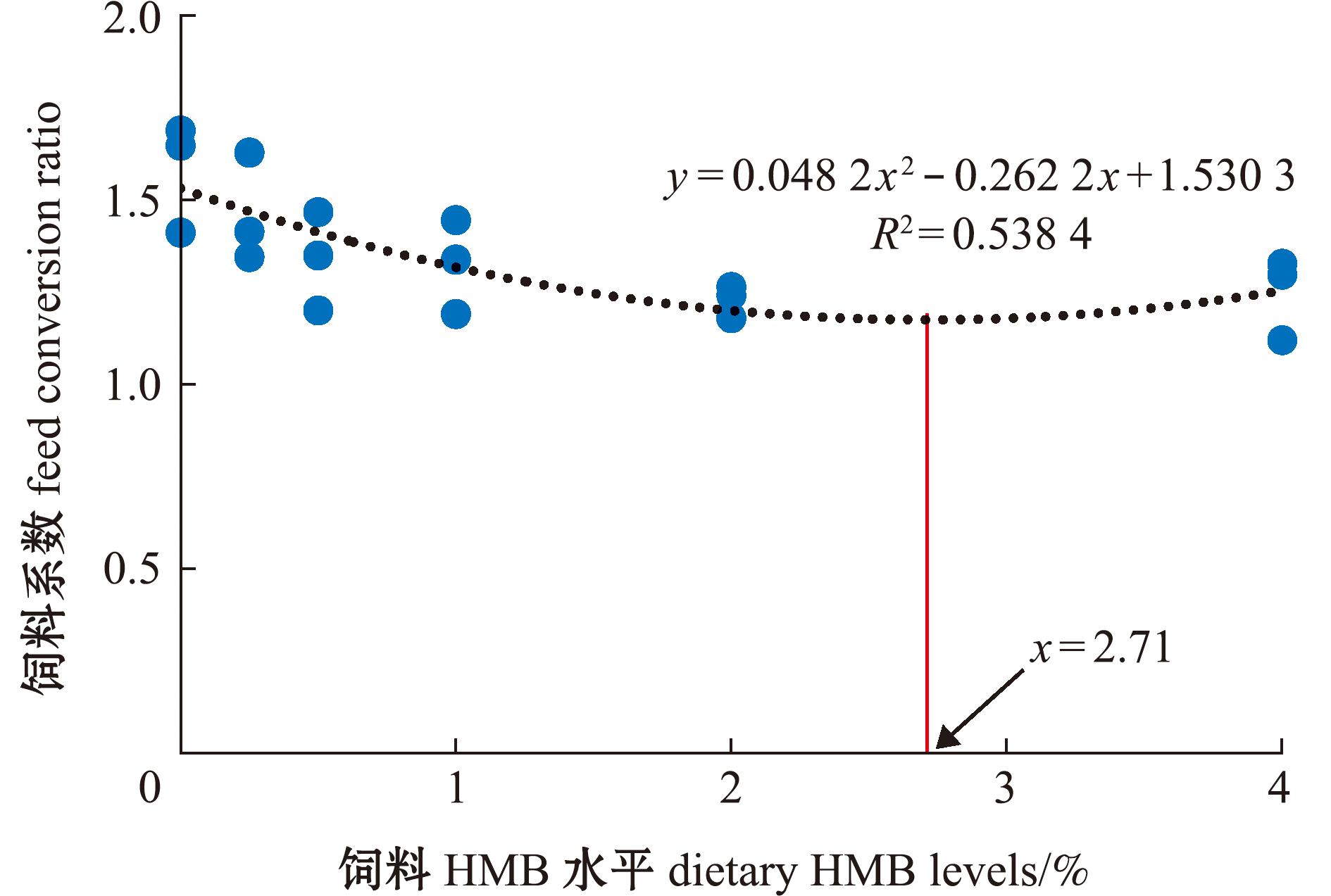
图2 高糖饲料HMB添加水平对凡纳滨对虾饲料系数的回归计算分析
Fig.2 Regression analysis of HMB level in high-carbohydrate diet on feed coefficient of Litopenaeus vannamei
表3 添加HMB后凡纳滨对虾的生长性能
Tab.3 Growth performance of Litopenaeus vannamei fed with diets with HMB additives

组别 group 初始体质量/g IBW 终末体质量/g FBW 增重率/% WGR 特定生长率/ (%·d-1) SGR 饲料系数 FCR 肝体比/% HSI 出肉率/% MR 存活率/% SR HMB0 0.29±0.01 1.72±0.08a 500.29±31.51a 3.19±0.09a 1.58±0.08b 5.02±0.16b 33.67±2.96a 80.00±1.44 HMB0.25 0.28±0.01 1.83±0.09a 552.02±25.32ab 3.35±0.07ab 1.46±0.08ab 3.81±0.11a 35.57±0.83ab 82.50±1.44 HMB0.5 0.29±0.01 2.00±0.09ab 589.41±37.45abc 3.44±0.10abc 1.33±0.07a 4.75±0.23b 38.64±1.28bc 80.83±0.83 HMB1 0.28±0.01 1.99±0.08ab 604.18±19.09bc 3.48±0.05bc 1.32±0.07a 4.42±0.28ab 38.86±0.96bc 80.83±3.00 HMB2 0.28±0.01 2.20±0.08b 679.93±27.54c 3.67±0.06c 1.22±0.02a 4.47±0.40ab 40.47±1.12c 82.50±3.82 HMB4 0.29±0.01 2.12±0.01b 633.35±21.04bc 3.56±0.05bc 1.24±0.06a 4.95±0.05b 42.45±1.25c 82.50±1.44
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significant differences (P<0.05),while the means with the same letters within the same column are not significant differences (P>0.05),et sequentia.
2.2 高糖饲料添加HMB对凡纳滨对虾体成分和肌肉组成的影响
对虾体成分的变化见表4。在本试验中,各组凡纳滨对虾的全虾及肌肉水分无显著性差异(P>0.05)。随着高糖饲料中HMB添加水平的升高,凡纳滨对虾全虾的粗蛋白质含量逐渐升高,粗灰分含量逐渐降低,当HMB添加量为0.5~4 g/kg时,全虾粗蛋白质含量显著高于HMB0组(P<0.05);当HMB添加量为1~4 g/kg时,全虾粗灰分含量显著低于HMB0组(P<0.05);全虾粗脂肪含量呈先下降后升高的趋势,当HMB为1 g/kg时,全虾粗脂肪含量最低(P<0.05)。
表4 添加HMB后凡纳滨对虾的体成分
Tab.4 Body composition of Litopenaeus vannamei fed with diets with HMB additives %

组别 group 水分 moisture 粗蛋白质 crudeprotein 粗脂肪 crudelipid 粗灰分 crudeash HMB0 78.11±1.34 72.99±0.24a 5.23±0.35c 18.56±0.15d HMB0.25 77.73±0.53 72.45±0.17a 5.06±0.40c 17.63±0.16bc HMB0.5 77.88±0.41 75.74±0.78b 5.16±0.35c 18.03±0.37cd HMB1 79.26±0.94 76.08±0.35b 2.95±0.09a 17.68±0.25bc HMB2 77.78±0.62 77.46±1.51b 4.16±0.26b 16.91±0.03ab HMB4 78.16±1.22 76.37±0.23b 4.10±0.13b 16.37±0.40a
对虾肌肉近似组成的变化见表5。随着高糖饲料中HMB水平的升高,凡纳滨对虾肌肉的粗蛋白质含量呈先升高后降低的趋势,粗脂肪含量逐渐降低;当饲料中HMB添加量为1~4 g/kg时,凡纳滨对虾肌肉粗蛋白质含量显著高于HMB0组(P<0.05);HMB添加量为2~4 g/kg时,凡纳滨对虾肌肉粗脂肪含量显著低于HMB0组(P<0.05)。
表5 添加HMB后凡纳滨对虾的肌肉组成
Tab.5 Muscle composition of Litopenaeus vannamei fed with diets with HMB additives %

组别 group 水分 moisture 粗蛋白质 crudeprotein 粗脂肪 crudelipid HMB0 76.79±0.44 89.43±0.44a 2.64±0.18b HMB0.25 76.74±0.33 90.36±0.16ab 2.66±0.15b HMB0.5 76.22±0.41 90.34±0.51ab 2.46±0.16b HMB1 77.38±0.32 92.47±0.25c 2.22±0.12b HMB2 76.20±0.52 93.72±0.37d 1.63±0.14a HMB4 76.72±0.73 91.32±0.43bc 1.68±0.19a
2.3 高糖饲料添加HMB对凡纳滨对虾肌肉品质和相关基因表达的影响
从表6可知,随着高糖饲料中HMB添加水平的升高,凡纳滨对虾肌肉的硬度、内聚性、弹性和咀嚼性逐渐升高,当HMB添加量为1~2 g/kg时,肌肉硬度显著高于HMB0组(P<0.05);当HMB添加量为0.25~4 g/kg时,肌肉内聚性和弹性显著高于HMB0组(P>0.05);当HMB添加量为1~4 g/kg时,肌肉咀嚼性显著高于HMB0组(P<0.05)。随着高糖饲料中HMB水平的升高,凡纳滨对虾肌肉羟脯氨酸和胶原蛋白质的含量逐渐升高,当高糖饲料中HMB添加量为0.5~4 g/kg时,凡纳滨对虾肌肉羟脯氨酸和胶原蛋白质含量显著高于HMB0组(P<0.05)。
表6 添加HMB后凡纳滨对虾的肉质品质
Tab.6 Meat quality of Litopenaeus vannamei fed with diets with HMB additives

组别 group 硬度/gf hardness 内聚性/% cohesiveness 弹性/mm springiness 咀嚼性/mJ chewiness 羟脯氨酸/ (μg·mg-1) hydroxyproline 胶原蛋白/ (μg·mg-1) collagenprotein HMB0 990.08±51.44ab 0.12±0.01a 0.23±0.01a 0.27±0.03a 0.23±0.01a 1.87±0.07a HMB0.25 994.00±37.52ab 0.14±0.01b 0.26±0.01b 0.35±0.02ab 0.23±0.01a 1.88±0.04a HMB0.5 975.42±19.66a 0.14±0.01b 0.27±0.01b 0.36±0.01ab 0.47±0.04c 3.78±0.32bc HMB1 1115.15±16.98cd 0.16±0.01bc 0.36±0.01c 0.61±0.02c 0.56±0.01d 4.51±0.08cd HMB2 1189.44±20.04d 0.15±0.01bc 0.38±0.01c 0.64±0.01c 0.56±0.03d 4.50±0.22cd HMB4 1073.49±17.74bc 0.16±0.01c 0.37±0.01c 0.68±0.01c 0.63±0.01d 5.02±0.06d
从图3(a)可见,随着高糖饲料中HMB水平的升高,myhc、mylc、tnnc、tpm1基因的mRNA表达水平呈先上升后下降的趋势,当HMB添加量为2~4 g/kg时,myhc基因的mRNA表达水平显著高于HMB0组(P<0.05);当HMB添加量在0.25~4 g/kg时,mylc基因的mRNA表达水平显著高于HMB0组;当HMB添加量在0.25~2 g/kg时, tnnc和tpm1基因的mRNA表达水平显著高于HMB0组(P<0.05)。
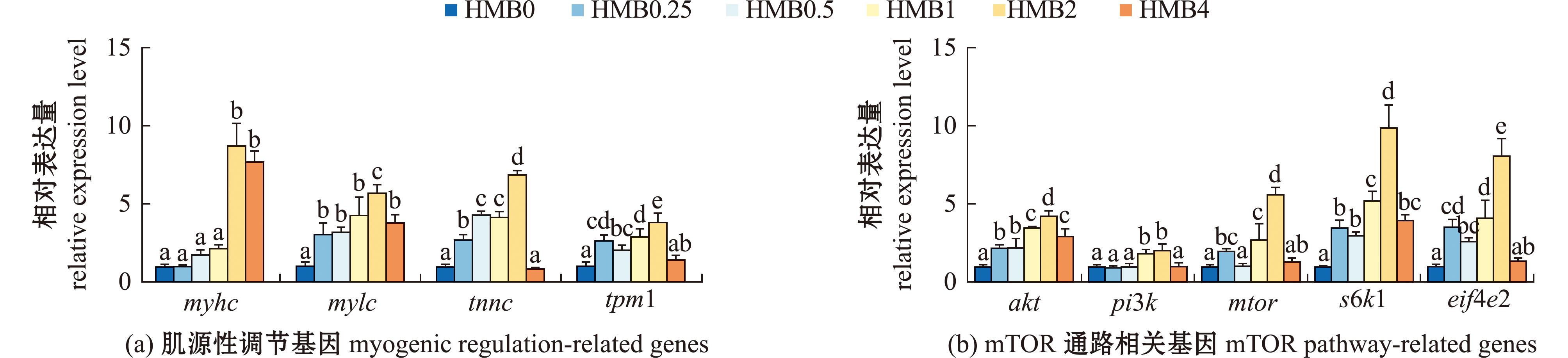
同一基因中标有不同字母者表示不同饲料组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The bars with different letters in same gene are significant differences in different diet groups (P<0.05),and the means with the same letter are not significant differences (P>0.05),et sequentia.
图3 添加HMB后凡纳滨对虾肌肉中肌源性调节和mTOR通路相关基因表达水平
Fig.3 Expression levels of genes related to myogenic regulation and the mTOR signaling pathway in the muscle tissue of Litopenaeus vannamei fed with diets with HMB additives
从图3(b)可见,随着高糖饲料中HMB添加水平的升高,凡纳滨对虾肌肉akt、pi3k、mtor、s6k1和eif4e2基因mRNA表达水平呈先上升后下降趋势,当HMB添加量为2 g/kg时,akt、pi3k、mtor、s6k1和eif4e2基因mRNA表达水平最高,且显著高于HMB0组(P<0.05)。
2.4 高糖饲料添加HMB对凡纳滨对虾血清生化指标的影响
从表7可知,各试验组凡纳滨对虾血糖含量并无显著性差异(P>0.05)。随着高糖饲料中HMB水平的升高,血清TG和T-CHO含量呈先下降后上升的趋势,当HMB添加量为0.25 g/kg时,TG含量最低(P<0.05);当HMB添加量为0.5 g/kg时,T-CHO含量最低(P<0.05)。随着高糖饲料中HMB水平的升高,各组血清HDL-C水平显著降低(P<0.05),血清LDL-C水平逐渐升高,当HMB添加量为0.25~4 g/kg时,血清HDL-C含量显著低于HMB0组(P<0.05),同时血清LDL-C含量显著高于HMB0组(P<0.05)。
表7 添加HMB后凡纳滨对虾的血清生化指标
Tab.7 Serum biochemical indicators of Litopenaeus vannamei fed with diets with HMB additives mmol/L

组别 group 甘油三酯 TG 总胆固醇 T-CHO 血糖水平 GLU 高密度脂蛋白胆固醇 HDL-C 低密度脂蛋白胆固醇 LDL-C HMB0 0.85±0.06c 0.31±0.03d 34.00±0.56 0.10±0.01b 0.12±0.01a HMB0.25 0.12±0.01a 0.17±0.03ab 35.23±0.16 0.06±0.01a 0.12±0.01ab HMB0.5 0.19±0.02a 0.15±0.02a 34.72±0.20 0.07±0.01a 0.12±0.01ab HMB1 0.22±0.02a 0.23±0.02bc 32.94±2.37 0.05±0.01a 0.15±0.01bc HMB2 0.22±0.01a 0.24±0.01c 33.84±0.21 0.07±0.01a 0.15±0.01abc HMB4 0.33±0.03b 0.25±0.01cd 33.25±0.73 0.06±0.01a 0.18±0.01c
2.5 高糖饲料添加HMB对凡纳滨对虾肝胰腺酶活指标的影响
从表8可见,随着高糖饲料中HMB水平的升高,肝胰腺TG含量先下降后升高,肝胰腺糖原含量逐渐减低,当HMB添加量为0.5 g/kg时,肝胰腺TG含量最低(P<0.05);当HMB添加量为0.5~4 g/kg时,肝胰腺糖原含量显著低于HMB0组(P<0.05)。
表8 添加HMB后凡纳滨对虾的肝胰腺酶活指标
Tab.8 Hepatopancreatic enzyme activity indicators of Litopenaeus vannamei fed with diets with HMB additives

组别 group 甘油三酯/ (mmol·L-1) TG 糖原/ (mg·g-1) Glycogen 磷酸果糖激酶/ (U·mg-1) PFK 磷酸烯醇丙酮酸羧化激酶/ (U·g-1) PEPCK HMB0 0.33±0.01c 2.87±0.04c 497.68±28.84ab 1496.96±59.86b HMB0.25 0.25±0.01b 2.74±0.08bc 407.65±17.50a 1302.25±79.00b HMB0.5 0.21±0.01a 2.68±0.06b 492.68±36.23ab 1327.00±90.02b HMB1 0.23±0.01ab 2.70±0.04b 602.72±15.21c 584.14±22.31a HMB2 0.24±0.01ab 2.66±0.02b 580.21±30.42bc 375.13±66.93a HMB4 0.25±0.01b 2.19±0.06a 590.21±35.28c 412.65±66.58a 己糖激酶/ (nmol·min-1·g-1) HK 6-磷酸葡萄糖酸脱氢酶/ (U·mgprot-1) 6PGD 葡萄糖6-磷酸脱氢酶/ (U·mgprot-1) G6PD 异柠檬酸脱氢酶/ (U·mgprot-1) ICDH 苹果酸脱氢酶/ (U·mgprot-1) ME 4678.85±171.98a 15.72±2.27b 21.62±3.00c 39.52±8.70b 116.38±3.63d 5423.63±112.41b 19.25±2.39b 12.61±1.33b 10.18±2.18a 32.52±3.70c 6421.83±224.20c 15.55±3.29b 8.71±1.65ab 7.46±0.72a 34.42±1.10c 6551.63±60.16c 13.82±1.02ab 5.41±1.04a 11.82±1.44a 33.86±1.06c 9651.29±126.22e 7.59±1.83a 6.90±0.69a 2.99±0.23a 18.17±2.04b 7352.04±140.71d 8.35±1.70a 7.07±1.28a 5.35±0.21a 9.64±0.74a
随着高糖饲料中HMB水平的升高,肝胰腺PFK酶活性呈先下降后升高的趋势,而HK酶活性呈现先上升后下降趋势,当HMB添加量为1~4 g/kg时,PFK酶活性显著高于HMB0组(P<0.05),当HMB添加量为2 g/kg时,HK酶活性最高(P<0.05)。同时,肝胰腺PEPCK酶活性呈下降趋势,当HMB添加量为1~4 g/kg时,PEPCK酶活性显著低于HMB0组(P<0.05)。
此外,随着高糖饲料中HMB水平的升高,肝胰腺6PGD、G6PD、ICDH和ME的酶活性逐渐降低,当HMB添加量为1~4 g/kg时,6PGD酶活性显著低于HMB0组(P<0.05);HMB添加量为0.25~4 g/kg时,ICDH和ME酶活性显著低于HMB0组(P<0.05)。
2.6 高糖饲料添加HMB对凡纳滨对虾肝胰腺糖脂代谢相关基因表达的影响
从图4可见,随着高糖饲料中HMB水平的升高,凡纳滨对虾肝胰腺pfk、hk和pk基因的mRNA表达水平呈先上升后下降趋势,当HMB添加量为2 g/kg时,pfk、hk和pk基因的mRNA表达水平最高(P<0.05)。而随着高糖饲料中HMB水平的升高,凡纳滨对虾肝胰腺g6pc、pepck、fbp和gsk-3β基因的mRNA表达水平呈逐渐下降趋势,当HMB添加量为0.25~4 g/kg时,g6pc基因的mRNA表达水平显著低于HMB0组(P<0.05);当HMB添加量为1~4 g/kg时,pepck基因的mRNA表达水平显著低于HMB0组(P<0.05);当HMB添加量为0.25~4 g/kg时,fbp和gsk-3β基因的mRNA表达水平显著低于HMB0组(P<0.05)。
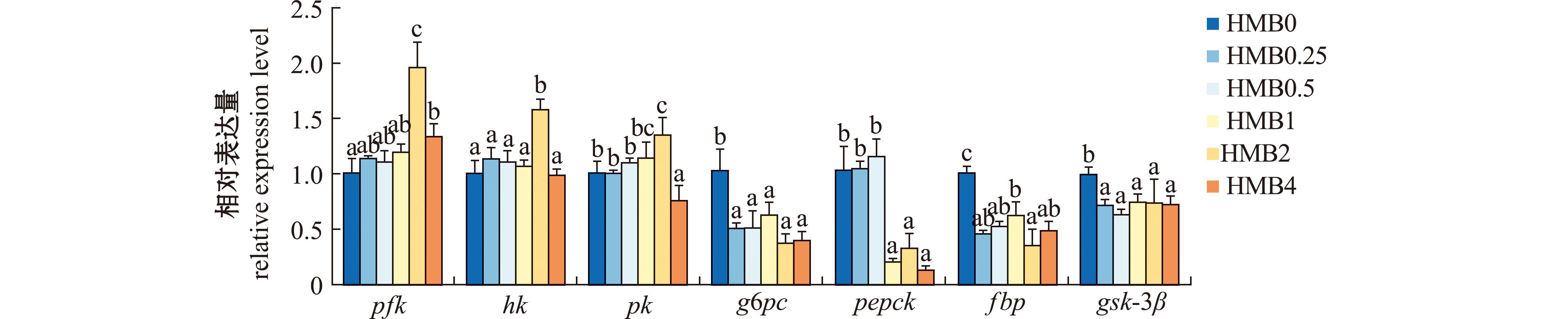
图4 添加HMB后凡纳滨对虾肝胰腺中糖代谢相关基因表达水平
Fig.4 Effect of HMB diet on expression level of glucose metabolism-related genes in hepatopancreas of Litopenaeus vannamei
从图5可见,随着高糖饲料中HMB水平的升高,fas、srebp-1和acc1基因的mRNA表达水平呈逐渐下降趋势,当HMB添加为0.5~4 g/kg时,fas基因的mRNA表达水平显著低于HMB0组(P<0.05);当HMB添加量为0.25~4 g/kg时,srebp-1和acc1基因的mRNA表达水平显著低于HMB0组(P<0.05)。
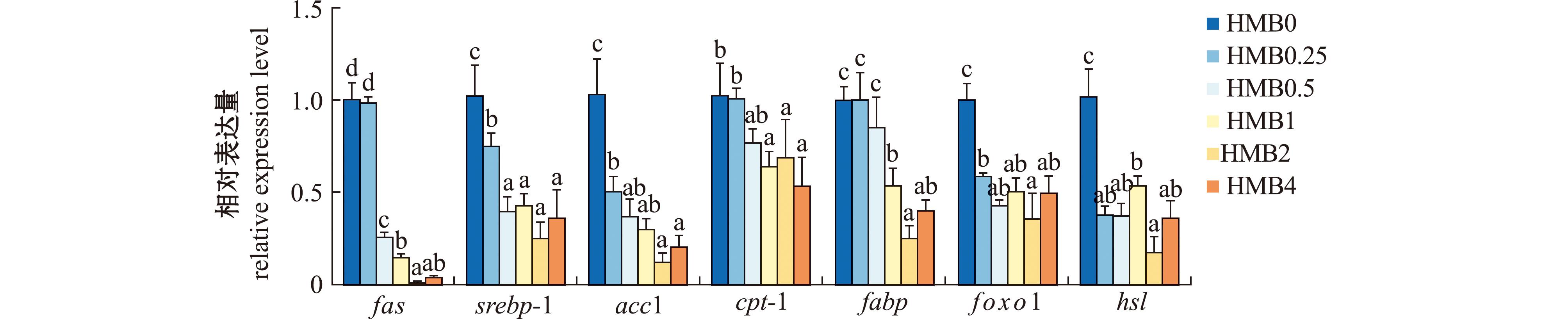
图5 添加HMB后凡纳滨对虾肝胰腺中脂代谢相关基因表达水平
Fig.5 Effect of HMB diet on expression level of lipid metabolism-related genes in hepatopancreas of Litopenaeus vannamei
此外,从图5可见,随着高糖饲料中HMB水平的升高,肝胰腺cpt-1、fabp、foxo1和hsl基因的mRNA表达水平明显降低,当HMB添加量为1~4 g/kg时,cpt-1和fabp基因的mRNA表达水平显著低于HMB0组(P<0.05);当HMB添加量为0.25~4 g/kg时,foxo1和hsl基因mRNA水平显著低于HMB0组(P<0.05),当HMB添加量为2 g/kg时,cpt-1、foxo1和hsl基因的mRNA表达水平最低(P<0.05)。
3 讨论
3.1 高糖饲料添加HMB对凡纳滨对虾生长性能和生化指标的影响
本试验结果表明,在高糖饲料中添加适量的HMB提高了凡纳滨对虾的生长性能,降低了饲料系数。经回归模型分析,HMB添加水平为2.58 g/kg时,凡纳滨对虾的WGR最高,HMB添加水平为2.71 g/kg时,对虾FCR最低。研究表明,在饲料中添加1 g/kg的HMB能够明显促进大菱鲆和大黄鱼的生长性能[12-13],这与本试验结果相似,表明在高糖饲料中添加适量的HMB能够提高凡纳滨对虾对饲料的利用,发挥其促生长的作用。在本试验中,未发现凡纳滨对虾血糖水平有明显差异。一般来说,血浆葡萄糖水平很容易受到采样时间和程序的影响[16]。因此,本试验中采集的血清可能受禁食的影响,导致血糖水平无显著性差异。此外,血清中HDL-C和LDL-C的水平变化是反映机体血脂肪代谢及肝脏脂肪代谢的重要指标。HDL-C参与脂质从外周组织逆向转运至肝胰腺的过程[17],而LDL-C可以将脂质转移到外周组织中进一步利用[18]。前期研究表明,适量的HMB可改善高脂诱导肥胖小鼠的血脂代谢,降低血清中TG和T-CHO含量[19]。对巴马香猪的研究表明,在饲料中添加1.3 g/kg的HMB显著改善了巴马香猪的血脂代谢[20]。本试验结果显示,在高糖饲料中添加1~4 g/kg的HMB显著降低了对虾血浆中HDL-C水平,提高了LDL-C水平,使得肝胰腺TG含量降低,这与肉鸡的研究结果相似[21]。而LDL-C水平的升高意味着更多的脂质被转运到外周组织,外周组织对脂质的利用能力增强,这可能是导致血脂降低的一个因素。综上可知,在高糖饲料中添加适量的HMB能够明显提高凡纳滨对虾的生长性能和饲料利用,同时改善对虾的血脂代谢。
3.2 高糖饲料添加HMB对凡纳滨对虾肌肉品质的影响
质地参数(硬度、内聚性、弹性和咀嚼性)是评价肌肉品质最重要的质量指标,决定了消费者对肉质的接受程度[22]。研究表明,饲料中添加适量HMB显著提高了大口黑鲈[16]和日本对虾[15]的肌肉硬度、弹性和咀嚼性。同样,在本研究中,当高糖饲料中添加2 g/kg的HMB时,凡纳滨对虾的肌肉硬度、弹性和咀嚼性都得到了明显改善。水生动物蛋白质周转是影响肉质的主要因素之一,而肌肉蛋白含量与蛋白质周转密切相关[23]。前期研究表明,在饲料中适当补充 HMB可增加大黄鱼[13]和日本囊对虾[14]的肌肉胶原蛋白和粗蛋白质含量。本研究中,随着高糖饲料中HMB添加量的增加,凡纳滨对虾肌肉胶原蛋白和粗蛋白质含量呈现上升趋势,当HMB添加量>0.5 g/kg时,肌肉胶原蛋白和粗蛋白质含量显著高于HMB0组,这可能是HMB引起凡纳滨对虾肌肉硬度、弹性和咀嚼性增加的原因。因为肌肉中总胶原蛋白含量的增加有助于形成弹性网络,并增强肌肉的拉伸强度[24]。研究发现,大黄鱼[25]肌肉中的总胶原蛋白质含量与肌肉硬度和弹性呈正相关,这与本试验结果一致。从基因水平来看,PI3K/AKT 信号通路是影响蛋白质含量的关键通路[26]。mTOR是其下游效应蛋白,影响大多数细胞调节蛋白质合成的功能,它可以直接磷酸化两个下游效应子S6K1和4EBP1,从而促进蛋白质转录起始和翻译[27]。在本研究中,HMB的添加显著上调了凡纳滨对虾肌肉中akt、pi3k、mtor、s6k1和eif4e2基因的mRNA表达水平,即促进肌肉蛋白质合成。据报道,饲料补充 HMB 可显著上调日本对虾肌肉中 pi3k、akt、tor 和 s6k 基因的相对表达[14]。同样,HMB 还增加了大黄鱼肌肉中 tor 基因的表达水平[13]。此外,在哺乳动物中也发现了类似结果,HMB补充剂显著上调了小鼠肌源细胞中mtor和p70 s6k1基因的表达水平[8,28]。
此外,mTOR信号通路在调控肌肉结构蛋白的合成中起着重要作用,对三倍体鲫(Carassius carassius)[29]的研究发现,肌肉中myhc、mylc、tnnc和tpm1基因的mRNA表达水平增加可能是由mTOR信号激活引起的。myhc、mylc、tnnc和tpm1是肌肉主要的结构蛋白,与肌纤维生长和蛋白质增加有关,是影响肌肉品质的重要因素[29-30]。本研究中,相比于HMB0组,添加2 g/kg的HMB显著增加了肌肉中myhc、mylc、tnnc和tpm1基因的mRNA表达水平。然而,目前关于HMB调控动物(特别是水产动物)肌肉结构蛋白基因表达影响的研究较为有限,未来需通过多组学整合分析、跨物种验证等手段深入探究其调控机制及潜在应用价值。综上所述,在高糖饲料中添加适量的HMB可以通过介导PI3K/AKT/mTOR信号通路促进凡纳滨对虾肌肉蛋白质沉积,同时该通路的激活促进了凡纳滨对虾肌肉结构蛋白的表达水平,进而调节肌纤维的生长并改善质地特性。
3.3 高糖饲料添加HMB对凡纳滨对虾糖脂代谢的影响
肝胰腺作为对虾糖原储存与糖脂代谢的核心器官,在机体应对高糖环境的代谢调控中至关重要。糖经消化吸收进入肝胰腺后,主要通过糖酵解与糖异生两条途径进行代谢:前者依赖 HK、PFK和PK等关键酶促进葡萄糖分解供能,后者则通过 PEPCK、G6PC和FBP等关键酶催化非糖物质转化为葡萄糖。研究表明,HMB可以通过激活 PI3K/AKT 通路,诱导 FoxO1 蛋白发生磷酸化,使其丧失转录活性,进而抑制糖异生并激活糖酵解[31-32]。本试验结果显示,随着高糖饲料中 HMB 添加水平的升高,foxo1基因表达量显著下调,在添加量为 2 g/kg 时抑制效果最为显著。这一调控直接反映在糖代谢关键酶活性与基因表达的变化中:糖酵解限速酶PFK、HK酶活性和pfk、hk、pk基因的mRNA表达水平先升高后降低,在添加2 g/kg的HMB时,凡纳滨对虾糖酵解限速酶活性和基因的mRNA表达水平最高;而糖异生限速酶PEPCK酶活性和 pepck、g6pc、fbp基因的 mRNA 表达水平则随 HMB 添加量的升高显著降低。HMB 通过抑制 foxo1基因表达阻断其对糖异生基因的激活作用和对糖酵解基因的抑制作用,最终通过 “增强糖酵解、抑制糖异生” 的双重机制,有效减少高糖饲料诱导的肝胰腺糖原异常积累,这与HMB处理组中糖原合成调控基因gsk-3β表达下调、肝糖原含量降低的试验结果相印证。
在脂代谢调控方面,HMB表现出对脂肪合成与分解的双向抑制作用。CPT-1、HSL是脂肪分解的关键限速酶,HMB通过诱导 FoxO1蛋白磷酸化,可以间接抑制cpt-1、hsl的表达[32-33]。Fabp为脂肪酸结合蛋白,主要促进脂肪酸的结合和运输,其表达量降低说明转运入肝脏中的脂肪酸减少[34]。研究表明,饲料中添加1.28% 的HMB显著下调了巴马香猪肝脏中hsl和fabp-1基因的mRNA表达量[20]。同样,本研究结果显示,在高糖饲料中添加HMB显著下调了凡纳滨对虾cpt-1、hsl、fabp和foxo1基因的mRNA表达水平,说明在高糖饲料中添加适量HMB对凡纳滨对虾的脂肪分解具有抑制作用。
研究表明,高糖可以增加水产动物肝脏中脂肪合成酶活性,从而刺激脂肪生成[35],导致组织中脂质沉积。SREBP-1是一种关键的转录因子,它的靶基因包括acc1和fas,这些酶是脂肪酸从头合成途径中的关键酶[36]。G6PD、6PGD、ME、ICDH是NADPH产生过程中的主要调节酶类,间接参与脂肪的合成[37-38]。相关研究显示,HMB可以下调脂肪合成相关基因 srebp-1、 acc1和fas 的表达,并降低脂肪合成关键酶 ICDH、ME、G6PD、6PGD 的活性,在一定程度上抑制肝脏脂肪合成[21,39]。在本研究中,高糖饲料添加HMB显著下调了凡纳滨对虾srebp-1、acc1和fas基因的mRNA表达水平,同时脂肪合成酶活性也表现出相似的趋势。结合添加HMB后对虾肝胰腺和体脂肪含量降低的试验结果,本研究结果表明,HMB通过抑制凡纳滨对虾脂肪合成相关基因和酶活性,减少脂质沉积。
4 结论
1)在高糖饲料中添加适量的HMB可以提高凡纳滨对虾的WGR和SGR,同时降低FCR,说明适量的HMB添加量有利于提高凡纳滨对虾的生长性能和饲料利用率。
2)在高糖饲料中添加适量的HMB可以激活PI3K/AKT/mTOR相关通路,促进凡纳滨对虾肌肉蛋白质沉积,同时该通路的激活促进了凡纳滨对虾肌肉结构蛋白的表达水平,进而调节肌纤维的生长并改善肌肉质地。
3)在高糖饲料中添加适量的HMB,一方面通过抑制foxo1基因的表达量,间接抑制对虾糖异生和脂肪分解过程,激活糖酵解过程,提高糖脂的利用;另一方面抑制脂肪合成,进而减少了由高糖饲料引起的脂肪沉积。
4)综合试验结果,高糖饲料(饲料蛋白质含量35%、无氮浸出物含量30%和脂肪含量8%)中最适 HMB添加量建议为2 g/kg。
[1] 李婷婷,夏枫峰,油九菊,等.肠道微生物群落结构对凡纳滨对虾生长的影响[J].浙江海洋大学学报(自然科学版),2022,41(6):499-507.
LI T T,XIA F F,YOU J J,et al.Effects of the intestinal microbial community structure on the growth of Litopenaeus vannamei[J].Journal of Zhejiang Ocean University (Natural Science Edition),2022,41(6):499-507.(in Chinese)
[2] 李广丽,朱春华,周歧存.不同蛋白质水平的饲料对南美白对虾生长的影响[J].海洋科学,2001,25(4):1-4.
LI G L,ZHU C H,ZHOU Q C.Effects of dietary protein level on the growth of Penaeus vannamei[J].Marine Sciences,2001,25(4):1-4.(in Chinese)
[3] ASADUZZAMAN M,WAHAB M A,VERDEGEM M C J,et al.Effects of carbohydrate source for maintaining a high C:N ratio and fish driven re-suspension on pond ecology and production in periphyton-based freshwater prawn culture systems[J].Aquaculture,2010,301(1/2/3/4):37-46.
[4] 郭冉,梁桂英,刘永坚,等.糖和蛋白质水平对饲养于咸淡水中的凡纳滨对虾生长、体营养成分组成和消化率的影响[J].水产学报,2007,31(3):355-360.
GUO R,LIANG G Y,LIU Y J,et al.Effect of dietary carbohydrate and protein levels on growth performance and digestibility of Litopenaeus vannamei juvenile reared in brackish water[J].Journal of Fisheries of China,2007,31(3):355-360.(in Chinese)
[5] 胡毅,谭北平,麦康森,等.不同碳水化合物水平饲料对凡纳滨对虾生长及部分生理生化指标的影响[J].水生生物学报,2009,33(2):289-295.
HU Y,TAN B P,MAI K S,et al.Influence of dietary carbohydrate levels on growth and some physiological-biochemical index in juvenile Litopenaeus vannamei[J].Acta Hydrobiologica Sinica,2009,33(2):289-295.(in Chinese)
[6] DING Z L,XIONG Y F,ZHENG J X,et al.Modulation of growth,antioxidant status,hepatopancreas morphology,and carbohydrate metabolism mediated by alpha-lipoic acid in juvenile freshwater prawns Macrobrachium nipponense under two dietary carbohydrate levels[J].Aquaculture,2022,546:737314.
[7] LIU Y L,LU Q S,HAN G L,et al.Dietary betulinic acid alleviates high carbohydrate diet-induced hepaticde novo lipogenesis through AMPK signaling and improves liver health in channel catfish (Ictalurus punctatus)[J].Aquaculture Reports,2024,36:102187.
[8] ELEY H L,RUSSELL S T,BAXTER J H,et al.Signaling pathways initiated by beta-hydroxy-beta-methylbutyrate to attenuate the depression of protein synthesis in skeletal muscle in response to cachectic stimuli[J].American Journal of Physiology Endocrinology and Metabolism,2007,293(4):E923-E931.
[9] SMITH H J,WYKE S M,TISDALE M J.Mechanism of the attenuation of proteolysis-inducing factor stimulated protein degradation in muscle by beta-hydroxy-beta-methylbutyrate[J].Cancer Research,2004,64(23):8731-8735.
[10] ZHENG J,ZHENG C B,SONG B,et al.HMB improves lipid metabolism of Bama Xiang mini-pigs via modulating the Bacteroidetes-acetic acid-AMPKα axis[J].Frontiers in Microbiology,2021,12:736997.
[11] ZHENG C B,ZHANG S Y,DUAN Y H,et al.Dietary beta-hydroxy-beta-methyl butyrate supplementation improves meat quality of Bama Xiang mini-pigs through manipulation of muscle fiber characteristics[J].Journal of Functional Foods,2022,88:104885.
[12] 王磊.植物乳杆菌 p8发酵豆粕及β-羟基-β-甲基丁酸钙(HMB-Ca)在大菱鲆饲料中应用的研究[D].青岛:中国海洋大学,2017.
WANG L.The effect of dietary supplementation of Lactobacillus plantarum P8 fermented soybean mealor β-hydroxy-β-methylbutyrate calcium (HMB-Ca) for juvenile turbot (Scophthalmus maximus L.)[D].Qingdao:Ocean University of China,2017.(in Chinese)
[13] 唐梦曦.β-羟基-β-甲基丁酸盐(HMB)对大黄鱼生长效应、肌肉品质和肠道健康影响的研究[D].青岛:中国海洋大学,2018.
TANG M X.Effects of β-hydroxy-β-methylbutyrate (HMB) on growth,muscle quality and intestinalhealth of large yellow croaker Larimichthys crocea[D].Qingdao:Ocean University of China,2018.(in Chinese)
[14] MU H,YANG C B,ZHANG Y,et al.Dietary β-hydroxy-β-methylbutyrate supplementation affects growth performance,digestion,TOR pathway,and muscle quality in kuruma shrimp (Marsupenaeus japonicas) fed a low protein diet[J].Aquaculture Nutrition,2023,2023(1):9889533.
[15] XU Y C,XU Y H,ZHAO T,et al.Waterborne Cu exposure increased lipid deposition and lipogenesis by affecting Wnt/β-catenin pathway and the β-catenin acetylation levels of grass carp Ctenopharyngodon idella[J].Environmental Pollution,2020,263:114420.
[16] DAVIS K B.Management of physiological stress in finfish aquaculture[J].North American Journal of Aquaculture,2006,68(2):116-121.
[17] 艾庆辉,严晶,麦康森.鱼类脂肪与脂肪酸的转运及调控研究进展[J].水生生物学报,2016,40(4):859-868.
AI Q H,YAN J,MAI K S.Research progresses of lipids and fatty acids transport in fish[J].Acta Hydrobiologica Sinica,2016,40(4):859-868.(in Chinese)
[18] ZHANG Q,ZHOU X L,ZHANG J S,et al.Selenium and vitamin B6 cosupplementation improves dyslipidemia and fatty liver syndrome by SIRT1/SREBP-1c pathway in hyperlipidemic Sprague-Dawley rats induced by high-fat diet[J].Nutrition Research,2022,106:101-118.
[19] DUAN Y H,ZHONG Y Z,XIAO H,et al.Gut microbiota mediates the protective effects of dietary β-hydroxy-β-methylbutyrate (HMB) against obesity induced by high-fat diets[J].The FASEB Journal,2019,33(9):10019-10033.
[20] 郑昌炳,宋博,郑界,等.饲粮中添加β-羟基-β-甲基丁酸对巴马香猪生长性能和肝脏脂肪代谢的影响[J].动物营养学报,2021,33(6):3176-3184.
ZHENG C B,SONG B,ZHENG J,et al.Effects of dietary supplementation of beta-hydroxy-beta-methylbutyrate on growth performance and liver lipid metabolism of Bama Xiang pigs[J].Chinese Journal of Animal Nutrition,2021,33(6):3176-3184.(in Chinese)
[21] 汤志毅.β-羟基-β-甲基丁酸对肉鸡肉品质和脂肪代谢的影响及调控机制[D].长沙:湖南农业大学,2022.
TANG Z Y.Effect of β-hydroxy-β-methylbutyric acid on meat quality and fat metabolism of broilers and its regulation mechanism[D].Changsha:Hunan Agricultural University,2022.(in Chinese)
[22] ZHU B W,DONG X P,SUN L M,et al.Effect of thermal treatment on the texture and microstructure of abalone muscle (Haliotis discus)[J].Food Science and Biotechnology,2011,20(6):1467-1473.
[23] CHENG J H,SUN D W,HAN Z,et al.Texture and structure measurements and analyses for evaluation of fish and fillet freshness quality:a review[J].Comprehensive Reviews in Food Science and Food Safety,2014,13(1):52-61.
[24] SIVAKUMAR P,SUGUNA L,CHANDRAKASAN G.Molecular species of collagen in the intramuscular connective tissues of the marine crab,Scylla serrata[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2000,125(4):555-562.
[25] WEI Z H,MA J,PAN X Y,et al.Dietary hydroxyproline improves the growth and muscle quality of large yellow croaker Larimichthys crocea[J].Aquaculture,2016,464:497-504.
[26] ZHU X,REN L,LIU J J,et al.Transcriptome analysis provides novel insights into the function of PI3K/AKT pathway in maintaining metabolic homeostasis of Chinese perch muscle[J].Aquaculture Reports,2021,21:100838.
[27] RAHMAN M M,LI X Q,SHARIFUZZAMAN S M,et al.Dietary threonine requirement of juvenile largemouth bass,Micropterus salmoides[J].Aquaculture,2021,543:736884.
[28] AVERSA Z,ALAMDARI N,CASTILLERO E,et al.β-Hydroxy-β-methylbutyrate (HMB) prevents dexamethasone-induced myotube atrophy[J].Biochemical and Biophysical Research Communications,2012,423(4):739-743.
[29] DONG B,WU L Y,WANG Y,et al.Glutamate improves flesh quality and muscle growth of triploid crucian carp[J].Aquaculture Reports,2023,33:101832.
[30] HEVRØY E M,JORDAL A O,HORDVIK I,et al.Myosin heavy chain mRNA expression correlates higher with muscle protein accretion than growth in Atlantic salmon,Salmo salar[J].Aquaculture,2006,252(2/3/4):453-461.
[31] HAEUSLER R A,HARTIL K,VAITHEESVARAN B,et al.Integrated control of hepatic lipogenesis versus glucose production requires FoxO transcription factors[J].Nature Communications,2014,5:5190.
[32] DAITOKU H,FUKAMIZU A.FOXO transcription factors in the regulatory networks of longevity[J].Journal of Biochemistry,2007,141(6):769-774.
[33] ZHANG W W,PATIL S,CHAUHAN B,et al.FoxO1regulates multiple metabolic pathways in the liver effects on gluconeogenic,glycolytic,and lipogenic gene expression[J].Journal of Biological Chemistry,2006,281(15):10105-10117.
[34] ![]() A.The multigene family of fatty acid-binding proteins (FABPs):function,structure and polymorphism[J].Journal of Applied Genetics,2006,47(1):39-48.
A.The multigene family of fatty acid-binding proteins (FABPs):function,structure and polymorphism[J].Journal of Applied Genetics,2006,47(1):39-48.
[35] MOREIRA I S,PERES H,COUTO A,et al.Temperature and dietary carbohydrate level effects on performance and metabolic utilisation of diets in European sea bass (Dicentrarchus labrax) juveniles[J].Aquaculture,2008,274(1):153-160.
[36] 朱若岚,宁波.SREBP-1相关通路为靶点的NAFLD发生机制及治疗进展[J].临床医学进展,2022,12(5):4210-4220.
ZHU R L,NING B.The Pathogenesis and Treatment Progress of NAFLD Targeted by SREBP-1 Related Pathway[J].Advances in Clinical Medicine,2022,12(5):4210-4220.(in Chinese)
[37] LING S C,ZHUO M Q,ZHANG D G,et al.Nano-Zn increased Zn accumulation and triglyceride content by up-regulating lipogenesis in freshwater teleost,yellow catfish Pelteobagrus fulvidraco[J].International Journal of Molecular Sciences,2020,21(5):1615.
[38] CHEN Q L,LUO Z,LIU X,et al.Effects of waterborne chronic copper exposure on hepatic lipid metabolism and metal-element composition in Synechogobius hasta[J].Archives of Environmental Contamination and Toxicology,2013,64(2):301-315.
[39] 廖启超.饲粮添加HMB对高脂高胆固醇饲喂的海兰褐蛋鸡生长性能、脂肪沉积、胆汁酸代谢和肠道微生物的影响[D].南宁:广西大学,2022.
LIAO Q C.Effects of HMB supplementation on growth performance,fat deposition,bile acid metabolism and intestinal microorganisms of Hailan brown laying hens fed with high fat and cholesterol[D].Nanning:Guangxi University,2022.(in Chinese)