凡纳滨对虾(Litopenaeus vannamei)是中国主要的对虾养殖品种,养殖方式以池塘养殖为主[1]。生产中普遍采用高密度集约化养殖,导致对虾养殖池塘水体富营养化,以微囊藻(Microcystis)为主的蓝藻水华频发[2-3]。藻毒素是蓝藻水华对养殖动物最严重、最直接的危害,其中微囊藻毒素(microcystins,MCs)是分布范围最广、危害最严重的一类蓝藻毒素[4]。
MCs理化性质稳定,不易被降解,能够在水环境中长时间稳定存在[5]。自然水体中MCs降解主要依赖于光降解和微生物降解[6-7]。在池塘养殖环境中,除了溶解在水中,MCs还可以在沉积物和养殖动物体内蓄积[8]。研究发现,湖泊沉积物中MCs的浓度和降解程度均高于水中,因缺乏光降解条件,沉积物中MCs降解主要以微生物降解为主[9-10]。目前,MCs微生物降解研究主要集中在有氧条件下分离鉴定特异性MCs降解菌[11-12]、分析特定菌或菌群的MCs降解性能[13-14],以及解析MCs微生物降解途径及其分子机制[15-17]。除有氧降解外,在厌氧条件下同样存在MCs的生物降解[18-20]。在沉积物中,溶解氧处于较低水平,MCs的生物降解以厌氧降解为主[9]。目前,对沉积物中厌氧降解的研究主要集中在湖泊等自然水体中[18-20],而养殖水体沉积物中厌氧降解研究开展较少,针对水产动物肠道MCs厌氧降解的研究更是处于空白状态。
目前,已发现MCs异构体高达200余种,其中MC-LR、MC-RR和MC-YR是出现频率最高的3种异构体[21]。本研究于2022年夏季采集凡纳滨对虾养殖池塘上覆水、底泥和对虾样品,分析MC-LR、MC-RR和MC-YR的蓄积情况,并利用以MCs为唯一碳氮源的Widdel培养基连续性富集底泥和对虾肠道MCs厌氧降解菌群,分析其群落结构及对MCs的降解性能,以期为通过厌氧生物降解途径减轻养殖池塘中的MCs污染提供科学参考。
1 材料与方法
1.1 材料
MC-LR、MC-RR和MC-YR标准品购自北京普华仕科技有限公司,菌群富集所用MCs由本实验室自鲈鱼池塘打捞水华微囊藻提取获得。
1.2 方法
1.2.1 样本采集 采样池塘位于天津市滨海新区,为凡纳滨对虾养殖池塘,夏季频发微囊藻水华。分别于2022年7月15日和8月15日采集池塘上覆水、底泥和对虾样本,共设置3个采样点。采用圆柱形采水器采集上覆水,用0.22 μm滤膜过滤后用于分析溶解于水中的MCs含量;采用Peterson沉积物采样器采集底泥。随机采集60只对虾(体长为135.07 mm±5.50 mm、体质量为24.23 g±3.18 g),解剖取其肝胰腺、肌肉和肠道组织。
1.2.2 MCs提取和测定 每20只对虾肝胰腺和肌肉样本分别进行合样,冻干研磨后加入90%甲醇水溶液(M/V,1/20);底泥样品冻融后冻干并研磨,加入0.1%三氟乙酸(TFA)(M/V,1/35)。超声处理3次(每次1 min,60%幅度,间隔10 s),离心(4 ℃,12 000 g)10 min,合并上清液。上清液和上覆水过滤液净化:用10 mL甲醇、10 mL去离子水活化C18固相萃取柱(Sep-Pak,Waters,USA),上样后流速为8 mL/min,用20%甲醇水溶液淋洗,然后用含0.1% TFA甲醇水溶液洗脱,收集洗脱液在氮气流下蒸发至干燥,用1 mL 50%甲醇定容,过0.22 μm滤膜后上样于HPLC(SPD-M20A,Shimadzu,Japan),通过样品中MC-LR、MC-RR和MC-YR峰面积与其标准品制备的标准曲线计算出3种异构体含量。
1.2.3 池塘底泥和对虾肠道原始菌群16S rDNA V3~V4区扩增及高通量测序 使用土壤DNA分离试剂盒(OMEGA,USA)提取池塘底泥和对虾肠道DNA。采用通用引物338F(5′ACTCCTACGGGAGGCAGCAG 3′)和806R(5′GGACTACHVGGGTWTCTAAT 3′)对所提取DNA的16S rDNA V3~V4区进行PCR扩增[22]。PCR反应体系包括模板DNA2 μL,2×Taq PCR MasterMix 12.5 μL,上下游引物各1 μL(5 μmol/L),BSA(2 ng/μL)3 μL 和ddH2O 5.5 μL。扩增程序为94 ℃ 下预变性5 min,94 ℃ 下变性30 s,50 ℃ 下退火30 s,72 ℃ 下延伸60 s,共进行30个循环,最后在72 ℃下再延伸7 min。扩增产物交由奥弗森基因技术有限公司进行高通量测序并进行数据分析。
1.2.4 MCs厌氧降解菌群的选择性富集 将8月采集的池塘底泥或对虾肠道与灭菌水以1∶20(质量/体积比或个体/体积比)混合,磁力搅拌1 h后静置1 h,经0.22 μm滤膜过滤上清液收集细菌,接种于以MCs为唯一碳氮源的Widdel培养基中。在密封培养箱中加入厌氧产气袋进行避光厌氧培养(120 r /min,30 ℃)。在上述厌氧条件下,沉积物中和对虾肠道中MCs降解菌群共富集6次,按照富集的先后顺序分别命名为S1~S6和I1~I6。在前3次富集中,初始MCs浓度为237.69 μg/L,每3天重新接种一次。在后3次富集中,MCs的初始浓度为267.64 μg/L,每3天重新接种一次。
1.2.5 MCs厌氧降解菌群的降解性能及群落结构分析 选择富集后的菌液离心(4 ℃,8 000 r/min)10 min,取沉淀提取DNA扩增16S rDNA V3~V4区并进行高通量测序分析,上清经0.22 μm膜过滤后采用HPLC系统测定MCs含量。MCs的降解率(V)计算公式为
(1)
式中:C1为每次选择富集前初始MCs浓度(μg/g),C2为每次选择富集后MCs浓度(μg/g)。
1.3 数据处理
试验结果用平均值±标准差(mean±S.D.)(n=3)表示。采用t检验(SPSS 23.0)检验7月与8月间MCs蓄积量是否存在显著性差异。采用LSD检验组间微生物群落多样性是否存在显著性差异。显著性差异设为0.05。
2 结果与分析
2.1 对虾池塘MCs蓄积
从表1可见,MC-RR为上覆水中主要异构体,8月上覆水中未检出MC-LR和MC-YR。7月和8月底泥样本均未检测到MC-LR。无论是上覆水中还是底泥中,8月MCs含量均高于7月,但无显著性差异(P>0.05)。从表2可见,7月和8月对虾肝胰腺和肌肉样本中仅检测到MC-RR,未检测到其他两种异构体。与上覆水和底泥中MCs含量变化一致,8月对虾肝胰脏和肌肉样本中MCs含量高于7月份,但无显著性差异(P>0.05)。
表1 溶解在水中和蓄积在池塘底泥中的MCs浓度
Tab.1 Concentrations of MCs dissolved in water and accumulated in pond sediment μg/g

日期 date 上覆水 water 底泥 sediment MC-RR MC-LR MC-YR MCs MC-RR MC-LR MC-YR MCs 07-15 3.10±0.98a 0.76±0.31a 0.72±0.24a 4.58±1.10a 0.14±0.20a — 0.17±0.03a 0.31±0.07a 08-15 5.23±1.04a —b —b 5.23±1.04a 0.44±0.42a — 0.14±0.10a 0.58±0.19a
注:—表示未检出。MC-RR表示微囊藻毒素-RR;MC-LR表示微囊藻毒素-LR;MC-YR表示微囊藻毒素-YR;MCs表示3种异构体之和。同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:— means not detected.MC-RR means microcystin-RR;MC-LR means microcystin-LR;MC-YR means microcystin-YR;and MCs means the sum of three microcystin isomers.The means with different letters within the same column are significantly different among groups(P<0.05),and the means with the same letter within the same column are not significantly differences among groups(P>0.05),et sequentia.
表2 蓄积在对虾肝胰腺和肌肉中的MCs浓度
Tab.2 Concentration of MCs accumulated in shrimp hepatopancreas and muscle μg/g

日期 date 肝胰腺 hepatopancreas 肌肉 muscle MC-RR MC-LR MC-YR MCs MC-RR MC-LR MC-YR MCs 07-15 0.04±0.01a — — 0.04±0.01a 0.02±0.03a — — 0.02±0.03a 08-15 0.38±0.18a — — 0.38±0.18a 0.05±0.06a — — 0.05±0.06a
2.2 池塘底泥和对虾肠道微生物群落多样性
从表3可见,与7月相比,8月池塘底泥和对虾肠道微生物群落α多样性均下降,变化趋势与MCs变化趋势相同。对虾肠道微生物群落α多样性显著低于底泥中微生物群落(P<0.05)。
表3 池塘底泥和对虾肠道微生物群落α多样性
Tab.3 Alpha diversity of bacteria community in pond sediment and shrimp intestine

组别 group 日期 date OTUs数量 OTUssquantity Chao1指数 Chao1index Shannon指数 Shannonindex Simpson指数 Simpsonindex 底泥 sediment 07-15 2167.33±170.39a 3433.09±187.92a 8.27±0.36a 0.98±0.01a 底泥 sediment 08-15 1983.33±165.49a 3188.67±244.46a 7.70±0.42a 0.97±0.01a 肠道intestine 07-15 676.67±74.63b 973.06±182.16b 5.36±0.10b 0.92±0.03b 肠道intestine 08-15 499.33±172.47b 732.45±228.21b 4.10±0.74c 0.84±0.06c
2.3 池塘底泥和对虾肠道MCs厌氧菌群降解性能
从表4可见,前5次富集过程中,池塘底泥和对虾肠道厌氧菌群对MCs降解率均随富集次数增加逐渐升高,第6次富集后MCs厌氧菌群降解率较第5次富集后略有下降。
表4 池塘底泥和对虾肠道MCs厌氧降解菌群的降解性能
Tab.4 Degradation activity of anaerobic MCs-degrading bacteria community enriched from pond sediment and shrimp intestine

富集次数 enrichedtime 初始浓度/ (μg·L-1) initialconcentration 池塘底泥 pondsediment 对虾肠道shrimpintestine 终浓度/ (μg·L-1) finalconcentration 降解率/% degradationrate 终浓度/ (μg·L-1) finalconcentration 降解率/% degradationrate 1 147.87±22.78 37.79 164.55±14.50 30.77 2 237.69 142.30±30.20 40.13 145.80±26.43 38.66 3 134.16±5.26 43.56 120.43±64.48 51.74 4 90.56±37.98 66.16 85.82±31.81 67.94 5 267.64 64.04±10.15 76.07 59.91±55.68 77.62 6 72.45±38.62 71.10 64.73±19.22 75.81
2.4 池塘底泥、对虾肠道厌氧菌群群落结构特征
池塘底泥MCs厌氧降解菌群OTUs数量及α多样性指数随富集次数增加逐渐下降,在第5次富集时略有升高,第6次富集时继续下降(表5)。对虾肠道厌氧降解菌群OTUs数量及α多样性指数的变化趋势与池塘底泥厌氧降解菌群的变化趋势一致(表6)。
表5 池塘底泥MCs厌氧降解菌群α多样性
Tab.5 Alpha diversity of anaerobic MCs-degrading bacteria community enriched from pond sediment

顺序 sequence OTUs数量 OTUs Chao1指数 Chao1index Shannon指数 Shannonindex Simpson指数 Simpsonindex S1 749a 974.50±344.20a 6.38±0.68a 0.94±0.03a S2 639a 1251.11±65.55a 4.31±0.43b 0.82±0.03b S3 269b 415.26±212.24b 3.66±0.37b 0.81±0.05b S4 244b 413.31±149.11b 0.70±0.29c 0.12±0.06d S5 379b 407.18±217.25b 1.12±0.34c 0.30±0.07c S6 180b 354.70±89.56b 0.59±0.34c 0.10±0.07d
表6 对虾肠道MCs厌氧降解菌群α多样性
Tab.6 Alpha diversity of anaerobic MCs-degrading bacteria community enriched from shrimp intestine

顺序 sequence OTUs数量 OTUs Chao1指数 Chao1index Shannon指数 Shannonindex Simpson指数 Simpsonindex I1 295ab 494.88±426.31a 2.34±0.69a 0.62±0.13a I2 129b 200.18±19.87ab 0.72±0.17b 0.15±0.04cd I3 169b 298.59±46.22ab 0.60±0.08b 0.12±0.03cd I4 92b 141.55±8.00b 0.29±0.12b 0.05±0.03d I5 167b 295.40±36.52ab 0.86±0.30b 0.22±0.09c I6 116b 241.90±121.13ab 0.40±0.31b 0.07±0.06d
从图1可见,池塘底泥在前3次选择富集中,绿脓杆菌属(Pseudomonas)菌属相对丰度占比最高,富集4次后,科萨克氏菌属Kosakonia成为优势菌属,在第5次富集时鞘脂菌属Sphingobium相对丰度升高,在第6次富集时该菌属相对丰度下降。对虾肠道微生物在第1次富集时,肠球菌属Enterococcus,气单胞菌属Aeromonas和Vibrio分别为相对丰度占比最高的3个菌属。富集2次后,Kosakonia成为优势菌属,在第5次富集时Sphingobium菌相对丰度升高,在第6次富集时该菌属相对丰度下降。从图2可见,4次富集后池塘底泥中厌氧降解菌群群落组成与2次富集后对虾肠道中厌氧降解菌群群落组成高度相似,且菌群结构相对稳定。
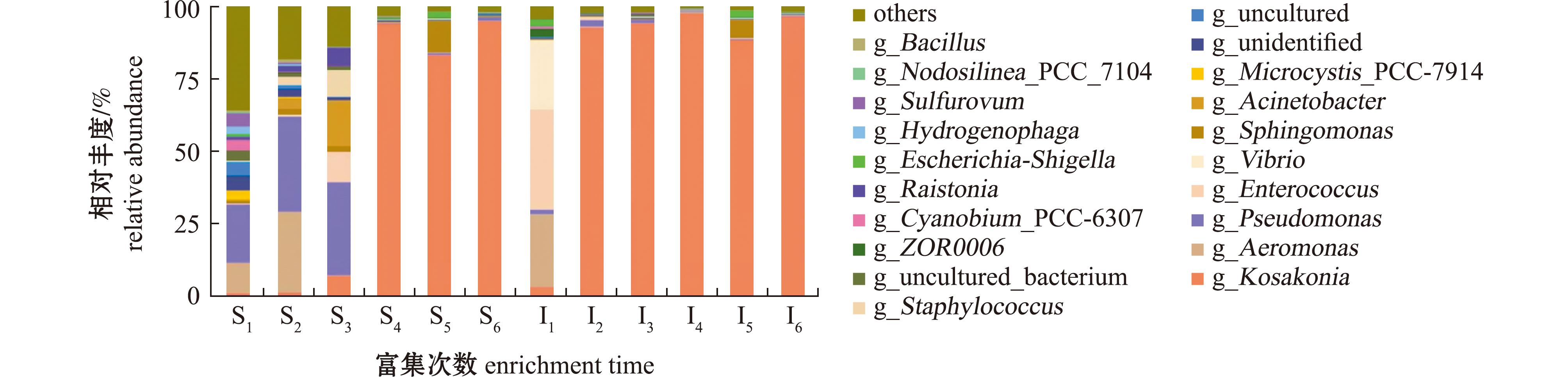
图1 池塘底泥和对虾肠道MCs厌氧降解菌群在属水平上的群落组成
Fig.1 Community composition of MCs anaerobic degrading bacteria in pond sediment and shrimp intestine at genus level
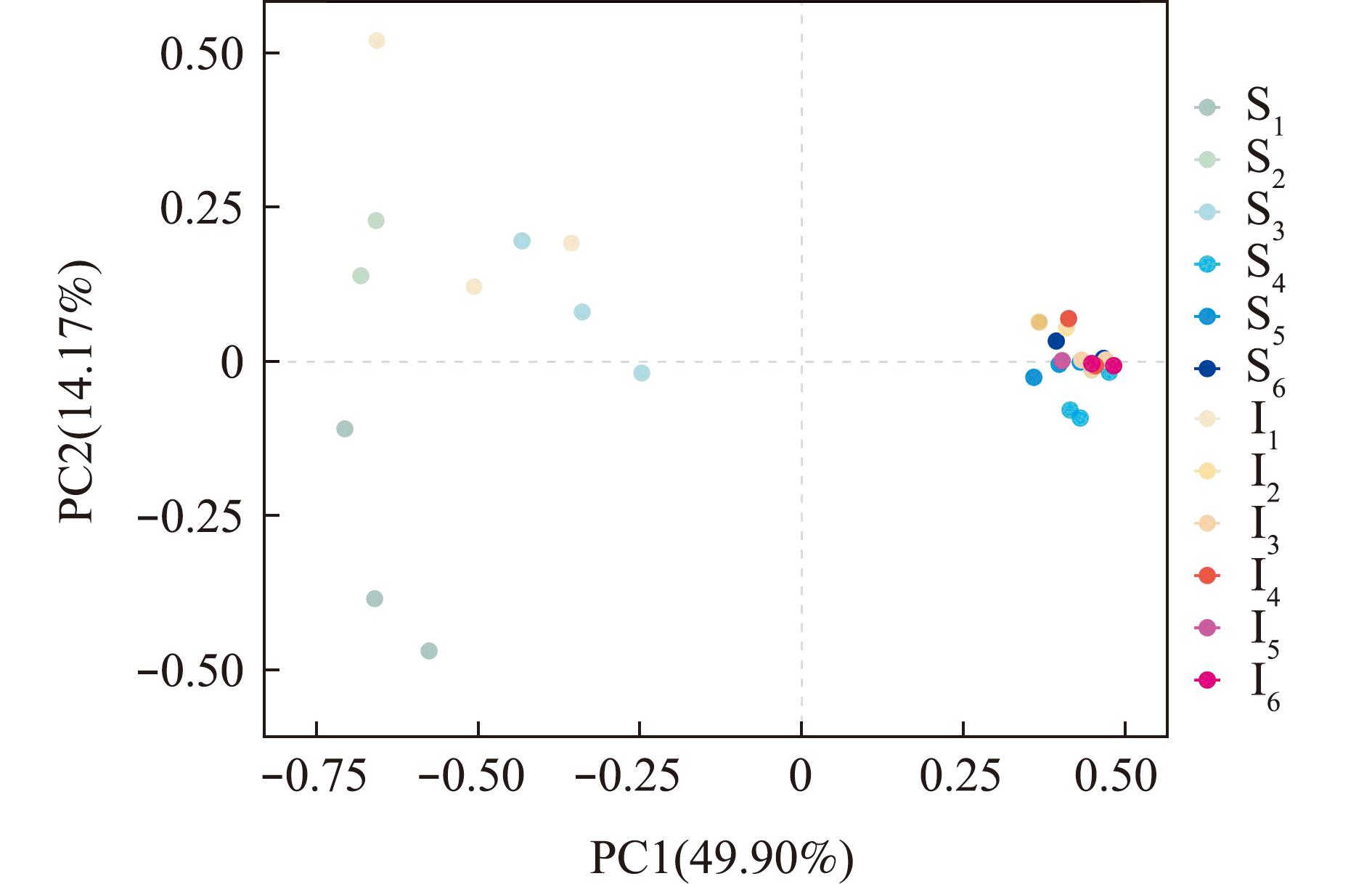
图2 池塘底泥和对虾肠道MCs厌氧降解菌群的主成分分析
Fig.2 Principle component analysis of MCs anaerobic degrading bacteria in pond sediment and shrimp intestine
3 讨论
3.1 MCs毒素蓄积对微生物多样性的影响
在蓝藻水华发生严重的自然水体中,水中溶解性MCs浓度通常保持在10 μg/L以下[23-24]。本研究中,7月和8月对虾养殖池塘水中溶解性MCs浓度分别为4.58、5.23 μg/L。因为残饵和粪便的影响,与非养殖水体相比[25-26],养殖水体MCs浓度相对偏高。MCs除了分布在水中,还可以通过化学混凝和絮凝[27],以及与黏土或颗粒物质共沉淀[28]等途径在底泥内蓄积。本研究中,7月和8月池塘底泥MCs浓度分别为0.31、0.58 μg/L,远高于其他淡水生态系统[29],但低于鲫养殖池塘[8]。肝胰腺是水产动物机体蓄积MCs的主要靶器官[8]。此外,肌肉中MCs含量与其食用安全性密切相关。本研究中养殖池塘对虾肝胰腺及肌肉中均检测到MCs,达到上市规格时其食用安全性有待评估。值得注意的是,与7月相比,8月上覆水和底泥样本中MCs含量均升高,其中底泥样本中MCs含量升高87%,8月对虾肝胰腺和肌肉中MCs含量亦升高,分别为7月MCs含量的9.5倍和2.5倍。与7月相比,8月底泥和对虾肠道微生物群落多样性下降。Lyu等[30]对比了非蓝藻水华和蓝藻水华期间铜锈环棱螺(Bellamya aeruginosa)肠道微生物群落结构,发现与非蓝藻水华期间相比,暴露于蓝藻水华的肠道菌群α多样性更低,且MCs为主要影响因子之一。对虾属于杂食性动物,吸收积累MCs主要是通过肠道实现,可以通过直接摄入蓝藻或含MCs的浮游动物及有机碎屑后在机体内蓄积MCs。与7月相比,8月对虾肝胰腺和肌肉中MCs含量显著升高,说明两次采样期间肠道摄入的MCs显著增加。8月池塘底泥中MCs含量升高及对虾肠道受MCs污染加剧可能是引起其微生物多样性下降的主要原因之一。
3.2 MCs厌氧降解菌群的降解性能及组成变化
以往关于MCs厌氧降解菌的研究多集中在单菌对MCs的厌氧降解能力。Enterobacter sp.YF3 对MC-LR降解速率为0.24 μg/d[31]。氨基酸降解厌氧菌ALA-1能够将4 mg/L MC-LR在10~19 d内降至检出限以下,且降解速度与温度有关[32]。本研究中连续多次富集底泥及对虾肠道厌氧菌群,日均降解量最大分别达到67.86、69.24 μg/d。除降解菌属差异外,接种密度、MC异构体类型及初始浓度差异均会影响降解能力,导致不同研究结果间缺乏可比性。已被发现的MCs厌氧降解菌多属于γ变形菌门[5,31,33-34]。无论池塘底泥还是对虾肠道选择富集获得的MCs厌氧降解复合菌群,Kosakonia均为主要优势菌属。Kosakonia属是最近由Enterobacter划分出来的新属[35],而Enterobacter YF3对MCs的降解不依赖mlr基因簇[31]。Kosakonia为主要优势菌属的MCs厌氧降解复合菌群可能以不依赖mlr基因的其他途径降解MCs。除Kosakonia外,富集菌群中亦存在已被鉴定的MCs降解菌属Sphingobium及Pseudomonas[36-38]。随着富集次数增加,池塘底泥和对虾肠道中MCs降解菌群对MCs降解率呈先升高后下降趋势,其中第5次富集时降解率最高。在第5次富集时,Sphingobium相对丰度升高,Kosakonia和Sphingobium对MCs可能产生协同降解作用。
4 结论
1)发生微囊藻水华的对虾养殖池塘上覆水、底泥及对虾体内存在MCs蓄积,经过选择性富集后,底泥和对虾肠道中菌群可高效降解MCs,说明对虾养殖池塘缺氧环境中存在MCs厌氧降解菌。
2)经过多次选择富集后,Kosakonia为第一优势菌属,底泥及对虾肠道中MCs厌氧降解菌群结构稳定,且菌群组成高度相似,说明在同一养殖水体的不同缺氧环境下存在相似的MCs厌氧降解菌。
3)对虾肠道中厌氧降解菌群可能是对虾应对MCs危害的主要防御策略之一。建议针对缺氧环境开发高效MCs降解复合菌剂或特异性MCs降解菌,通过生物降解途径有效减轻MCs对养殖对虾的危害。
[1] 李雅媛,张旺,刘兴国,等.凡纳滨对虾循环水养殖系统生物膜反硝化菌研究[J].水产科学,2024,43(5):775-783.
LI Y Y,ZHANG W,LIU X G,et al.Gdenitrifying microorganisms on suspended carrier biofilmina recirculating aquaculture system of Pacific White Shrimp Litopenaeus vannamei[J].Fisheries Science,2024,43(5):775-783.(in Chinese)
[2] 查广才,周昌清,牛晓光.铜绿微囊藻对凡纳滨对虾低盐度养殖的危害研究[J].中山大学学报(自然科学版),2007,46(2):64-67.
ZHA G C,ZHOU C Q,NIU X G.Harm of Microcystis aeruginosa to Litopenaeus vannamei low salinity stocking[J].Acta Scientiarum Naturalium Universitatis Sunyatseni(Natural Science Edition),2007,46(2):64-67.(in Chinese)
[3] 潘璠,江敏,吴昊,等.凡纳滨对虾养殖池塘及外河道的浮游植物群落结构变化[J].水产学报,2024,48(9):138-150.
PAN F,JIANG M,WU H,et al.Changes of phytoplankton community structure in Litopenaeus vannamei culture ponds and outer river[J].Journal of Fisheries of China,2024,48(9):138-150.(in Chinese)
[4] 毕相东.微囊藻毒素(MCs)对淡水池塘养殖业的危害及防控研究进展[J].大连海洋大学学报,2021,36(4):535-545.
BI X D.Research progress on the harm and control of microcystins (MCs) in freshwater pond aquaculture:a review[J].Journal of Dalian Ocean University,2021,36(4):535-545.(in Chinese)
[5] MASSEY I Y,YANG F,DING Z,et al.Exposure routes and health effects of microcystins on animals and humans:a mini-review[J].Toxicon,2018,151:156-162.
[6] SHEN R Y,CHEN Z H,DONG X N,et al.Biodegradation kinetics of microcystins-LR crude extract by Lysinibacillus boronitolerans strain CQ5[J].Annals of Microbiology,2019,69(12):1259-1266.
[7] WANG X,WANG X J,ZHAO J F,et al.An alternative to in situ photocatalytic degradation of microcystin-LR by worm-like N,P Co-doped TiO2/expanded graphite by carbon layer (NPT-EGC) floating composites[J].Applied Catalysis B:Environmental,2017,206:479-489.
[8] BI X D,DAI W,WANG X Y,et al.Microcystins distribution,bioaccumulation,and Microcystis genotype succession in a fish culture pond[J].Science of the Total Environment,2019,688:380-388.
[9] CHEN W,SONG L R,PENG L,et al.Reduction in microcystin concentrations in large and shallow lakes:Water and sediment-interface contributions[J].Water Research,2008,42(3):763-773.
[10] ZASTEPA A,PICK F R,BLAIS J M,et al.Analysis of intracellular and extracellular microcystin variants in sediments and pore waters by accelerated solvent extraction and high performance liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2015,872:26-34.
[11] ZHU F P,HAN Z L,DUAN J L,et al.A novel pathway for the anaerobic biotransformation of microcystin-LR using enrichment cultures[J].Environmental Pollution,2019,247:1064-1070.
[12] JONES G J,BOURNE D G,BLAKELEY R L,et al.Degradation of the cyanobacterial hepatotoxin microcystin by aquatic bacteria[J].Natural Toxins,1994,2(4):228-235.
[13] WANG R,TAI Y P,WAN X,et al.Enhanced removal of Microcystis bloom and microcystin-LR using microcosm constructed wetlands with bioaugmentation of degrading bacteria[J].Chemosphere,2018,210:29-37.
[14] 杨静东,尹玉芬,胡梁斌,等.微生物菌群JSM004对微囊藻毒素的生物降解[J].农业环境科学学报,2009,28(8):1669-1675.
YANG J D,YIN Y F,HU L B,et al.Biodegradation of microcystins by indigenous mixed bacterial population JSM004[J].Journal of Agro-Environment Science,2009,28(8):1669-1675.(in Chinese)
[15] BOURNE D G,JONES G J,BLAKELEY R L,et al.Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR[J].Applied and Environmental Microbiology,1996,62(11):4086-4094.
[16] BOURNE D G,RIDDLES P,JONES G J,et al.Characterisation of a gene cluster involved in bacterial degradation of the cyanobacterial toxin microcystin LR[J].Environmental Toxicology,2001,16(6):523-534.
[17] DZIGA D,WASYLEWSKI M,SZETELA A,et al.Verification of the role of MlrC in microcystin biodegradation by studies using a heterologously expressed enzyme[J].Chemical Research in Toxicology,2012,25(6):1192-1194.
[18] DING Q,SONG X L,YUAN M X,et al.Multiple pathways for the anaerobic biodegradation of microcystin-LR in the enriched microbial communities from Lake Taihu[J].Environmental Pollution,2022,297:118787.
[19] CHEN X G,YANG X,YANG L L,et al.An effective pathway for the removal of microcystin LR via anoxic biodegradation in lake sediments[J].Water Research,2010,44(6):1884-1892.
[20] HOLST T,JØRGENSEN N O G,JØRGENSEN C,et al.Degradation of microcystin in sediments at oxic and anoxic,denitrifying conditions[J].Water Research,2003,37(19):4748-4760.
[21] TRUNG B,DAO T S,FAASSEN E,et al.Cyanobacterial blooms and microcystins in southern Vietnam[J].Toxins,2018,10(11):471.
[22] MUNYAKA P M,EISSA N,BERNSTEIN C N,et al.Antepartum antibiotic treatment increases offspring susceptibility to experimental colitis:a role of the gut microbiota[J].PLoS One,2015,10(11):e0142536.
[23] SONG L R,CHEN W,PENG L,et al.Distribution and bioaccumulation of microcystins in water columns:a systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay,Lake Taihu[J].Water Research,2007,41(13):2853-2864.
[24] TSUJI K,SETSUDA S,WATANUKI T,et al.Microcystin levels during 1992-95 for Lakes Sagami and tsukui-Japan[J].Natural Toxins,1996,4(4):189-194.
[25] ZHAO X,LIU Y,GUO Y M,et al.Meta-analysis reveals cyanotoxins risk across African inland waters[J].Journal of Hazardous Materials,2023,451:131160.
[26] MUTOTI M I,EDOKPAYI J N,MUTILENI N,et al.Cyanotoxins in groundwater;occurrence,potential sources,health impacts and knowledge gap for public health[J].Toxicon,2023,226:107077.
[27] DRIKAS M,CHOW C W K,HOUSE J,et al.Using coagulation,flocculation,and settling to remove toxic cyanobacteria[J].Journal - American Water Works Association,2001,93(2):100-111.
[28] PAN G,ZHANG M M,CHEN H,et al.Removal of cyanobacterial blooms in Taihu Lake using local soils.I.Equilibrium and kinetic screening on the flocculation of Microcystis aeruginosa using commercially available clays and minerals[J].Environmental Pollution,2006,141(2):195-200.
[29] CHENG C,STEINMAN A D,ZHANG K Y,et al.Risk assessment and identification of factors influencing the historical concentrations of microcystin in Lake Taihu,China[J].Journal of Environmental Sciences,2023,127:1-14.
[30] LYU T Y,ZHU J Y,YANG X M,et al.Responses of gut microbial community composition and function of the freshwater gastropod Bellamya aeruginosa to cyanobacterial bloom[J].Frontiers in Microbiology,2022,13:906278.
[31] HUANG F Y,FENG H,LI X Y,et al.Anaerobic degradation of microcystin-LR by an indigenous bacterial Enterobacter sp.YF3[J].Journal of Toxicology and Environmental Health,Part A,2019,82(21):1120-1128.
[32] BAO Z Y,WU Y.Biodegradation of microcystin-LR by an amino acid-degrading anaerobic bacterium[J].Desalination and Water Treatment,2016,57(2):870-880.
[33] SILVA F G,LOPES D D,HECTOR R E,et al.Microcystin-detoxifying recombinant Saccharomyces cerevisiae expressing the mlrA gene from Sphingosinicella microcystinivorans B9[J].Microorganisms,2023,11(3):575.
[34] MASSEY I Y,YANG F.A mini review on microcystins and bacterial degradation[J].Toxins,2020,12(4):268.
[35] GU C T,LI C Y,YANG L J,et al.Enterobacter xiangfangensis sp.nov.,isolated from Chinese traditional sourdough,and reclassification of Enterobacter sacchari Zhu et al.2013 as Kosakonia sacchari comb.nov[J].International Journal of Systematic and Evolutionary Microbiology,2014,64(8):2650-2656.
[36] KERTESZ M A,KAWASAKI A.Hydrocarbon-degrading sphingomonads:Sphingomonas,Sphingobium,Novosphingobium,and Sphingopyxis[M]//Handbook of Hydrocarbon and Lipid Microbiology.Berlin,Heidelberg:Springer Berlin Heidelberg,2010:1693-1705.
[37] KANG Y H,PARK C S,HAN M S.Pseudomonas aeruginosa UCBPP-PA14 a useful bacterium capable of lysing Microcystis aeruginosa cells and degrading microcystins[J].Journal of Applied Phycology,2012,24(6):1517-1525.
[38] LIU H F,YANG X M,YANG W,et al.Gut microbiota of freshwater gastropod (Bellamya aeruginosa) assist the adaptation of host to toxic cyanobacterial stress[J].Toxins,2023,15(4):252.