凡纳滨对虾(Litopenaeus vannamei)因其养殖周期短、适应性强、生长迅速、肉质鲜美而备受青睐,是中国海水养殖的主要品种。随着凡纳滨对虾养殖模式向高密度、集约化转变,病害频发成为限制对虾养殖业持续健康发展的主要因素。在对虾疾病中,超过80%由病毒、细菌和寄生虫等病原诱发[1]。早期对虾疾病的研究大多聚焦于单病原,研究人员不仅在分子层面深入探究单病原的致病机制,还开发出单病毒示踪技术。该技术的应用推动了水产动物病毒感染机制研究向着更加精准化和系统化方向发展[2]。然而,近期调查研究发现[3-7],在甲壳动物野生群体和养殖群体中,两种或两种以上病原共感染现象经常出现,这给甲壳动物疾病防治工作带来了更大的挑战。
共同感染是指宿主同时感染两种或两种以上的病原体,当动物体受到两种及两种以上病原感染时情况十分复杂,不同病原之间可能相互干扰、相互协同、相互叠加或者是一方主导等[8]。如凡纳滨对虾经投喂感染传染性皮下及造血组织坏死病毒(infectious hypodermal and haematopoietic necrosis virus,IHHNV)后,再进行对虾白斑综合征病毒(white spot syndrome virus,WSSV)攻毒可明显减缓WSSV引起的对虾死亡速度[5]。进一步研究发现,IHHNV和WSSV在对虾细胞膜上有共同的受体,对虾同时感染这种病毒时存在受体竞争作用,因此研究者认为这两种病原之间存在干扰机制[9]。
虾肝肠孢虫(enterocytozoon hepatopenaei,EHP)是引起对虾肝胰腺微孢子虫病(hepatopancreatic microsporidiosis,HPM)的原生生物病原,感染这种病原可导致对虾生长迟缓,饲料系数增加[10]。IHHNV是引起对虾患慢性矮小残缺综合征(runt deformity syndrome,RDS)的病毒病原,患病对虾规格参差不齐,外壳变形,附肢残缺,产量下降[11]。当对虾罹患这两种病原体时,都会给养殖者带来巨大的经济损失。在养殖生产中发现,感染EHP的对虾往往同时感染IHHNV。刘宝彬等[12]对天津某些地区凡纳滨对虾仔虾进行IHHNV和EHP荧光定量PCR检测时发现,IHHNV和EHP共感染率高达49%。Gao等[13]采用新建立的IHHNV和EHP进行双重PCR检测,对578个凡纳滨对虾样品的检测结果显示,大约45.8%的样品同时感染了EHP和IHHNV。当对虾同时感染IHHNV和EHP这两种异源病原体后,目前还未出现病原之间关系和相互作用机制的研究报道。
本研究中以同时感染IHHNV和EHP两种病原的凡纳滨对虾为研究对象,采用RNA测序技术,构建IHHNV和EHP共感染对虾的肝胰腺转录组文库,通过对感染更高浓度EHP和IHHNV的两组对虾进行转录组比较分析,明确了IHHNV和EHP的相互作用方式,探讨了凡纳滨对虾共感染IHHNV和EHP的致病机理,以期进一步增加对病原与宿主相互作用的认识。
1 材料与方法
1.1 材料
试验用凡纳滨对虾采自山东滨州无棣的患病对虾虾塘。先采用常规PCR方法对样本进行抽样检测,筛查WSSV、IHHNV和EHP。结果显示,患病对虾均未感染WSSV,感染情况为IHHNV、EHP单感染或共感染。将共感染的对虾于-80 ℃冰箱中保存,作为RNA测序的试验材料。
1.2 方法
1.2.1 样本分组 将试验用凡纳滨对虾用清水洗净擦干,冰上分离肝胰腺并置于洁净预冷的1.5 mL离心管中,液氮中冷冻保存。取1/3对虾肝胰腺采用本实验室建立的荧光定量PCR测定对虾感染IHHNV和EHP的载量。在共感染IHHNV和EHP的对虾中取3只感染EHP更严重的(载量≥108 copies/μL)对虾标记为EH组,3只感染IHHNV更严重的(载量≥108 copies/μL)对虾标记为IH组。
1.2.2 RNA提取 将标记为EH组和IH组的6只对虾肝胰腺自液氮中取出,在预冷的研钵中研磨成粉末状,参照Trizol试剂(Takara,9753 A)说明书,从试验对虾肝胰腺中提取总RNA。取1 μL RNA溶液利用超微量光度计评析RNA的质量,并经10 g/L琼脂糖凝电泳查验其完整性。最后将达试验要求的肝胰腺RNA保存于-80 ℃冰箱中。
1.2.3 cDNA文库构建及转录组测序 本研究委托上海欧易生物医学科技有限公司进行,经VAHTS Universal V6 RNA-seq Library Prep Kit构建测序文库,通过Illumina Novaseq 6000平台生成测序数据。
1.2.4 差异表达基因DEGs的筛选 以|log2(Fold Change)|>1且P value≤0.05作为基因的筛选标准,同时考虑基因的功能注释和生物学背景,以排除可能的假阳性结果。将序列与公共数据库进行比较,将pad j<0.05作为筛选显著性富集的标准,识别出真正具有差异表达的基因(differentially expressed genes,DEGs),并进行GO功能注释和KEGG通路分析。
1.2.5 荧光定量PCR验证差异基因表达水平 测序所用的RNA样品,经去除gDNA反转录试剂盒合成cDNA用于qRT-PCR反应的模板。所有独立样品均设置生物学复孔和技术复孔,采用比较Ct法(2-ΔΔCt)分析差异基因的相对表达量,以稳定的凡纳滨对虾的β-Actin(LOC113813020)内参基因进行校正,并利用SPSS 17.0软件计算qRT-PCR下机数据是否具有显著性差异。本文从EH vs IH组合中选择了免疫、代谢和生长相关等9个基因进行qRT-PCR检测。特异性引物由Primer 5.0软件设计,生工生物工程股份有限公司合成,引物序列见表1。配制20 μL的qRT-PCR反应体系:SYBR Green Taq HS Premix Ⅱ(AG 11719) 10 μL,cDNA模板0.4 μL,引物(F/R) 0.8 μL,ddH2O 8.8 μL。采用两步法设定qRT-PCR反应程序,95 ℃下预变性30 s;95 ℃下变性5 s,56 ℃下退火30 s,共进行40个循环。
表1 EH vs IH引物序列
Tab.1 Sequence list of EH vs IH primers

基因编码 geneID 功能注释 functionannotation 引物序列 (5'→3') primersequences (5'→3') 引物长度/bp primerlength 上调/下调 regulation LOC11380986 Triosephosphateisomerase-llike F:GTGATCGGGAACTGGAA- GA R: AGGACAGGTAGCAG- GAAGG 127 ↓ LOC113822637 MicrosomalglutathioneS-transferase1 F: CTTCTACTCTGCTCTC- CTG R: GTCGTTCATCTTCTCCT- TC 133 ↓ LOC113806643 Sepiapterinreductase F: AGGCAAAGCAG- GCAGAGAT R: CGAGGAAAAAACG- GAACGA 157 ↓ LOC113823539 Aminopeptidase F: GGGGAAAG- GACGAAGATAG R: CGGATACGACAGGTT- GAAG 123 ↑ LOC113800127 Heparan-alpha-glucosaminideN-acetyltransferase F: GGGATTAGCATCGTGGT- TA R: AGAGGGTCTTTTTCTT- GGG 193 ↑ LOC113818677 Putativegamma-butyrobetainedioxygenase-like F: GAGCAATGAGT- TCGGGGTC R: CGGTTAAGTGTTCGTG- GAG 111 ↑ LOC113812903 alpha-2-macroglobulin F: GCAAGAATGGCGGG- TAGAA R: ATCGTGAAGCAGCAGG- GAG 127 ↓ LOC113821812 G1/S-specificcyclin-D2 F: TGTACTGTGCTGAAGT- GCC R: CCAACATCCATCTGGT- GAC 195 ↑ LOC113825393 Hexokinase-1 F: TTAGGAGGGCGAAACT- TAC R: CTCACCAACAACAC- CAGGG 123 ↓ LOC113813020 β-Actin F:AGTAGCCGCCCTGGTTGT R: AGGATACCTCGCTT- GCTCT 183 —
2 结果与分析
2.1 凡纳滨对虾感染EHP和IHHNV的PCR检测
检测EHP所用引物序列为5′GCCTGAGAGATGGCTCCCACGT 3′(EHP510F)、5′GCGTACTATCCCCAGAGCCCGA 3′(EHP510R);检测IHHNV所用引物序列为5′CGGAACACAACCCGACTTTA 3′(IHHNV389F)、5′GGCCAAGACCAAAATACGAA 3′(IHHNV389R)[12]。通过普通PCR法检测凡纳滨对虾EHP和IHHNV感染情况,筛选出6个样本电泳结果如图1所示。样本1~3感染IHHNV浓度较高,感染EHP浓度较低;样本4~6感染EHP浓度较高,感染IHHNV浓度较低。

M—DL2000 DNA Marker;1~6—6只凡纳滨对虾样品;P—阳性对照;N—阴性对照。
M—DL2000 DNA Marker;1-6—6 DNA samples of shrimps;P—positive control;N—negative control.
图1 凡纳滨对虾感染EHP和IHHNV的PCR检测
Fig.1 PCR detection of EHP and IHHNV infection in Litopenaeus vannamei
2.2 检出基因数目统计
本研究中采用Illumina Novaseq 6000平台测序技术对共感染的6只凡纳滨对虾肝胰腺样本(EH1-3,IH1-3)进行了转录组测序,共获得数据总量共计42.11 G,产生了279 798 282 条clean reads。即平均每个独立样本的有效数据量为7.02 G,产生了46 633 047条clean reads。碱基质量的Q30分布范围为91.28%~93.75%,平均GC含量为50.30%,表明测序生成的数据具有较高的准确性可以支撑后续试验。
去除counts数在所有样本中都为0的基因后,检出基因数目为17 109条。
2.3 测序样本数据的相关性
生物学样品相关性热图可以用于评估DEGs的可靠性。如果生物学重复间的样品相关系数较高,那么热图中圆圈越大,差异表达基因的检测结果就更为可靠;反之,如果相关系数较低,那么热图中圆圈越小,差异表达基因的检测结果可能存在较大的不确定性。相关系数趋近于1时,样品间相似度提升,差异减小。从图2可见,6个样本的差异量都在0.90以上,其中EHP感染样本的相关系数最小值为0.94,IHHNV感染样本的相关系数最小值为0.92,表明生物学重复样本有效。
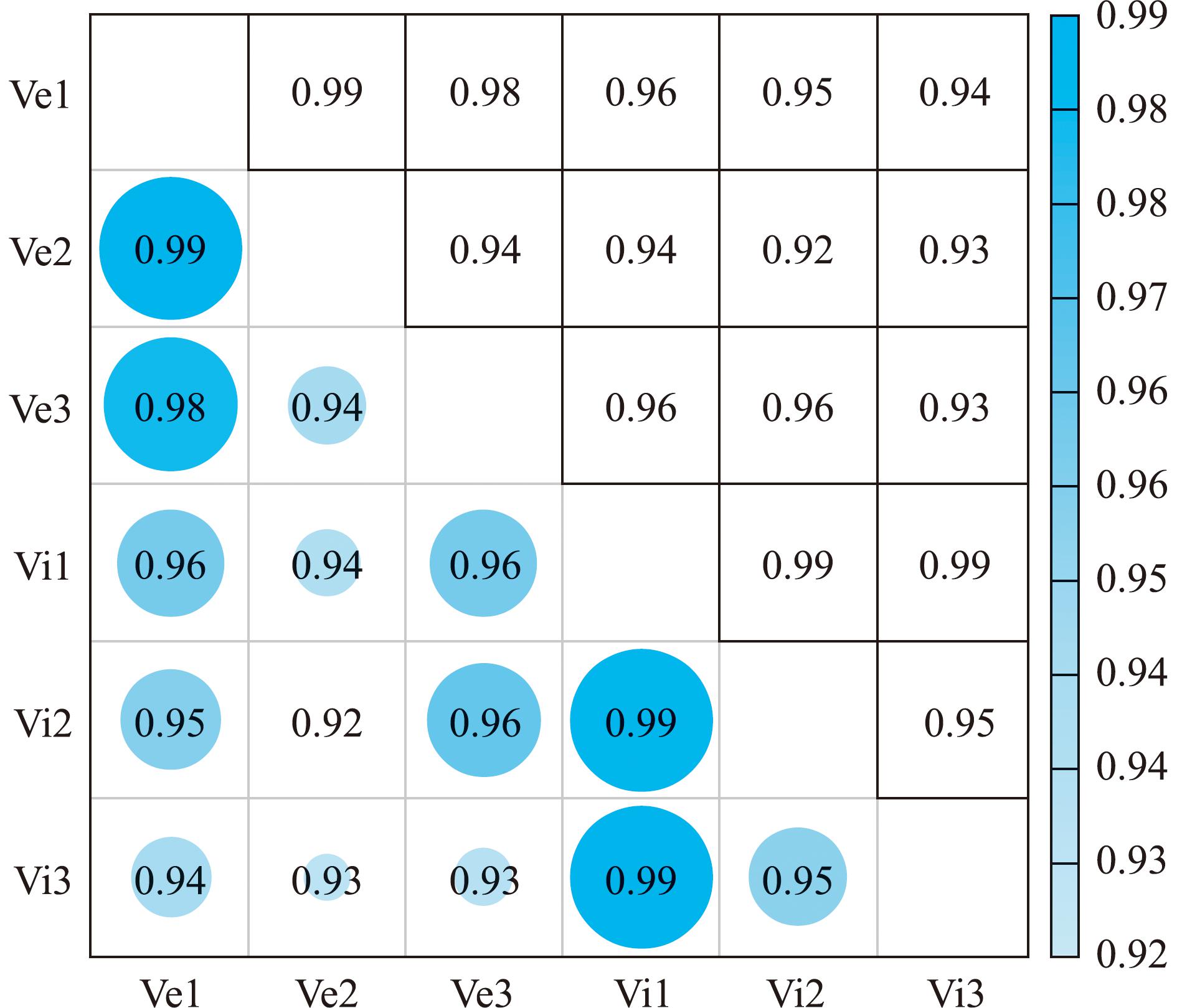
图2 样本间相关系数热图
Fig.2 Heat map of correlation coefficient between samples
2.4 差异表达基因的分析
为了了解差异基因的分布情况,绘制了EH组相对IH组的上调和下调基因火山图(图3)。火山图横坐标为基因表达倍数变化(log2FoldChange),纵坐标为基因表达改变量的幅度(lg q value)。火山图散点代表检测的对虾基因,灰色圆点表示非差异表达基因,红色圆点表示上调表达基因,蓝色圆点表示下调表达基因。以|log2FoldChange|>1.0且DESeq2 pad j<0.05为差异基因筛选标准,EH vs IH组差异基因总数619个,其中上调基因数243个,下调基因数376个(图3)。
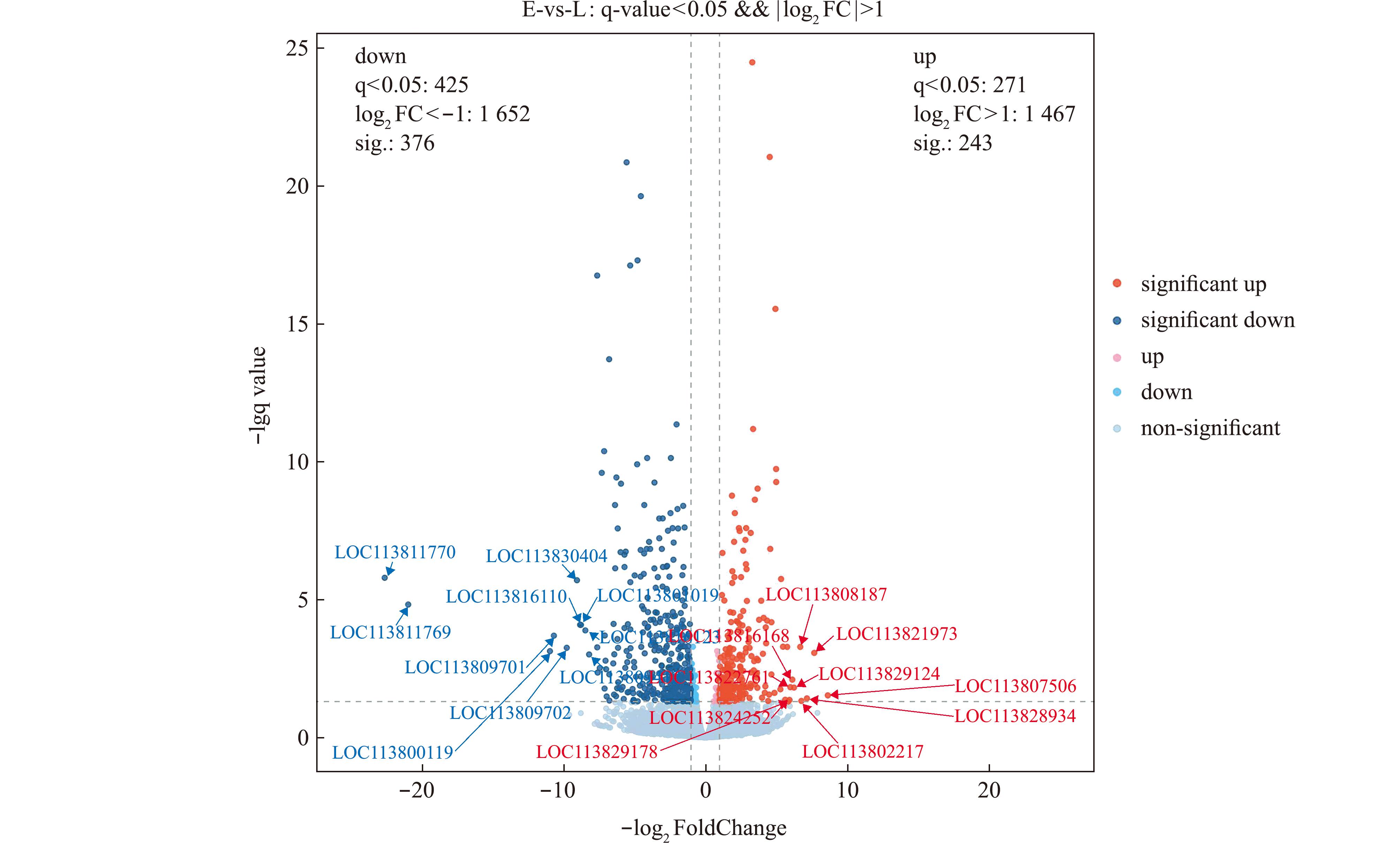
图3 差异表达基因火山图
Fig.3 Volcano map of differentially expressed genes
2.5 GO功能注释
基因本体论(gene ontology,GO)是一个国际标准化的基因功能分类体系,提供了一套动态更新的标准词汇表来全面描述生物体中基因和基因产物的属性。GO共有3个本体,分别描述基因参与的生物学过程(biological process,BP)、细胞组分(cellularcomponent,CC)及基因的分子功能(molecular function,MF)。本研究中通过GO功能共注释了1 672条单基因(unigenes),其中参与基因的分子功能1 037条单基因,占比62%;参与生物学过程382条单基因,占比22.8%;参与细胞组分253条单基因,占比15.1%。差异基因在BP、MF和CC水平上的富集前3位依次是:糖酵解、甘油三磷酸合成、糖异生;缝隙连接通道、磷酸丙糖异构酶、细胞外基质;缝隙连接、胞外区、细胞外空间(图4)。
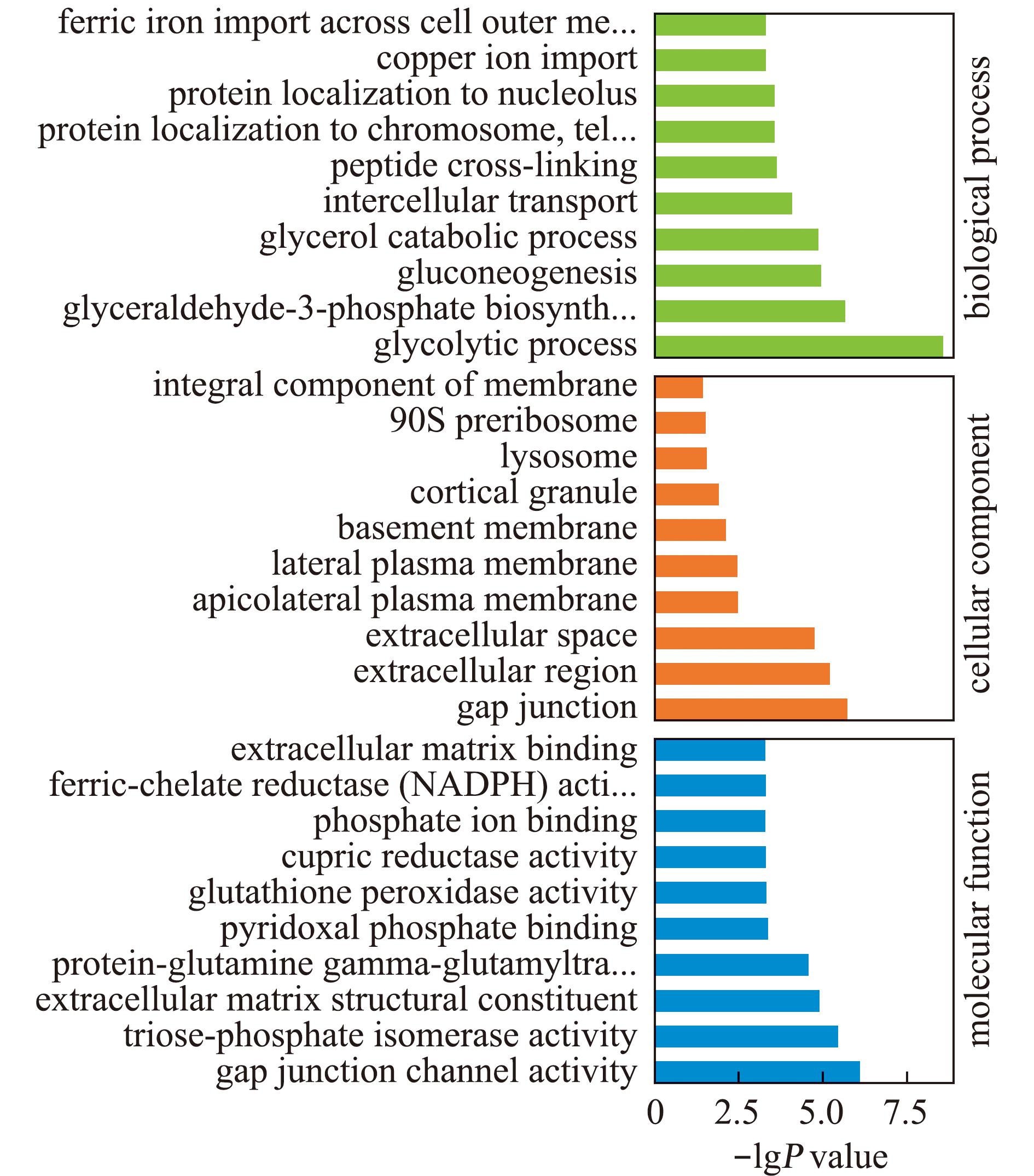
图4 EH vs IH组差异表达基因的GO富集分析(前30条)
Fig.4 Results of GO enrichment analysis in EH vs IH group(top 30 terms)
2.6 KEGG通路富集
KEGG是系统分析基因产物在细胞中的代谢途径及这些基因产物的功能数据库,可以进一步研究基因在生物学上的复杂行为,根据注释信息能进一步得到DEGs的通路注释。通过KEGG差异基因代谢通路分析,共有1 452条DEGs注释到相关信号通路中。DEGs的KEGG富集分析前20条通路如图5所示。气泡图横轴为富集分值,气泡大小反映了差异蛋白编码基因数,即气泡越大编码基因数越多,反之则少。气泡颜色由蓝至红渐变,代表P-value的降低,即显著度增强。图5(a)是EH vs IH组所有差异基因富集的前20通路,主要集中在代谢方面,如碳代谢、氨基酸生物合成、糖酵解和糖异生、果糖和甘露糖代谢、外源化合物代谢、花生四烯酸代谢等途径;图5(b)是EH vs IH组下调基因富集的前20条通路,下调基因富集通路同样主要集中在代谢方面,如碳代谢、氨基酸生物合成、糖酵解和糖异生、果糖和甘露糖代谢等途径;图5(c)是EH vs IH组上调基因富集的前20条通路,这些通路主要集中在代谢通路如谷胱甘肽代谢(glutathione metabolism)、花生四烯酸代谢(arachidonic acid metabolism)、蛋白质的消化和吸收(protein digestion and absorption),以及免疫通路如补体及凝血级联(complement and coagulation cascades)、PI3K-Akt信号通路、细胞外基质受体相互作用(ECM-receptor-interaction)、黏着斑、溶酶体(lysosome)、ABC转运蛋白(ABC transporters)等。
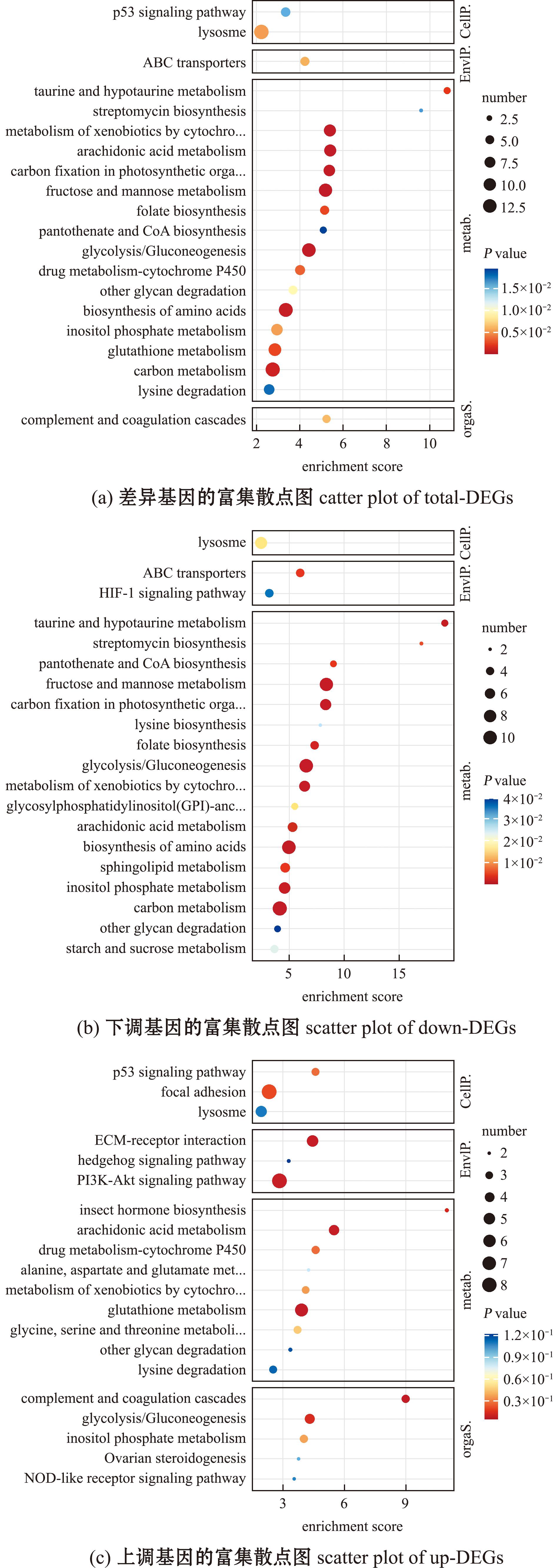
图5 EH vs IH组差异表达基因的KEGG通路富集散点图
Fig.5 KEGG enrichment scatter plot of DEGs in EH vs IH group
2.7 qPCR验证差异表达基因
为了验证DEGs在代谢、免疫、生长发育过程中的表达情况,本研究中采用荧光定量PCR技术对9个候选DEGs进行了测定。结果表明,荧光定量PCR结果与RNA-seq数据显著相关,二者在表达趋势上呈现出高度一致性(图6)。这充分验证了转录组测序结果的可靠性和准确性,为深入研究相关基因的功能及调控机制提供了有力支撑。
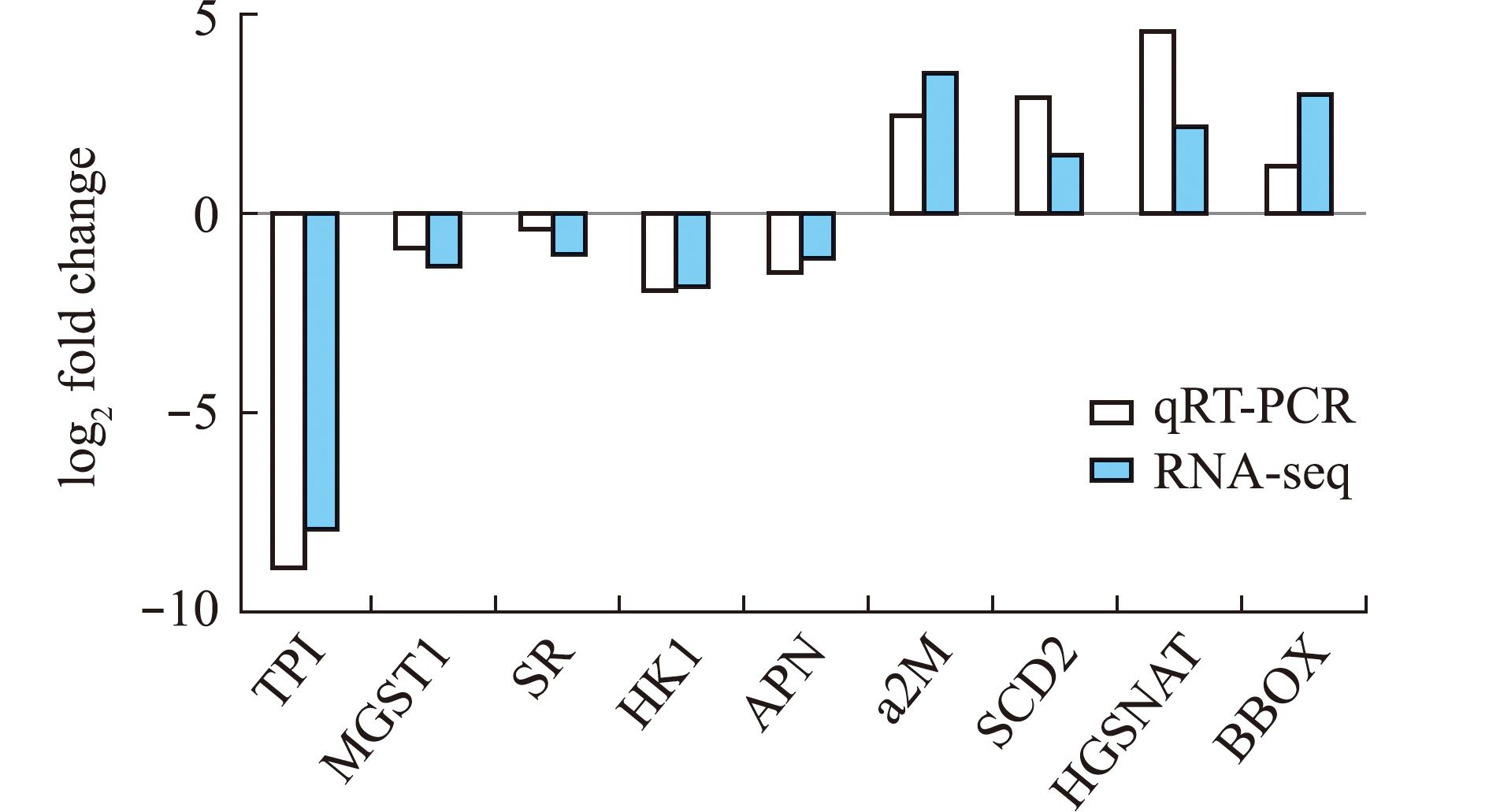
图6 qPCR验证差异表达基因
Fig.6 Validation of DEGs by qPCR
3 讨论
在对虾养殖行业中,IHHNV与EHP是两种广泛流行且危害极大的病原,凡纳滨对虾一旦感染,就会出现生长迟滞、规格参差不齐的状况。与此同时,饲料转化率降低,造成浪费,还会诱发多种次生性病害,给养殖户带来沉重的经济负担。在养殖生产中,IHHNV与EHP共同感染对虾的情况屡见不鲜,这让病害的防控工作愈发困难。
肝胰腺在对虾体内扮演着举足轻重的角色,它是对虾最大的消化道器官,负责食物的消化与营养摄取;作为主要的代谢器官,其还参与各类物质的合成与分解;肝胰腺还是免疫分子的主要发源地,可为对虾的免疫防御提供关键支持。然而,这一重要器官却是IHHNV和EHP的主要侵袭目标[14-15]。所以,当对虾遭遇这两种病原的双重攻击时,其营养吸收、代谢功能及免疫防御系统均会受到显著影响。
本研究中借助对共感染对虾肝胰腺的RNA转录组测序技术,分析了感染高浓度EHP(EH组)和IHHNV(IH组)对虾肝胰腺基因表达量的变化。试图借此揭示在共感染情形下两种病原的相互作用机制,以进一步探究对虾多病原感染的深层机理。这不仅有助于深化对这一复杂生物学过程的认识,更为制定针对性强、行之有效的防控策略奠定了基础,可推动对虾养殖产业的稳健发展。
3.1 KEGG通路分析
经KEGG通路分析可知,DEGs主要聚焦于糖酵解过程。在甲壳动物的生理活动中,糖酵解占据着极为重要的地位,它不仅是能量代谢不可或缺的关键环节,更是甲壳动物在低氧甚至无氧特殊生存环境下,能够持续获取能量,以保障自身存活及各项正常生理活动顺利进行的重要代谢途径。值得注意的是,糖酵解过程中关键酶的表达水平一旦受到干扰,将会直接对甲壳动物的产能过程及正常生理活动产生不利影响。Zhang等[16]的研究成果表明,当对虾感染白斑综合征病毒(WSSV)后,糖酵解的限速酶三磷酸异构酶(TPI)、关键酶己糖激酶(HK)及乳酸脱氢酶(LDH)的表达水平和酶活性均呈现增强态势。这种变化使得糖酵解过程加速,同时乳酸大量积累,而乳酸的积累又会促进组蛋白乳酸化,进而抑制对虾干扰素通路的激活,最终为病毒感染创造了有利条件。
在Yang等[17]和Cao等[18]的研究中,当凡纳滨对虾单独感染IHHNV或EHP时,糖酵解过程中关键酶基因的表达量均呈现出下调趋势。由此可见,动物个体在遭受不同病原侵染时,糖代谢通路会展现出不同的调控机制。在本试验针对EH vs IH组共感染的对虾研究中,发现TPI和HK的转录组显著下调。这一现象充分说明,在共感染的情况下,原生生物病原EHP对虾糖酵解途径的影响更为显著,进而对虾的糖代谢及产能过程也会受到相应影响。
此外,通过KEGG通路分析还发现,差异性基因在PI3K-Akt信号通路、ECM-receptor-interaction细胞外基质受体相互作用等途径也呈现出富集现象。其中,PI3K-Akt信号通路是细胞内一个至关重要的信号传导网络,多种细胞刺激或毒性损伤都能够激活该通路。在调控细胞的转录、翻译、增殖、生长及存活等基本功能方面,PI3K-Akt信号通路发挥着举足轻重的作用。而ECM-receptor-interaction细胞外基质受体相互作用,对于维持组织的完整性、推动伤口愈合、引导胚胎发育及决定细胞命运等诸多方面都有着极其关键的意义。不过,目前关于这些通路的研究大多集中在哺乳动物领域,在水生生物方面,尚未见到与之相关的报道。
3.2 免疫相关因子
海洋无脊椎动物缺乏后天获得的特异性免疫,它们只有先天性的非特异性免疫系统,能够识别并有效清除入侵的微生物和寄生虫等异物。补体及凝血级联系统作为一种非特异性免疫系统,在无脊椎动物免疫防御过程中发挥重要作用[19]。科研人员已在淡水螯虾(Pacifastacus leniusculus)[20]、凡纳滨对虾[21]及三疣梭子蟹(Portunus trituberculatus)[22]等物种的转录组分析中,成功鉴定出补体样分子,因此研究者认为,甲壳动物体内存在类似于脊椎动物的补体激活通路。
在本研究中,通过对差异表达基因(DEGs)展开KEGG通路富集分析,发现大量基因富集于补体及凝血级联通路,其中与该通路密切相关的补体样蛋白α2M的转录组呈现上调趋势。截至目前,虽然α2M在甲壳动物免疫过程中的详细分子作用机制尚未完全阐明,但众多研究已经证实,α2M基因表达水平的升高与动物免疫反应存在着紧密关联。如当弧菌或白斑综合征病毒感染中国明对虾后,会导致其血细胞中的α2M mRNA水平显著提高[23]。本研究进一步发现,相较于IH组,EH组的α2M基因转录呈上调趋势。这一结果表明,在共感染的情况下,EHP对该免疫通路活性的刺激更为显著。
MGST基因编码的是一种微粒体膜结合蛋白,该蛋白具有谷胱甘肽S-转移酶(GST)活性。在生物体应对氧化胁迫及细胞解毒过程中,MGST发挥着至关重要且不可替代的生物学功能[24]。目前,针对凡纳滨对虾[25]和珍珠牡蛎(Pinctada martensii)[26]的转录组研究显示,在逆境胁迫及病原感染所引发的氧化应激反应里,MGST基因转录组会出现上调现象。然而,本研究在共同感染试验中却得到了不同的结果,MGST基因转录组呈现出下调趋势。这一现象背后可能的原因是,当对虾受到两种及以上病原刺激时,部分免疫通路或许会受到抑制。
3.3 共感染机理
在水产养殖领域,共感染现象较为普遍。当两种同源病原混合感染水生生物时,它们之间可能会产生一定的干扰作用[13]。然而,当水生生物同时遭受两种不同源病原的侵袭时,这两种病原之间常常表现出协同作用。如在对大西洋鲑(Salmo salar)的研究中,科研人员对鲑鱼虱(Lepeophtheirus Salmonis)单独感染及鲑鱼虱和传染性鲑贫血病毒(infectious salmon anemia virus,ISAv)共感染的情况分别进行了转录组测序。结果显示,在共感染情况下,DEGs中显著上调的基因数量大幅增多。通过通路富集分析进一步发现,单独感染鲑鱼虱时,显著抑制了大西洋鲑的先天免疫系统;而联合感染时,却诱导了大西洋鲑强烈的免疫反应[27]。Lukman等[28]构建了罗非鱼湖病毒(tilapia lake virus,TiLV)和无乳链球菌(Streptococcus agalactiae)共感染红色杂交罗非鱼的模型。研究发现,共感染的致死率相较于单独感染上升了约30%。而且,在共感染状态下,鱼体除了呈现出两种病原单独感染时的典型大体病变外,还出现了更为严重的症状。据推测,这很可能是因为第一次感染引发了免疫抑制,从而为第二次病原体感染创造了有利条件,最终导致了更严重的组织损伤。在关于WSSV和副溶血性弧菌(Vibrio parahaemolyticus)共感染南美白对虾的研究中,也观察到了类似的协同效应。研究发现,先感染WSSV的对虾,在后续感染副溶血性弧菌后,死亡率明显升高,并且WSSV的感染症状相较于单独感染时更为严重。该研究的作者认为,这是由于WSSV和副溶血性弧菌具有相同的感染途径,副溶血性弧菌的二次感染增加了对虾对其他病原体的易感性[29]。
尽管目前已有大量关于水生生物混合感染的报道,但鉴于水生生物独特的生活习性和免疫特性,科研人员对于混合感染过程中病原之间及病原与宿主之间复杂的相互作用机制的研究仍处于不断探索的阶段。
4 结论
1)代谢影响。当凡纳滨对虾共感染不同剂量的EHP和IHHNV时,差异基因集中于糖酵解,共感染时EHP对糖酵解影响更显著,干扰对虾糖代谢与产能。
2)免疫响应。补体及凝血级联通路基因富集,α2M转录上调,EH组更明显,提示EHP对免疫通路刺激更强;MGST转录下调,或因多病原刺激抑制部分免疫通路。
3)共感染机制。水生生物不同源病原共感染常协同作用,但病原间及病原与宿主间的相互作用机制仍待深入研究。
[1] FLEGEL T W.Historic emergence,impact and current status of shrimp pathogens in Asia[J].Journal of Invertebrate Pathology,2012,110(2):166-173.
[2] 秦启伟.单病毒示踪技术在病毒侵染机制及水生动物病毒研究中的应用进展[J].大连海洋大学学报,2021,36(6):899-909.
QIN Q W.Application of single-virus tracking technology on study of virus infection in live cells:a review[J].Journal of Dalian Ocean University,2021,36(6):899-909.(in Chinese)
[3] 王博雅,王力,刘美如,等.凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析[J].大连海洋大学学报,2017,32(2):150-154.
WANG B Y,WANG L,LIU M R,et al.Epidemiological investigation of three major viruses and Enterocytozoon hepatopenaei(EHP) in Pacific white leg shrimp Litopenaeus vannamei in Liaoning Province[J].Journal of Dalian Ocean University,2017,32(2):150-154.(in Chinese)
[4] CHAYABURAKUL K,NASH G,PRATANPIPAT P,et al.Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand[J].Diseases of Aquatic Organisms,2004,60(2):89-96.
[5] BONNICHON V,LIGHTNER D V,BONAMI J R.Viral interference betweeninfectious hypodermal and hematopoietic necrosis virus and white spot syndrome virus in Litopenaeus vannamei[J].Diseases of Aquatic Organisms,2006,72(2):179-184.
[6] 孙苗苗,陆波,伏光辉,等.海州湾海域野生甲壳动物病原携带调查[J].水产养殖,2023,44(10):34-39.
SUN M M,LU B,FU G H,et al.Investigation on pathogen of wild crustaceans in Haizhou Bay[J].Journal of Aquaculture,2023,44(10):34-39.(in Chinese)
[7] QIN JH,MENG F Z,WANG G H,et al.Coinfection with yellow head virus genotype 8 (YHV-8) and oriental wenrivirus 1 (OWV1) in wild Penaeus chinensis from the Yellow Sea[J].Viruses,2023,15(2):361.
[8] COX F E.Concomitant infections,parasites and immune responses[J].Parasitology,2001,122(Sup):S23-S38.
[9] YAN D C,HUANG J,YANG B,et al.Competition of infectious hypodermal andhaematopoietic necrosis virus (IHHNV) with white spot syndrome virus (WSSV) for binding to shrimp cellular membrane[J].Journal of Fish Diseases,2016,39(10):1225-1229.
[10] ARANGUREN CARO L F,ALGHAMDI F,DE BELDER K,et al.The effect of salinity on Enterocytozoon hepatopenaei infection in Penaeus vannamei under experimental conditions[J].BMC Veterinary Research,2021,17(1):65.
[11] RAI P,SAFEENA M P,KRABSETSVE K,et al.Genomics,molecular epidemiology and diagnostics of infectious hypodermal and hematopoietic necrosis virus[J].Indian Journal of Virology,2012,23(2):203-214.
[12] 刘宝彬,杨冰,吕秀旺,等.凡纳滨对虾(Litopenaeus vannamei)传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测[J].渔业科学进展,2017,38(2):158-166.
LIU B B,YANG B,LÜ X W,et al.Detection and quantification of infectious hypodermal and hematopoietic necrosis virus (IHHNV) and Enterocytozoon hepatopenaei (EHP) of Litopenaeus vannamei by real-time PCR[J].Progress in Fishery Sciences,2017,38(2):158-166.(in Chinese)
[13] GAO Y,CHEN C Y,CAO Z,et al.Development of a duplex PCR for the simultaneous detection of EHP and IHHNV and analysis of the correlation between these two pathogens[J].Journal of Invertebrate Pathology,2023,201:108013.
[14] HOU Z H,GAO Y,WANG J J,et al.Study of infectious hypodermal and hematopoietic necrosis virus (IHHNV) infection in different organs of Penaeus vannamei[J].Journal of Invertebrate Pathology,2023,199:107952.
[15] CHAIJARASPHONG T,MUNKONGWONGSIRI N,STENTIFORD G D,et al.The shrimp microsporidian Enterocytozoon hepatopenaei (EHP):biology,pathology,diagnostics and control[J].Journal of Invertebrate Pathology,2021,186:107458.
[16] ZHANG Y,ZHANG X B.Virus-induced histone lactylation promotes virus infection in crustacean[J].Advanced Science,2024,11(30):2401017.
[17] YANG N,XU J H,GAO Y,et al.Transcriptome analysis of IHHNV infection in Penaeus vannamei at different developmental stages[J].Fish &Shellfish Immunology,2022,127:329-339.
[18] CAO Z,CHEN C Y,WANG C X,et al.Enterocytozoon hepatopenaei (EHP) infection alters the metabolic processes and induces oxidative stress in Penaeus vannamei[J].Animals,2023,13(23):3661.
[19] 章跃陵,赵贤亮,严芳.无脊椎动物免疫分子的多态性[J].中国生物化学与分子生物学报,2010,26(3):209-214.
ZHANG Y L,ZHAO X L,YAN F.Polymorphisms of immune molecules in invertebrates[J].Chinese Journal of Biochemistry and Molecular Biology,2010,26(3):209-214.(in Chinese)
[20] WU C L,NOONIN C,JIRAVANICHPAISAL P,et al.An insect TEP in acrustacean is specific for cuticular tissues and involved in intestinal defense[J].Insect Biochemistry and Molecular Biology,2012,42(2):71-80.
[21] LI C Z,LI H Y,XIAO B,et al.Identification and functional analysis of a TEP gene from a crustacean reveals its transcriptional regulation mediated by NF-κB and JNK pathways and its broad protective roles against multiple pathogens[J].Developmental &Comparative Immunology,2017,70:45-58.
[22] 宁军号.三疣梭子蟹补体样分子结构及免疫功能研究[D].青岛:中国科学院大学(中国科学院海洋研究所),2019.
NING J H.Study on complement-like molecular structure and immune function of Portunus trituberculatus[D].Qingdao:Institute of Oceanology,Chinese Academy of Sciences,2019 (in Chinese).
[23] MA H M,WANG B,ZHANG J Q,et al.Multiple forms of alpha-2macroglobulin in shrimp Fenneropenaeus chinesis and their transcriptional response to WSSV or Vibrio pathogen infection[J].Developmental and Comparative Immunology,2010,34(6):677-684.
[24] JAKOBSSON P J,MANCINI J A,FORD-HUTCHINSON A W.Identification and characterization of a novel human microsomal glutathione S-transferase with leukotriene C4 synthase activity and significant sequence identity to 5-lipoxygenase-activating protein and leukotriene C4 synthase[J].Journal of Biological Chemistry,1996,271(36):22203-22210.
[25] 郑佩华,汪蕾,张秀霞,等.凡纳滨对虾微粒体谷胱甘肽硫转移酶3基因克隆及其功能分析[J].南方农业学报,2020,51(10):2311-2320.
ZHENG P H,WANG L,ZHANG X X,et al.Cloning and function analysis of microsomal glutathione transferase 3 gene (MGST3) from Litopenaeus vannamei[J].Journal of Southern Agriculture,2020,51(10):2311-2320.(in Chinese)
[26] CHEN J H,XIAO S,DENG Y W,et al.Cloning of a novel glutathioneS-transferase 3 (GST3) gene and expressionanalysis in pearl oyster,Pinctada martensii[J].Fish &Shellfish Immunology,2011,31(6):823-830.
[27] ZHONG L,CARVALHO L A,GAO S N,et al.Transcriptome analysis revealed immune responses in the kidney of Atlantic salmon (Salmo salar) co-infected with sea lice (Lepeophtheirus salmonis) and infectious salmon Anemia virus[J].Fish &Shellfish Immunology,2023,143:109210.
[28] LUKMAN B,ROSLINDAWANI M N,AZZAM-SAYUTI M,et al.Disease development in red hybrid Tilapia following single and co-infection with Tilapia lake virus and Streptococcus agalactiae[J].Aquaculture,2023,567:739251.
[29] HAN J E,KIM J E,JO H,et al.Increased susceptibility of white spot syndrome virus-exposed Penaeus vannamei to Vibrio parahaemolyticus causing acute hepatopancreatic necrosis disease[J].Aquaculture,2019,512:734333.