嗜水气单胞菌(Aeromonas hydrophila)是一种革兰氏阴性条件致病菌,广泛分布于自然界的各种水体中,能够引发人-鱼-畜共患病[1]。在水产养殖生态系统中,鱼类一旦感染嗜水气单胞菌,易引发一系列疾病。特别是在高温、高密度养殖环境及水质恶化等特定条件刺激下,该菌会产生一系列具有强大破坏力的致病毒力因子,如气胞溶素、溶血素、肠毒素、蛋白酶等。受感染的鱼类,病情较轻时仅表现为肠炎症状,严重时则会出现溶血、出血等症状,进而严重损害宿主的免疫反应,最终引发细菌性败血症,导致鱼类大量死亡[2-3]。近年来,在全球水产养殖行业中,由嗜水气单胞菌引发的细菌感染性疾病频繁暴发,给养殖户造成了巨大的经济损失。
在应对嗜水气单胞菌感染的传统治疗手段中,抗生素的使用一直占据主导地位。然而,随着抗生素的长期大量使用,抗生素耐药菌株不断涌现,这一现象已在全球范围内对公共卫生安全和生态环境构成了严峻威胁[4]。因此,迫切需要探索并开发新型、可持续的治疗方法,以有效代替抗生素,预防和控制细菌性感染的发生与传播。
百里香酚(thymol)是从百里香(Origanum vulgare)、牛至(Thymus mongolicus)等多种药用植物中提取出来的天然精油,具有天然的抗菌、抗炎、抗氧化等多重生物学特性[5]。作为饲料添加剂,百里香酚展现出强大的病原体抑制能力,能有效控制包括灰色葡萄球菌、黄曲霉、烟曲霉、大肠杆菌、耐甲氧西林金黄色葡萄球菌及各类真菌在内的多种病原体的生长与繁殖[6-7]。此外,在断奶仔猪的饲粮中添加抗生素一直是改善仔猪健康状况与生长性能的常用手段,但长期使用会不可避免地导致致病菌产生耐药性,同时极有可能破坏仔猪肠道菌群结构,进而降低仔猪免疫力[8]。已有研究表明,在仔猪饲粮中使用百里香酚替代抗生素,不仅可以显著改善仔猪的生长性能,有效缓解腹泻症状,还能显著减少肠道内致病菌的数量[9]。欧盟饲料添加剂和产品(FEEDAP)研究小组经过严格的评估后指出,在产蛋鸡饲料中添加百里香酚,蛋黄样品中百里香酚的残留量未超过定量限(20 μg/kg)。基于此,百里香酚被认定为一种安全、可靠的添加剂,并广泛应用于食品和饲料领域[10]。这无疑为当前全球范围内推行的“减抗替抗”行动提供了极具价值的研究思路与方向。
本研究中聚焦于探究百里香酚对嗜水气单胞菌的体外抑菌活性及其作用机制,通过系统地测定百里香酚的最低抑菌浓度(MIC)、最低杀菌浓度(MBC),深入分析细胞膜的通透性、菌体形态特征及群集运动能力等多个关键指标,全面深入地探究了百里香酚的抑菌机理。本研究旨在为天然成分的抑菌剂的开发与应用提供科学依据,推动水产养殖、饲料科学及公共卫生安全等相关领域的可持续发展。
1 材料与方法
1.1 材料
嗜水气单胞菌AH-221212,由上海海洋大学水生动物病原库鉴定保藏[11]。百里香酚购自立晟生物;脑心浸液肉汤(BHI)、琼脂糖来源于上海爱科坦生物科技有限公司;N-苯基-1-萘胺(NPN)购自上海麦克林生化科技股份有限公司;碘化丙啶(PI)染色液源于上海源叶生物科技有限公司。
1.2 方法
1.2.1 菌株活化 从-80 ℃超低温冰箱中取出保藏的嗜水气单胞菌,用接种环蘸取后,在BHI固体培养基上划线,置于30 ℃培养箱培养18 h。挑取单菌落,接种于脑心浸液肉汤培养基中,在30 ℃、180 r/min的摇床中震荡培养至对数期。将对数期菌液在4 ℃下以6 000 r/min离心10 min,弃上清,用生理盐水清洗菌体,再用适量生理盐水重悬,把菌悬液浓度OD600 nm值调至0.5备用。
1.2.2 MIC和MBC的测定 百里香酚对嗜水气单胞菌MIC的测定采用微量肉汤稀释法[12]。首先,称取2.0 g百里香酚溶解于二甲基亚砜(DMSO),加入1 L BHI液体培养基,配制成2 000 mg/L的百里香酚原液。随后,在96孔板中运用二倍稀释法构建浓度梯度,依次为1 000、500、250、125、62.5、31.25 mg/L,另设0 mg/L(仅含DMSO)对照组。每个浓度梯度均设置3个平行复孔,空白对照组仅含培养基,不添加药物与菌液。然后,用生理盐水将嗜水气单胞菌菌悬液调整至0.4~0.6麦氏浊度(MFC),而后吸取10 μL菌悬液,分别加入到含有不同浓度百里香酚溶液的孔中,30 ℃下培养18~24 h。用多功能酶标仪(Synergy H1,美国伯腾仪器有限公司)测定各孔培养液在600 nm波长处的吸光度(OD600 nm值)。通过比较各孔OD600 nm值,确定抑制嗜水气单胞菌生长的最低抑菌浓度,即MIC。
在确定MIC后,将对照组及浓度大于MIC的菌悬液分别涂布于BHI平板,30 ℃培养24 h。最终,将平板上无菌落生长的最低药物浓度确定为MBC。
1.2.3 时间-杀菌曲线 时间-杀菌曲线的绘制方法参照文献[13],并在此基础上进行了适当调整。具体操作如下:在多个50 mL离心管中,分别加入等体积但浓度不同的百里香酚溶液,其浓度梯度设置为0(对照组)、1/2、1、2 MIC。接着,向各离心管内加入等体积的菌悬液,使管内细菌的最终浓度为1.0×106 CFU/mL。将离心管放置于30 ℃、180 r/min摇床震荡培养。在培养过程中,于0、4、8、12、24、36、48 h,按顺序取出离心管,混匀后取等量样品,使用酶标仪(Synergy H1,美国伯腾仪器有限公司)测定样品的OD600 nm值。为保证数据的准确可靠,每项操作重复3次,取其均值。最后,根据所得数据绘制时间-杀菌曲线。
1.2.4 群集运动 在探究百里香酚对嗜水气单胞菌群集运动的影响时,试验参照了文献[14]的方法,并加以适当调整。具体步骤如下:首先,配制琼脂糖含量为0.5%的BHI半固体培养基,经121 ℃高温高压灭菌20 min。待培养基冷却至50 ℃时,在多个培养皿中,分别加入等体积但浓度不同的百里香酚溶液,随后迅速倒入等量BHI半固体培养基,充分混匀。待培养基凝固后,得到百里香酚终浓度分别为0(对照组)、1/4、1/2、1、2 MIC的BHI半固体培养基。接着,将嗜水气单胞菌菌液浓度调节至1.0×108 CFU/mL,吸取0.5 μL菌液,垂直滴加至半固体培养基中央位置。将培养皿置于30 ℃培养箱倒置培养24 h后,测量细菌的运动直径。每个浓度梯度设置3个平行样本,取平均值。
1.2.5 NPN摄取 在NPN摄取试验中,按照文献[15]方法制备样品。首先,取等量处于对数生长期的嗜水气单胞菌培养液,加入百里香酚溶液并充分混匀,使其终浓度达到1 MIC。随后,将菌液置于30 ℃、180 r/min的摇床震荡培养。分别于0(对照组)、20、40、80、120 min时取出菌液,混匀后取等量样品。接着,将采集到的样品进行离心处理,弃去上清液,再用生理盐水洗涤3次,重悬菌体,并调节菌液的OD600 nm值至0.5。接下来,在避光环境下,将185 μL菌悬液加到96孔黑色酶标板中,然后加入15 μL终浓度为0.5 mmol/L NPN溶液,混匀后在黑暗条件下孵育20 min。最后,用荧光酶标仪(Synergy H1,美国伯腾仪器有限公司)测定混合液在吸收峰355 nm、散射峰460 nm处的荧光强度。每个样品设3个重复试验,取平均值。NPN相对荧光强度计算公式为
NPN相对荧光强度(%)=
处理组荧光强度/对照组荧光强度×100%。
(1)
1.2.6 PI染色 在测定PI染料与核酸结合的相对荧光强度时,本试验参考了文献[16]的方法,并略作修改。首先,取等量处于对数生长期的嗜水气单胞菌培养液,向其中加入百里香酚溶液并混匀,确保百里香酚的终浓度达到1 MIC。随后,将菌液置于30 ℃、180 r/min摇床震荡培养。在培养过程中,分别于0(对照组)、20、40、80、120 min取出菌液,混匀后取等量样品。接着,将采集的样品进行离心处理,弃去上清液,用生理盐水对菌体洗涤3次后重新悬浮,并将菌液的OD600 nm值调节至0.5。之后,在避光环境下,取185 μL样品加入96孔黑色酶标板中,再加入15 μL终浓度为50 μg/mL的PI染液,混匀后在黑暗中孵育20 min。最后,使用多功能酶标仪(Synergy H1,美国伯腾仪器有限公司)测定荧光强度,设定激发波长为482 nm,发射波长为635 nm。每组试验设置3个重复,并取平均值。计算公式为
PI相对荧光强度(%)=
处理组荧光强度/对照组荧光强度×100%。
(2)
1.2.7 扫描电镜分析 为探究百里香酚作用于嗜水气单胞菌后对菌体微观形态的影响,本试验采用热场发射扫描电镜(日立SU5000,日立高新技术公司)进行观察。样品制备参照文献[17]的方法。首先,取处于对数期的菌液进行离心操作,弃上清液,用生理盐水对菌体洗涤3次,重悬菌体并将菌液的 OD600 nm值调节至0.5。随后,取等量上述菌悬液,加入百里香酚溶液并混匀,使百里香酚的终浓度分别为0(对照组)、1/2、1 MIC。将样品置于30 ℃、180 r/min摇床震荡培养2 h。之后,从各样本中取1.5 mL菌悬液进行离心,弃去上清液,加入2.5%戊二醛,置于4 ℃冰箱固定过夜。最后,用1×PBS缓冲液对固定后的样品洗涤3次,再依次使用30%、50%、70%、90%乙醇及无水乙醇进行分级脱水处理。完成脱水后,将样品滴加到盖玻片中央,用另一盖玻片缓慢覆盖样品,待其自然风干,此时样品便可用于扫描电镜观察。
1.2.8 细胞内容物渗漏 本试验参照文献[18]的方法。首先,将嗜水气单胞菌培养至对数生长期,随后在4 ℃下以8 000 r/min离心8 min,去除上清液。接着,用生理盐水对细胞进行洗涤,重悬细胞并将菌液的 OD600 nm值调节至0.5。然后,取等量的上述菌悬液,加入百里香酚溶液,配成百里香酚终浓度为0(对照组)、1/2、1、2、4 MIC的菌液。将上述菌液置于30 ℃、180 r/min摇床震荡培养。在培养过程中,分别在0、2、4、8 h时取出菌液,混匀后取等量菌悬液,再次在4 ℃条件下,以8 000 r/min离心8 min,收集上清液。最后,使用超微量核酸蛋白检测仪(NanoDrop,赛默飞世尔科技公司)测量上清液中蛋白质和核酸浓度。每组设置3个重复,取平均值。
1.3 数据处理
本研究中,试验数据均以3次重复测定的平均值±标准差(mean±S.D.)表示。利用SPSS 22.0软件中的One-way ANOVA和Tukey检验比较多组数据间的差异。显著性水平设置为0.05。
2 结果与分析
2.1 最低抑菌浓度和最低杀菌浓度
本研究采用微量稀释法测定百里香酚对嗜水气单胞菌的最低抑菌浓度,结果见表1。当百里香酚浓度≤62.5 mg/L时,嗜水气单胞菌呈正常生长繁殖状态,与空白对照组相比,二者并无显著性差异(P>0.05)。而当百里香酚浓度≥125 mg/L时,菌液的OD600 nm值与空白对照组一致,无显著性变化(P>0.05),这表明嗜水气单胞菌的生长已被完全抑制。由此,可判定百里香酚对嗜水气单胞菌的最低抑菌浓度为125 mg/L。
表1 百里香酚对嗜水气单胞菌的最低抑菌浓度
Tab.1 Minimum inhibitory concentration of thymol against Aeromonas hydrophila

百里香酚浓度thymolconcentration/ (mg·L-1) 空白对照 0 (DMSO) 31.25 62.5 125 250 500 1000 吸光度 (600nm)OD600nm 0.058 0.535 0.584 0.589 0.071 0.069 0.068 0.071
在进一步试验中,将各浓度组的菌液等量涂布于BHI平板上,24 h培养后观察菌落生长情况,结果如图1所示。具体而言,在百里香酚处理浓度为0~250 mg/L的4组样品中,BHI平板上均出现了明显的菌落生长现象(图1(a)~(d))。然而,当百里香酚处理浓度提升至500和1 000 mg/L时,对应的两组样品所涂布的平板上均未出现菌落生长迹象(图1(e)、(f))。据此试验现象,将百里香酚对嗜水气单胞菌的最低杀菌浓度判定为500 mg/L。综上试验结果表明,植物提取物百里香酚对嗜水气单胞菌的生长繁殖具有显著的抑制作用。
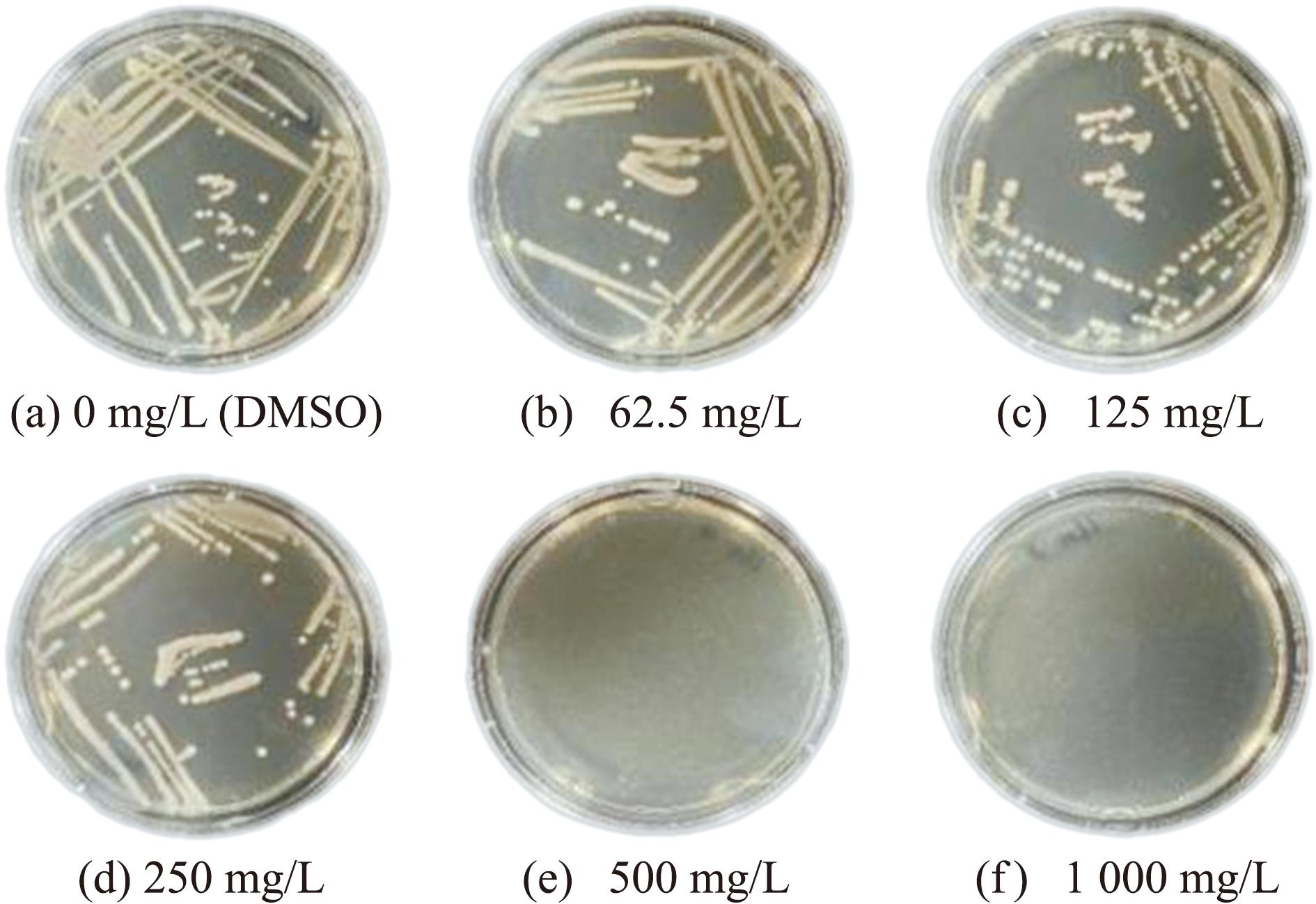
图1 百里香酚对嗜水气单胞菌最低杀菌浓度
Fig.1 MBC of thymol against Aeromonas hydrophila
2.2 百里香酚对嗜水气单胞菌的生长抑制作用
根据测定的MIC,本研究中深入探究了百里香酚对嗜水气单胞菌体外生长曲线的影响,结果如图2所示。从图2可见,在未添加百里香酚的空白对照组中,嗜水气单胞菌呈现出正常的生长繁殖趋势,其生长曲线走势与该菌的典型生长特征相符[19]。而在添加百里香酚的试验组中,不同浓度的百里香酚对嗜水气单胞菌生长产生了不同程度的影响。当百里香酚浓度为1/2 MIC时,嗜水气单胞菌的生长繁殖速率显著降低。在4~48 h的培养周期内,该处理组的菌液浓度(OD600 nm)与空白对照组相比,始终处于显著较低水平(P<0.05),这表明较低浓度的百里香酚已对嗜水气单胞菌的生长繁殖产生了明显的抑制作用。当百里香酚浓度提升至1 MIC时,嗜水气单胞菌的生长繁殖遭受到更为显著的抑制,细菌生长速度极为缓慢,整个培养阶段未出现典型的对数生长期,这意味着细菌的增殖过程受到严重阻滞。当百里香酚浓度达到2 MIC时,嗜水气单胞菌的生长被完全抑制,在整个观察时段内,菌液吸光度(OD600 nm)近乎维持在初始水平,几乎无任何增长迹象。综上结果,百里香酚对嗜水气单胞菌的抑制效果显著。在1 MIC浓度条件下,百里香酚能够在24 h内高效抑制该菌的生长,有效控制其增殖。
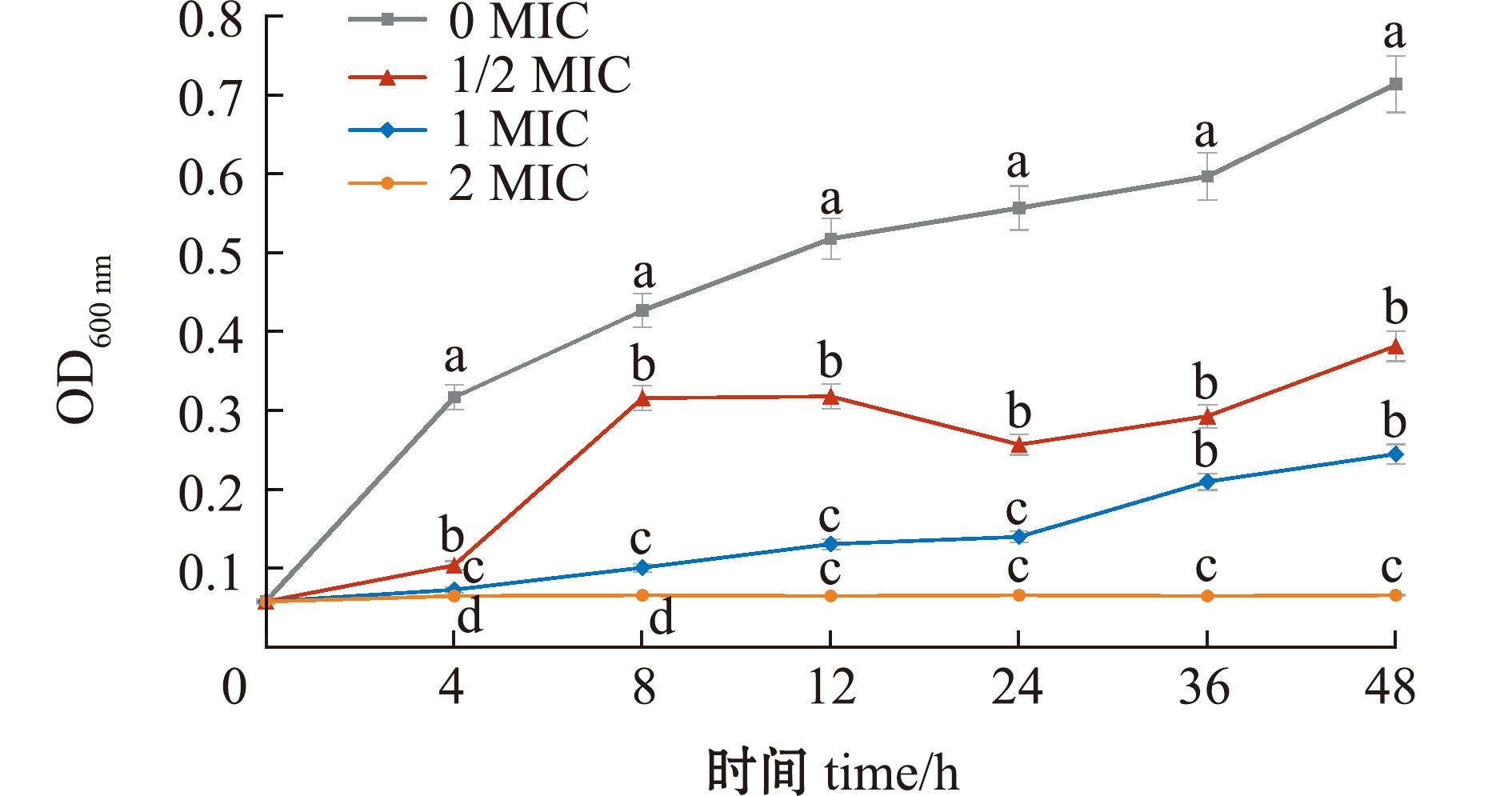
图2 添加百里香酚后嗜水气单胞菌的生长曲线
Fig.2 Effect of thymol on the growth curve of Aeromonas hydrophila
2.3 百里香酚对嗜水气单胞菌群集运动的影响
群集运动是细菌借助鞭毛和Ⅳ型菌毛(type Ⅳ pili,TFP),以群体形式在半固体表面进行的协调性共同运动,属于典型的协同运动模式[20]。这种运动方式有助于病原菌在宿主表面定植,进而对宿主造成损害[21]。已有研究证实,嗜水气单胞菌具有极地鞭毛和Ⅳ型菌毛,因而能够发生群集运动[22]。图3展示了不同浓度百里香酚对嗜水气单胞菌群集运动能力的影响状况。结果显示,与对照组相比,添加不同浓度的百里香酚均能对嗜水气单胞菌的群集能力产生抑制作用。具体而言,当百里香酚浓度分别为1/4、1/2、1 MIC时,细菌群集运动直径分别为对照组运动直径的85%、78%、40%。而当百里香酚浓度达到2 MIC时,培养基上已无细菌生长。这一结果与之前所观察到的百里香酚对嗜水气单胞菌生长曲线的影响结果高度一致。
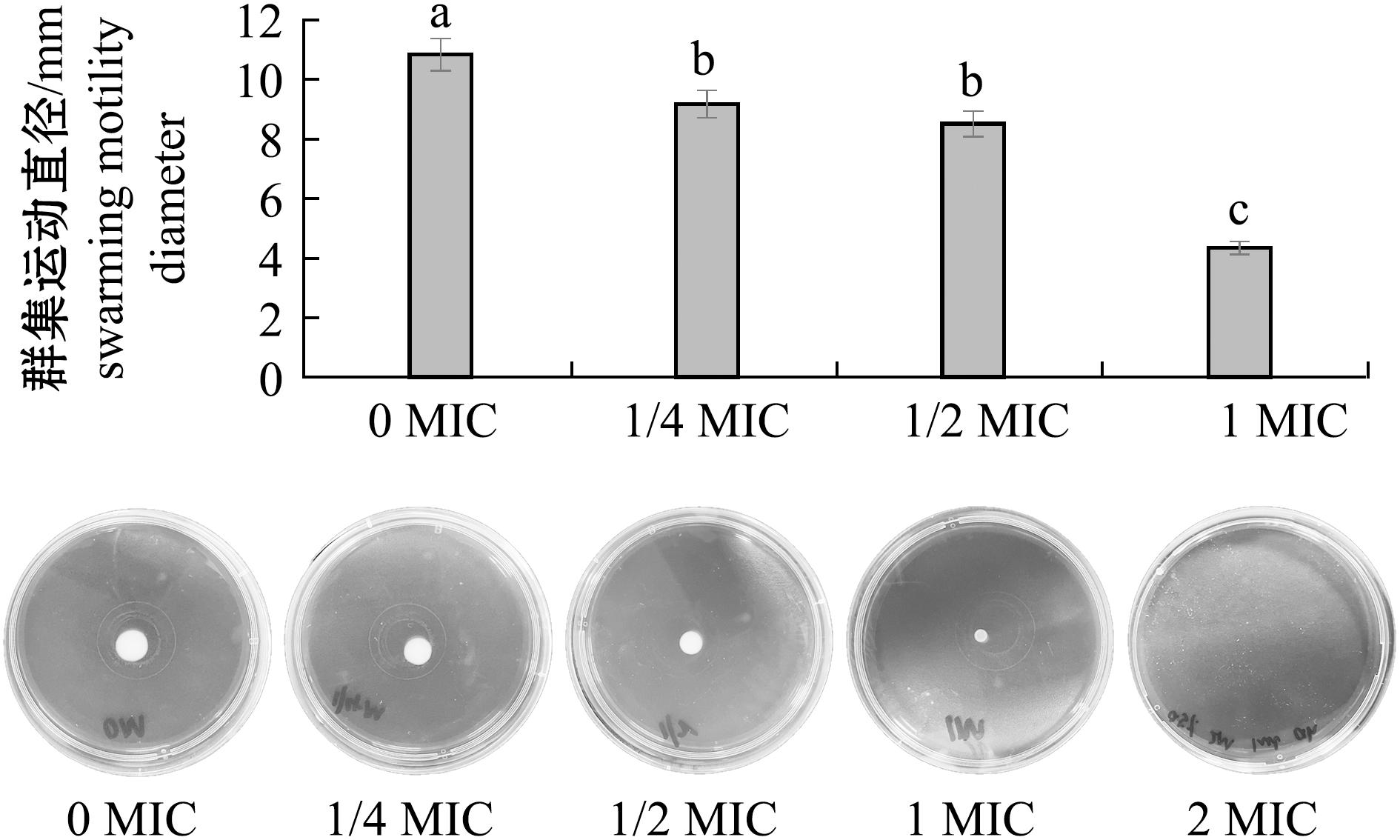
图3 百里香酚对嗜水气单胞菌的群集运动的抑制
Fig.3 Inhibitory activity of thymol on swarming motility of Aeromonas hydrophila
2.4 百里香酚对嗜水气单胞菌细胞外膜损伤的影响
革兰氏阴性菌的细胞包膜结构复杂,由质膜、肽聚糖细胞壁和外膜构成,其中,外膜对维持细胞强度起着关键作用[23]。正苯基萘胺(1-N-phenyl-naphtylamine;NPN)作为疏水性荧光探针,正常情况下会被完整的细菌细胞外膜排斥。但当外膜受损,NPN便能进入膜磷脂层,进而引发荧光增强现象,基于此特性,可利用 NPN来评估细菌外膜的损伤程度[24]。
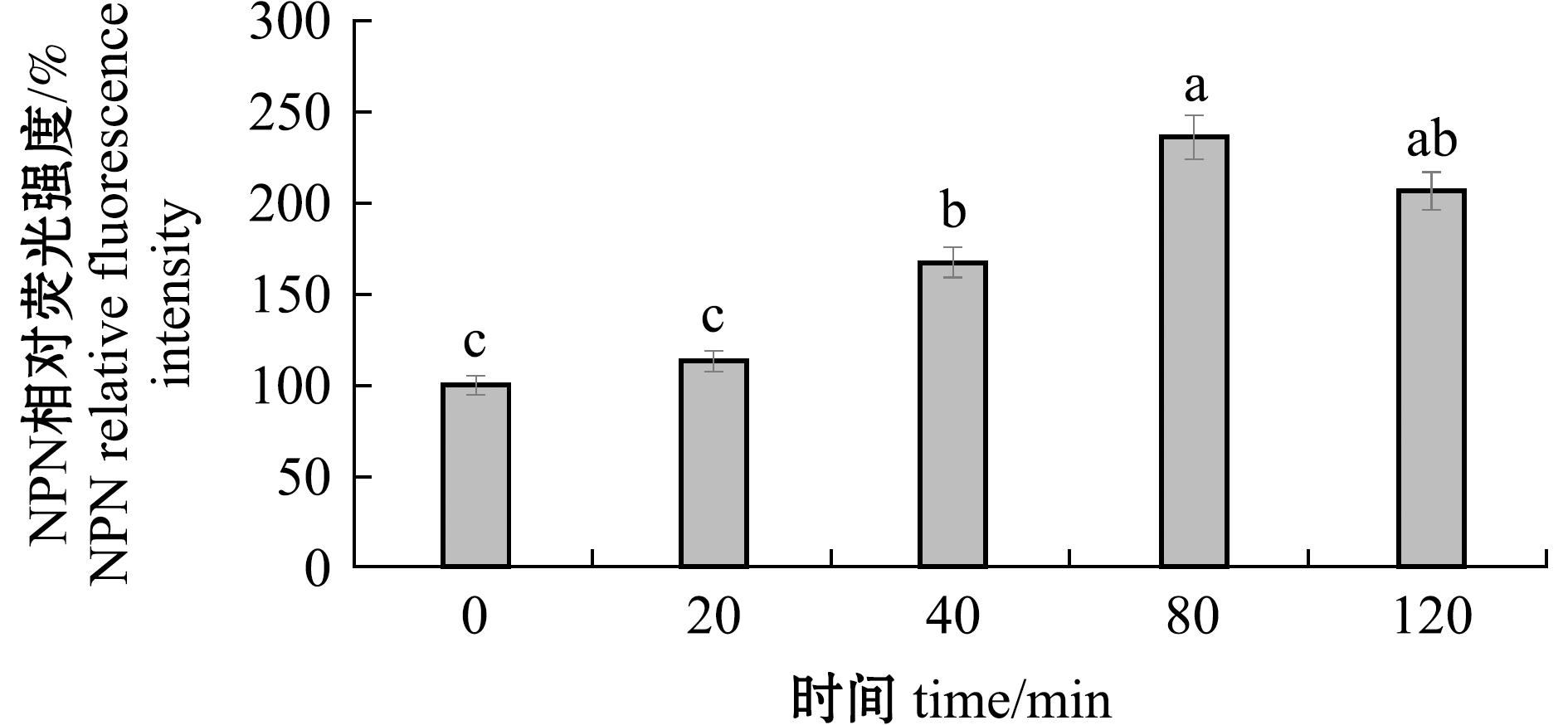
为探究百里香酚作用于嗜水气单胞菌后对其菌体外膜的破坏程度,运用多功能酶标仪,测定了细菌摄取NPN后的荧光强度变化,结果如图4所示,相较于对照组(0 min),当1 MIC浓度的百里香酚分别作用20、40、80、120 min后,处理组相对荧光强度分别为对照组的113%、167%、236%、206%。尤其在百里香酚作用80 min时,NPN荧光强度达到峰值,为对照组荧光强度的2.36倍。结果清晰地表明,经过百里香酚处理后,嗜水气单胞菌细胞外膜遭到一定程度的破坏,且外膜的破坏程度与百里香酚的作用时间呈现出正相关关系。
同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences in different group (P<0.05),and the means with the same letter are not significant differences(P>0.05),et sequentia.
图4 添加百里香酚后嗜水气单胞菌细胞的外膜通透性
Fig.4 Effect of thymol on extracellular membrane permeability of Aeromonas hydrophila
2.5 百里香酚对嗜水气单胞菌细胞质膜损伤的影响
细胞质膜作为维持细胞结构功能的关键要素,膜上众多成分在细胞间信号传导、物质交换及信息传递等重要生理过程中发挥着不可或缺的作用[25]。碘化丙啶(PI)因无法穿透完整的细胞膜,故而会被阻挡在活细胞外部。然而,一旦细胞膜出现破损,PI 便能够顺利穿过,进而与细胞内的DNA结合。当PI与核酸结合后,在特定的激发/发射波长条件下,会呈现出显著增强的荧光强度。基于此特性,可借助 PI来评估细胞内膜的损伤程度[26]。
为明确百里香酚作用于嗜水气单胞菌后对其菌体内膜的破坏程度,本研究借助多功能酶标仪,对PI荧光强度的变化展开测定。试验结果如图5所示,从图5可见,对于经1 MIC百里香酚处理的嗜水气单胞菌,随着处理时间的延长,PI相对荧光强度呈现出逐渐上升的趋势。与对照组(0 min)相比较,在百里香酚分别作用20、40、80、120 min后,1 MIC处理组的相对荧光强度分别达到对照组荧光强度的132%、164%、190%、207%。上述结果表明,经百里香酚处理后,嗜水气单胞菌细胞内膜的通透性显著增加,这意味着百里香酚对嗜水气单胞菌的内膜具有一定程度的破坏作用。
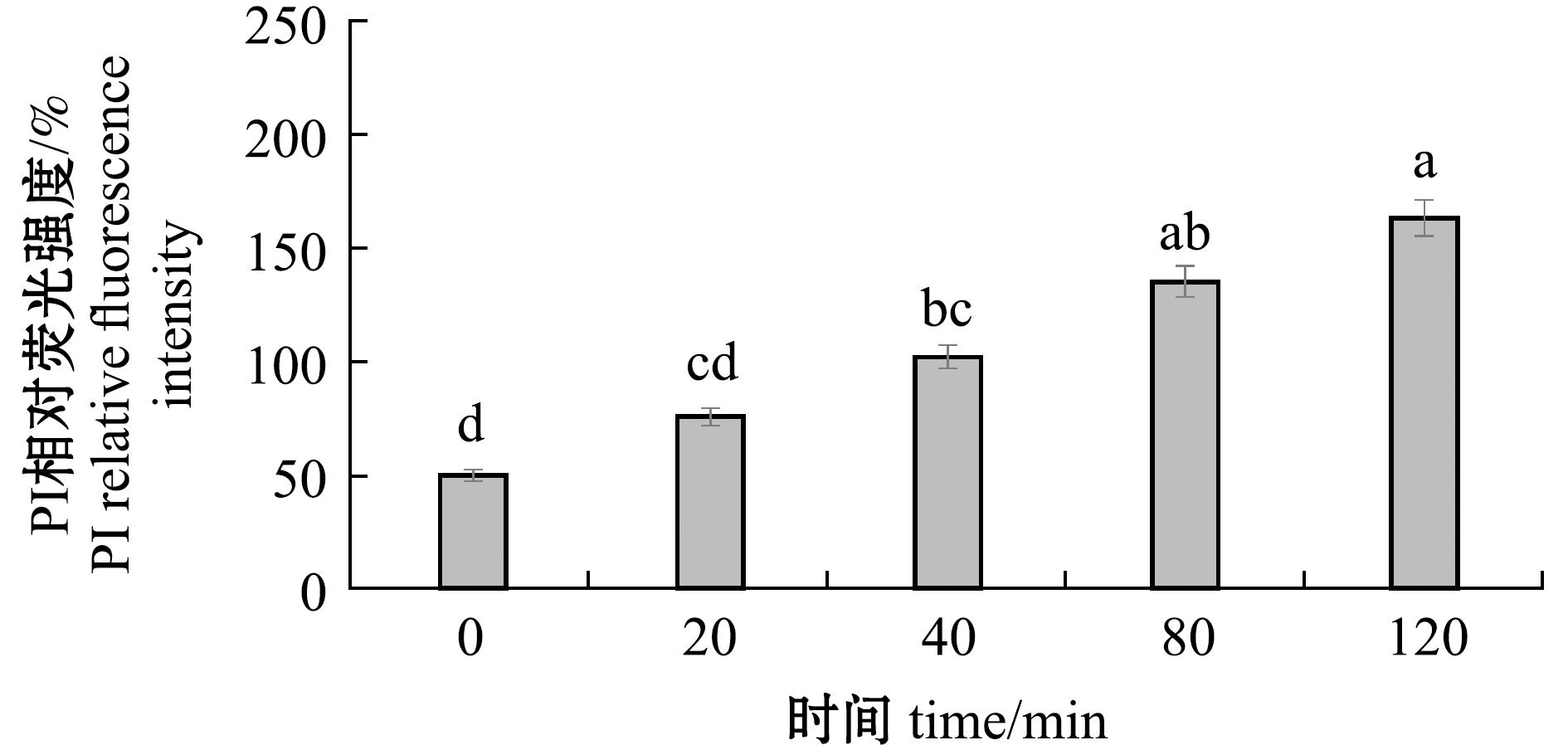
图5 百里香酚对嗜水气单胞菌细胞的内膜通透性的影响
Fig.5 Effect of thymol on cytoplasmic membrane permeability of Aeromonas hydrophila
2.6 百里香酚对嗜水气单胞菌微观形态的影响
为探究百里香酚对嗜水气单胞菌形态的影响,采用热场发射扫描电镜,对经百里香酚处理的嗜水气单胞菌进行观察,结果如图6所示,未经百里香酚处理的嗜水气单胞菌,菌体形态保持正常,细胞完整,既无破损迹象,也未出现明显塌陷(图6A)。而当采用1/2 MIC浓度的百里香酚处理后,嗜水气单胞菌的细胞表面出现了明显的塌陷情况,部分菌体表面甚至出现破裂(图6B)。进一步将百里香酚浓度提高至1 MIC时,嗜水气单胞菌的细胞壁遭到严重破坏,菌体形态结构改变,部分菌体严重破裂,产生大量细胞碎片(图6C)。通过扫描电镜的观察结果可知,百里香酚能破坏嗜水气单胞菌的菌体形态,进而实现杀菌效果。
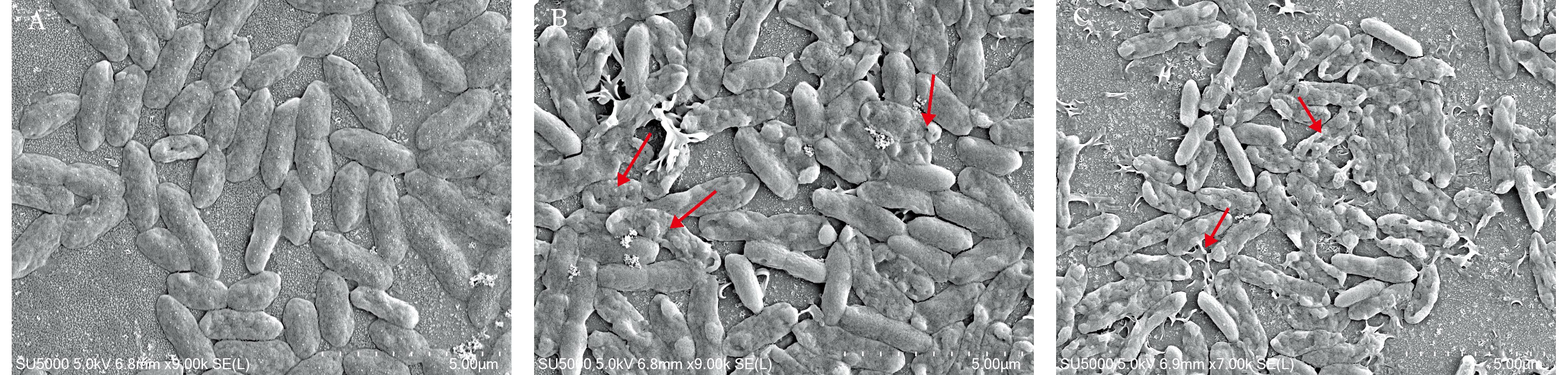
A—0 MIC;B—1/2 MIC;C—1 MIC
图6 百里香酚对嗜水气单胞菌细胞膜的微观形态的影响
Fig.6 Effect of thymol on the microscopic morphology of cell membranes of Aeromonas hydrophila
2.7 百里香酚对菌体细胞内容物泄露的影响
当菌体细胞膜受到破坏时,细胞内的蛋白质、核酸等大分子物质会发生泄漏。基于此,可将细胞内大分子物质的外泄浓度作为衡量细胞膜受损程度的重要依据[27]。本试验运用超微量核酸蛋白检测仪,测定了不同浓度百里香酚作用于嗜水气单胞菌后上清液中的蛋白质和核酸质量浓度,并以此判断细胞内大分子物质的外泄情况。试验结果如图7所示,在百里香酚作用下,上清液中蛋白质(图7(a))与DNA(图7(b))的浓度均呈现显著上升趋势(P<0.05)。同时,这些大分子物质的外泄浓度与百里香酚的作用时间及浓度均呈现明显的正相关关系。这表明,随着百里香酚作用时间的延长和浓度的增加,嗜水气单胞菌细胞膜的受损程度加剧,并导致更多细胞内大分子物质外泄。
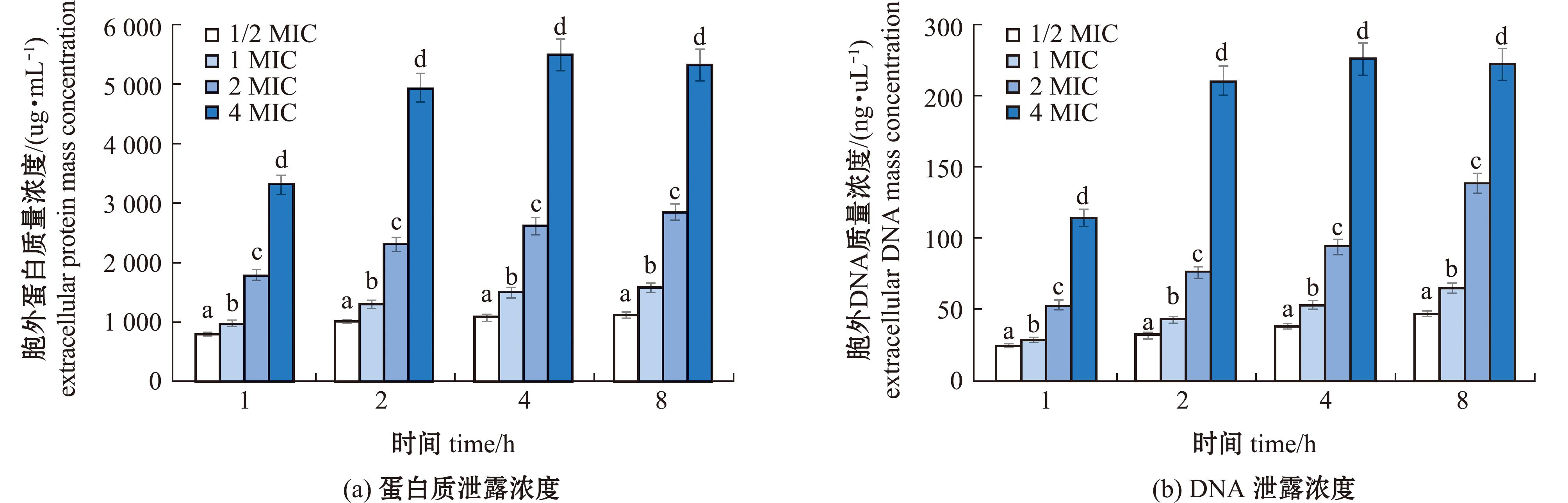
图7 百里香酚处理不同时间嗜水气单胞菌细胞内蛋白质和DNA泄露浓度
Fig.7 Thymol treatment with intracellular protein and nucleic acid leakage concentrations of Aeromonas hydrophila at different times
3 讨论
3.1 抗生素耐药危机下百里香酚的替代潜力
在抗生素问世前,细菌感染是致使生物体死亡的主要因素之一。抗生素被发现后,现代医学迎来了彻底变革[28]。抗生素在预防和治疗细菌感染、推动动物生长及保障人类健康等方面都产生了深远的影响。然而,随着抗生素的过度使用,一系列负面效应逐渐显现,细菌耐药性问题尤为突出[29]。因此,探寻全新治疗方案以攻克细菌耐药性难题已成为当务之急。
近年来,诸多研究表明,部分植物精油的有效成分具有一定的抗菌活性[30]。其中,百里香酚针对多种病原体的抗菌特性已得到广泛研究。其抑菌机制多元,包括改变细胞膜通透性、靶向铁蛋白诱导细菌铁死亡、干扰蛋白质代谢及干扰细菌正常二分裂等[31-33]。这为替代抗生素,进而控制病原菌传播和感染提供了新的研究方向。
3.2 百里香酚对嗜水气单胞菌的抑制活性
Kauser等[31]的研究指出,百里香酚针对白色念珠菌、热带念珠菌和光滑念珠菌,其最低抑菌浓度分别为32、63、125 mg/L,而最低杀菌浓度分别为64、110、240 mg/L。此外,Cai等[32]的研究表明,百里香酚对酸性脂环芽孢杆菌的最低抑菌浓度和最低杀菌浓度均为250 mg/L。在本研究中,百里香酚对嗜水气单胞菌的MIC为125 mg/L,MBC为500 mg/L。综合以上研究结果可见,百里香酚对多种病原体均展现出较强的抑制与杀灭能力。这表明百里香酚在抗菌领域具有广阔的研究价值与应用潜力,为应对不同病原体感染提供了新的方向。
3.3 百里香酚改变嗜水气单胞菌膜通透性和细胞形态
在本研究中,发现百里香酚能够破坏嗜水气单胞菌细胞膜,致使细胞内容物中的大分子物质如蛋白质和核酸泄露,从而实现杀菌效果。尤其是高浓度的百里香酚,甚至会严重破坏菌体细胞,产生大量的细胞碎片。研究表明,百里香酚能通过破坏细菌膜结构、改变菌体形态,实现对细菌的杀灭与生长抑制。这可能是因为百里香酚可与细胞膜脂质层的有效靶点相结合,增加膜的表面曲率,进而降低细胞膜的稳定性,最终导致细胞膜破裂[33]。如Li等[34]发现,百里香酚可使金黄色葡萄球菌的细胞膜去极化,造成细胞膜受损,细胞质中NADP+浓度上升,NADPH和ATP浓度降低。这一现象说明,百里香酚破坏金黄色葡萄球菌细胞膜后,细胞内容物的部分成分发生泄漏,使NADP+/NADPH浓度失衡。Wang等[35] 对鲁氏酵母的研究发现,经百里香酚作用后,其细胞膜通透性增强、膜超极化、膜完整性降低,细胞内ATP含量减少。同时,扫描电镜观察进一步证实,百里香酚作用于鲁氏酵母会导致细胞膜穿孔。另外,Tian等[36]在研究百里香酚对坂崎肠杆菌的作用机制时也证实,百里香酚能使细胞膜去极化、降低细胞内ATP浓度、扰乱细胞内稳态并破坏菌体外观形态。以上研究均证实,百里香酚能够作用于多种病原菌的细胞膜,可使细胞膜通透性增加、出现膜穿孔甚至膜破裂,并引发细胞内容物泄漏,最终致使细菌死亡。
3.4 百里香酚抑制嗜水气单胞菌生物膜的形成
细菌凭借鞭毛实现的运动性,与细菌的致病性密切相关,其运动形式主要有群集和泳动两种[37]。就嗜水气单胞菌而言,它拥有极鞭毛,能促使菌体进行泳动运动;同时具有侧鞭毛,可介导群集运动[38]。相关研究表明,细菌借助鞭毛展现出的运动能力与菌株生物膜的形成存在紧密联系。细菌生物膜属于一种多细胞结构,相当于一层坚固的防御屏障。相较于游离状态的菌株,形成生物被膜的菌株对抗生素具有更强的耐受性,这也是导致细菌耐药性问题产生的关键因素之一[39]。本试验中研究了百里香酚对嗜水气单胞菌群集能力的影响,结果显示,浓度为1 MIC的百里香酚能够显著抑制嗜水气单胞菌的群集能力,从而有效降低了病原菌形成生物膜后在宿主表面定植的风险。
4 结论
1)本研究中系统探讨了百里香酚对嗜水气单胞菌的抗菌效果及其作用机制。研究发现,百里香酚对嗜水气单胞菌展现出较强的抑制与杀灭能力,低至1/2 MIC浓度即可有效抑制该菌的生长,而在1 MIC浓度下,24 h内几乎能完全抑制嗜水气单胞菌的生长繁殖。
2)从作用机制来看,经百里香酚处理后,嗜水气单胞菌菌体形态发生显著变化,细胞表面出现塌陷、褶皱,并伴随膜穿孔现象;其细胞外膜及内膜结构完整性遭到破坏,导致细胞内大分子物质泄漏,进而影响细菌正常生理功能。此外,百里香酚能够显著降低嗜水气单胞菌群集运动能力,有效减少细菌生物被膜的形成,降低其在宿主表面定植的风险,从而削弱细菌的致病性。
3)本研究中从抑菌活性、细胞形态变化、膜通透性改变及致病性调控等多维度,深入探究了百里香酚对嗜水气单胞菌的作用效果,为进一步研究天然抗菌剂百里香酚替代抗生素用于控制致病菌感染提供了重要的理论依据,对推动绿色抗菌药物研发及水产养殖病害防控等领域的发展具有积极意义。
[1] TANHAY MANGOUDEHI H,ZAMANI H,SHAHANGIAN S S,et al.Effect of curcumin on the expression of ahyI/R quorum sensing genes and some associated phenotypes in pathogenic Aeromonas hydrophila fish isolates[J].World Journal of Microbiology &Biotechnology,2020,36(5):70.
[2] CHEN F Y,OUYANG X H,LIAO Z P,et al.Comprehensive transcriptomic,proteomic,and intestinal microbiota analyses of largemouth bass (Micropterus salmoides) intestines reveal new insights into immune responses to Aeromonas hydrophila infection[J].Fish &Shellfish Immunology,2025,156:110057.
[3] YU P H,SU L,LI B,et al.Selenomethionine alleviates Aeromonas hydrophila-induced oxidative stress and ferroptosis via the Nrf2/HO1/GPX4 pathway in grass carp[J].Fish &Shellfish Immunology,2024,154:109927.
[4] ZHANG Y L,QI X Z,LUO F,et al.Antibiotics combination exposure increases the resistance to Aeromonas hydrophila infection by improving the microbial network of zebrafish[J].Aquaculture,2024,593:741277.
[5] LUNA A,LEMA-ALBA R C,DAMBOLENA J S,et al.Thymol as natural antioxidant additive for poultry feed:oxidative stability improvement[J].Poultry Science,2017,96(9):3214-3220.
[6] ZHANG J Y,MENG X,ZHU X L,et al.Thymol induces Fenton-reaction-dependent ferroptosis in Vibrio parahemolyticus[J].Journal of Agricultural and Food Chemistry,2024,72(25):14337-14348.
[7] AHMED O M,GALALY S R,RASLAN M,et al.Thyme oil and thymol abrogate doxorubicin-induced nephrotoxicity and cardiotoxicity in Wistar rats via repression of oxidative stress and enhancement of antioxidant defense mechanisms[J].Biocell,2020,44(1):41-53.
[8] TEILLANT A,BROWER C H,LAXMINARAYAN R.Economics of antibiotic growth promoters in livestock[J].Annual Review of Resource Economics,2015,7:349-374.
[9] SILVA ![]() C D,MARTINS C C S,DIAS F T F,et al.The use of an alternative feed additive,containing benzoic acid,thymol,eugenol,and piperine,improved growth performance,nutrient and energy digestibility,and gut health in weaned piglets[J].Journal of Animal Science,2020,98(5):skaa119.
C D,MARTINS C C S,DIAS F T F,et al.The use of an alternative feed additive,containing benzoic acid,thymol,eugenol,and piperine,improved growth performance,nutrient and energy digestibility,and gut health in weaned piglets[J].Journal of Animal Science,2020,98(5):skaa119.
[10] BAMPIDIS V,AZIMONTI G,et al.Safety and efficacy of a feed additive consisting of a preparation of carvacrol,thymol,dcarvone,methyl salicylate and lmenthol (Biomin® DC-P) for all poultry species (Biomin GmbH)[J].EFSA Journal,2022,20(9):e07429.
[11] 王姝然,徐嘉楠,范厚勇,等.嗜水气单胞菌RPA-LFD快速检测方法的建立[J].水生生物学报,2024,48(5):849-858.
WANG S R,XU J N,FAN H Y,et al.Establishment of a method for rapid detection of Aeromonas hydrophila by recombinase polymerase amplification(rpa) combined with lateral flow strips(lfd)[J].Acta Hydrobiologica Sinica,2024,48(5):849-858.(in Chinese)
[12] ASHRAFUDOULLA M,MIZAN M F R,HA A J,et al.Antibacterial and antibiofilm mechanism of eugenol against antibiotic resistance Vibrio parahaemolyticus[J].Food Microbiology,2020,91:103500.
[13] 曾成容,刘馨,毕文文,等.丁酸钠对嗜水气单胞菌生长及毒力的影响[J].中国畜牧兽医,2023,50(7):2987-2997.
ZENG C R,LIU X,BI W W,et al.Effect of sodium butyrate on the growth and virulence of Aeromonas hydrophila[J].China Animal Husbandry &Veterinary Medicine,2023,50(7):2987-2997.(in Chinese)
[14] ROY P K,PARK S H,SONG M G,et al.Antimicrobial efficacy of quercetin against Vibrio parahaemolyticus biofilm on food surfaces and downregulation of virulence genes[J].Polymers,2022,14(18):3847.
[15] ALAKOMI H L,PUUPPONEN-PIMI R,AURA A M,et al.Weakening of Salmonella with selected microbial metabolites of berry-derived phenolic compounds and organic acids[J].Journal of Agricultural and Food Chemistry,2007,55(10):3905-3912.
R,AURA A M,et al.Weakening of Salmonella with selected microbial metabolites of berry-derived phenolic compounds and organic acids[J].Journal of Agricultural and Food Chemistry,2007,55(10):3905-3912.
[16] LIU X,ZHANG M L,MENG X,et al.Inactivation and membrane damage mechanism of slightly acidic electrolyzed water on Pseudomonas deceptionensis CM2[J].Molecules,2021,26(4):1012.
[17] LÜ X R,DU J F,JIE Y,et al.Purification and antibacterial mechanism of fish-borne bacteriocin and its application in shrimp (Penaeus vannamei) for inhibiting Vibrio parahaemolyticus[J].World Journal of Microbiology &Biotechnology,2017,33(8):156.
[18] 张文艳,李茂东,黄堃,等.青花椒提取物对金黄色葡萄球菌抑制作用研究[J].食品安全导刊,2023(11):118-121.
ZHANG W Y,LI M D,HUANG K,et al.Inhibitory effect of Zanthoxylum schinifolium extract on Staphylococcus aureus[J].China Food Safety Magazine,2023(11):118-121.(in Chinese)
[19] 毛宁,王志明,郑莺.嗜水气单胞菌与其拮抗菌R-15的生长曲线研究[J].福建师范大学学报(自然科学版),2008,24(1):82-85.
MAO N,WANG Z M,ZHENG Y.Study on growth curve of aeronionas hydrophila and its antagonistic bacteria[J].Journal of Fujian Normal University (Natural Science Edition),2008,24(1):82-85.(in Chinese)
[20] 张晨曦,刘鼎阔.细菌群集运动特性的研究进展[J].生物工程学报,2023,39(8):3188-3203.
ZHANG C X,LIU D K.Characterization of bacterial swarming motility:a review[J].Chinese Journal of Biotechnology,2023,39(8):3188-3203.(in Chinese)
[21] POZO F,BORBOR M,SOL RZANO R,et al.Optimized swarming motility assay to identify anti-virulence products against Vibrio parahaemolyticus,a pathogen of farmed shrimp[J].MethodsX,2024,12:102622.
RZANO R,et al.Optimized swarming motility assay to identify anti-virulence products against Vibrio parahaemolyticus,a pathogen of farmed shrimp[J].MethodsX,2024,12:102622.
[22] QIN T,CHEN K,XI B W,et al.In vitro antibiofilm activity of resveratrol against Aeromonas hydrophila[J].Antibiotics,2023,12(4):686.
[23] ROJAS E R,BILLINGS G,ODERMATT P D,et al.The outer membrane is an essential load-bearing element in Gram-negative bacteria[J].Nature,2018,559(7715):617-621.
[24] HELANDER I M,MATTILA-SANDHOLM T.Fluorometric assessment of gram-negative bacterial permeabilization[J].Journal of Applied Microbiology,2000,88(2):213-219.
[25] CASARES D,ESCRIB P V,ROSSELL
P V,ROSSELL C A.Membrane lipid composition:effect on membrane and organelle structure,function and compartmentalization and therapeutic avenues[J].International Journal of Molecular Sciences,2019,20(9):2167.
C A.Membrane lipid composition:effect on membrane and organelle structure,function and compartmentalization and therapeutic avenues[J].International Journal of Molecular Sciences,2019,20(9):2167.
[26] BERNEY M,HAMMES F,BOSSHARD F,et al.Assessment and interpretation of bacterial viability by using the LIVE/DEAD BacLight Kit in combination with flow cytometry[J].Applied and Environmental Microbiology,2007,73(10):3283-3290.
[27] LIANG C,HUANG S H,GENG Y,et al.AStudy onthe antibacterial mechanism of thymol against Aeromonas hydrophila in vitro[J].Aquaculture International,2022,30(1):115-129.
[28] AHMAD O,AHMED S,KHAN F,et al.Antibiotic resistant bacteria colonising microplastics in the aquatic environment:an emerging challenge[J].Discover Sustainability,2024,5(1):465.
[29] DOLKAR P,SHARMA M,MODEEL S,et al.Challenges and effective tracking down strategies of antibiotic contamination in aquatic ecosystem[J].Environmental Science and Pollution Research International,2024,31(44):55935-55957.
[30] AMBROSIO C M S,DE ALENCAR S M,DE SOUSA R L M,et al.Antimicrobial activity of several essential oils on pathogenic and beneficial bacteria[J].Industrial Crops and Products,2017,97:128-136.
[31] KAUSER S,RAJ N,AHMEDI S,et al.Mechanistic insight into the membrane disrupting properties of thymol in Candida species[J].The Microbe,2024,2:100045.
[32] CAI R,ZHANG M Q,CUI L,et al.Antibacterial activity and mechanism of thymol against Alicyclobacillus acidoterrestris vegetative cells and spores[J].LWT,2019,105:377-384.
[33] ZOU P F,LIU J,LI X Y,et al.A membrane curvature modulated lipopeptide to broadly combat multidrug-resistant bacterial pneumonia with low resistance risk[J].ACS Nano,2022,16(12):20545-20558.
[34] LI Q X,HUANG K X,PAN S,et al.Thymol disrupts cell homeostasis and inhibits the growth of Staphylococcus aureus[J].Contrast Media &Molecular Imaging,2022,2022:8743096.
[35] WANG H X,PENG Z H,SUN H M.Antifungal activities and mechanisms of trans-cinnamaldehyde and thymol against food-spoilage yeast Zygosaccharomyces rouxii[J].Journal of Food Science,2022,87(3):1197-1210.
[36] TIAN L,WANG X Y,LIU R J,et al.Antibacterial mechanism of thymol against Enterobacter sakazakii[J].Food Control,2021,123:107716.
[37] 李交昆,南美花,吴学玲,等.细菌鞭毛在生理活动中的作用[J].生命科学,2018,30(6):673-679.
LI J K,NAN M H,WU X L,et al.The functions of bacterial flagella in physiological activity[J].Chinese Bulletin of Life Sciences,2018,30(6):673-679.(in Chinese)
[38] KIROV S M,CASTRISIOS M,SHAW J G.Aeromonas flagella (polar and lateral) are enterocyte adhesins that contribute to biofilm formation on surfaces[J].Infection and Immunity,2004,72(4):1939-1945.
[39] SHREE P,SINGH C K,SODHI K K,et al.Biofilms:understanding the structure and contribution towards bacterial resistance in antibiotics[J].Medicine in Microecology,2023,16:100084.