趋化因子(chemokine)是一类相对分子质量仅为8 000~12 000的小分子细胞因子,在先天和适应性免疫中均发挥重要作用。趋化因子可通过结合位于细胞膜表面的趋化因子受体,激活并诱导淋巴细胞迁移参与机体抗感染、组织发育和血管生成等生物学过程[1]。同时,部分趋化因子成员具有不依赖于受体的直接抗感染作用,可直接结合并杀灭病原微生物,具有这样“双重作用”的趋化因子也被称为“kinocidin”[2]。
白介素-8(Interleukin-8,IL-8)是CXC型趋化因子家族成员,也被称为CXCL8[3]。哺乳类IL-8是一种kinocidin,其可通过受体CXCR1和CXCR2介导的信号通路,诱导中性粒细胞的定向趋化和激活[4-5],也可直接杀灭病原(如白色念珠菌),促进机体抗感染[2]。目前,IL-8在鱼类中已有广泛的研究,其趋化作用已在多种鱼类中被证实。如斑马鱼IL-8可趋化中性粒细胞移动至机体损伤部位[6];牙鲆IL-8可激活外周血白细胞,促进其趋化、增殖和吞噬,并诱导IL-1β、IL-6、TNF-α等炎症因子的表达[7]。在机制层面的分析发现,鱼类IL-8的趋化作用及对炎症因子的诱导调控均依赖于受体CXCR1/CXCR2介导的信号通路,这与哺乳类IL-8类似[6,8]。然而,关于鱼类IL-8直接抗感染作用的研究目前并不多见。在线鳢、虹鳟和大西洋鲑中发现,IL-8的C末端α螺旋区具有直接的抗菌活性[9-11],而IL-8完整蛋白的直接抗菌作用则在最新的两项研究中被发现,即尖吻鲈和牙鲆IL-8能够直接抑制或杀灭病原菌,然而其抗菌机制尚不清楚,有待进一步解析[7,12]。
鳜(Siniperca chuatsi),隶属鲈形目,是中国重要的淡水经济鱼类。随着鳜养殖规模的扩大,病害发生日渐频繁,严重影响鳜养殖业的健康发展[13-15]。因此,对鳜抗病免疫机理的研究具有重要的产业意义。鳜IL-8(SCIL-8)已被报道对头肾白细胞具有趋化能力,并能促进IL-1β等炎症因子的表达,在鱼体抗感染炎症反应中发挥作用[16]。然而,SCIL-8是否具有直接的病原杀伤作用,目前还不清楚。本研究中对鳜IL-8的理化性质和结构特征展开分析,并通过原核表达制备蛋白,检测了其对多种鱼类致病菌的直接抗菌作用,并探讨了相关抗菌机制,以期丰富对SCIL-8多样的抗感染方式的认识,为鳜病害防控提供科学参考。
1 材料与方法
1.1 材料
试验用鳜购自湖北省荆州市某养殖场。抗菌试验中使用的大肠杆菌(Escherichia coli ATCC11775)和金黄色葡萄球菌(Staphylococcus aureus ATCC6538)购自中国工业微生物菌种保藏管理中心,嗜水气单胞菌(Aeromonas hydrophila)、中间气单胞菌(Aeromonas media)和无乳链球菌(Streptococcus agalactiae)为本实验室保藏。
载体和试剂:总RNA提取使用TRIzol试剂盒,购自Invitrogen;cDNA合成使用反转录试剂盒HiScript Ⅲ 1st Strand cDNA Synthesis Kit,质粒构建使用ClonExpress Ultra One Step Cloning Kit,均购自南京诺唯赞公司;荧光定量PCR使用2×SYBR Green qPCR Mix试剂,购自山东思科捷公司;采用Ex Taq DNA聚合酶(TaKaRa公司)进行基因扩增;采用His-tag蛋白纯化磁珠(ATGCTM)进行蛋白纯化;采用BCA蛋白浓度测定试剂盒(索莱宝公司)测定蛋白浓度;碘化丙啶(propidium iodide,PI)和DiBAC4(3)探针均购自索莱宝公司。
1.2 方法
1.2.1 鳜IL-8的理化性质和结构分析 由于鳜IL-8序列已报道[16],根据已知信息,将其成熟肽区域进行净电荷和等电点预测(https://www.novopro.cn/tools/calc_peptide_property.html),并使用Swiss-model进行同源建模(https://swissmodel.expasy.org/),所得模型在Pymol软件中进行三维结构和表面电势展示。
1.2.2 鳜头肾白细胞的分离和LPS刺激 鳜头肾白细胞的分离方法参考笔者前期研究成果[17]。将所得细胞密度调整为5×106 cells/mL,种于12孔板(1 mL/孔),置于含5% CO2的28 ℃培养箱中。细胞静置培养2 h后,向孔内加入LPS(用PBS配置为母液)至终浓度为50 μg/mL,对照孔加入等体积PBS,静置培养6 h后用TRIzol试剂盒收样。
1.2.3 总RNA提取、cDNA制备和荧光定量检测 TRIzol试剂盒收取细胞后,按试剂盒说明书提取总RNA,采用NanoDrop仪器检测RNA浓度,并按照反转录试剂盒操作说明进行cDNA模板制备。合成SCIL-8的荧光定量引物(表1),根据2×SYBR Green qPCR Mix试剂操作说明进行荧光定量反应体系配置,并采用CFX96 Real-Time PCR Detection System仪器进行荧光定量检测。
表1 试验用引物序列
Tab.1 Primer sequence used in experiments

引物 primer 序列 (5'-3') primersequence (5'-3') 用途 application SCIL8qF ACCTCTATTGTGGTGCTCCTG 荧光定量 SCIL8qR CAGTGGGAGTTGGCAGGAAT 荧光定量 SCactinqF GAGAGGGAAATCGTGCGTGA 荧光定量 SCactinqR CATACCGAGGAAGGAAGGCTG 荧光定量 SCIL8hrF ATGGGTCGCGGATCCGAATTC- ATGAGCCTGAGAAGCCTGGG 质粒构建 SCIL8hrR CTCGAGTGCGGCCGCAAGC- TTTCAGCGTCTTTTGTTGGA 质粒构建
1.2.4 引物设计 根据鳜IL-8序列(JQ513375.1)及鳜β-actin序列(FJ436084.1),采用Primer Premier软件分别设计引物用于荧光定量检测(表1),其中,β-actin为内参。根据ClonExpress Ultra One Step Cloning Kit操作说明,设计原核表达重组质粒构建所需引物。
1.2.5 原核表达和蛋白纯化 按照Ex Taq DNA聚合酶说明书,使用SCIL8hrF/R引物(表1)扩增SCIL-8基因成熟肽区域。将所得片段纯化后,使用ClonExpress Ultra One Step Cloning Kit与pET-28a(+)载体连接,连接产物命名为pET-28a-SCIL-8。所得产物转化入DH5α感受态,PCR确定阳性克隆。从阳性克隆中提取重组质粒,转化入BL21感受态中,构建表达菌株,并进行测序验证。将验证正确的菌株用于目的蛋白表达和纯化,操作方法参考笔者已发表论文[18]。所得产物经聚丙烯酰胺凝胶电泳进行条带验证,BCA试剂盒测定蛋白浓度。
1.2.6 抑菌试验 将受试菌培养至对数生长期,另将SCIL-8蛋白(溶解于50 mmol/L的Tris缓冲液)进行梯度稀释。将5 μL菌液与45 μL梯度稀释的蛋白溶液混合,在所得的50 μL混合液中,细菌终浓度为105 CFU/mL,蛋白终浓度分别为4、8、16、32 μmol/L。对照组为5 μL菌液与45 μL Tris缓冲液的混合。混合液转移至96孔板,于酶标仪中检测600 nm处的吸光度值,作为初始吸光度。板子静置培养至对照孔有明显的细菌生长后,再次测定吸光度值,作为最终吸光度。细菌生长情况的计算公式为
细菌生长百分比![]()
(1)
1.2.7 流式试验 将受试菌培养至对数生长期,离心去除培养基,用Tris缓冲液重悬。取100 μL菌液与400 μL SCIL-8蛋白溶液(或BSA蛋白溶液,作为对照)混合,所得500 μL混合液中,细菌终浓度为108 CFU/mL,SCIL-8蛋白终浓度为16 μmol/L(BSA蛋白终浓度与SCIL-8的最终质量浓度相同)。混合液静置孵育2 h后,离心去除蛋白,分别使用碘化丙啶(终浓度为10 μmol/L;用于检测菌膜通透性)或膜电位探针DiBAC4(3)(终浓度为5 μmol/L;用于检测菌膜去极化)避光染色30 min。离心去除探针,500 μL PBS重悬菌体,流式检测染色情况,后使用Flowjo软件分析流式结果。
1.3 数据处理
试验结果以平均值±标准误(mean±S.E.)表示,采用SPSS 16.0软件进行独立样本T检验分析,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 鳜IL-8的结构与表达分析
鳜IL-8成熟肽净电荷含量(pH=7时)为+4.1,预测等电点为9.15,分子整体携带净正电荷,呈现“阳离子性”(cationicity)(图1A)。同源建模表明,鳜IL-8具有趋化因子的典型结构:N端为无规则卷曲,中间部分为3个反向平行β折叠,C端为α螺旋结构(图1A上排)。静电势预测发现,鳜IL-8的表面静电势分布不均匀,带正电荷的氨基酸残基主要分布于C端α螺旋区,少量分布于N端无规则卷曲部分,疏水性氨基酸残基主要分布于中部β折叠区,且正电荷和疏水性氨基酸残基分别聚集于分子表面两侧,使分子整体呈现“两亲性”(amphipathicity)(图1A下排)。值得注意的是,阳离子性和两亲性特征常见于抗菌肽,是抗菌肽对细菌菌膜破坏功能的结构基础[19]。鳜IL-8具有这两个特征,暗示其可能具有类似抗菌肽的直接抗菌活性。此外,使用LPS作用于鳜头肾白细胞,荧光定量检测发现,SCIL-8具有明显的表达上调(图1B),表明SCIL-8可能参与机体抗菌免疫。
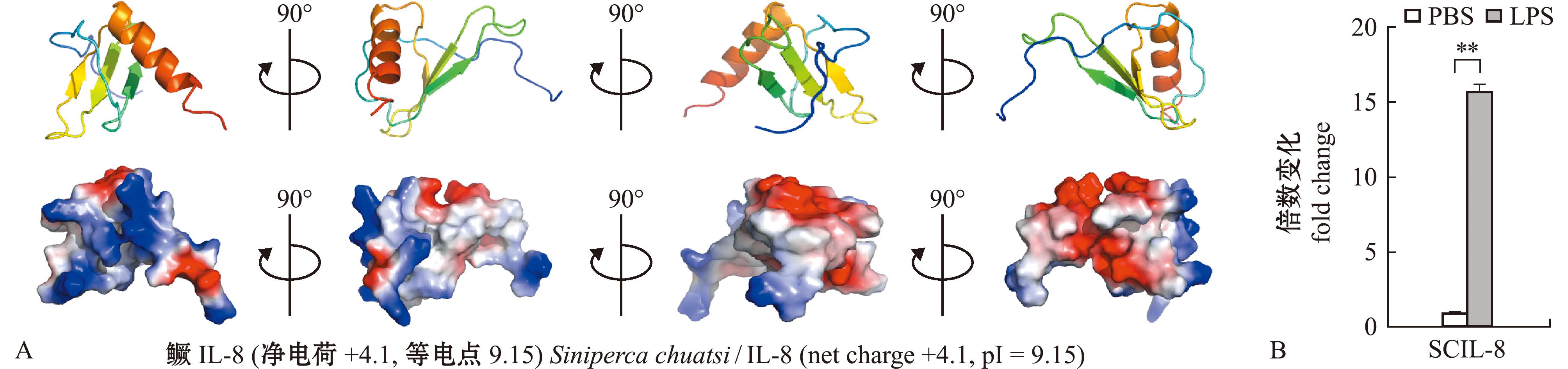
A—鳜IL-8的三维结构(上排)及分子表面静电势分布预测(下排)。在表面静电势分布中,蓝色、红色和白色分别代表正电荷氨基酸残基、负电荷氨基酸残基和疏水性氨基酸残基;上排和下排分别以相同的角度呈现。B—荧光定量PCR检测LPS刺激鳜头肾白细胞6 h后IL-8的表达变化。**表示与对照组相比有极显著性差异(P<0.01),下同。
A—the prediction of three-dimensional structure (top row) and molecular surface electrostatic potential distribution (bottom row) of SCIL-8.In the electrostatic potential distribution,the positive,negative and hydrophobic charges are indicated in blue,red and white respectively,the top and bottom row are presented in the same angle. B—the expression change of SCIL-8 in mandarin fish head kidney leukocytes following 6 hours of LPS stimulation is detected by real-time quantitative PCR.**means very significant difference compared with control group(P<0.01),et sequentia.
图1 鳜IL-8的结构与表达分析
Fig.1 Structural and expression analysis of SCIL-8
2.2 鳜IL-8的蛋白制备
为了探究SCIL-8是否具有直接抗菌活性,使用pET-28a原核表达载体对其进行蛋白制备。结果表明,pET-28a-SCIL-8重组质粒在IPTG诱导后,相比于pET-28a空质粒,在相对分子质量约为12 000处有明显条带,条带大小符合鳜IL-8重组蛋白的预测分子量。重组质粒经大体积诱导和纯化后得到目的蛋白SCIL-8(图2),所得蛋白将用于后续抗菌功能和机制研究。
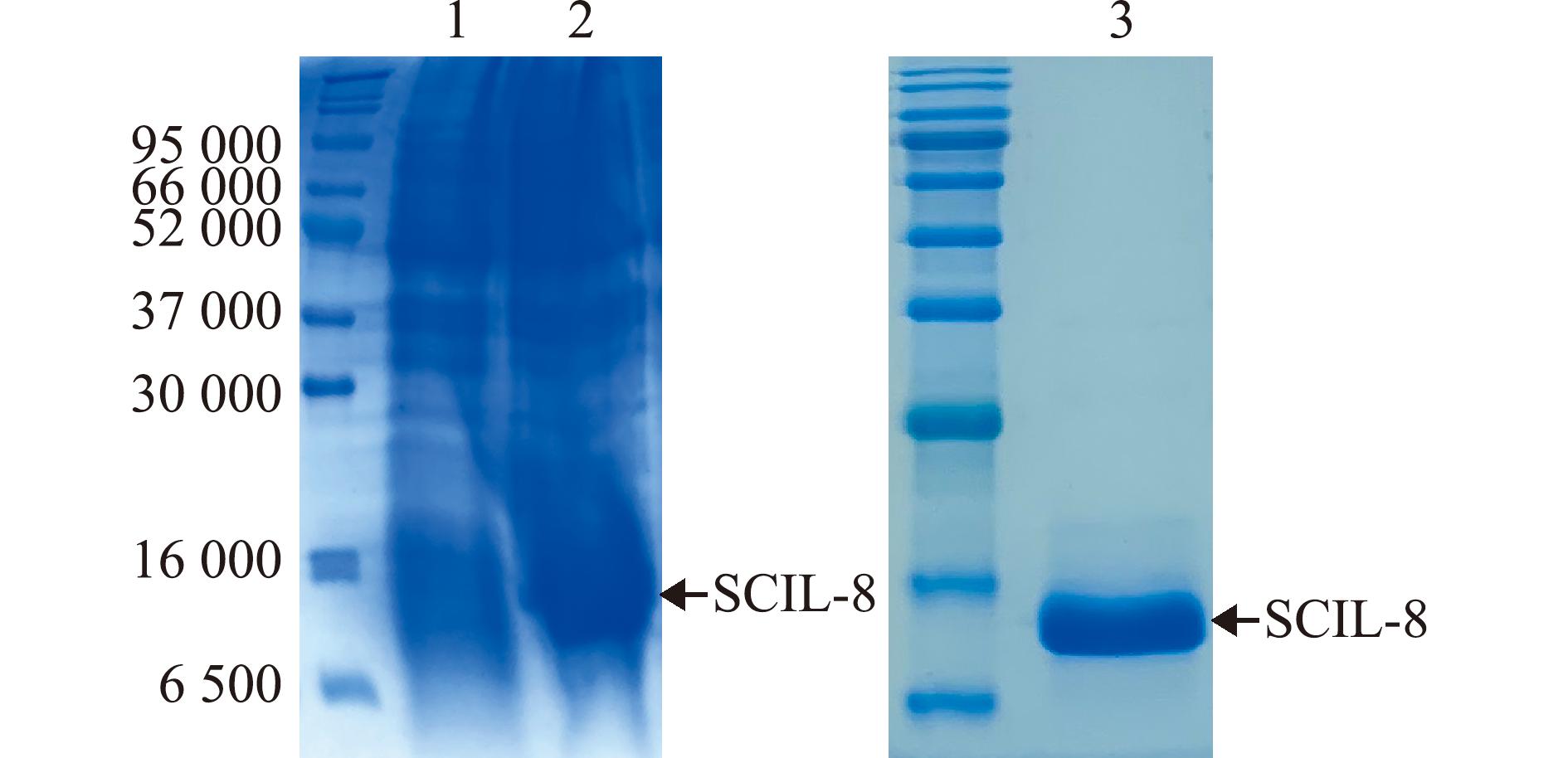
1—pET-28a空质粒诱导组;2—pET-28a-SCIL-8重组质粒诱导组;3—纯化的SCIL-8蛋白。
1—induced pET-28a empty vector;2—induced pET-28a-SCIL-8 recombinant plasmid;3—purified SCIL-8 protein.
图2 鳜IL-8的蛋白制备
Fig.2 Preparation of SCIL-8 protein
2.3 鳜IL-8的直接抗菌功能检测
将受试菌与梯度稀释的鳜IL-8蛋白混合培养,检测蛋白对细菌生长的影响。结果表明,鳜IL-8对3种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、中间气单胞菌)和2种革兰氏阳性菌(金黄色葡萄球菌、无乳链球菌)均表现出明显的生长抑制作用,在4 μmol/L时即有抑菌效果,在32 μmol/L时能够完全抑制受试菌的生长(图3),表明鳜IL-8具有直接抗菌功能。
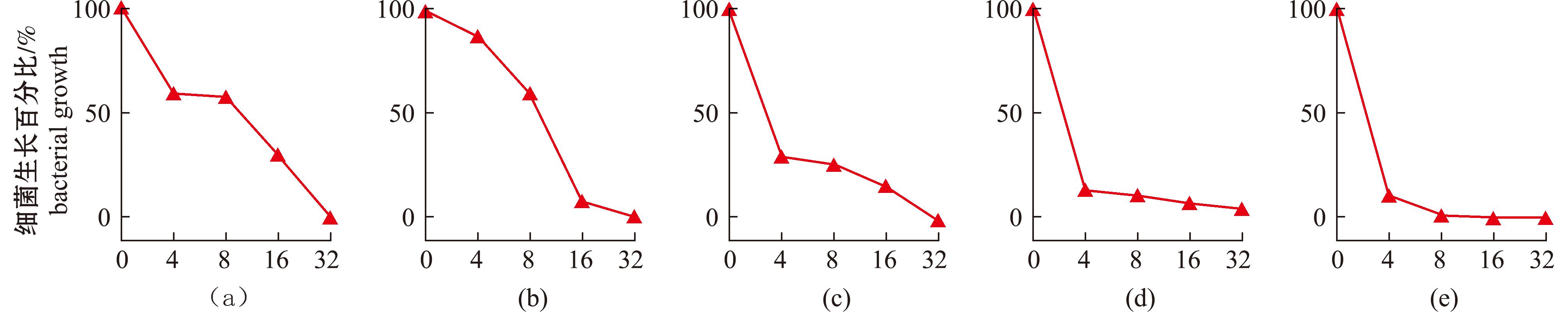
(a)~(e)—大肠杆菌(a),嗜水气单胞菌(b),中间气单胞菌(c),金黄色葡萄球菌(d)和无乳链球菌(e)在不同浓度鳜IL-8蛋白处理下的细菌生长百分比(μmol/L)。
(a)-(e)—the bacterial growth of E.coli (a),A.hydrophila (b),A.media(c),S.aureus (d) and S.agalactiae (e) following the treatment of different concentrations of SCIL-8 protein (μmol/L).
图3 鳜IL-8的直接抗菌功能检测
Fig.3 Detection of the direct antibacterial function of SCIL-8
2.4 鳜IL-8的直接抗菌机制分析
由于鳜IL-8具有与抗菌肽共同的阳离子性和两亲性特征(图1A),而这两个特征是抗菌肽对细菌菌膜破坏作用的关键[19],推测鳜IL-8可能有类似的菌膜破坏作用。通过流式检测PI和DiBAC4(3)对鳜IL-8处理后大肠杆菌的染色情况分析可知,PI是一种核酸染料,无法透过完整的菌膜,但当膜通透性提升或膜破损时,其可通过菌膜进入细菌内部,与核酸结合而发出荧光。DiBAC4(3)是一种膜电位探针,可通过去极化的菌膜,与胞内物质结合而发出增强的荧光,荧光越强代表膜去极化程度越高。结果表明,大肠杆菌经鳜IL-8蛋白处理后,21.2%的菌体有明显的PI着色,远高于对照组(图4A),且全部菌体平均荧光强度也与对照组有显著性差异(图4C),表明鳜IL-8可引发大肠杆菌膜通透性提升或膜破损。同样,鳜IL-8处理后的大肠杆菌有30%菌体表现出明显的DiBAC4(3)染色,相比对照组有明显提升(图4B),且全部菌体的平均荧光强度也显著高于对照组(图4D),表明鳜IL-8可导致大肠杆菌菌膜去极化。上述结果表明,鳜IL-8对大肠杆菌具有膜破坏作用。
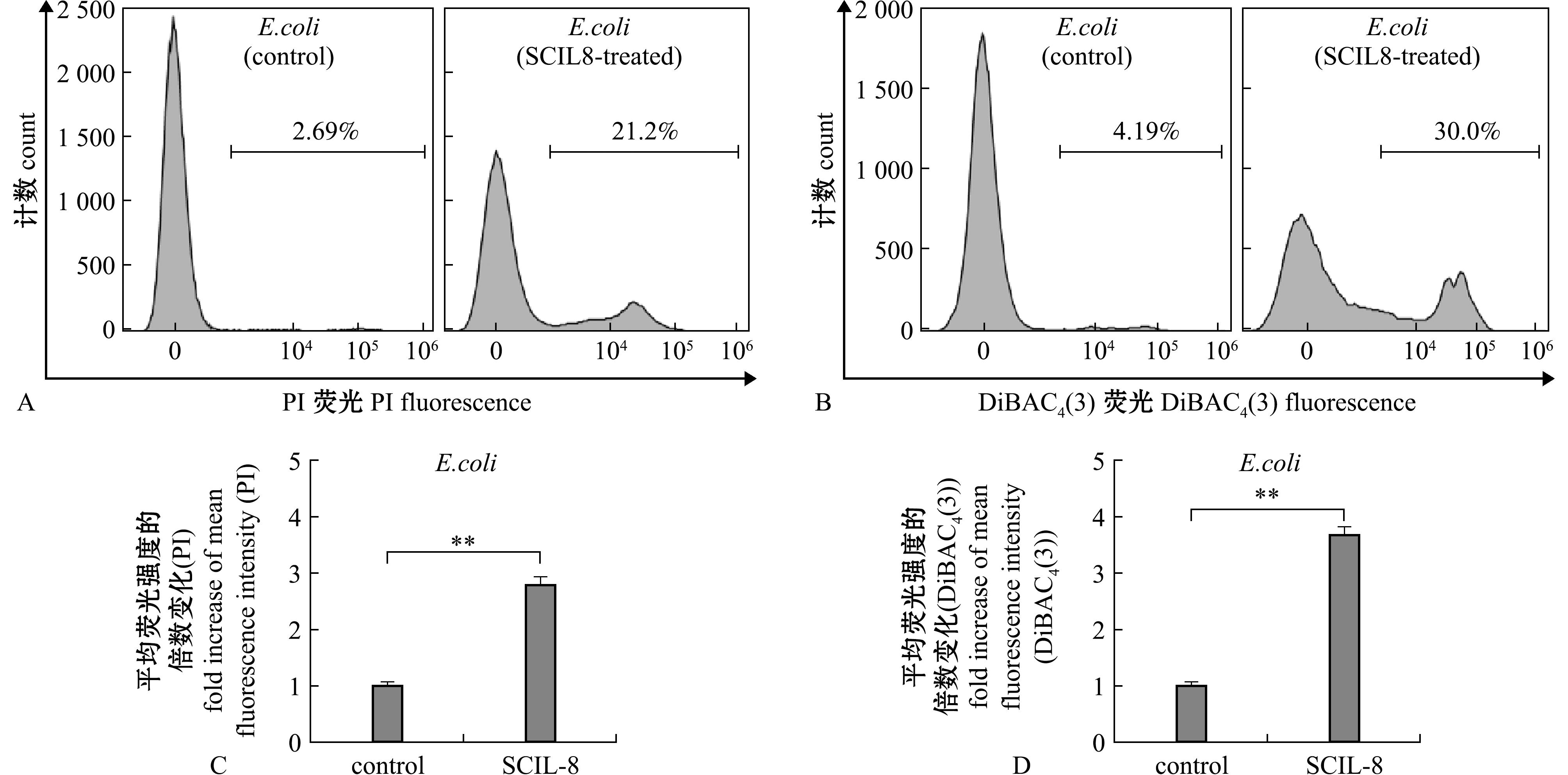
A~D—流式检测大肠杆菌经鳜IL-8蛋白处理后对PI(A,C)和DiBAC4(3)(B,D)的着色变化。其中,A和B为流式直方图,C和D为平均荧光强度分析。
A-D—flow cytometric analysis ofE.coli following treatment with SCIL-8 protein,showing changes in PI (A,C) and DiBAC4(3) (B,D) staining.Panels A and B present flow cytometry histograms,while C and D illustrate mean fluorescence intensity analysis.
图4 鳜IL-8对大肠杆菌的膜破坏作用分析
Fig.4 Analysis of membrane-disrupting effect of SCIL-8
进一步分析鳜IL-8对鱼类致病菌的抗菌机制。以中间气单胞菌和无乳链球菌为受试菌,发现鳜IL-8可分别使17.1%和35.6%的菌体对PI着色,远高于对照组(图5A、B),且两种受试菌的平均荧光强度与对照组相比有显著性提升(图5C、D)。以上结果表明,鳜IL-8可通过破坏菌膜发挥直接抗菌作用。
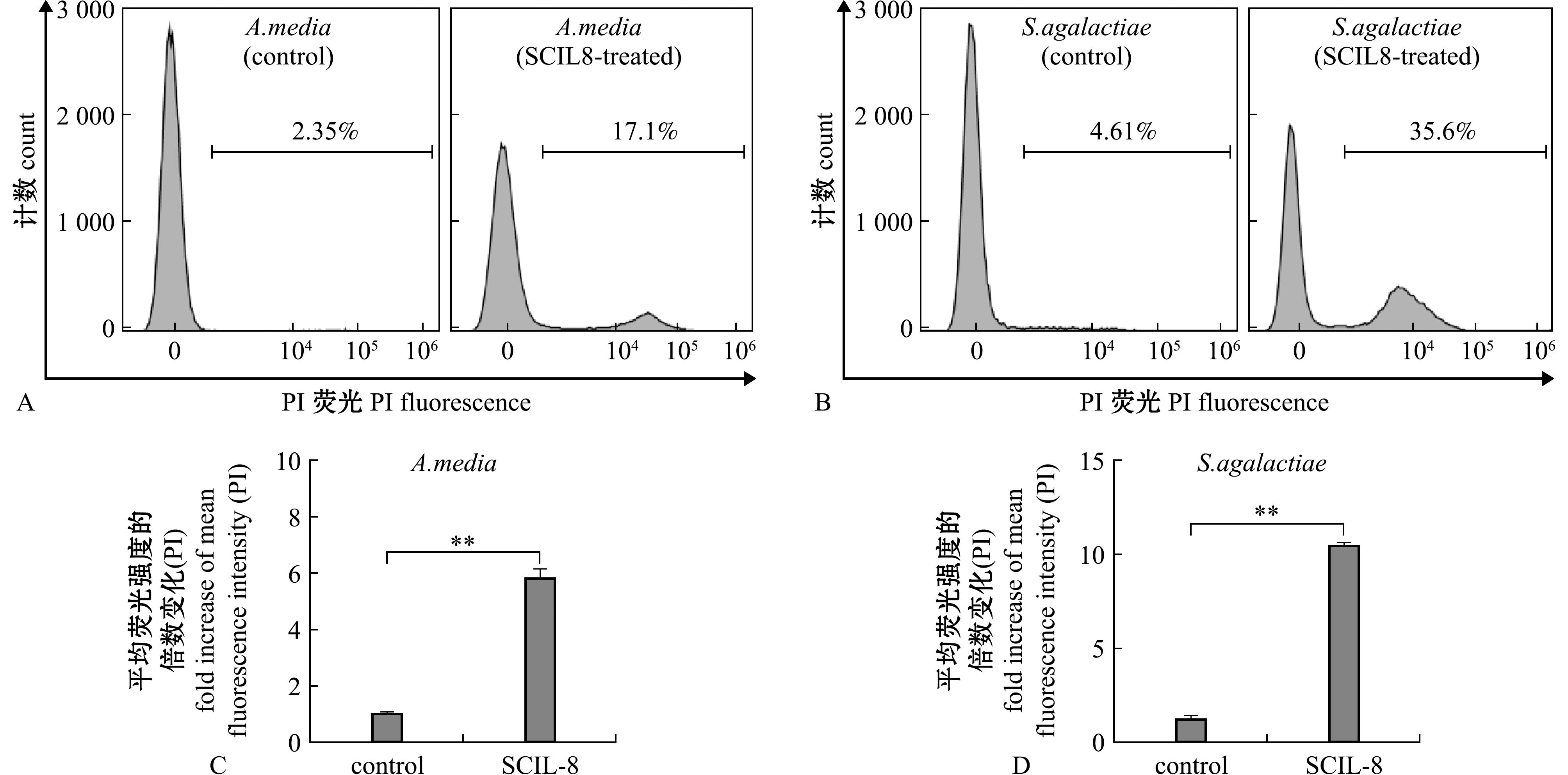
A~D—流式检测中间气单胞菌(A,C)和无乳链球菌(B,D)经鳜IL-8蛋白处理后对PI的着色变化。其中,A和B为流式直方图,C和D为平均荧光强度分析。
A-D—Flow cytometric analysis of A.media (A,C) and S.agalactiae (B,D) following treatment with SCIL-8 protein,showing changes in PI staining.Panels A and B present flow cytometry histograms,while C and D illustrate mean fluorescence intensity analysis.
图5 鳜IL-8对中间气单胞菌和无乳链球菌的膜破坏作用分析
Fig.5 Analysis of membrane-disrupting effect of SCIL-8 on Aeromonas media and Streptococcus agalactiae
3 讨论
3.1 鳜IL-8具有直接抗菌相关结构基础
抗菌肽是一类具有直接杀菌活性的天然小分子肽,其杀菌机制主要表现为对细菌菌膜的破坏作用[19]。抗菌肽通常富含阳离子氨基酸,如精氨酸、赖氨酸和组氨酸,分子携带净正电荷,呈现“阳离子性”。由于细菌菌膜表面常携带负电荷基团,如磷壁酸和脂多糖,抗菌肽可凭借其阳离子性,通过静电吸引与细菌表面基团结合。抗菌肽也含有一定比例的疏水性氨基酸,且阳离子与疏水性氨基酸分别聚集分布于空间结构的两侧,分子呈现“两亲性”。而细菌菌膜的基本组成单位为磷脂分子,也具有两亲性。抗菌肽可凭借其阳离子聚集区,与磷脂分子中携带负电荷的磷酸头部发生静电相互作用,同时凭借其疏水区,与磷脂分子的脂肪链尾部发生疏水相互作用,从而插入菌膜磷脂分子层中。抗菌肽凭借其阳离子性和两亲性特征与菌膜相互作用,形成跨膜孔洞或引发菌膜局部瓦解,导致细菌内含物外流及死亡[20-21]。因而,阳离子性和两亲性特征为抗菌肽的直接抗菌活性提供了结构基础。
鳜IL-8的分子净电荷含量为+4.1,且阳离子与疏水性氨基酸残基在分子表面的不同区域聚集分布,因而具有阳离子性和两亲性,这样的结构特征将有利于鳜IL-8破坏细菌菌膜及发挥直接抗菌作用。因而,鳜IL-8具有直接抗菌相关结构基础。
3.2 鳜IL-8通过破坏菌膜发挥直接抗菌作用
将鳜IL-8蛋白与受试菌共孵育后,检测发现细菌生长受到明显抑制,表明鳜IL-8具有直接抗菌作用。分别使用PI和DiBAC4(3)对鳜IL-8处理后的菌体染色,发现细菌着色均远高于对照组,表明鳜IL-8可破坏细菌菌膜,使其通透性提升或造成膜破损,并促使菌膜发生去极化。在对抗菌肽的机制研究中发现,其插入细菌菌膜后,可破坏磷脂双分子层的规则排列,增加膜结构的不稳定性,形成孔道或引发膜局部瓦解,导致膜通透性提升或膜破损。而膜的不完整会进一步干扰细菌的离子平衡,如引发质子内流及钾离子外流,造成菌膜去极化,继而影响菌膜呼吸链的正常功能,导致ATP合成受阻,从而影响细菌的各项耗能反应[21-22]。可见,菌膜的破坏对细菌的影响十分广泛。鳜IL-8对大肠杆菌及致病菌的菌膜均有破坏作用,膜破坏是其抗菌机制。
事实上,不同kinocidin成员对菌膜的破坏作用均有报道。如虹鳟CK11,一种CC型趋化因子,具有阳离子性和两亲性特征,能够破坏细菌菌膜及寄生虫的细胞膜,从而发挥直接的抗感染作用[23]。草鱼CXCL20a,一种硬骨鱼特有的CXC型趋化因子,也具有阳离子性和两亲性特征,能够在菌膜上打孔而介导细菌死亡[24]。因此,对菌膜的直接破坏可能是kinocidin的共有抗菌机制。
4 结论
1)鳜IL-8具有阳离子性的理化性质和两亲性的结构特点,表明其具有直接抗菌相关的结构基础。
2)鳜IL-8对模式菌株(大肠杆菌、金黄色葡萄球菌)及鱼类致病菌(嗜水气单胞菌、中间气单胞菌、无乳链球菌)均表现出明显的直接抗菌功能。
3)鳜IL-8能够引发菌膜通透性提升及菌膜去极化,表明其可通过破坏菌膜而抗菌。
[1] NGUYEN L T,VOGEL H J.Structural perspectives on antimicrobial chemokines[J].Frontiers in Immunology,2012,3:384.
[2] YOUNT N Y,WARING A J,GANK K D,et al.Structural correlates of antimicrobial efficacy in IL-8 and related human kinocidins[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2007,1768(3):598-608.
[3] BJÖRSTAD A,FU H M,KARLSSON A,et al.Interleukin-8-derived peptide has antibacterial activity[J].Antimicrobial Agents and Chemotherapy,2005,49(9):3889-3895.
[4] DONG R,ZHENG S.Interleukin-8:a critical chemokine in biliary atresia[J].Journal of Gastroenterology and Hepatology,2015,30(6):970-976.
[5] HAN Z-J,LI Y-B,YANG L-X,et al.Roles of the CXCL8-CXCR1/2 axis in the tumor microenvironment and immunotherapy[J].Molecules,2022,27(1):137.
[6] DE OLIVEIRA S,REYES-ALDASORO C C,CANDEL S,et al.Cxcl8 (IL-8) mediates neutrophil recruitment and behavior in the zebrafish inflammatory response[J].Journal of Immunology,2013,190(8):4349-4359.
[7] ZHAO K Y,CHEN G Y,HUANG H,et al.PoCXCL8,a teleost chemokine,exerts direct bactericidal,chemotactic/phagocytic,and NETs releasing properties,promoting host anti-bacterial immunity[J].Fish &Shellfish Immunology,2024,154:109874.
[8] ZHAO M H,LIU Y Z,GAO Y J,et al.Insights into the functional role of grass carp IL-8 in head kidney leukocytes:pro-inflammatory effects and signalling mechanisms[J].Journal of Fish Biology,2022,100(1):192-202.
[9] SATHYAMOORTHI A,BHATT P,RAVICHANDRAN G,et al.Gene expression and in silico analysis of snakehead murrel interleukin 8 and antimicrobial activity of C-terminal derived peptide WS12[J].Veterinary Immunology and Immunopathology,2017,190:1-9.
[10] SANTANA P A,SALINAS N,CLAUDIO A  ,et al.Alpha-helical domain from IL-8 of salmonids:mechanism of action and identification of a novel antimicrobial function[J].Biochemical and Biophysical Research Communications,2018,498(4):803-809.
,et al.Alpha-helical domain from IL-8 of salmonids:mechanism of action and identification of a novel antimicrobial function[J].Biochemical and Biophysical Research Communications,2018,498(4):803-809.
[11] S ENZ-MART
ENZ-MART NEZ D E,SANTANA P A,AR
NEZ D E,SANTANA P A,AR STICA M,et al.Immunodetection of rainbow trout IL-8 cleaved-peptide:tissue bioavailability and potential antibacterial activity in a bacterial infection context[J].Developmental &Comparative Immunology,2021,124:104182.
STICA M,et al.Immunodetection of rainbow trout IL-8 cleaved-peptide:tissue bioavailability and potential antibacterial activity in a bacterial infection context[J].Developmental &Comparative Immunology,2021,124:104182.
[12] MUANGRERK C,UCHUWITTAYAKUL A,SRISAPOOME P.Identification,expression and antimicrobial functional analysis of Interleukin-8 (IL-8) in response to Streptococcus iniae and Flavobacterium covae in Asian seabass (Lates calcarifer Bloch,1790)[J].Animals,2024,14(3):475.
[13] LIN Q,LI J,FU X Z,et al.Hemorrhagic gill disease of Chinese perch caused by Aeromonas salmonicida subsp.salmonicida in China[J].Aquaculture,2020,519:734775.
[14] 王宇航,梅俊俊,王学民,等.鳜鱼源嗜水气单胞菌的分离鉴定及药敏试验[J].安阳工学院学报,2024,23(4):115-119.
WANG Y H,MEI J J,WANG X M,et al.Isolation and identification of Aeromonas hydrophila from Siniperca chuatsi and its antibiotic sensitivity test[J].Journal of Anyang Institute of Technology,2024,23(4):115-119.(in Chinese)
[15] 吕圆圆,周凯,房文红,等.养殖鳜鱼出血病病原的分离与鉴定[J].中国动物检疫,2023,40(2):23-29.
LÜ Y Y,ZHOU K,FANG W H,et al.Isolation and identification of hemorrhagic disease pathogens in cultured Siniperca chuatsi[J].China Animal Health Inspection,2023,40(2):23-29.(in Chinese)
[16] WANG G L,WANG M C,ZHANG X W,et al.Molecular cloning,biological effect,and tissue distribution of interleukin-8 protein in mandarin fish (Siniperca chuasti) upon Flavobacterium columnare infection[J].Fish &Shellfish Immunology,2017,66:112-119.
[17] HUO H J,CHEN S N,LAGHARI Z A,et al.Specific bioactivity of IL-22 in intestinal cells as revealed by the expression of IL-22RA1 in Mandarin fish,Siniperca chuatsi[J].Developmental &Comparative Immunology,2021,121:104107.
[18] HUO H J,YANG T Z,ZHU Q,et al.A basic investigation on evolution of CL-L1 in vertebrates and its bioactivities in black rockfish (Sebastes schlegelii)[J].Aquaculture,2023,563:738923.
[19] ZASLOFF M.Antimicrobial peptides of multicellular organisms:my perspective[J].Advances in Experimental Medicine and Biology,2019,1117:3-6.
[20] ZASLOFF M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.
[21] BROGDEN K A.Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria?[J].Nature Reviews Microbiology,2005,3(3):238-250.
[22] HUANG H W.DAPTOMYCIN,its membrane-active mechanism vs.that of other antimicrobial peptides[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2020,1862(10):183395.
[23] MU OZ-ATIENZA E,AQUILINO C,SYAHPUTRA K,et al.CK11,a teleost chemokine with a potent antimicrobial activity[J].Journal of Immunology,2019,202(3):857-870.
OZ-ATIENZA E,AQUILINO C,SYAHPUTRA K,et al.CK11,a teleost chemokine with a potent antimicrobial activity[J].Journal of Immunology,2019,202(3):857-870.
[24] ZHANG Y Q,XIAO X,HU Y Z,et al.CXCL20a,a teleost-specific chemokine that orchestrates direct bactericidal,chemotactic,and phagocytosis-killing-promoting functions,contributes to clearance of bacterial infections[J].Journal of Immunology,2021,207(7):1911-1925.