菲律宾蛤仔(Ruditapes philippinarum),简称“蛤仔”,隶属软体动物门(Mollusca)双壳纲(Lamellibranchia)帘蛤目(Veneroida)帘蛤科(Veneridae)蛤仔属(Ruditapes),为广温广盐性埋栖贝类,具有环境适应能力强和生长培育周期短等优点,是中国海水养殖单种产量最高的双壳贝类[1]。2023年中国蛤仔年产量约356万t,占海水养殖贝类总量的21.6%,其中辽宁地区产量约占39.5%。辽宁丹东东港是中国北方最大的蛤仔养殖区,20世纪90年代突破10 m等深线以内浅海底播蛤仔养殖技术,现已形成规模化产业格局[2],2023年养殖面积达51 200万hm2,年产蛤仔50万t,年产值突破24.3亿元。为了进一步提高养殖蛤仔的成活率,缩短养殖生产周期,降低养殖风险,底播蛤仔苗种常选用大规格的苗种(壳长>20 mm)。在蛤仔养殖产业链中,获得大规格蛤仔苗种的关键生产技术是中间育成技术,即小规格蛤仔苗种从育苗室出库到进入海区底播前的过渡阶段培育技术。蛤仔的中间育成直接影响苗种规格均匀度和成活率等核心生产指标,具有关键的养殖生产调控价值。蛤仔中间育成技术体系主要包括3种典型养殖模式,分别为室外土池法[3]、海上网袋法[4]和海区底播法[5]。对比研究表明,由于出库蛤仔稚贝个体较小,在海区开展蛤仔中间育成易受海上风浪影响,而池塘养殖因具有相对可控的水体理化环境,其养殖效益略优于海区底播模式[3]。刘忠颖等[6]比较了蛤仔土池与滩涂中间育成效果,发现蛤仔土池中间育成的损耗率仅为20%,而滩涂损耗率超过95%,这与温子川[4]在辽宁省盘锦市二界沟镇的对比试验结论相同,即土池法养殖蛤仔的生长速度快于各类海区养殖方法。
中国南北方蛤仔中间育成养殖区存在显著的生态位分化特征。南方产区(福建、浙江)通过构建“土池高密度培育-中潮区疏苗养殖”技术体系,已实现蛤仔苗种的规模化生产,如周栋田等[7]投放壳长1.5 mm稚贝开展蛤仔池塘中间育成研究,发现池塘中间育成蛤仔的壳长月平均增长达0.49~4.23 mm,池塘底质、培养方式、养殖密度、敌害防除等因素会影响蛤仔生长速度。目前,北方海区底播所需蛤仔苗种大量从南方采购,仅辽宁东港就年需蛤仔苗种近5万t。但是,南苗北运存在运输成本高和苗种存活率低等问题,且南方苗种在北方海域养殖越冬适应性差。北方蛤仔养殖产业的需求促进了本地化蛤仔中间育成技术发展,闫喜武等[8]在辽宁大连开展的蛤仔池塘中间育成试验,在水温20 ℃~25 ℃时,蛤仔苗种放养规格>1.5 mm,壳长平均生长速度可达 0.085 mm/d,成活率>80%,放养规格、肥水、追肥、清池及适时疏苗是影响北方池塘蛤仔中间育成效果的主要因素(下文所述“高温”环境为温度>28℃)。
随着中国北方地区蛤仔池塘中间育成技术的不断完善,北方池塘中间育成的大规格蛤仔苗种在北方海区放养比例逐渐增加。但是,在全球气候变化的大背景下,夏季高温期已成为影响北方池塘中间育成效果的关键窗口期。研究表明,在夏季极端高温条件下,蛤仔的滤食及潜沙能力下降[9];而pH值波动(8.0→7.7)导致蛤仔排氨率增加[10]。2019年夏季莱州湾养殖区蛤仔大规模死亡(死亡率80%)的溯因分析也显示,可能是夏季水温异常升高(最高温度为31.49 ℃)、缺氧(溶解氧最低浓度为3.35 mg/L)与硫化氢浓度升高(最大浓度为24.72 μmol/L)等多种环境因素的协同胁迫效应[11]。目前,蛤仔对极端气候变化的响应机制研究尚存不足,特别是针对夏季北方池塘中间育成蛤仔的高温适应性机制尚缺乏系统研究。因此,为了提高中国北方蛤仔池塘中间育成过程的可控程度,本研究中选择辽宁丹东东港双峰岛蛤仔中间育成养殖池塘为研究对象,通过开展“水环境因子连续监测-生长性状定量评估-呼吸代谢特征分析”研究,系统探讨了夏季高温期池塘中间育成蛤仔的生长和代谢,以期明晰北方池塘蛤仔中间育成技术体系中高温胁迫的响应机制,为建立基于池塘水质调控的蛤仔精细化中间育成模式提供科学依据。
1 材料与方法
1.1 材料
本试验在辽宁丹东东港双峰岛进行,该试验地点的经度为123°53′16″,纬度为39°49′57″(图1)。开展蛤仔中间育成池塘占地约7.3 hm2,水深为1.5~2.0 m,涨潮时可自然纳水。试验池塘所投放的蛤仔苗种来源于本地室内人工繁育的苗种,2023年7月20日测得池塘播放的蛤仔苗种个体的平均壳长为8.76 mm,平均体质量为0.13 g,放养密度约为5 000 ind./m2。
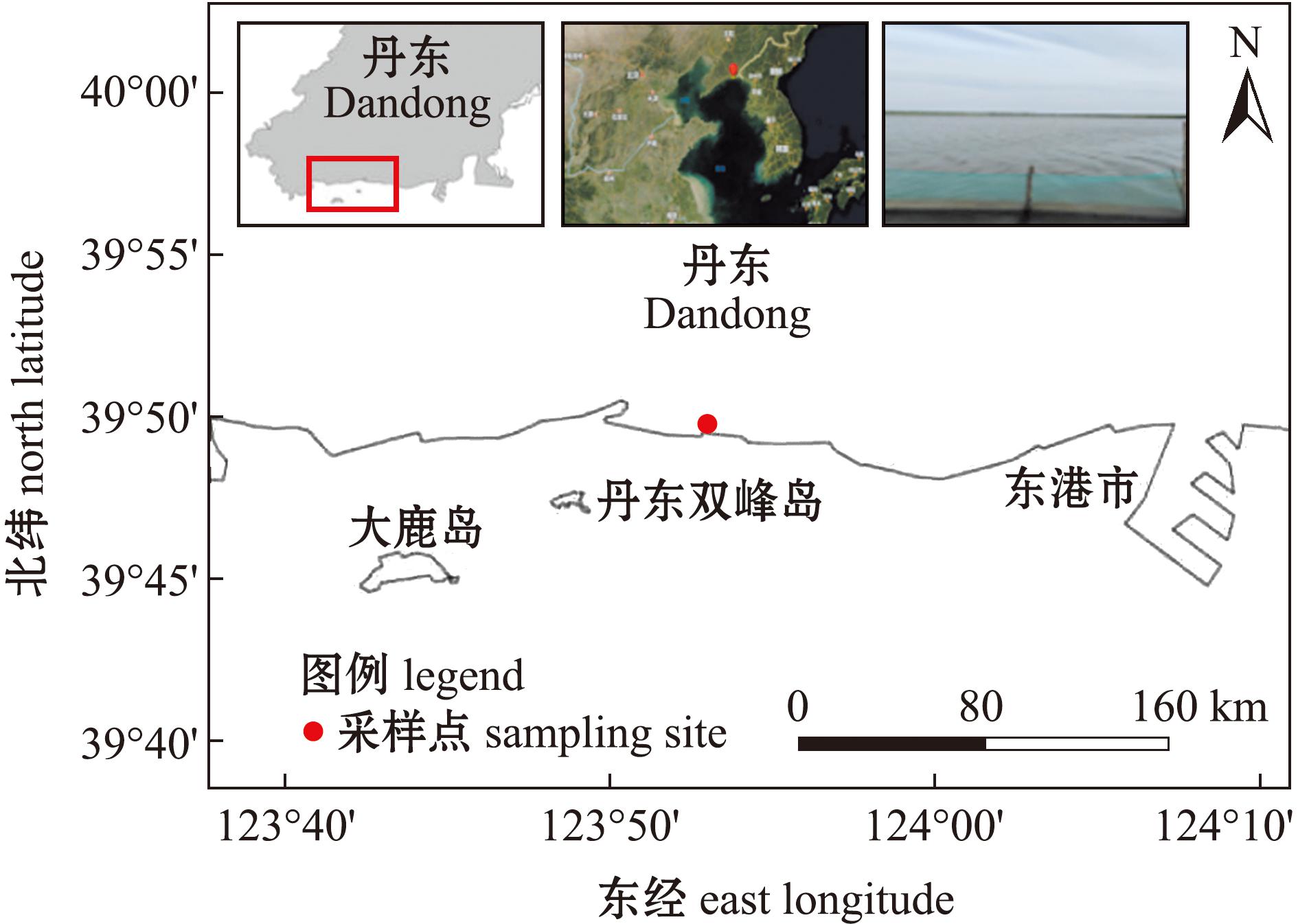
图1 丹东蛤仔中培池塘站位
Fig.1 Culture pond station of Ruditapes philippinarum in Dandong
1.2 方法
在试验全过程中,养殖池塘每日换水1次,换水量约为总水量的10%;当水色出现异常或水体透明度小于30 cm时,晚上排底水,白天则排中上层水,并补新水。从2023年7月30日开始,每10 d进行一次中间育成蛤仔采样,每次采样均于中午12:00进行,随机采捕个体健康、贝壳无损伤的蛤仔500枚,同时取池塘表底层混合水样6 L。
蛤仔个体体长、体质量测定:使用游标卡尺测量蛤仔的壳长、壳宽和壳高,并称量个体湿质量。将蛤仔的软体部与贝壳解剖分离,置于70 ℃的烘箱中烘干24 h后,称量其干质量。
耗氧率和排氨率测定:选取个体规格相同的蛤仔5枚,置于500 mL呼吸瓶中,海水盐度为23,水温设定为20 ℃,试验时长为3 h,每个试验设置3个平行。试验前后采用碘量法和次溴酸盐氧化法(GB 17378.4—2007)分别测定水中溶解氧和总氨氮含量。中间育成蛤仔的耗氧率、排氨率和氧氮比(O∶N)计算公式分别为
RO=(CD0-CDt)×V/(m×t),
(1)
RN= (CNt-CN0)×V/(m×t),
(2)
RO∶N=(RO/16)/(RN/14)。
(3)
式中:RO为耗氧率[mg/(g·h)];RN为排氨率[mg/(g·h)];RO∶N为氧氮比;CD0和CDt分别为试验前和试验t时水中的溶解氧含量(mg/L);CN0和CNt分别为试验前和试验t时水中的总氨氮质量浓度(mg/L);V为试验用海水体积(L);m为蛤仔软体部干质量(g);t为试验时长(h)。
水质指标检测:采用YSI多功能水质分析仪(Professional Plus Model 550A,Yellow Springs,美国)现场测定蛤仔中间育成池塘水的盐度、水温和溶解氧,采用精密酸度计(Model PB-10,Sartorius,德国)现场测定水的pH。化学需氧量(COD)、总氨态氮、亚硝酸盐氮、总氮、总磷等水质指标的测定参照《海洋监测规范第4部分:海水分析》(GB 17378.4—2007)。
1.3 数据处理
采用SPSS 26.0软件包对数据进行统计分析,并进行LSD多重比较,显著性水平设为0.05。
2 结果与分析
2.1 夏季北方池塘中间育成蛤仔的生长
图2为2023年7月30日—9月10日池塘中间育成蛤仔的壳长、壳高及壳宽的变化情况。从图2可见,随着池塘中间育成时间的推进,蛤仔的壳长、壳高和壳宽均呈现出增长态势。2023年7月30日,蛤仔的壳长为8.92 mm,壳高为6.45 mm,壳宽为3.48 mm。7月30日—8月10日,蛤仔生长速度较为迅速,其中,壳长的平均增长速率达到0.37 mm/d,壳高的平均增长速率为0.26 mm/d,壳宽的平均增长速率为0.17 mm/d。至8月10日时,蛤仔的壳长增长至12.66 mm,壳高增长至9.06 mm,壳宽增长至5.15 mm。至9月10日,池塘中间育成蛤仔的平均壳长达到15.58 mm,平均壳高为10.87 mm,平均壳宽为6.35 mm。整个试验期间,池塘中间育成蛤仔壳长的平均增长率为0.14 mm/d,壳高的平均增长速率为0.12 mm/d,壳宽的平均增长速率为0.04 mm/d。
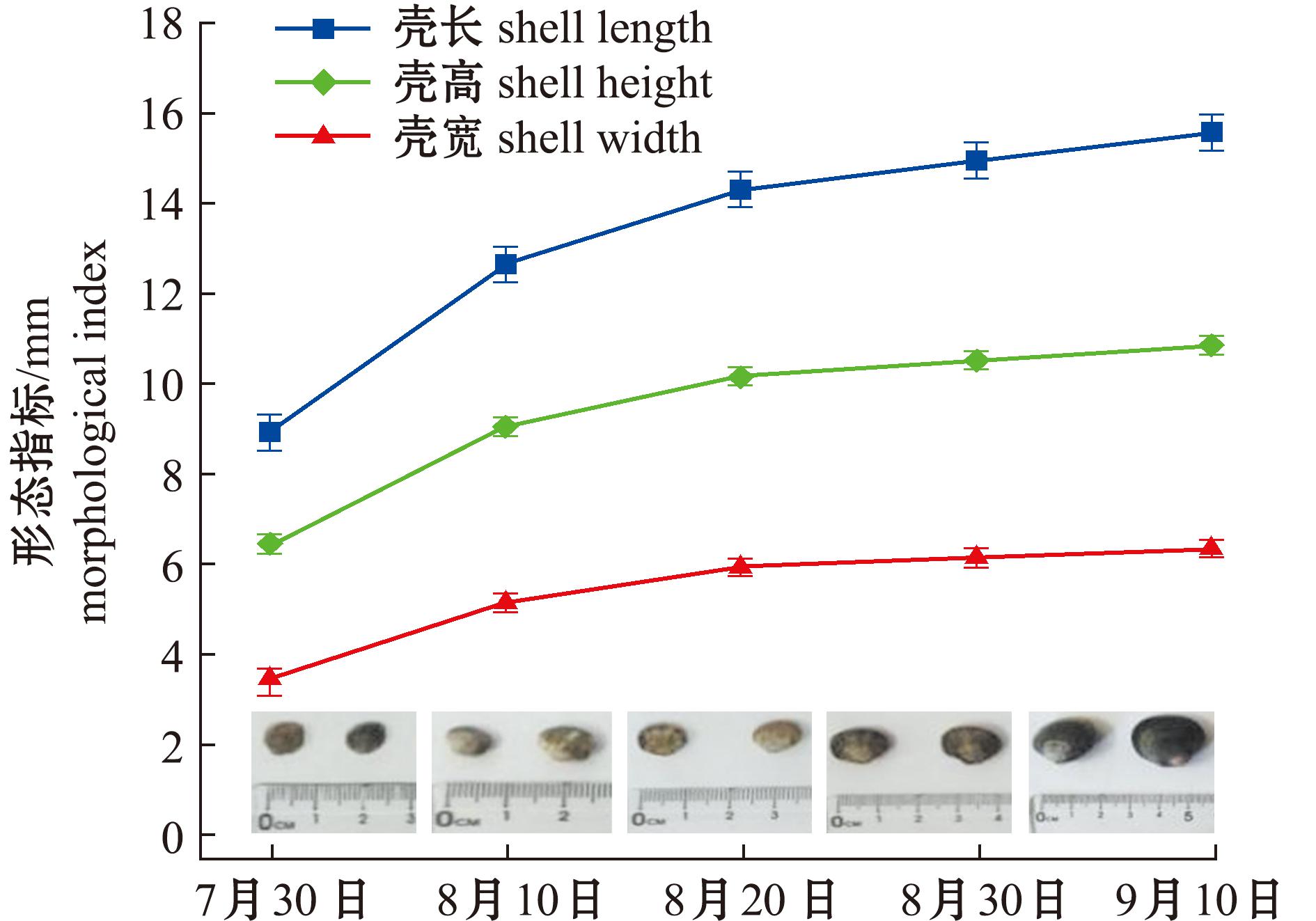
图2 蛤仔的生长
Fig.2 Growth of Ruditapes philippinarum
图3为蛤仔在夏季中间育成阶段体质量的时序变化。7月30日—9月10日,通过每10 d的定期采样监测发现,蛤仔平均体质量从初始值0.178 g显著增长至0.683 g,其日均增长速率为0.012 g/d。为进一步量化形态参数与生长性能的关联性,对体质量(Wt,g)与壳长(L,mm)进行生长分析,获得回归方程:Wt=0.000 9L2.417 3(R2=0.992 2;n=300),该模型表明,壳长与体质量呈显著幂函数关系,拟合优度极高(R2>0.99),表明壳长可作为评估蛤仔生长状况的可靠形态指标。
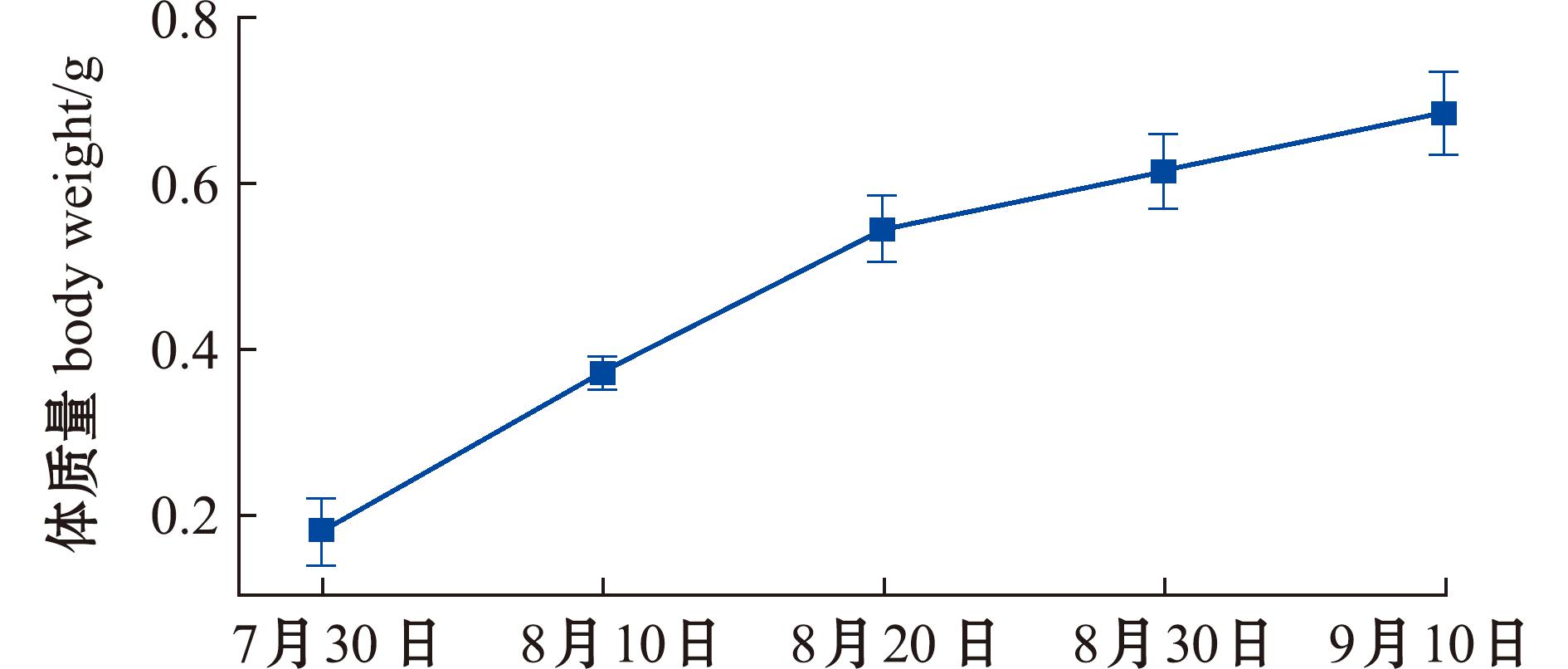
图3 蛤仔的体质量
Fig.3 Body weight of Ruditapes philippinarum
2.2 夏季北方池塘中间育成蛤仔的代谢
图4为夏季池塘中间育成蛤仔在不同生长阶段的耗氧率与排氨率变化情况。从图4可见,随着蛤仔中间培育时间的增加,蛤仔稚贝每小时、单位干质量的耗氧率和排氨率总体均呈下降趋势。对于耗氧率的变化趋势,在2023年7月30日,蛤仔的耗氧率为1.974 mg/(g·h);至8月10日,耗氧率降至1.776 mg/(g·h)。从8月10日—8月20日,蛤仔的耗氧率呈现稳定状态,之后缓慢下降,至9月10日,耗氧率降至1.532 mg/(g·h)。对于排氨率的变化趋势,夏季池塘中间育成蛤仔的排氨率同样随中间育成时间的延长而逐渐降低。7月30日测得蛤仔的排氨率为0.086 mg/(g·h),8月10日降至0.072 mg/(g·h),至8月20日时,排氨率进一步降至0.054 mg/(g·h),至2023年9月10日,蛤仔的排氨率为0.048 mg/(g·h)。
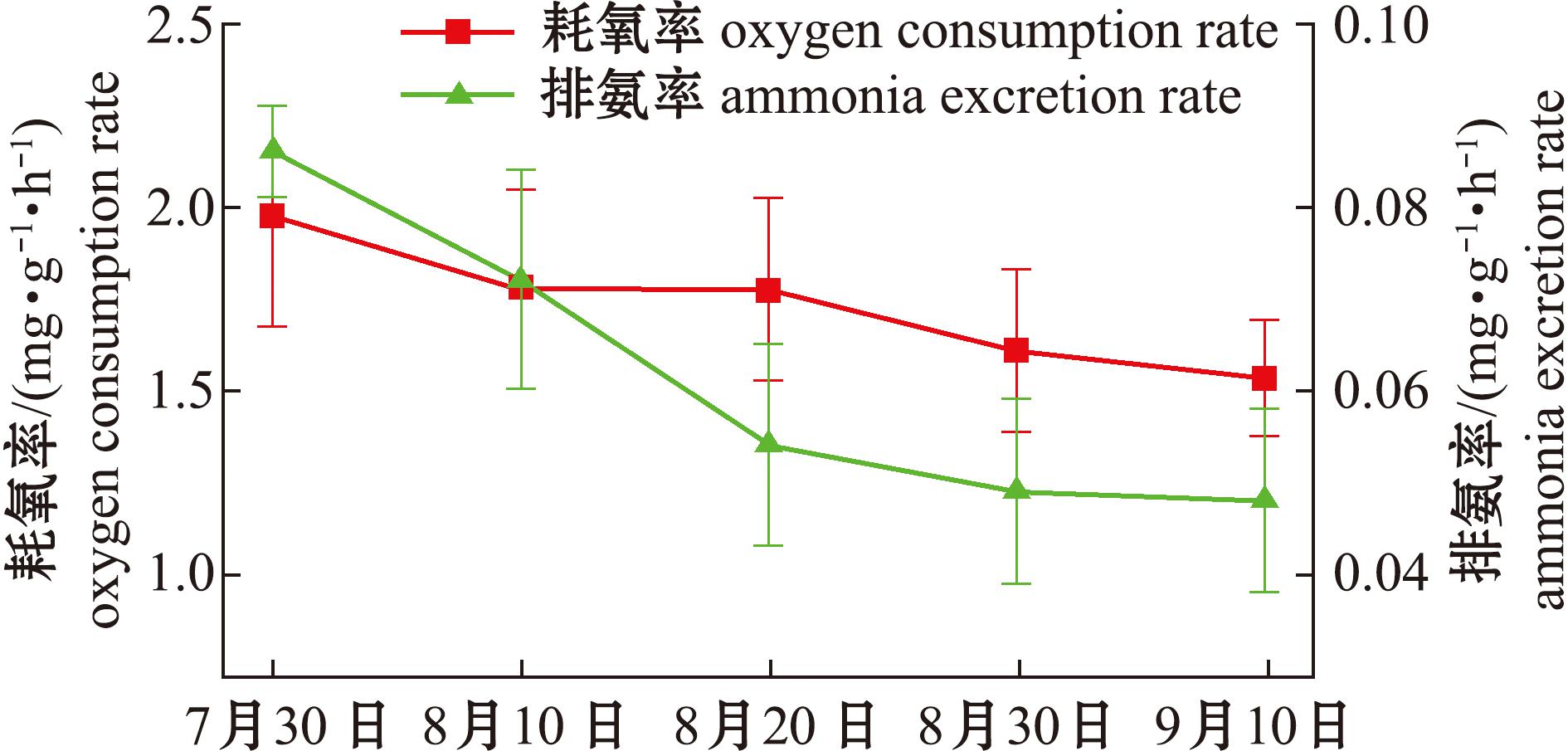
图4 蛤仔的耗氧率和排氨率
Fig.4 Oxygen consumption rate and ammonia excretion rate of Ruditapes philippinarum
夏季中间育成池塘蛤仔的氧氮代谢比RO∶N见表1,在池塘中间育成过程中蛤仔的O∶N呈现显著时序变化特征(P<0.05)。
表1 蛤仔的氧氮代谢比
Tab.1 O∶N of Ruditapes philippinarum

日期 date 氧氮比 O∶N 日期 date 氧氮比 O∶N 7月30日 20.08±3.23 8月30日 28.70±4.15 8月10日 21.58±2.21 9月10日 27.93±2.13 8月20日 28.71±3.17
2.3 夏季北方蛤仔中间育成池塘的水质
在对北方蛤仔中间育成池塘的夏季现场测定中,所获取的水温、盐度、溶解氧及pH的结果如图5所示。具体而言,图5(a)呈现了池塘水温的动态变化情况。2023年7月30日—9月10日,池塘水温波动范围为27.3 ℃~29.6 ℃。在整个试验期间,水温最高值出现于8月10日,此后,随着蛤仔中间育成时间的持续进行,水温值呈逐渐降低态势。图5(b)为中间育成池塘水体的盐度情况,其数值为20.6~24.4。其中,盐度最高值出现于7月30日,而最低值则出现在8月10日。图5(c)为水中溶解氧浓度变化,范围为 4.72~7.13 mg/L。溶解氧浓度的最高值同样出现在8月10日,随后伴随蛤仔中间育成时间的延长而逐渐降低,至9月10日达到溶解氧浓度的最低值。图5(d)为水的pH变化情况,其变化趋势与水中溶解氧浓度的变化趋势一致,pH的波动范围为7.16~8.11。
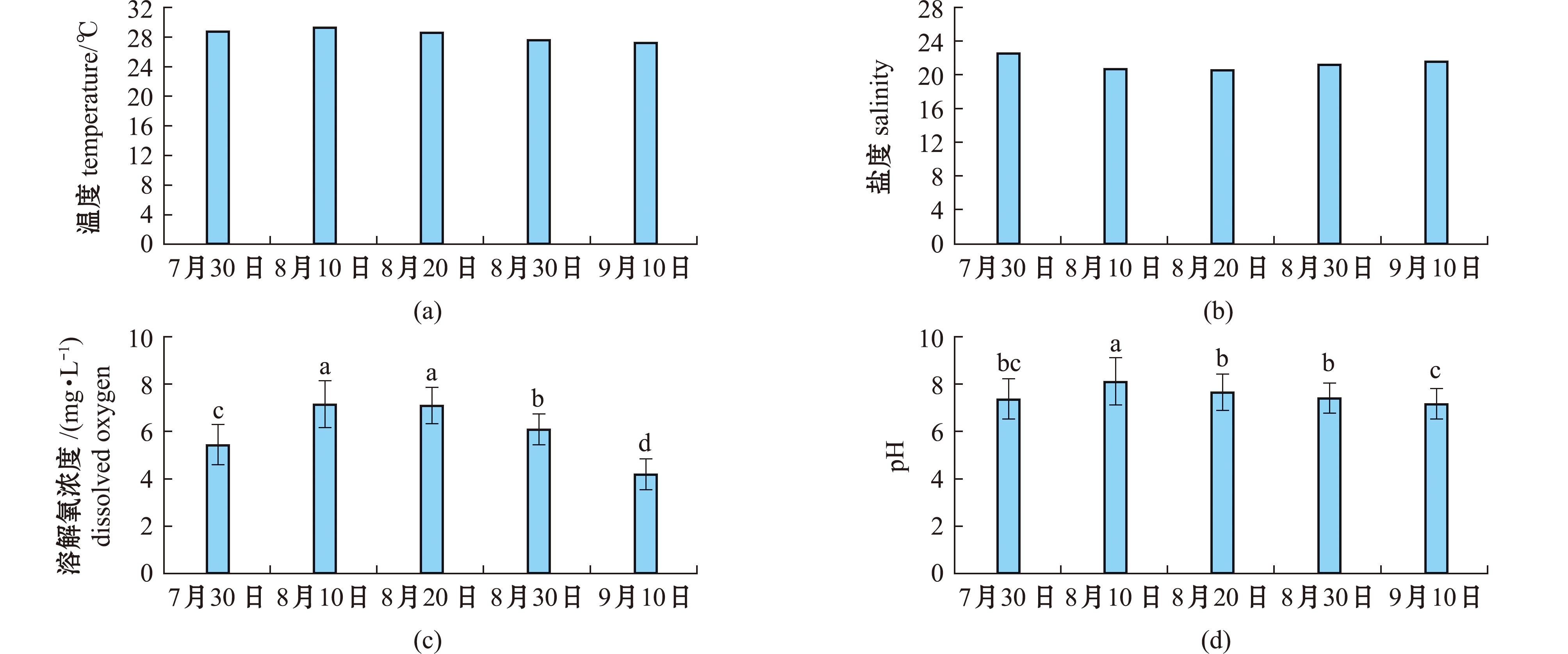
标有不同字母表示各组间有显著差异(P<0.05),标有相同字母表示各组间无显著差异(P>0.05),下同。
Different letters indicate significant differences between the groups (P<0.05),while the same letter indicates no significant differences between the groups (P>0.05),et sequentia.
图5 蛤仔中间育成池塘水温、盐度、溶解氧及pH
Fig.5 Water temperature,salinity,DO,and pH of the intermediate culture pond for Ruditapes philippinarum
图6为蛤仔中间育成池塘水中总氨氮和亚硝酸盐氮浓度变化。从图6(a)可见,水中总氨态氮浓度在7月30日达到0.470 mg/L,8月10日时降低至0.061 mg/L,8月20日水中总氨态氮浓度仅为0.029 mg/L,之后逐渐升高,至9月10日时为0.198 mg/L。图6(b)为水中亚硝酸态氮浓度变化,在7月30日时为0.097 mg/L,在8月10日达到0.310 mg/L,8月20日降至0.010 mg/L,后逐渐升高至9月10日时的0.238 mg/L。
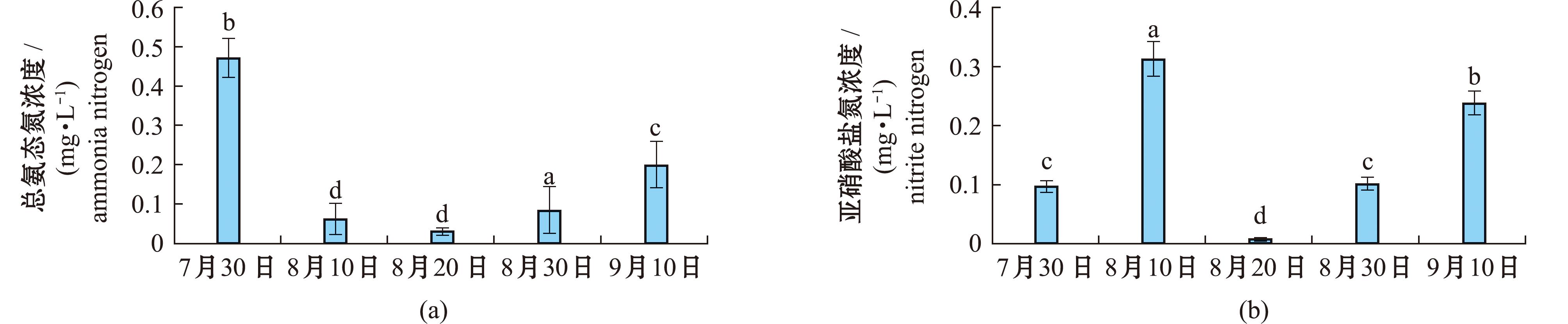
图6 蛤仔中间育成池塘水中总氨氮和亚硝酸盐氮浓度的变化
Fig.6 Ammonia and nitrite concentration of intermediate culture pond for Ruditapes philippinarum
图7为蛤仔中间育成池塘水中化学需氧量(COD)和叶绿素a的变化。图7(a)为池塘水中COD浓度变化,在7月30日仅为2.49 mg/L,8月10日水中COD浓度达到4.32 mg/L,8月20日—9月10日水中COD为2.86~3.24 mg/L。水中叶绿素a浓度变化如图7(b)所示,在7月30日最低为3.66 μg/L,在8月10日为16.02 μg/L,在8月20日达到最高值为16.86 μg/L,至9月10日时叶绿素a浓度降至11.17 μg/L。
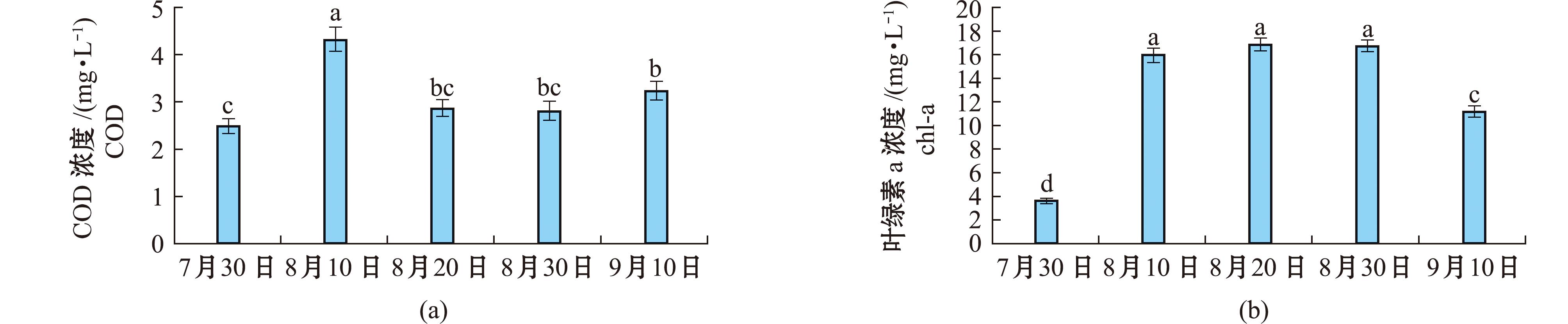
图7 蛤仔中间育成池塘水中COD和叶绿素a的变化
Fig.7 Chemical oxygen demand and chlorophyll a of intermediate culture pond for Ruditapes philippinarum
2.4 蛤仔生长代谢与水环境因子相关性分析
为深入探究夏季北方池塘中蛤仔中间育成阶段的生长代谢与水质之间的内在联系,本研究中针对蛤仔生长代谢与水环境因子展开了相关性分析(图8)。从图8可见,在夏季北方池塘环境下,中间育成阶段的蛤仔,其壳长与池塘水体的溶解氧、pH值、化学需氧量(COD)及叶绿素a含量均呈现出显著的正相关关系。同时,蛤仔的耗氧率与水体溶解氧和pH值之间存在极显著的正相关;蛤仔的排氨率与水体溶解氧、pH值及叶绿素a含量同样呈显著正相关。此外,夏季北方池塘中间育成的菲律宾蛤仔,其生长和代谢与池塘水的盐度及水中总氨氮浓度均呈现负相关关系。
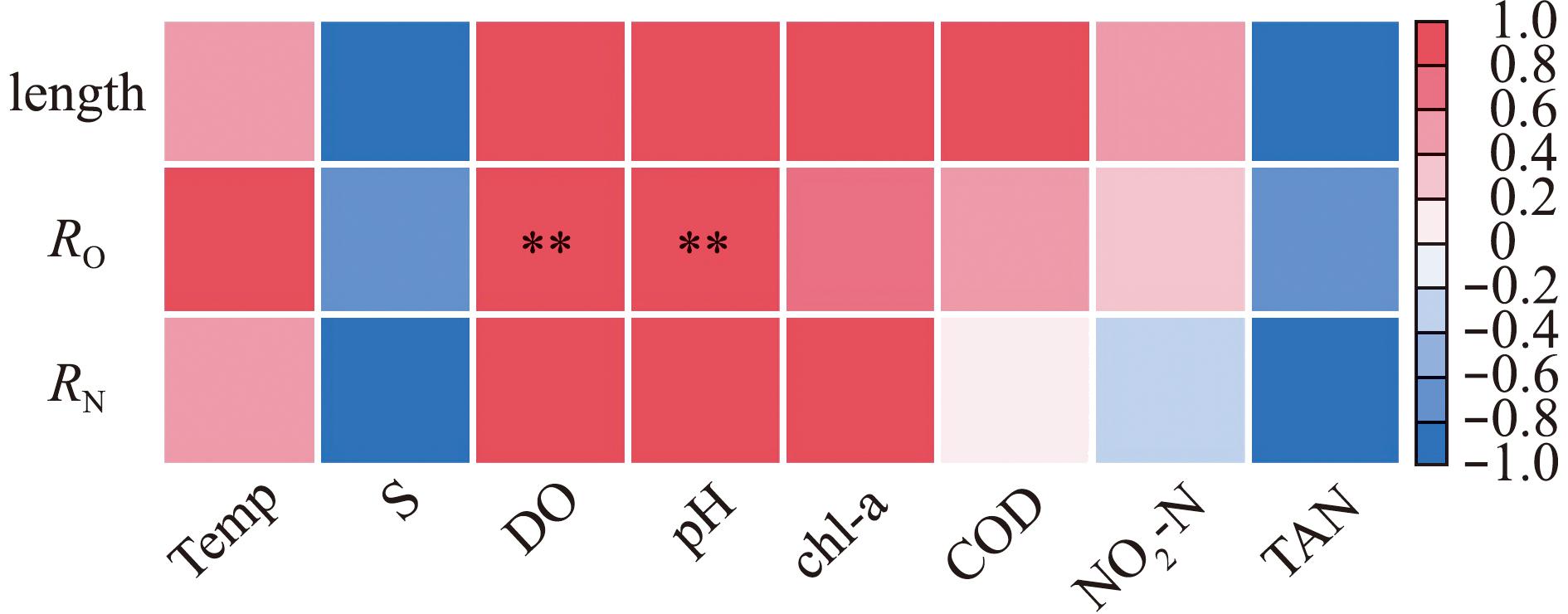
图8 蛤仔生长代谢与水质相关性分析
Fig.8 Correlation analysis between growth and water quality of Ruditapes philippinarum
3 讨论
3.1 夏季北方池塘蛤仔中间育成效果
实现蛤仔苗种生产的本地化,对于推动北方滩涂蛤仔养殖产业的可持续发展具有重要意义。在蛤仔苗种生产过程中,从室内繁育到滩涂养殖间的室外池塘中间育成可以使蛤仔苗种能够逐步适应外界复杂多变的自然环境条件,包括温度、盐度、光照和水流速度等,从而提高养殖存活率。同时,中间育成环节还能为滩涂养殖提供大规格苗种,提高养殖周期的灵活性,有助于养殖经营人根据市场需求和海区条件,科学合理地规划生产安排。然而,夏季高温期池塘水质的动态变化,可能对蛤仔的中间育成效果产生不利影响。
生长速度是评估蛤仔北方夏季池塘中间育成效果的关键指标之一。本研究表明,在2023年7月30日—9月10日,蛤仔的壳长平均增长了3.93 mm,且呈现出良好的生长速率。这一结果与闫喜武等[8]在辽宁大连海量水产食品有限公司育苗场的试验结果相近,该试验在2003年6月14日放苗后,于同年8月5日观测到蛤仔壳长月平均增长为4.16 mm。刘忠颖等[6]在辽宁普兰店皮口镇科洋水产有限公司选择室内人工繁育的平均壳长为1.74 mm的蛤仔苗种进行生产性池塘中间育成试验,在当年8月23日—11月23日测定发现,池塘中稚贝的壳长月平均增长为2.79 mm,研究者认为,池塘中饵料含量的高低是影响蛤仔中间育成效果的直接因素,通过人工控制饵料数量、施肥、换水等生产管理措施,将有利于稚贝在池塘中生长。但是,闫喜武等[8]在同一个试验地点发现,2003年7月30日放苗,8月16日测定蛤仔壳长月平均增长仅为0.80 mm,远低于其在6月的放苗效果,研究者认为,这次中间育成效果差的原因,可能是7月30日放苗的蛤仔中间育成池塘中敌害生物侵袭或饵料生物不足。本研究在夏季开展了蛤仔池塘中间育成研究,当蛤仔中间育成池塘水质稳定时,蛤仔作为滤食性贝类,池塘内稳定的颗粒有机物和浮游植物供应,能够为蛤仔生长提供充足的饵料来源,有助于蛤仔稚贝的生长,这些结果为蛤仔中间育成技术的优化提供了重要参考。
蛤仔的代谢特征是评估其生长状况的重要指标,笔者通过测定池塘中间育成蛤仔的耗氧率和排氨率,以评估夏季北方池塘中培蛤仔个体的健康活力状态。胥贤等[12]选择壳长为17 mm的蛤仔,在水温为7.6 ℃时,测得其耗氧率为0.237~0.301 mg/(g·h),排氨率为0.016~0.017 mg/(g·h),其耗氧率和排氨率的结果均低于本试验结果,其原因应是水温对蛤仔呼吸代谢的能量收支造成影响[13]。张继红等[14]在水温为3 ℃~8 ℃时测得平均壳长为2.96 cm蛤仔的耗氧率也仅为0.18~0.90 mg/(g·h),排氨率仅为1.4~16.8 μg/(g·h),研究者发现,水温对蛤仔耗氧率和排氨率的影响呈正相关,且在适温范围内随着温度升高蛤仔代谢增强。聂鸿涛等[15]研究也发现,温度对蛤仔的耗氧率和排氨率影响显著,壳长为(20.90±1.34) mm的蛤仔在水温为30 ℃时,耗氧率和排氨率分别为2.563、0.079 mg/(g·h),此结果与本研究结果相近,但该研究选用的蛤仔规格略高于本研究使用的蛤仔稚贝。
本研究首次开展了中间育成阶段蛤仔的时序代谢特征研究,发现随着蛤仔池塘中间育成时间的增加,蛤仔稚贝的个体规格不断增大,蛤仔归一化体质量的耗氧率和排氨率均呈逐渐下降的趋势,这与王芳等[16]的研究结果相同,即随着蛤仔规格的增大,单位时间、干质量的耗氧率和排氨率均呈下降趋势,表明个体发育过程中呼吸表面积/体积比的降低导致代谢强度递减。姜祖辉等[17]也发现,蛤仔体质量对耗氧率和排氨率影响显著,表现出耗氧率和排氨率随个体增大而下降的趋势,即体质量与蛤仔代谢呈负相关。王晓宇等[18]研究证实,不同规格的蛤仔呼吸排泄速率具有明显的差异,单位个体耗氧率和排氨率均随蛤仔个体大小的增加而增加,而单位体质量蛤仔耗氧率和排氨率则随个体大小的增加而降低。
除了耗氧率和排氨率,O∶N比值同样是指示能量代谢途径的重要指标。当O∶N值较低时,表明蛋白质分解主导能量代谢;当O∶N值为24左右时,蛋白质和脂肪同时为生物体提供能量;如脂肪和碳水化合物成为主要的供能物质,则O∶N值大于24。本试验中测得池塘中间育成蛤仔的O∶N范围为20.08~28.71,在本试验初期阶段(7月30日),蛤仔的O∶N值为20.08,反映此时蛋白质代谢为主要供能途径;在试验中期阶段(8月20日) O∶N值升至28.71,较初始值提升了42.96%,显示碳水化合物代谢贡献率明显增加;在试验末期阶段(9月10日),虽然O∶N值略降至27.93,但仍大于24,表明夏季高温期中间育成蛤仔的代谢主要依靠脂肪和碳水化合物。这表明随着O∶N值的升高,中间育成蛤仔通过生理适应机制调整代谢底物利用策略来应对池塘高温胁迫[19],中间育成初期小规格蛤仔体内是蛋白质和脂肪分解代谢占据主导地位,当达到较大规格时,蛤仔的呼吸代谢可能转向主要依靠脂肪和碳水化合物,其呼吸代谢的主要供能物质发生变化,这表明高温(>28 ℃)可能诱导蛤仔能量代谢模式由蛋白质主导型向碳水化合物主导型转变,蛤仔的呼吸代谢存在温度驱动代谢模式转变。本研究中表明,在夏季池塘水温较高且水质稳定时,蛤仔能够有效地调节其代谢路径,以适应池塘环境的变化,保持正常的生长和发育,这与双壳类应对热应激的代谢策略一致,这种代谢可塑性是中间育成蛤仔在高温期仍保持较高生长速率的生理基础。需要进一步指出的是,不同的研究者对蛤仔的耗氧率、排氨率及O∶N的测定结果不应简单地直接进行数值大小的对比,这是因为蛤仔的呼吸代谢强度不仅与蛤仔规格有关,而且与蛤仔所处的水环境条件密切相关。如王芳等[16]发现,埋栖物(砂子)会影响蛤仔的呼吸代谢;聂鸿涛等[15]研究表明,盐度变化会对蛤仔的耗氧率和排氨率影响显著;张文斌等[20]发现,缺氧胁迫会对蛤仔的生理代谢产生明显影响。因此,池塘中间育成蛤仔的代谢特征与池塘的养殖水环境条件密切相关。
3.2 夏季北方池塘温度及盐度对中间育成蛤仔影响
近年来,中国北方地区蛤仔池塘中间育成技术不断改进,这使得北方池塘中间育成的大规格蛤仔苗种在北方海区的放养比例逐渐提高。然而,蛤仔苗种在北方池塘中间育成过程中,依旧面临着诸多挑战,其中气候变化对蛤仔养殖的影响尤为关键。众多学者的研究已证实气候变化对蛤仔养殖的不利作用。Li等[21]研究指出,天气的极端变化可能会对蛤仔的免疫状态造成不利影响;Galimany等[9]发现,极端的夏季高温和pH环境会显著影响蛤仔苗种的生理代谢;Liu等[11]通过收集大量环境和生物数据推断,2019年夏季莱州湾水产养殖区内蛤仔的大规模死亡,与包括相对较高水温在内的多种环境胁迫因素同时存在密切关联。北方夏季养殖池塘的水质极易受到气候变化(如高温、降雨、风力等)的显著影响,而这些环境因子的突变会极大地改变中间育成蛤仔的代谢和生长情况。
水温是影响水生生物生理活动的关键因素,对蛤仔的呼吸代谢起着显著的调控作用。夏季长时间的高温环境会促使蛤仔的呼吸代谢需求增加,以维持其正常的生理功能。本研究聚焦于夏季北方池塘中间育成蛤仔的生长代谢与水环境因子的相关性,监测发现,在夏季高温窗口期蛤仔池塘的水温最高值为29.6 ℃,且未对蛤仔的正常生长和代谢造成明显负面影响,这与姜宏波等[22]研究中当水温低于30 ℃时蛤仔代谢与温度的相关结论一致,且进一步丰富了已有蛤仔对水温适应情况的研究。吴磊等[23]研究指出,在适宜温度范围内,蛤仔幼虫的生长发育速度会随温度升高而加快,当温度超出耐受范围时,生长发育会减缓甚至停滞。同时,温度骤变会导致蛤仔的耗氧率显著上升,说明其应对环境温度变化需消耗更多能量以维持生理活动。此外,蛤仔在极端高温胁迫下的分子应答机制研究显示,急性热应激可诱导蛤仔体内miRNAs差异表达显著,其中保守miRNAs与温度响应调控网络强关联。KEGG富集分析表明,代谢/信号通路在热应激条件下显著富集,可能与蛤仔的抗逆特性密切相关。如FoxO信号通路激活,该通路通过上调SOD、CAT等抗氧化酶基因表达,有效清除热应激产生的活性氧自由基,这与双壳贝类在潮间带极端环境中的生存策略高度相符。另外,泛素介导的蛋白水解途径的显著富集,提示蛋白质质量控制机制在热损伤修复中发挥关键作用,这可能是软体动物特有的温度适应机制,为后续研究蛤仔应对高温胁迫的分子机制提供了新视角[24]。
本研究中还发现,蛤仔中间育成池塘水的盐度变化范围为20.6~24.4,这一变动范围对蛤仔生长无明显影响。林笔水等[25]的研究表明,蛤仔幼虫的适宜发育盐度范围为14.0~33.5,最适生长盐度为20.5。夏季养殖池塘水体的盐度易受降雨影响而明显下降,这会对蛤仔的生长和生理代谢产生不利作用。蛤仔主要通过鳃呼吸,盐度下降会破坏其鳃丝结构,显著抑制蛤仔的呼吸和生理代谢,影响蛤仔呼吸和生长[26]。Velez等[27]的研究显示,盐度降低会导致蛤仔的耗氧率升高,意味着蛤仔需消耗更多能量维持体内渗透压平衡。在低盐度环境下,蛤仔会出现明显应激反应,表现为呼吸节律出现异常[28]。
3.3 夏季北方池塘水质因子对中间育成蛤仔影响
海水pH值同样是影响蛤仔生理发育和代谢的重要环境因子,极端pH会干扰其生理功能。Zhao等[29]的试验证实,当pH约为8时,蛤仔排出体内废物的频率最快,表明其代谢活动较为活跃。陈强等[30]的研究显示,当pH低于8时,蛤仔的耗氧率和排氨率呈现下降趋势,说明低pH环境对蛤仔的呼吸代谢和免疫功能具有抑制作用。陈丽梅等[31]对胶州湾底播蛤仔滤水率的研究发现,蛤仔的适宜pH范围为7.2~8.2。此外,蛤仔稚贝在pH为6~9条件下均能完成100%的潜沙行为,且在pH为8~8.5时潜沙速度最快[32]。
除了水温、盐度和pH外,本研究还发现,DO、COD、叶绿素a、亚硝酸盐氮和总氨氮均与蛤仔的生长代谢密切相关。水体DO浓度范围为4.72~7.13 mg/L时,可以满足蛤仔的呼吸需求,且与蛤仔的生长代谢呈显著正相关。DO作为池塘养殖的关键水质指标,不仅直接影响养殖生物密度,还决定了水体中还原性物质的浓度。COD浓度为2.49~4.32 mg/L,表明蛤仔中间育成过程中水体有机污染水平相对稳定。但过高的COD浓度会导致水体恶化,因其分解矿化过程会大量消耗溶解氧,影响蛤仔生长。叶绿素a浓度是反映水体浮游植物生物量的重要指标,也是蛤仔饵料的主要来源。本研究中,叶绿素a浓度波动范围较大,7月30日为3.66 μg/L,8月20日达16.86 μg/L。Zanella等[33]在意大利亚得里亚海北部的研究中发现,在采用初始壳长为1.8~2.6 mm的蛤仔进行中间育成试验时,当放养密度为100~300 ind./cm2时,试验水体中春季叶绿素a的平均浓度保持在1.3 μg/L,秋季为3.8 μg/L,且发现叶绿素a浓度变化对蛤仔特定生长率无明显影响。亚硝酸盐氮和总氨氮是水体中常见的氮化合物,对蛤仔的生长代谢具有潜在影响[26,34]。本试验中,亚硝酸盐氮浓度范围为0.010~0.310 mg/L,处于较低水平,不会对蛤仔生长造成显著影响。然而,高浓度的亚硝酸盐氮会干扰蛤仔体内血液的氧气运输,导致发育不良,降低其免疫力和呼吸代谢能力[35-36]。本研究中池塘水中总氨氮浓度为0.020~0.580 mg/L,处于安全范围内,但仍需定期监测,因为高浓度氨氮胁迫可能对蛤仔的生长发育产生负面影响,如王文琪等[37]的研究表明,氨氮浓度升高会显著增加蛤仔的死亡率;Cong等[38]研究发现,氨暴露会导致蛤仔体内溶酶体不稳定、代谢紊乱、鳃结构异常和神经递质变化,导致呼吸和免疫方面的功能失调;田雯雯[39]发现,即使在0.1 mg/L的氨氮浓度下,长期暴露仍会对蛤仔产生毒性效应。综上,为了应对水质波动对蛤仔养殖的潜在威胁,可使用智能化的水质监测和管理系统,以实现实时水质监测。
4 结论
1)本研究中阐明了北方池塘中间育成蛤仔在夏季高温期的呼吸代谢变化规律,发现随着中间育成蛤仔规格的增大,其单位体质量的耗氧率和排氨率均呈下降趋势。同时,蛤仔O∶N值的时序变化可知,夏季高温驱动(非生长阶段差异)其能量供给模式从蛋白质分解转向碳水化合物/脂肪代谢为主。蛤仔通过激活其代谢可塑性表达,进而形成维持池塘中间育成阶段生长速率的高温适应性机制。
2)通过对池塘中间育成蛤仔的生长代谢与水质相关性分析可知,夏季北方蛤仔生长代谢与蛤仔中间育成池塘水中DO和pH呈极显著正相关,与水温和叶绿素a呈显著正相关,揭示了夏季北方池塘中间育成蛤仔可实现“高温-高代谢-稳定生长”的关键是良好的水质调控策略,这为夏季蛤仔池塘中间育成的精准养殖管理提供了技术参考。
[1] 闫喜武,霍忠明.菲律宾蛤仔“斑马蛤2号”[J].中国水产,2022(1):102-106.
YAN X W,HUO Z M.Philippine clam “Zebra clam 2” [J].China Fisheries,2022(1):102-106.(in Chinese)
[2] 车向庆,张刚.菲律宾蛤仔土池中间培育技术[J].科学养鱼,2022(5):62-63.
CHE X Q,ZHANG G.Intermediate cultivation techniques of Ruditapes philippinarum in soil pond[J].Scientific Fish Farming,2022(5):62-63.(in Chinese)
[3] 郭文,房慧,潘雷,等.菲律宾蛤仔苗种土池中间培育及越冬生产实验[J].海洋科学,2005,29(8):4-6.
GUO W,FANG H,PAN L,et al.Overwintering cultivation of Ruditapes philippinarum (Adams et Reeve) and intermediate pond preparation[J].Marine Sciences,2005,29(8):4-6.(in Chinese)
[4] 温子川.菲律宾蛤仔“斑马蛤” 中间育成的研究[D].大连:大连海洋大学,2016.
WEN Z C.Study on intermediate breeding of Ruditapes philippinarum “Zebra clam” [D].Dalian:Dalian Ocean University,2016.(in Chinese)
[5] 祁剑飞,巫旗生,宁岳,等.菲律宾蛤仔浅海规模化苗种中间培育调查[J].渔业研究,2020,42(1):57-62.
QI J F,WU Q S,NING Y,et al.Nursery culture for commercial Manila clam (Ruditapes philippinarum) spat in subtidal zoon[J].Journal of Fisheries Research,2020,42(1):57-62.(in Chinese)
[6] 刘忠颖,李大成,王志松,等.滩涂与土池进行菲律宾蛤仔稚贝中间育成的效果比较[J].水产科学,2004,23(1):22-24.
LIU Z Y,LI D C,WANG Z S,et al.Comparative study on culture of larval clam Ruditapes philippinarum in beaches and earthern ponds[J].Fisheries Science,2004,23(1):22-24.(in Chinese)
[7] 周栋田,朱明,施并章,等.土池人工培育菲律宾蛤仔稚贝研究[J].厦门大学学报,1984,23(4):515-522.
ZHOU D T,ZHU M,SHI B Z,et al.Studies on the argtifical culture of philippine clam Ruditapes philippinarum (Adams et Reeve) in the ponds[J].Journal of Xiamen University,1984,23(4),515-522.(in Chinese)
[8] 闫喜武,张国范,杨凤,等.菲律宾蛤仔土池中间育成的研究[J].水产科学,2006,25(9):433-437.
YAN X W,ZHANG G F,YANG F,et al.Interim breeding of Manila clam Ruditapes philippinarumm in earthen ponds[J].Fisheries Science,2006,25(9):433-437.(in Chinese)
[9] GALIMANY E,LUCAS A,MAYNOU F,et al.Experimental determination of differential seasonal response in seed of the Manila clam,Ruditapes philippinarum,in context of climate change[J].Aquaculture,2023,576:739891.
[10] XU X,YANG F,ZHAO L Q,et al.Seawater acidification affects the physiological energetics and spawning capacity of the Manila clam Ruditapes philippinarum during gonadal maturation[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2016,196:20-29.
[11] LIU Y,REN J S,WANG X M,et al.Environmental influence on summer survival of Manila Clam Ruditapes philippinarum:a case study in an aquaculture bay[J].Marine Environmental Research,2023,192:106242.
[12] 胥贤,杨凤,朱恒涛,等.低温对3种壳色菲律宾蛤仔幼贝耗氧率和排氨率的影响[J].大连海洋大学学报,2015,30(6):627-633.
XU X,YANG F,ZHU H T,et al.Effects of low temperature on oxygen consumption rate,ammonia excretion rate of juvenile Manila clam Ruditapes philippinarum with three color shells[J].Journal of Dalian Ocean University,2015,30(6):627-633.(in Chinese)
[13] HAN K N,LEE S W,WANG S Y.The effect of temperature on the energy budget of the Manila clam,Ruditapes philippinarum[J].Aquaculture International,2008,16(2):143-152.
[14] 张继红,方建光,金显仕,等.低温对菲律宾蛤仔能量收支的影响[J].水产学报,2002,26(5):423-427.
ZHANG J H,FANG J G,JIN X S,et al.Effect of energy budget of short-necked clam Ruditapes philippinarum under low temperature[J].Journal of Fisheries of China,2002,26(5):423-427.(in Chinese)
[15] 聂鸿涛,霍忠明,侯晓琳,等.温度和盐度突变对菲律宾蛤仔斑马蛤耗氧率和排氨率的影响[J].水生生物学报,2017,41(1):121-126.
NIE H T,HUO Z M,HOU X L,et al.Comparison study on the effect of temperature and salinity on oxygen consumption and ammonia excretion in Zebra strain and wild Ruditapes philippinarum[J].Acta Hydrobiologica Sinica,2017,41(1):121-126.(in Chinese)
[16] 王芳,董双林,王涛,等.菲律宾蛤仔呼吸和排泄规律的研究[J].海洋科学,1998,22(2):1-3.
WANG F,DONG S L,WANG T,et al.Study on the law of respiration and excretion of Ruditapes philippinarum[J].Marine Sciences,1998,22(2):1-3.(in Chinese)
[17] 姜祖辉,王俊,唐启升.菲律宾蛤仔生理生态学研究 Ⅰ.温度、体重及摄食状态对耗氧率及排氨率的影响[J].海洋水产研究,1999,20(1):40-44.
JIANG Z H,WANG J,TANG Q S.Studies on physiological ecology of short-necked clam (Ruditapes philippinarum)Ⅰ.effects of temperature,body weight and feeding state on oxygen consumption rate and ammonia excretion rate[J].Marine Fisherries Reseach,1999,20(1):40-44.(in Chinese)
[18] 王晓宇,周毅,杨红生.胶州湾菲律宾蛤仔(Ruditapes philippinarum)呼吸排泄作用的现场研究[J].海洋与湖沼,2011,42(5):722-727.
WANG X Y,ZHOU Y,YANG H S.In situ study of respiration and excretion of the Manila clam Ruditapes philippinarum in the Jiaozhou bay[J].Oceanologia et Limnologia Sinica,2011,42(5):722-727.(in Chinese)
[19] 肖国强,张炯明,柴雪良,等.菲律宾蛤仔稚贝摄食、呼吸和排泄率的研究[J].台湾海峡,2006,25(1):30-35.
XIAO G Q,ZHANG J M,CHAI X L,et al.Sutdies on the filtration feeding,respiration and excretion of Ruditapes philippinarum juvenile[J].Journal of Oceanography in Taiwan Strait,2006,25(1):30-35.(in Chinese)
[20] 张文斌,吕振波,张莹,等.缺氧胁迫对菲律宾蛤仔(Ruditapes philippinarum)生理代谢的影响[J].生态学杂志,2014,33(9):2448-2453.
ZHANG W B,LÜ Z B,ZHANG Y,et al.Influence of hypoxia stress on physiological metabolism of Ruditapes philippinarum[J].Chinese Journal of Ecology,2014,33(9):2448-2453.(in Chinese)
[21] LI R L,WANG J J,HAN W,et al.Mathematical description of the immunochemical response of the Manila clam (Ruditapes philippinarum) to extreme temperature reductions[J].Water,2025,17(1):93.
[22] 姜宏波,宋忠涛,包杰,等.不同温度及突变方式对菲律宾蛤仔耗氧率的影响[J].现代畜牧兽医,2014(3):5-8.
JIANG H B,SONG Z T,BAO J,et al.Effect of different temperatures and abrupt change on oxygen consumption rate of Ruditapes philippinarum[J].Modern Journal of Animal Husbandry and Veterinary Medicine,2014(3):5-8.(in Chinese)
[23] 吴磊,涂康,周丽青,等.温度、盐度和密度对菲律宾蛤仔稚贝生长和存活的影响[J].中国海洋大学学报(自然科学版),2024,54(1):58-66.
WU L,TU K,ZHOU L Q,et al.Effects of temperature,salinity and density on the growth and survival in spats of clam (Ruditapes philippinarum)[J].Periodical of Ocean University of China(Natural Science Edition),2024,54(1):58-66.(in Chinese)
[24] GAO C S,NIE H T.Exploring the heat-responsive miRNAs and their target gene regulation in Ruditapes philippinarum under acute heat stress[J].Marine Biotechnology,2024,26(4):810-826.
[25] 林笔水,吴天明,黄炳章.温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J].水产学报,1983,7(1):15-23.
LIN B S,WU T M,HUANG B Z.The effects of temperature and salinity on the growth and development of spats of the clam (Ruditapes philippinarum)[J].Journal of Fisheries of China,1983,7(1):15-23.(in Chinese)
[26] 周红,谷晶,朱弦一,等.盐度和亚硝酸盐氮胁迫对菲律宾蛤仔“斑马蛤2号” 和莆田群体代谢的影响[J].大连海洋大学学报,2023,38(4):630-636.
ZHOU H,GU J,ZHU X Y,et al.Synergistic stress of salinity and nitrite on metabolism of “Zebra 2” and Putian population of Manila clam (Ruditapes philippinarum)[J].Journal of Dalian Ocean University,2023,38(4):630-636.(in Chinese)
[27] VELEZ C,FIGUEIRA E,SOARES A M V M,et al.Combined effects of seawater acidification and salinity changes in Ruditapes philippinarum[J].Aquatic Toxicology,2016,176:141-150.
[28] KIM W S,HUH H T,HUH S H,et al.Effects of salinity on endogenous rhythm of the Manila clam,Ruditapes philippinarum (Bivalvia:Veneridae)[J].Marine Biology,2001,138(1):157-162.
[29] ZHAO L Q,YANG F,MILANO S,et al.Transgenerational acclimation to seawater acidification in the Manila clam Ruditapes philippinarum:Preferential uptake of metabolic carbon[J].Science of the Total Environment,2018,627:95-103.
[30] 陈强,林毅,黎中宝,等.pH胁迫对菲律宾蛤仔(Ruditapes philippinarum)耗氧率、排氨率、免疫和抗氧化酶活性以及组织形态的影响[J].海洋与湖沼,2023,54(5):1424-1433.
CHEN Q,LIN Y,LI Z B,et al.Effects of pH stress on oxygen consumption rate,ammonia excretion rate,immune and antioxidant enzyme activity and tissue morphology of clam Ruditapes philippinarum[J].Oceanologia et Limnologia Sinica,2023,54(5):1424-1433.(in Chinese)
[31] 陈丽梅,任一平,徐宾铎.环境因子对胶州湾移植底播菲律宾蛤仔滤水率的影响[J].南方水产,2007,3(2):30-35.
CHEN L M,REN Y P,XU B D.Effects of environmental factors on the clearance rate of the transplant enhanced Manila clam (Ruditapes philippinarum) in the Jiaozhou Bay[J].South China Fisheries Science,2007,3(2):30-35.(in Chinese)
[32] 杨凤,曾超,王华,等.环境因子及规格对菲律宾蛤仔幼贝潜沙行为的影响[J].生态学报,2016,36(3):795-802.
YANG F,ZENG C,WANG H,et al.Effects of environmental factors and clam size on the burrowing behavior of Manila clam Ruditapes philippinarum[J].Acta Ecologica Sinica,2016,36(3):795-802.(in Chinese)
[33] ZANELLA L,PASTRES R,FREGUGLIA M,et al.Effects of water flow rate and stocking density on the early pre-fattening of Manila clams (Ruditapes philippinarum) farmed in a North Adriatic “Valle da Pesca” (Italy)[J].Aquaculture International,2025,33(3):161.
[34] LÜ J S,CAO T F,JI C L,et al.Digital gene expression analysis in the gills of Ruditapes philippinarum after nitrite exposure[J].Ecotoxicology and Environmental Safety,2019,184:109661.
[35] 陈震楠,刘念,张跃环,等.亚硝酸态氮对菲律宾蛤仔浮游幼虫及幼贝的急性毒性[J].大连海洋大学学报,2019,34(3):399-404.
CHEN Z N,LIU N,ZHANG Y H,et al.Acute toxicity of nitrite nitrogen to planktonic larvae and juveiles of Manila clam Ruditapes philippinarum[J].Journal of Dalian Ocean University,2019,34(3):399-404.(in Chinese)
[36] MA Q Y,JIN Y,JAHAN K,et al.Effects of ammonia nitrogen on early growth and survival of the “Zebra 2” strain of the Manila clam (Ruditapes philippinarum)[J].Aquaculture Research,2021,52(10):4767-4775.
[37] 王文琪,姜令绪,杨宁,等.氨氮对菲律宾蛤仔免疫力的影响[J].海洋科学,2007,31(1):23-27.
WANG W Q,JIANG L X,YANG N,et al.The effect of ammonia-N on immune activity of Ruditapes philippinarum[J].Marine Sciences,2007,31(1):23-27.(in Chinese)
[38] CONG M,WU H F,CAO T F,et al.Digital gene expression analysis in the gills of Ruditapes philippinarum exposed to short- and long-term exposures of ammonia nitrogen[J].Aquatic Toxicology,2018,194:121-131.
[39] 田雯雯.氨氮对菲律宾蛤仔miRNA表达谱的影响及代表性miRNAs的响应特征研究[D].烟台:烟台大学,2024.
TIAN W W.Effect of ammonia nitrogen on the expression profile of miRNA in Ruditapes philippinarum and the response characteristics of representative miRNAs[D].Yantai:Yantai University,2024.(in Chinese)