盐度是影响水生生物分布和群落结构的重要环境因子,与鱼类的生长、发育、免疫调节等生理活动密切相关[1]。大部分鱼类仅能在特定盐度阈值内维持正常生理状态,当环境盐度突破耐受阈值时,机体的渗透平衡将被破坏,严重时可导致个体死亡[2]。盐度胁迫下鱼体会出现代谢过程紊乱、免疫功能抑制及生长繁殖障碍等表现,显著影响鱼类的生理稳态,且不同盐度条件下鱼类会表现出不同的适应状态[3-4]。面对盐度变化,鱼类会通过自身特有的器官及各种生理变化来调整内外渗透压的动态平衡以尽可能保持稳态[5]。鱼类主要通过鳃、肾脏及肠道等器官进行渗透调节,鳃作为鱼类呼吸器官,在维持离子平衡和渗透调节方面发挥着至关重要的作用。研究表明,硬骨鱼中鳃泌氯细胞的数量和结构可以根据盐度进行调整[6-7]。肝脏也是鱼类代谢的重要器官,是调节渗透压机制的主要碳水化合物代谢物来源,在调节鱼类对环境变化的适应性中起到关键作用[8]。鱼类血液指标是反映鱼体健康状态的重要标尺,盐度胁迫下鱼体的神经内分泌系统的调节作用可以通过血液渗透压、无机盐离子及血液代谢物等指标来评价鱼类的生理、营养及对环境的适应状况[9]。此外,盐度变化使鱼体产生有害的活性氧自由基,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)等自由基清除酶是机体抗氧化酶系统的重要组成部分,在鱼类渗透调节过程中发挥重要作用[10]。
白鲑属(Coregonus)的鱼类大多具有广盐性,能够适应不同盐度的水域。Madsen等[11]研究显示,真白鲑(Coregonus Lavaretus)可以适应盐度25的环境,但在转移到盐度32后死亡。尖吻白鲑(Coregonus oxyrinchus)幼鱼能够适应盐度18条件[12]。宽鼻白鲑(Coregonus nasus)的盐度适应范围为0~30[13]。乌苏里白鲑(Coregonus ussuriensis ),又名“兔子鱼”,隶属于鲑科白鲑亚科白鲑属,主要分布于中国黑龙江流域及俄罗斯西伯利亚、萨哈林等水域[14]。1998年,该物种被列入《中国濒危动物(鱼类)红皮书》名录[15]。王继隆等[16]结合耳石年轮特征分析,结果推测乌苏里白鲑具有季节洄游特征,存在江海或淡水至河口之间的洄游履历,然而关于该物种的盐度适应范围研究尚未见报道。本研究中初步探讨不同盐度对循环系统中乌苏里白鲑存活、生长和应激的影响,以期筛选出适宜的养殖盐度,为今后人工增殖放流和半咸水养殖提供科学依据。
1 材料与方法
1.1 材料
试验用乌苏里白鲑幼鱼源自黑龙江水产研究所渤海冷水性鱼类试验站(牡丹江),平均体长为(15.0±1.5) cm,平均体质量为(30.0±3.5) g。带水充气运回实验室,在循环控温水族箱(80 cm×60 cm×50 cm)中驯化两周后,挑选规格整齐的幼鱼进行盐度试验。水源为地下冷泉水,经充分曝气后,用过滤器净化、紫外线杀菌处理。试验期间各组水温控制在12.0 ℃±0.1 ℃,溶解氧为 7.8~10.0 mg/L,pH为7.2~7.5。光周期为12L∶12D,光照强度为500 lx。日投喂商业饲料2次,投饵量为鱼体质量的2%,投喂30 min后除去水中残饵。驯化及试验期间每周换水1次,换水量为30%~40%,用于换水的海水预先配制,盐度差小于0.5,温度差小于0.5 ℃。
1.2 方法
1.2.1 盐度试验设计 盐度试验设计5个试验组,分别为0(S0,淡水对照)、8(S8)、16(S16)、24(S24)、32(S32)。除对照组外,各个试验组的盐度每天升4,直至达到设定盐度,试验周期为30 d。试验水源采用海水素配制,盐度计测定盐度值(误差≤±0.5),每个试验组设置3个重复,每一平行放养15尾幼鱼,每组放置45尾。养殖结束后,试验鱼禁食24 h后取样,取样前使用100 mg/mL 的MS-222进行麻醉,采集血液、肝脏和鳃组织样品用于后续试验。
1.2.2 血浆生理指标检测 鱼体麻醉后在冰盘上进行尾椎取血(n=9),血液样品4 ℃下以3 500 r/min离心15 min,吸取上清液于-80 ℃冰箱中保存备用。用蒸汽压渗透压计(Fiske One Ten Osmeter,Fiske,VT)检测血浆渗透压。使用原子吸收分光光度法(Philips PU7000)检测血浆Na+、K+、Mg2+、Ca2+和P+水平,并使用Choride Sigma-Aldrich试剂盒(货号:A070-2)测量Cl-水平。使用Sigama-Aldrich的商业试剂盒(glucose HK#16-20UV)检测血浆葡萄糖。谷草转氨酶(AST)、谷丙转氨酶(ALT)和尿素氮(UREA)由南京建成生物工程研究所的试剂盒(货号:C009-2-1;C010-2-1;C013-2-1)进行检测。在全自动生化分析仪(Olympus AU 600,Japan)上读取测定结果[12]。
1.2.3 组织切片 采集鳃和肝脏组织样品(n=6),用Bouin’s液固定,乙醇脱水,二甲苯透明,石蜡包埋。采用KD1508型切片切割样品,制备5 μm厚的切片,之后经苏木素伊红(hematoxylin-eosin,HE)染色,中性树脂封片。制好的组织切片通过Olympus CX41显微镜观察并拍照。
1.2.4 生长及生理指标测定 每组取6尾试验鱼,收集盐度处理后的肝脏,并保存在-80 ℃进行酶活性分析。SOD采用南京建成生物工程研究所提供的试剂盒检测过氧化氢酶 (CAT)和谷胱甘肽过氧化物酶(GSH-Px)均采用考马斯亮蓝法检测组织总蛋白含量。
特定生长率(SGR)、存活率(SR)计算公式为
RSGR=(lnWT-lnW0)/T×100%,
(1)
RSR=(NT/N0)×100%。
(2)
式中:W0为试验开始时幼鱼体质量(g);WT为试验结束时的幼鱼体质量(g);T为试验时间(d);N0为试验开始时乌苏里白鲑的尾数(ind.);NT为试验结束时的幼鱼的存活尾数(ind.)。
1.3 数据处理
试验数据采用平均值±标准差(mean±S.D.)表示,使用SPSS 22.0和Excel 2016软件进行统计分析,在单因子方差分析的基础上采用Duncan多重比较检验组间差异显著性,显著性差异设为0.05,极显著性差异设为0.01。
2 结果与分析
2.1 存活率和生长性能
在试验中,高盐度组(S32)较对照组的存活率和特定生长率有显著性差异(P<0.05)。从表1可见,直至S24盐度,在试验期间乌苏里白鲑均能正常存活,无死亡现象。而在S32盐度下,乌苏里白鲑存活率显著下降至21.4%(P<0.05)。对照组中乌苏里白鲑的末体质量为(53.33±5.53) g,特定增长率为1.24%,然而,在S32盐度下,出现了负增长的现象。SGR呈现相似的变化规律。
表1 不同盐度处理下乌苏里白鲑的存活和生长
Tab.1 Survival and growth of juvenile Coregonus ussuriensis in different salinity groups

组别 group 存活率/% survivalrate 初始体质量/g IW 末体质量/g FW 特定生长率/% SGR S0 100a 35.08±3.73a 53.33±5.53a 1.24a S8 100a 37.47±2.22a 49.44±3.80a 1.17a S16 100a 34.15±2.23a 50.00±5.59a 1.22a S24 100a 36.29±1.51a 47.00±3.94a 1.02a S32 21.4b 34.66±3.65a 30.77±5.28b -0.47b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different among the groups(P<0.05),and the means with the same letter within the same column are not significant different(P>0.05),et sequential.
2.2 乌苏里白鲑盐度处理下血液生理指标
盐度处理下乌苏里白鲑血浆生理指标见表2,随着盐度的增加,血浆渗透压呈逐渐上升的趋势,在S32盐度下较对照组有显著性差异(P<0.05)。血浆中Na+和Mg2+的浓度变化趋势同渗透压趋势基本一致,而K+浓度则随着盐度梯度增加逐渐下降。Cl-的变化最为显著,在S24组较对照组产生了显著性差异(P<0.05)。然而,Ca2+和P+浓度未产生显著性变化。从表3可见,乌苏里白鲑血浆中血糖在S0~S24盐度组无显著性差异(P>0.05),而在S32盐度时血糖浓度显著升高(P<0.05)。ALT和AST浓度随着盐度的升高逐渐下降,UREA含量各盐度组无显著性差异(P>0.05)。
表2 不同盐度处理下乌苏里白鲑幼鱼的血浆渗透压和电解质含量
Tab.2 Plasma osmolality pressure and electrolytes content of juvenile Coregonus ussuriensis in different salinity groups

组别 group 渗透压/ (m·L-1) osmolality Na+/ (mmol·L-1) K+/ (mmol·L-1) Mg2+/ (mmol·L-1) Ca2+/ (mmol·L-1) Cl-/ (mmol·L-1) P+/ (mmol·L-1) S0 296.98±5.37a 151.33±3.09a 2.39±0.24a 1.24±0.23a 2.97±0.14a 121.33±2.49a 5.60±1.08a S8 293.14±8.75a 154.33±1.24a 1.74±0.30ab 1.23±0.19a 2.89±0.44a 123.67±0.94ab 5.03±1.31a S16 301.0±13.29a 156.00±5.71a 1.51±0.37b 1.37±0.54a 2.85±0.14a 130.67±3.85bc 3.62±0.23a S24 307.05±7.32a 153.67±1.25a 1.46±0.39b 1.61±0.26a 3.37±0.12a 133.00±3.74c 4.15±0.46a S32 407.78±18.89b 204.67±7.85b 1.24±0.68b 2.79±0.04b 3.21±0.16a 168.67±4.10d 4.57±1.10a
表3 不同盐度处理下乌苏里白鲑幼鱼血浆中血糖及酶类含量
Tab.3 Plasma glucose and enzyme content of juvenile Coregonus ussuriensis in different salinity groups

组别 group 血糖/ (mmol·L-1) GLU 谷丙转氨酶/ (IU·L-1) ALT 谷草转氨酶/ (IU·L-1) AST 谷丙转氨酶/谷草转氨酶 AST/ALT 尿素氮/ (mmol·L-1) UREA S0 5.67±0.16a 32.33±0.94a 777.67±61.25a 20.20±2.45a 0.50±0.08a S8 4.80±0.35a 32.33±1.24a 724.00±37.18ab 25.56±7.72a 0.70±0.12a S16 4.60±0.49a 24.00±1.41b 705.67±61.22ab 26.72±3.66a 0.63±0.12a S24 5.10±0.28a 23.67±0.94b 651.00±31.90bc 20.49±2.79a 0.80±0.21a S32 10.73±1.59b 18.67±0.47c 577.67±28.66c 30.11±7.15a 0.70±0.28a
2.3 乌苏里白鲑组织切片观察
S0盐度下,乌苏里白鲑幼鱼鳃丝上皮由多层上皮细胞组成,包括泌氯细胞、扁平细胞等。在鳃小片上皮细胞上分布着扁平细胞、柱状细胞及血管道。从图1可见,随着盐度的逐渐增加,鳃小片变细,形态呈现损伤趋势,细胞密度降低排列紊乱,且间隙增大,泌氯细胞和上皮细胞呈现出不同程度空泡化,其中S32盐度下鳃丝细胞空泡化最为严重。
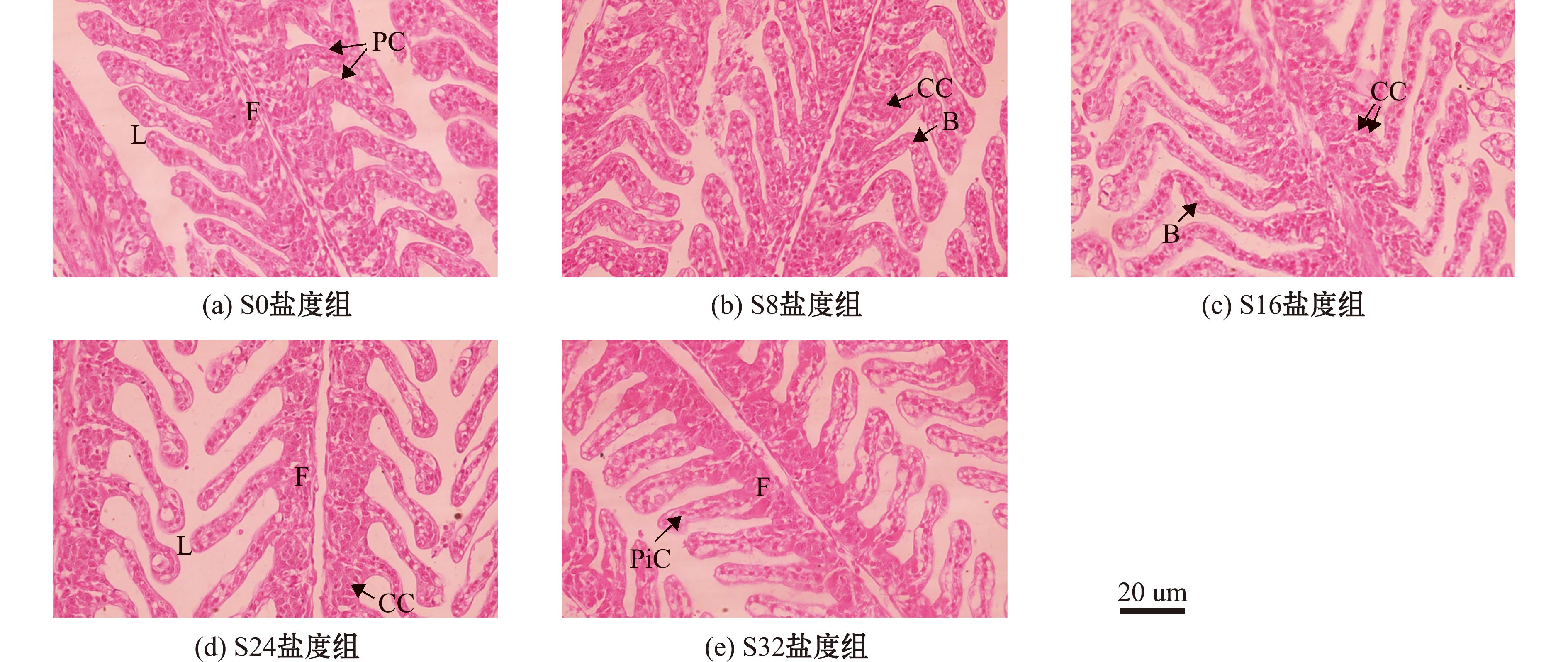
F—鳃丝;L—鳃小片;CC—泌氯细胞;PC—扁平细胞;PiC—柱状细胞;B—血管通道。
F—gill filament;L—gill lamella;CC—chloride cell;PC—squamous cell;PiC—pillar cell;B—blood channel.
图1 暴露于不同盐度下乌苏里白鲑的鳃组织显微切片
Fig.1 Microscopic section of gill tissue of Coregonus ussuriensis exposed to different salinity
与对照组(S0)相比,随着盐度的升高,乌苏里白鲑幼鱼肝脏组织发生了不同程度变化(图2)。在盐度为0时,肝组织结构正常,肝细胞排列紧凑整齐,结构清晰,细胞核呈圆形并居中,界限明显,未观察到明显的空泡化现象。随着盐度的逐渐升高,细胞结构出现萎缩趋势,但在S8和S16盐度下,未出现明显损伤,在S24和S32盐度下,部分细胞形态不规则且界限模糊,血管形态不规则,肝脏中空泡化现象显著,细胞内空泡明显增多,细胞核形态位置异常且损伤严重。
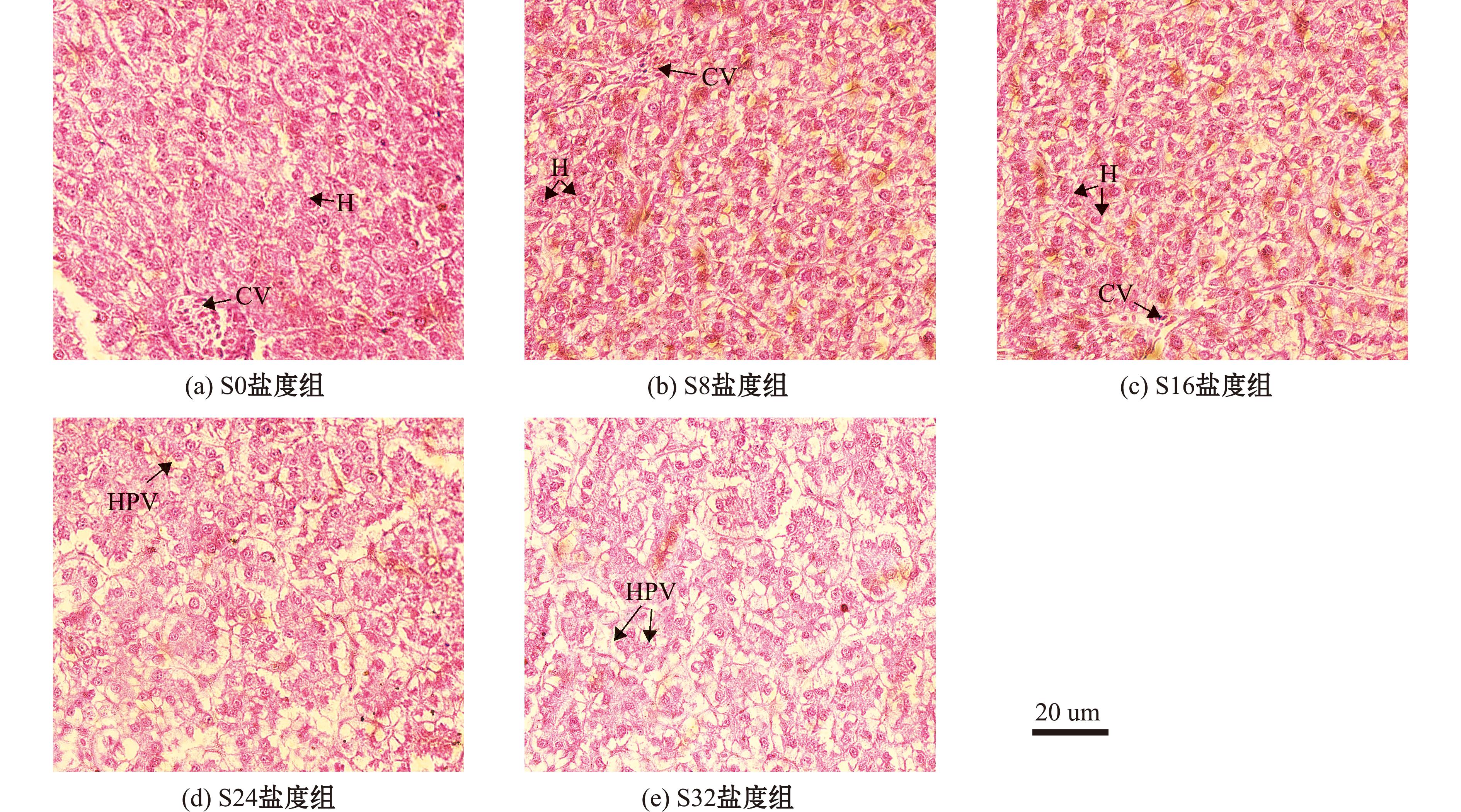
CV—中央静脉;H—肝细胞;HPV—肝细胞空泡化。
CV—central vein;H—hepatocyte;HPV—hepatocyte vacuolization.
图2 暴露于不同盐度下乌苏里白鲑的肝组织显微切片
Fig.2 Microscopic section of liver tissue of Coregonus ussuriensis exposed to different salinity
2.4 抗氧化酶活性研究
本研究对盐度试验中的肝脏组织进行相关酶活力的测定,比较了不同盐度下乌苏里白鲑氧化应激的影响(图3)。试验中观察到SOD活性的显著变化,与对照组相比,随着盐度的升高SOD活性呈先升高后降低的趋势,在S24盐度下达到峰值(图3(a))(P<0.05)。CAT活性随着盐度的升高显著增加,在S32盐度下达到峰值,比对照组高2.67倍(图3(b))。GSH-Px活性在S32达到峰值(图3(c))(P<0.05)。
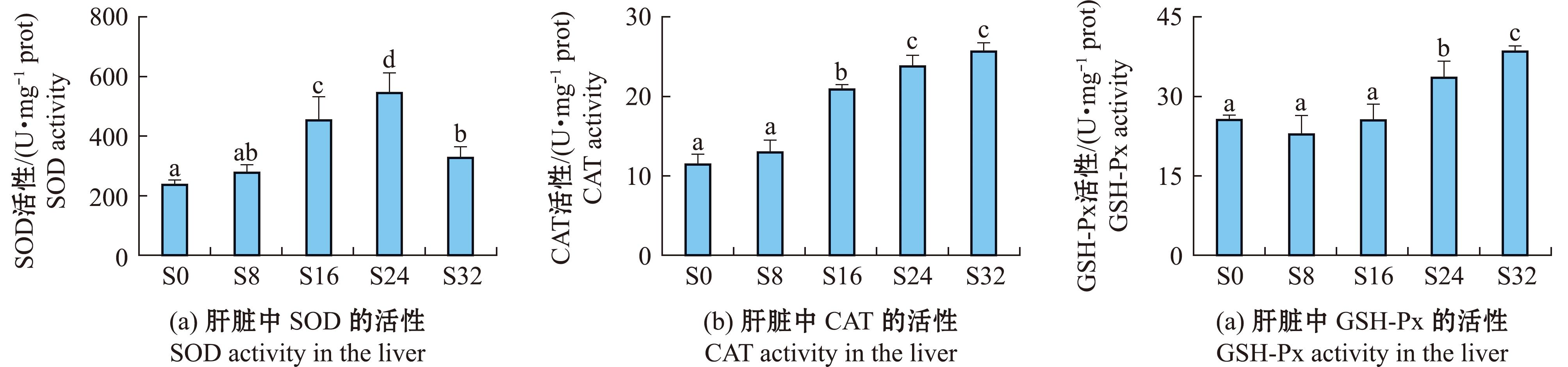
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different among the groups(P<0.05),and the means with the same letter are not significant different(P>0.05).
图3 不同盐度下乌苏里白鲑肝脏酶活性生理指标调查
Fig.3 Investigation of physiological indexes of Coregonus ussuriensis exposed to different salinity
3 讨论
3.1 乌苏里白鲑的耐盐性
乌苏里白鲑是中国黑龙江流域唯一的白鲑属鱼类,其人工繁殖技术尚处于探索阶段。本研究对乌苏里白鲑开展了盐度驯化试验。结果表明,乌苏里白鲑在盐度暴露低于24时死亡率均为0,而当盐度为32时存活率仅为21.4%。S0~S24组试验鱼的生长无显著性差异,而在32盐度下鱼体质量显著降低。类似地,尖吻白鲑(Coregonus oxyrinchus)的盐度适应范围为0~25[12]。研究结果证实了前期的推测,即乌苏里白鲑存在江海或淡水-河口之间的洄游履历。与其他鲑科鱼类相似,暴露在盐水环境下时,乌苏里白鲑存在一些低渗调节机制[6,17]。
3.2 盐度胁迫对乌苏里白鲑血液生理指标的影响
鱼类血液生理指标能够反映生理生化状态的标尺,可根据不同的血液指标来评价鱼类的生理、营养状况及对环境的适应情况[18]。已有研究发现,当环境盐度发生变化时,广盐性鱼类血浆渗透压、浓度随着盐度的升高呈上升趋势[19],这与本研究的结果一致(表2),乌苏里白鲑血浆中Na+、Cl-和Mg2+的浓度变化同渗透压趋势基本一致,这些结果与Massen等[11]对真白鲑(Coreginus lavaretus)研究结果一致。然而,K+浓度随盐度增加而逐渐降低,可能是为了满足低调节的生理需求。ALT和AST活性是普遍存在于鱼类线粒体中的氨基转移酶。这两种酶是反映肝功能和损伤诊断的重要指标[20-21]。本研究中,ALT和AST活性在盐度32时降至最低水平,这与刘伟等[22]和李培伦等[23]在大麻哈鱼盐度胁迫下呈现的变化趋势相同,但引起这一变化的具体机制仍需进一步探讨。
3.3 盐度胁迫对乌苏里白鲑鳃的影响
鳃是鱼类体内的一种多功能器官,除进行气体交换和含氮废物的排泄外,它还参与维持无机盐离子和酸碱平衡的调节。生活在不同盐度水体中的鱼类其鳃组织结构具有较大差异,如广盐性硬骨鱼通过调节鳃丝上皮中泌氯细胞的结构和数量来适应水体的盐度变化[24]。因此,当鱼类处于极端环境中时,鳃组织结构常被广泛用于研究。泌氯细胞主要位于鳃丝上皮内,少量分布于鳃小片上。当环境中离子平衡发生变化,鱼体鳃上皮细胞的形态、分布、数量及内部结构均会发生明显的适应性改变,以维持体内的渗透压平衡[25]。本研究中发现,随着环境盐度逐渐增加,试验鱼泌氯细胞和上皮细胞呈现出不同程度空泡化,其中盐度32下鳃丝细胞空泡化最为严重(图1),这与Shirangi等[26]对波斯鲟(Acipenser persicus)的研究结果类似,表明盐度32时是乌苏里白鲑的生理不耐受状态。
3.4 盐度胁迫对乌苏里白鲑肝脏的影响
肝脏是鱼体的主要免疫器官,尽管不直接参与渗透调节,但它是糖原/葡萄糖(glycogen/glucose)代谢的主要部位,且在渗透适应过程中代谢得到增强,为渗透调节创造了更多的能量,在维持渗透平衡中发挥关键作用[27-28]。本研究结果可以看出,盐度对乌苏里白鲑幼鱼的肝脏存在一定程度影响,在盐度为0时肝脏组织结构正常,肝细胞形态完整,排列紧密有序,细胞边界清晰,随着盐度升高,肝细胞逐渐萎缩变形,在盐度为32时肝细胞结构不清晰,细胞核形态异常,出现严重空泡化(图2),这与已有研究表明暴露于盐度应激的鱼类肝脏会受到损伤结果一致[29]。空泡化是细胞对高盐环境应激反应的一种表现,这可能与乌苏里白鲑在盐度下的生理变化有关,是由于细胞内水分平衡的改变、细胞膜损伤及线粒体功能障碍引起。随着盐度增加,试验鱼肝细胞损伤程度逐渐加重,从轻微的空泡化到严重的细胞形态改变和功能损伤,推测该盐度已经超出其生理调节能力,导致肝组织结构发生病理性变化。
3.5 盐度胁迫对乌苏里白鲑抗氧化系统的影响
盐度对鱼类的生理状态有重大影响,环境盐度的突然升高或降低都会使鱼体产生大量的ROS[超氧阴离子自由基(O2-)],对机体造成氧化损伤,随后鱼类的抗氧化系统被激活以应对氧化应激[30-31]。抗氧化酶的形成则可以清除这些自由基[32],如超氧化物歧化酶(SOD)是鱼体内抗氧化防御系统的关键酶,可通过清除过多的O2-以减少鱼体损伤,并将其转化为氧气(O2)和过氧化氢(H2O2)[33-34],而 CAT 是一种催化酶,可以清除细胞中产生的过氧化氢,并防止其转化为更具有毒性的羟基自由基(·OH)。本研究中,盐度变化导致乌苏里白鲑SOD酶活性先升高后降低(图3),表明盐度变化激活了乌苏里白鲑幼鱼的抗氧化能力,这一结果与其他鱼类研究结果类似[35]。在盐度较低时,鱼类的抗氧化反应机制被激活,SOD活性增加清除过量的自由基并保护细胞免受氧化损伤。然而,随着盐度水平的升高,SOD活性降低;这可能是脂肪β氧化速率的增加,可以提供能量并调节离子通道和转运蛋白,以在高盐环境下维持细胞内外的渗透平衡,这一过程会产生大量的ROS,长期高盐胁迫会导致抗氧化系统耗竭或酶蛋白合成与降解失衡,从而降低SOD活性[36]。过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)也通过调节将应激造成的损伤最小化[37]。本研究中,GSH-Px和CAT酶活性均随着盐度升高而显著增加。这一结果与Ma等[38]和Martinez-Alvarez等 [39]研究结果一致,表明乌苏里白鲑通过自身的抗氧化调节机制能够适应一定范围内的盐度变化。
4 结论
1)乌苏里白鲑幼鱼在盐度0~24范围内能够正常存活和生长,存活率达100%,且特定生长率(SGR)与淡水对照组无显著性差异。当盐度升至32时,存活率骤降至21.4%,并出现负增长。因此,乌苏里白鲑幼鱼适宜在盐度0~24的水体中养殖,超过此范围会对其生存和健康造成不利影响。
2)高盐度(32)引起血浆渗透压、Na+、Cl-和Mg2+浓度显著上升,而K+浓度下降,表明乌苏里白鲑通过调节离子平衡适应盐度变化,但在盐度32时调节能力不足。
3)乌苏里白鲑鳃组织和肝组织在高盐度(32)下出现了严重空泡化和结构损伤。尽管SOD、CAT和GSH-Px活性随盐度升高而增强,盐度32时仍无法抵消高盐带来的损伤。
4)SOD、CAT和GSH-Px活性随盐度升高而增强,表明鱼体通过提高抗氧化能力应对盐度胁迫,但在盐度32时仍无法完全缓解高盐造成的生理损伤。
[1] EL-LEITHY A A A,HEMEDA S A,EL NABY W S H A,et al.Optimum salinity for Nile Tilapia (Oreochromis niloticus) growth and mRNA transcripts of ion-regulation,inflammatory,stress- and immune-related genes[J].Fish Physiology and Biochemistry,2019,45(4):1217-1232.
[2] 户业丽,蔡焕焕,程波,等.人工养殖鲟鱼头中硫酸软骨素的提取工艺[J].食品研究与开发,2010,31(4):115-118.
HU Y L,CAI H H,CHENG B,et al.Study on extraction technology of chondroitin sulfate from the head of farmed sturgeon[J].Food Research and Development,2010,31(4):115-118.(in Chinese)
[3] 成智丽,孙鹏飞,罗珺,等.盐度驯化下许氏平鲉血清生化指标及渗透压的变化[J].水产科学,2021,40(3):310-317.
CHENG Z L,SUN P F,LUO J,et al.Changes in serum bochemical profiles and osmotic pressure of Schlegel’s black rockfish Sebastes schlegelii acclimatized by various salinities[J].Fisheries Science,2021,40(3):310-317.(in Chinese)
[4] 姜志强,刘钢,金柏.盐度对美国红鱼幼鱼生长和摄食的影响[J].大连水产学院学报,2005,20(2):91-94.
JIANG Z Q,LIU G,JIN B.Effects of salinity on feeding and growth of juvenile red drum Sciaenops ocellatus[J].Journal of Dalian Fisheries University,2005,20(2):91-94.(in Chinese)
[5] 党云飞,徐伟,耿龙武,等.盐碱和pH对鱼类生长和发育的影响[J].水产学杂志,2012,25(2):62-64.
DANG Y F,XU W,GENG L W,et al.A review of effects of saline-alkalinity and pH on growth and development in fish[J].Chinese Journal of Fisheries,2012,25(2):62-64.(in Chinese)
[6] MCCORMICK S D,MOYES C D,BALLANTYNE J S.Influence of salinity on the energetics of gill and kidney of Atlantic salmon (Salmo salar)[J].Fish Physiology and Biochemistry,1989,6(4):243-254.
[7] DABORN K,COZZI R R,MARSHALL W S.Dynamics of pavement cell-chloride cell interactions during abrupt salinity change in Fundulus heteroclitus[J].Journal of Experimental Biology,2001,204(Pt 11):1889-1899.
[8] TSENG Y C,HWANG P P.Some insights into energy metabolism for osmoregulation in fish[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2008,148(4):419-429.
[9] 洪磊,张秀梅.环境胁迫对鱼类生理机能的影响[J].海洋科学进展,2004,22(1):114-121.
HONG L,ZHANG X M.Effects of environmental stress on physiological function of fish[J].Advances in Marine Science,2004,22(1):114-121.(in Chinese)
[10] NIE H T,JAHAN K,ZHANG W L,et al.Physiological and biochemical responses of different shell color strains of Manila clam to low salinity challenges[J].Aquaculture Reports,2020,16:100260.
[11] MADSEN S S,LARSEN B K,JENSEN F B.Effects of freshwater to seawater transfer on osmoregulation,acid-base balance and respiration in river migrating whitefish (Coregonus lavaretus)[J].Journal of Comparative Physiology B,1996,166(2):101-109.
[12] JENSENL F,THOMSEN D S,MADSEN S S,et al.Development of salinity tolerance in the endangered anadromous North Sea houting Coregonus oxyrinchus:implications for conservation measures[J].Endangered Species Research,2015,28(2):175-186.
[13] SFORMO T L,DE LA BASTIDE P Y,LEBLANC J,et al.Temperature response and salt tolerance of the opportunistic pathogen Saprolegnia parasitica:implications for the broad whitefish subsistence fishery[J].Arctic,Antarctic,and Alpine Research,2021,53(1):271-285.
[14] BOCHKAREVN A,ZUYKOVA E I,ABRAMOV S A,et al.The sympatric whitefishes Coregonus ussuriensis and C.chadary from the Amur River basin:morphology,biology and genetic diversity[J].Fundamental and Applied Limnology,2017,189(3):193-207.
[15] 汪松,乐佩琦,陈宜瑜.中国濒危动物红皮书.鱼类[M].北京:科学出版社, 1998:60-62.
WANG S,YUE P Q,CHEN Y Y.China red data book of endangered animals.Pisces[M].Beijing:Science Press,1998:60-62.(in Chinese)
[16] 王继隆, 刘伟, 王臣, 等.基于耳石微化学的乌苏里白鲑生境履历分析[J].水生生物学报, 2022, 43(4):825-831
WANG J L, LIU W, WANG C, et al. Microchemistry analysis of otoliths of Coregonus ussuriensis from the Heilong River basin[J]. Acta Hydrobiologica Sinica, 2022,43(4):825-831.(in Chinese)
[17] 支兵杰,刘伟,赵春刚,等.盐度对大麻哈鱼幼鱼消化酶及碱性磷酸酶活力的影响[J].上海海洋大学学报,2009,18(3):289-294.
ZHI B J,LIU W,ZHAO C G,et al.Effects of salinity on digestive enzyme and alkaline phosphatase activity of young chum salmon(Oncorhynchus keta Walbaum)[J].Journal of Shanghai Ocean University,2009,18(3):289-294.(in Chinese)
[18] HARIKRISHNAN R,NISHA RANI M,BALASUNDARAM C.Hematological and biochemical parameters in common carp,Cyprinus carpio,following herbal treatment for Aeromonas hydrophila infection[J].Aquaculture,2003,221(1/2/3/4):41-50.
[19] SAKAMOTO T,UCHIDA K,YOKOTA S.Regulation of the ion-transporting mitochondrion-rich cell during adaptation of teleost fishes to different salinities[J].Zoological Science,2001,18(9):1163-1174.
[20] TURNERL A,BUCKING C.The role of intestinal bacteria in the ammonia detoxification ability of teleost fish[J].Journal of Experimental Biology,2019,222(Pt 24):jeb209882.
[21] DUANX Y,MA R J,CHUNG-DER H,et al.Tripterygium wilfordii multiglycoside-induced hepatotoxicity via inflammation and apoptosis in zebrafish[J].Chinese Journal of Natural Medicines,2021,19(10):750-757.
[22] 刘伟,支兵杰,战培荣,等.盐度对大麻哈鱼幼鱼血液生化指标及肝组织的影响[J].应用生态学报,2010,21(9):2411-2417.
LIU W,ZHI B J,ZHAN P R,et al.Effects of salinity on haematological biochemistrical indices and liver tissue in juvenile Oncorhynchus keta[J].Chinese Journal of Applied Ecology,2010,21(9):2411-2417.(in Chinese)
[23] 李培伦,刘伟,王继隆,等.盐度对养殖大麻哈鱼血液生化指标及消化酶活力的影响[J].西北农林科技大学学报(自然科学版),2020,48(9):10-16.
LI P L,LIU W,WANG J L,et al.Effects of salinity on blood biochemical parameters and digestive enzyme activities of farmed chum salmon (Oncorhynchus keta)[J].Journal of Northwest A &F University (Natural Science Edition),2020,48(9):10-16.(in Chinese)
[24] ZIMMERA M,PERRY S F.Physiology and aquaculture:a review of ion and acid-base regulation by the gills of fishes[J].Fish and Fisheries,2022,23(4):874-898.
[25] AZODI M,BAHABADIM N,GHASEMI A,et al.Effects of salinity on gills' chloride cells,stress indices,and gene expression of Asian seabass (Lates calcarifer,Bloch,1790)[J].Fish Physiology and Biochemistry,2021,47(6):2027-2039.
[26] SHIRANGI S A,KALBASSI M R,KHODABANDEH S,et al.Salinity effects on osmoregulation and gill morphology in juvenile Persian sturgeon (Acipenser persicus)[J].Fish Physiology and Biochemistry,2016,42(6):1741-1754.
[27] VAN D E LAARSCHOTL F M,JANSEN P L M,SCHAAP F G,et al.The role of bile salts in liver regeneration[J].Hepatology International,2016,10(5):733-740.
[28] ZHANG X L,GABALLA M M S,HASAN A A,et al.Effects of high salt intake on glucose metabolism,liver function,and the microbiome in rats:influence of ACE inhibitors and angiotensin II receptor blockers[J].American Journal of Physiology Cell Physiology,2025,328(4):C1366-C1382.
[29] XU M J,ZHANG C N,QI Q,et al.Effects of salinity stress on anxiety behavior and antioxidant capability of guppy (Poecilia reticulata)[J].Ecotoxicology,2023,32(5):598-605.
[30] SEALE A P,CAO K,CHANG R J A,et al.Salinity tolerance of fishes:Experimental approachesand implications for aquaculture production[J].Reviews in Aquaculture,2024,16(3):1351-1373.
[31] EDWARDS S L,MARSHALL W S.Principles andpatterns of osmoregulation and euryhalinity in fishes[M]//Euryhaline Fishes.Amsterdam:Elsevier,2012:1-44.
[32] TOMANEK L,ZUZOWM J,IVANINA A V,et al.Proteomic response to elevated PCO2 level in eastern oysters,Crassostrea virginica:evidence for oxidative stress[J].Journal of Experimental Biology,2011,214(Pt 11):1836-1844.
[33] SINHAA K,ABDELGAWAD H,ZINTA G,et al.Nutritional status as the key modulator of antioxidant responses induced by high environmental ammonia and salinity stress in European Sea bass (Dicentrarchus labrax)[J].PLoS One,2015,10(8):e0135091.
[34] LIU B,GUOH Y,ZHU K C,et al.Growth,physiological,and molecular responses of golden pompano Trachinotus ovatus (Linnaeus,1758) reared at different salinities[J].Fish Physiology and Biochemistry,2019,45(6):1879-1893.
[35] CONIDES A J,GLAMUZINA B,PAPACONSTANTINOU C.Laboratory simulation of the effects of environmental salinity on wild-caught juveniles of European sea bass Dicentrarchus labrax and gilthead seabream Sparus aurata[J].Journal of Fish Biology,2004,65:327-328.
[36] WANG X X,DENG C Y,LIN W Y,et al.Transcriptome analysis revealed that largemouth bass (Micropterus salmoides) may mobilize liver lipid metabolism to provide energy for adaptation to hypertonic stress[J].Aquaculture,2025,607:742646.
[37] HOSSAINM A,AKTAR S,QIN J G.Salinity stress response in estuarine fishes from the Murray Estuary and Coorong,South Australia[J].Fish Physiology and Biochemistry,2016,42(6):1571-1580.
[38] MA Z H,ZHENG P L,GUO H Y,et al.Salinity regulates antioxidant enzyme and Na+K+-ATPase activities of juvenile golden pompano Trachinotus ovatus (Linnaeus 1758)[J].Aquaculture Research,2016,47(5):1481-1487.
[39] MART NEZ-ALVAREZ R M,HIDALGO M C,DOMEZAIN A,et al.Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity[J].Journal of Experimental Biology,2002,205(Pt 23):3699-3706.
NEZ-ALVAREZ R M,HIDALGO M C,DOMEZAIN A,et al.Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity[J].Journal of Experimental Biology,2002,205(Pt 23):3699-3706.