花斑裸鲤(Gymnocypris eckloni)隶属鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)裸鲤属(Gymnocypris)[1],主要分布于黄河水系的扎陵湖、鄂陵湖及下至积石峡的各干支流水系,以及柴达木盆地的格尔木河、诺木洪河、托索湖等水系,是黄河上游最重要的土著鱼类之一,具有重要的生态保护价值[2-3]。近年来,黄河上游总体水质保持良好,对花斑裸鲤的生存和繁殖无显著性影响,但偶发性重金属含量超标仍对鱼类生存造成潜在威胁[4]。然而,大型水利工程的建成及人为活动的影响,致使花斑裸鲤的洄游通道受阻,鱼类生境片断化,生存空间恶化,并使花斑裸鲤资源受到破坏,不仅个体趋向小型化,而且性成熟年龄逐渐变小[5]。为推进青海的绿色生态可持续发展,花斑裸鲤资源恢复和保护刻不容缓。花斑裸鲤生活在天然无重金属污染水域中,对于重金属的危害相较于其他鱼类更敏感,在国家水质标准规定的重金属离子浓度胁迫下,其体内相关基因和调节机制已产生应答,直观地反映水体重金属胁迫下鱼类所面临的生理生化危机[6]。
传统毒理学常以半致死和致死浓度来确定重金属胁迫浓度,并探究重金属对于鱼类的影响,然而重金属浓度在达到半致死浓度前,鱼体内分子伴侣、金属螯合、免疫应答等基因早已被激活,并在达到致死浓度时,水生生态系统的安全和水生生物的生长受到了极其严重的影响,表明传统的检测方法筛选出的信号分子并不能为水生生态系统保护提供准确的预警信号[7]。低剂量重金属胁迫下鱼类的分子毒理学研究不仅能揭示鱼类的解毒机制,还能筛选出作为环境退化的早期预警分子——生物标志物[8]。Cd2+的长期暴露,会造成水体中浮游动物、植物和藻类的死亡及群落组成的减少,并且以浮游动植物或藻类为食的鱼类体内也有重金属富集[9-10]。0.01 mg/L Pb2+胁迫会导致斑马鱼(Danio rerio)胚胎毒性、行为改变和成鱼学习与记忆缺陷[11]。由此可知,长期高浓度的重金属污染常常导致水体生态系统中物种消亡,而长期微量的重金属污染或者偶发瞬时高浓度的重金属污染,通过水体的汇集和重金属的富集对水体生物产生的危害更加普遍和严重。因此,了解低浓度重金属的毒理学特征和鱼类解毒机制,防止微量重金属的富集污染及其对水体生态环境造成的影响显得尤为重要。本研究中基于转录组学分析Cu2+对花斑裸鲤肾脏的影响,筛选出花斑裸鲤机体内与Cu2+胁迫响应和适应性相关的关键基因,分析Cu2+胁迫后花斑裸鲤肾脏的适应机制及相应基因在体内生理调节功能,以期为花斑裸鲤的人工增殖放流提供理论支持,也为黄河上游土著鱼类的资源保护和利用提供科学参考。
1 材料与方法
1.1 材料
从青海省渔业技术推广中心获取3龄左右的无伤病、活力较好的花斑裸鲤,体质量(100.0±2.5) g,体长(19.0±3.4)cm。暂养于已用高锰酸钾(KMnO4)浸泡清洗并盛有40 L除氯曝气自来水的玻璃鱼缸(48 cm×25 cm×45 cm)中,温度为15.0 ℃±0.5 ℃,环境为14 h光照/10 h黑暗。驯养7 d,早晚各投食一次,试验开始前一天停止投喂换水。
1.2 方法
1.2.1 Cu2+胁迫试验毒性 随机取驯养结束的12尾无伤病、活力较好的花斑裸鲤,设置3个试验组和1个空白对照组,每组放置3尾鱼。经0.01 mg/L Cu2+(Sigma,美国)胁迫0(K0组)、6(K1组)、36(K2组)、72(K3组)h后,将每尾鱼置于含有1.5 L 0.1%丁香酚的2 L容器中,直至失去方向感和鳃盖停止活动,并解剖获取其肾脏,送至北京诺禾致源科技股份有限公司进行转录组学测序和数据分析。
1.2.2 RNA提取与转录组测序 使用RNAiso Plus试剂盒(TaKaRa,日本)提取总RNA。经DNase I处理,采用10 g/L琼脂糖凝胶电泳检测RNA的降解情况;使用NanoPhotometer®分光光度计(IMPLEN,美国)检测RNA样品的A260/A280比率以衡量其纯度;使用Agilent Bioanalyzer 2100系统中的RNA Nano 6000检测试剂盒(Agilent TEChnologies,CA,USA)评估RNA的完整性。将提取的RNA送至北京诺禾致源科技股份有限公司,经Illumina HiSeq 2500仪器测序,并建立测序文库。
1.2.3 实时荧光定量PCR(RT-qPCR)验证 以β-actin作为内参基因,选择7个基因进行实时定量PCR(real-time quantitative PCR,RT-qPCR),利用Primer Premier 5设计引物后由生工生物工程(上海)股份有限公司合成(表1)和验证引物扩增效率。使用南京诺唯赞生物科技有限公司ChamQ SYBR Color qPCR Master Mix(2X)试剂盒进行实时定量PCR检测。PCR反应条件:95 ℃下预变性3 min;95 ℃下变性30 s;56 ℃下退火30 s;72 ℃下延伸 40 s;共进行35个循环。 每个样品设置3次重复,采用2-ΔΔCt方法计算相对表达量。
表1 实时荧光定量RT-PCR引物
Tab.1 Primers for qRT-PCR

基因 gene 引物 primer 序列 (5'-3') sequence(5'-3') HIF1A HIF1A-F CGGCCTTAGAACCAAATCAG HIF1A-R TTGAGCTTGCAGCACTCTTC Susd2 Susd2-F GAGGGCTATGTGGATGAGAG Susd2-R GATCGGTCAAAGTTGACTCC CXCL8 CXCL8-F ACAGCTACGCTGCAAGTGTG CXCL8-R TGTCCATTTTTCAGAGTTGC INIP INIP-F CAGTCTGTGAATAACCCAGG INIP-R TGCTGTAAAGCTGCTTTCTG ATP8B2 ATP8B2-F TCTCCTCTCTTTCGTGGTTC ATP8B2-R TGTTGATCACTTTTATGGCG Golph3 Golph3-F CTTAAGAGGACGCCTGCAAC Golph3-R ACATGTTTCAATGCCTCGTC TOP2B TOP2B-F TGACGAGATCCTCGTAAATG TOP2B-R GAATTCCCTTCCCATTATTC β-actin β-actin-F GAACCCCAAGGCTAACAGAGAA β-actin-R AGGCATACAGGGACAGCACA
1.3 数据处理
1.3.1 转录组测序数据组装及分析 对RNA-seq原始数据进行严格的质量控制,去除低质量及污染序列,确保数据的可靠性。使用Trinity软件生成单个从头转录组组装和单个端对端转录组组分(其中min_kmer_cov设置为2,其他参数设置为默认值)。从RNA-seq读取中提取所有重叠的k-mers来产生转录重叠群,产生主要亚型全长转录本,保留选择性剪接转录物的特殊部分用于后续分析。使用原始数据对相关重叠群进行聚类,再通过德布鲁因图生成可能的转录序列,解析来自共生同源基因的选择性剪接亚型和转录物。运用Trinity的Inchworm模块,基于k-mer方法将高质量reads组装成初步contigs,初步勾勒出转录本结构。采用Chrysalis模块对contigs进行聚类,并为每个聚类构建de Bruijn图,以全面捕捉转录本的复杂性和可变剪接模式。采用Butterfly模块深入解析de Bruijn图,通过精细追踪reads路径,精准重构出全长转录本。
使用TransDecoder(http://transdecoder.github.io/)进行鉴定转录序列内的候选编码区。采用Nr蛋白质数据库、KEGG数据库和GO数据库进行基因功能注释。使用DESeq软件检测差异表达基因,并通过RPKM值衡量基因表达水平;使用Benjamini和Hochberg多重检验校正P值,调整后|log2(fold change)|≥1,P<0.05的基因被指定为差异表达;通过GOseq R软件进行GO富集分析,并校正基因长度偏差;通过Fisher精确检验进行显著性分析。
1.3.2 数据获取 本研究结果的原始数据集可在NCBI BioProject(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA666236)和NCBI序列读取档案(SRA)存储库(https://www.ncbi.nlm.nih.gov/sra/)中获得(序列号:PRJNA666236)。
2 结果与分析
2.1 转录组测序数据分析
为系统研究不同时长Cu2+胁迫后花斑裸鲤肾脏的转录组动态,共获取12个转录组样本,去除低质量序列,并修整衔接子序列后,每个文库生成7.47~9.12 Gb的有效数据,且读长总数为49 789 164~60 800 266,Q20≥93.78%,Q30≥85.33%,G+C含量在44.9%~45.71%,错误率≤0.03(表2)。由于未见该物种或密切相关物种基因组的发表,选择从头组装转录本,并将此组装作为参考。De novo使用高质量数据检测出704 405个转录片段,长度为201~23 517 bp不等,平均长度为774 bp。所得转录本的N50(按转录本长度降序排列的1/2组装物的长度)和N90(按转录本长度降序排列的90%组装物的长度)值分别为1 265、298 bp。在进一步的组装分析中,在所有转录本中鉴定出486 221个基因片段,平均长度为994 bp。所得基因片段的N50和N90值分别为1 480、438 bp。本研究中获得的转录本数量与许多发表的转录组组装物相似,这表明组装质量可靠,可用于后续转录组数据分析。
表2 花斑裸鲤肾脏组织转录组测序数据统计
Tab.2 Transcriptome sequencing data statistics of kidney tissue in Gymnocypris eckloni

样本 sample 原始数据rawread 高质量数据 cleanread 高质量碱基 cleanbases/G错误率 error/% Q20/% Q30/% GC/% K0-1 51985182 51134918 7.67 0.02 96.66 91.87 45.70 K0-2 63385810 60800266 9.12 0.03 93.86 85.36 45.47 K0-3 56716572 53128826 7.97 0.03 94.26 85.90 45.09 K1-1 57820382 55379842 8.31 0.03 93.78 85.33 45.59 K1-2 59620058 57779206 8.67 0.02 96.59 91.90 45.47 K1-3 61093980 58966572 8.84 0.02 96.31 91.32 45.60 K2-1 54846104 53209292 7.98 0.02 96.52 91.76 45.19 K2-2 59944866 59128268 8.87 0.02 96.98 92.57 45.21 K2-3 55430546 54581102 8.19 0.02 96.96 92.50 45.62 K3-1 51932918 51076196 7.66 0.02 96.98 92.62 44.9 K3-2 53569038 52824018 7.92 0.02 97.12 92.82 45.71 K3-3 50654790 49789164 7.47 0.02 96.58 91.78 47.11
2.2 胁迫后差异表达基因分析
为筛选出Cu2+胁迫0、6、36、72 h后的差异表达基因,并分析各胁迫组间共有差异表达基因,绘制韦恩图(图1)。与K0组相比,Cu2+胁迫6 h后,花斑裸鲤肾脏中有422个基因上调和326个基因下调;在Cu2+胁迫36 h后,花斑裸鲤肾脏中有332个基因上调和357个基因下调;在Cu2+胁迫72 h后,花斑裸鲤肾脏中有295个基因上调和255个基因下调。在Cu2+胁迫6、36 h后,共有的差异表达基因127个,其中79个基因上调和48个基因下调;在Cu2+胁迫6、72 h后,共有的差异表达基因119个,其中71个基因上调和36个基因下调;在Cu2+胁迫36、72 h后,共有的差异表达基因107个,其中66个基因上调和53个基因下调。在Cu2+胁迫6、36、72 h后,共有的差异表达基因36个,其中26个基因上调和10个基因下调。此外,通过TCseq分析对Cu2+胁迫6、36、72 h后差异表达基因的表达模式进行聚类分析,共获得10个聚类(图2)。其中 ,免疫相关差异表达基因主要集中于聚类6、7、10等;应激相关差异表达基因主要集中于聚类3、7、10等。
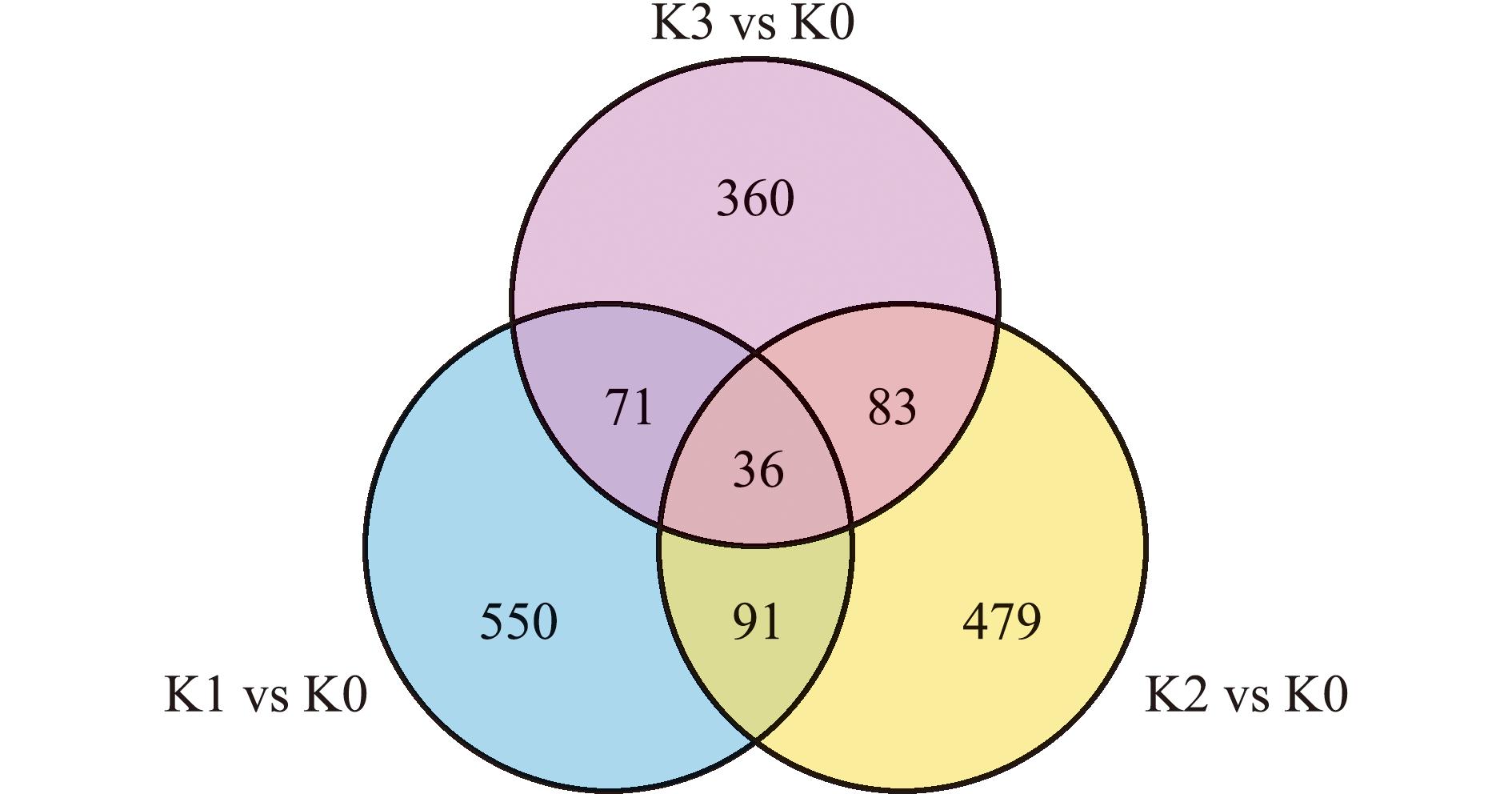
图1 Cu2+胁迫不同时长的差异表达基因
Fig.1 Differentially expressed genes of fish under Cu2+ stress for different time
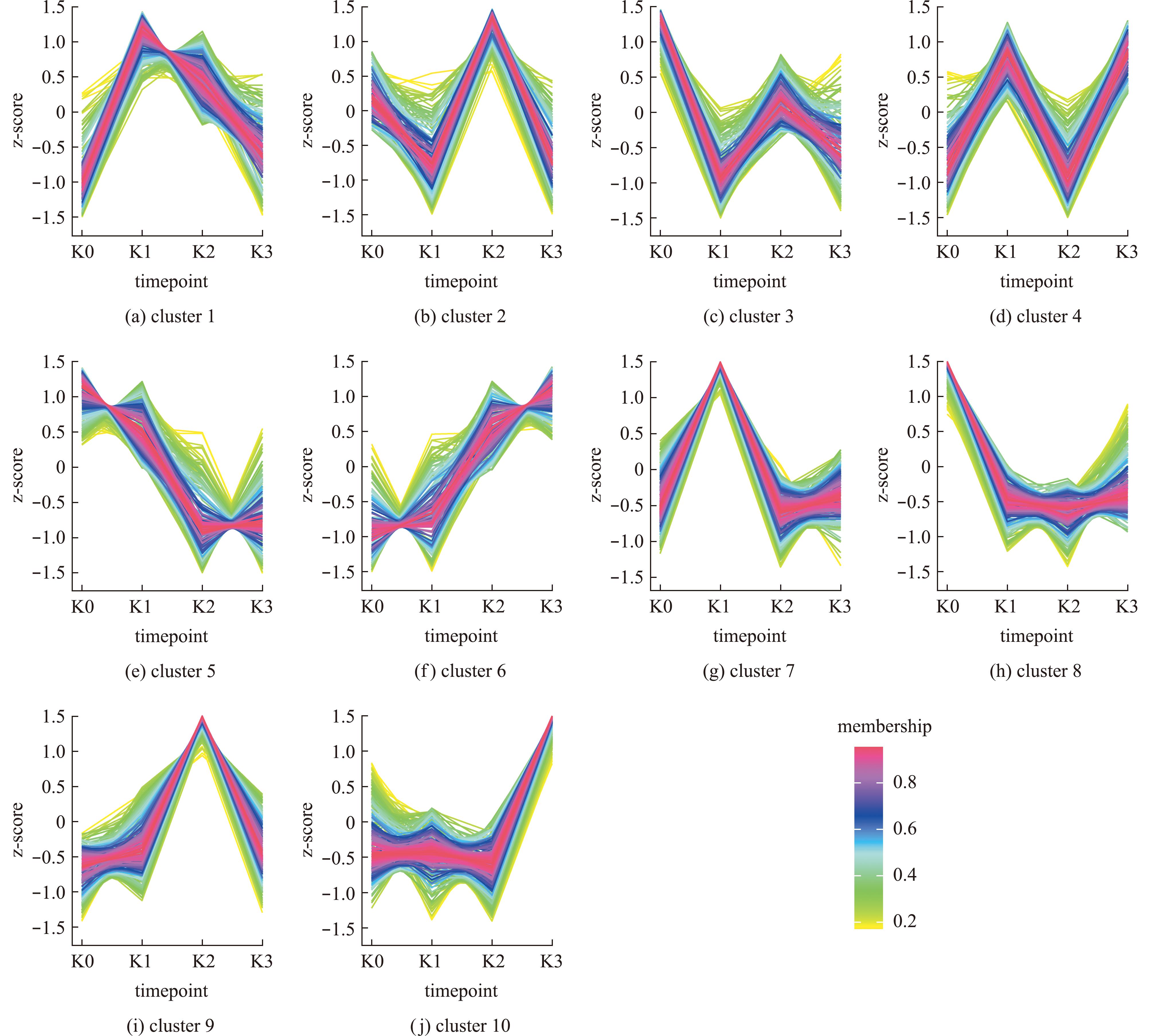
图2 Cu2+胁迫后差异基因表达时序分析
Fig.2 Time series analysis of different gene expression of fish under Cu2+ stress
与K0组相比,Cu2+胁迫后Ascc1、Ccdc22、Cluster-47180.325418、Golph3、Rbm4.1、Cops2、Plpp2、Hprt1、Gss、Mrtfa、Spag9、Slc22a15b、Cluster-47180.279780、Lpar6、Igkvld-33、Tec、HIF1A、Arid5b、Cluster-47180.235408、Trim66、Slc22a15b、Cluster-47180.279780、Lpar6、Igkvld-33、Tec、HIF1A、Arid5b、Cluster-47180.235408、Trim66、Rap1b、Slc2a12、Zscan20、Thrb、Nsdhl和Rpl21表达上调,而Ggt1、Atf6、Cluster-47180.220655、Ppp4r3b-b、Pik3cd、Zdhhc3、Med31、Gpr4、Galc和Pol表达下调(图3)。
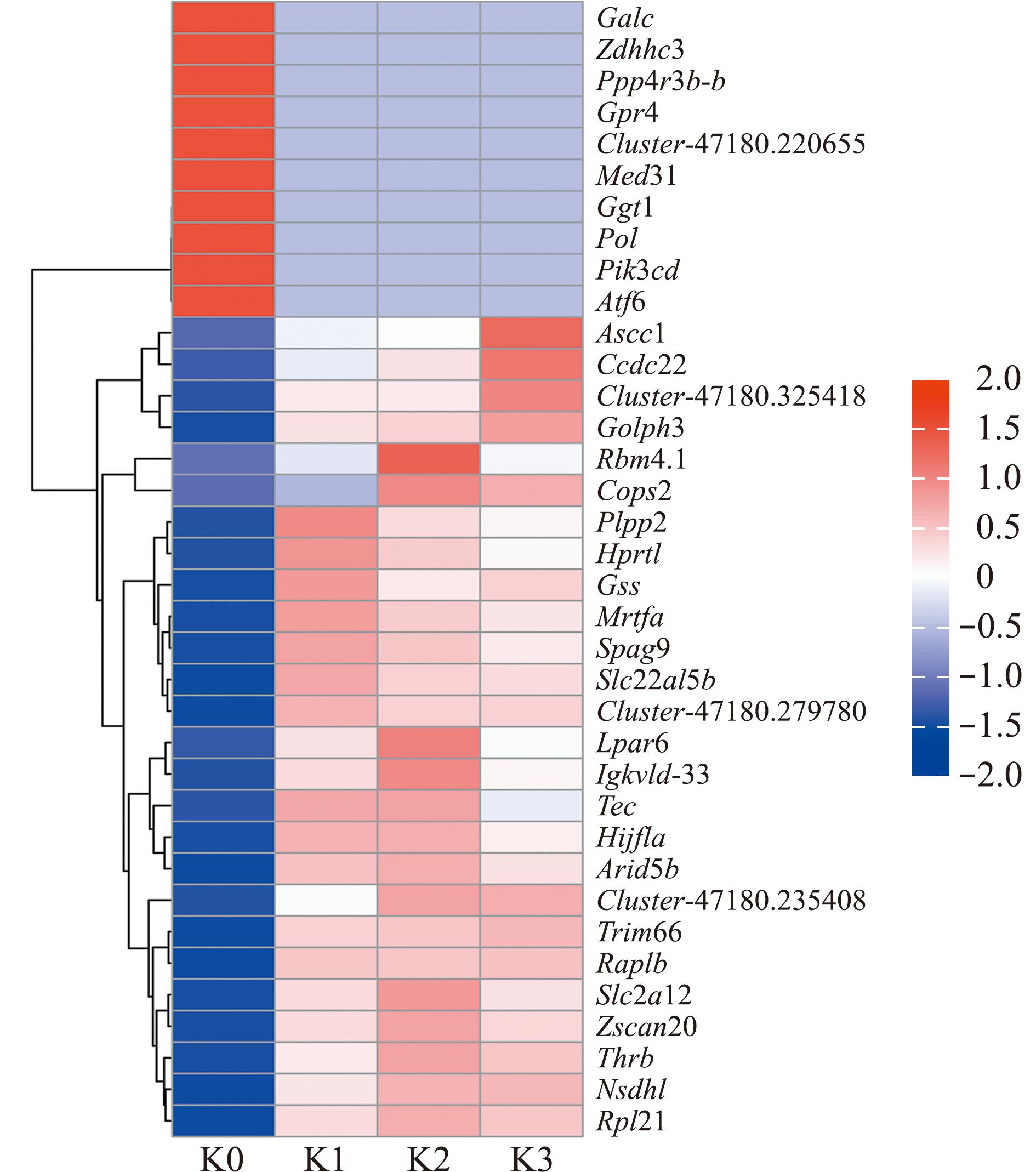
图3 不同胁迫组共有的36个差异表达基因聚类分析
Fig.3 Clustering analysis of 36 differentially expressed genes of fish from different groups
与K0组相比,筛选出差异表达显著的前50个差异基因进行功能注释分析(图4),发现Cu2+胁迫6、36、72 h后的差异表达基因主要分布在生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)三个大类。其中36条GO term与生物过程有关,包括13条代谢过程相关通路,7条免疫反应相关通路;分子功能相关通路共13条;细胞组分相关通路1条。表明Cu2+胁迫后,细胞中前50条GO term主要集中在代谢过程和免疫反应中。

图4 Cu2+胁迫后Top 50差异基因GO功能注释
Fig.4 GO annotations of Top 50 differentially expressed genes of fish under Cu2+ stress
2.3 Cu2+胁迫不同时间对肾脏中基因表达的影响
2.3.1 Cu2+胁迫6 h对肾脏中基因表达的影响 与K0组相比,Cu2+胁迫6 h后K1组中共筛选出748个差异表达基因(图5),其中4个基因与应激过程相关:INIP(INA Interactor)、KRT1(keratin 1)、APBB3(amyloid beta precursor protein-binding family B member 3)和A2M(alpha-2-Macroglobulin);8个基因与免疫过程相关:Susd2(sushi domain containing 2)、cep57l1(centrosomal protein 57kDa-like 1)、PRSS27(serine protease 27)、CXCL8(C-X-C motif chemokine 8)、H2-Eb1(histocompatibility 2,class Ⅱ antigen E beta)、PRR18(pentatricopeptide repeat domain 18)和Rin3 (ras and Rab interactor 3)。其中KRT1、APBB3、HIF1A(hypoxia-inducible factor 1-alpha)、A2M、Susd2、HIF1A、CXCL8、H2-Eb1、PRR18和Rin3基因的表达显著上调,而INIP、cep57l1和PRSS27基因的表达显著下调(n=3,P<0.05)。
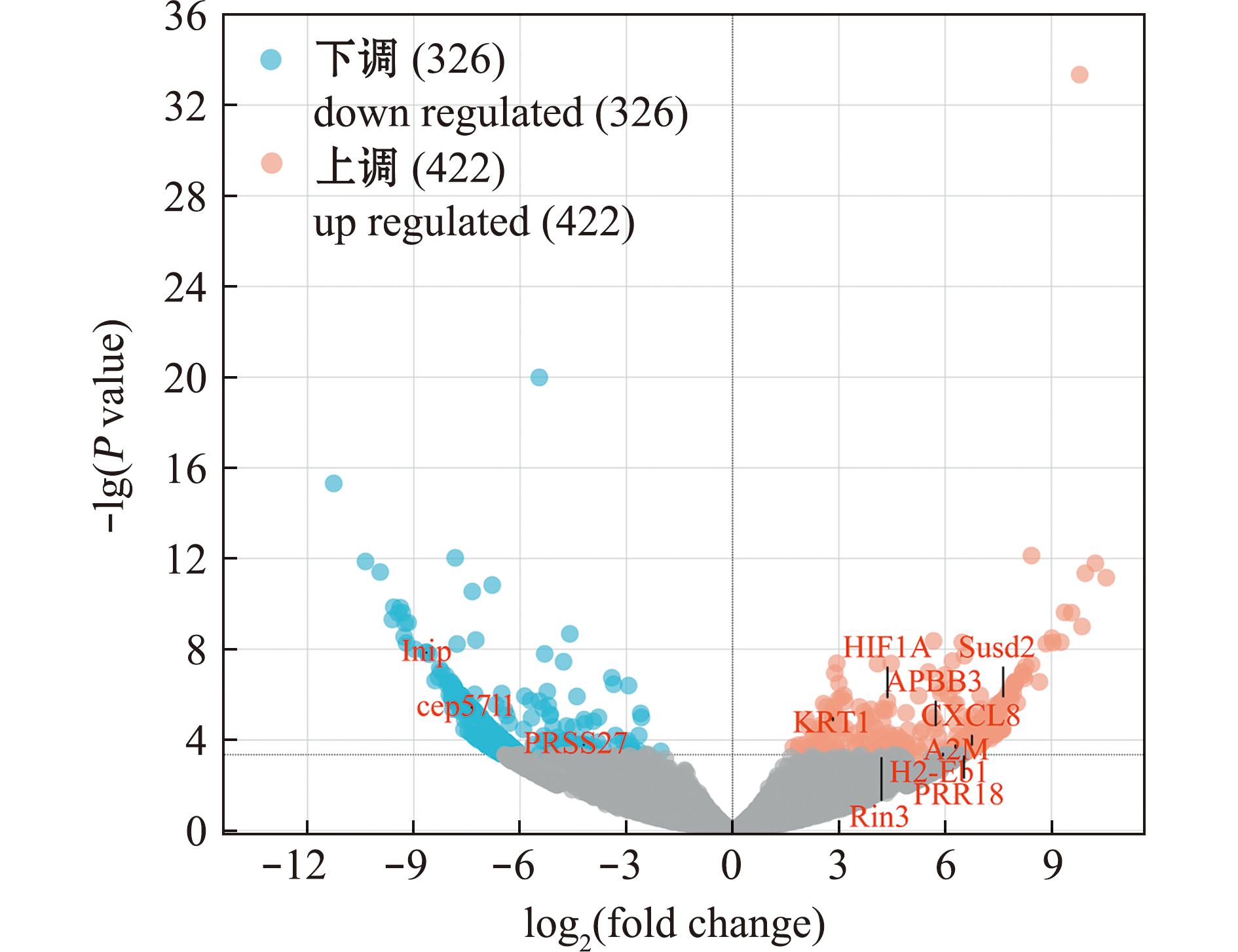
图5 K1 vs K0中差异基因的上下调分析
Fig.5 Upregulation and downregulation analysis of differential gene in K1 vs K0
与K0组相比,Cu2+胁迫6 h后的主要生物通路有甘氨酸、丝氨酸和苏氨酸代谢,嘌呤代谢,鞘脂代谢,内吞作用,卟啉和叶绿素代谢,脂肪消化和吸收,精氨酸和脯氨酸代谢,丙酸酯代谢,矿物质吸收,药物代谢-其他酶,氮代谢,丙酮酸代谢,近端小管碳酸氢盐回收,花生四烯酸代谢,抗原加工和呈递,乙醛酸酯和二羧酸盐代谢,胰高血糖素信号通路,嘧啶代谢,弓形体病,细菌侵袭上皮细胞等KEGG通路。显著富集的20条生物通路中,除了抗原加工与呈递,嘧啶代谢,细菌侵染上皮细胞通路外,其余通路在K1 vs K0中的显著程度均比其他比较组高(图6)。其中,代谢相关通路12条,环境信息处理通路3条,细胞过程通路2条,有机系统通路2条,人类疾病通路1条。总体上,Cu2+胁迫6 h后,显著富集的KEGG通路主要集中在代谢、信号传导和细胞防御等方面。

图6 K1 vs K0 Top20 KEGG通路在各组中的表达分析
Fig.6 Expression analysis of the Top 20 KEGG pathways in comparative genomics in K1 vs K0
2.3.2 Cu2+胁迫36 h对肾脏中基因表达的影响 与K0相比,Cu2+胁迫36 h后共筛选出689个差异表达基因(图7(a)),其中4个基因与应激过程相关:RPT2B(26S proteasome non-ATPase regulatory subunit 2B)、H315、ATP8B2(ATPase phospholipid transporting 8B2)和Pfn1(profilin 1);5个基因与免疫过程相关:Golph3(golgi phosphoprotein 3)、HIF1A、Mr1(major histocompatibility complex,class Ⅰ related)、MHC2 (major histocompatibility complex,class Ⅱ)和TOP2B(DNA topoisomerase Ⅱ Beta)。其中,Golph3、RPT2B、HIF1A和Mr1基因的表达显著上调(n=3,P<0.05),而H315、ATP8B2、Pfn1、MHC2和TOP2B基因的表达显著下调(n=3,P<0.05)。
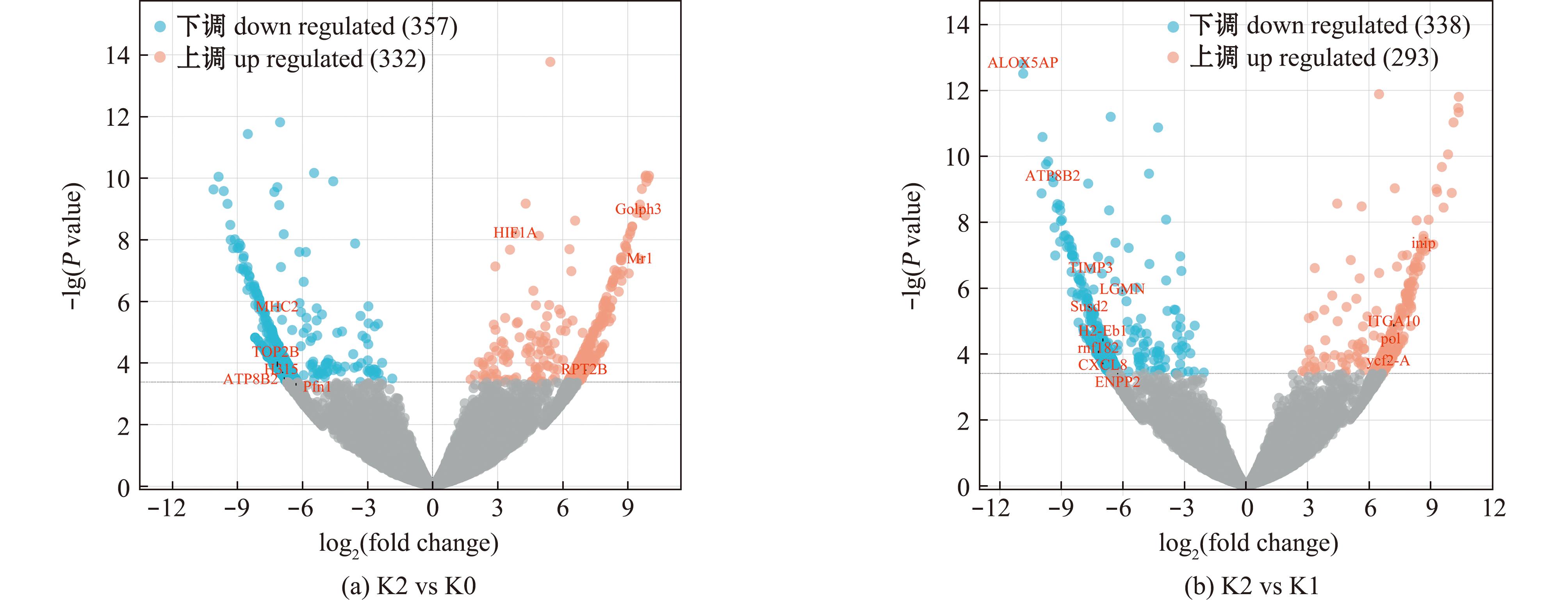
图7 K2 vs K0和K2 vs K1中差异基因的上下调分析
Fig.7 Upregulation and downregulation analysis of differential gene in K2 vs K0 and K2 vs K1
与Cu2+胁迫6 h相比,Cu2+胁迫36 h后共筛选出631个差异表达基因,包含338个基因显著下调和293个基因显著上调(图7(b))。其中6个基因与应激过程相关:INIP、ALOX5AP(arachidonate 5-lipoxygenase activating protein)、ATP8B2、TIMP3(TIMP metallopeptidase inhibitor 3)、ITGA10(integrin subunit alpha 10)和pol(polymerase);7个基因与免疫过程相关:LGMN(legumain)、Susd2、H2-Eb1、rnf182(ring finger protein 182)、ycf2-A、CXCL8和ENPP2(ectonucleotide pyrophosphatase/phosphodiesterase 2)。其中,INIP、ITGA10、pol和ycf2-A基因的表达显著上调(n=3,P<0.05),而ALOX5AP、ATP8B2、TIMP3、LGMN、Susd2、H2-Eb1、rnf182、CXCL8和ENPP2基因的表达显著下调(n=3,P<0.05)。
结合Cu2+胁迫6 h后的上下调差异基因分析(图5),发现与K0组相比,HIF1A在Cu2+胁迫6和36 h中的表达均呈现显著上调趋势,然而两个胁迫组间差异并不显著;Susd2、H2-Eb1和CXCL8的表达量在Cu2+胁迫6 h显著上升,而在Cu2+胁迫36 h显著下降;INIP的表达量在Cu2+胁迫6 h显著下降,而在Cu2+胁迫36 h显著上升。
与Cu2+胁迫6 h相比,在Cu2+胁迫36 h后的主要生物通路有甲型流感、抗原加工和呈递、甲状腺激素信号通路、肾细胞癌、炎症性肠病、碳水化合物的消化和吸收、细菌侵袭上皮细胞、黏着、破骨细胞分化、结直肠癌、病毒性心肌炎、小细胞肺癌、病毒致癌、单纯疱疹病毒感染、类风湿性关节炎、子宫内膜癌、移植物抗宿主病、急性髓系白血病、醛固酮调节的钠重吸收、蛋白质消化和吸收等KEGG通路(图8)。其中,疾病相关通路11条,免疫相关通路2条,信号传导相关通路2条,代谢相关通路2条,细胞过程相关通路3条。与Cu2+胁迫6 h相比,在Cu2+胁迫36 h后细胞的响应从代谢调节逐渐转向病理和免疫反应等方面。
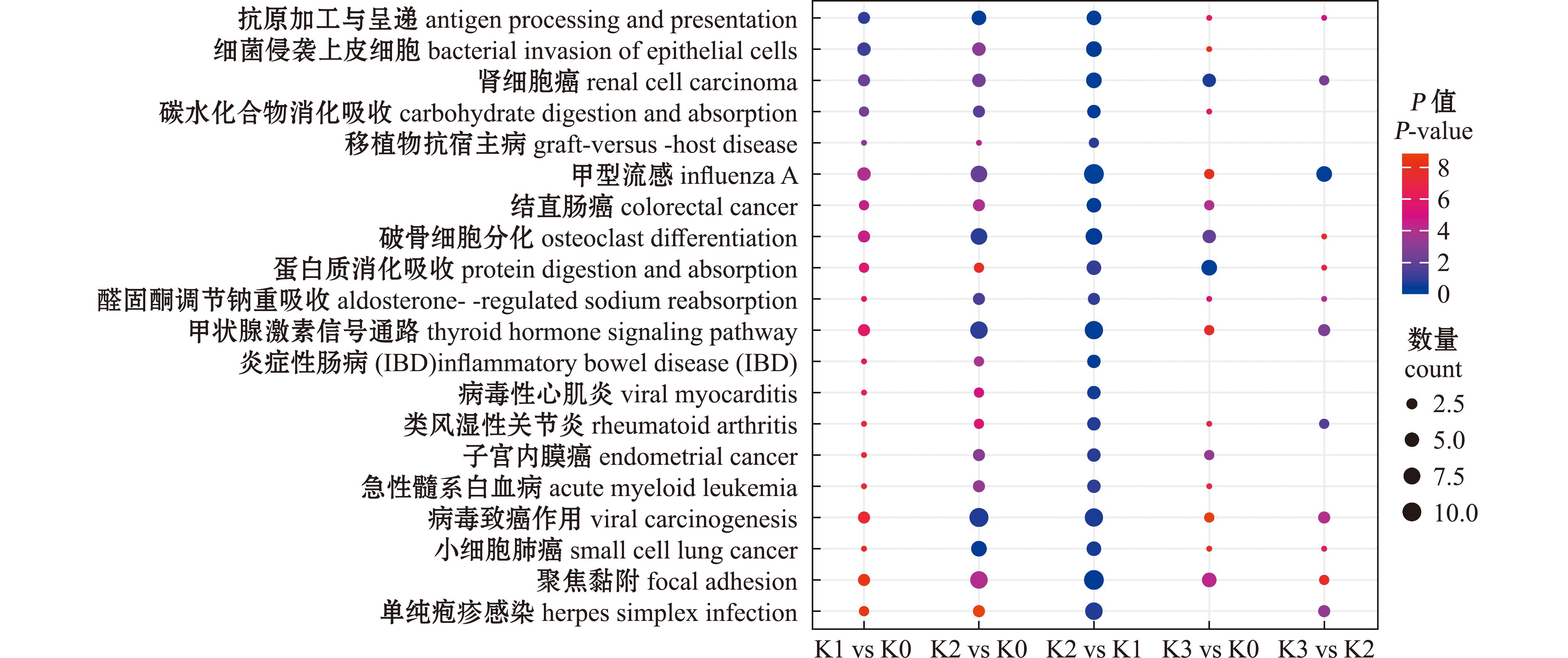
图8 K2 vs K1 Top20 KEGG通路在各组中的表达分析
Fig.8 Expression analysis of the Top 20 KEGG pathways in comparative genomics in K2 vs K1
2.3.3 Cu2+胁迫72 h对肾脏中基因表达的影响 与K0组相比,Cu2+胁迫72 h后共筛选出550个差异表达基因(图9(a)),其中1个基因与应激过程相关:Pigo(phosphatidylinositol glycan anchor biosynthesis class O);7个基因与免疫过程相关:Golph3、HIF1A、Hmg20a (high mobility group protein 20A)、Susd2、TOP2B、Ramp1 (receptor activity-modifying protein 1)和PRR18Mr1。其中,Golph3、Pigo、HIF1A、Hmg20a和Susd2基因的表达显著上调(n=3,P<0.05),而Ramp1和TOP2B基因的表达显著下调(n=3,P<0.05)。
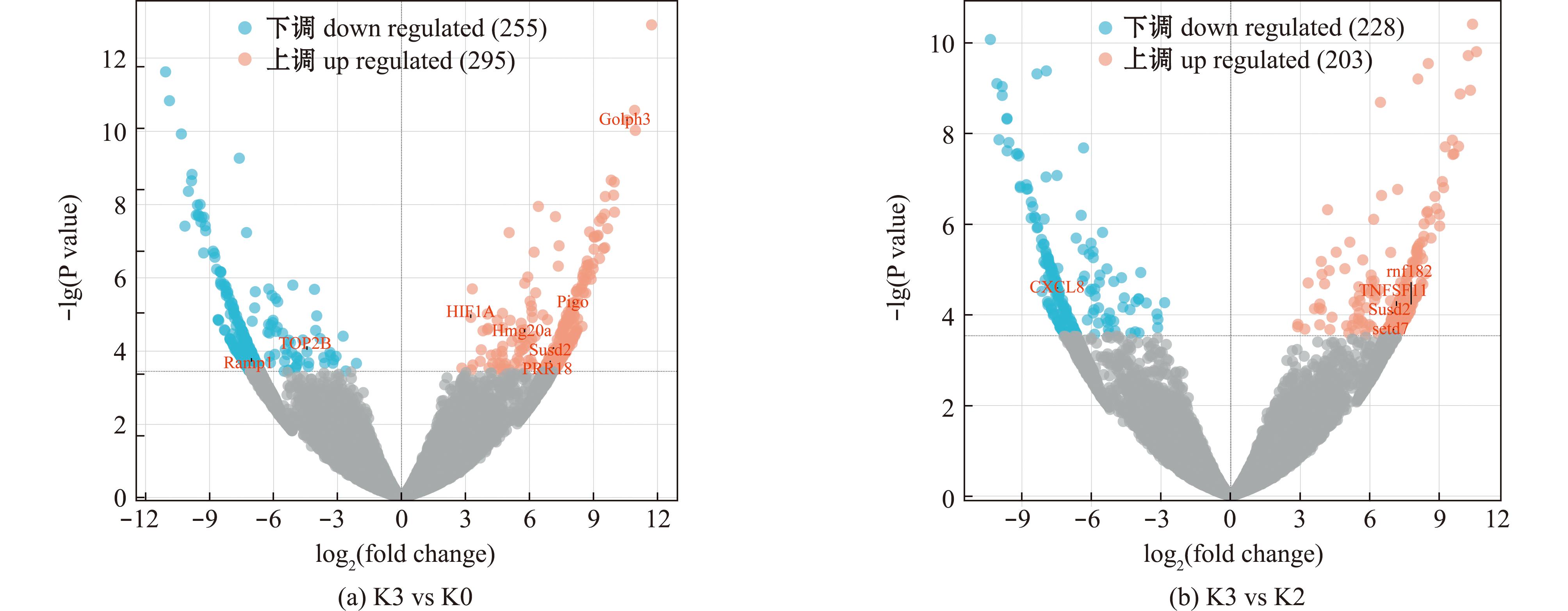
图9 K3 vs K0和K3 vs K2中差异基因的上下调分析
Fig.9 Upregulation and downregulation analysis of differential gene in K3 vs K0 and K3 vs K2
与Cu2+胁迫36 h相比,Cu2+胁迫72 h后共有431个差异表达基因(图9(b)),其中5个基因与免疫过程相关:CXCL8、rnf182、TNFSF11(Tumor Necrosis Factor Ligand Superfamily Member 11)、Susd2和setd7(SET domain containing lysine methyltransferase 7)。其中,rnf182、TNFSF11、Susd2和setd7基因的表达显著上调(n=3,P<0.05),而CXCL8基因的表达显著下调(n=3,P<0.05)。
结合Cu2+胁迫6、36 h(图5和图7)后的差异基因分析,发现与K0组相比HIF1A在Cu2+胁迫6、36、72 h中的表达均呈现显著上调趋势;Golph3在Cu2+胁迫36、72 h中的表达均呈现显著上调趋势;TOP2B在Cu2+胁迫36、72 h中的表达均呈现显著下调趋势,然而HIF1A、Golph3和TOP2B在不同胁迫时长组间无显著性差异。CXCL8的表达量在Cu2+胁迫6 h显著上升,在Cu2+胁迫36、72 h均显著下降。Susd2的表达量在Cu2+胁迫6 h显著上升,在Cu2+胁迫36 h显著下降,而在Cu2+胁迫72 h又呈现显著上升趋势。
与Cu2+胁迫36 h相比,Cu2+胁迫72 h后的主要生物通路有甲型流感、剪接体、亨廷顿氏病、胆汁分泌、甾体激素生物合成、DNA复制、cGMP-PKG信号通路、细胞周期-杆状菌、NF-κB信号通路、醚脂代谢、幽门螺杆菌感染上皮细胞信号传导、鞘脂代谢、光传导-果蝇、造血细胞谱系、内质网中的蛋白质加工、矿物质吸收、钙信号通路、帕金森病、FcγR介导的吞噬作用、细胞因子-细胞因子受体相互作用等KEGG通路(图10)。其中,疾病相关通路4条,遗传信息处理相关通路3条,代谢相关通路4条,信号传导相关通路3条,细胞过程相关通路3条,有机系统相关通路3条。Cu2+胁迫72 h后,细胞的响应进一步从免疫和代谢调节转向病理变化、信号传导和遗传信息处理等方面。

图10 K3 vs K2 Top20 KEGG通路在各组中的表达分析
Fig.10 Expression analysis of the Top 20 KEGG pathways in comparative genomics in K3 vs K2
2.3.4 Cu2+胁迫下花斑裸鲤肾脏组织差异表达基因RT-qPCR验证分析 为验证转录组数据的准确性,挑选6个转录因子进行RT-qPCR验证。从图11可见,6个转录因子RT-qPCR的相对表达量随胁迫时间的变化趋势与转录组测序结果存在一定差异,但总体而言,Cu2+胁迫下的转录组结果与RT-qPCR验证试验基本一致,转录本真实反映了基因表达的差异。
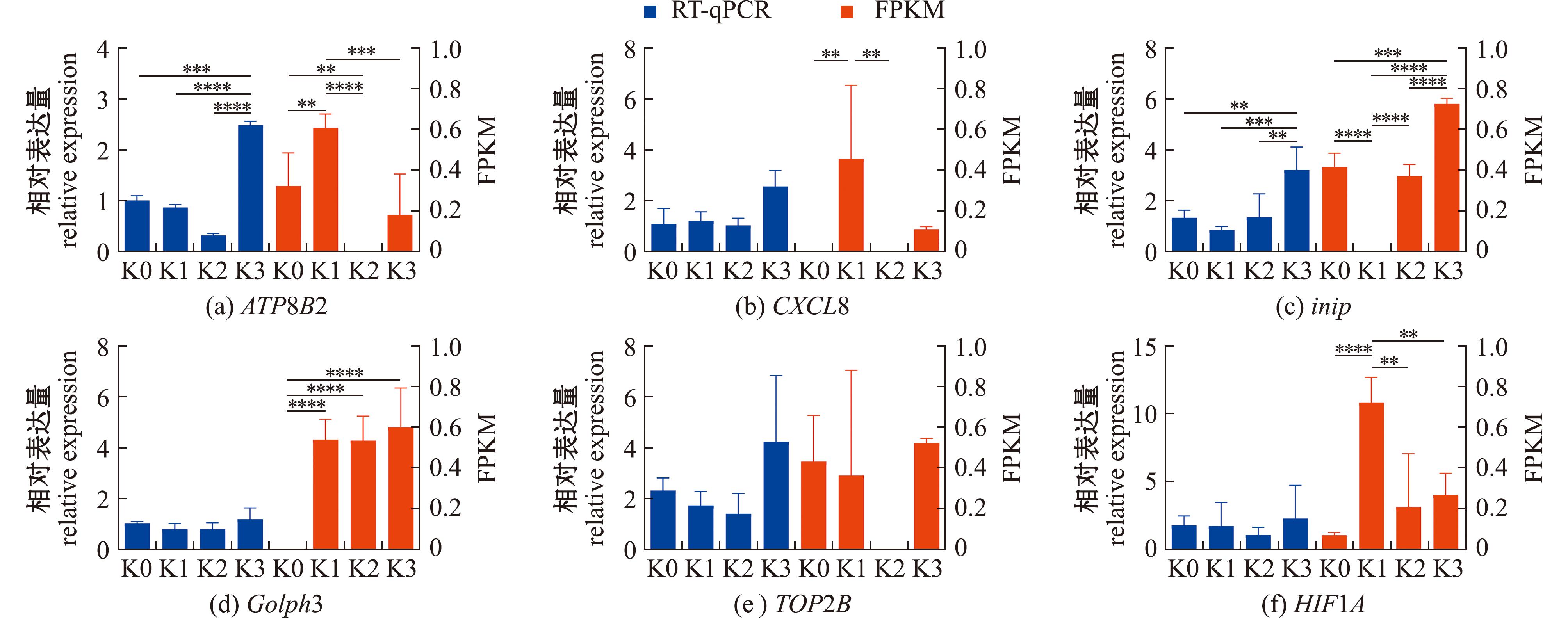
**,***,****表示组间有极显著性差异(P<0.01)。
**,***,**** means very significant difference within the same column(P<0.01).
图11 Cu2+胁迫下花斑裸鲤肾脏组织差异表达基因RT-qPCR验证分析
Fig.11 RT-qPCR validation analysis of differentially expressed genes in kidney tissue of Gymnocypris eckloni under Cu2+ stress
3 讨论
3.1 Cu2+胁迫对花斑裸鲤肾脏免疫调节的影响
本研究中,在Cu2+胁迫后花斑裸鲤肾脏中共筛选出6个有显著变化的免疫相关基因:HIF1A、Golph3、Susd2、CXCL8、H2-Eb1和TOP2B,初步推测这些基因在Cu2+胁迫后花斑裸鲤肾脏的免疫调节中均发挥着重要作用。
HIF1A即缺氧诱导因子-1α(hypoxia-inducible factor-1 alpha,HIF-1α),是HIF-1的一个亚基。在重金属胁迫下,细胞代谢和微环境的变化会影响氧的利用和供应,进而调控HIF1A的活性[12]。研究表明,不同重金属通过HIF1A介导的免疫调节机制发挥不同作用:Co2+胁迫促进HIF1A依赖的巨噬细胞M2型极化,增加抗炎因子IL-10分泌以减轻炎症[13];Hg2+胁迫通过HIF1A上调巨噬细胞甘露糖受体表达,增强其吞噬功能以维持免疫稳态[14];Ni2+胁迫则通过HIF1A促进肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)分泌,激活免疫细胞增强炎症反应[15];而Ti4+胁迫下HIF1A与核因子-κB(nuclear factor kappa B,NF-κB)协同作用诱导炎症反应[16]。此外,HIF1A还能调节T细胞活性,影响其对病原体的清除能力[17]。高尔基体磷蛋白3(golgi phosphoprotein 3,Golph3)是定位于高尔基体的磷蛋白,在细胞内参与囊泡运输、蛋白质糖基化修饰,维持高尔基体结构和功能等多种生理过程[18]。当细胞受到重金属胁迫时,Golph3可通过与其他信号分子的相互作用,激活细胞内的抗氧化防御系统,引起超氧化物歧化酶、过氧化氢酶等抗氧化酶的表达和活性增加,以清除重金属诱导产生的过量ROS,减轻氧化应激对细胞的损害[19]。Sushi结构域蛋白2(Susd2)作为细胞表面蛋白,在肿瘤、免疫和炎症反应中至关重要。重金属离子与Susd2结合后,诱导其构象变化并与受体酪氨酸激酶(receptor tyrosine kinase,RTK)形成复合物,激活RTK内在酪氨酸激酶活性,经磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)、磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-trisphosphate,PIP3)等信号分子激活蛋白激酶B(protein kinase B,PKB,Akt)信号通路,参与细胞存活、增殖和免疫调节[20-21];同时,Susd2与IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKK)复合物相互作用,促使NF-κB释放并启动免疫相关基因转录[22]。CXC趋化因子配体8(CXC chemokine ligand 8,CXCL 8),又称白细胞介素-8(interleukin-8,IL-8),在免疫反应和炎症过程中发挥关键作用。Pb2+、Cd2+和Hg2+等重金属离子通过诱导氧化应激、DNA损伤,激活NF-κB、MAPK及DNA损伤修复通路等(如ATM/ATR),上调CXCL8表达,经其受体招募免疫细胞清除受损细胞、减轻炎症[23-24]。组织相容性2Eβ链1(histocompatibility 2,E beta chain 1,H2-Eb1)主要参与细胞骨架稳定和动态调节,在重金属离子胁迫下,在免疫和氧化应激方面具有复杂机制。免疫方面,H2-Eb1通过影响B细胞和T细胞受体信号通路,调控B、T细胞分化[25];抗氧化方面,其与Nrf2-ARE信号通路相互作用调节抗氧化酶表达,还通过影响IκB调节NF-κB活性[26]。拓扑异构酶Ⅱβ(topoisomerase Iiβ,TOP2B)在DNA拓扑结构调控中扮演关键角色,深度参与DNA复制、转录、重组及染色体分离等重要生命过程[27]。在重金属离子胁迫下,TOP2B能够通过改变染色质拓扑结构来调控免疫相关基因转录[28]。在Cd2+胁迫下,细胞内氧化应激信号促使TOP2B与Nrf2基因启动子区域结合,改变其拓扑结构,促进Nrf2表达上调[29]。Nrf2进入细胞核后与ARE结合,启动抗氧化酶和解毒酶基因转录,增强细胞抵御氧化应激能力[30]。
本研究中,不同时长Cu2+胁迫显著影响花斑裸鲤肾脏中免疫相关基因表达。其中,HIF1A分别在Cu2+胁迫6、36、72 h时表达水平均显著上调且保持稳定,推测是Cu2+改变细胞氧化还原状态与离子平衡,经氧化应激促进HIF1A基因和VHL蛋白表达,通过VHL泛素化降解HIF1A形成稳定表达的负反馈环路[31]。Golph3在Cu2+胁迫下表达显著上调,且不随时间变化,显示其对胁迫敏感,能快速响应并稳定表达,在应激反应早期信号识别与转导中起核心作用,激活下游防御机制以减轻细胞损伤。Susd2在胁迫6、72 h时显著上调,其启动的免疫应答有助于肾脏抵御重金属损伤,推测肾脏细胞可通过上调该蛋白从而激活NF-κB通路与Akt信号通路,维持细胞存活。CXCL8在胁迫6 h显著上调,随后逐渐下调,36、72 h时与K0组无显著性差异,表明初期上调有助于应对急性损伤,后期细胞通过适应性调节降低表达以减轻炎症和损伤。H2-Eb1胁迫6 h显著上调,36 h下调至与对照组无显著性差异,表明其表达具有时间依赖性,早期上调利于维持免疫、清除ROS及调节NF-κB活性,后期下调反映肾脏细胞适应机制转变或受损,影响免疫和抗氧化能力。TOP2B对胁迫的响应呈现复杂动态特征,胁迫6 h时表达无显著性变化,可能是通过调整染色质结构帮助细胞适应环境;而胁迫36 h时显著下调,表明长时间胁迫对细胞造成较严重损害,致使细胞调控体系紊乱。
3.2 Cu2+胁迫对花斑裸鲤肾脏应激反应的影响
本研究中,在Cu2+胁迫后花斑裸鲤肾脏中共筛选出2个在胁迫组中有显著变化的应激相关基因:INIP和ATP8B,初步推测这2个基因在Cu2+胁迫后花斑裸鲤肾脏的应激反应中均发挥着重要作用。
INTS3和NABP相互作用蛋白(ints3 and nabp interacting protein,INIP)是单链DNA结合复合体(sensor of single-stranded DNA complex,SOSS)的一个亚基[32]。SOSS复合体可与DNA损伤处的单链DNA结合,对细胞周期检查点激活、重组修复和维持基因组稳定性等细胞DNA损伤反应产生影响[33]。此外,SOSS复合体还参与依赖于同源重组的双链断裂(double-strand breaks,DSB)修复和共济失调毛细血管扩张突变蛋白(ataxia-telangiectasia mutated,ATM)依赖的信号通路[34]。重金属离子进入细胞后,会与细胞内生物分子发生非特异性结合,改变生物分子的结构,导致蛋白质变性失活,同时诱导ROS的产生,进一步损伤细胞内的DNA、蛋白质和脂质等生物分子,破坏细胞正常生理功能,从而影响细胞的生存、增殖和分化等过程[35]。ATP酶磷脂转运蛋白8B2(ATPase phospholipid transporting 8B2,ATP8B2)作为P4-ATPase flippase复合体的催化组分,可以将磷脂酰丝氨酸等特定磷脂从细胞膜的外层转运到内层,从而维持细胞膜的脂质不对称性,调节细胞的识别、信号传导等过程[36]。此外,ATP8B2还参与调节内质网、高尔基体等细胞器膜的磷脂组成,促进蛋白质的合成、加工、运输等功能。有研究显示,重金属胁迫产生的活性氧(ROS)会攻击细胞膜中的磷脂,导致脂质过氧化,形成如丙二醛(MDA)和4-羟基壬烯酸(4-HNE)等活性脂质衍生物[37]。在此过程中,ATP8B2持续转运磷脂,修复可能出现的磷脂分布异常,减少细胞膜的损伤,从而保证细胞内信号能够正常传导到细胞核,增强细胞的抗氧化能力[38]。
本研究中,在Cu2+胁迫6 h时,INIP表达显著下调,可能是由于Cu2+迅速与细胞内生物分子相互作用,致使SOSS复合体组装不全或功能受损,进而影响了细胞应对DNA损伤的能力[39];与此同时,KEGG通路富集于代谢调节,细胞内ROS引发脂质过氧化,形成脂质衍生物,造成脂质分布不均,而ATP8B2通过正常表达维持细胞膜脂质不对称性,调节细胞识别与信号传导过程。胁迫36 h时,INIP表达量显著上调,这可能是细胞面对持续累积的DNA损伤,因SOSS复合体功能异常无法及时修复,故而试图通过上调INIP表达来重建功能完整的SOSS复合体,增强对DNA损伤处单链DNA的结合能力以缓解危害。然而,在Cu2+胁迫36 h的肾脏中ATP8B2的表达受到抑制,可能是由于细胞内Cu2+不断积累,ROS浓度持续上升,致使内质网功能受损,影响蛋白质的折叠与加工[40]。
3.3 Cu2+胁迫对花斑裸鲤肾脏细胞信号通路的影响
本研究中表明,Cu2+胁迫对花斑裸鲤肾脏细胞生物通路的影响呈现显著的动态变化特征。Cu2+胁迫6 h时,生物通路主要富集于甘氨酸、丝氨酸和苏氨酸代谢等基础代谢过程,以及内吞作用、矿物质吸收等细胞基础生理活动,同时涉及卟啉和叶绿素代谢、药物代谢等特殊代谢通路。研究表明,重金属可通过干扰酶活性或竞争结合关键位点影响细胞代谢甚至引发细胞形态的改变[41-42]。由此推测此时Cu2+刚进入细胞,可能破坏细胞内正常代谢的稳态,迫使细胞优先调动基础代谢通路以应对离子胁迫带来的能量和物质需求变化。Cu2+胁迫36 h时,生物通路转向与疾病发生发展相关的过程,如肾细胞癌、炎症性肠病等,同时出现甲型流感、病毒致癌等与病原体感染及肿瘤发生相关通路,而持续的氧化应激和炎症状态与肿瘤发生发展紧密相关[43]。这可能暗示持续的Cu2+胁迫导致细胞DNA损伤累积、氧化应激加剧,使得细胞内抑癌基因和原癌基因表达失衡,免疫微环境紊乱,机体免疫与疾病防御系统被激活,细胞开始向病理状态转变。当胁迫持续至72 h,生物通路进一步转变,涵盖DNA复制、细胞周期调控、NF-κB信号通路等与细胞修复、增殖及炎症反应密切相关的过程,同时涉及亨廷顿氏病、帕金森病等神经退行性疾病相关通路,表明长时间Cu2+胁迫不仅严重影响肾脏细胞的正常生理功能,还可能引发更严重的细胞病理改变。
4 结论
1)本研究中通过高质量转录组测序和从头组装,获得了花斑裸鲤肾脏在Cu2+胁迫下的486 221个基因片段(N50=1 480 bp)和704 405个转录本(N50=1 265 bp),组装质量可靠,为后续差异表达分析奠定了基础。
2)花斑裸鲤肾脏对Cu2+胁迫的应答通路具有时间依赖性。在Cu2+胁迫6 h时主要激活代谢调节相关通路,体现出细胞对重金属的初级适应;36 h时显著转向病理反应与免疫应答通路,反映机体启动防御机制;72 h时主要涉及遗传信息处理和信号传导通路,表明随胁迫时间延长细胞响应已从基础代谢调控逐步演变为复杂的分子调控网络和系统性防御过程。
3)不同时长Cu2+胁迫的花斑裸鲤肾脏中,共筛选与鉴定出6个免疫相关基因(HIF1A、Golph3、Susd2、CXCL8、H2-Eb1和TOP2B)和2个应激相关基因(INIP和ATP8B2),其表达均呈现动态变化。此外,这些基因通过参与调控氧化应激响应、免疫信号通路激活、细胞膜稳态维持及DNA损伤修复等关键生物学过程,在花斑裸鲤肾脏应对Cu2+胁迫的免疫防御机制和应激适应过程中发挥核心调控作用。
[1] ZHOU C W,DUAN Y T,LI J T,et al.A study on the hepatic response to heat stress in Gymnocypris eckloni through an approach combining metabolomic and transcriptomic profiling[J].Aquaculture Reports,2024,39:102392.
[2] 申志新,王国杰,杨成,等.青海省花斑裸鲤现状及保护对策 [J].青海农牧业,2011,(2):17-19.
SHEN Z X,WANG G J,YANG C,et al.Current status and conservation strategies of Gymnocypris eckloni in Qinghai Province [J].Journal of Qinghai Agriculture and Animal Husbandry,2011,(2):17-19.(in Chinese)
[3] HE H,ZHANG B B,SUN S J,et al.Liver transcriptome analysis revealing response to high-temperature stress in Glyptosternum maculatum (Sisoridae:Siluriformes)[J].Aquaculture Reports,2023,29:101538.
[4] 李聪,王振斌,高云霓,等.黄河上游青川甘段表层沉积物重金属分布特征及风险评价[J].水生态学杂志,2024,45(2):63-72.
LI C,WANG Z B,GAO Y N,et al.Distribution and risk assessment of heavy metals in surface sediments of the qingchuangan section of the upper Yellow River[J].Journal of Hydroecology,2024,45(2):63-72.(in Chinese)
[5] WANGHE K Y,FENG C G,TANG Y T,et al.Phylogenetic relationship and taxonomic status of Gymnocypris eckloni (Schizothoracinae) based on specific locus amplified fragments sequencing[J].Frontiers in Ecology and Evolution,2022,10:933632.
[6] 冉凤霞,金文杰,端智卓玛,等.Zn2+胁迫对花斑裸鲤抗氧化关键基因表达和抗氧化酶活性的影响[J].大连海洋大学学报,2021,36(3):406-413.
RAN F X,JIN W J,DUANZHI Z M,et al.Effects of Zn2+ stress on expression of key antioxidant genes and antioxidant enzyme activities in eckloni naked carp Gymnocypris eckloni[J].Journal of Dalian Ocean University,2021,36(3):406-413.(in Chinese)
[7] ZAGHLOUL G Y,EISSA H A,ZAGHLOUL A Y,et al.Impact of some heavy metal accumulation in different organs on fish quality from Bardawil Lake and human health risks assessment[J].Geochemical Transactions,2024,25(1):1.
[8] AJANWACHUKWU O J,ONAH I E,UBACHUKWU P O.Heavy metal concentrations in the water and fish muscles of lakes ogelube and ojii in southeastern nigeria[J].Polish Journal of Natural Sciences,2023,38(1).
[9] GU R T,LIN H Y,ZHOU Y,et al.Programmed responses of different life-stages of the seagrass Ruppia sinensis to copper and cadmium exposure[J].Journal of Hazardous Materials,2021,403:123875.
[10] 吕芳,詹冬梅,郭文,等.重金属镉对铜藻生长及其生物活性成分积累的影响[J].大连海洋大学学报,2017,32(6):664-670.
LÜ F,ZHAN D M,GUO W,et al.Effect of cadmium stress on growth and accumulation of bioactive compounds in brown Alga Sargassum horneri[J].Journal of Dalian Ocean University,2017,32(6):664-670.(in Chinese)
[11] KOMOIKE Y,MATSUOKA M.Developmental adverse effects of trace amounts of lead:evaluation using zebrafish model[J].Frontiers in Pharmacology,2022,13:1014912.
[12] WANG H Q, ZHAO X Y, XUAN W, et al. Rice roots avoid asymmetric heavy metal and salinity stress via an RBOH-ROS-auxin signaling cascade [J].Molecular Plant, 2023, 16(10): 1678-1694.
[13] SALLOUM Z, LEHOUX E A, HARPER M E, et al. Effects of cobalt and chromium ions on glycolytic flux and the stabilization of hypoxia-inducible factor-1α in macrophages in vitro [J].Journal of Orthopaedic Research, 2021, 39(1): 112-120.
[14] CHANG J,YANG B B,ZHOU Y,et al.Acute methylmercury exposure and the hypoxia-inducible factor-1αsignaling pathway under normoxic conditions in the rat brain and astrocytes in vitro[J].Environmental Health Perspectives,2019,127(12):127006.
[15] KANG Y T,LI C T,TANG S C,et al.Nickel chloride regulates ANGPTL4 via the HIF-1α-mediated TET1 expression in lung cells[J].Toxicology Letters,2021,352:17-25.
[16] HONG F S,JI J H,ZE X,et al.Liver inflammation and fibrosis induced by long-term exposure to nano titanium dioxide (TiO2) nanoparticles in mice and its molecular mechanism[J].Journal of Biomedical Nanotechnology,2020,16(5):616-625.
[17] TRAN C W,GOLD M J,GARCIA-BATRES C,et al.Hypoxia-inducible factor 1 alpha limits dendritic cell stimulation of CD8 T cell immunity[J].PLoS One,2020,15(12):e0244366.
[18] LOWE M.GOLPH3 keeps the Golgi residents at home[J].The Journal of Cell Biology,2021,220(10):e202108147.
[19] LI Y,ZHANG H F,LONG W H,et al.Inhibition of NLRP3 and Golph3 ameliorates diabetes-induced neuroinflammation in vitro and in vivo[J].Aging,2022,14(21):8745-8762.
[20] DU Z F,LOVLY C M.Mechanisms of receptor tyrosine kinase activation in cancer[J].Molecular Cancer,2018,17(1):58.
[21] YANG Y,LI S,WANG Y J,et al.Protein tyrosine kinase inhibitor resistance in malignant tumors:molecular mechanisms and future perspective[J].Signal Transduction and Targeted Therapy,2022,7(1):329.
[22] ZHAO B,GONG W P,MA A J,et al.SUSD2 suppresses CD8+ T cell antitumor immunity by targeting IL-2 receptor signaling[J].Nature Immunology,2022,23(11):1588-1599.
[23] MORTIER A,VAN DAMME J,PROOST P.Overview of the mechanisms regulating chemokine activity and availability[J].Immunology Letters,2012,145(1/2):2-9.
[24] CAMBIER S,GOUWY M,PROOST P.The chemokines CXCL8 and CXCL12:molecular and functional properties,role in disease and efforts towards pharmacological intervention[J].Cellular &Molecular Immunology,2023,20(3):217-251.
[25] SHAO W,WANG Y F,FANG Q,et al.Epigenetic recording of stimulation history reveals BLIMP1-BACH2 balance in determining memory B cell fate upon recall challenge[J].Nature Immunology,2024,25(8):1432-1444.
[26] 李航,段惠军.Nrf2/ARE信号通路及其调控的抗氧化蛋白[J].中国药理学通报,2011,27(3):300-303.
LI H,DUAN H J.Nrf2/ARE pathway and downstream antioxidant genes[J].Chinese Pharmacological Bulletin,2011,27(3):300-303.(in Chinese)
[27] SAROJ N,DHOLANIYA P S,ALVI S B,et al.SiRNA-mediated knockdown of TOP2B protects hiPSC-derived cardiomyocytes from doxorubicin-induced toxicity[J].Life Sciences,2025,371:123595.
[28] COWELL I G,CASEMENT J W,AUSTIN C A.To break or not to break:the role of TOP2B in transcription[J].International Journal of Molecular Sciences,2023,24(19):14806.
[29] PI J B,BAI Y S,REECE J M,et al.Molecular mechanism of human Nrf2 activation and degradation:role of sequential phosphorylation by protein kinase CK2[J].Free Radical Biology &Medicine,2007,42(12):1797-1806.
[30] UUSKÜLA-REIMAND L,WILSON M D.Untangling the roles of TOP2A and TOP2B in transcription and cancer[J].Science Advances,2022,8(44):eadd4920.
[31] YANG Z,SU W,WEI X Y,et al.Hypoxia inducible factor-1α drives cancer resistance to cuproptosis[J].Cancer Cell,2025,43(5):937-954.e9.
[32] PHAN L M,REZAEIAN A H.ATM:main features,signaling pathways,and its diverse roles in DNA damage response,tumor suppression,and cancer development[J].Genes,2021,12(6):845.
[33] XU C L,LI C Y,CHEN J W,et al.R-loop-dependent promoter-proximal termination ensures genome stability[J].Nature,2023,621(7979):610-619.
[34] ZHAO H C,LI J,YOU Z S,et al.Distinct regulation of ATM signaling by DNA single-strand breaks and APE1[J].Nature Communications,2024,15(1):6517.
[35] ZHU Q Q,LI X H,GE R S.Toxicological effects of cadmium on mammalian testis[J].Frontiers in Genetics,2020,11:527.
[36] TAKATSU H,NISHIMURA N,KOSUGI Y,et al.De novo missense variations of ATP8B2 impair its phosphatidylcholine flippase activity[J].Molecular and Cellular Biology,2024,44(11):473-488.
[37] SIES H,BELOUSOV V V,CHANDEL N S,et al.Defining roles of specific reactive oxygen species (ROS) in cell biology and physiology[J].Nature Reviews Molecular Cell Biology,2022,23(7):499-515.
[38] ZHANG Y F,DENG B L,LI Z T.Inhibition of NADPH oxidase increases defense enzyme activities and improves maize seed germination under Pb stress[J].Ecotoxicology and Environmental Safety,2018,158:187-192.
[39] BALALI-MOOD M,NASERI K,TAHERGORABI Z,et al.Toxic mechanisms of five heavy metals:mercury,lead,chromium,cadmium,and arsenic[J].Frontiers in Pharmacology,2021,12:643972.
[40] LI H,KELLEY J,YE Y Q,et al.REDOX imbalance and oxidative stress in the intervertebral disc:the effect of mechanical stress and cigarette smoking on ER stress and mitochondrial dysfunction[J].Cells,2025,14(8):613.
[41] TIAN L J,ZHENG Y T,DANG Z,et al.Near-native imaging of metal ion-initiated cell state transition[J].ACS Nano,2025,19(5):5279-5294.
[42] CAO D,CHEN X Q,NAN J,et al.Biomolecular insights into the inhibition of heavy metals on reductive dechlorination of 2,4,6-trichlorophenol in Pseudomonas sp.CP-1[J].Water Research,2023,247:120836.
[43] LEONE A,ROCA M S,CIARDIELLO C,et al.Oxidative stress gene expression profile correlates with cancer patient poor prognosis:identification of crucial pathways might select novel therapeutic approaches[J].Oxidative Medicine and Cellular Longevity,2017,2017:2597581.