脊椎动物生殖细胞在增殖和分化过程中需要相应的能量来支持配子的发生和成熟。精子生成过程包括精原细胞增殖、减数分裂及精子的发育成熟阶段,需要大量能量代谢维持,主要依赖糖酵解和氧化磷酸化(OXPHOS)提供能量[1]。精子发生是一个高增殖、高消耗过程,需要持续的能量供应。相反,卵母细胞的维持和卵泡发育则需要稳定且相对较低的能量供应,仅在排卵和早期胚胎发育需要额外的能量支持,主要依赖氧化磷酸化和脂质代谢提供[2]。卵子发生是一个低增殖、低消耗的过程,但卵母细胞的维持和卵泡发育需要长期稳定的能量支持。已有形态学观察报道,在小鼠粗线期精母细胞中的线粒体被拉长,并含有“浓缩”嵴,即一种与高OXPHOS利用率相关的超微结构[3]。说明线粒体内膜上高OXPHOS利用率对雄性生殖细胞正常进入第一次减数分裂前期的发育起着重要作用。这表明线粒体动态变化,伴随着精原细胞增殖和分化对能量需求的升高,可能存在雌雄差异。并且线粒体代谢对调控雌雄性分化关键信号的敏感性可能也会呈现精原细胞高于卵原细胞。
线粒体作为动态变化显著的细胞器,其形态、数量及活性的动态调控由线粒体裂变与融合机制(即线粒体动力学)所介导。该机制通过精准调控线粒体的分裂与融合过程,参与到细胞中线粒体依赖的生物过程(脂质稳态、钙稳态和ATP生成)[4-5]。人视神经萎缩1型(optic atrophy type 1,opa1)基因编码一种线粒体内膜融合蛋白,即OPA1蛋白。OPA1蛋白包含多个功能域,包括GTPase域、线粒体定位信号和多个剪切位点,主要参与线粒体融合及维持线粒体功能[6]。除此之外,OPA1蛋白也是调控线粒体嵴形态和功能的关键蛋白。在线粒体内,OPA1以内膜锚定形式和面向膜间隙的可溶形式存在。人OPA1基因的mRNA经选择性剪接后,可产生8种不同的剪接变体[7-8],表达后,OPA1通过N-末端线粒体靶向序列(MTS)进入线粒体。MTS下游的跨膜(TM)结构域充当终止转移信号,将OPA1蛋白锚定在内膜处,将大部分蛋白留在膜间隙中[9]。膜锚定OPA1(L-OPA1)被TM区下游的蛋白酶进一步切割,产生无TM的OPA1(S-OPA1)。L-OPA1因含有跨膜结构域,直接锚定于线粒体内膜,而S-OPA1则不具备该结构域,主要存在于线粒体基质中[10-11]。
黑腹果蝇fuzzy onions(fzo)基因编码第一个已知的线粒体融合蛋白介质。在果蝇精子发生过程中,减数分裂早期精子细胞中的线粒体在生长的鞭毛轴丝旁边聚集、融合和伸长。fzo突变雄性在这种发育调节的线粒体融合中存在缺陷并且不育[12]。在果蝇精巢早期生殖细胞中线粒体融合蛋白dMfn(mitofusin)或Opa1的缺失导致线粒体肿胀,嵴塌陷[13]。这与在gsdf-/-精原细胞中观察到的部分线粒体肿胀、管状嵴结构受损消失一致[14]。OPA1在牛卵母细胞减数分裂的不同阶段表达,OPA1活性的抑制导致牛卵母细胞第一极体排出速率降低,纺锤体结构中断,OPA1缺失导致线粒体功能障碍、促进线粒体裂变和通过PINK1/Parkin通路诱导线粒体自噬来影响线粒体[15]。以上研究表明,opa1的表达与生殖细胞的发育密切相关。
gsdf是雄性决定基因dmy(dm-domain on the Y chromosome)的下游因子,其表达受dmy调控,在雄性生殖细胞的有丝分裂增殖与减数分裂启动中起着核心调控作用。在斑马鱼研究中,已成功构建Tg(Crystal-pro-gsdf - 2A-egfp)转基因品系,这一模型为探究斑马鱼精巢发育的分子调控机制提供了全新的研究手段[16]。本研究中,早期以青鳉(Oryzias latipes)作为模式动物,通过锌指核酸酶技术构建了gsdf-/-青鳉,获得了XY巨大精巢的雄鱼[17]。本试验通过分析opa1在gsdf+/+及gsdf-/-青鳉性腺转录组数据,发现opa1 mRNA(包含L-opa1和S-opa1两种亚型)在精巢中的表达因gsdf缺失而显著升高。且通过分析L-opa1在gsdf+/+及gsdf-/-青鳉性腺中的比例,发现其mRNA的表达在gsdf-/-精巢中显著降低。提示opa1两种亚型在gsdf-/-精巢中的比例失衡,可能是导致gsdf-/-雄性生殖细胞线粒体嵴结构异常的原因之一。本试验的研究结果为研究脊椎动物生殖细胞的增殖和分化提供了新的线索和发现。
1 材料与方法
1.1 材料
本试验以日本青鳉(HdrR 品系)为研究对象,选用gsdf正常型(gsdf+/+)和gsdf缺失型(gsdf-/-)两组青鳉品系。试验动物饲养于上海海洋大学水产与生命学院A栋地下室的恒温青鳉鱼房中,环境温度严格控制在24 ℃~26 ℃,并采用14 h光照/10 h黑暗的光周期管理。本试验严格遵循动物伦理规范,所有操作均按照上海海洋大学动物试验相关规章制度执行(试验动物批准编号:SHOU-DW-2021-201)。
1.2 方法
1.2.1 Opa1序列同源性和进化保守性分析 从Ensembl网站上(https://www.ensembl.org/)下载高等脊椎动物(人、小鼠)、两栖动物爪蟾、爬行动物蜥蜴、低等脊椎动物(斑马鱼、青鳉、罗非鱼)及鸡的Opa1氨基酸序列,进行多序列同源比对,并构建不同物种间的系统进化树。以上物种的Ensembl的登录号分别为
青鳉:ENSORLT00000036166.1;
斑马鱼:ENSDART00000104256.4;
罗非鱼:ENSONIT00000003282.2;
人:ENST00000361150.6;
小鼠:ENSMUST00000038867.13;
鸡:ENSGALT00010032965.1;
蜥蜴:ENSACAT00000011325.4;
爪蟾:ENSXETT00000036723.5。
1.2.2 RNA提取及cDNA合成 解剖取得三月龄性成熟gsdf+/+青鳉精巢(testis)、卵巢(ovary)、心脏(heart)、脑(brain)、肝脏(liver)、眼(eyes)、头肾(head kidney)、鳃(gill)和肠(gut)及gsdf-/-青鳉精巢(gsdf -/- T)和卵巢(gsdf -/- O)各组织多个样本(n=3)。利用Trizol法(ThermoFisher,美国)提取RNA,琼脂糖凝胶电泳验证RNA质量,测定其浓度,-80 ℃条件下保存。通过反转录试剂盒(TaKaRa,大连,中国)反转录合成cDNA。
1.2.3 实时荧光定量PCR(quantitative real-time PCR,qPCR) 以上述步骤获得的cDNA为模板。引物通过跨青鳉opa1基因的外显子设计(表1),opa1 qFw和opa1 qRv为L-opa1的上下游引物,opa1 qFw2和opa1 qRv2为opa1(包含L-opa1和S-opa1两种亚型)的上下游引物。利用琼脂糖凝胶电泳验证引物的可用性,结果为特异性条带时,引物可用。选用β-actin作为定量表达内参基因,使用TB Green(TaKaRa,大连,中国)进行目的基因的相对表达量检测。
表1 引物信息
Tab.1 Primer information

引物名称 primername 序列 (5'-3') sequence 片段长度/bp fragmentlength actinqFw GTGCTGTCTTTCCCTCCATC 168 actinqRv TCTCCATGTCATCCCAGTTG fis1qFw ATCGCGTTGTTGGAGGAACT 150 fis1qRv GTTCTCCGGCTCGTTCTTCA opa1qFw CAACTGAATCGCAAGTCATCAG 106 opa1qRv CCTTCTCGAGCCTCTCAAGC opa1qFw2 CTGCTGCCCAAACAATGGAC 144 opa1qRv2 CAGCCATGAAACGGGCAAAT mffqFw ATTCGCCGTCAGCTCATCAA 137 mffqRv CGCATCCACACCCAGGTATT drp1qFw GTTGTTGGAACCCAGAGCAG 138 drp1qRv GCGATCCTCGGGATCAAT
1.3 数据处理
从早期得到的gsdf+/+和gsdf-/-性腺转录组数据,以差异倍数|FoldChange|>1和差异显著性 P<0.05为标准,筛选差异表达基因。利用GraphPad Prism软件绘制显著差异表达基因群的火山图。利用DAVID(https://davidbioinformatics.nih.gov/)在线网站进行GO富集。利用String网站进行蛋白互作网络(PPI)预测。
实时荧光定量PCR方法得到的数据结果,使用 2-ΔΔCt法计算,通过 GraphPad Prism软件进行绘图和显著性分析,显著性差异设为0.05。
2 结果与分析
2.1 青鳉Opa1序列在各物种间的同源性和进化保守性
对青鳉opa1的cDNA片段进行分析,结果表明其全长为5 628 bp,可编码1 034个氨基酸。利用EMBOSS Needle对青鳉及其他7个物种的Opa1氨基酸序列进行比对分析,结果显示,罗非鱼与青鳉的Opa1氨基酸序列相似性最高,达到96.8%;而爪蟾和蜥蜴与青鳉的相似性最低,均为73.8%(表2)。进一步对8个物种的Opa1氨基酸序列进行同源性分析,发现其相似性高达81.26%(图1),表明Opa1序列具有进化保守性。

TM(Transmembrane domain)—跨膜结构域;P-loop_NTPase(DLP_1)—GTPase结构域;C-terminal—C端结构域。
TM—the transmembrane domain;P-loop_NTPase(DLP_1)—the GTPase domain;C—terminal is the C-terminal domain.
图1 各物种Opa1氨基酸序列的同源性比对分析
Fig.1 Structural characterization of Opa1 amino acids alignment across species constructed by ClustalW
表2 脊椎动物中opa1基因结构及氨基酸序列相似性比较
Tab.2 Comparison of the structure and amino acid sequence of opa1 gene among vertebrate species

总目 superorder 物种 species 外显子数目 exonnumber 氨基酸长度/aa aminoacidlength 一致性/% identity 相似性/% similarity 青鳉 (Oryziaslatipes) 31 1034 100.0 100.0 鱼类fishes 斑马鱼 (Daniorerio) 29 966 84.2 88.2 罗非鱼 (Oreochromisniloticus) 31 1032 93.1 96.8 哺乳类 mammals 人 (Homosapiens) 29 961 74.3 83.4 小鼠 (Musmusculus) 30 978 74.1 83.3 鸟类 birds 鸡 (Gallusgallus) 31 1014 79.5 88.5 爬行类reptiles 蜥蜴 (Anoliscarolinensis) 25 836 67.1 73.8 两栖类 amphibians 爪蟾 (Xenopustropicalis) 26 830 67.2 73.8
本试验中采用邻接法(N-J法)结合自举法(1 000次重复)对8个物种的Opa1氨基酸序列进行多重比较,构建系统进化树。进化树结果显示,青鳉与罗非鱼聚为一支(图2),说明二者有较近的亲缘关系。
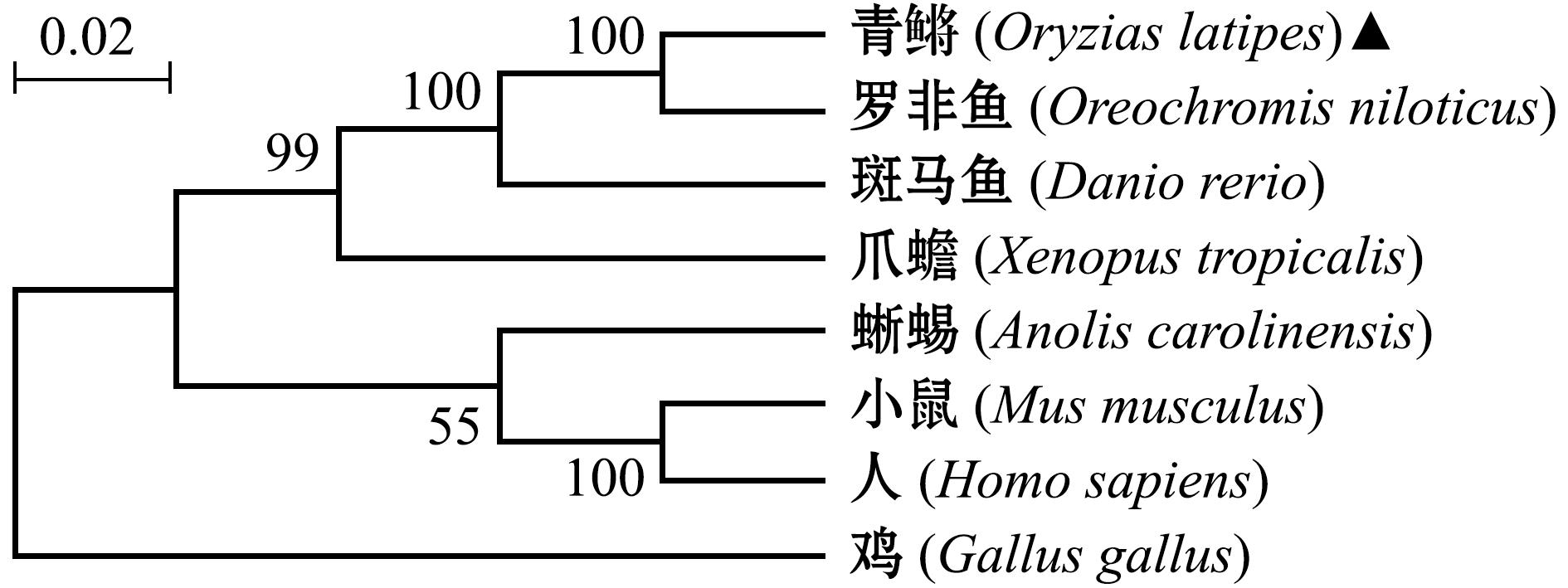
图2 Opa1蛋白系统发育树
Fig.2 Phylogenetic tree of multiple metazoan Opa1 proteins constructed by Neighbor-Joining
2.2 青鳉Opa1蛋白理化性质及结构分析
青鳉Opa1蛋白的氨基酸序列长度为1 034个氨基酸,通过ExPASy proparam tool对Opa1氨基酸序列的分析结果显示,其分子量为118 907.72,理论等电点为8.57,化学分子式为C5 262H8 432N1498O1 579S30。序列主要以亮氨酸(Leu)为主,占比为10.5%,半胱氨酸(Cys)占比最低只有0.8%,且含有149个带负电荷的残基和156个带正电荷的残基。该蛋白的不稳定性指数为38.72(指数大于40为不稳定蛋白),表明Opa1蛋白具有较高的稳定性。进一步利用ExPASy ProtScale tool对Opa1蛋白进行分析(图3(a)),发现Opa1蛋白第236位的甘氨酸(Gly)疏水性最强,而第283位的丝氨酸(Ser)亲水性最强,这些结果表明,该Opa1蛋白是一种亲水性蛋白。
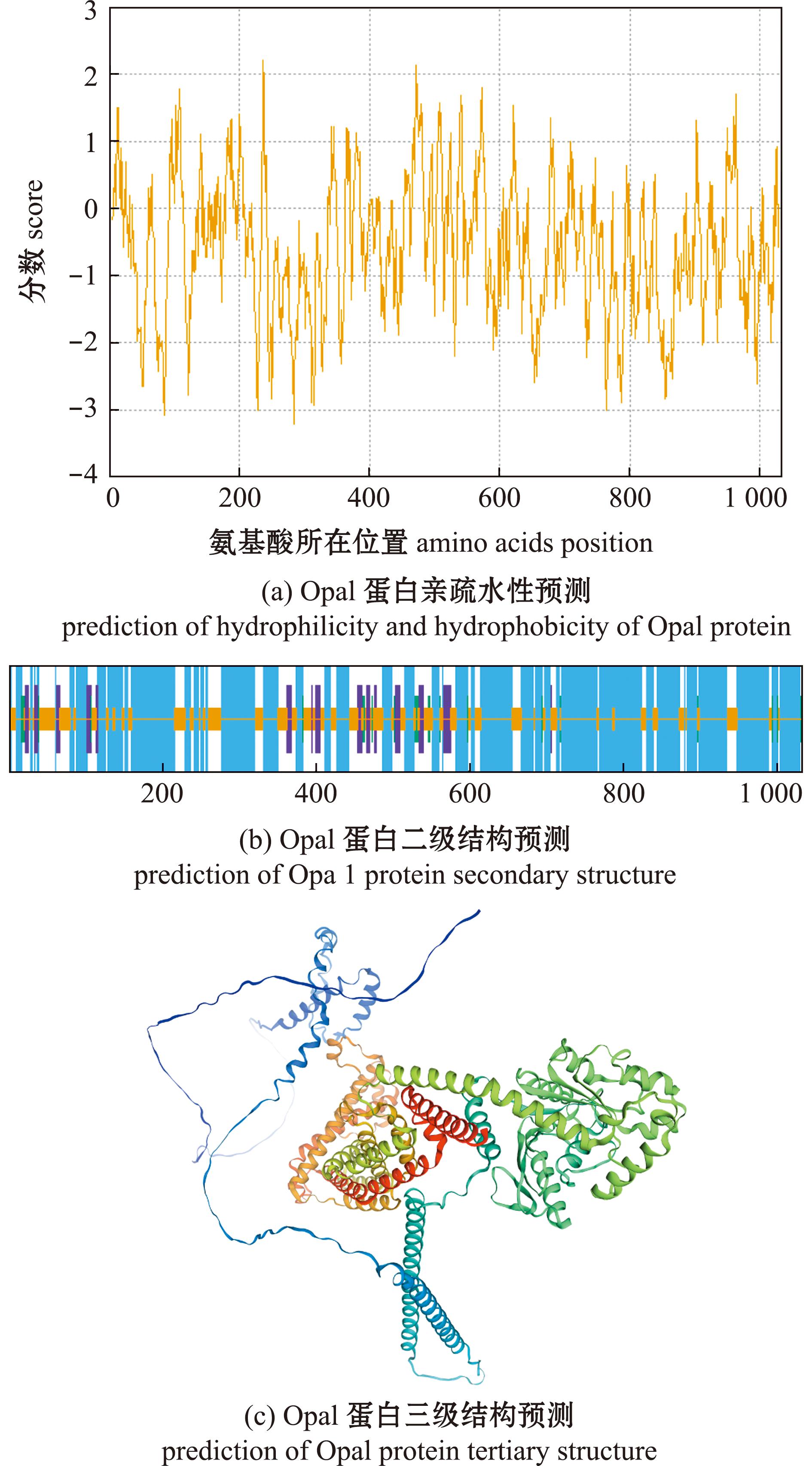
图(a)中Score>0疏水,Score>1.5高度疏水,Score<0亲水;图(b)中蓝线代表α-螺旋,绿线代表β-折叠,黄线代表无规则卷曲,紫线代表延伸链。
In Fig (a),score>0 hydrophobic,score>1.5 highly hydrophobic,score<0 hydrophilic;In Fig (b),the blue line represents α-helix,green line represents β- turn,yellow line represents random coil,and purple line represents extended strand.
图3 Opa1蛋白亲疏水性和二、三级结构预测
Fig.3 Hydrophilic and hydrophobic nature and secondary and tertiary structure prediction of Opa1 protein
采用SOPMA对Opa1蛋白二级结构进行预测,结果如图3(b)所示,该序列以无规则卷曲和α螺旋为主,各自占到整个二级结构的28.72%和62.28%。运用SWISS-MODEL对Opa1蛋白三级结构进行预测,全局模型质量评估(GMQE)值越接近1,表明该模型可信度较高,同时序列相似性(Seq-Similarity)数值大于0.5,证实该模型具有正确且可靠的结构拓扑。Coverage代表两者之间的覆盖率(分值范围为0~1),模型的分数越接近1,表示覆盖率越高,结果越可信。Opa1蛋白三级结构模型如图3(c)所示,该模型的GMQE为0.71,Seq-Similarity为0.59,Coverage为1.00。这3个数值支持预测的Opa1蛋白三级结构模型具有一定的可信度。
2.3 青鳉性腺opa1 mRNA的表达受到gsdf信号调控
对gsdf+/+和gsdf-/-青鳉卵巢转录组数据绘制火山图,如图4(a)所示,筛选条件为差异倍数|FoldChange|>1且P<0.05,其中有1 143个基因上调(图中红色圆点),有516个基因下调(图中绿色圆点)。结果显示,青鳉opa1在gsdf+/+和gsdf-/-卵巢中无明显差异。对gsdf+/+和gsdf-/-青鳉精巢转录组数据绘制火山图,如图4(b)所示,在相同的筛选条件下,其中有2 664个基因上调(图中红色圆点),有1 991个基因下调(图中绿色圆点)。结果显示,青鳉opa1在gsdf+/+和gsdf-/-精巢中存在明显差异,并且属于上调基因。
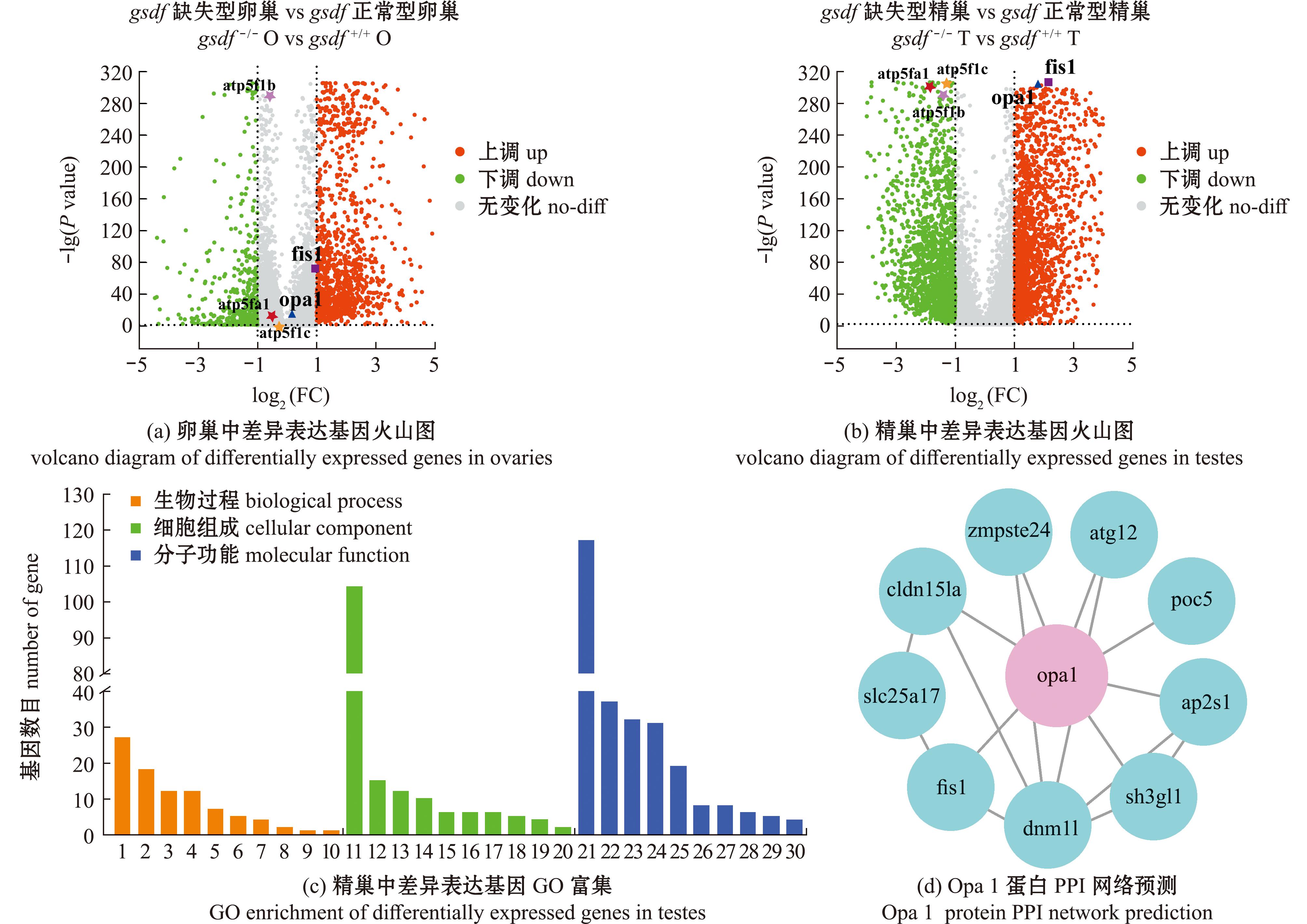
图(a)、(b)中红色圆点表示显著上调的基因,绿色圆点表示显著下调的基因,灰色圆点表示无显著差异的基因;图(c)中各数字代表富集到不同的通路。1—纤毛装配;2—DNA修复;3—凋亡过程;4—rRNA加工;5—减数分裂细胞周期;6—蛋白内酰化;7—核质转运;8—线粒体自噬;9—参与凋亡过程的线粒体破碎;10—过氧物酶体分裂;11—细胞质;12—核仁;13—纤毛;14—微管;15—运动纤毛;16—线粒体内膜;17—纤毛基质;18—轴丝;19—纤毛膜;20—纤毛内运输颗粒A;21—ATP结合;22—GTP结合;23—GTP酶活性;24—ATP水解活性;25—微管结合;26—细胞外基质结构成分;27—肽基脯氨酰顺反异构酶活性;28—DNA定向5′-3′RNA聚合酶活性;29—RNA甲基转移酶活性;30—错配DNA结合。
Red dots indicate significantly up-regulated genes,green dots indicate significantly down-regulated genes,gray dots indicate genes with no significant difference in Fig (a) and Fig (b);the numbers represent the enriched to different pathways in Fig (c). 1—cilium assembly;2—DNA repair;3—apoptotic processes;4—rRNA processing;5—meiotic cell cycle;6—protein neddylation;7—nucleocytoplasmic transport;8—autophagy of mitochondrion;9—mitochondrial fragmentation involved in the apoptotic process;10—peroxisome division;11—cytoplasm;12—nucleolus;13—cilium;14—microtube;15—motile cilium;16—mitochondrial inner membrane;17—ciliary basal body;18—axoneme;19—ciliary membrane;20—intraciliary transport particle A;21—ATP binding;22—GTP binding;23—GTPase activity;24—ATP hydrolysis activity;25—microtubule binding;26—extracellular matrix structural constituent;27—peptidyl-prolylcis-trans isomerase activity;28—DNA-directed 5′-3′ RNA polymerase activity;29—RNA methyltransferase activity;30—mismatched DNA binding.
图4 gsdf+/+和gsdf-/-青鳉性腺差异基因火山图和GO富集及Opa1蛋白网络互作群
Fig.4 Volcano plots and GO enrichment of gsdf+/+ and gsdf-/- medaka gonad differential genes and the Opa1 protein network interaction groups
对gsdf-/-青鳉精巢差异表达基因进行GO富集发现(图4(c)),opa1富集在凋亡过程、GTP结合、GTP酶(GTPase)活性,微管结合、定位到微管和线粒体内膜。这与前面所展示的青鳉opa1功能结构域相吻合。
通过string网站来预测Opa1蛋白与其他蛋白之间的相互作用(图4(d)),结果表明,Opa1蛋白与参与线粒体外膜分裂的Fis1蛋白[18]、参与中心粒组装和延长的Poc5(proteome of centriole 5)蛋白[19]、参与调节细胞衰老和细胞核膜稳定性的Zmpste24(zinc metallopeptidase,STE24 homolog)蛋白[20]、参与细胞自噬的Atg12(ubiquitin-like protein ATG12 isoform 2)蛋白[21]、参与转运细胞内膜蛋白的Ap2s1(adaptor-related protein complex 2,sigma 1 subunit)蛋白[22]、参与细胞间紧密连接形成的Cldn15la(claudin-15)蛋白[23]、参与膜运输和细胞信号传导的Sh3gl1(recombinant human endophilin-A2)蛋白[24]相互作用。
2.4 gsdf信号抑制精巢中opa1 mRNA的表达
与线粒体分裂融合相关的基因,在gsdf-/-精巢转录组数据中有明显差异变化的基因有:opa1,fis1(mitochondrial fission 1 protein),mff(mitochondrial fission factor),drp1/dnm1l(dynamin 1-like),并且这4个基因的表达都显著上调(图5(a))。半定量RT-qPCR结果也验证了此结果(图5(b)),其中opa1是线粒体内膜融合的关键基因,与线粒体嵴的变化息息相关,而其余3个基因是线粒体外膜分裂的关键调控基因。然而,这4个基因在gsdf-/-卵巢中的表达均无显著性差异(图5(c)、(d))。这些结果均表明,opa1表达的线粒体动态变化,可能在雄性生殖细胞的发育过程中起着重要作用,并且其表达可能受到gsdf信号的抑制。
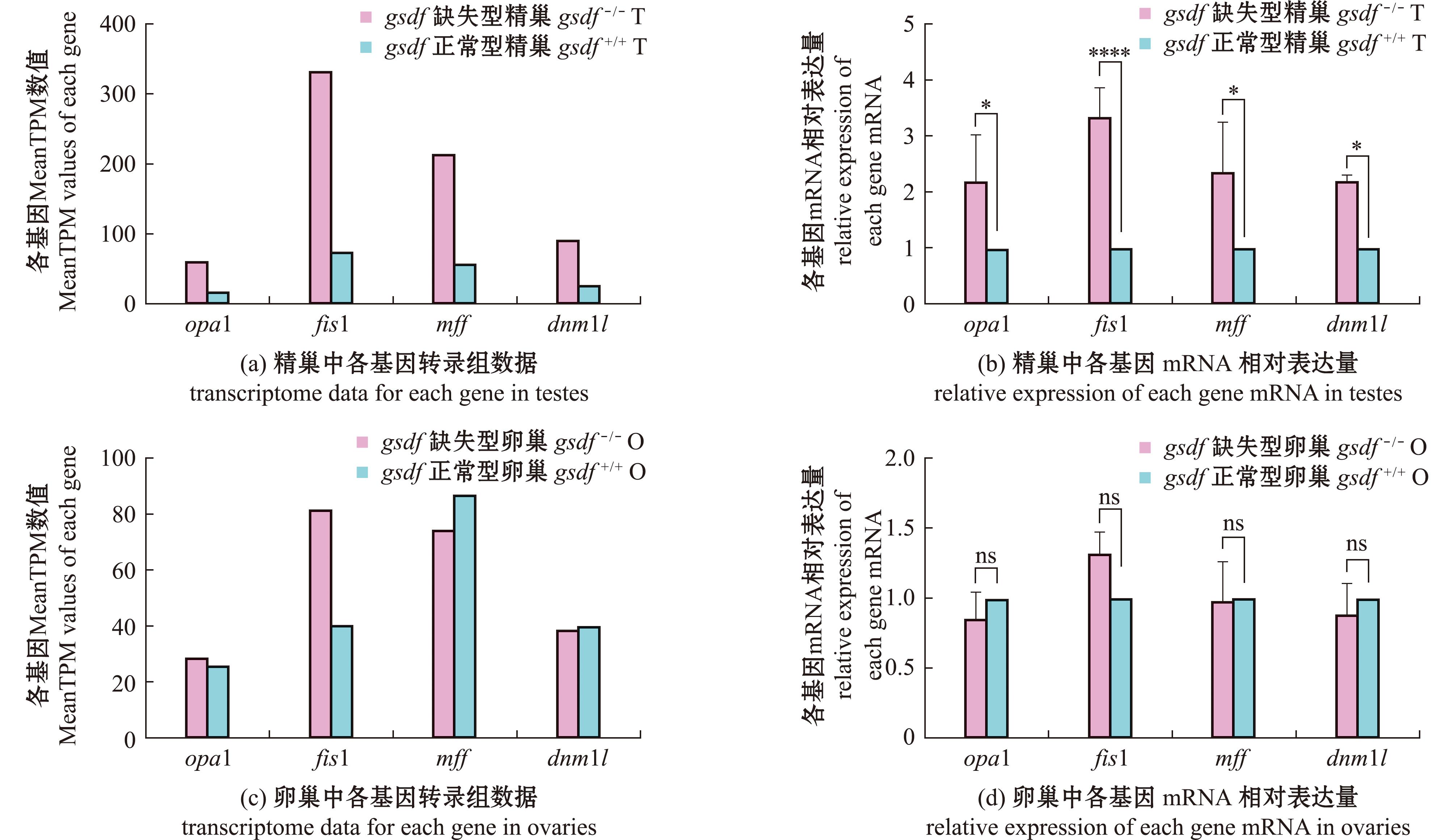
*表示P<0.05;****表示P<0.000 1,下同。 *means P<0.05;****means P<0.000 1,et sequentia.
图5 转录组中线粒体分裂融合相关基因的表达情况及qPCR验证
Fig.5 Expression of genes involved to mitochondrial fission fusion in transcriptome and qPCR validation
2.5 gsdf缺失导致精巢中opa1两种亚型比例失衡
针对从Ensembl和美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中下载的10种青鳉opa1转录本设计引物,如图6(a)所示,并进行RT-qPCR,检测opa1长亚型(L-opa1)和opa1(包含L-opa1和S-opa1两种亚型) mRNA在gsdf+/+及gsdf-/-青鳉性腺中的表达,如图6(b)所示。结果显示,在gsdf-/-青鳉精巢中,opa1 mRNA的表达显著升高,而L-opa1 mRNA表达却显著降低。最终表现为L-opa1占比显著降低,S-opa1占比显著升高。卵巢中opa1和L-opa1 mRNA的表达量比在精巢中低很多,且其表达无关gsdf信号而呈现明显变化。
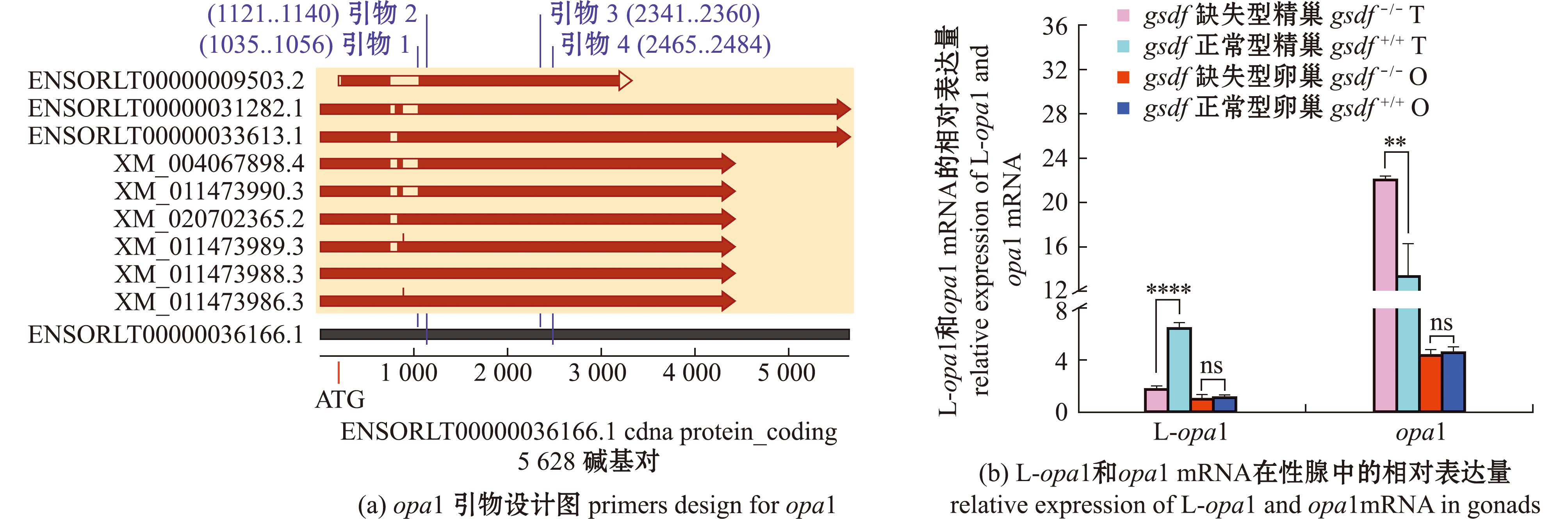
(a)中引物1和2是L-opa1的上下游引物,引物3和4是opa1的上下游引物;不同的序号代表青鳉opa1不同转录本在Ensembl和NCBI数据库中的登录号。
(a),primers 1 and 2 are upstream and downstream primers of L-opa1,and primers 3 and 4 are upstream and downstream primers of opa1;The different serial numbers represent the accession numbers of the different transcripts of medaka opa1 in the Ensembl and NCBI databases.
图6 引物位点设计图及L-opa1和opa1 mRNA在gsdf+/+及gsdf-/-青鳉性腺中的表达
Fig.6 Design of the primer sites and the expression of L-opa1 and opa1 mRNA in gsdf+/+ and gsdf-/- medaka gonads
2.6 青鳉opa1 mRNA在正常型青鳉性腺及其他组织中的表达
青鳉opa1在正常型青鳉性腺及其他组织中的表达情况,如图7所示,opa1 mRNA在正常型青鳉各组织中普遍表达,并且精巢opa1 mRNA的表达量显著高于其他组织(图7(a)),而在卵巢中的表达量与其他组织中的表达量并无显著性差异(图7(b))。
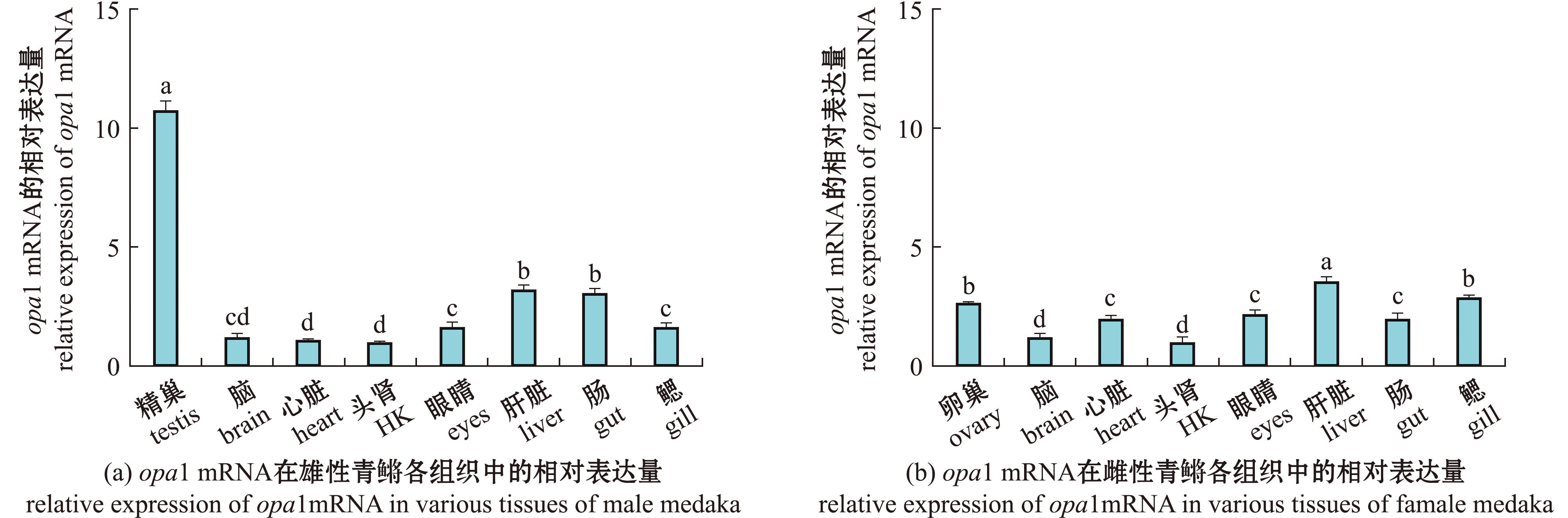
图中标有不同字母者表示有显著性差异(P<0.05)。 The mean with different letters indicates significant difference(P<0.05).
图7 opa1 mRNA在正常型青鳉性腺和其他组织中的表达情况
Fig.7 Expression of the opa1 mRNA in wild-type medaka gonads and other tissues
3 讨论
本研究从gsdf+/+和gsdf-/-雌雄青鳉性腺转录组数据比较分析中发现青鳉opa1 mRNA在雌雄性腺中的两态性差异表达,以及opa1两种亚型在XX和XY青鳉性腺中应答gsdf信号的差异性。首次提出在青鳉雄性生殖细胞增殖与分化过程中,gsdf信号可能通过调控XY型线粒体中opa1两种亚型的表达,产生肿胀且管状嵴严重受损的线粒体,并导致ATP生成受阻,进而影响配子健康发育和成熟,为进一步理解脊椎动物性别调控机制提供了新线索。
3.1 青鳉opa1 mRNA在雌雄性腺中的两态性差异表达
gsdf+/+和gsdf-/-青鳉性腺转录组数据的火山图结果表明,青鳉opa1 mRNA的表达在XY精巢中受到gsdf信号的抑制,在XX卵巢中,无论有无gsdf信号,opa1 mRNA的表达均不受影响。RT-qPCR结果与转录组数据一致,这进一步说明青鳉gsdf信号可能仅在雄性精巢发育过程中调控opa1表达,很可能是雄性特异的,即青鳉在XY精巢中opa1 mRNA的表达受gsdf信号调控,在XX卵巢中,受gsdf信号微弱影响或非gsdf调控影响。提示青鳉opa1表达的线粒体,对gsdf信号的敏感性,可能存在XX型和XY型两种不同类型。图4显示编码ATP合酶F1部分α,β,γ 3个亚基的atp5fa1(ATP synthase F1 subunit alpha),atp5f1b(ATP synthase F1 subunit beta),atp5f1c(ATP synthase F1 subunit gamma)[25],在gsdf-/-精巢中表达下降,这可能是线粒体内膜上OXPHOS受损的表现。
opa1 mRNA在gsdf+/+雌雄青鳉不同空间的表达结果说明,opa1 mRNA在gsdf+/+青鳉XY精巢中的高表达同精子发生过程中高能量需求[1]一致,进一步说明线粒体能量代谢的正常运转对雄性生殖细胞增殖和分化至关重要。
3.2 opa1两种亚型在XX和XY青鳉性腺中应答gsdf信号的差异性
L-OPA1主要参与线粒体嵴的形成和维持,其通过促进内膜的融合,维持嵴的紧密排列和完整性。S-OPA1则主要参与线粒体的分裂和嵴的重塑。在应激条件下,S-OPA1的增加会导致线粒体嵴的松散和断裂,从而影响线粒体的功能[26]。L-OPA1和S-OPA1的动态平衡对保护线粒体嵴的形态和功能至关重要,若L-OPA1或S-OPA1异常积累将会导致线粒体嵴结构被破坏,进而影响ATP的生成和细胞的能量代谢[27]。L-opa1(opa1长亚型)和opa1(包含L-opa1和S-opa1) mRNA在gsdf+/+及gsdf-/-青鳉性腺中的表达结果说明,opa1 mRNA在gsdf-/- XY精巢中的高表达是L-opa1低表达和S-opa1高表达的结果。有趣的是,在XX卵巢中,无论有无gsdf信号,L-opa1和opa1 mRNA的表达均无明显变化。L-opa1低表达和S-opa1高表达使得线粒体管状嵴结构数量减少、变宽[28]。这些结果说明,gsdf缺失导致XY精巢中opa1两种亚型比例失衡可能是gsdf-/-青鳉精原细胞线粒体肿胀,管状嵴结构严重受损[14]的原因之一。线粒体内膜严重受损,导致ATP能量代谢异常,无法提供生殖细胞健康增殖和分化所需的能量,最终表现为精母细胞发育不同步和囊性增殖,以及一系列的配子发育受阻和凋亡[17]。
3.3 青鳉fis1同opa1一起参与到gsdf信号调控通路中的可能性分析
通过string网站预测Opa1蛋白网络互作群,显示Opa1蛋白与参与线粒体外膜分裂的Fis1蛋白等7个蛋白形成蛋白互作网络。Fis1是线粒体外膜分裂的关键调控因子,在小鼠中表达异常可影响精子发生和线粒体功能[29],提示gsdf缺失后fis1 mRNA表达异常升高可能导致线粒体肿胀、裂变和融合等动态变化。Zmpste24蛋白是促进核纤层蛋白水解的一种金属蛋白酶,Zmpste24酶活性丧失导致核纤层蛋白从核膜上切割失败,保留在细胞核的周边,这使得细胞核僵硬、变形[30],提示gsdf缺失后zmpste24 mRNA表达异常升高可能是精巢中粗线期精母细胞核膜呈现破裂凹陷状态[31]的原因之一。Cldn15是细胞间紧密连接形成的关键蛋白,缺失会促进细胞增殖[23],这与gsdf缺失后生殖细胞异常增殖[17]一致。结果表明,fis1可能与opa1一起参与到gsdf信号调控青鳉雄性生殖细胞增殖与分化的通路中。
4 结论
1)青鳉opa1 mRNA的表达受gsdf信号调控是存在性别差异的,且opa1 mRNA在gsdf-/-精巢中的高表达,同gsdf缺失后雄性生殖细胞线粒体嵴结构的异常密切相关。
2)gsdf信号可能增加XY生殖细胞的长亚型(L-opa1)表达或维持长亚型(L-opa1)mRNA的稳定,进而维持生殖细胞线粒体嵴的正常结构。
3)青鳉fis1可能同opa1一起参与到gsdf信号调控青鳉雄性生殖细胞增殖与分化的通路中。
[1] ZHANG Z R,MIAO J R,WANG Y.Mitochondrial regulation in spermatogenesis[J].Reproduction,2022,163(4):R55-R69.
[2] ARHIN S K,LU J Q,XI H T,et al.Energy requirements in mammalian oogenesis[J].Cellular and Molecular Biology,2018,64(10):12-19.
[3] VARUZHANYAN G,CHAN D C.Mitochondrial dynamics during spermatogenesis[J].Journal of Cell Science,2020,133(14):jcs235937.
[4] WESTERMANN B.Mitochondrial fusion and fission in cell life and death[J].Nature Reviews Molecular Cell Biology,2010,11(12):872-884.
[5] YOULE R J,VAN DER BLIEK A M.Mitochondrial fission,fusion,and stress[J].Science,2012,337(6098):1062-1065.
[6] ALEXANDER C,VOTRUBA M,PESCH U E,et al.OPA1,encoding a dynamin-related GTPase,is mutated in autosomal dominant optic atrophy linked to chromosome 3q28[J].Nature Genetics,2000,26(2):211-215.
[7] OLICHON A,ELACHOURI G,BARICAULT L,et al.OPA1 alternate splicing uncouples an evolutionary conserved function in mitochondrial fusion from a vertebrate restricted function in apoptosis[J].Cell Death and Differentiation,2007,14(4):682-692.
[8] DELETTRE C,GRIFFOIN J M,KAPLAN J,et al.Mutation spectrum and splicing variants in the OPA1 gene[J].Human Genetics,2001,109(6):584-591.
[9] OLICHON A,EMORINE L J,DESCOINS E,et al.The human dynamin-related protein OPA1 is anchored to the mitochondrial inner membrane facing the inter-membrane space[J].FEBS Letters,2002,523(1/2/3):171-176.
[10] SONG Z Y,CHEN H,FIKET M,et al.OPA1 processing controls mitochondrial fusion and is regulated by mRNA splicing,membrane potential,and Yme1L[J].The Journal of Cell Biology,2007,178(5):749-755.
[11] SOOD A,JEYARAJU D V,PRUDENT J,et al.A Mitofusin-2-dependent inactivating cleavage of Opa1 links changes in mitochondria cristae and ER contacts in the postprandial liver[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(45):16017-16022.
[12] HALES K G,FULLER M T.Developmentally regulated mitochondrial fusion mediated by a conserved,novel,predicted GTPase[J].Cell,1997,90(1):121-129.
[13] DEMARCO R S,UYEMURA B S,D’ALTERIO C,et al.Mitochondrial fusion regulates lipid homeostasis and stem cell maintenance in the Drosophila testis[J].Nature Cell Biology,2019,21(6):710-720.
[14] ZHANG X T,CHANG Y Y,ZHAI W Y,et al.A potential role for the gsdf-eEF1α complex in inhibiting germ cell proliferation:a protein-interaction analysis in medaka (Oryzias latipes) from a proteomics perspective[J].Molecular &Cellular Proteomics,2021,20:100023.
[15] HAN T C,ZHAO Y H,JIAO A H,et al.OPA1 deficiency induces mitophagy through PINK1/Parkin pathway during bovine oocytes maturation[J].Theriogenology,2025,234:51-63.
[16] 郭安宁,关桂君,王映,等.斑马鱼Tg(Crystal-pro-gsdf-2A-egfp)质粒的构建及验证[J].大连海洋大学学报,2018,33(6):683-689.
GUO A N,GUAN G J,WANG Y,et al.Construction and validation of tg(crystal-pro-gsdf-2A-egfp) plasmid in zebrafish[J].Journal of Dalian Fishery University,2018,33(6):683-689.(in Chinese)
[17] ZHANG X,GUAN G J,LI M Y,et al.Autosomal gsdf acts as a male sex initiator in the fish medaka[J].Scientific Reports,2016,6:19738.
[18] YOON Y,KRUEGER E W,OSWALD B J,et al.The mitochondrial protein hFis1 regulates mitochondrial fission in mammalian cells through an interaction with the dynamin-like protein DLP1[J].Molecular and Cellular Biology,2003,23(15):5409-5420.
[19] AZIMZADEH J,HERGERT P,DELOUV E A,et al.hPOC5 is a centrin-binding protein required for assembly of full-length centrioles[J].The Journal of Cell Biology,2009,185(1):101-114.
E A,et al.hPOC5 is a centrin-binding protein required for assembly of full-length centrioles[J].The Journal of Cell Biology,2009,185(1):101-114.
[20] OSORIO F G,VARELA I,LARA E,et al.Nuclear envelope alterations generate an aging-like epigenetic pattern in mice deficient in Zmpste24 metalloprotease[J].Aging Cell,2010,9(6):947-957.
[21] WALCZAK M,MARTENS S.Dissecting the role of the Atg12-Atg5-Atg16 complex during autophagosome formation[J].Autophagy,2013,9(3):424-425.
[22] GORVIN C M,ROGERS A,HASTOY B,et al.AP2σ mutations impair calcium-sensing receptor trafficking and signaling,and show an endosomal pathway to spatially direct G-protein selectivity[J].Cell Reports,2018,22(4):1054-1066.
[23] TAMURA A,KITANO Y,HATA M,et al.Megaintestine in claudin-15-deficient mice[J].Gastroenterology,2008,134(2):523-534.e3.
[24] MALINOVA D,WASIM L,NEWMAN R,et al.Endophilin A2 regulates B-cell endocytosis and is required for germinal center and humoral responses[J].EMBO Reports,2021,22(9):e51328.
[25] WALKER J E.The ATP synthase:the understood,the uncertain and the unknown[J].Biochemical Society Transactions,2013,41(1):1-16.
[26] ISHIHARA N,FUJITA Y,OKA T,et al.Regulation of mitochondrial morphology through proteolytic cleavage of OPA1[J].EMBO Journal,2006,25(13):2966-2977.
[27] PATTEN D A,WONG J,KHACHO M,et al.OPA1-dependent cristae modulation is essential for cellular adaptation to metabolic demand[J].EMBO Journal,2014,33(22):2676-2691.
[28] PERNAS L,SCORRANO L.Mito-morphosis:mitochondrial fusion,fission,and cristae remodeling as key mediators of cellular function[J].Annual Review of Physiology,2016,78:505-531.
[29] VARUZHANYAN G,LADINSKY M S,YAMASHITA S I,et al.Fis1 ablation in the male germline disrupts mitochondrial morphology and mitophagy,and arrests spermatid maturation[J].Development,2021,148(16):dev199686.
[30] TONOYAMA Y,SHINYA M,TOYODA A,et al.Abnormal nuclear morphology is independent of longevity in a zmpste24-deficient fish model of Hutchinson-Gilford progeria syndrome (HGPS)[J].Comparative Biochemistry and Physiology Toxicology &Pharmacology,2018,209:54-62.
[31] 李雅园,王光幸,李新闻,等.青鳉nup58的表达及其在性别分化中的潜在作用[J].广西师范大学学报(自然科学版),2024,42(1):168-179.
LI Y Y,WANG G X,LI X W,et al.Expression of nup58 in medaka and its potential role in sex differentiation[J].Journal of Guangxi Normal University (Natural Science Edition),2024,42(1):168-179.(in Chinese)