性类固醇激素是影响鱼类性腺分化、发育和功能的最重要因素之一[1],其中,17β-雌二醇(E2)和睾酮(T)是最为关键的两种性类固醇激素。两者都是由胆固醇经一系列反应合成而来[2],催化这些合成反应的酶主要分属于细胞色素P450家族和羟基类固醇脱氢酶(HSD)家族[3]。17β-羟基类固醇脱氢酶(Hsd17b)属于HSD家族,位于类固醇合成途径的下游位置,参与性类固醇激素合成。hsd17b基因在哺乳动物基因组中一般有15种亚型[4],表达于不同组织,如睾丸、卵巢、肝脏和肾脏等[5],其中1-3型与性别发育相关的研究较多[6]。除hsd17b5外,都能催化雌酮(E1)和雌二醇及雄烯二酮和睾酮之间的氧化还原反应[7-8]。人类中HSD17B3基因的遗传突变会损害人类雄性性腺发育[9]。而HSD17B12作为HSD17B3的同工酶,具有将E1转化为E2的作用,在卵巢和乳腺中有高表达[10]。
目前,鱼类中发现的hsd17b基因数目低于哺乳类,只有9种,包括hsd17b1、hsd17b2、hsd17b3、hsd17b4、hsd17b7、hsd17b8、hsd17b10、hsd17b12和hsd17b14[11]。与哺乳动物不同,鱼类的hsd17b12基因普遍存在两个拷贝hsd17b12a和hsd17b12b。研究表明,hsd17b12a在许多鱼类的性腺中特异表达,可能参与性别相关的发育过程。如在牙鲆(Paralichthys olivaceus)中,hsd17b12a基因在性腺中高表达[12],在大马哈鱼(Oncorhynchus masou)中,该基因在卵母细胞成熟过程中的激素合成中发挥重要作用[13],在胡子鲶(Clarias batrachus)中,hsd17b12a通过调整类固醇水平来调节性腺发育和配子发生[14]。但该基因在大鳞副泥鳅中与性别发育的相关性并无研究。
大鳞副泥鳅(Paramisgurnus dabryanus)是一种淡水杂食性鱼类,是中国的重要经济养殖品种之一,近年来市场需求逐渐增加[15-16]。该物种生长具有性别二态性,相同日龄的雌鱼体质量通常大于雄性。其性别决定方式为雌性异配的ZZ-ZW类型[17],同时还受温度的影响[18],在温度升高时,雄性占比就会显著升高[19-20]。这些性别决定的特征使得大鳞副泥鳅性别分化发育研究广受关注。目前,关于大鳞副泥鳅性别相关研究主要集中在cyp19a[21]、sox家族[22-24]和dmrt1[23]等经典的性别决定基因研究中,hsd17b12a与大鳞副泥鳅性腺发育是否有关联尚无报道。本实验室前期转录组学研究中发现,hsd17b12a基因在大鳞副泥鳅的雌雄性腺中存在显著的差异表达[25],暗示着该基因在大鳞副泥鳅的性别决定中可能发挥着重要作用。因此,本试验中以大鳞副泥鳅为试验对象,基于其参考基因组[20]所注释的hsd17b12a基因全长CDS和蛋白质序列,进行了蛋白质预测与进化分析;并采用实时荧光定量PCR技术(qRT-PCR)测定了大鳞副泥鳅胚胎、不同发育时期的性腺,以及成鱼不同组织中hsd17b12a的表达模式,以期为该基因在大鳞副泥鳅生长发育与性腺分化中的重要作用提供科学参考。
1 材料与方法
1.1 材料
试验用鱼均为购自湖北武汉白沙洲的成年野生大鳞副泥鳅,雌鱼体质量为(34.5±2.8)g,体长为(15.30±0.88)cm;雄鱼体质量为(29.6±1.2)g,体长为(12.50±1.08) g,于实验室暂养(水温25 ℃±1 ℃)两周后,随机选取雌雄鱼各10尾,采用2 mg/kg地欧酮(DOM)和4 μg/kg促黄体素释放激素类似物(LHRH-A2)催产,次日进行人工授精,先将精子与Hanks缓冲液1∶1(体积比)进行混合,挤出卵子并受精后,将受精卵置于室温28 ℃的环境条件下孵化,出膜后10 d,将幼鱼放于循环水系统中养殖。
1.2 方法
1.2.1 样本采集 为了调查hsd17b12a基因在发育过程中的表达动态,本试验在多个时间点进行了取样。具体而言,在大鳞副泥鳅胚胎发育的桑葚胚期(1 hpf)、囊胚期(4 hpf)、原肠期(8 hpf)、神经胚期(9 hpf)、肌节出现期(14 hpf)、尾芽期(15 hpf)和出膜前期(30 hpf)7个时期取3组样,每组30个胚胎,作为大鳞副泥鳅不同胚胎发育时期的样本。随机取3组32 hpf幼鱼,每组放置5尾;取出膜后14 d(14 dph)幼鱼6组,每组放置5尾;取25 dph幼鱼20尾,选取可观察到初始卵巢腔的雌鱼和未观察到明显初始性腺的未分化性腺鱼各3组,每组各1尾;随机选择30、45、75 dph个体各3尾,取其性腺组织所在区域作为不同发育阶段性腺的样本,并取一部分进行HE染色切片。此外,取雌雄成年个体(> 1 year)各3尾经200 mg/L的MS-222麻醉后,迅速获取其8个组织,包括大脑、鳃、心脏、肌肉、肝脏、肠道、脾脏和性腺,作为成鱼不同组织样本。所有组织均用PBS冲洗干净后,使用TRIzol研磨浸泡,置于-80 ℃冰箱中保存。
1.2.2 总RNA提取和反转录 按照TRIzol Reagent说明书提取收集所取样本的总RNA,利用核酸定量仪(Nanodrop 2000)检测RNA浓度和质量,制作10 g/L的琼脂糖凝胶电泳检测各组织总RNA的完整性。参照HiScript Ill All-in-one RT SuperMix Perfect for qPCR试剂盒(诺唯赞,中国)说明书进行反转录,合成cDNA模板,于-80 ℃冰箱中保存,用于后续分析。
1.2.3 hsd17b12a基因序列分析 通过大鳞副泥鳅基因组注释的hsd17b12a基因全长CDS及氨基酸序列,使用Expasy Protparam(https://web.expasy.org/protparam/)分析编码的蛋白质理化性质;WoLF PSORT(https://www.genscript.com/wolf-psort.html)预测亚细胞定位;SMART(http://smart.embl-heidelberg.de/)与NCBI CD-Search(https://www.ncbi.nlm.nih.gov/cdd/?term=)预测该蛋白的结构域;PRABI(https://npsa-prabi.ibcp.fr/)预测蛋白质二级结构;SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白质三级结构;通过BLAST(https://blast.ncbi.nlm.nih.gov/)进行同源性分析;使用并通过ClustalW(https://www.genome.jp/tools-bin/clustalw)对13个物种的hsd17b12a的氨基酸序列进行多重序列比对分析,包括哺乳类、硬骨鱼类、鸟类及两栖类,通过比较跨物种的保守性模式,揭示基因功能的进化关系;通过MEGA 11采用邻接法(Neighbor-Joining)构建系统进化树,bootstrap值为1 000。
1.2.4 实时荧光定量PCR检测基因表达 通过Primer Premier 5.0软件设计荧光定量特异性引物(表1)。使用ChamQ SYBR qPCR Master Mix (Vazyme,Nanjing,China),在CFX96TM Real-Time PCR Detection System(Bio-Rad,Hercules,CA,USA)上进行Real-time PCR,程序设置如下:95 ℃下预变性30 s;95 ℃下变性10 s,51 ℃下退火30 s,共进行40个循环。反应体系为20 μL,包括cDNA 2 μL,2 x ChamQ SYBR qPCR Master Mix 10 μL,上下游引物各0.4 μL,50 x ROX Reference Dye 1为0.4 μL,ddH2O 6.8 μL。以RNA 18S作为内参基因,采用2-ΔΔCt法计算相对表达量。
表1 实时荧光定量PCR引物序列
Tab.1 Primers used for qRT-PCR

基因 gene 引物名称 primername 引物序列 (5'-3') primersequences(5'-3') 片段大小/bp amplicon length RNA18S RNA18S_FTCGTGATCGGGACTGGGGATTGCA 126 RNA18S_RAATCGGTAGTAGCGACGGGCGGTGT hsd17b12a hsd17b12a_F TGATAAACCCACCCCTGA 198 hsd17b12a_R CGTAGCTTTCTCCTCCTG
1.3 数据处理
试验数据以平均值±标注差(mean±S.D.)表示,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),显著性差异设为0.05。
2 结果与分析
2.1 基因序列分析
大鳞副泥鳅的hsd17b12a基因全长CDS为949 bp,可编码319个氨基酸(aa),其蛋白分子式为C1 630H2 606N422O450S12,分子质量为35 700,理论等电点PI为9.50。含量最高的5种氨基酸分别为亮氨酸(Leu)、缬氨酸(Val)、苏氨酸(Thr)、异亮氨酸(Ile)和甘氨酸(Gly),在总氨基酸中的占比分别为11.6%、8.2%、7.8%、7.5%和7.2%。该蛋白的不稳定系数为34.99,属于稳定蛋白;其亲水性值(grand average of hydropathicity,GRAVY)为0.144。亚细胞定位的预测结果显示,该蛋白可能主要分布在线粒体(mito:10),也可能在细胞质(cyto:7)和细胞核(nucl:6)中动态分布(cyto_nucl:7.5)。SMART预测表明,该蛋白可能含有三段跨膜结构,分别位于氨基酸位置15~34、188~210和283~302(图1)。NCBI CD-Search预测结果显示,该基因的56~288位氨基酸序列与17β-羟类固醇脱氢酶样的短链脱氢酶/还原酶(17beta-HSD1_like_SDR_c)家族的结构域高度匹配(E-value=9.77×10-132)。该家族属于NADP(H)-Rossmann超家族,参与代谢过程,尤其是类固醇代谢过程中的脱氢和还原反应。二级结构预测表明,hsd17b12a基因编码的蛋白质包含45.45%的α-螺旋、19.12%的延伸链及35.42%的无规则卷曲。这些结构单元共同构成了蛋白质的三级结构(图2)。
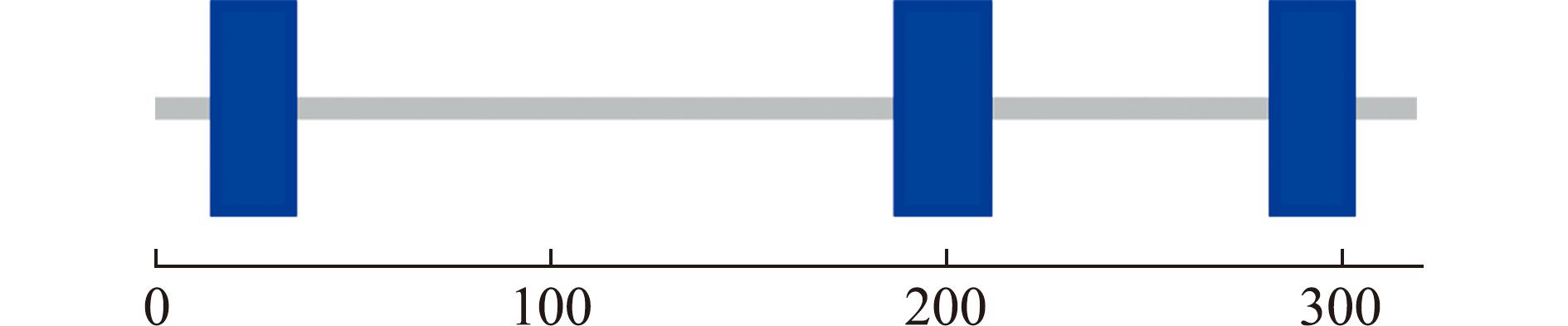
数字代表氨基酸位置;蓝色方框代表功能结构域(保守结构域);灰色线条代表整个蛋白的序列主链。
The numbers indicate amino acid positions;the blue boxes represent functional domains (conserved domains);and thegray line denotes the full-length backbone of the protein sequence.
图1 Hsd17b12a蛋白的预测结构域
Fig.1 Prediction of Hsd17b12a protein domain

蓝色螺旋为蛋白质的α-螺旋,代表该蛋白三级结构的空间结构;灰色点阵区域代表蛋白质的表面或潜在互作区域。
The blue helices represent α-helices of the protein,reflecting the spatial conformation of its tertiary structure.The gray dotted regions indicate the protein surface or potential interaction areas.
图2 Hsd17b12a蛋白的三级结构预测
Fig.2 Prediction of hsd17b12a protein tertiary structure
2.2 基因同源比对与系统进化树构建
在与其他12个物种的同源蛋白比较中,大鳞副泥鳅Hsd17b12a氨基酸序列与硬骨鱼类的相似性较高,都在78%以上,其中与鲤(Cyprinus carpio)和斑马鱼(Danio rerio)的相似性高达90.28%和89.03%(表 2)。与其他物种同源性都较低,为48.80%~60.40%。多序列比对分析结果显示,在60~294氨基酸为高保守区域(图3),且与NCBI CD-Search预测的功能区域(56~288位)相一致;其中蓝色区域的氨基酸残基有所变化,可能反映了进化的适应性或物种间的差异性。依据Hsd17b12a氨基酸序列构建的系统进化树(图4)显示,大鳞副泥鳅与鲤和斑马鱼的亲缘关系较近,而与人类、小鼠和野猪等哺乳动物亲缘关系较远。

红底白字体表示高度保守的氨基酸残基,蓝色方框中白底红字次之。
Amino acids with white letters on a red background are highly conserved,while those with red letters on a white background outlined by blue boxes are comparatively less conserved.
图3 大鳞副泥鳅hsd17b12a与其他脊椎动物的氨基酸序列比对
Fig.3 Amino acid sequences alignment of hsd17b12a between Paramisgurnus dabryanus and other vertebrates
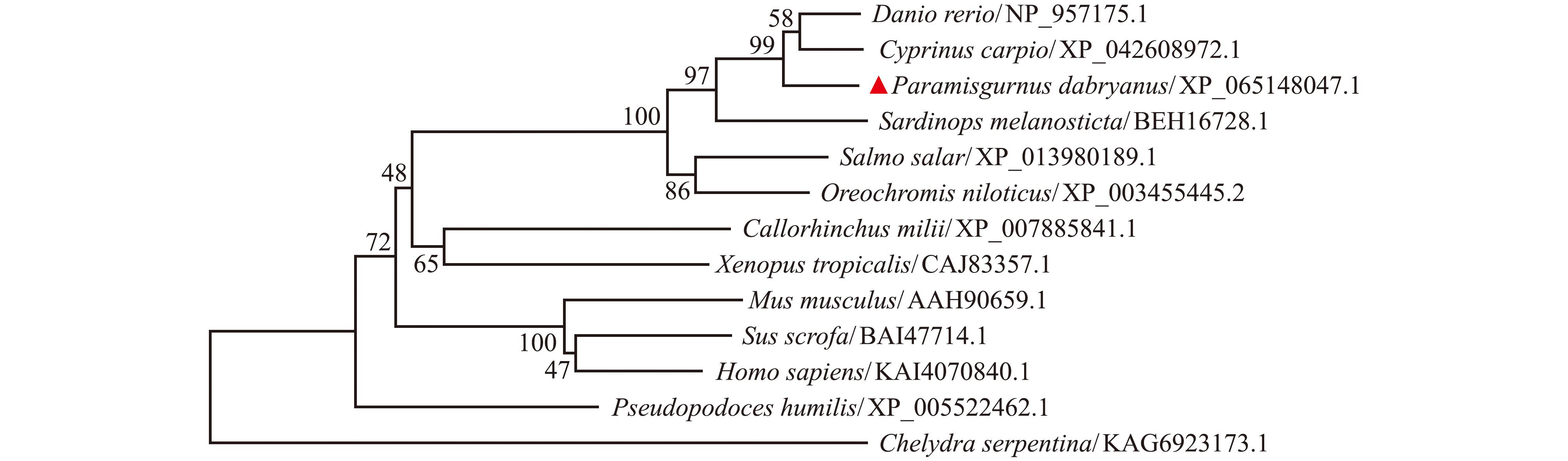
图4 不同脊椎动物hsd17b12a氨基酸序列的系统进化树
Fig.4 Phylogenetic tree of amino acid sequences of different vertebrate hsd17b12a
2.3 发育时期组织学观察与表达分析
2.3.1 性腺组织学观察 在14~75 d期间每天取大鳞副泥鳅性腺进行HE染色切片,观察发育情况以确定性腺的关键发育阶段(图5)。大鳞副泥鳅14 d时性腺尚未成熟,但鱼体体腔切片中已可观察到原始生殖细胞(图5(a)、(b));25 d时卵巢开始发育,切片可观察到卵巢腔(图5(c));30 d时精巢开始发育,可观察到输精管(图5(d));45 d时卵巢发育完成,可观察到卵原细胞(图5(e));75 d时精巢发育完成,可观察到精原细胞(图5(f))。
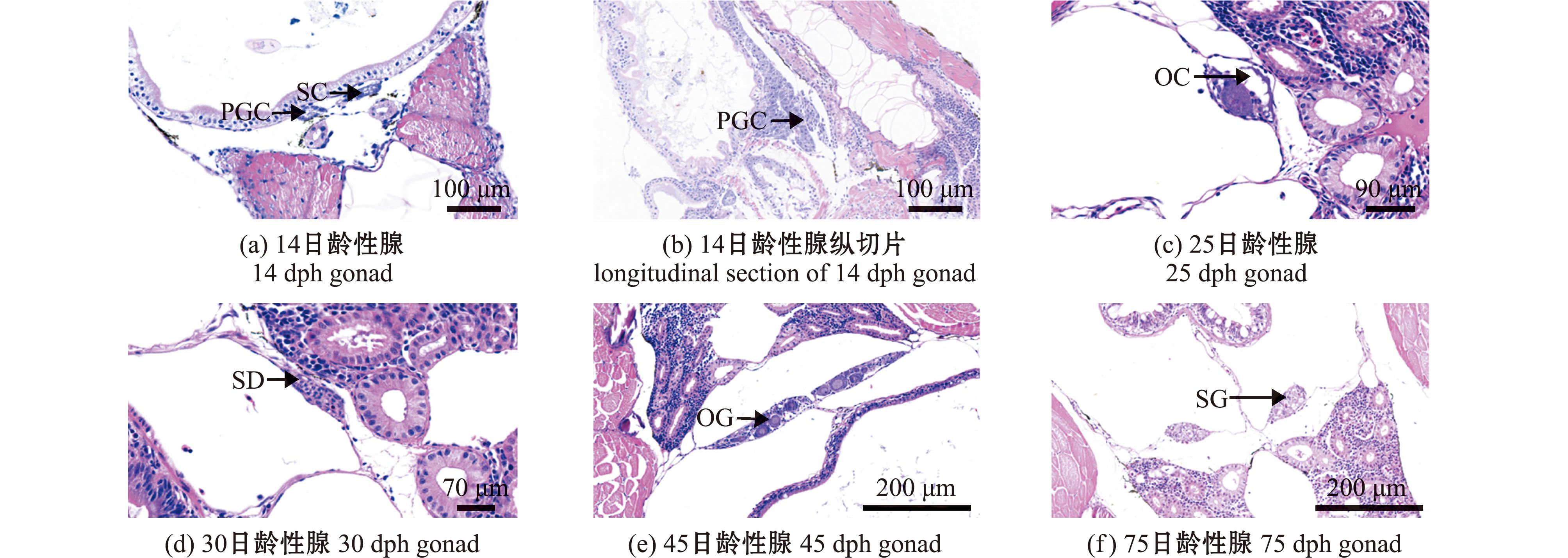
PGC—原始生殖细胞;SC—体细胞;OC—卵巢腔;SD—输精管;OG—卵原细胞;SG—精原细胞。
PGC—denotes primordial germ cells;SC—indicatessomatic cells;OC—represents the ovarian cavity;SD—refers to the sperm duct;OG—stands for oogonia;SG—signifies spermatogonia.
图5 大鳞副泥鳅不同发育时期性腺的组织学特征
Fig.5 Histological characteristics of gonads of Paramisgurnus dabryanus in different developmental stages.
2.3.2 hsd17b12a基因的表达 Hsd17b12a基因在大鳞副泥鳅胚胎发育的8个时期[桑葚胚期(1 hpf)、囊胚期(4 hpf)、原肠期(8 hpf)、神经胚期(9 hpf)、肌节出现期(14 hpf)、尾芽期(15 hpf)、出膜前期(30 hpf)和孵出期(32 hpf)]均有表达(图6),其中该基因在桑葚胚期的相对表达量显著高于除神经胚期外的其他6个时期(P<0.05)。其在成鱼的心、肝、脾、肌、肠、鳃、脑、性腺中均有表达,在性腺、脾和脑3个器官中呈现了明显的表达性别二态性,在卵巢中的表达量显著高于精巢,而在脾和脑中雄性表达量显著高于雌性表达量(P<0.05)(图7)。两性性腺的这种差异表达从大鳞副泥鳅出膜后25 d开始出现,在出膜后30 d差异达到顶峰,而后逐渐回落(图8)。
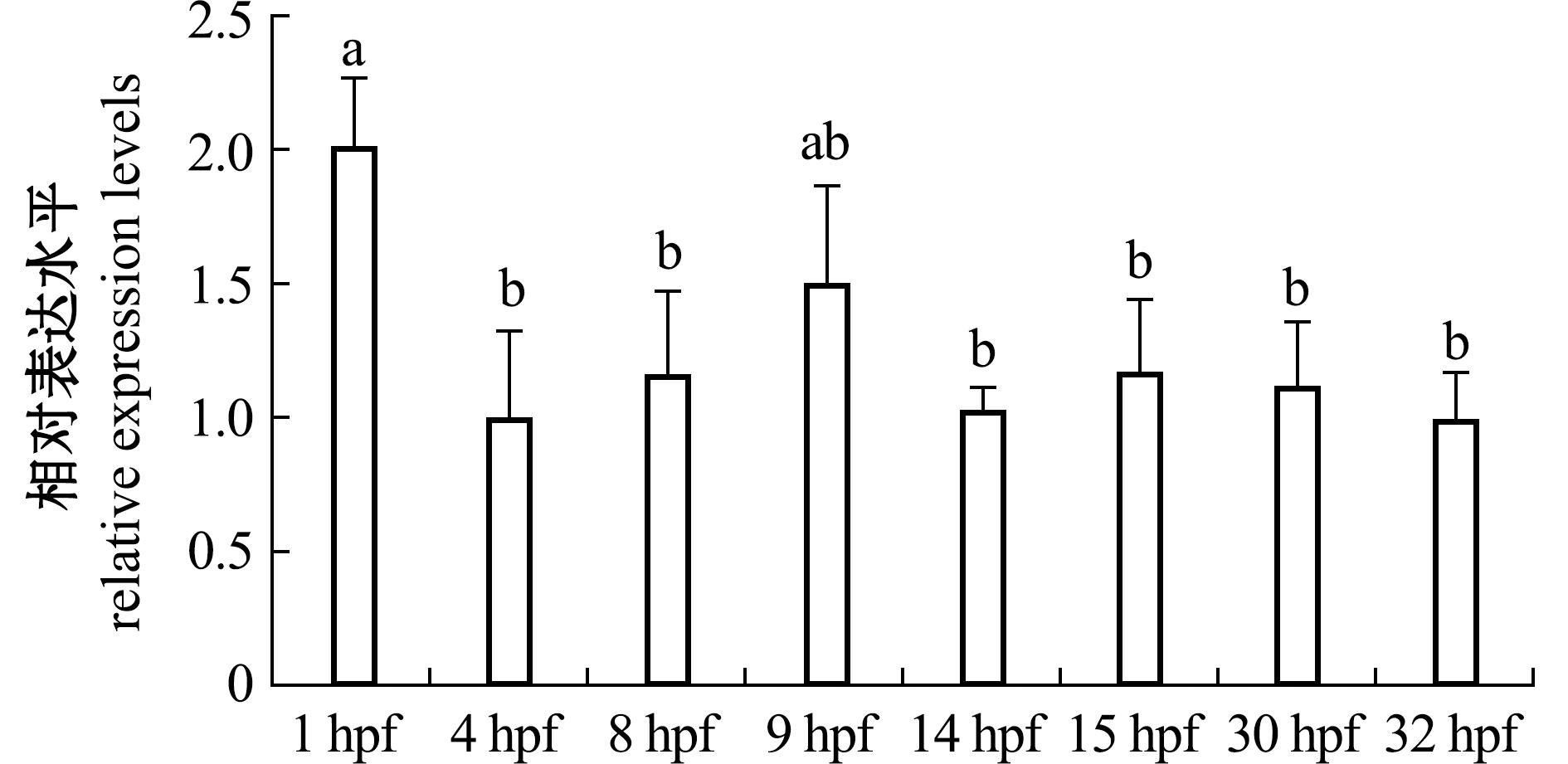
不同字母者表示组间有显著性差异(P<0.05),相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图6 大鳞副泥鳅胚胎发育时期hsd17b12a基因的表达水平
Fig.6 Expression level of the hsd17b12a gene during embryonic developmental stages in Paramisgurnus dabryanus
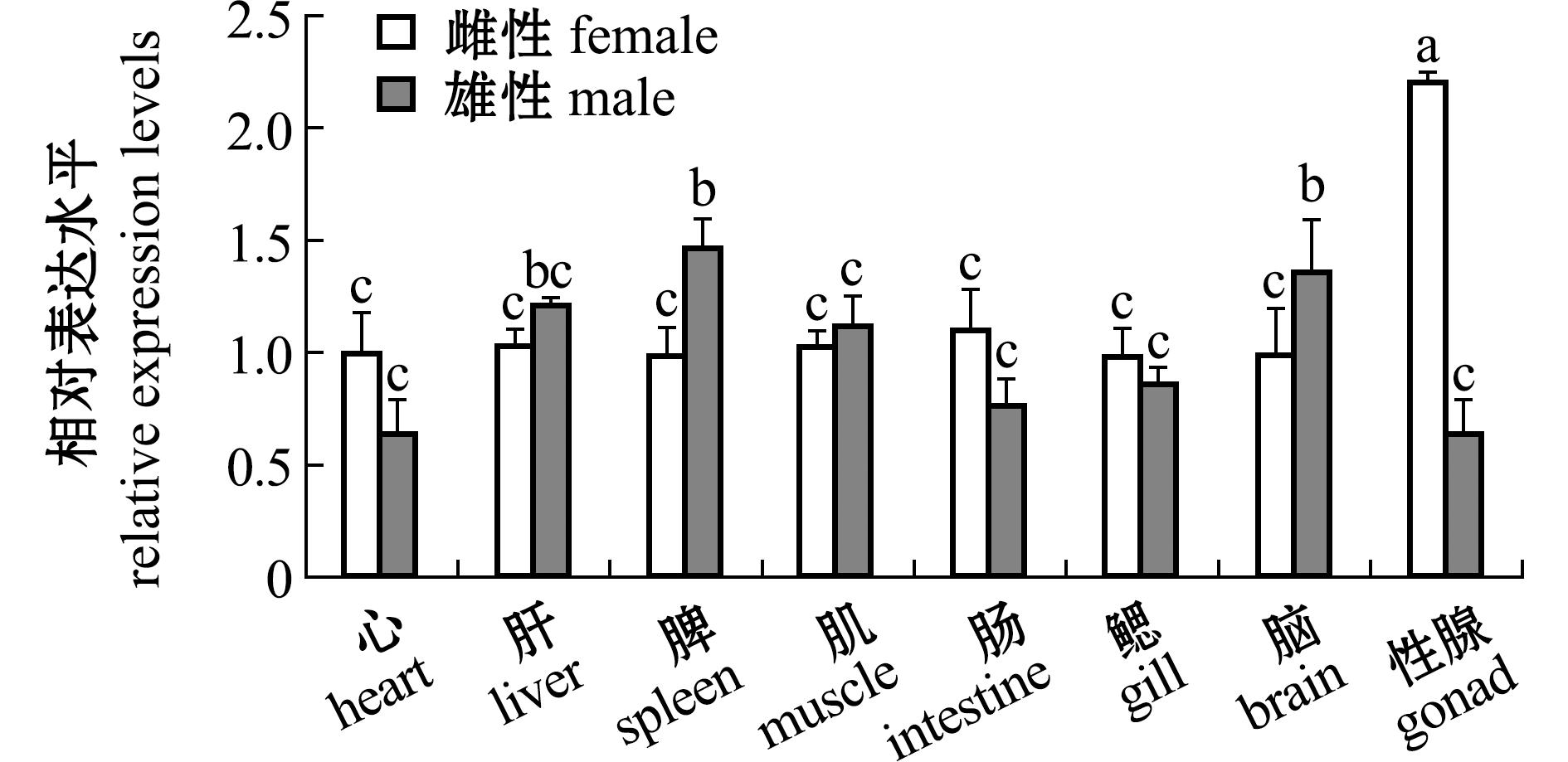
图7 大鳞副泥鳅不同组织hsd17b12a基因的表达水平
Fig.7 Expression level of the hsd17b12a gene in various tissues of Paramisgurnus dabryanus
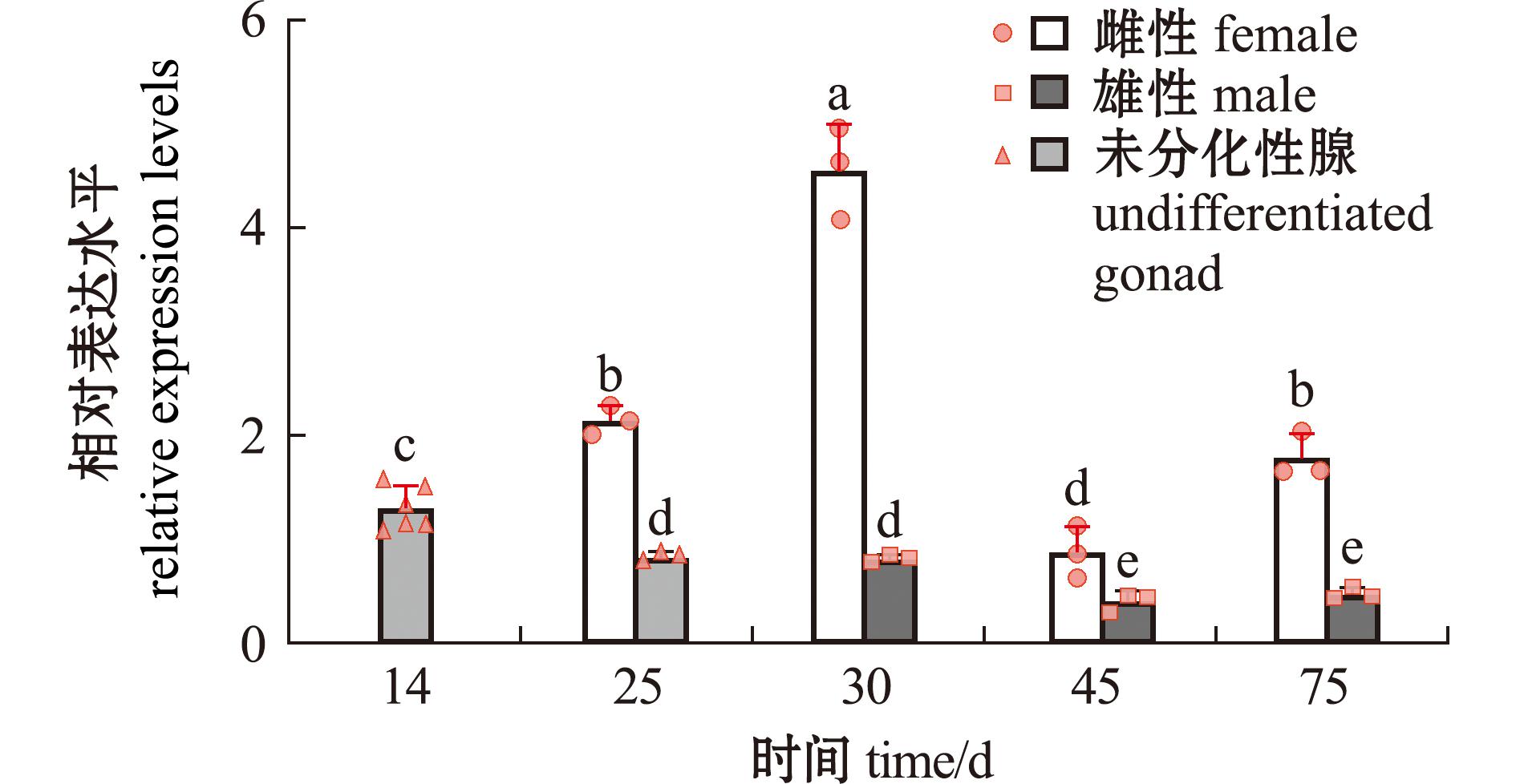
图8 大鳞副泥鳅性腺发育关键时间点hsd17b12a基因的表达水平
Fig.8 Expression levels of the hsd17b12a gene at key time points of gonadal development in Paramisgurnus dabryanus
3 讨论
鱼类的性别决定机制可大致划分为三大类别:基因决定(genotypic sex determination,GSD)、环境决定(environmental sex determination,ESD),以及基因与环境协同决定(GSD+ESD)机制[26]。温度决定性别(temperature-dependent sex determination,TSD)是鱼类中一种较为常见的ESD。大鳞副泥鳅的性别决定机制即为GSD+TSD类型。由于该物种的生长存在显著的性别二态性[27],其性别决定机制的研究同时具有经济上的意义。
17β-羟基类固醇脱氢酶(HSD17B)家族成员在哺乳动物的性类固醇激素生物合成路径中具有重要的作用,HSD17B12在人体各组织器官广泛分布[28],且在多数雌激素敏感组织中高表达,可能是参与雌激素激活的主要酶[29]。Hsd17b12a在鱼类中普遍存在hsd17b12a和hsd17b12b两个拷贝,其中hsd17b12a可能在性腺发育过程中起到重要作用[11,16,30-34]。然而关于大鳞副泥鳅这一物种,目前尚未发现针对其hsd17b12a基因在性别决定或性腺发育中作用的报道。
3.1 大鳞副泥鳅hsd17b12a基因的序列及进化特征
本研究中基于大鳞副泥鳅基因组注释获得的hsd17b12a基因全长CDS序列,进行了蛋白质预测与进化分析。大鳞副泥鳅与鲤Hsd17b12a蛋白的一致性最高,达到90.28%。根据氨基酸序列的相似度,所有硬骨鱼类聚为一支(图4),相似性均在78%以上,表明该基因在鱼类中比较保守。除硬骨鱼类外,该基因和其他物种如鸟类、两栖类、爬行类、哺乳类的相似性为48.80%~60.40%,说明这些序列之间在关键功能位点存在一定保守性,以维持该基因的基本生化功能(表2、图3)。
表2 不同物种的Hsd17b12a氨基酸序列同源性比对
Tab.2 Comparative analysis of amino acid sequence homology in Hsd17b12a orthologs across multiple species %

物种 species GenBank登录号 GenBankaccessionNo. 相似性 identity 拟鳄龟 (Chelydraserpentina) KAG6923173.1 48.80 野猪 (Susscrofa) BAI47714.1 56.34 小鼠 (Musmusculus) AAH90659.1 56.91 人 (Homosapiens) KAI4070840.1 57.56 象鼻鲨 (Callorhinchusmilii) XP_007885841.1 59.09 热带爪蟾 (Xenopustropicalis) CAJ83357.1 59.38 藏地山雀 (Pseudopodoceshumilis) XP_005522462.1 60.40 大西洋鲑 (Salmosalar) XP_013980189.1 78.10 尼罗罗非鱼 (Oreochromisniloticus) XP_003455445.2 80.32 远东拟沙丁鱼 (Sardinopsmelanosticta) BEH16728.1 81.15 斑马鱼 (Daniorerio) NP_957175.1 89.03 鲤 (Cyprinuscarpio) XP_042608972.1 90.28
3.2 大鳞副泥鳅hsd17b12a基因的表达特征
大鳞副泥鳅的hsd17b12a基因在胚胎发育期持续表达,而以桑葚胚期(1 hpf)表达水平最高(图6),表明该基因在胚胎发育起始阶段可能具有重要的作用。囊胚期(4 hpf)后其表达量略微下降,而后就一直维持在一个相对平稳的水平。有研究表明,小鼠的hsd17b12a基因还催化4-雄烯二酮转化为睾酮(T),以及脱氢表雄酮(DHEA)转化为5-雄烯-3α、17β二醇(3α-二醇)[35-36]。有学者发现,将克隆的牙鲆hsd17b12a基因构建重组质粒并经腹腔注射到牙鲆体内之后,能显著升高卵巢中的雄烯二酮水平,诱导卵原细胞增殖[37]。与其他物种类似[38-39],大鳞副泥鳅的hsd17b12a蛋白也具有17beta-HSD1_like_SDR_c家族的结构域,很可能具有催化类固醇代谢过程中的脱氢和还原反应的能力。
在成年大鳞副泥鳅的多个组织中hsd17b12a基因均有表达,且仅在性腺、脑和脾中表达水平存在显著的性别差异,这意味着该基因的稳定表达可能是机体正常生理功能所必需的,也参与了雌雄性腺的发育与分化。已有研究发现,除了在性类固醇代谢中的作用外,hsd17b12a的主要功能可能是在脂质代谢中,Hsd17b12+/-小鼠会出现神经元异常发育导致的胚胎死亡,其酶的缺失会导致脂肪酸合成中断,影响卵巢中花生四烯酸的合成[33,35]。在斑马鱼和秀丽隐杆线虫的研究也支持hsd17b12a在脂肪酸合成中的作用[40-41]。hsd17b12a基因的缺失会引起胚胎卵黄吸收不完全和消化器官扩张受阻,导致胚胎死亡[42]。
值得注意的是,本研发现,hsd17b12a基因在大鳞副泥鳅的雌雄性腺中存在明显的差异表达,该现象并非大鳞副泥鳅所特有,在牙鲆、豹纹鳃棘鲈(Plectropomus leopardus)、日本沙丁鱼(Sardinops melanostictus)等其他鱼类中也发现过类似现象[14,26,43]。大鳞副泥鳅hsd17b12a基因在精巢中的表达除脑和脾外与其他组织无显著性差异,但在卵巢中特异高表达,呈现出明显的性别二态性(图7)。在哺乳动物中也曾发现该基因高表达于雌性激素的靶组织,Hsd17b12a基因通过增强氧化还原酶活性,提高雌二醇浓度,且可能通过调节乳腺内雌激素代谢增加乳腺癌发生风险[32],表明该基因可能与雌性特征的发育存在关联。此外,本研究中发现,在大鳞副泥鳅脑和脾中雄性个体的hsd17b12a表达量显著高于雌性,这可能与雌激素调节有关,雄性个体表达更多的hsd17b12a基因来调控雌激素的合成或转化,以维持不同性别个体的内分泌平衡[44]。
大鳞副泥鳅具有ZZ/ZW性别决定系统,但其性别分化同时也受到环境因素的影响,如温度或者外源激素等。hsd17b12a基因在性类固醇激素合成与代谢中扮演重要角色,本研究中其表达水平在雌鱼中显著高于雄鱼,这显示它在性别分化过程中起调控作用。同性别大鳞副泥鳅的hsd17b12a表达水平在20 ℃、25 ℃温度下并无显著性差异[20]。在性逆转试验中,投喂混有17β-雌二醇的饲料,可促进大鳞副泥鳅未分化性腺向卵巢发育[45]。
此外,通过追踪该基因在大鳞副泥鳅性腺发育过程中重要节点的表达变化,研究发现,hsd17b12a基因在雌雄性腺间不仅表达量一直存在差异,表达变化模式也完全不同(图8)。先利用性腺的HE切片检测试验用鱼的性腺发育节点,结果与前人研究基本相同[25]。
在雌雄性腺未分化时(14 d),随机抽取了6组(每组5尾)鱼进行检测,各组hsd17b12a基因的表达量差异很小(图8),表达水平基本相同。但随着性腺的发育,该基因在性腺出现两性分化与发育成熟过程中呈现出了完全不同的变化趋势。hsd17b12a基因的表达在卵巢分化初期开始上调(25 d),在30 d时的表达水平最高,远高于所有其他节点,在卵巢分化完全时(45 d)回落至表达量最低点,在性腺分化完全时(75 d)又上调至接近分化初期的水平。其表达变化与卵巢发育的时间点相吻合,表明该基因在卵巢的分化发育中发挥着重要作用。
在雄性性腺的发育过程中,hsd17b12a基因呈现较为平稳的下调趋势。在雄性性腺发育初始阶段(30 d),该基因的表达水平与25 d未出现性腺分化样本的表达水平相当,且低于14 d时所有样本的表达水平。这一结果一方面表明,25 d时性腺尚未向卵巢分化的个体可能会发育成生理雄性,另一方面展示了雄性性腺发育起始之前,该基因已下调至较低水平。而后在性腺继续发育至成熟精巢时(45 d,75 d),该基因的表达进一步下调并维持在更低的水平。阶段性的下调模式表明,该基因的表达可能在一定程度上受到雄性性腺发育的影响,即随着雄性性腺的发育逐步降低,并最终维持于低水平表达。
需要明确的是,由于大鳞副泥鳅性别决定的特殊性,该物种在25 ℃下遗传上有约50%雌性个体会发育成生理上的雄性[27],即雄鱼中约有1/3为“伪雄鱼”。在本研究的多组qRT-PCR结果中,在性腺开始分化后的每个时间点,组间(雌性性腺 vs未分化性腺,或雌性性腺 vs 雄性性腺)差异明显高于任一组内差异(图8),尤其是在多个雌、雄性组内都未出现任何异常表达的个体,表明hsd17b12a基因的表达与生理性别具有明显的相关性。
4 结论
1)大鳞副泥鳅与鲤的Hsd17b12a蛋白的一致性最高(90.28%)。根据氨基酸序列的相似度,所有硬骨鱼类聚为一支,表明该基因在鱼类中比较保守。
2)hsd17b12a在整个胚胎发育过程中持续表达,其中桑葚胚期的表达量显著高于其他时期;在成熟大鳞副泥鳅的8种组织中也均有表达,且在雌雄性腺中的表达有显著性差异;在可分辨雌雄性腺后的发育过程中,hsd17b12a在卵巢中的表达量均高于同期精巢中的表达量。这些发现表明,该基因在大鳞副泥鳅的生长发育与性腺分化过程中具有重要作用。
[1] NAKAMOTO M,SHIBATA Y,OHNO K,et al.Ovarian aromatase loss-of-function mutant medaka undergo ovary degeneration and partial female-to-male sex reversal after puberty[J].Molecular and Cellular Endocrinology,2018,460:104-122.
[2] MILLER K A,KENTER L W,BRETON T S,et al.The effects of stress,cortisol administration and cortisol inhibition on black sea bass (Centropristis striata) sex differentiation[J].Comparative Biochemistry and Physiology Part A,Molecular &Integrative Physiology,2019,227:154-160.
[3] MOELLER G,ADAMSKI J.Multifunctionality of human 17β-hydroxysteroid dehydrogenases[J].Molecular and Cellular Endocrinology,2006,248(1/2):47-55.
[4] MOELLER G,ADAMSKI J.Integrated view on 17beta-hydroxysteroid dehydrogenases[J].Molecular and Cellular Endocrinology,2009,301(1/2):7-19.
[5] MUSTONEN M V,POUTANEN M H,ISOMAA V V,et al.Cloning of mouse 17beta-hydroxysteroid dehydrogenase type 2,and analysing expression of the mRNAs for types 1,2,3,4 and 5 in mouse embryos and adult tissues[J].Biochemical Journal,1997,325 ( Pt 1):199-205.
[6] SALONIEMI T,LAMMINEN T,HUHTINEN K,et al.Activation of androgens by hydroxysteroid (17β) dehydrogenase 1 in vivo as a cause of prenatal masculinization and ovarian benign serous cystadenomas[J].Molecular Endocrinology,2007,21(11):2627-2636.
[7] LIU J G,ZHANG Z F,MA X S,et al.Characteristics of 17β-hydroxysteroid dehydrogenase 8 and its potential role in gonad of Zhikong scallop Chlamys farreri[J].The Journal of Steroid Biochemistry and Molecular Biology,2014,141:77-86.
[8] OPPERMANN U,FILLING C,HULT M,et al.Short-chain dehydrogenases/reductases (SDR):the 2002 update[J].Chemico-Biological Interactions,2003,143/144:247-253.
[9] GEISSLER W M,DAVIS D L,WU L,et al.Male pseudohermaphroditism caused by mutations of testicular 17β-hydroxysteroid dehydrogenase 3[J].Nature Genetics,1994,7(1):34-39.
[10] MIETTINEN M M,MUSTONEN M V J,POUTANEN M H,et al.Human 17 β-hydroxysteroid dehydrogenase type 1 and type 2 isoenzymes have opposite activities in cultured cells and characteristic cell-and tissue-specific expression[J].Biochemical Journal,1996,314(3):839-845.
[11] MINDNICH R,ADAMSKI J.Zebrafish 17beta-hydroxysteroid dehydrogenases:an evolutionary perspective[J].Molecular and Cellular Endocrinology,2009,301(1/2):20-26.
[12] IJIRI S,SHIBATA Y,TAKEZAWA N,et al.17β-HSD type 12-like is responsible for maturation-inducing hormone synthesis during oocyte maturation in Masu Salmon Free[J].Endocrinology,2017,158(3):627-639.
[13] WEI J,CHEN Y Y,WANG W M.A high-density genetic linkage map and QTL mapping for sex and growth-related traits of large-scale loach (Paramisgurnus dabryanus)[J].Frontiers in Genetics,2019,10:1023.
[14] ZOU C C,WANG L J,ZOU Y X,et al.Characteristics and sex dimorphism of 17β-hydroxysteroid dehydrogenase family genes in the olive flounder Paralichthys olivaceus[J].The Journal of Steroid Biochemistry and Molecular Biology,2020,199:105597.
[15] ZHANG Y L,WU Q W,HU W H,et al.Changes in digestive enzyme activities during larval development of Chinese loach Paramisgurnus dabryanus (Dabry de Thiersant,1872)[J].Fish Physiology and Biochemistry,2015,41(6):1577-1585.
[16] XIA X H,HUO W R,WAN R Y,et al.Molecular cloning and expression analysis of Sox3 during gonad and embryonic development in Misgurnus anguillicaudatus[J].The International Journal of Developmental Biology,2017,61(8/9):565-570.
[17] 常重杰,余其兴.大鳞副泥鳅ZZ/ZW型性别决定的细胞遗传学证据[J].遗传,1997,19(3):17-19.
CHANG Z J,YU Q X.Cytogenetic evidence for sex determination of ZZ/ZW type in Paraloach Macrolepis[J].Hereditas(Beijing),1997,19(3):17-19.(in Chinese)
[18] 游翠红.两种小型鱼类的某些基因组特征研究[D].武汉:中国科学院研究生院(水生生物研究所),2007.
YOU C H.Study on some genomic characteristics of two small fishes[D].Wuhan:Institute of Hydrobiology,Chinese Academy of Sciences,2007.(in Chinese)
[19] NOMURA T,ARAI K,HAYASHI T,et al.Effect of temperature on sex rations of normal and gynogenetic diploid loach[J].Fisheries Science,1998,64(5):753-758.
[20] ZHANG L,FANG Y T,SHI M J,et al.Gonadal expression profiles reveal the underlying mechanisms of temperature effects on sex determination in the large-scale loach (Paramisgurnus dabryanus)[J].Animal Reproduction Science,2025,272:107661.
[21] 南平,杜启艳,燕帅国,等.温度对泥鳅和大鳞副泥鳅性腺分化的影响和CYP19a基因的克隆与时空表达[J].中国水产科学,2005,12(4):407-413.
NAN P,DU Q Y,YAN S G,et al.Effects of temperature on sex differentiation of gonads and the cloning and expression of CYP19a in two species of loaches[J].Journal of Fishery Sciences of China,2005,12(4):407-413.(in Chinese)
[22] 常重杰,周荣家,余其兴.大鳞副泥鳅中Sox9基因保守区的序列分析[J].遗传学报,2000,27(2):121-126.
CHANG Z J,ZHOU R J,YU Q X.The conservative region sequence analysis of PdSox9 in Paramisgurnus dabryanus[J].Acta Genetica Sinica,2000,27(2):121-126.(in Chinese)
[23] 夏晓华.两种泥鳅SoxE亚族和DMRT1基因的结构与功能分析[D].新乡:河南师范大学,2011.
XIA X H.Structural and functional analysis of SoxE subfamily and DMRT1 genes in two loach species[D].Xinxiang:Henan Normal University,2011.(in Chinese)
[24] XIA X H,WAN R Y,HUO W R,et al.Molecular cloning and mRNA expression pattern of Sox4 in Paramisgurnus dabryanus[J].Gene Expression Patterns,2017,25/26:109-117.
[25] 史改花,杜启艳,张晓亚,等.大鳞副泥鳅性腺发生和分化的组织学研究[J].河南师范大学学报(自然科学版),2008,36(6):163-166.
SHI G H,DU Q Y,ZHANG X Y,et al.Histological study of gonadogenesis and differentiation in paramisgarnus dabryanus[J].Journal of Henan Normal University (Natural Science Edition),2008,36(6):163-166.(in Chinese)
[26] MEI J,GUI J F.Genetic basis and biotechnological manipulation of sexual dimorphism and sex determination in fish[J].Science China Life Sciences,2015,58(2):124-136.
[27] HUANG Z H,MA B H,GUO X L,et al.Comparative transcriptome analysis of themolecular mechanism underlying the golden red colour in mutant Taiwanese loach[J].Aquaculture,2021,543:736979.
[28] SAKURAI N,MIKI Y,SUZUKI T,et al.Systemic distribution and tissue localizations of human 17beta-hydroxysteroid dehydrogenase type 12[J].Journal of Steroid Biochemistry and Molecular Biology,2006,99(4/5):174-181.
[29] LUU-THE V,TREMBLAY P,LABRIE F.Characterization of type 12 17beta-hydroxysteroid dehydrogenase,an isoform of type 3 17beta-hydroxysteroid dehydrogenase responsible for estradiol formation in women[J].Molecular Endocrinology,2006,20(2):437-443.
[30] KEMIL INEN H,ADAM M,M
INEN H,ADAM M,M KI-JOUPPILA J,et al.The hydroxysteroid (17β) dehydrogenase family gene HSD17B12 is involved in the prostaglandin synthesis pathway,the ovarian function,and regulation of fertility[J].Endocrinology,2016,157(10):3719-3730.
KI-JOUPPILA J,et al.The hydroxysteroid (17β) dehydrogenase family gene HSD17B12 is involved in the prostaglandin synthesis pathway,the ovarian function,and regulation of fertility[J].Endocrinology,2016,157(10):3719-3730.
[31] RAJAKUMAR A,SENTHILKUMARAN B.Molecular cloning and expression analysis of 17β-hydroxysteroid dehydrogenase 1and 12 during gonadal development,recrudescence and after in vivo hCG induction in catfish,Clarias batrachus[J].Steroids,2014,92:81-89.
[32] LEE O,FOUGHT A J,SHIDFAR A,et al.Association of genetic polymorphisms with local steroid metabolism in human benign breasts[J].Steroids,2022,177:108937.
[33] LIU M J,DING H,JIN C F,et al.Theoretical analysis and expression profiling of 17β-hydroxysteroid dehydrogenase genes in gonadal development and steroidogenesis of leopard coral grouper (Plectropomus leopardus)[J].International Journal of Molecular Sciences,2024,25(4):2180.
[34] ZHANG Y L,HU W H,WU Q W,et al.Ontogenetic changes in RNA,DNA and protein contents of Chinese loach,Paramisgurnus dabryanus (Dabry de Thiersant,1872),larvae and juveniles[J].Journal of Applied Ichthyology,2015,31(5):876-882.
[35] KEMIL INEN H.HSD17B12-an enzyme with a role in embryonic development,normal ovarian function and cancer[D].Turku:Turun yliopisto,2018.
INEN H.HSD17B12-an enzyme with a role in embryonic development,normal ovarian function and cancer[D].Turku:Turun yliopisto,2018.
[36] BLANCHARD P G,LUU-THE V.Differential androgen and estrogen substrates specificity in the mouse and Primates type 12 17beta-hydroxysteroid dehydrogenase[J].Journal of Endocrinology,2007,194(2):449-455.
[37] 邹聪聪,尤锋,王丽娟,等.一种牙鲆17β-羟类固醇脱氢酶12b的应用:CN116602243A[P].2023-08-18.
ZOU C C, YOU F, WANG L J, et al. Application of 17β-hydroxysteroid dehydrogenase 12b from Paralichthys olivaceus: CN116602243A[P]. 2023-08-18. (in Chinese)
[38] 周林燕.罗非鱼三种17β-羟类固醇脱氢酶(17β-HSD1,17β-HSD3,17β-HSD8)的克隆、表达及酶活性鉴定[D].重庆:西南师范大学,2004.
ZHOU L Y.Cloning,expression and enzyme activity identification of three 17β-hydroxysteroid dehydrogenases (17β-HSD1,17β-HSD3 and 17β-HSD8) from Tilapia[D].Chongqing:Southwest University,2004.(in Chinese)
[39] ARANYAKANONT C,IJIRI S,HASEGAWA Y,et al.17β-Hydroxysteroid dehydrogenase type 12 is responsible for maturation-inducing steroid synthesis during oocyte maturation in Nile Tilapia[J].General and Comparative Endocrinology,2020,290:113399.
[40] MINDNICH R,HRAB DE ANGELISM,ADAMSKI J.Functional genome analysis indicates loss of 17beta-hydroxysteroid dehydrogenase type 2 enzyme in the zebrafish[J].The Journal of Steroid Biochemistry and Molecular Biology,2007,103(1):35-43.
DE ANGELISM,ADAMSKI J.Functional genome analysis indicates loss of 17beta-hydroxysteroid dehydrogenase type 2 enzyme in the zebrafish[J].The Journal of Steroid Biochemistry and Molecular Biology,2007,103(1):35-43.
[41] ENTCHEV E V,SCHWUDKE D,ZAGORIY V,et al.LET-767is required for the production of branched chain and long chain fatty acids in Caenorhabditis elegans[J].Journal of Biological Chemistry,2008,283(25):17550-17560.
[42] CHEN Z F,HE M D,WANG H P,et al.Intestinal DHA-PA-PG axis promotes digestive organ expansion by mediating usage of maternally deposited yolk lipids[J].Nature Communications,2024,15(1):9769.
[43] NYUJI M,HONGO Y,KAZETO Y,et al.Characterization of eight types of 17β-hydroxysteroid dehydrogenases from the Japanese sardine Sardinops melanostictus:The probable role of type 12a in ovarian estradiol synthesis[J].General and Comparative Endocrinology,2024,347:114423.
[44] AMENYOGBE E,CHEN G,WANG Z L,et al.A review on sex steroid hormone estrogen receptors in mammals and fish[J].International Journal of Endocrinology,2020,2020(1):5386193.
[45] 李松,何治德,钟其渝,等.17β-雌二醇对大鳞副泥鳅生长和性腺分化的影响[J].淡水渔业,2015,45(1):83-87.
LI S,HE Z D,ZHONG Q Y,et al.Effects of 17β-estradiol on sex differentiation and growth in Paramisgurnus dabryanus(Sauvage)[J].Freshwater Fisheries,2015,45(1):83-87.(in Chinese)