细胞增殖、分化及细胞凋亡共同维持了机体环境的稳定。细胞增殖通过更新组织和器官发挥作用,而细胞凋亡则通过清除功能异常的细胞及发育过程中冗余的细胞来维持机体平衡,即程序性细胞死亡[1]。凋亡是一种基本的生物学过程,调控多细胞生物的生长、发育及免疫反应[2]。
半胱氨酸-天冬氨酸蛋白酶(Caspases)是一类具有底物特异性的半胱氨酸蛋白酶,通过切割多种细胞底物在细胞凋亡过程中发挥关键调控作用[3]。根据其功能特征可分为起始型Caspase和效应型Caspase两大类[4]。起始型Caspase位于级联反应的上游,负责接收并传递来自线粒体或死亡受体的凋亡信号[5]。效应型Caspase则通过激活DNase和蛋白酶等凋亡相关酶类执行凋亡程序[6]。迄今为止,在哺乳动物中已鉴定出15种Caspase(Caspase1-15)。在凋亡信号通路中被进一步分为凋亡起始因子(Caspase-2、-8、-9、-10),凋亡效应因子(Caspase-3、-6、-7),以及炎症介质(Caspase-1、-4、-5 、-11、-12)[7]。Caspase-15是最近发现的成员,其确切功能仍需进一步研究[8]。
Caspase-8的N端包含一个前结构域,该结构域由两个死亡效应结构域(death effector domain,DED)组成[9]。DED作为一种蛋白质相互作用结构域,能够介导蛋白质间的特异性结合,在参与凋亡信号诱导的适配蛋白中高度保守[10]。在哺乳动物中,已鉴定出14种Caspase,但DED仅存在于Caspase-8和Caspase-10中[11]。当死亡配体(如Fas配体)与细胞膜表面的相应受体结合后,会在细胞质中形成由死亡受体、FADD和Caspase-8组成的蛋白复合物[12],继而放大下游凋亡级联反应,导致细胞解体和死亡。
Caspase-8作为半胱天冬酶家族的重要成员,其调控免疫系统功能在鱼类中已有研究。Caspase-8基因在免疫组织中高表达,并在受到刺激后,其表达显著上升,在敲降后相关炎症因子和凋亡基因表达随之下降[13-14]。同时,Caspase-8可通过与FADD蛋白的协同作用,增强抗菌肽的表达,并促进免疫细胞的迁移,表明Caspase-8在调节免疫细胞功能和增强宿主抗病能力方面发挥着重要作用[15]。此外,Caspase-8与抗氧化酶在鱼类白细胞中也表现出协同上调,提示其在应对细菌感染时调控细胞死亡与自由基清除[16]。因此,Caspase-8通过调控多种免疫因子,参与水产动物的免疫防御和细胞凋亡,是连接细胞凋亡与免疫反应的重要分子。
1989年,大连海洋大学引进了中间球海胆(Strongylocentrotus intermedius)并在中国沿海地区进行了推广[17]。如今,该物种已成为中国最受欢迎的海胆品种之一。然而,中间球海胆养殖业同时也面临着疾病困扰。对于缺乏获得性免疫系统的棘皮动物,其先天免疫系统是抵御外来病原体入侵的关键。因此,研究先天免疫相关基因的克隆及其表达水平,对促进海胆的健康养殖及优良品种的选择和培育有很大作用。目前,在中间球海胆中尚未出现关于Caspase-8鉴定的相关报道, Caspase-8与Caspase-3之间的调控关系也尚不明确。因此,明确Caspase-8在中间球海胆中的功能对于理解其免疫反应至关重要。本研究中采用cDNA末端快速扩增技术(rapid-amplification of cDNA ends,RACE)获得Caspase-8的全长cDNA序列,通过荧光定量PCR分析其在不同发育阶段和组织中的表达模式,结合RNA干扰技术,探讨Caspase-8与Caspase-3的调控关系,并测定其免疫酶活性,以探究Caspase-8在中间球海胆中的免疫功能,促进海胆养殖业的发展。
1 材料与方法
1.1 材料
选取2龄活力旺盛的中间球海胆个体,壳高为(26.84±1.49) mm,壳径为(47.52±2.57) mm,体质量为(37.32±4.87) g。所有试验个体均来自同一家系,以确保遗传背景的一致性。
1.2 方法
1.2.1 样本采集 随机选取9只中间球海胆解剖,采集管足、围口膜、亚里士多德提灯、体腔细胞、性腺及肠道组织。为获得不同发育阶段样本,通过围口膜向海胆体腔注射1 mL氯化钾溶液(每克体质量40 μL)进行催产[18]。随机选取雌雄个体各3只,分别收集其卵子和精子进行人工授精。授精完成后2 h内进行洗卵及定量,密度为20~30 ind./L,水温为19.0 ℃±0.5 ℃,期间持续充氧。受精卵通过卵裂从多细胞阶段发育到囊胚阶段,在囊胚旋转后进入原肠胚阶段,然后发育到浮游阶段。浮游幼虫分为两个阶段,即棱柱幼虫和长腕幼虫。在长腕幼虫后期,幼虫的腕逐渐消失,经过一系列变态后最终成为稚胆。在此期间,定期经显微镜观察发育状态并采集9个发育阶段样本(受精卵、2细胞期、4细胞期、8细胞期、32细胞期、囊胚期、原肠胚期、棱柱幼虫和四腕幼虫),保存于1.5 mL离心管中。所有样本迅速液氮冷冻后于-80 ℃保存,用于后续RNA提取及免疫酶活性分析。
1.2.2 Caspase-8 cDNA全长克隆 基于前期转录组测序数据(http://gsa.big.ac.cn/,登录号:PRJCA000276)中获得的Caspase-8的部分cDNA序列,采用Primer Premier 5.0软件设计基因特异性引物(表1),引物由生工生物工程有限公司合成。RACE产物采用快速凝胶提取试剂盒(全式金,北京)提取和纯化后连接至pEASY®-1克隆载体(全式金,北京),转化至Trans1-T1噬菌体抗性化学感受态细胞(全式金,北京)。通过M13引物(全式金,北京)进行菌落PCR鉴定阳性重组体,最终在生工生物工程有限公司进行测序验证。
表1 试验所用引物序列
Tab.1 Sequences of primers used in this study

引物名称 primers 引物序列 sequence (5'-3') 目的 purpose Caspase-8-F1 GAAGGACCCAACTGCAAGGGAATACG 3'RACEPCR Caspase-8-F2 GTCTGCGTCATTCTGTCGCATGGAT 3'RACEPCR Caspase-8-R1 CAATCCTTTCACTAGCTATATTCTGGGGGTA 5'RACEPCR Caspase-8-R2 TGTGACTGTCATTTGTGCAGTTTGATGGAT 5'RACEPCR 18s-F TGAGCCGCAACAGTAATC qPCR 18s-R AAGGGAAAAGGAAGTGAAAG qPCR Caspase-8-F CAGAGGAAGGCGGCGGAGAG qPCR Caspase-8-R AGTGTGCTGCTTTGCTGTGAGTC qPCR Caspase-3-F GCTTCAGAACCGAGGCTCATAGTG qPCR Caspase-3-R CCTCTTCGCCGTGACTCATTGC qPCR NegativecontrolsiRNA-F UUCUCCGAACGUGUCACGUTT RNAi NegativecontrolsiRNA-R ACGUGACACGUUCGGAGAATT RNAi Caspase-8-siRNA-F GGAUCUUCUUUCGAUGCUUTT RNAi Caspase-8-siRNA-R AAGCAUCGAAAGAAGAUCCTT RNAi
1.2.3 生物信息学分析 采用BLAST(https://www.ncbi.nlm.nih.gov/BLAST/)对Caspase-8 全长序列进行核苷酸序列比对分析,并通过ExPASy(http://www.expasy.org/)推导其氨基酸序列。利用NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)确定基因开放阅读框,运用ProtParam工具(http://web.expasy.org/protparam/)计算推导蛋白质的理化参数,包括分子量、理论等电点(pI)及疏水性总平均值(GRAVY)。通过SignalP 4.1服务器(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽切割位点,采用InterPro(http://www.ebi.ac.uk/ interpro/)分析蛋白质功能域和重要位点。使用ClustalW程序(http://www.ch.embnet.org/software/ClustalW.html)进行多序列比对,基于MEGA11软件构建系统发育树。
1.2.4 Caspase-8的时空表达分析 采用荧光定量PCR仪(Roche,LightCycler 96)进行实时定量PCR反应(qRT-PCR),以检测Caspase-8 mRNA的相对表达水平。反应总体系20 μL,包括cDNA2 μL、FastStart Essential DNA Green Master mix 10 μL、ddH2O 6.4 μL及(10 μmol/L)上下游引物0.4 μL。反应程序如下:95 ℃下预变性5 min,95 ℃下变性15 s,60 ℃下退火30 s,72 ℃下延伸45 s,最后在72 ℃下再延伸10 min,共进行40个循环。不同组织和不同发育阶段的样本各进行3次生物重复和3次技术重复,并通过熔解曲线分析确认扩增产物的特异性。以18s rRNA作为内参基因,靶基因的相对表达水平通过Livak等[19]描述的2-ΔΔCt方法计算。
1.2.5 Caspase-8和Caspase-3之间关系的鉴定 Caspase-8的特异性小干扰RNA(siRNA)由上海吉玛制药技术有限公司设计并合成(表1)。选取6只健康中间球海胆(壳径41.35 mm±1.39 mm、湿质量24.36 g±2.04 g)随机分为对照组和试验组,每组放置3只。对照组使用5 μL 阴性对照(NC)、5 μL Lipo6000TM转染试剂(碧云天,上海)及40 μL PBS缓冲液的混合液;试验组使用5 μL siRNA、5 μL Lipo6000TM转染试剂(碧云天,上海)及40 μL PBS缓冲液的混合液。静置5 min后通过海胆围口膜注入体腔。转染48 h后,分别采集管足、亚里士多德提灯、体腔细胞、肠道和性腺组织,提取总RNA并逆转录为cDNA,采用qRT-PCR检测Caspase-8和Caspase-3基因的相对表达水平。
1.2.6 免疫酶活性测定 采用Epoch酶标仪(BioTek,Winooski,VT,美国)测定中间球海胆体腔液上清液中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)、过氧化物酶(POD)和谷胱甘肽过氧化物酶(GSH-Px)的活性。所有检测试剂盒均购自南京建成生物工程研究所,试验操作过程严格遵循相关标准操作流程。
1.3 数据处理
试验数据以均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),显著性水平设为0.05。
2 结果与分析
2.1 Caspase-8基因克隆与生物信息学分析
通过RACE克隆得到中间球海胆Caspase-8全长3 107个碱基对(bp),包括620 bp的5′ 非翻译区(UTR)和423 bp的3′ UTR,推测的ORF为2 064 bp。该基因编码687个氨基酸残基的蛋白质。推导出的Caspase-8 氨基酸序列的预测分子量为254 700,其理论等电点为4.85。该蛋白质序列包括两个DED结构域和一个CASc结构域(图1),Caspase-8基因与其他物种氨基酸序列比对见图2。

斜体表示表示起始密码子;*表示终止密码子;灰色阴影表示DED结构域;黑色阴影表示CASc结构域;矩形方框表示保守区域。
The initiation codon is shown in italics;* means a terminal codon;DED is shown in the gray background;CASc domain is shown in the dark background;The conserved regions are in the red boxes.
图1 Caspase-8基因cDNA序列及其推导氨基酸序列
Fig.1 cDNA sequence and encoded amino acid sequence of Caspase-8

颜色深浅代表蛋白序列相似程度,颜色越深相似度越高。
The color depth represents the similarity of protein sequence,and much darker color indicates much higher similarity.
图2 Caspase-8基因与其他物种氨基酸序列比对
Fig.2 Amino acid sequence alignment of Caspase-8 genes with other species
2.2 Caspase-8的氨基酸组成分析
使用ProtScale在线分析Caspase-8的氨基酸亲水性/疏水性。结果表明,脂肪族氨基酸指数为31.93,最大亲水系数为2.189,最小亲水系数为-0.633,总平均亲水系数为0.825,因此蛋白质具有亲水性界面区域。使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线分析Caspase-8的跨膜结构域,结果表明该蛋白无跨膜结构域。
2.3 Caspase-8的多重比对和系统发育分析
使用BLAST分析中间球海胆Caspase-8的氨基酸序列,表明其与脊椎动物的Caspase-8具有高度同源性。为揭示Caspase-8的系统发育,使用NJ算法构建Caspase-8系统发育树,中间球海胆的Caspase-8和拟球海胆(Paracentrotus lividus)的Caspase-8聚集,表明二者具有密切亲缘关系(图3)。
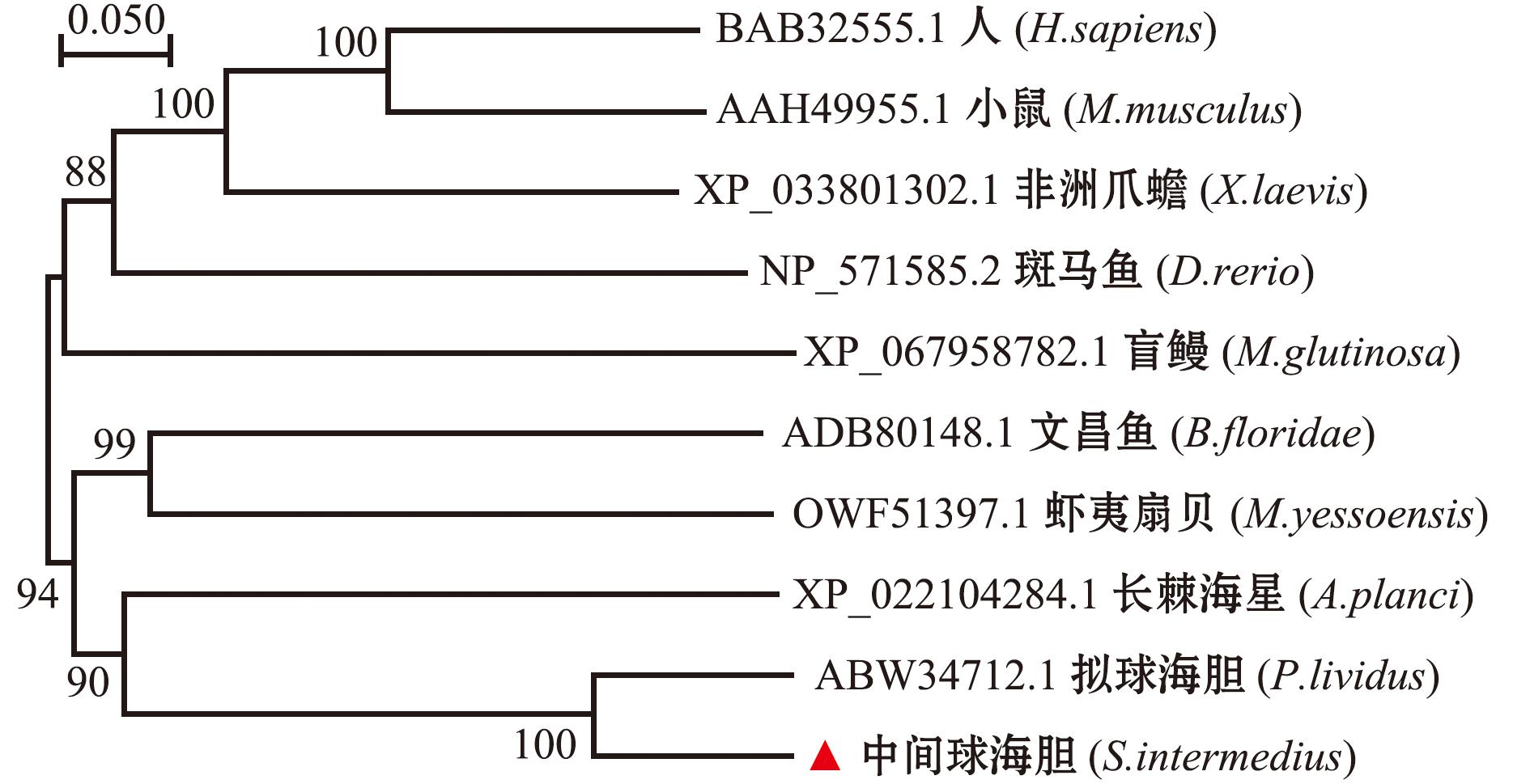
图3 Caspase-8基因在不同物种中构建的NJ系统进化树
Fig.3 Phylogenetic tree of Caspase-8 amino acid sequence of different species
2.4 Caspase-8基因的表达模式
通过qRT-PCR观察Caspase-8基因在6个不同组织中的表达。检测结果表明,Caspase-8基因在所有检测组织中均有表达,表达水平在体腔细胞中最高,在肠道中最低(图4)。为了解Caspase-8基因在海胆不同发育阶段的表达变化,检测了Caspase-8基因在中间球海胆受精卵、2细胞期、4细胞期、8细胞期、32细胞期、囊胚期、原肠胚期、棱柱幼虫和四腕幼虫阶段的表达,试验结果如图5所示,从图5可见,Caspase-8在9个阶段都有表达,其相对表达水平在8细胞期最高,在原肠胚期最低。
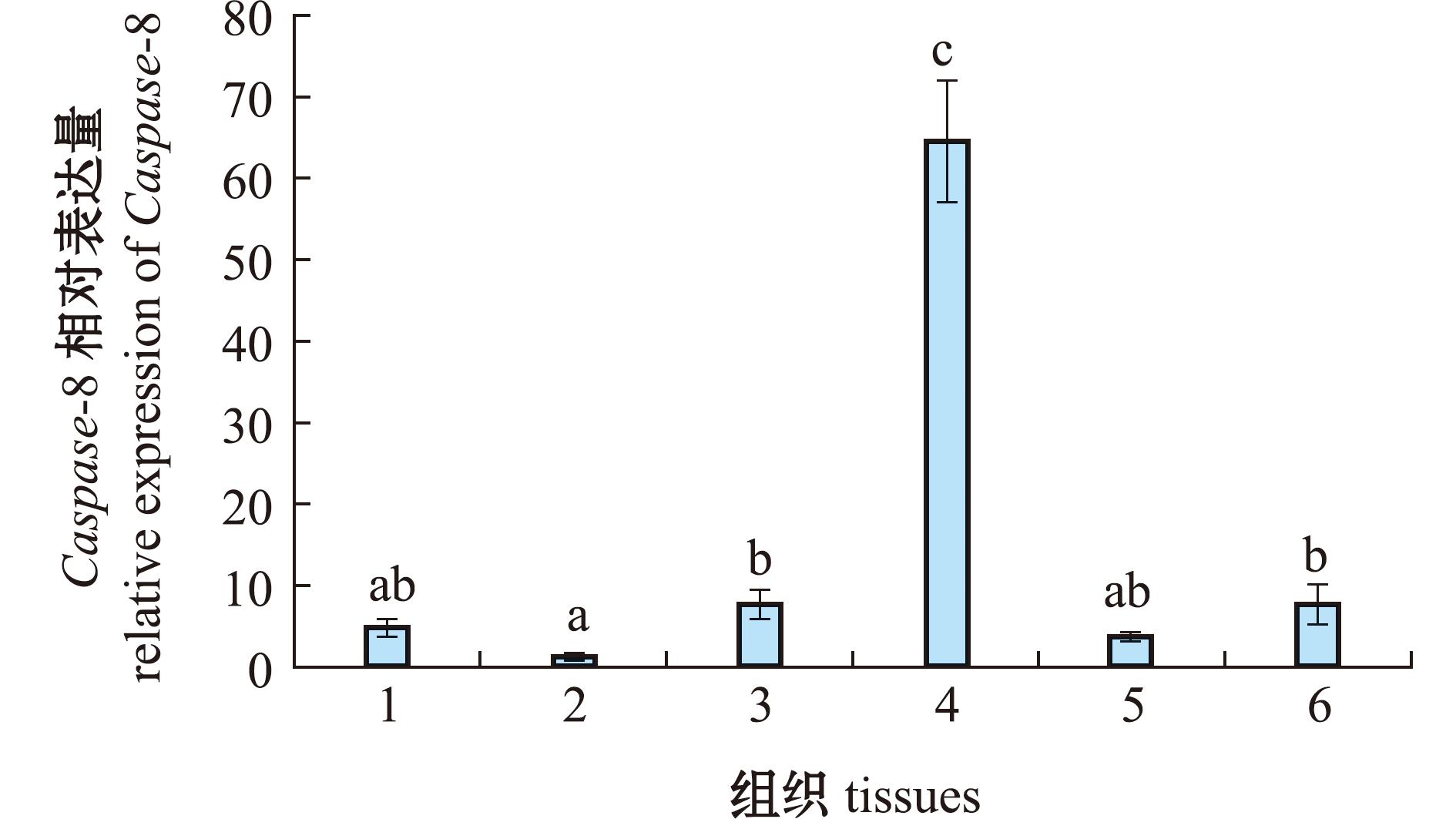
1—管足;2—肠道;3—亚里士多德提灯;4—体腔细胞;5—性腺;6—围口膜。标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
1—tube feet;2—intestines;3—Aristotle’s lantern;4—coelomocyte tissues;5—gonads;6—peristomial membrane.The means with different letters are significant differences at the 0.05 probability level;and the means with the same letters are not significant differences,et sequential.
图4 Caspase-8在不同组织的相对表达量
Fig.4 Relative expression levels of Caspase-8 in different tissues
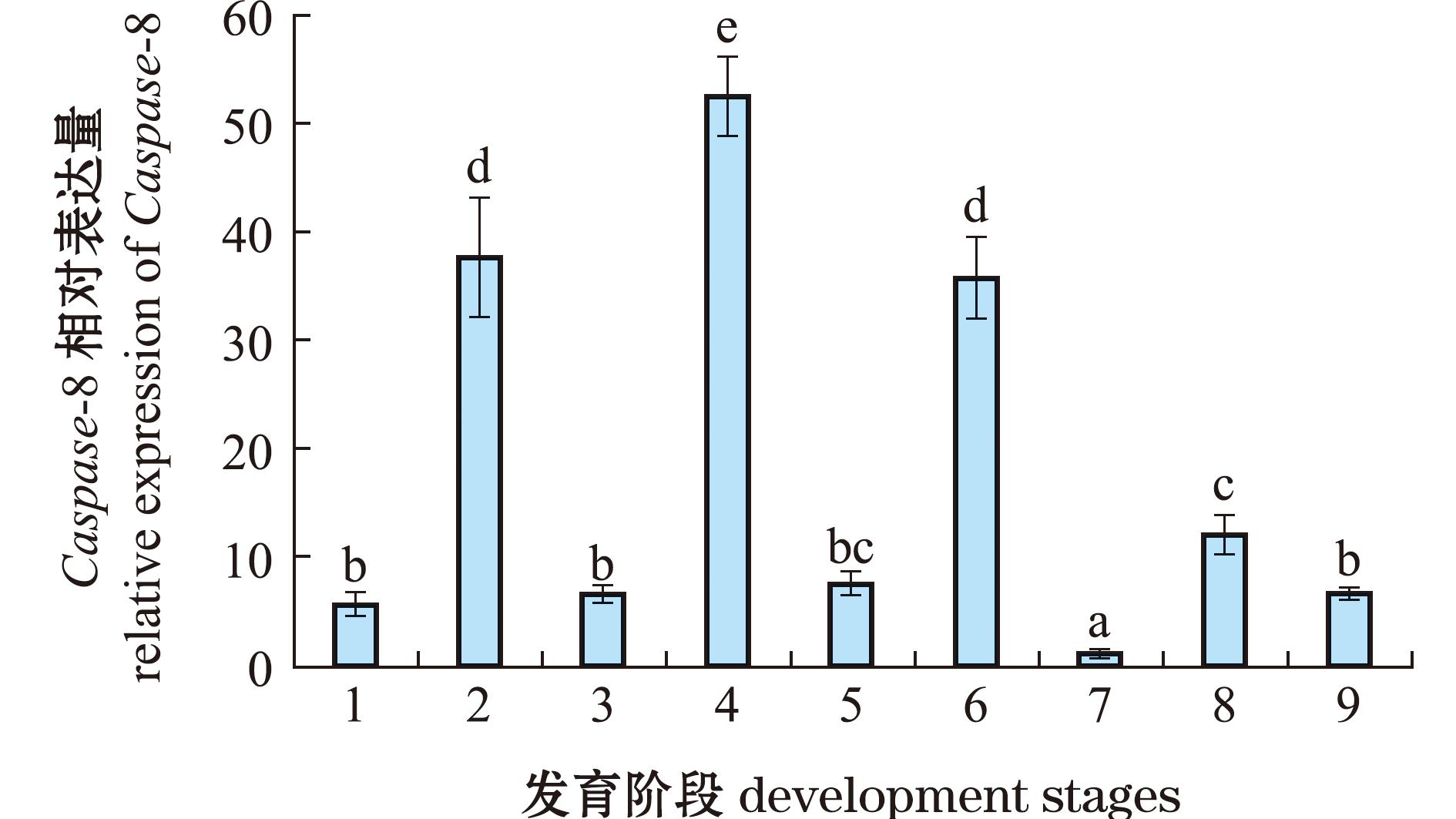
1—受精卵;2—2细胞期;3—4细胞期;4—8细胞期;5—32细胞期;6—囊胚期;7—原肠胚期;8—棱柱幼虫;9—四腕幼虫。
1—eggs;2—two-cells;3—four-cells;4—Eight-cells;5—thirty-two cells;6—blastula;7—gastrula;8—prism larval;9—four-wrist larval.
图5 Caspase-8在不同发育阶段的相对表达量
Fig.5 Relative expression levels of Caspase-8 in different development stages
2.5 Caspase-8基因siRNA干扰试验
为了解Caspase-8和Caspase-3之间关系,进行siRNA试验。结果显示,与对照组相比,转染Caspase-8 siRNA 48 h后,管足、亚里士多德提灯、体腔细胞、肠道和性腺中Caspase-8的表达分别降低了12.15%、8.58%、89.98%、14.76%和73.98%;Caspase-3的表达量分别降低了73.78%、56.10%、62.67%、80.67%和64.70%(图6)。
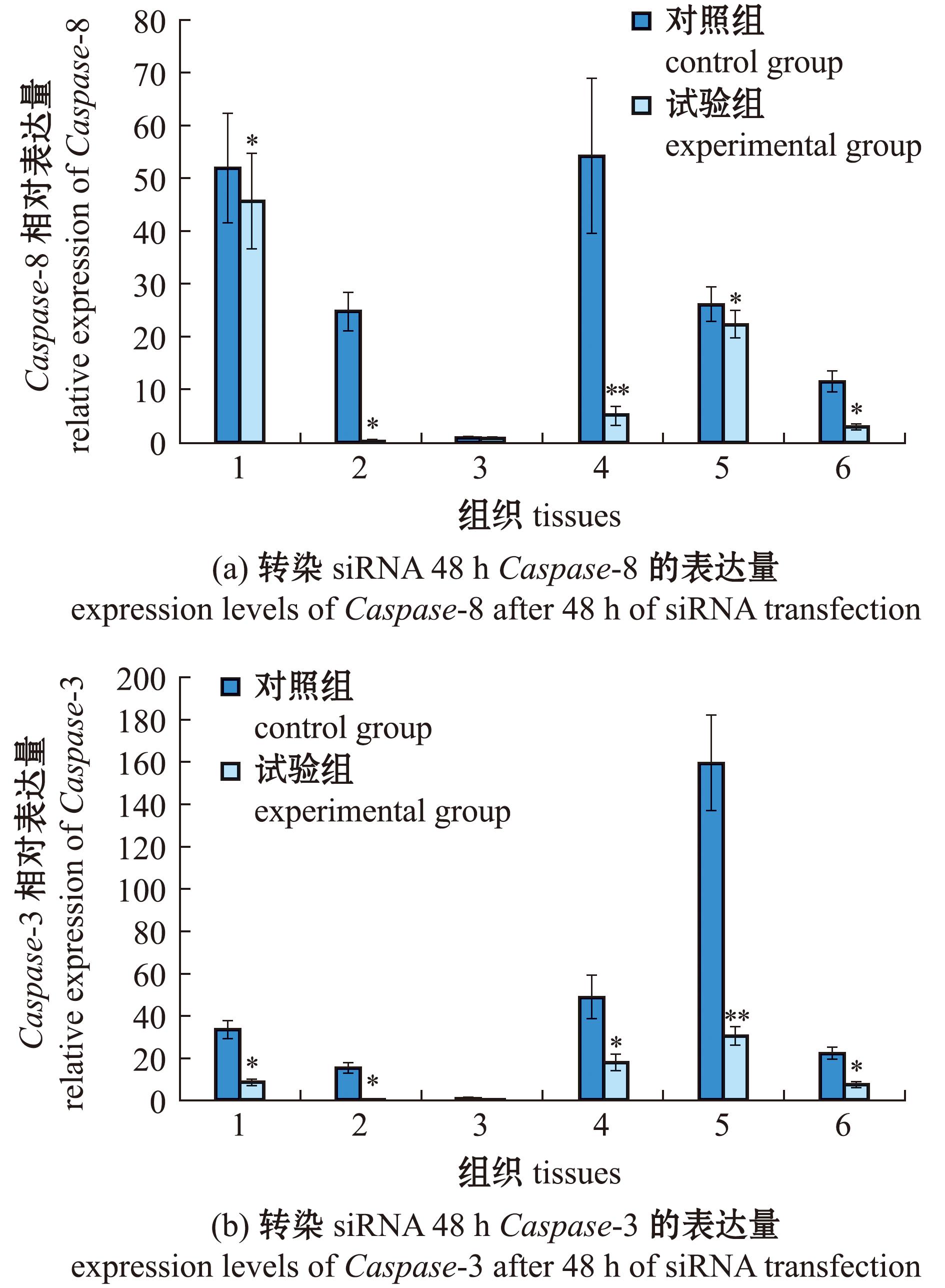
1—管足;2—围口膜;3—亚里士多德提灯;4—体腔细胞;5—肠道;6—性腺。*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同。
1—tube feet;2—peristomial membrane;3—Aristotle’s lantern;4—coelomocyte tissues;5—intestines;6—gonads.* means significant difference compared with the control(P<0.05);** means very significant difference compared with the control(P<0.01),et sequential.
图6 转染siRNA 48 h后不同组织的相对表达量
Fig.6 Relative expression levels in different tissues 48 hours after siRNA transfection
2.6 siRNA干扰前后免疫酶活性的变化
为了确定Caspase-8基因在免疫系统中的作用,检测了干扰前后海胆免疫酶活性的变化。结果表明,SOD、CAT、ACP、AKP 、POD、LZM和GSH-Px的活性水平降低(图7)。
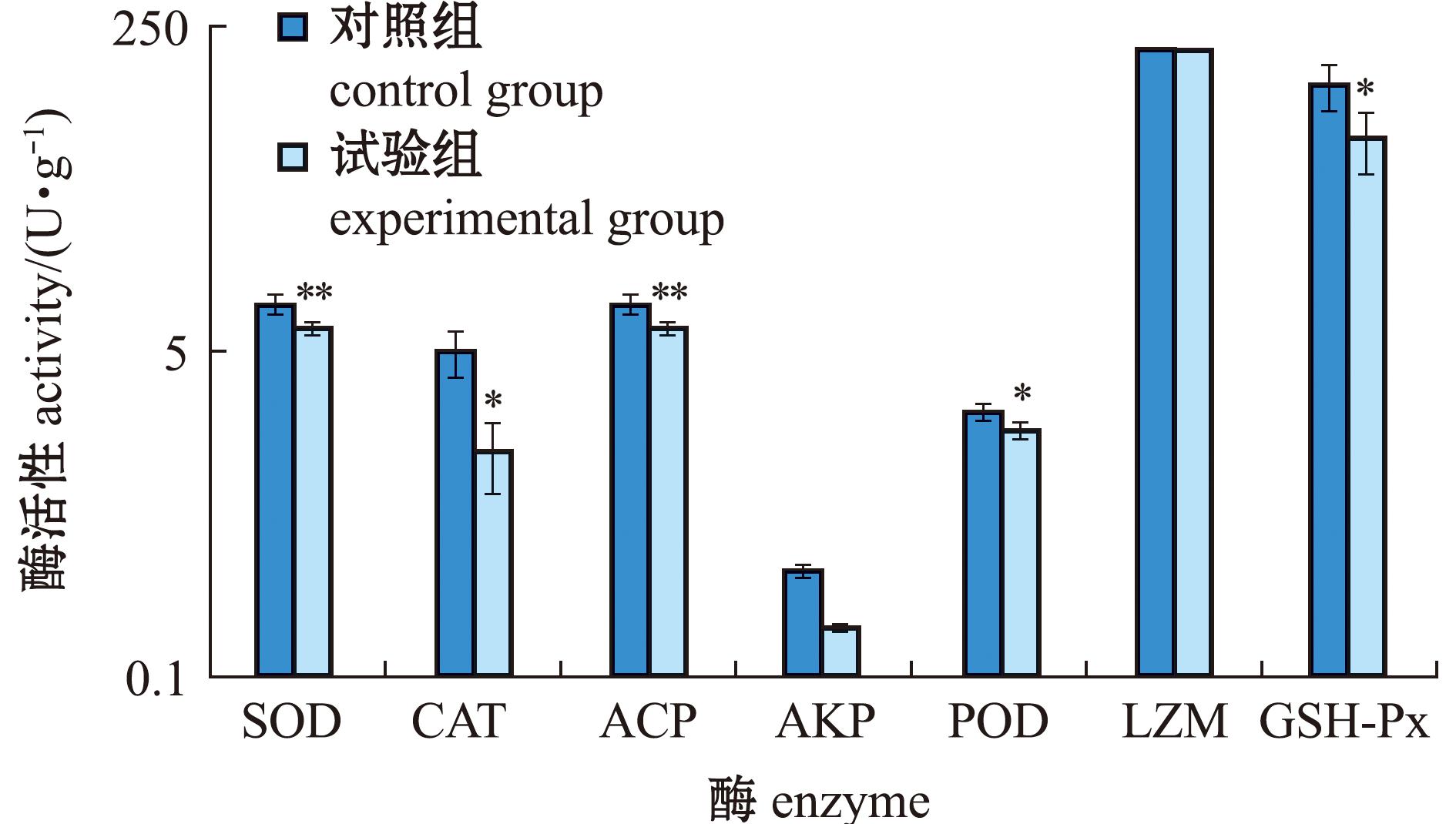
图7 干扰前后免疫酶活性变化
Fig.7 Changes in immune enzyme activity before and after interference
3 讨论
3.1 中间球海胆Caspase-8基因序列特征及进化分析
近年来,海胆养殖规模的扩大与环境恶化导致其适应性下降,抗病能力显著降低,疾病发生率急剧上升。中间球海胆易感疾病主要包括黑嘴病[20]和红斑病[21]。Caspase-8与调节免疫反应的细胞凋亡密切相关,经本研究中鉴定及分析,中间球海胆Caspase-8 cDNA,其全长序列为3 107 bp。系统发育分析显示,中间球海胆的Caspase-8和拟球海胆的Caspase-8聚集,表明二者具有密切亲缘关系。序列、保守结构域和系统发育分析的相似性为中间球海胆Caspase-8和拟球海胆Caspase-8的两个DED结构域和CASc结构域高度相似提供了有力证据。
3.2 中间球海胆Caspase-8基因的表达模式
Caspase-8的组织表达与其功能之间的关系在鱼类中已有研究。在检测金鱼体内Caspase-8的表达情况时发现,其在鱼体的肝脏、肾脏、鳃、肌肉、脑组织中均有表达,且鳃组织表达水平最高[22]。虹鳟(Oncorhynchus mykiss)感染柱状黄杆菌后,鳃组织中Caspase-8含量上升[23]。鳃作为水生生物宿主免疫的重要器官,在病原识别、吞噬作用和细胞信号转导等过程中发挥关键作用。这一发现提示,Caspase-8的表达与免疫反应具有显著相关性。在本研究中,Caspase-8在中间球海胆的所有组织中均有表达,且在体腔细胞的表达水平最高。中间球海胆具有真体腔结构,其免疫机制主要依赖于先天免疫系统,体腔液中的免疫因子可直接作用于入侵病原体,构成了棘皮动物先天免疫防御系统的关键组成部分[24]。Caspase-8在体腔细胞中的高表达进一步表明该基因在中间球海胆的免疫防御系统中的重要作用。
作为棘皮动物的典型代表,海胆完全依赖于先天免疫系统,通过细胞免疫和体液免疫的协同作用抵抗病原菌的入侵。在本研究中,结果显示Caspase-8在海胆的所有发育阶段都有表达。受精后,海胆经历一个胚胎阶段,已有研究发现,棘皮动物的早期发育依赖于母体沉积的产物。Song等[25]通过检测太平洋牡蛎胚胎期12个免疫相关基因的表达水平及3种抗氧化酶和溶菌酶的活性,证实父本母本特异性免疫物质可通过卵子传递给后代,并在胚胎发育过程中提供免疫保护。在中间球海胆的早期发育过程中,Caspase-8在受精卵至32细胞期的高表达可能与父母免疫及卵膜保护机制有关。Silva[26]通过将酿酒酵母显微注射至绿海胆囊胚腔的试验,首次证实吞噬作用出现于中期原肠胚阶段。然而,本研究中原肠胚阶段的表达水平并不显著,可能与父本母本免疫物质的降解及免疫系统处于初始阶段有关。上述研究表明,Caspase-8的表达模式与海胆早期发育阶段的免疫系统成熟过程密切相关,这为深入探究海胆发育过程中免疫系统的建立与完善提供了重要依据。
3.3 中间球海胆Caspase-8与Caspase-3的关系特征
Caspase-3是Caspase家族的另一个成员,在凋亡途径的执行中起着关键作用。高彦军等[27]研究发现,Caspase-8特异性抑制剂Z-IETD-FMK可同时抑制Caspase-8和Caspase-3。Zhuang等[28]同样发现,通过Z-IETD-FMK阻断Caspase-8可抑制Caspase-3的切割。在本研究中,Caspase-8干扰后在体腔细胞表达量显著降低,提示Caspase-8可能在中间球海胆的免疫反应中发挥重要作用。Caspase-3在肠道中的表达下调最为显著,其次是在体腔细胞中,这可能是因为Caspase-8与Caspase-10在结构和功能上具有相似性,均为启动子,能够激活Caspase-3[29]。因此,即使Caspase-8在体腔细胞中的表达显著降低,Caspase-10可能通过补偿作用维持Caspase-3的相对稳定表达,从而确保细胞免疫功能的正常运作。因此推测在中间球海胆中,Caspase-3同样位于Caspase-8的下游,二者存在调控关系。
3.4 中间球海胆Caspase-8基因功能分析
研究发现,Caspase-8在水产动物病原感染或免疫刺激下,与抗氧化酶、免疫酶活性变化密切相关,协同调控细胞凋亡、炎症反应和氧化应激,是水产动物免疫应答的重要分子节点[13-14]。SOD和CAT可以通过降低细胞中的H2O2和O2-含量来反映生物体抵抗氧化应激的能力并间接反映海胆的免疫水平[30]。POD和GSH-Px也在ROS清除中发挥关键作用,保护细胞免受氧化损伤[31-32]。在已有鱼类研究中表明,当受到感染或免疫刺激时,Caspase-8与抗氧化酶的表达同时上调[16,33]。在本研究中分别检测了Caspase-8 siRNA干扰前后中间球海胆体腔液中SOD、CAT、POD、GSH-Px活性水平的变化。结果显示,Caspase-8在体腔细胞中的表达显著降低后,SOD、CAT、POD和GSH-Px的活性水平也显著降低,表明海胆的免疫反应受到抑制。ACP和AKP参与免疫防御机制,与水生动物的免疫能力相关[34]。LZM通过水解破坏细菌,消除侵入体内的异物,从而起到防御作用[35]。在中华绒螯蟹中干扰Caspase-8抑制了溶菌酶(LZM)相关抗菌肽表达,说明其在非脊椎动物免疫系统中可能直接影响LZM活性[36]。在本研究中,Caspase-8的干扰未显著影响ACP、AKP和LZM的活性。这与上述研究不一致,可能是因为物种不同。在中间球海胆中,这些酶主要参与抵抗外来细菌等异物的免疫防御,而不直接参与细胞凋亡过程。
4 结论
1)本研究中成功克隆了中间球海胆Caspase-8基因全长cDNA序列,Caspase-8氨基酸序列与拟球海胆一致性最高,表明二者具有密切亲缘关系。
2)Caspase-8基因在6个组织、9个发育阶段中均有表达,其中体腔细胞组织中表达水平最高,胚胎发育过程中的8细胞期表达最高,在原肠胚期表达不显著。表明该基因在中间球海胆免疫防御系统中具有重要作用。
3)在干扰Caspase-8 48 h后发现,Caspase-8在体腔细胞组织中的干扰率最高;Caspase-3在肠道中的干扰率最高,其次是体腔细胞,说明中间球海胆中Caspase-8与Caspase-3可能存在调控关系。
4)在干扰48 h后,免疫酶(SOD、CAT、POD和GSH-Px)的活性水平降低,而ACP、AKP和LZM无显著性变化,表明Caspase-8可能参与中间球海胆的免疫过程。
[1] CHAKRABORTY C,NANDI S S,SINHA S,et al.Retraction notice:zebrafish caspase-3:molecular cloning,characterization,crystallization and phylogenetic analysis[J].Protein &Peptide Letters,2012,19(9):1010.
[2] MEIER P,FINCH A,EVAN G.Apoptosis in development[J].Nature,2000,407(6805):796-801.
[3] NICHOLSON D W,THORNBERRY N A.Caspases:killer proteases[J].Trends in Biochemical Sciences,1997,22(8):299-306.
[4] PHILCHENKOV A.Caspases:potential targets for regulating cell death[J].Journal of Cellular and Molecular Medicine,2004,8(4):432-444.
[5] VINCENZ C,DIXIT V M.Fas-associated death domain protein interleukin-1beta-converting enzyme 2 (FLICE2),an ICE/Ced-3 homologue,is proximally involved in CD95- and p55-mediated death signaling[J].The Journal of Biological Chemistry,1997,272(10):6578-6583.
[6] LIU X S,ZOU H,SLAUGHTER C,et al.DFF,a heterodimeric protein that functions downstream of caspase-3 to trigger DNA fragmentation during apoptosis[J].Cell,1997,89(2):175-184.
[7] THORNBERRY N A,LAZEBNIK Y.Caspases:enemies within[J].Science,1998,281(5381):1312-1316.
[8] ECKHART L,BALLAUN C,UTHMAN A,et al.Identification and characterization of a novel mammalian caspase with proapoptotic activity[J].Journal of Biological Chemistry,2005,280(42):35077-35080.
[9] FERNANDES-ALNEMRI T,ARMSTRONG R C,KREBS J,et al.In vitro activation of CPP32 and Mch3 by Mch4,a novel human apoptotic cysteine protease containing two FADD-like domains[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(15):7464-7469.
[10] BARNHART B C,LEE J C,ALAPPAT E C,et al.The death effector domain protein family[J].Oncogene,2003,22(53):8634-8644.
[11] FAN T J,HAN L H,CONG R S,et al.Caspase family proteases and apoptosis[J].Acta Biochimica et Biophysica Sinica,2005,37(11):719-727.
[12] CREAGH E M.Caspase crosstalk:integration of apoptotic and innate immune signalling pathways[J].Trends in Immunology,2014,35(12):631-640.
[13] LI S,LI J F,PENG W J,et al.Characterization of the responses of the caspase 2,3,6 and 8 genes to immune challenges and extracellular ATP stimulation in the Japanese flounder (Paralichthys olivaceus)[J].BMC Veterinary Research,2019,15(1):20.
[14] FU S L,DING M M,WANG J R,et al.Identification and functional characterization of three caspases in Takifugu obscurus in response to bacterial infection[J].Fish &Shellfish Immunology,2020,106:252-262.
[15] WANG T Y,LIN P,WANG Y L,et al.FADD cooperates with Caspase-8 to positively regulate the innate immune response and promote apoptosis following bacterial infection in Japanese eel[J].Fish &Shellfish Immunology,2025,157:110110.
[16] REYES-BECERRIL M,SANCHEZ V,DELGADO K,et al.Caspase-1,-3,-8 and antioxidant enzyme genes are key molecular effectors following Vibrio parahaemolyticus and Aeromonas veronii infection in fish leukocytes[J].Immunobiology,2018,223(10):562-576.
[17] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
CHANG Y Q,DING J,SONG J,et al.Biological research and culture of sea cucumber and sea urchin[M].Beijing:Ocean Press,2004.(in Chinese)
[18] KELLY M S,HUNTER A J,SCHOLFIELD C L,et al.Morphology and survivorship of larval Psammechinus miliaris (Gmelin) (Echinodermata:Echinoidea) in response to varying food quantity and quality[J].Aquaculture,2000,183(3/4):223-240.
[19] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
[20] 李太武,徐善良,王仁波,等.虾夷马粪海胆黑嘴病的初步研究[J].海洋科学,2000,24(3):41-44.
LI T W,XU S L,WANG R B,et al.Preliminary studies on the black mouth disease of sea Urchin,Strongylocentrotus intermedius (Strongylocentrotidae Echinoidea)[J].Marine Sciences,2000,24(3):41-44.(in Chinese)
[21] 王斌,李岩,李霞,等.中间球海胆“红斑病” 病原弧菌致病机理的研究[J].大连水产学院学报,2005,20(1):11-15.
WANG B,LI Y,LI X,et al.Pathogenic mechanism of the causative Vibrio found in “red spotting” diseased sea urchin Strongylocentroyus intermedius[J].Journal of Dalian Fisheries University,2005,20(1):11-15.(in Chinese)
[22] 吴玉青,罗鑫,王鑫莹,等.金鱼Caspase-8多克隆抗体的制备[J].浙江师范大学学报(自然科学版),2024,47(2):196-203.
WU Y Q,LUO X,WANG X Y,et al.Preparation of polyclonal antibody against Caspase-8 in goldfish (Carassius auratus)[J].Journal of Zhejiang Normal University (Natural Sciences Edition),2024,47(2):196-203.(in Chinese)
[23] 宋子曦.柱状黄杆菌感染对虹鳟鳃组织结构和功能影响的研究[D].武汉:华中农业大学,2022.
SONG Z X.Study on the influence of Flavobacterium columniform infection on the gill structure and function of rainbow trout[D].Wuhan:Huazhong Agricultural University,2022.(in Chinese)
[24] MENG F Y, MAI K S, MA H M, et al.The Evolution of Echinoderm Immunology[J].Progress in Biochemistry &Biophysics, 2009, 36(7):803-809.
[25] SONG X R,WANG H,XIN L S,et al.The immunological capacity in the larvae of Pacific oyster Crassostrea gigas[J].Fish &Shellfish Immunology,2016,49:461-469.
[26] SILVA J R.The onset of phagocytosis and identity in the embryo of Lytechinus variegatus[J].Developmental and Comparative Immunology,2000,24(8):733-739.
[27] 高彦军,林红卫,王在强,等.Fas/FasL途径在PM2.5诱导肺泡上皮细胞凋亡中的作用及机制[J].山西医科大学学报,2022,53(4):428-435.
GAO Y J,LIN H W,WANG Z Q,et al.Role of Fas/FasL pathway in PM2.5-induced apoptosis of alveolar epithelial cells and its mechanism[J].Journal of Shanxi Medical University,2022,53(4):428-435.(in Chinese)
[28] ZHUANG S G,LYNCH M C,KOCHEVAR I E.Caspase-8 mediates caspase-3 activation and cytochrome c release during singlet oxygen-induced apoptosis of HL-60 cells[J].Experimental Cell Research,1999,250(1):203-212.
[29] MILHAS D,CUVILLIER O,THERVILLE N,et al.Caspase-10 triggers Bid cleavage and caspase cascade activation in FasL-induced apoptosis[J].The Journal of Biological Chemistry,2005,280(20):19836-19842.
[30] ZANG Y Q,TIAN X L,DONG S L,et al.Growth,metabolism and immune responses to evisceration and the regeneration of viscera in sea cucumber,Apostichopus japonicus[J].Aquaculture,2012,358:50-60.
[31] 丁文君,丁君,孟凌峰.Cu(Ⅱ)对海胆免疫相关酶活性的影响及其在壳中蓄积量的研究[J].大连海洋大学学报,2015,30(2):165-169.
DING W J,DING J,MENG L F.Bioaccumulation and effect of Cu(Ⅱ) on serum immune- related enzyme activities in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2015,30(2):165-169.(in Chinese)
[32] 丁君,常亚青,孙巍.虾夷马粪海胆谷胱甘肽过氧化物酶、谷胱甘肽硫转移酶基因的克隆与表达分析[J].海洋科学进展,2011,29(sup 1):67-79.
DING J,CHANG Y Q,SUN W.Molecular cloning and expression of glutathione peroxidase and glutathione S-transferases genes from sea vrchin (Strongylocentrotus intermedius)[J].Advances in Marine Science,2011,29(sup 1):67-79.(in Chinese)
[33] SUN J X,WANG S C,CAO Y R,et al.Cadmium exposure induces apoptosis,inflammation and immunosuppression through CYPs activation and antioxidant dysfunction in common carp neutrophils[J].Fish &Shellfish Immunology,2020,99:284-290.
[34] MAZORRA M T,RUBIO J A,BLASCO J.Acid and alkaline phosphatase activities in the clam Scrobicularia plana:kinetic characteristics and effects of heavy metals[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2002,131(2):241-249.
[35] SHIMIZU M,KOHNO S,KAGAWA H,et al.Lytic activity and biochemical properties of lysozyme in the coelomic fluid of the sea urchin Strongylocentrotus intermedius[J].Journal of Invertebrate Pathology,1999,73(2):214-222.
[36] WANG G Y,SHEN G Q,XU C H,et al.Caspase-8 promotes innate immunity in the Chinese mitten crab by regulating the expression of antimicrobial peptides and apoptosis in hemocyte[J].Developmental &Comparative Immunology,2025,162:105308.