弧菌(Vibrio spp.)作为革兰氏阴性菌的典型代表,广泛分布于河口、近海等水生生态系统,多数以游离态参与物质循环,少数通过Ⅲ型分泌系统、黏附素等毒力因子与真核宿主建立致病或共生关系,并在宿主与环境界面上定植[1]。常见的水生病原弧菌包括副溶血弧菌(V.parahaemolyticus)、溶藻弧菌(V.alginolyticus)、鳗弧菌(V.anguillarum)、哈维氏弧菌(V.harveyi)、创伤弧菌(V.vulnificus)、霍乱弧菌(V.cholerae)、坎贝氏弧菌(V.campbellii)、费氏弧菌(V.fischeri)及河流弧菌(V.fluvialis)等。弧菌是水产养殖领域的重要病原菌,可侵染鱼类(如大黄鱼弧菌病)、甲壳类(如对虾急性肝胰腺坏死症)和贝类(如鲍鱼脓疱病)等经济物种,引发体表溃疡、组织坏死及系统性败血症等病症,给产业造成巨大经济损失[1]。
弧菌在宿主体内和养殖环境中形成的生物被膜是其实现长期存活和慢性感染的关键毒力因子。目前,弧菌病的防控主要依赖抗生素治疗、疫苗免疫和益生菌应用等策略[1]。然而,抗生素滥用易导致多重耐药菌株出现,疫苗保护率受限于血清型多样性,且防控效果呈现区域性差异,这些情况严重限制了传统策略的应用效果[1]。因此,开发基于生物防治和生态调控等非抗生素防控策略显得尤为必要。深入解析生物被膜的形成机制、结构特征及其生物学功能,不仅有助于阐明细菌的耐药机制和感染传播规律,更为开发新型防控策略提供了理论支撑。近年来,针对生物被膜抑制剂开发抗菌制剂已取得重要进展,体现出弧菌防控策略正从“病原杀灭”向“生物被膜微生态调控”转变,这种策略转变为减少抗生素使用、降低药物残留对水生态环境的影响提供了新思路,有利于维护水生生态系统的平衡与稳定。因此,开发高效、安全的弧菌生物被膜抑制剂已成为水产养殖病害防控领域亟待解决的关键科学问题。
1 生物被膜
1.1 生物被膜的形成及组成
生物被膜是细菌等微生物通过吸附于生物或非生物表面,并分泌胞外聚合物(extracellular polymeric substances,EPS)而形成的具有三维结构的微生物群落。其形成过程可分为四个关键阶段:初始附着、不可逆附着、生物被膜成熟和生物被膜分散(图1)。在初始附着阶段,浮游细菌通过可逆性黏附作用靠近生物或非生物表面;随后,细菌分泌群体感应分子和黏性基质,实现从可逆附着向不可逆附着的转变[2-3]。在成熟阶段,细菌大量繁殖并分泌EPS,形成稳定的三维结构,显著增强其对环境胁迫的抗性。最终,部分细菌从成熟的生物被膜中游离出来,重新进入浮游状态,形成“浮游态-生物被膜态”的动态循环[4]。
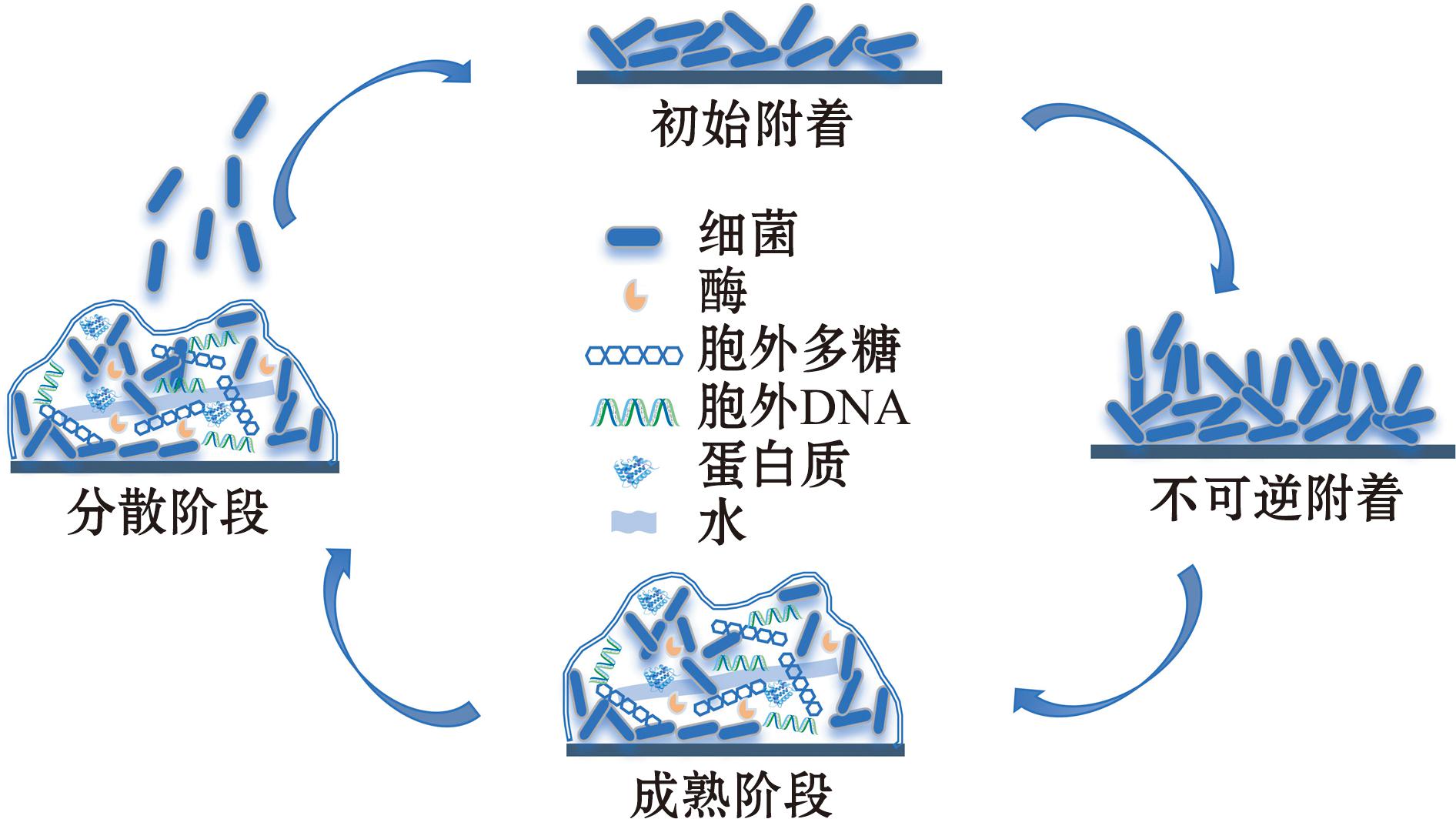
图1 生物被膜的形成过程及组成
Fig.1 Life cycle and composition of biofilms
生物被膜的主要成分包括脂蛋白、表面蛋白、多糖基质、胞外DNA和水等,这些成分通过静电力、疏水作用及化学键等相互作用黏连在细胞表面及细胞间。胞外聚合物是生物被膜的核心组分,由胞外多糖、蛋白质、胞外DNA和脂质等构成[2]。胞外聚合物不仅为生物被膜内的细菌提供结构支撑和稳定性,还通过促进细胞间相互作用,增强对有机物、金属离子及化学污染物的吸附能力,从而确保生物被膜在复杂环境中的持久性和功能性[2]。范德华相互作用、静电作用、离子吸引力和氢键,促进了胞外多糖合成及维持生物被膜基质结构和稳定性所需的蛋白质、离子的相互作用[5]。胞外蛋白与胞外多糖和核酸成分相互作用,从而有助于生物被膜基质稳定、表面定植及维持生物被膜的完整性和结构[6]。胞外DNA作为胞外基质的关键成分之一,在生物被膜内的微生物聚集过程中发挥重要作用[7]。
1.2 生物被膜形成的调控因素
弧菌生物被膜的形成受多种基因及信号通路的调控。主要包括群体感应(quorum sensing,QS)系统、环二鸟苷酸(c-di-GMP)信号、鞭毛、菌毛、多糖及全局转录调控因子等。
1)群体感应。群体感应是一种细胞密度依赖的细菌通讯机制,广泛存在于细菌中,用于精确调控基因表达和群体行为。细菌通过感知自诱导剂(autoinducers,AIs)的浓度变化,响应环境信号,从而调节基因表达,优化其生长、定植、感染及生物被膜形成等生理过程[8-9]。弧菌QS系统中LuxR及其同源物包括副溶血弧菌中的OpaR、哈维氏弧菌中的LuxR、霍乱弧菌中的HapR及创伤弧菌中的SmcR,其可通过结合其靶基因启动子并激活生物被膜相关基因的转录来调控生物被膜形成及细菌群体行为[10]。其中,LuxR和AphA是QS系统的核心转录因子,二者通过动态平衡低细胞密度(low cell density,LCD)和高细胞密度(high cell density,HCD)下的基因表达,协同调控多种QS相关基因[10-11]。
以副溶血弧菌为例,目前已鉴定出3种不同QS系统:1) CAI-1系统。由CqsS受体感知CAI-1自诱导剂,并通过CqsA/S系统进行信号传递。2)AI-2系统。由LuxS合成AI-2信号分子,LuxP/Q作为受体感知信号。3)HAI-1系统。由LuxM合成HAI-1自诱导剂,LuxN作为受体感知信号。在LCD下,AphA主导调控,而在HCD下,OpaR被激活,二者共同调控生物被膜形成、毒力因子合成及运动性等生理过程。其中,OpaR可正调控菌落不透明性和黏附因子的表达,进而影响生物被膜的形成。AphA和OpaR还可直接或间接调控环二鸟苷酸和多糖的合成,从而调节生物被膜的发育[10]。QsvR作为一种AraC型转录调节因子,直接调控AphA和OpaR的表达,并参与QS级联反应[12]。具体而言,QsvR通过抑制aphA转录和激活opaR转录,整合到QS调控网络中。同时,AphA在LCD下抑制qsvR转录,而OpaR在HCD下激活其转录,形成反馈调控环路。QsvR与OpaR协同作用,抑制生物被膜形成和c-di-GMP合成,同时促进荚膜多糖(capsular polysaccharide,CPS)的合成[13]。此外,QsvR和OpaR共同激活Ⅳ型菌毛基因(如pilA)、荚膜多糖合成基因(如cps)及scrG基因的转录,同时抑制scrA基因的表达。OpaR还负向调控与胞外聚合物合成相关基因的转录[13]。此外,ToxR作为膜结合调控蛋白,其表达受QS核心调控因子AphA的调控,并进一步影响生物被膜的形成[14]。
2)环二鸟苷酸。环二鸟苷酸是细菌中广泛存在的第二信使,参与调控多种生理过程,包括运动性、生物被膜形成及毒力等。c-di-GMP的细胞内浓度由两类酶动态调控:GGDEF结构域蛋白(鸟苷酸环化酶)负责c-di-GMP的合成,而EAL或HD-GYP结构域蛋白(磷酸二酯酶)则介导其降解[15]。研究表明,c-di-GMP的水平与细菌表型转换密切相关:低浓度c-di-GMP促进细菌的游动和群集运动,而高浓度c-di-GMP则诱导细菌表面附着和生物被膜的形成[16]。
副溶血弧菌中VPA0198、GefA和GefB是关键的GGDEF结构域蛋白,参与c-di-GMP的合成调控。研究发现,缺失vpa0198和gefB基因会显著降低c-di-GMP的细胞内浓度,并抑制生物被膜形成[17-19];GefA通过抑制侧鞭毛基因(如lafA)的表达,同时激活胞外多糖合成基因(如cpsA),促进细菌从运动表型向附着表型的转换[18]。OpaR作为群体感应系统的核心调控因子,能够直接抑制c-di-GMP合成相关基因的转录,导致c-di-GMP浓度下降,从而抑制生物被膜形成[20]。进一步研究表明,c-di-GMP信号通过调控鞭毛马达蛋白YcgR的活性,影响细菌的泳动和群集运动能力。低c-di-GMP水平下,YcgR与鞭毛马达的解离增强,从而增强细菌的运动性[21-22]。
3)鞭毛。鞭毛在弧菌的运动、定植、黏附、生物被膜形成及毒力等多种生理过程中发挥关键作用。c-di-GMP通过调控鞭毛相关蛋白的活性影响细菌表型转换。高c-di-GMP水平激活YcgR蛋白,后者与鞭毛马达相互作用,降低鞭毛旋转速度并增加方向反转频率,从而抑制细菌运动性[22]。同时,c-di-GMP通过激活CsgD转录因子,抑制鞭毛基因(如fliA)的表达,促进细菌从运动表型向附着表型转换[22]。在副溶血弧菌中,极性鞭毛基因缺失株(ΔflgD和ΔflgE )的生物被膜形成能力显著降低,其生物被膜发育停滞于单层阶段[23]。此外,创伤弧菌中鞭毛同源蛋白FlaE和FlaF虽不参与鞭毛的组装,但在生物被膜形成中起重要作用,其突变株在生物被膜形成方面明显受损[24]。
4)菌毛。Ⅳ型菌毛(Type Ⅳ pili,T4P)在细菌从浮游态向附着态转变过程中起重要作用,通过机械收缩增强细菌的表面附着力和微菌落形成能力[25]。副溶血弧菌中AphA和OpaR参与调控mshA1(MSHA菌毛蛋白编码基因)的转录并协调菌毛介导的附着行为。AphA在LCD下间接抑制mshA1转录,而OpaR在HCD下直接结合mshA1启动子区域,激活其表达[26]。创伤弧菌中,PilA(T4P主要结构蛋白)的缺失导致生物被膜形成能力显著下降,并显著减弱其对HEp-2细胞的黏附能力和毒力[27]。此外,创伤弧菌基因组编码的3组紧密黏附(Tad)菌毛(tad-1、tad-2和tad-3)中,tad-3的表达显著增强细菌的初始附着和自体聚集能力,并提升生物被膜对机械清除的抗性[28]。
5)多糖。多糖是弧菌生物被膜的主要成分,其包括荚膜多糖和胞外多糖。作为生物被膜中最普遍的组成成分,胞外多糖通过将细菌细胞聚集并固定于表面,促进生物被膜的稳定性和环境抗性[29]。同时,细胞外蛋白、细胞外DNA和膜融合蛋白(Mfp)等其他成分也在生物被膜形成中发挥作用[30]。在副溶血性弧菌中,cpsA-K和scvA-O基因簇负责胞外多糖的合成。AphA通过正向调控cpsA-K和scvA-O的转录,影响胞外多糖的产生[31]。另外,H-NS作为全局转录调控因子,直接激活cpsA操纵子的表达,使胞外多糖产量显著增加[31]。Ⅵ型分泌系统的结构蛋白IcmF2通过促进细胞外DNA(eDNA)和细胞外蛋白的分泌,增强生物被膜基质的机械强度和抗逆性[32]。
6)sRNA等其他调控因子。小分子非编码RNA和RNA结合蛋白(RNA binding protein,RBP)在细菌转录后调控中起重要作用[33]。小分子非编码RNA(sRNAs)作为一种新兴的基因表达调控因子,在细菌毒力、致病性及生理代谢过程中起着至关重要的作用[34]。RBP可以与细胞中的RNA结合,包括sRNA[35]。其中,ProQ是一种关键的RBP,在溶藻弧菌中,proQ基因的缺失导致生物被膜形成能力下降。ProQ通过调控鞭毛相关基因(如flgC和flgE)的表达,影响生物被膜的形成[36]。副溶血弧菌包含的5种Qrr sRNA通过调控OpaR的表达,影响荚膜多糖合成、运动性及代谢水平。RpoN(σ54因子)作为全局转录调控因子,控制鞭毛合成和胞外多糖产生。rpoN基因的缺失导致生物被膜分离失败、鞭毛缺失及运动能力下降,表明其在生物被膜动态平衡中具有关键作用[37]。
图2总结了副溶血弧菌生物被膜形成的调控网络。然而,不同弧菌物种的生物被膜形成机制存在一定差异,这些差异可能与其适应特定生态位和环境条件的能力密切相关。
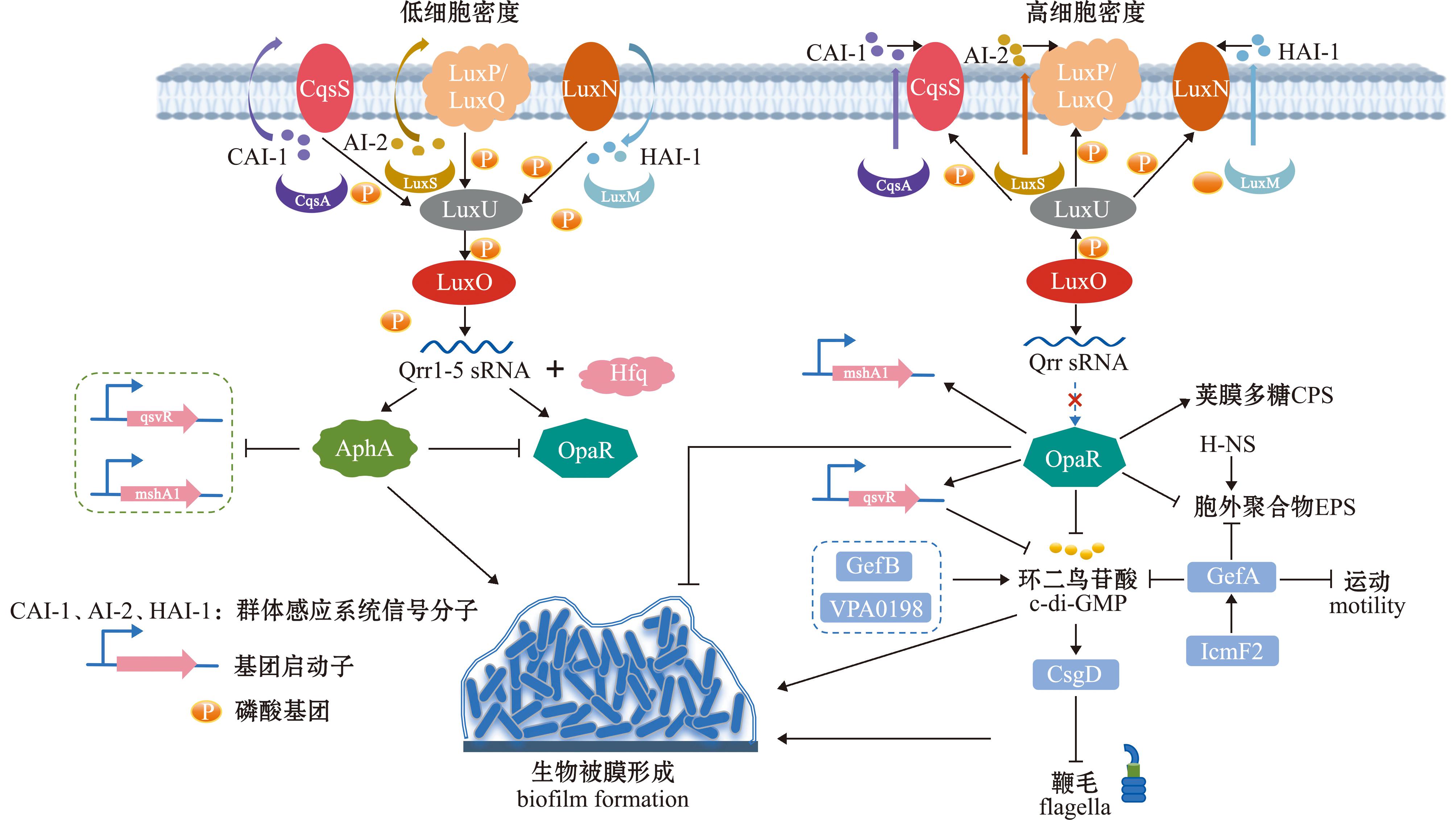
图2 副溶血弧菌生物被膜调控网络
Fig.2 Regulatory network of Vibrio parahaemolyticus biofilm
1.3 生物被膜抑制机理
目前,关于弧菌生物被膜抑制策略主要集中在以下三个方面:1)阻断细菌附着。细菌在物体表面的附着是生物被膜形成的初始步骤,抑制附着可有效阻断生物被膜的发育。研究表明,粪肠球菌Z096能够通过分泌代谢产物干扰副溶血弧菌的表面附着,其提取物Z096-E在1.6 mg/mL浓度下可抑制副溶血弧菌群集和泳动能力[38]。2)抑制或破坏EPS。EPS主要为细菌提供物理屏障,阻挡抗菌药物的渗透,降低其杀菌效果[2]。针对EPS主要成分(如蛋白质、多糖、脂质和eDNA等)进行清除或破坏,是抑制生物被膜形成的重要策略。3)干扰群体感应系统。QS系统通过调控LuxR及其同源蛋白(如OpaR、HapR)控制生物被膜形成的关键基因表达。卤代呋喃酮(红海藻提取物)通过干扰AI-2信号分子,抑制哈维氏弧菌生物被膜形成[39]。此外,c-di-GMP信号通路作为QS的下游调控网络,可通过降低c-di-GMP水平,抑制生物被膜形成。
1.4 弧菌生物被膜抑制剂的种类
生物被膜抑制和清除方法包括使用抗生素、表面改性和物理去除等。根据《水产养殖养殖用药明白纸(2024年2号)》,目前批准用于水产养殖的药物包括抗菌药、抗真菌药、抗寄生虫药、消毒剂、中成药、疫苗、维生素、激素和其他类。结合已有科学研究,可将弧菌生物被膜抑制剂归纳为6类(表1):抗生素(如多粘菌素B、氨苄西林、头孢他啶等[40])、消毒剂类(如苯扎氯铵、二氧化氯、次氯酸钠等[41])、防腐剂类(如亚硝酸钠、聚赖氨酸等[42])、中药类(如桃金娘、连翘乙酸乙酯提取物[43])、化学合成类(如合成大麻素HU-2100[44])及天然产物类(如肉桂醛、姜黄素[45-46])。这些抑制剂主要针对副溶血弧菌、溶藻弧菌和哈维氏弧菌等水产病原菌,作用机制多样。消毒剂通过直接清除生物被膜并杀灭细菌[41],防腐剂通过干扰细胞聚集、抑制胞外多糖合成发挥作用[42],化学合成与天然产物类则主要通过干扰群体感应系统阻断细菌信号传导[44]。部分抗生素和中药类抑制剂的分子机制尚未完全阐明(部分研究未提及)。
表1 弧菌生物被膜抑制剂分类
Tab.1 Classification of Vibrio biofilm inhibitors

种类type名称name目标细菌target bacteria抑制机理mechanism of inhibition参考文献reference抗生素 antibiotic多粘菌素B、氨苄西林、头孢他啶、头孢噻肟、氧氟沙星副溶血弧菌未提及Cai等[40]消毒剂类 disinfectant苯扎氯铵、二氧化氯、过氧乙酸、二氯异氰尿酸钠、次氯酸钠副溶血弧菌清除生物被膜并使细菌死亡Zhu等[41]防腐剂类 preservative亚硝酸钠、山梨酸钾、脱氢乙酸钠、聚赖氨酸副溶血弧菌影响细胞聚合与表面黏附;抑制胞外多糖Lei等[42]中药类 traditional Chinese medicine桃金娘、连翘乙酸乙酯提取物溶藻弧菌未提及Li等[43]化学合成类 chemical synthesis合成大麻素HU-210哈维氏弧菌干扰群体感应Soni等[44]天然产物类 natural product肉桂醛、姜黄素副溶血弧菌干扰群体感应Wang等[47]、 Packiavathy等[45]
2 天然产物类弧菌生物被膜抑制剂
抗生素的广泛使用不仅加剧了细菌耐药性问题,还对生态环境和人类健康构成威胁。因此,开发天然、绿色、安全的生物被膜抑制剂成为当前研究的热点。天然产物因其结构多样性、低毒性和低耐药性诱导风险,在生物被膜防控中展现出巨大潜力。根据其来源,天然产物可分为植物来源、动物来源、海洋来源和微生物来源四大类。
2.1 植物来源的弧菌生物被膜抑制剂
植物是天然产物的重要来源之一,其提取物通过多靶点作用抑制弧菌生物被膜的形成。其中,中草药因其资源丰富,且具有药效持续、来源广泛、成本低廉、毒副作用小及耐药性低等特点被广泛关注。表2总结了包括中草药在内的不同植物来源的弧菌生物被膜抑制剂及其最小抑菌浓度(minimal inhibitory concentration,MIC),这些植物通过多种机制(如抑制QS,减少胞外多糖合成等)发挥抗生物被膜作用。
表2 植物来源的弧菌生物被膜抑制剂
Tab.2 Plant-derived Vibrio biofilm inhibitors

抗生物被膜物质anti-biofilm substance来源source目标细菌target bacteria最小抑菌浓度MIC抑制机理mechanism of inhibition参考文献reference苦参提取物苦参副溶血弧菌0.25 mg/mL减少PIA和胞外DNA分泌Zhao等[48]五味子提取物五味子副溶血弧菌1.25 mg/mL减少PIA和胞外DNA分泌Zhang等[46]百里香醌黑种草副溶血弧菌25 mg/L减少细菌间聚集和黏附Guo等[49]槲皮素槲皮副溶血弧菌220 μg/mL切断细胞接触,诱导细胞裂解Bai等[50]柠檬草精油柠檬草副溶血弧菌80 μg/ mL诱导细胞裂解孙杨[51]白藜芦醇葡萄副溶血弧菌20 μg/ mL干扰群体感应冯芳等[52]圣罗勒提取物圣罗勒副溶血弧菌、哈维氏弧菌、创伤弧菌25 mg/mL干扰群体感应,减少胞外多糖产生Issac Abraham等[53]香芹酚精油香芹副溶血弧菌0.375μg/mL破坏细胞壁和细胞膜完整性Xu等[54]姜黄素姜黄副溶血弧菌、哈维氏弧菌、创伤弧菌150 μg/mL、150 μg/mL、300 μg/mL干扰群体感应Packiavathy等[45]公丁香、重楼乙酸乙酯提取物公丁香、重楼溶藻弧菌12.5 mg/mL未提及Li等[43]罗勒精油罗勒副溶血弧菌、创伤弧菌、霍乱弧菌、溶藻弧菌0.023 mg/mL干扰群体感应Snoussim等[55]胡椒乙酸乙酯提取物胡椒哈维氏弧菌1 600 μg/ mL干扰群体感应Srinivasan等[56]柠檬苦素柑橘哈维氏弧菌未提及影响LuxO表达Vikram等[57]
研究发现,五味子提取物[46]能有效减少多糖细胞间黏附素的合成和细胞外DNA的分泌,从而抑制副溶血弧菌生物被膜的形成。公丁香和重楼的乙酸乙酯提取物对溶藻弧菌生物被膜的形成有明显抑制作用[43]。100 μg/mL的姜黄素[45]对哈维氏弧菌、副溶血弧菌和创伤弧菌生物被膜抑制率分别达到69%、56%和79%,并且对3种弧菌成熟的生物被膜具有一定清除能力,姜黄素还能显著抑制胞外多糖产生,在100 μg/mL浓度下,对哈维氏弧菌、副溶血弧菌和创伤弧菌的胞外多糖产量抑制率分别为61%、71%和62%。通过光学显微镜观察发现,姜黄素作用后生物被膜的厚度和微菌落数量显著减少。
苦参碱[48]提取物(Sophorae Flavescentis Radix,KSE)能够减少副溶血弧菌多糖细胞间黏附素(polysaccharide intercellular adhesin,PIA)的合成和胞外DNA分泌,从而抑制生物被膜形成。1.0 mg/mL的KSE对生物被膜形成的抑制率和成熟生物被膜的清除率分别为85.32%和74.04%,发育中和成熟生物被膜代谢活性分别降低77.98%和74.46%。圣罗勒提取物[53]可以通过干扰QS系统减少胞外多糖产生,从而抑制生物被膜的形成。在提取物12 mg/mL时,哈维氏弧菌、副溶血弧菌和创伤弧菌的胞外多糖分别降低 91%、68%和82%。这些研究表明,植物提取物通过多靶点、多机制的作用方式,在抑制弧菌生物被膜形成和清除成熟生物被膜方面展现出显著潜力,为开发绿色、高效的弧菌防控策略提供了重要依据。
2.2 动物和海洋来源的弧菌生物被膜抑制剂
动物来源的天然产物在医药、食品、化妆品等领域具有广泛应用。抗菌肽是一类具有抗菌活性的小分子多肽,广泛存在于生物界[58],动物来源的抗菌肽生物被膜抑制剂具有多种作用机制和应用前景。窦宝杰等[59]从泥鳅中分离的抗菌肽M1抑制鳗弧菌的IC50值为15.76 mg/mL,其可抑制鳗弧菌的生长,减少鳗弧菌生物被膜的形成。卵黄抗体(immunoglobulin of yolk,IgY)是一种免疫球蛋白,主要存在于禽类、两栖动物及爬行动物的血清当中,浓度高于5 mg/mL的特异性卵黄抗体能够抑制创伤弧菌的黏附作用,影响其生物被膜的形成[60]。酒糟大黄鱼抗菌肽FAH34能够破坏副溶血弧菌的细胞膜,对副溶血弧菌具有较强的抑菌作用,但并未证实其对生物被膜有抑制作用[61]。由于成分复杂、提取难度大且成本较高等因素制约了动物来源的弧菌生物被膜抑制剂的研究进展,目前相关研究仍处于初步阶段,未来需结合现代生物技术(如基因工程和代谢工程),深入挖掘动物来源抑制剂的潜力。
海洋天然产物因其独特的化学结构和生物活性,在生物被膜防控中备受关注。如来自红树林生态系统的稀有海洋放线菌RMA46的有机提取物能够抑制霍乱弧菌群体感应调节因子LuxO、HapR及生物被膜的形成,同时不具备杀菌性和细胞毒性[62]。此外,海洋中的虾、蟹等甲壳类动物外壳富含壳聚糖,壳聚糖能够通过与弧菌表面的负电荷相互作用,改变细菌细胞膜的通透性,干扰其代谢过程,从而抑制弧菌生物被膜的形成[63]。红海藻中的卤代呋喃酮通过干扰群体感应系统,抑制哈维氏弧菌生物被膜的形成[39]。
2.3 微生物来源的弧菌生物被膜抑制剂
微生物来源的生物被膜抑制剂是一类具有抑制细菌生物被膜形成或破坏已形成生物被膜能力的物质,它们主要来源于微生物的代谢产物,具有易培养、适应性强、无耐药性等优点,作为一种环境友好的抗生素替代物,可通过干扰弧菌群体感应代谢通路,抑制生物被膜的形成。表1列出了8类微生物来源弧菌生物被膜抑制剂及其作用机制,包括地衣芽孢杆菌乙酸乙酯提取物[64]、粪肠球菌Z096-E[38]、鼠李糖乳杆菌MS1乙酸乙酯提取物[65]等,这些抑制剂针对溶藻弧菌、副溶血弧菌、哈维氏弧菌等水产病原菌,作用机制多样,如地衣芽孢杆菌提取物[64]通过降解群体感应信号分子C6HSL抑制溶藻弧菌生物被膜;鼠李糖乳杆菌MS1提取物[65]和LQLY3-1肽[66]则通过干扰群体感应系统分别作用于副溶血弧菌和哈维氏弧菌;苯乳酸通过抑制鞭毛合成阻断副溶血弧菌的黏附能力;0.4 mg/mL的戊糖乳杆菌DF9乙酸乙酯提取物(DF9-QSI)[67]可通过抑制副溶血弧菌的AI-2活性,靶向干扰其QS系统,且对副溶血弧菌生物被膜的抑制率为可达44%。此外,DF9-QSI能明显影响副溶血弧菌鞭毛和菌毛的功能,减弱细菌在早期的转移、黏附和成膜能力。
表3 微生物来源的弧菌生物被膜抑制剂
Tab.3 Microbial-derived Vibrio biofilm inhibitors

抗生物被膜物质anti-biofilm substance来源source目标细菌target bacteria抑制机理mechanism of inhibition参考文献reference地衣芽孢杆菌乙酸乙酯提取物地衣芽孢杆菌溶藻弧菌降解C6HSLGutierreez等[64]粪肠球菌Z096-E粪肠球菌Z096副溶血弧菌抑制表面附着韩翔鹏等[38]鼠李糖乳杆菌MS1乙酸乙酯提取物鼠李糖乳杆菌MS1副溶血弧菌干扰群体感应上官文丹等[65]戊糖乳杆菌DF9乙酸乙酯提取物戊糖乳杆菌戊糖乳杆菌干扰群体感应上官文丹等[67]苯乳酸白地霉副溶血弧菌抑制鞭毛合成方梅梅[68]LQLY3-1肽乳酸乳球菌哈维氏弧菌干扰群体感应孙梦桐[66]乳酸菌素大菱鲆肠道乳酸菌鳗弧菌、哈维氏弧菌未提及包瑞璇[69]乳酸植物乳杆菌A10副溶血弧菌干扰群体感应彭嘉屹等[70]
3 存在问题及展望
目前,水产养殖业迅速发展,水产病原弧菌病已成为制约其可持续发展的关键瓶颈。水产病原弧菌生物被膜是引发持续感染的关键问题,弧菌生物被膜的形成机制复杂,涉及群体感应、环二鸟苷酸、鞭毛、菌毛、多糖及转录因子等多重信号通路的协同调控。多年来,水产养殖业对抗弧菌生物被膜主要依赖传统抗生素和化学消毒剂。然而,抗生素的滥用导致弧菌产生耐药性,使原本有效的药物逐渐失去效力;化学消毒剂在杀灭病菌的同时,也对养殖水体生态环境造成了严重破坏,影响了水体微生物群落的平衡,增加了后续养殖的潜在风险。因此,天然产物生物被膜抑制剂的应用成为控制水产弧菌生物被膜的必然趋势。
天然产物来源广泛,涵盖植物提取物、动物抗菌肽、微生物代谢产物等,它们往往具有多靶点作用机制,可同时作用于弧菌生物被膜形成过程中的多个关键环节,降低弧菌产生抗性的几率;且其低生态风险的特性,最大限度减少了对养殖环境的负面影响,契合了可持续发展的理念,因此成为当下生物被膜防控的重要研究方向。但是,天然产物抑制剂的开发和利用也存在诸多问题,如一些动植物或微生物资源稀有,来源有限,且其结构复杂,导致化学合成困难、成本较高,限制了其进一步优化并影响生物学评价;部分天然产物产生药理学效应的具体靶标尚未阐明,导致研发瓶颈;水产养殖体系环境复杂,温度、酸碱度、盐度等因素会影响天然产物抑制剂的稳定性和活性。此外,天然产物抑制剂在水体中的降解速度和残留情况也需进一步研究,以避免对养殖环境造成不良影响。
构建绿色综合防控体系是未来水产弧菌生物被膜防控的发展方向。在该领域的深入探索中,多组学技术(转录组、代谢组和蛋白质组联合分析)的整合应用可以全方位、深层次地解析天然产物作用于弧菌生物被膜的分子机制,为后续研发更高效的防控策略奠定坚实基础。新材料中,利用纳米材料包载天然产物,可有效改善其稳定性,保护天然产物免受外界环境因素的破坏,延长其作用时间;同时,通过对纳米材料表面进行修饰,能够实现对弧菌生物被膜的靶向递送,使其精准作用于病灶部位,提高治疗效果的同时,减少对其他正常组织的影响。总之,将这些技术与天然产物联合应用,可实现对弧菌生物被膜的高效、绿色防控。
[1] 邓益琴.水产动物弧菌病及其生物防治研究进展[J].大连海洋大学学报,2023,38(4):553-563.DENG Y Q.Progress in research on vibriosis and biological control in animals in aquaculture:a review[J].Journal of Dalian Ocean University,2023,38(4):553-563.(in Chinese)
[2] FLEMMING H C,VAN HULLEBUSCH E D,LITTLE B J,et al.Microbial extracellular polymeric substances in the environment,technology and medicine[J].Nature Reviews Microbiology,2025,23(2):87-105.
[3] SAUER K,CAMPER A K,EHRLICH G D,et al.Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm[J].Journal of Bacteriology,2002,184(4):1140-1154.
[4] HOFFMAN M D,ZUCKER L I,BROWN P J B,et al.Timescales and frequencies of reversible and irreversible adhesion events of single bacterial cells[J].Analytical Chemistry,2015,87(24):12032-12039.
[5] LEMBRE P,LORENTZ C,DI P.Exopolysaccharides of the biofilm matrix:a complex biophysical world[M]//The Complex World of Polysaccharides.Kandy:InTech,2012.
[6] FONG J N C,YILDIZ F H.Biofilm Matrix Proteins[M].America:Microbiol Spectr.2015.
[7] RATHER M A,GUPTA K,MANDAL M.Microbial biofilm:formation,architecture,antibiotic resistance,and control strategies[J].Brazilian Journal of Microbiology,2021,52(4):1701-1718.
[8] TRIPATHI S,PURCHASE D,GOVARTHANAN M,et al.Regulatory and innovative mechanisms of bacterial quorum sensing-mediated pathogenicity:a review[J].Environmental Monitoring and Assessment,2022,195(1):75.
[9] BARRASSO K,WATVE S,SIMPSON C A,et al.Dual-function quorum-sensing systems in bacterial pathogens and symbionts[J].PLoS Pathogens,2020,16(10):e1008934.
[10] TESCHLER J K,NADELL C D,DRESCHER K,et al.Mechanisms underlying Vibrio cholerae biofilm formation and dispersion[J].Annual Review of Microbiology,2022,76:503-532.
[11] LU R F,OSEI-ADJEI G,HUANG X X,et al.Role and regulation of the orphan Apha protein of quorum sensing in pathogenic Vibrios[J].Future Microbiology,2018,13(3):383-391.
[12] ZHANG Y Q,HU L H,QIU Y,et al.QsvR integrates into quorum sensing circuit to control Vibrio parahaemolyticus virulence[J].Environmental Microbiology,2019,21(3):1054-1067.
[13] ZHANG Y Q,XUE X F,SUN F J,et al.Quorum sensing and QsvR tightly control the transcription of vpa0607 encoding an active RNase Ⅱ-type protein in Vibrio parahaemolyticus[J].Frontiers in Microbiology,2023,14:1123524.
[14] ZHANG Y,DENG Y,FENG J,et al.ToxR modulates biofilm formation in fish pathogen Vibrio harveyi[J].Letters in Applied Microbiology,2022,74(2):288-299.
[15] HOMMA M,KOJIMA S.Roles of the second messenger c-di-GMP in bacteria:Focusing on the topics of flagellar regulation and Vibrio spp[J].Genes to Cells,2022,27(3):157-172.
[16] JENAL U,REINDERS A,LORI C.Cyclic di-GMP:second messenger extraordinaire[J].Nature Reviews Microbiology,2017,15(5):271-284.
[17] ZHOU Y N,CHANG J Y,ZHANG M M,et al.VPA0198,a GGDEF domain-containing protein,affects the motility and biofilm formation of Vibrio parahaemolyticus and is regulated by quorum sensing associated regulators[J].Microbial Pathogenesis,2024,195:106882.
[18] ZHONG X J,LU Z,WANG F,et al.Characterization of GefA,a GGEEF domain-containing protein that modulates Vibrio parahaemolyticus motility,biofilm formation,and virulence[J].Applied and Environmental Microbiology,2022,88(6):e0223921.
[19] ZHOU Y N,CHANG J Y,ZHANG M M,et al.GefB,a GGDEF domain-containing protein,affects motility and biofilm formation of Vibrio parahaemolyticus and is regulated by quorum sensing regulators[J].Gene,2025,933:148968.
[20] ZHANG Y Q,QIU Y,GAO H,et al.OpaR controls the metabolism of c-di-GMP in Vibrio parahaemolyticus[J].Frontiers in Microbiology,2021,12:676436.
[21] MART NEZ-M
NEZ-M NDEZ R,CAMACHO-HERN
NDEZ R,CAMACHO-HERN NDEZ D A,SULVAR
NDEZ D A,SULVAR N-GUEL E,et al.A trigger phosphodiesterase modulates the global c-di-GMP pool,motility,and biofilm formation in Vibrio parahaemolyticus[J].Journal of Bacteriology,2021,203(13):e0004621.
N-GUEL E,et al.A trigger phosphodiesterase modulates the global c-di-GMP pool,motility,and biofilm formation in Vibrio parahaemolyticus[J].Journal of Bacteriology,2021,203(13):e0004621.
[22] GUTTENPLAN S B,KEARNS D B.Regulation of flagellar motility during biofilm formation[J].FEMS Microbiology Reviews,2013,37(6):849-871.
[23] ENOS-BERLAGE J L,GUVENER Z T,KEENAN C E,et al.Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus[J].Molecular Microbiology,2005,55(4):1160-1182.
[24] JUNG Y C,LEE M A,LEE K H.Role of flagellin-homologous proteins in biofilm formation by pathogenic Vibrio species[J].mBio,2019,10(4):e01793-19.
[25] CRAIG L,FOREST K T,MAIER B.Type Ⅳ pili:dynamics,biophysics and functional consequences[J].Nature Reviews Microbiology,2019,17(7):429-440.
[26] SUN J F,LI X,QIU Y,et al.Quorum sensing regulates transcription of the pilin gene mshA1 of MSHA Pilus in Vibrio parahaemolyticus[J].Gene,2022,807:145961.
[27] PARANJPYE R N,STROM M S.A Vibrio vulnificus type Ⅳ pilin contributes to biofilm formation,adherence to epithelial cells,and virulence[J].Infection and Immunity,2005,73(3):1411-1422.
[28] PU M,ROWE-MAGNUS D A.Atad Pilus promotes the establishment and resistance of Vibrio vulnificus biofilms to mechanical clearance[J].NPJ Biofilms and Microbiomes,2018,4:10.
[29] YILDIZ F H,VISICK K L.Vibrio biofilms:so much the same yet so different[J].Trends in Microbiology,2009,17(3):109-118.
[30] LI W,WANG J J,QIAN H,et al.Insights into the role of extracellular DNA and extracellular proteins in biofilm formation of Vibrio parahaemolyticus[J].Frontiers in Microbiology,2020,11:813.
[31] CHEN L,ZHANG M M,LI X,et al.AphA directly activates the transcription of polysaccharide biosynthesis gene scvE in Vibrio parahaemolyticus[J].Gene,2023,851:146980.
[32] HUANG Q L,ZHANG M M,ZHANG Y Q,et al.IcmF2 of the type Ⅵ secretion system 2 plays a role in biofilm formation of Vibrio parahaemolyticus[J].Archives of Microbiology,2024,206(7):321.
[33] VAN ASSCHE E,VAN PUYVELDE S,VANDERLEYDEN J,et al.RNA-binding proteins involved in post-transcriptional regulation in bacteria[J].Frontiers in Microbiology,2015,6:141.
[34] STORZ G,OPDYKE J A,ZHANG A X.Controlling mRNA stability and translation with small,noncoding RNAs[J].Current Opinion in Microbiology,2004,7(2):140-144.
[35] DOS SANTOS R F,ARRAIANO C M,ANDRADE J M.New molecular interactions broaden the functions of the RNA chaperone Hfq[J].Current Genetics,2019,65(6):1313-1319.
[36] FENG R N,CHEN Y,CHEN T X,et al.DUF1127-containing protein and ProQ had opposite effects on biofilm formation in Vibrio alginolyticus[J].BMC Microbiology,2024,24(1):330.
[37] ZHANG N,ZHANG S,REN W,et al.Roles of rpoN in biofilm formation of Vibrio alginolyticus HN08155 at different cell densities[J].Microbiological Research,2021,247:126728.
[38] 韩翔鹏,陈清莹,张杏果,等.粪肠球菌Z096对副溶血弧菌生物被膜及群体感应的抑制作用[J].食品工业科技,2022,43(19):167-176.HANX P,CHEN Q Y,ZHANG X G,et al.Inhibitory effects of Enterococcus faecalis Z096 on biofilm and quorum sensing of Vibrio parahaemolyticus[J].Science and Technology of Food Industry,2022,43(19):167-176.(in Chinese)
[39] KARNJANA K,NOBSATHIAN S,SOOWANNAYAN C,et al.Purification and evaluation of N-benzyl cinnamamide from red seaweed Gracilaria fisheri as an inhibitor of Vibrio harveyi AI-2 quorum sensing[J].Marine Drugs,2020,18(2):80.
[40] 蔡萍瑶.舍曲林对副溶血弧菌的毒力抑制与多粘菌素B耐药性逆转作用研究[D].广州:华南理工大学,2023.CAI P Y.Inhibitory effect of sertraline on Vibrio parahaemolyticus and reversal effect of polymyxin B resistance[D].Guangzhou:South China University of Technology,2023.(in Chinese)
[41] 朱洪日,王佳莹,蒋萌萌,等.副溶血弧菌生物膜的形成及消毒剂的清除作用[J].大连工业大学学报,2019,38(5):327-333.ZHU H R,WANG J Y,JIANG M M,et al.Biofilm formation of Vibrio parahaemolyticus and scavenging effect of disinfectants[J].Journal of Dalian Polytechnic University,2019,38(5):327-333.(in Chinese)
[42] 雷欢,谢婷,魏宇清,等.4种防腐剂对副溶血弧菌生物膜形成的抑制作用[J].食品科学,2017,38(7):6-10.LEI H,XIE T,WEI Y Q,et al.Inhibitory effects of four kinds of food preservatives on biofilm formation by Vibrio parahaemolyticus[J].Food Science,2017,38(7):6-10.(in Chinese)
[43] 李百元,张叶敏,夏晶晶,等.19种中药提取物对海洋致病溶藻弧菌生长和生物被膜的影响[J].天然产物研究与开发,2024,36(6):1013-1021.LI B Y,ZHANG Y M,XIA J J,et al.Effects of 19 Chinese herbal medicines extracts on the growth and biofilm formation of Vibrio alginolyticus[J].Natural Product Research and Development,2024,36(6):1013-1021.(in Chinese)
[44] SONI D,SMOUM R,BREUER A,et al.Effect of the synthetic cannabinoid HU-210 on quorum sensing and on the production of quorum sensing-mediated virulence factors by Vibrio harveyi[J].BMC Microbiology,2015,15:159.
[45] PACKIAVATHY I A S V,SASIKUMAR P,PANDIAN S K,et al.Prevention of quorum-sensing-mediated biofilm development and virulence factors production in Vibrio spp.by curcumin[J].Applied Microbiology and Biotechnology,2013,97(23):10177-10187.
[46] ZHANG Z Y,ZHAO Y N,CAI J,et al.Optimized extraction,identification and anti-biofilm action of wu Wei zi (Fructus schisandrae chinensis) extracts against Vibrio parahaemolyticus[J].Molecules,2023,28(5):2268.
[47] 王硕,邓海潮,郭都,等.反式肉桂醛对副溶血性弧菌毒力因子的抑制作用[J].食品科学,2020,41(15):88-95.WANG S,DENG H C,GUO D,et al.Anti-virulence effect of trans-cinnamaldehyde against Vibrio parahaemolyticus[J].Food Science,2020,41(15):88-95.(in Chinese)
[48] ZHAO Y N,GUO S Y,LI S G,et al.Ultrasonic-assisted extraction,anti-biofilm activity,and mechanism of action of Ku Shen (Sophorae Flavescentis Radix) extracts against Vibrio parahaemolyticus[J].Frontiers in Microbiology,2024,15:1379341.
[49] GUO D,YANG Z Y,ZHENG X Y,et al.Thymoquinone inhibits biofilm formation and attachment-invasion in host cells of Vibrio parahaemolyticus[J].Foodborne Pathogens and Disease,2019,16(10):671-678.
[50] BAI X,CHEN X L,ZHANG D F,et al.Targeted phytogenic compounds against Vibrio parahaemolyticus biofilms[J].Critical Reviews in Food Science and Nutrition,2025,65(9):1761-1772.
[51] 孙杨.柠檬草精油对副溶血性弧菌及其生物被膜的抑制和作用机理研究[D].杭州:浙江工商大学,2022.SUN Y.Inhibitory effect and mechanism of lemon grass essential oil on Vibrio parahaemolyticus and its biofilm[D].Hangzhou:Zhejiang Gongshang University,2022.(in Chinese)
[52] 张芳,朱军莉,冯立芳.基于RNA-Seq技术分析白藜芦醇对副溶血弧菌生物被膜的抑制作用[J].微生物学报,2016,56(5):856-866.ZHANG F,ZHU J L,FENG L F.Inhibition analysis of resveratrol against Vibrio parahaemolyticus biofilm based on RNA-Seq technology[J].Acta Microbiologica Sinica,2016,56(5):856-866.(in Chinese)
[53] ISSAC ABRAHAM S V P,ARUMUGAM V R,MARY N I,et al.Ocimum sanctum as a source of quorum sensing inhibitors to combat antibiotic resistance of human and aquaculture pathogens[J].Life,2024,14(7):785.
[54] 徐臻.香芹酚精油和没食子酸对副溶血性弧菌协同抑制的研究[D].锦州:渤海大学,2023.XU Z.Synergistic inhibition of Vibrio parahaemolyticus by essential oil of carvacrol and gallic acid[D].Jinzhou:Bohai University,2023.(in Chinese)
[55] SNOUSSI M,DEHMANI A,NOUMI E,et al.Chemical composition and antibiofilm activity of Petroselinum crispum and Ocimum basilicum essential oils against Vibrio spp.strains[J].Microbial Pathogenesis,2016,90:13-21.
[56] SRINIVASAN R,SANTHAKUMARI S,RAVI A V.In vitro antibiofilm efficacy of Piper betle against quorum sensing mediated biofilm formation of luminescent Vibrio harveyi[J].Microbial Pathogenesis,2017,110:232-239.
[57] VIKRAM A,JESUDHASAN P R,JAYAPRAKASHA G K,et al.Citrus limonoids interfere with Vibrio harveyi cell-cell signalling and biofilm formation by modulating the response regulator LuxO[J].Microbiology,2011,157(Pt 1):99-110.
[58] 叶星,白俊杰.抗菌肽的研究及其在水产上的应用前景[J].大连水产学院学报,2000,15(4):274-279.YE X,BAI J J.Researches on anti microbial peptides and its application perspective in aquaculture[J].Journal of Dalian Fisheries University,2000,15(4):274-279.(in Chinese)
[59] 窦宝杰,丁闻,卢静,等.泥鳅抗菌肽制备及其抑制致鳗弧菌作用[J].食品研究与开发,2024,45(5):74-80.DOU B J,DING W,LU J,et al.Preparation of antimicrobial peptides from Misgurnus anguillicaudatus and its inhibitory effect on Vibrio anguillarum[J].Food Research and Development,2024,45(5):74-80.(in Chinese)
[60] 俞晶晶.抗创伤弧菌卵黄抗体的制备及特性分析[D].福州:福建师范大学,2022.YU J J.Preparation and characterization of yolk antibody against Vibrio vulnificus[D].Fuzhou:Fujian Normal University,2022.(in Chinese)
[61] 李若冰,刘嘉鑫,金日天,等.酒糟大黄鱼抗菌肽FAH34的抑菌活性及热稳定性[J].中国食品学报,2023,23(12):247-254.LI R B,LIU J X,JIN R T,et al.Antibacterial activity,mechanism and thermal stability of antibacterial peptide FAH34 from distiller’s grains Larimichthys crocea[J].Journal of Chinese Institute of Food Science and Technology,2023,23(12):247-254.(in Chinese)
[62] SARVESWARI H B,KALIMUTHU S,SHANMUGAM K,et al.Exploration of anti-infectives from mangrove-derived Micromonospora sp.RMA46 to combat Vibrio cholerae pathogenesis[J].Frontiers in Microbiology,2020,11:1393.
[63] 雷欢,魏宇清,方祥,等.副溶血弧菌生物膜的形成及壳聚糖的抑制作用[J].食品与发酵工业,2016,42(10):29-33.LEI H,WEI Y Q,FANG X,et al.Biofilm formation of Vibrio parahaemolyticus and the inhibition effects of chitosan[J].Food and Fermentation Industries,2016,42(10):29-33.(in Chinese)
[64] GUTI RREZ-ALMADA K,GONZ
RREZ-ALMADA K,GONZ LEZ-ACOSTA B,BORGES-SOUZA J M,et al.Marine bacteria associated with shallow hydrothermal systems in the Gulf of California with the capacity to produce biofilm inhibiting compounds[J].Archives of Microbiology,2020,202(6):1477-1488.
LEZ-ACOSTA B,BORGES-SOUZA J M,et al.Marine bacteria associated with shallow hydrothermal systems in the Gulf of California with the capacity to produce biofilm inhibiting compounds[J].Archives of Microbiology,2020,202(6):1477-1488.
[65] 上官文丹,陈松,韩翔鹏,等.鼠李糖乳杆菌MS1对副溶血弧菌群体感应淬灭作用的研究[J].食品与发酵工业,2021,47(24):64-70.SHANGGUAN W D,CHEN S,HAN X P,et al.Quorum sensing quenching effect of Lactobacillus rhamnosus MS1 on Vibrio parahaemolyticus[J].Food and Fermentation Industries,2021,47(24):64-70.(in Chinese)
[66] 孙梦桐.对哈维氏弧菌群体感应具有抑制活性乳酸菌的筛选及作用机制研究[D].锦州:渤海大学,2019.SUN M T.Screening of lactic acid bacteria with inhibitory activity on quorum sensing of Vibrio harveyi and its mechanism[D].Jinzhou:Bohai University,2019.(in Chinese)
[67] 上官文丹,陈可,陈清莹,等.戊糖乳杆菌DF9对副溶血弧菌群体感应的淬灭作用[J].食品工业科技,2022,43(6):126-132.SHANGGUAN W D,CHEN K,CHEN Q Y,et al.Quenching effects of Lactobacillus pentosus DF9 on quorum sensing of Vibrio parahaemolyticus[J].Science and Technology of Food Industry,2022,43(6):126-132.(in Chinese)
[68] 方梅梅.苯乳酸对副溶血性弧菌的抑菌机制研究[D].广州:华南理工大学,2022.FANG M M.Study on antibacterial mechanism of phenyllactic acid against Vibrio parahaemolyticus[D].Guangzhou:South China University of Technology,2022.(in Chinese)
[69] 包瑞璇.大菱鲆肠道乳酸菌的筛选、鉴定及其抑菌特性研究[D].连云港:江苏海洋大学,2022.BAO R X.Screening,identification and antibacterial characteristics of lactic acid bacteria from intestine of Scophthalmus maximus[D].Lianyungang:Jiangsu Ocean University,2022.(in Chinese)
[70] 彭嘉屹,上官文丹,张孟雨,等.淬灭副溶血弧菌群体感应的乳酸菌益生特性研究[J].食品工业科技,2023,44(8):180-186.PENG J Y,SHANGGUAN W D,ZHANG M Y,et al.Probiotic properties of lactic acid bacteria quenching quorum-sensing of Vibrio parahaemolyticus[J].Science and Technology of Food Industry,2023,44(8):180-186.(in Chinese)