目前,中国的工厂化循环水养殖(recirculating aquaculture system,RAS)已形成规模化产业。根据《2024中国渔业统计年鉴》[1],2023年中国淡水工厂化养殖产量为50.17万t,同比增长24.34%,但养殖水体缩减至5 009.9万m3(同比下降16.7%)。循环水养殖作为现代化渔业模式,在提升产量、优化资源利用方面发挥了重要作用,并成为多地渔业技术推广的重点方向。
RAS通过水处理技术实现水质精准调控,仅需补充少量水即可长久运行[2],并可大幅减少氮磷污染排放[3];其封闭循环与高密度养殖模式(密度达31.2 kg/m3)[4]显著节约土地资源,且结合恒温、高溶解氧(dissolved oxygen,DO)环境提升了鱼类存活率和生长效率;该系统还集成有益生菌调控、臭氧/紫外线病原灭活(灭活率>99%)及自动化监测技术(pH、DO实时反馈)[5],强化疾病防控能力[6],兼具环境友好、稳产高产与可持续发展优势,成为集约化水产养殖的核心解决方案。然而,该系统也存在一些缺点,如耗能高,尤其表现为电力消耗占比过高。循环水养殖的电力成本占总成本的60%以上,水泵、热泵、增氧设备是主要的耗能单元[7],生产中可以采用斜管重力滤沉淀装置减少水泵的数量[8]。工厂化养殖中饲料的成本占比较大,且有少量饲料进入水体,造成水环境污染,因此需要科学计算投喂量和时间,减少浪费,并且选择高质量的饲料,提高营养价值[9]。研究表明,40%的循环水系统失败案例与水处理失控有关[10],主要问题有设备老化和工艺缺陷、进水水质变化导致生物滤池膜不稳定等。
在工厂化循环水养殖系统中,养殖池和生物滤池的水质和微生物调控最为重要,两池可以形成微生物的功能互补,保证水质的稳定。其中生物滤池是水质稳定的核心,养殖池可作为补充。生物滤池的原理就是通过硝化细菌将氨氮逐步氧化为硝酸盐,再通过反硝化细菌进一步还原为氮气,从而实现氮污染物的高效去除[11]。生物滤池中的滤料类型[12]和挂膜方式(如添加枯草芽孢杆菌[13])显著影响脱氮效率[14],养殖池中微生物重点是将外来物质(残饵粪便等)分解,主要通过异养菌(如变形菌门)降解残饵粪便并维持DO平衡,抑制硫化氢等有害物质积累。在养殖池中添加芽孢杆菌制剂可提升有机物降解效率,并抑制弧菌属等病原菌,使虾类存活率提高10%~20%[15-16],两池可以实现微生物功能的协同。
目前,关于工厂化循环水养殖系统主要是围绕生物滤池微生物[17]、肠道微生物[18]、养殖对象的生长性能[19-20]进行研究,且使用了紫外线[21]和电化学[22]杀菌技术。但是对养殖池的微生物生态进行研究尚不多见,同时也缺少养殖池和生物滤池间相互影响的研究报道。因此,本研究中将探究宁夏RAS系统3个平行系统的微生物群落结构,采用生态化的技术,结合水质动态监测,并采用16S rRNA高通量测序等分子生物学手段,重点揭示了功能菌群在养殖池和生物滤池之间的空间分布,功能菌群在养殖池和生物滤池之间的差别,以及两个池之间微生物和水质波动之间的关系,以期为RAS精准管理提供科学参考。
该循环水养殖系统建于宁夏回族自治区银川市贺兰县科海渔业有限公司,该厂区共有3个正常运行的工厂化循环水养殖系统(图1(a)),每个系统由6个直径6 m高1.2 m的圆形养殖池,以及微滤机、生物滤池、紫外线消毒设备、液氧罐等单元组成。其中生物滤池有3级,前2级为移动床反应器(填有的生物滤料为比表面积600 m2/m3的多孔塑料环,图1(b)),后1级为固定床反应器;第1级移动床反应器面积为14.25 m2,第2级移动床反应器面积为13.8 m2,固定床反应器面积为24.6 m2,工艺流程如图2所示。

图1 宁夏工厂化循环水养殖系统实拍图
Fig.1 Field documentation of industrialized RAS in Ningxia
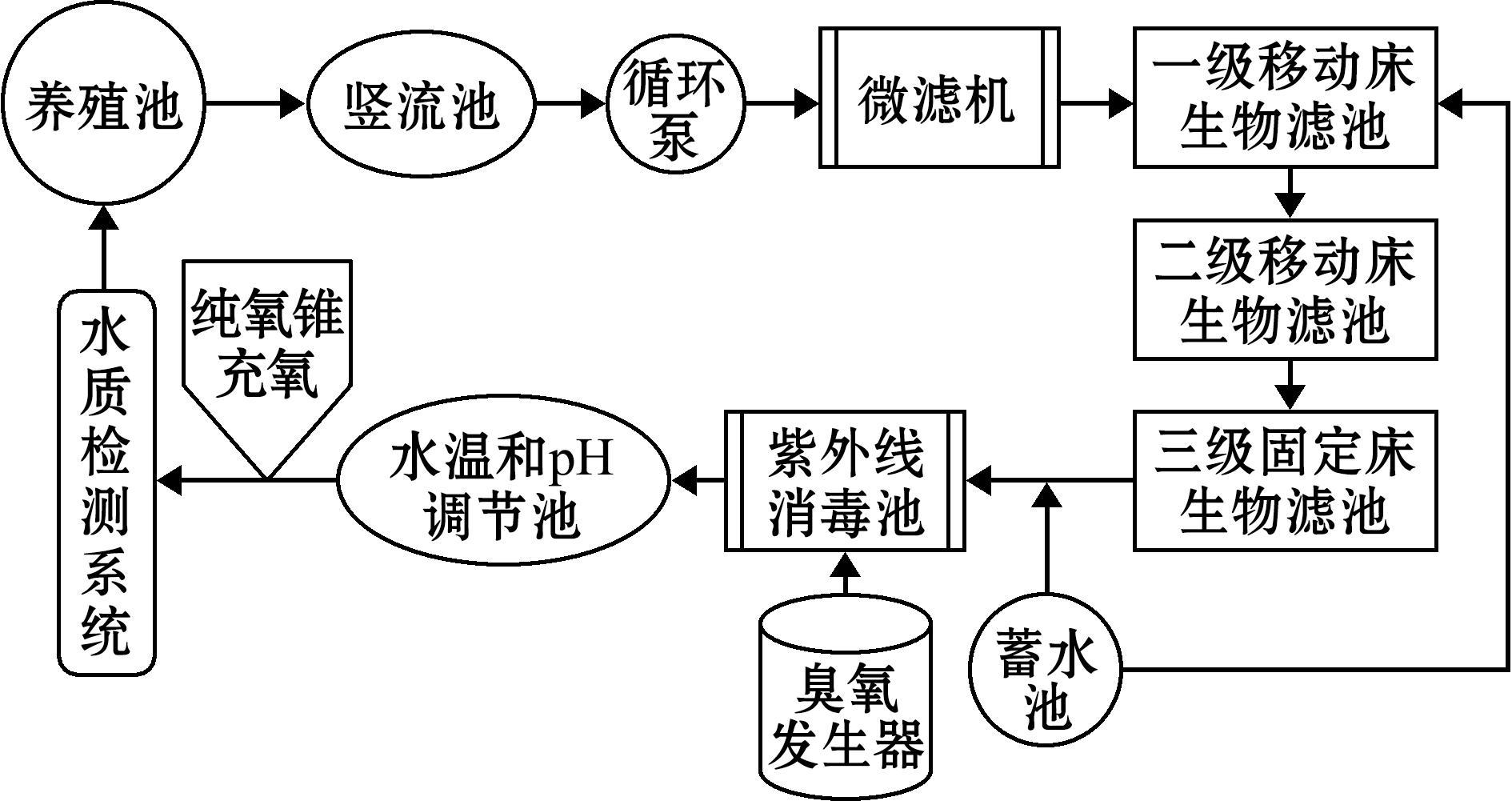
图2 厂区循环水养殖工艺流程
Fig.2 Flowchart of working processes of the RAS
每个循环水系统包含6个圆形养殖池和一套水处理设施(图3),其中在A系统养殖鲟(500 尾/池),B系统养殖银鲑(2 000 尾/池)、C系统养殖金鳟和银鲑(2 000 尾/池)。养殖过程中鲟投喂特种鱼膨化配合饲料5.0(鱼倍健牌,粗蛋白质含量≥42%,粗脂肪含量≥10%),金鳟和银鲑投喂鱼膨化颗粒配合饲料(爱乐银牌,粗蛋白质含量≥41%,粗脂肪含量≥24%),投喂量为鱼体质量的3%~5%,每天9:00和15:00各投喂一次,鱼体生长状态良好。
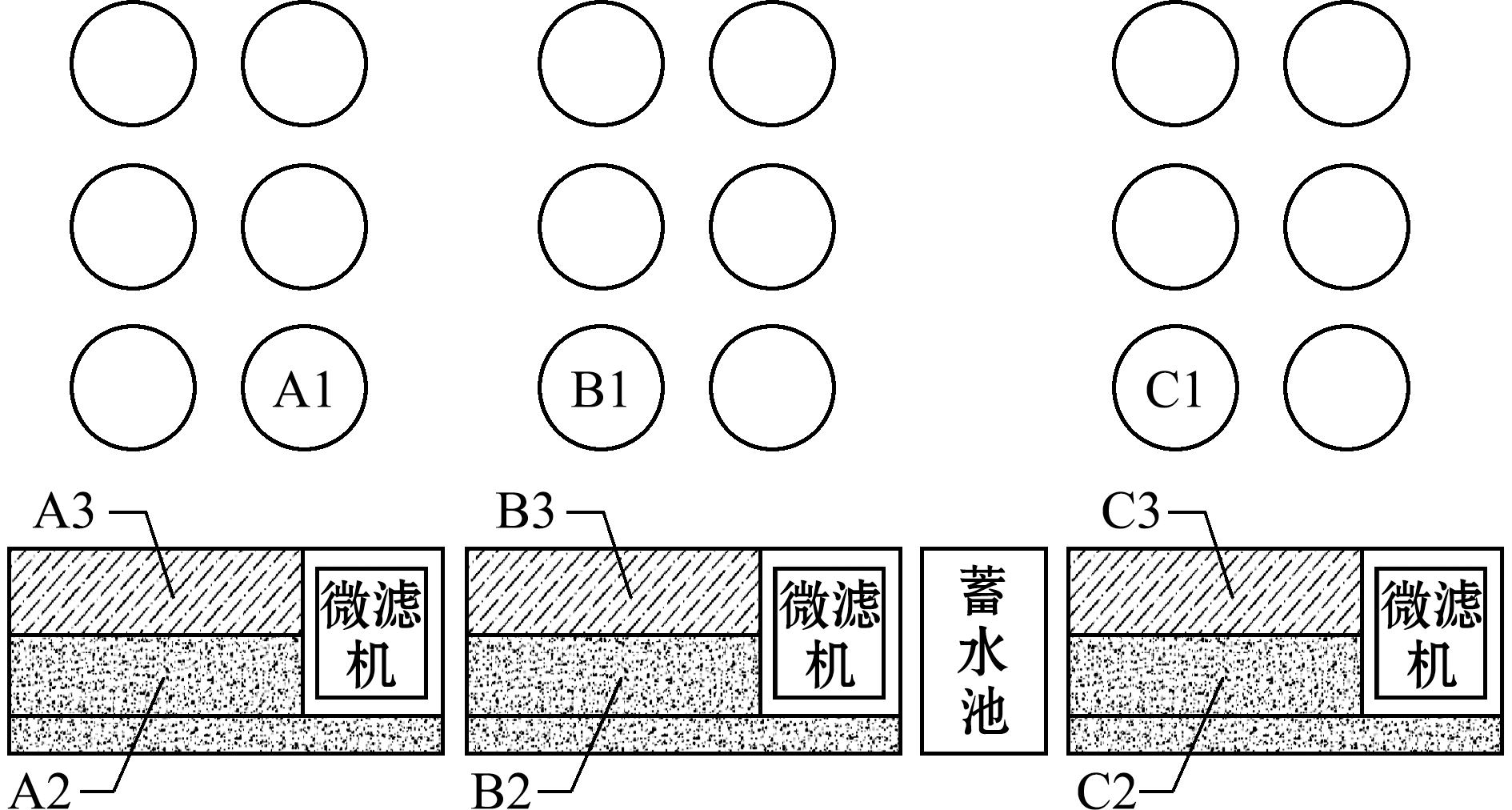
图3 工厂化循环水养殖厂区示意图
Fig.3 Schematic layout of RAS plant
1.2.1 样品采集 本研究在工厂化循环水的鱼池和生化反应器中取样,试验时间为2024年7月17日—2024年8月14日,该厂区共有4个系统,其中西边第一个系统尚未使用,其他3个系统分别设置为A、B、C,3个系统中各设置一个鱼池(A1、B1、C1);一个生化反应池(A2、B2、C2);一个鱼池进水池(A3、B3、C3)(图3)。采样时,每隔7 d取一次水样,每个采样点采集500 mL水样,装入500 mL无菌聚乙烯瓶中。采集水样进行低温保存,24 h完成样品水质指标检测,采集盐度、pH、DO、水温、磷酸盐![]() 亚硝酸态氮
亚硝酸态氮![]() 氨氮
氨氮![]() 总碱度、浊度等水质指标。采用便携式水质分析仪(YSL550A)测定盐度、DO、水温,采用雷磁pH计测定pH,采用希玛盐度计测定盐度,采用钼锑抗分光光度计(HJ 632—2011)测定磷酸盐,采用N-(1-萘基)-乙二胺分光光度法(GB/T 11889—1989)测定亚硝酸态氮,采用纳氏试剂分光光度法(HJ 535—2009)测定氨氮,采用酸碱指示剂滴定法测定总碱度。
总碱度、浊度等水质指标。采用便携式水质分析仪(YSL550A)测定盐度、DO、水温,采用雷磁pH计测定pH,采用希玛盐度计测定盐度,采用钼锑抗分光光度计(HJ 632—2011)测定磷酸盐,采用N-(1-萘基)-乙二胺分光光度法(GB/T 11889—1989)测定亚硝酸态氮,采用纳氏试剂分光光度法(HJ 535—2009)测定氨氮,采用酸碱指示剂滴定法测定总碱度。
水体中微生物的采集使用孔径为0.22 μm的玻璃纤维滤膜(GF/C Whatman)通过真空泵抽滤水样,将带有水样菌体的滤膜样品置于离心管中,并保存于-80 ℃冰箱中,用于后续的微生物菌群结构分析。
1.2.2 基因组DNA的提取和高通量测序 使用E.Z.N.A® soil试剂盒(Omega Bio-tek,Norcross,GA,USA)提取DNA,通过10 g/L琼脂糖凝胶电泳检测DNA取质量,采用Nano-Drop2000检测DNA的纯度和浓度。运用扩增引物338F和806R对16S rDNA基因的V3~V4区进行扩增。由上海美吉生物医药科技有限公司进行高通量测序,将滤膜样品送至该公司,数据分析基于该公司所提供的云服务进行(www.majorbio.com)。
本研究基于美吉生物信息分析平台,对水体微生物组数据进行系统解析,通过Alpha多样性指数(ACE、Chao1、Sobs、Coverage、Shannon、Simpson)评估微生物群落结构特征;计算水体样本间微生物群落丰度信息和OTU组成,以及不同样本间的微生物优势门属及微生物在门和属水平上的相似性、差异性,基于KEGG数据库,选取丰度前30的功能及其样品丰度绘制热图,并进行功能差异聚类,结合主坐标分析(PCoA)和冗余分析(RDA)等多元统计方法,系统阐释环境因子与微生物群落结构的耦合关系。所有生物信息学流程均在美吉云分析系统内完成。
根据表1的数据,本研究对工厂里3个循环水系统的主要水质指标(磷酸盐、亚硝酸态氮、氨氮、总碱度)进行了分析,并通过t检验(样本量n=6)计算了显著性差异。得出了以下结果:A系统的磷酸盐含量(均值5.37 mg/L)显著高于B系统(均值3.34 mg/L)和C系统(均值2.00 mg/L)(P<0.05),且B系统的磷酸盐含量也显著高于C系统(P<0.05);A系统(均值0.037 mg/L)和B系统(均值0.053 mg/L)的亚硝酸态氮含量均显著高于C系统(均值0.01 mg/L)(P<0.05),A、B系统之间无显著性差异(P>0.05);氨氮方面的3个系统之间的差异与亚硝酸态氮相似,A系统(均值0.263 mg/L)和B系统(均值0.237 mg/L)均显著高于C系统(均值0.14 mg/L)(P<0.05),A、B系统间无显著性差异(P>0.05);3个系统的总碱度均值A系统为411.72 mg/L、B系统为394.89 mg/L、C系统为431.39 mg/L,经t检验,各系统间无显著性差异(P>0.05)。
表1 工厂化3个系统中的水质指标
Tab.1 Water quality indicators in three recirculating aquaculture systems
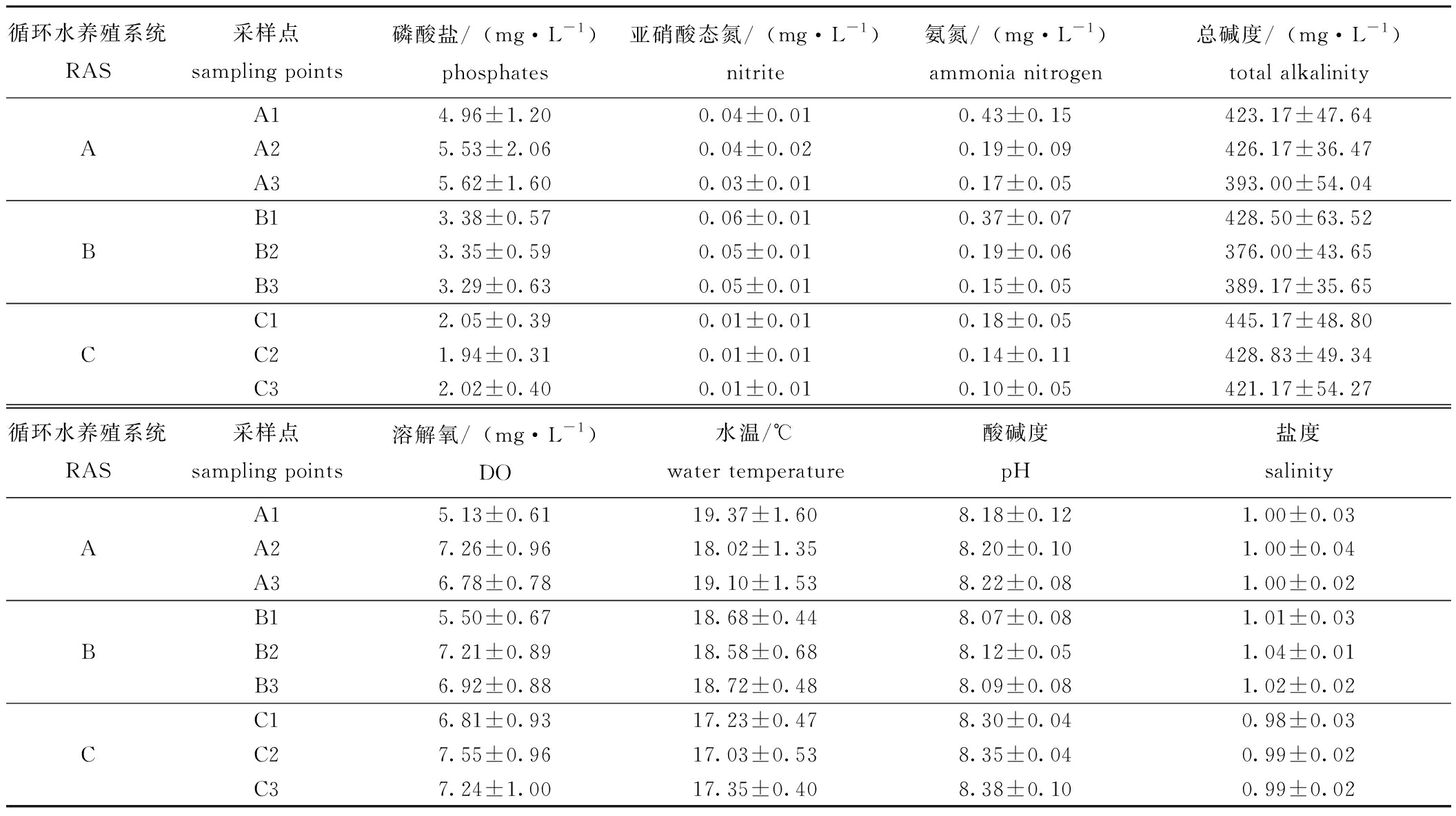
循环水养殖系统RAS采样点sampling points磷酸盐/(mg·L-1)phosphates亚硝酸态氮/(mg·L-1)nitrite氨氮/(mg·L-1)ammonia nitrogen总碱度/(mg·L-1)total alkalinityA14.96±1.200.04±0.010.43±0.15423.17±47.64AA25.53±2.060.04±0.020.19±0.09426.17±36.47A35.62±1.600.03±0.010.17±0.05393.00±54.04B13.38±0.570.06±0.010.37±0.07428.50±63.52BB23.35±0.590.05±0.010.19±0.06376.00±43.65B33.29±0.630.05±0.010.15±0.05389.17±35.65C12.05±0.390.01±0.010.18±0.05445.17±48.80CC21.94±0.310.01±0.010.14±0.11428.83±49.34C32.02±0.400.01±0.010.10±0.05421.17±54.27循环水养殖系统RAS采样点sampling points溶解氧/(mg·L-1)DO水温/℃water temperature酸碱度pH盐度salinityA15.13±0.6119.37±1.608.18±0.121.00±0.03AA27.26±0.9618.02±1.358.20±0.101.00±0.04A36.78±0.7819.10±1.538.22±0.081.00±0.02B15.50±0.6718.68±0.448.07±0.081.01±0.03BB27.21±0.8918.58±0.688.12±0.051.04±0.01B36.92±0.8818.72±0.488.09±0.081.02±0.02C16.81±0.9317.23±0.478.30±0.040.98±0.03CC27.55±0.9617.03±0.538.35±0.040.99±0.02C37.24±1.0017.35±0.408.38±0.100.99±0.02
2.2.1 工厂化循环水养殖池塘和生物滤池高通量测序结果及Alpha多样性分析 对3个系统OTU水平上进行PcoA分析以探索样本间群落组成的相似性或差异性,样本距离越近,说明样本物种组成结构相似性越大,相反则说明样本物种组成结构差异性越大。从图4(a)可见,A、B、C 3个系统中微生物群落的有着显著性差异。第一主坐标(PC1)解释了36.5%的总方差,第二主坐标(PC2)解释了28.82%的总方差,两者共同捕捉了微生物多样性的大部分变异。R值为0.754 3,P值为0.001,说明群落结构存在显著性差异。95%的置信椭圆显示,各组之间出现明显的分离,其中,B系统中微生物群落的同质性较高,A、C系统的变异性则较大。
采用高通量测序技术对所有非重复序列进行生物信息统计分析(图4(b)),共得到了5 024个OTUs,其中C系统有着最高的微生物多样性(2 226个OTUs),A、B系统分别为1 489和1 309个OTUs。通过Venn图(图4(b))可以看出,C系统拥有最多的独有OTUs(928,占其总OTUs的41.69%),相比之下,A、B系统的独有OTUs分别为420(28.21%)和293(22.38%)。3个系统共有的核心微生物OTUs为605,占共有OTUs的12.04%。此外,两两系统间的共享物种分析显示,A与C系统共有373个物种,远高于A与B(91个)及B与C(320个)的共有数量,表示A、C系统在环境条件或微生物交互方面可能存在关联。

图4 3个循环水养殖系统在OTU水平下的PCoA散点图和Venn图
Fig.4 PCoA scatter plot on OTU level and Venn diagram of three RAS
本研究中还通过α多样性指标对3个循环水养殖系统的水体微生物群落进行系统分析。分别分析了ACE、Chao、coverage、Shannon指数、Simpson指数和sobs,并且coverage值均大于0.99,证明测序深度可靠(表2)。通过对比可以看出,C系统中其物种丰富度(sobs 1 020~1 130)与预测值(ACE 1 293~1 458)的稳定比例(sobs/ACE≈0.78~0.82),配合高Shannon多样性(3.210~3.618)和低Simpson优势度(0.098~0.140)。B系统则呈现多样性较低,Shannon指数仅为1.901~1.971,尤其生物滤池单元(G_B_2)sobs值仅为476。B系统养殖池进水单元(G_B_3)出现Chao值(724.208)显著低于ACE值(924.208)的异常现象,结合其sobs(509)仅达到ACE预测值的55.1%。
表2 3个循环水养殖系统不同采样点微生物群落多样性和丰富度
Tab.2 Alpha diversity and richness analysis of microbial communities in three RAS sampling points
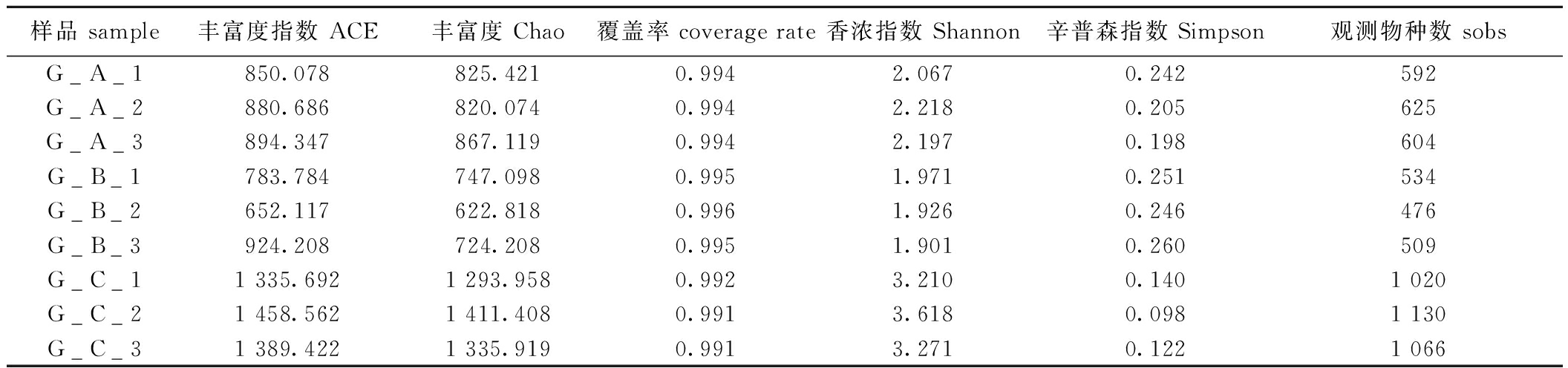
样品 sample丰富度指数 ACE丰富度 Chao覆盖率 coverage rate香浓指数 Shannon辛普森指数 Simpson观测物种数 sobsG_A_1850.078825.4210.9942.0670.242592G_A_2880.686820.0740.9942.2180.205625G_A_3894.347867.1190.9942.1970.198604G_B_1783.784747.0980.9951.9710.251534G_B_2652.117622.8180.9961.9260.246476G_B_3924.208724.2080.9951.9010.260509G_C_11 335.6921 293.9580.9923.2100.1401 020G_C_21 458.5621 411.4080.9913.6180.0981 130G_C_31 389.4221 335.9190.9913.2710.1221 066
2.2.2 工厂化循环水养殖池塘和生物滤池微生物群落组成分析 微生物群落中(图5),放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)在A、B系统中均占主导地位(80%以上),在A系统中丰度较高,尤其在养殖池中G_A_1至G_A_4样品中占比稳定在50%以上;其中A系统中的梭杆菌门(Fusobacteriota)的占比远大于其余两个系统。变形菌门为次优势菌门,在B系统中显著丰富(30%~40%),尤其在鱼池水体(G_B_1)和生物滤池(G_B_2)样品中达到峰值,而在A、C系统中比例较低(约20%~30%);拟杆菌门(Bacteroidota)在多数单元中占比为第三,而在B系统第二次采样时,拟杆菌门迅速减少而螺旋体门(Spirochaetota)迅速增加。
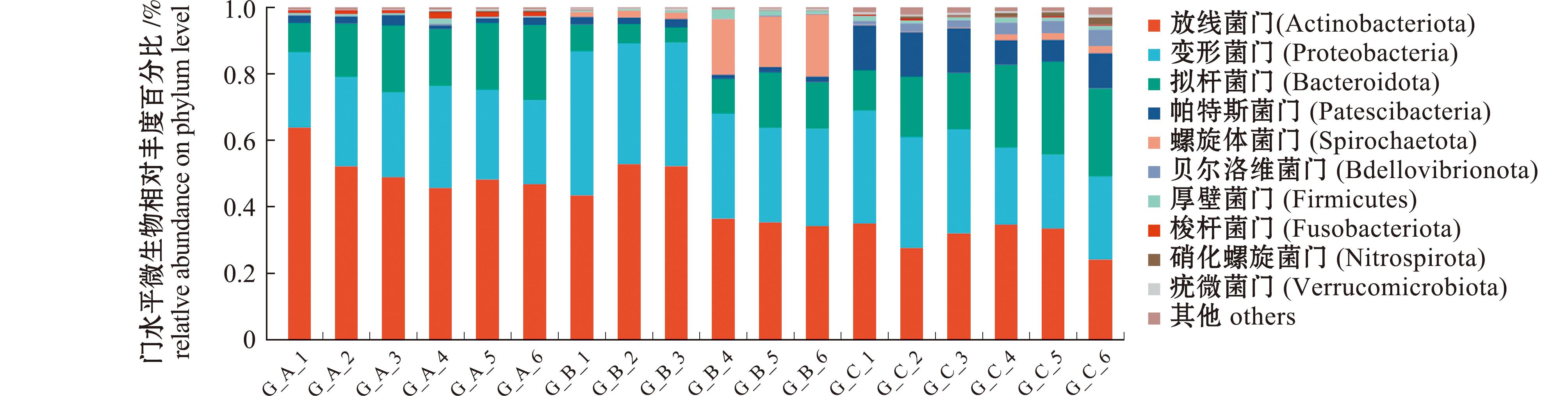
图5 系统群落组成分析
Fig.5 Microbial community composition analysis
通过对微生物属水平群落数据的分析可以看出(图6),A系统中,玫月菌属Rhodoluna、Auranti-microbium和Polynucleobacter占据绝对优势,其中Rhodoluna在3个系统中丰度稳定且最高。在C系统中Polynucleobacter和Fluviicola丰度显著升高,而norank_o_Candidatus_Falkowbacteria及g_hgcI_clade在G_C组中呈现特异性富集。B系统的核心菌属Polynucleobacter丰度达到各组峰值,同时Leptospira和norank_f_Parachlamydiaceae在该组显著增加。部分菌属表现出明显的组间排斥性分布:如GKS98_freshwater_group在A系统中丰度较高,而在其他组几乎消失;Cetobacterium在A系统维持在高水平,在G_B/G_C组骤降。此外,A、B系统中的低丰度菌属如Candidatus_Aquiluna、g_Bdellovibrio和g_Peredibacter在C系统中呈现较高数值。
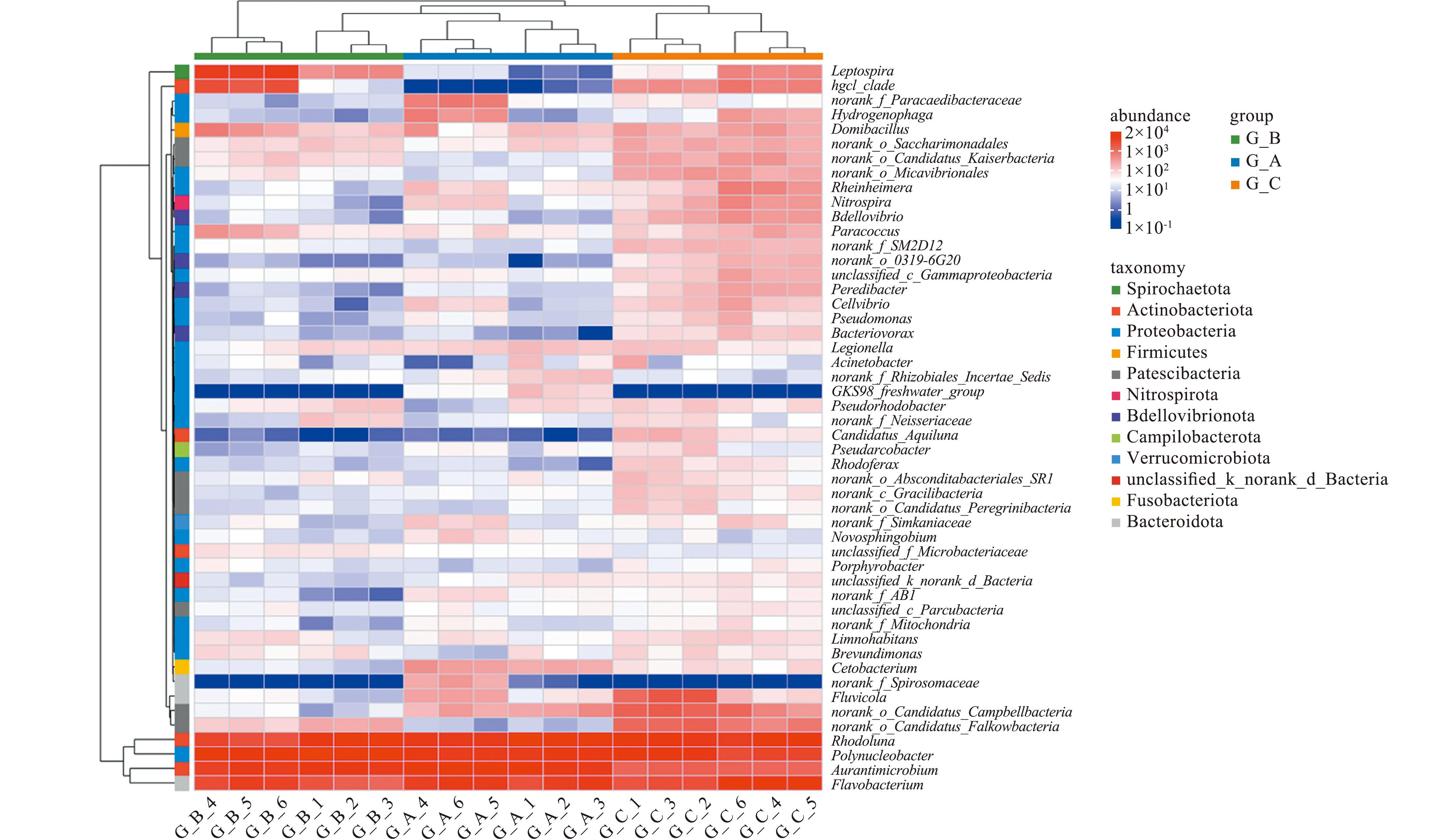
图6 3个循环水养殖系统微生物群落的属水平上Heatmap图
Fig.6 Genus-level heatmap for microbial communities in three RAS
2.2.3 工厂化循环水养殖池塘和生物滤池微生物群落功能预测 通过对3个工厂循环水养殖系统微生物群落进行KEGG Pathway一级功能注释分析(图7(a)),结果显示,代谢功能(metabolism)在3大系统的功能注释中占据绝对优势,其次为遗传信息处理(genetic information processing)。进一步对二级功能注释结果进行解析(图7(b))发现,微生物功能主要富集于碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、辅因子与维生素代谢(cofactor and vitamin metabolism)、能量代谢(energy metabolism)等核心代谢通路,同时亦在遗传信息处理相关的DNA复制与修复机制(DNA replication and repair)及环境响应相关的膜运输(membrane transport)等通路中呈现显著富集特征。
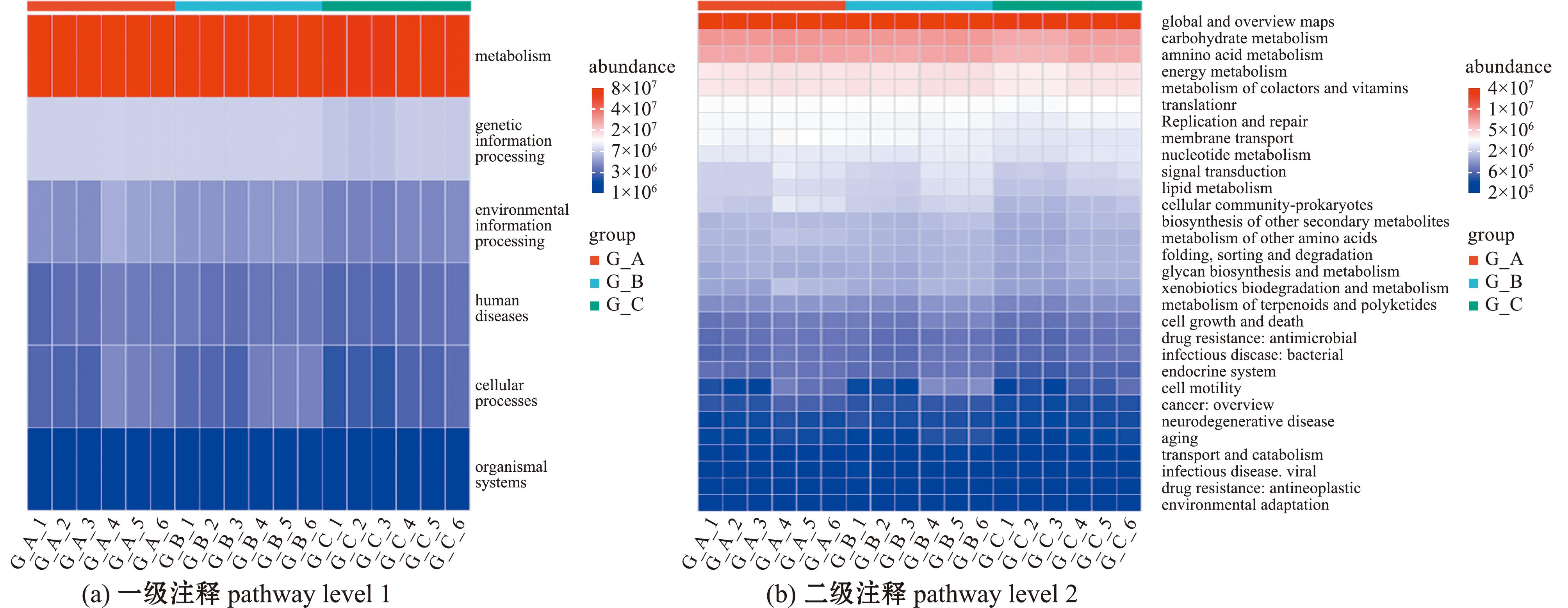
图7 KEGG注释下循环水系统细菌群落功能绝对丰度
Fig.7 Relative abundance of bacterial community functions in RAS under KEGG annotation
2.2.4 工厂化循环水养殖池塘和生物滤池微生物群落与环境因子相关性分析 在属水平的冗余分析中(图8(a)),前两轴(RDA1和RDA2)累计解释率达85.96%,其中RDA1(52.76%)主要受磷酸盐![]() 和pH驱动,表现为这两个环境因子的箭头长度显著且与RDA1轴高度重合,说明在本研究中磷酸盐浓度和pH是改变微生物群落结构的主导因素。A系统靠近
和pH驱动,表现为这两个环境因子的箭头长度显著且与RDA1轴高度重合,说明在本研究中磷酸盐浓度和pH是改变微生物群落结构的主导因素。A系统靠近![]() 箭头,表明高磷酸盐浓度(5.37 mg/L)可能影响某些微生物的生长,通过相关性热图(图8(b))可知,磷酸盐
箭头,表明高磷酸盐浓度(5.37 mg/L)可能影响某些微生物的生长,通过相关性热图(图8(b))可知,磷酸盐![]() 与Verrucomicrobiota、Deinococcota和Fibrobacterota间存在显著的负相关关系;B系统与pH呈现显著的负相关;C系统则分布于RDA2负方向,表示出其对总碱度或DO(溶解氧)的敏感性。
与Verrucomicrobiota、Deinococcota和Fibrobacterota间存在显著的负相关关系;B系统与pH呈现显著的负相关;C系统则分布于RDA2负方向,表示出其对总碱度或DO(溶解氧)的敏感性。
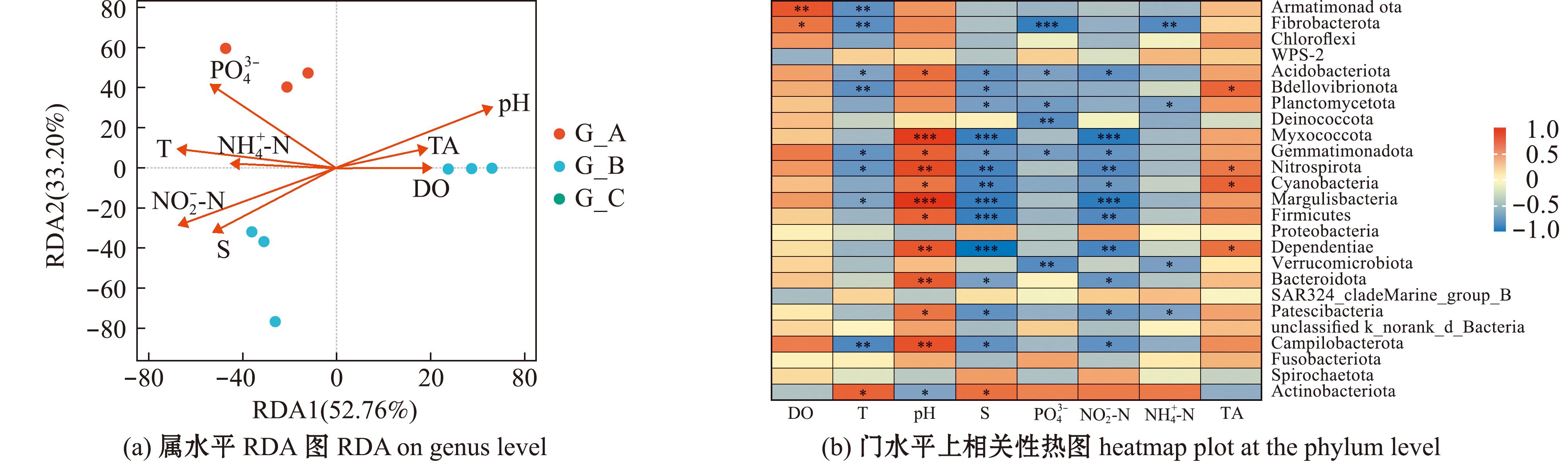
图8 3个循环水系统的微生物和环境因子分析
Fig.8 Microbial and environmental factor analysis of three RAS
相关性热图(图8(b))揭示了沉积物微生物类群与环境因子之间的关系,分析显示,Armatimonadota和Planctomycetota与DO、T和pH呈现显著正相关,Chloroflexi和Margulisbacteria则与![]() 和
和![]() 显著正相关,同时与pH和TA负相关。Cyanobacteria和Acidobacteriota与
显著正相关,同时与pH和TA负相关。Cyanobacteria和Acidobacteriota与![]() 和TA显著负相关,Firmicutes和Bacteroidota同样与
和TA显著负相关,Firmicutes和Bacteroidota同样与![]() 和
和![]() 正相关。Deinococcota和Gemmatimonadota与S和
正相关。Deinococcota和Gemmatimonadota与S和![]() 正相关,Nitrospirota和Campylobacterota与多数环境因子负相关。Proteobacteria和Actinobacteriota表现复杂,与T和S正相关,但与
正相关,Nitrospirota和Campylobacterota与多数环境因子负相关。Proteobacteria和Actinobacteriota表现复杂,与T和S正相关,但与![]() 负相关,反映了其广泛的生态适应性。总体而言,营养参数
负相关,反映了其广泛的生态适应性。总体而言,营养参数![]() 显著促进Chloroflexi、Margulisbacteria、Firmicutes和Bacteroidota的分布;DO、T和pH有利于Armatimonadota和Planctomycetota;而
显著促进Chloroflexi、Margulisbacteria、Firmicutes和Bacteroidota的分布;DO、T和pH有利于Armatimonadota和Planctomycetota;而![]() 和TA的高值对Cyanobacteria、Acidobacteriota和Nitrospirota产生抑制作用。
和TA的高值对Cyanobacteria、Acidobacteriota和Nitrospirota产生抑制作用。
本研究中,3个平行系统(A、B、C)的水质参数差异显著,数据显示,A系统养殖池的磷酸盐含量较生物滤池、进水点低,但是系统总体指数偏高,B、C系统养殖池中的磷酸盐含量偏高,且三者的磷酸盐含量变化范围较大,这与Jiang等[23]研究相符。3个系统的生物滤池均较成熟,亚硝酸态氮均处于极低的数值,且变化幅度不大,这与Park等[20]研究相符;氨氮在A系统养殖池中略高(0.43 mg/L),经过生物滤池处理后,降到较低水平(0.17 mg/L),与Zhao等[24]在相同温度下养殖池中氨氮水平结果相似[25],养殖池水质符合典型循环水养殖废水特征。3个系统的养殖池平均DO量为5.81 mg/L,为所有采样点中最低。养殖池中养殖对象的密度为500~2 000 尾/池,这可能是DO量显著降低的主要原因,后续需补充DO。3个系统中的总碱度相差不大(P>0.05),且pH值均大于8,该厂区位于宁夏,且采用黄河水作为水源,这与黄河水质偏碱性的特征相符[26]。以系统A为例,养殖池水中的氨氮从0.43 mg/L下降至0.17 mg/L(P<0.05),显示出显著的去除效果;而磷酸盐从4.96 mg/L 增至5.62 mg/L(P>0.05),变化不显著。Song等[27]研究发现,进水口的TP浓度为0.40~1.57 mg/L,出水口为0.51~2.17 mg/L,系统对TP的去除效果不佳,甚至存在磷的积累现象,与本研究结果相似。Lu等[28]研究中,![]() 和TP的图表显示两种系统的数值重叠,差异无统计学意义(P>0.05),也表现出磷酸盐去除率较低。
和TP的图表显示两种系统的数值重叠,差异无统计学意义(P>0.05),也表现出磷酸盐去除率较低。
研究显示,多物种的混养比单一物种养殖的微生物群落多样性指数更高[29],在本研究中,C系统的微生物多样性显著高于A和B系统,而A和B系统之间无显著性差异。这可能是因为A系统(鲟)和B系统(银鲑)仅养殖单一物种,而C系统同时养殖两种物种(金鳟和银鲑),多种物种的养殖提供了更丰富的生态位。研究表明,放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)为RAS中丰度最高的菌门[30-31],在本研究中,微生物群落在门分类水平上,放线菌门、变形菌门和拟杆菌门(Bacteroidota)占据了养殖池中90%以上的微生物含量。其中,放线菌门和变形菌门占据了80%左右,与其他人研究结果一致。本研究发现,在A系统养殖池中,最优势菌为放线菌门,B、C系统养殖池中放线菌门和变形菌门丰度接近。放线菌是天然抗生素的主要生产者,其产生的链霉素、庆大霉素等化合物能抑制水产病原菌(如弧菌、气单胞菌)的生长[32]。在3个系统中,优势菌属包括黄杆菌属(Flavobacterium)、红细菌属(Rhodoluna)和多核杆菌属(Polynucleobacter)。黄杆菌属、红细菌属能降解蛋白质、脂类等有机聚合物,在水体有机质循环中起关键作用[33],且黄杆菌属还参与氮元素的循环,有助于维持生物滤池的稳定性[34]。多核杆菌属可以促进碳循环,有助于减少RAS中积累的腐殖酸和难降解有机物,改善水质[35]。
深入解析3个系统的菌群特征差异发现(图6),邻近窗口的C系统显示出独特的光能利用优势。该系统特有的Candidatus_Aquiluna菌属为携带放线菌视紫质的兼性光异养菌,推测其形成可能与C系统临近窗口的光照优势有关。值得注意的是,C系统较A、B系统显著富集了norank_o_Saccharimonadales、norank_o_Candidatus_Kaiserbacteria、norank_o_Micavibrionales及功能菌属Rheinheimera、Nitrospira、Bdellovibrio、Paracoccus等,这种多营养级菌群的协同分布为其生态优势奠定了基础。其中,C系统生物滤池样本G_C_2展现出最优的微生物多样性(Shannon指数3.618,sobs达1130),其硝化螺菌(Nitrospira)的丰度较其他系统显著提升。研究表明,微生物多样性丰富的群落在高效氮循环过程中发挥了积极调控作用[28],与C系统较低的氨氮(0.14 mg/L)和亚硝酸态氮(0.01 mg/L)水平形成对应。相较而言,B系统在第二次采样中呈现异常生态波动:样本集G_B_4-6内(norank_f_Spirosomaceae)的相对丰度突增,该拟杆菌门成员的异常增殖可能源于水力停留时间不足导致的氨氧化不完全,未降解有机物为其提供了异养基质,并且,此阶段硝化螺菌(Nitrospira)丰度同步提升,印证了硝化菌与异养菌的竞争性互作对群落结构的影响[36]。综合比较显示,C系统微生物多样性指数显著高于A、B系统,且磷酸盐、氨氮、亚硝酸态氮指标均处于较低水平,表明有益菌属多样性增高可以提高RAS中水质处理效率。
循环水养殖系统水体环境因子对微生物的群落有着重要影响,研究显示,养殖池磷酸盐数值处于较高水平可能促进某些微生物的增殖[19]。本研究中A系统的养殖池中的磷酸盐浓度较高(均值5.37 mg/L),显著高于B系统(3.34 mg/L)和C系统(2.00 mg/L)(P<0.05)。研究显示,多样性丰富的群落通过高效氮循环降低了有害氮化合物积累[37],本研究中C系统亚硝酸态氮(均值0.01 mg/L)和氨氮浓度(均值0.14 mg/L)较其他两个系统相比最低,同时微生物多样性最高(Shannon指数3.271),A、B系统较高的亚硝酸态氮(均值A:0.037 mg/L,B:0.053 mg/L)和氨氮浓度(均值A:0.263 mg/L,B:0.237 mg/L)则与较低的微生物多样性相关,可能反映出氮代谢功能的相对不足,印证了这一观点。本研究结果显示,影响水体中微生物群落结构的水质指标有DO、pH、磷酸盐、氨氮、亚硝酸态氮。结果表明,水质参数与微生物群落的动态平衡是RAS系统稳定运行和水质优化的核心机制。
1)本研究揭示了宁夏工厂化循环水养殖系统(RAS)中微生物群落与水质调控的协同机制。结果表明:C系统(混养模式)通过高微生物多样性(Shannon指数3.271)和功能互补(硝化菌富集)实现氨氮与亚硝酸盐的高效去除,水质稳定性最优。
2)磷酸盐![]() 和pH是驱动微生物群落分异的核心环境因子(解释率85.96%)。系统间差异与养殖模式(单养/混养)及环境调控策略密切相关,优化生物滤池脱氮功能并提升群落多样性是RAS精准管理的关键。
和pH是驱动微生物群落分异的核心环境因子(解释率85.96%)。系统间差异与养殖模式(单养/混养)及环境调控策略密切相关,优化生物滤池脱氮功能并提升群落多样性是RAS精准管理的关键。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2024中国渔业统计年鉴[M].北京:中国农业出版社,2024.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2024 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2024.(in Chinese)
[2] 王海姮,侯昊晨,刘鹰.循环水养殖系统的研究进展及发展趋势[J].水产科学,2023,42(4):735-741.WANG H H,HOU H C,LIU Y.Research progress and development trend in recirculating aquaculture system[J].Fisheries Science,2023,42(4):735-741.(in Chinese)
[3] 吕剑,于晓斌,张宇轩,等.多层纤维球生物滤池净化工厂化养殖循环水处理[J].河海大学学报(自然科学版),2019,47(4):304-309.LÜ J,YU X B,ZHANG Y X,et al.Treatment of recirculating aquaculture water using biological filter with multi-layer fiber ball[J].Journal of Hohai University (Natural Sciences Edition),2019,47(4):304-309.(in Chinese)
[4] 林中凌.两种鱼类工厂化循环水养殖过程的水质调控及水中悬浮颗粒物分类[D].大连:大连海洋大学,2016.LIN Z L.Water quality control and classification of suspended particles in industrial circulating water culture of two kinds of fish[D].Dalian:Dalian Ocean University,2016.(in Chinese)
[5] 戚翠战,韩世成,曹广斌,等.应用于冷水鱼工厂化循环水养殖的自动化系统[J].广东农业科学,2014,41(13):182-185.QI C Z,HAN S C,CAO G B,et al.Automation system used in cold-water recirculating aquaculture[J].Guangdong Agricultural Sciences,2014,41(13):182-185.(in Chinese)
[6] 叶海斌,樊英,王晓璐,等.循环水养殖系统中凡纳滨对虾肠道微生物对三种复合益生菌制剂的响应[J].微生物学报,2018,58(9):1647-1657.YE H B,FAN Y,WANG X L,et al.Effects of three biological agents on intestinal microbiota of white shrimp(Litopenaeus vannamei) in a water-recirculating cultivation system[J].Acta Microbiologica Sinica,2018,58(9):1647-1657.(in Chinese)
[7] 杨德国,危起伟,王凯,等.淡水养殖中华鲟成鱼的3种方式及效果比较[J].南方水产,2006,2(2):1-5.YANG D G,WEI Q W,WANG K,et al.Three types of culture Chinese sturgeon (Acipenser sinensis) and the analysis of their effects by comparison[J].South China Fisheries Science,2006,2(2):1-5.(in Chinese)
[8] 管崇武,杨菁,宋红桥,等.鲟鱼工厂化循环水养殖系统设计及运行效果[J].渔业现代化,2017,44(4):30-36.GUAN C W,YANG J,SONG H Q,et al.Design and operation effects of industrial recirculating aquaculture system for sturgeon[J].Fishery Modernization,2017,44(4):30-36.(in Chinese)
[9] 戈贤平,缪凌鸿,孙盛明,等.水产饲料对养殖环境调控的研究与探索[J].中国渔业质量与标准,2014,4(4):1-6.GE X P,MIAO L H,SUN S M,et al.Study and exploration on the regulation of aquaculture environment with aquatic feed[J].Chinese Fishery Quality and Standards,2014,4(4):1-6.(in Chinese)
[10] 朱建新,刘慧,程海华,等.工厂化循环水养殖技术研究与产业化发展[J].中国水产,2022(10):41-49.ZHU J X,LIU H,CHENG H H,et al.Study on industrial circulating aquaculture technology and its industrialization development[J].China Fisheries,2022(10):41-49.(in Chinese)
[11] 张海耿,马绍赛,李秋芬,等.循环水养殖系统(RAS)生物载体上微生物群落结构变化分析[J].环境科学,2011,32(1):231-239.ZHANG H G,MA S S,LI Q F,et al.Analysis of the changes of microbial community structure on bio-carrier of recirculating aquaculture systems(RAS)[J].Environmental Science,2011,32(1):231-239.(in Chinese)
[12] 章霞,徐志进,柳敏海,等.循环水养殖系统中不同滤料生物挂膜水处理效果及微生物群落分析[J].大连海洋大学学报,2020,35(4):528-535.ZHANG X,XU Z J,LIU M H,et al.Analysis of biofilm water treatment effect and microbial community on different filter materials in a circulating aquaculture system[J].Journal of Dalian Ocean University,2020,35(4):528-535.(in Chinese)
[13] 黄炜.芽孢杆菌的复配及其在循环水养殖中的应用研究[D].泰安:山东农业大学,2024.HUANG W.Study on the compound of Bacillus and its application in circulating water culture[D].Taian:Shandong Agricultural University,2024.(in Chinese)
[14] 黄志涛.封闭式循环水养殖系统生物滤池及滤料的研究[D].青岛:中国海洋大学,2007.HUANG Z T.Study on biological filter and filter material in closed circulating water culture system[D].Qingdao:Ocean University of China,2007.(in Chinese)
[15] 李卓佳,林亮,杨莺莺,等.芽孢杆菌制剂对虾池环境微生物群落的影响[J].农业环境科学学报,2007,26(3):1183-1189.LI Z J,LIN L,YANG Y Y,et al.Influence of Bacillus on the microbial communities in shrimp ponds[J].Journal of Agro-Environment Science,2007,26(3):1183-1189.(in Chinese)
[16] 杨莺莺,李卓佳,梁晓华,等.芽胞杆菌对鱼池微生物群落代谢功能的影响[J].微生物学杂志,2009,29(3):11-17.YANG Y Y,LI Z J,LIANG X H,et al.Influences of Bacillus on metabolic functions of microbial communities in fishponds[J].Journal of Microbiology,2009,29(3):11-17.(in Chinese)
[17] XU J P,DU Y S,ZHANG J W,et al.Effects of an electrocoagulation-air flotation-microfiltration pretreatment process on the start-up of a moving bed biofilm reactor:performance and microbial community structure[J].Environmental Science:Water Research &Technology,2024,10(3):743-756.
[18] MES W,LÜCKER S,JETTEN M S M,et al.Comparison of the gill and gut microbiomes of common carp (Cyprinus carpio) and zebrafish (Danio rerio) and their RAS environment[J].Science of the Total Environment,2023,896:165212.
[19] HUYNH T G,TU PHAN T C,HAI VU H,et al.The use of different air diffusers on whiteleg shrimp,Penaeus vannamei in recirculating aquaculture system:effects on water quality and shrimp growth[J].Latin American Journal of Aquatic Research,2024,52(1):163-173.
[20] PARK J,KIM H B,KIM P K,et al.The growth of disk abalone,Haliotis discus Hannai at different culture densities in a pilot-scale recirculating aquaculture system with a baffled culture tank[J].Aquacultural Engineering,2008,38(3):161-170.
[21] 吴越,马建忠,郑伊诺,等.石斑鱼循环水养殖系统微生物群落结构[J].中国水产科学,2017,24(5):1045-1054.WU Y,MA J Z,ZHENG Y N,et al.Analysis of microbial community structure in recirculating aquaculture system for groupers(Epinephelus)[J].Journal of Fishery Sciences of China,2017,24(5):1045-1054.(in Chinese)
[22] 王成,闫岩,李祥舟,等.循环水系统排污水回用工业应用试验[J].石化技术,2003,10(2):49-52,56.WANG C,YAN Y,LI X Z,et al.Industrial application experiment for reuse of sewage in circulating cooling water system[J].Petrochemical Industry Technology,2003,10(2):49-52,56.(in Chinese)
[23] JIANG H C,CHEN X H,BIAN W J,et al.Comparison of bacterial communities in channel catfish Ictalurus punctatus culture ponds of an industrial ecological purification recirculating aquaculture system[J].Aquaculture Research,2020,51(6):2432-2442.
[24] ZHAO R X,SYMONDS J E,WALKER S P,et al.Effects of feed ration and temperature on Chinook salmon (Oncorhynchus tshawytscha) microbiota in freshwater recirculating aquaculture systems[J].Aquaculture,2021,543:736965.
[25] LEE W J,BAEK S W,SEO H N,et al.Variation of water quality in fish farm using recirculating aquaculture system for fancy carp[J].Journal of the Korean Society for Environmental Technology,2018,19(1):37-45.
[26] 陈静生,王飞越,何大伟.黄河水质地球化学[J].地学前缘,2006,13(1):58-73.CHEN J S,WANG F Y,HE D W.Geochemistry of water quality of the Yellow River Basin[J].Earth Science Frontiers,2006,13(1):58-73.(in Chinese)
[27] SONG C Y,ZHOU Y J,LI X,et al.Interaction among biofilter microbiome,fecal metabolome and water quality and regulation of sewage discharge in the recirculating aquaculture system of Apostichopus japonicus[J].Journal of Environmental Management,2023,330:117100.
[28] LU Z B,LIN W C,LI Q,et al.Recirculating aquaculture system as microbial community and water quality management strategy in the larviculture of Scylla paramamosain[J].Water Research,2024,252:121218.
[29] 刘瑞娟,田相利,董双林,等.蟹虾贝混养池塘生态系统微生物群落功能多样性研究[J].水产科学,2014,33(9):535-544.LIU R J,TIAN X L,DONG S L,et al.The functional diversity of flora in polyculture ecosystem of swimming crab,shrimp and short-necked clam[J].Fisheries Science,2014,33(9):535-544.(in Chinese)
[30] 杜玉龙,董登攀,李长剑,等.对虾工厂化养殖系统不同浓度氨氮和亚硝氮水体的微生物群落与氮循环功能基因丰度[J].渔业科学进展,2025,46(3):222-235.DU Y L,DONG D P,LI C J,et al.Relationship between concentrations of ammonia and nitrite in water,microbial community structure and abundance of nitrogen cycling function genes[J].Progress in Fishery Sciences,2025,46(3):222-235.(in Chinese)
[31] 刘丹,潘浩然,倪红东,等.刺参循环水养殖系统水体及沉积物微生物群落结构特征[J].大连海洋大学学报,2025,40(1):135-145.LIU D,PAN H R,NI H D,et al.Structural characteristics of microbial community in the water and sediments of recirculating aquaculture systems for Apostichopus japonicus[J].Journal of Dalian Ocean University,2025,40(1):135-145.(in Chinese)
[32] RANJANI A,DHANASEKARAN D,GOPINATH P M.An introduction to Actinobacteria[M]//Actinobacteria-Basics and Biotechnological Applications.London:InTech,2016.
[33] MAGUATE N J I F S,TABUGO S R M.Diversity and functional annotation of bacteria community associated with the epithelial surface of Hippocampus kuda (Yellow Seahorse) and its surrounding environment[J].Biodiversitas Journal of Biological Diversity,2024,25(5):2230-2240.
[34] QU J Q,YANG H C,LIU Y,et al.The study of natural biofilm formation and microbial community structure for recirculating aquaculture system[J].IOP Conference Series:Earth and Environmental Science,2021,742(1):012018.
[35] WATANABE K,KOMATSU N,ISHII Y,et al.Effective isolation of bacterioplankton genus Polynucleobacter from freshwater environments grown on photochemically degraded dissolved organic matter[J].FEMS Microbiology Ecology,2009,67(1):57-68.
[36] BARTELME R P,MCLELLAN S L,NEWTON R J.Freshwater recirculating aquaculture system operations drive biofilter bacterial community shifts around a stable nitrifying consortium of ammonia-oxidizing Archaea and comammox Nitrospira[J].Frontiers in Microbiology,2017,8:101.
[37] 熊向英,王志成,刘旭佳,等.工厂化循环水养殖系统微生物群落结构和功能分析[J].水产科学,2022,41(5):810-819.XIONG X Y,WANG Z C,LIU X J,et al.Analysis of microbial community structure and function in industrial recirculating aquaculture system[J].Fisheries Science,2022,41(5):810-819.(in Chinese)