虹鳟(Oncorhynchus mykiss)作为中国最具经济价值的冷水性鱼类之一,其肉质鲜美、营养价值丰富。然而,随着养殖规模的快速扩张,高密度集约化养殖模式引发的一系列生态问题逐渐显现,导致养殖水体质量下降、鱼类免疫力和抗病力降低等问题日益凸显,养殖虹鳟病害发生愈发严重,其中,传染性造血器官坏死病毒(infectious hematopoietic necrosis virus,IHNV)的暴发和流行尤为突出,并对产业可持续发展构成严重威胁。目前,生产中普遍使用抗生素和化学药物进行疾病预防[1],但这些药物的使用不仅会导致药物残留,过量使用还会引发耐药性增强及环境污染等问题,因此,迫切需要研究出有效且无副作用的替代药物。中草药具有安全、副作用小、无残留且生态效益良好的特点,其富含多种营养成分和活性物质,包括多糖、生物碱、黄酮类化合物、挥发油、有机酸、单宁、氨基酸、矿物质及维生素等[2],这些成分可以有效提升水产动物的生长性能、产品质量、消化能力和免疫能力。因此,中草药可成为提高水产动物免疫能力的理想替代品。
鱼体受到刺激时,会产生大量活性氧自由基,这些自由基与脂质发生过氧化反应产生丙二醛(malondial dehyde,MDA),其积累会对生物膜结构造成损害,因此MDA含量可以间接反映组织过氧化损伤的程度[3]。在饲料中添加中草药,其所含的活性物质(黄酮类化合物、党参多糖、甘草酸等),一方面可以通过直接消除自由基减少MDA的产生,另一方面可通过提升超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶的活性,从而清除过量的自由基。SOD和CAT是机体重要的抗氧化酶,二者协同作用,能够消除超氧阴离子对细胞的毒害与损伤。相关研究表明,黄芪总皂苷和黄芪总黄酮可以提高鱼类谷胱甘肽过氧化物酶(GSH-Px)、SOD和CAT的活性,并降低MDA含量,从而增强机体的抗氧化能力。向静[4]在黄鳝(Monopterus albus)饲料中加入黄芪多糖,发现其CAT、SOD活性均显著升高。付廷斌等[5]使用添加1%复方中草药(黄芪、丹皮、大黄、连翘和白术等比例混合)的饲料连续投喂杂交鲟(Acipenser schrenckii♀×Acipenser baeri Brandt♂)30 d,结果发现,杂交鲟肝脏和血清中T-AOC、SOD、CAT活性显著升高,MDA含量显著降低。综上所述,中草药可以通过增强鱼体的抗氧化能力来提高机体对环境刺激的免疫能力,进而提升鱼体对环境的适应能力。
在基因调控层面,中草药活性成分(生物碱、黄酮类、萜类等)通过不同途径对基因表达进行调控,使用中草药饲喂鱼类,这些活性成分进入细胞后,能够作用于细胞内的各种信号传导通路及与基因转录、翻译相关的分子靶点,从而影响基因的表达水平,最终实现对生理功能的调节。Wang等[6]以甘草提取物饲料饲喂柱状黄杆菌感染的黄颡鱼(Pelteobagrus fulvidraco),Toll样受体通路、RIG-I样受体通路和炎症相关通路等被激活,其中,tlr3、tlr5、myd88、il-1β和il-8基因表达显著上调,从而增强了机体的免疫能力。TLR3和TLR5同属于Toll样受体通路,对于病原体的识别具有重要作用,TLR5识别病原体后与MyD88相互作用,激活下游信号通路,导致NF-κB被激活,进而诱导IL-1β、IL-6、TNF-α等炎症细胞因子的分泌和Ⅰ型干扰素的表达,有助于招募更多的免疫细胞到达感染部位,增强局部的免疫防御[7]。同样,Khieokhajonkhet等[8]向无乳链球菌感染的尼罗罗非鱼(Oreochromis niloticus)日粮中添加猴头菇提取物后,也得到了类似的结果。戴小连[9]研究发现,黄芪可显著提升褐点石斑鱼(Epinephelus fuscoguttatus)il-2、mx、ifn、tnf等免疫功能基因的表达水平。其中,MX蛋白是由干扰素诱导产生的具有GTP酶活性的肌动蛋白,具有广谱的抗病毒功能,在体内Ⅰ型干扰素(IFN-I)的诱导下可以抑制RNA病毒的复制,从而发挥抗病毒作用[10]。TNF则与机体的炎症反应密切相关,不仅可以直接作用于炎症基因,还可通过诱导细胞死亡间接参与炎症免疫反应[11]。由此可见,中草药对于鱼类炎症反应具有显著的调节作用,如Wang等[12]向大黄鱼(Larimichthys crocea)基础饲料中加入白芍、黄连、黄柏皮和白蜡皮,肝脏和肠道中与炎症反应相关的il-10、tnf-α基因表达上调。综上,中草药对鱼类的基因表达具有良好的调控效果,可以通过不同途径显著增强机体的免疫和抗病能力。
研究表明,单一中草药所含活性物质相对较少,而复方中草药活性物质更加全面,可以相互协同、增强药效,从多层面、多靶位发挥作用。因此,本研究遵循“君、臣、佐、使”原则,结合中草药配伍禁忌,以增强免疫力的黄芪、当归、党参、麦冬、甘草、茯苓为主,提高抗病力的金银花、板蓝根和大青叶为辅,佐以促进消化的山楂组合成复方中草药。肠道不仅是鱼类主要的消化器官,也是重要的免疫器官,其包含了大量的免疫细胞和黏膜免疫系统,对抵御病原体起着至关重要的作用。目前,关于IHNV对鱼类血清、肝脏和脾脏等器官免疫力影响的研究较多,但对虹鳟肠道免疫力影响的研究相对有限。本研究中构建“中草药梯度浓度-免疫应激”模型,将本试验复方中草药按不同比例添加到虹鳟的基础饲料中,通过检测虹鳟在IHNV未感染及感染条件下其肠道抗氧化指标和免疫相关基因的表达量,评估了不同浓度复方中草药对虹鳟肠道抗氧化能力及免疫力的影响,以期为中草药在虹鳟病害防控和健康养殖中的应用提供科学参考。
1 材料与方法
1.1 材料
试验用虹鳟(体质量30.0 g±0.5 g)源自甘肃省永靖县虹鳟渔场,在水温为12.0 ℃±1.0 ℃、溶解氧为(8.5±0.5)mg/L条件下,于甘肃农业大学水产科学实训中心微流水系统暂养14 d。
在本地药店购买黄芪、当归、党参、麦冬、甘草、茯苓、金银花、山楂、板蓝根和大青叶,经超微粉碎成粉末状后过165 μm筛绢,以相同质量比均匀混合成复方中草药,将其按0、1%、2%和3%的配比添加到基础饲料(表1)中混合均匀,再使用制粒机将其制成粒径为1.5 mm的颗粒型饲料,干燥后保存在4 ℃冰箱中备用。
表1 基础饲料的组成和营养成分分析
Tab.1 Composition and nutritional analysis of base diet %
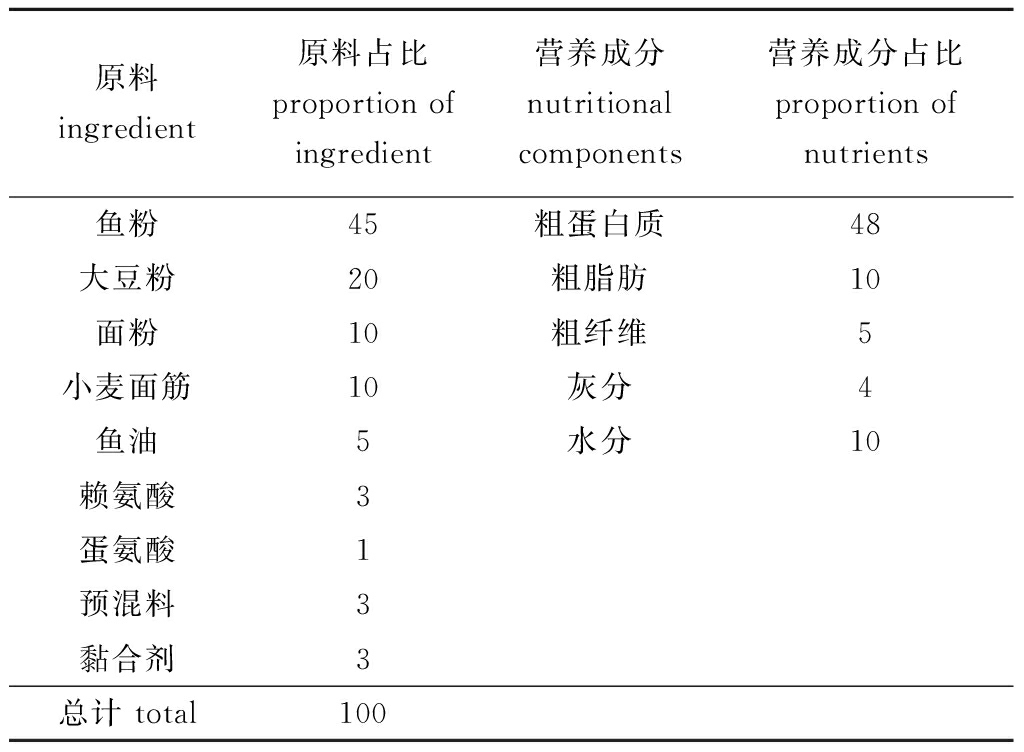
原料ingredient原料占比proportion ofingredient营养成分nutritional components营养成分占比proportion of nutrients鱼粉45粗蛋白质48大豆粉20粗脂肪10面粉10粗纤维5小麦面筋10灰分4鱼油5水分10赖氨酸3蛋氨酸1预混料3黏合剂3总计 total100
注:每千克预混料所含营养成分为维生素A 450 000 IU;维生素D3 200 000 IU;维生素E 5 000 mg;维生素K3 550 mg;维生素B1 500 mg;维生素B2 1 000 mg;维生素B6 550 mg;维生素B12 1.5 mg;维生素C 15 000 mg;叶酸 180 mg;烟酰胺 3 500 mg;泛酸钙 2 000 mg;生物素 8 mg;锰 2 500 mg;铜 6 500 mg;铁 4 500 mg;锌 5 500 mg;硒 500 mg;碘 2 500 mg;钴 550 mg;氯化胆碱 115 000 mg。
Note:Nutrient composition per kilogram of premix—vitamin A,450 000 IU;vitamin D3,200 000 IU;vitamin E,5 000 mg;vitamin K3,550 mg;vitamin B1,500 mg;vitamin B2,1 000 mg;vitamin B6,550 mg;vitamin B12,1.5 mg;vitamin C,15 000 mg;folic acid,180 mg;niacin amide,3 500 mg;calcium pantothenate,2 000 mg;biotin,8 mg;manganese,2 500 mg;copper,6 500 mg;ferrous,4 500 mg;zinc,5 500 mg;selenium,500 mg;iodine,2 500 mg;cobalt,550 mg;choline chloride,115 000 mg.
1.2 方法
1.2.1 试验设计 选取480尾规格大小一致的虹鳟,随机分成4组,每组设置3个平行,每个平行设置40尾鱼,饲养于12个圆形鱼缸中。按照虹鳟体质量的3%分别投喂含0(对照组)、1%、2%、3%(试验组)复方中草药的试验饲料,每日3次(8:00、13:00、18:00),并每日更换1/3水、清理鱼粪和残留饲料。
IHNV从患病虹鳟组织中分离,接种至96孔板中的鲤上皮瘤细胞(epithelioma papulosum cyprini cell,EPC),15 ℃培养,设对照组,每日观察细胞病变。培养3代以上的病毒液反复冻融2~3次,10倍梯度稀释10次后分别接种至96孔板的EPC细胞,设置8孔重复,15 ℃培养,观察细胞病变并计算TCID50,注射试验中将病毒液稀释至500 pfu IHNV。各组(0、1%、2%、3%)虹鳟饲喂至35 d时,向试验组虹鳟腹腔注射100 μL 500 pfu的IHNV病毒液,对照组虹鳟注射100 μL的细胞培养基。按上述试验条件及方法进行饲养,观察其病程变化,饲养12 d。
1.2.2 采样 试验后7、21、35 d和攻毒后12 d,分别将各组虹鳟用间氨基苯甲酸乙酯甲磺酸盐(MS-222)麻醉,待充分麻醉后解剖出肠道组织中部置于标记好的冻存管中,迅速将其转移至液氮中,待采样结束后将所采样品置于-80 ℃冰箱中保存。
1.2.3 生化指标测定 取适量上述所采样品,经组织研磨机研磨后加入9倍体积生理盐水,配成浓度为10%的组织匀浆,再将10%组织匀浆稀释成不同浓度,按照说明书进行生化指标的测定。生化指标包括总抗氧化能力(total antioxidant capacity,T-AOC)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、谷草转氨酶(AST)、谷丙转氨酶(ALT)和酸性磷酸酶(acid phosphatase,ACP)。试剂来自南京建成生物工程有限公司。
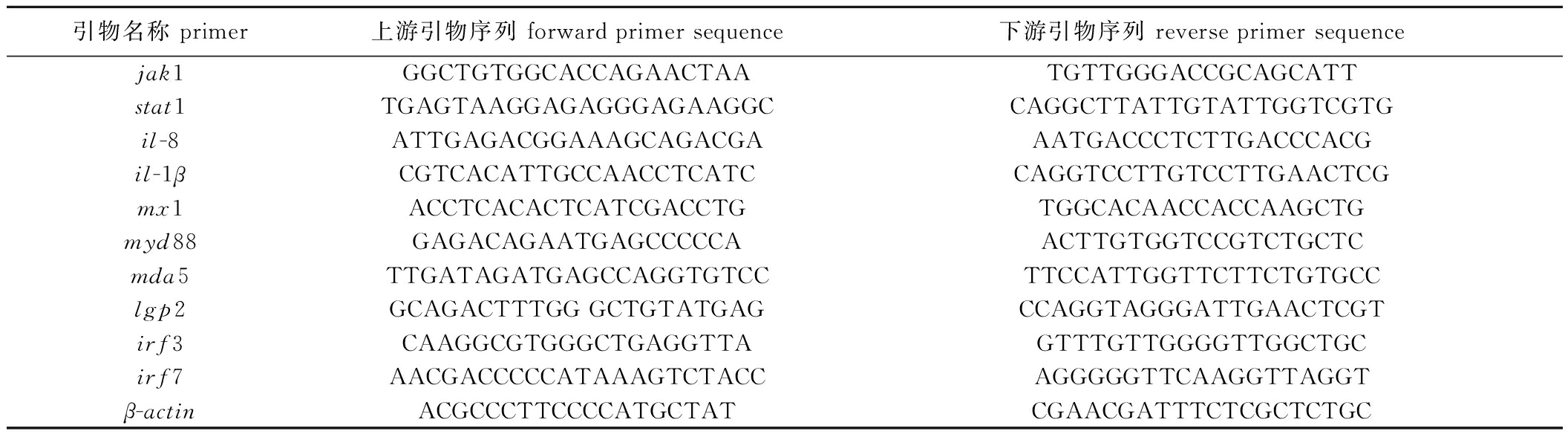
1.2.4 实时荧光定量PCR(qRT-PCR) 采用Premier 6.0软件设计jak1、stat1、il-8、il-1β、mx1、myd88、mda5、lgp2、irf3和irf7基因的引物序列,由生工生物工程(上海)股份有限公司合成,以β-肌动蛋白(β-actin)作为内部参照基因(表2)。使用Total RNA试剂盒提取攻毒前和攻毒后12 d的样品总RNA,再以琼脂糖凝胶电泳检查RNA的完整性,后使用Evo M-MLV反转录试剂盒将RNA反转录为cDNA。以cDNA为模板,通过qRT-PCR检测虹鳟肠道中jak1、stat1、il-8、il-1β、mx1、myd88、mda5、lgp2、irf3和irf7基因的mRNA水平。按照荧光定量试剂盒说明书设置20 μL体系:RNase-free water 7.5 μL、上下游引物各1 μL,SYBR Premix Ex Taq Ⅱ 10 μL,cDNA 0.5 μL;反应条件:95 ℃下预变性30 s;95 ℃下变性 5 s,60 ℃下退火 30 s,共进行40个循环。采用2-ΔΔCt法分析样品中所测基因相对表达量。
表2 qRT-PCR所用引物及其序列
Tab.2 Primers and their sequences used in qRT-PCR
引物名称 primer上游引物序列 forward primer sequence下游引物序列 reverse primer sequencejak1GGCTGTGGCACCAGAACTAATGTTGGGACCGCAGCATTstat1TGAGTAAGGAGAGGGAGAAGGCCAGGCTTATTGTATTGGTCGTGil-8ATTGAGACGGAAAGCAGACGAAATGACCCTCTTGACCCACGil-1βCGTCACATTGCCAACCTCATCCAGGTCCTTGTCCTTGAACTCGmx1ACCTCACACTCATCGACCTGTGGCACAACCACCAAGCTGmyd88GAGACAGAATGAGCCCCCAACTTGTGGTCCGTCTGCTCmda5TTGATAGATGAGCCAGGTGTCCTTCCATTGGTTCTTCTGTGCClgp2GCAGACTTTGG GCTGTATGAGCCAGGTAGGGATTGAACTCGTirf3CAAGGCGTGGGCTGAGGTTAGTTTGTTGGGGTTGGCTGCirf7AACGACCCCCATAAAGTCTACCAGGGGGTTCAAGGTTAGGTβ-actinACGCCCTTCCCCATGCTATCGAACGATTTCTCGCTCTGC
1.3 数据处理
采用SPSS 27.0软件对数据进行统计学分析,采用单因素方差分析(one-way ANOVA),结合Duncan多重比较法评估数据间的显著性差异,显著性差异设为0.05。
2 结果与分析
2.1 复方中草药对虹鳟肠道生化指标的影响
添加不同浓度(1%、2%、3%)复方中草药的各试验组T-AOC、CAT、T-SOD和ACP活性均高于对照组(0),ALT和AST活性与MDA含量均低于对照组,随时间不同,本试验复方中草药对酶活性的调节效果也有所不同。7 d时,T-AOC、CAT和T-SOD活性在2%组达到峰值,且与其他试验组有显著性差异(P<0.05),AST活性与MDA含量在2%组显著低于对照组(P<0.05),ALT活性在1%组最低,但与2%组无显著性差异(P>0.05);21 d时,T-AOC和CAT活性的峰值出现在2%组,T-SOD活性在1%组值最高,ALT活性和MDA含量在3%组降到最低;35 d时,添加2%复方中草药各试验组CAT活性显著高于对照组,MDA含量显著低于对照组(P<0.05)(图1)。
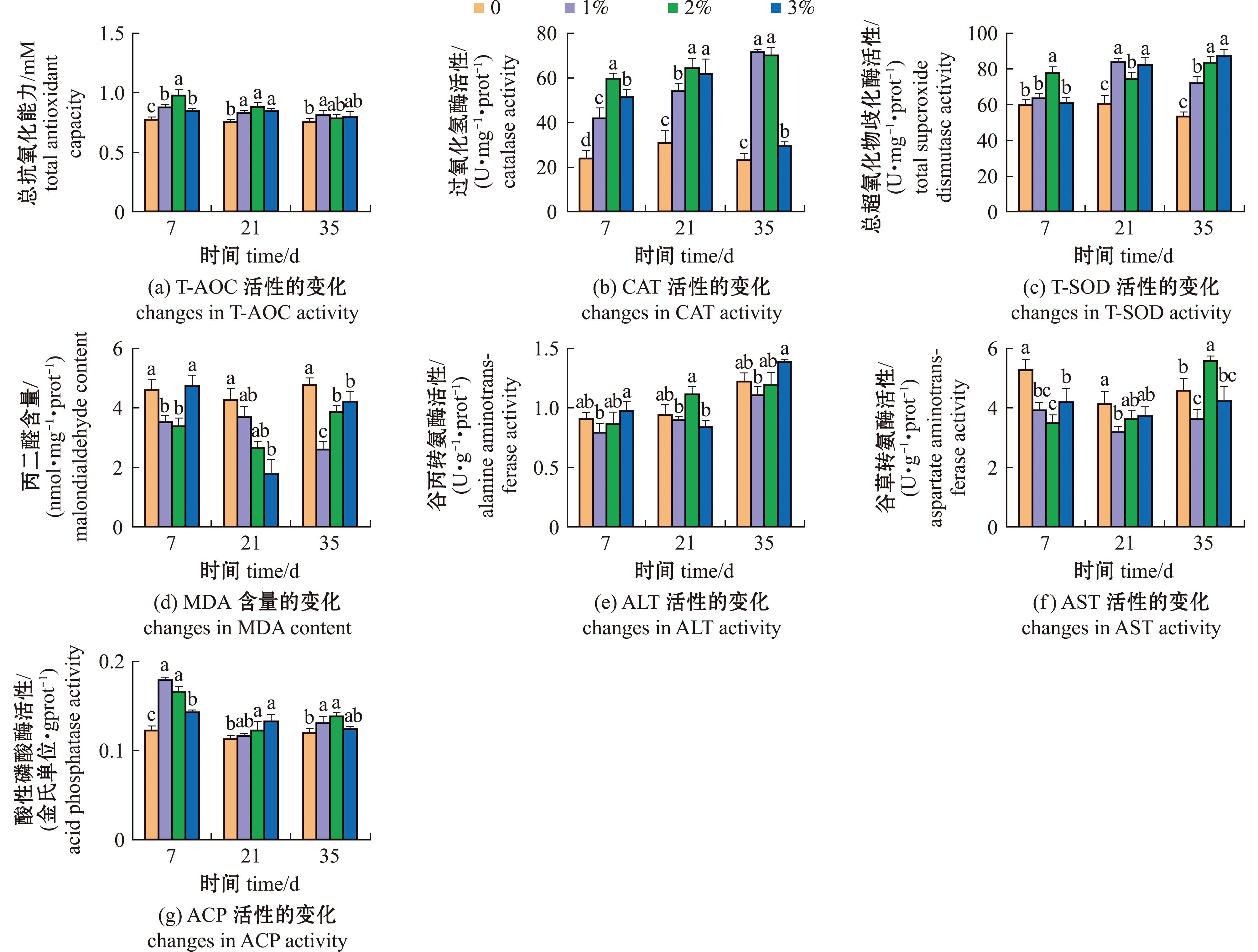
标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia.
图1 复方中草药对虹鳟肠道生化指标的影响
Fig.1 Effects of compound Chinese herbal medicine on the biochemical indexes of rainbow trout intestines
2.2 IHNV攻毒后复方中草药对虹鳟肠道生化指标的影响
对试验组虹鳟进行IHNV攻毒后,与对照组相比,各试验组T-AOC、T-SOD和ACP活性皆升高,呈先上升后下降趋势,MDA含量降低,呈先下降后上升趋势;ALT活性呈下降趋势,T-AOC、T-SOD和ACP活性在1%组最高,且显著高于对照组(P<0.05)。AST活性和MDA含量整体低于对照组,呈先下降后上升趋势,在1%组显著低于对照组(P<0.05)(图2)。
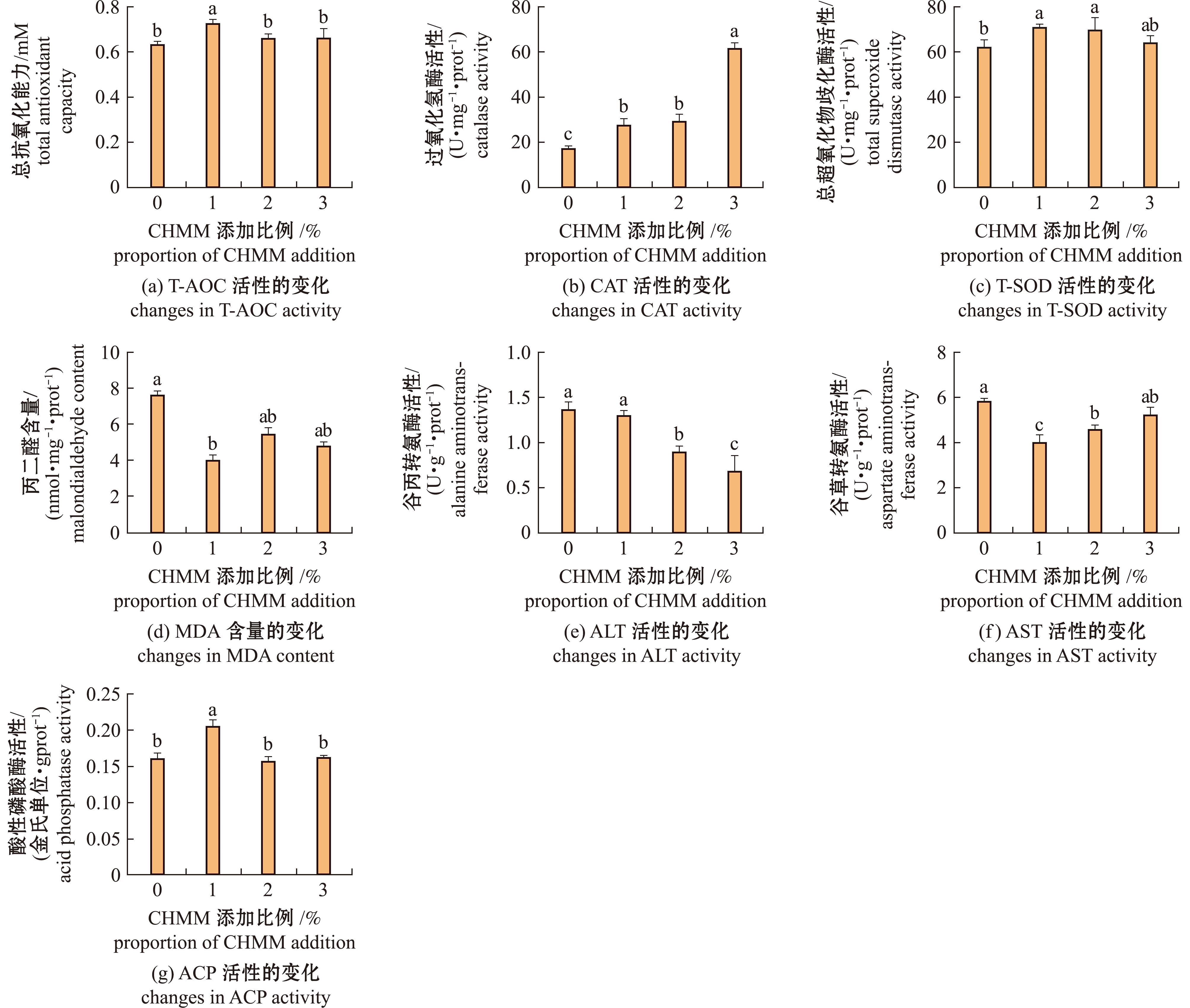
CHMM为复方中草药,下同。
CHMM stands for compound Chinese herbal medicine,et sequentia.
图2 IHNV攻毒后复方中草药对虹鳟肠道生化指标的影响
Fig.2 Effects of CHMM on the biochemical indicators of rainbow trout intestines infected with IHNV
2.3 复方中草药对虹鳟肠道免疫相关基因表达的影响
将本试验复方中草药饲喂虹鳟后,其免疫相关基因的表达受到不同程度上调或下调,同一基因的表达,也因添加比例的不同而上调或下调。添加1%本试验复方中草药jak1、il-8、il-1β、mda5、irf3、irf7、mx1和myd88基因相对表达量上升,而stat1和lgp2基因表达量下降;il-8基因表达量在2%组显著高于对照组(P<0.05),而在3%组显著低于对照组;il-1β和mx1基因表达量在1%、2%和3%组与对照组均无显著性差异(P>0.05)(图3)。
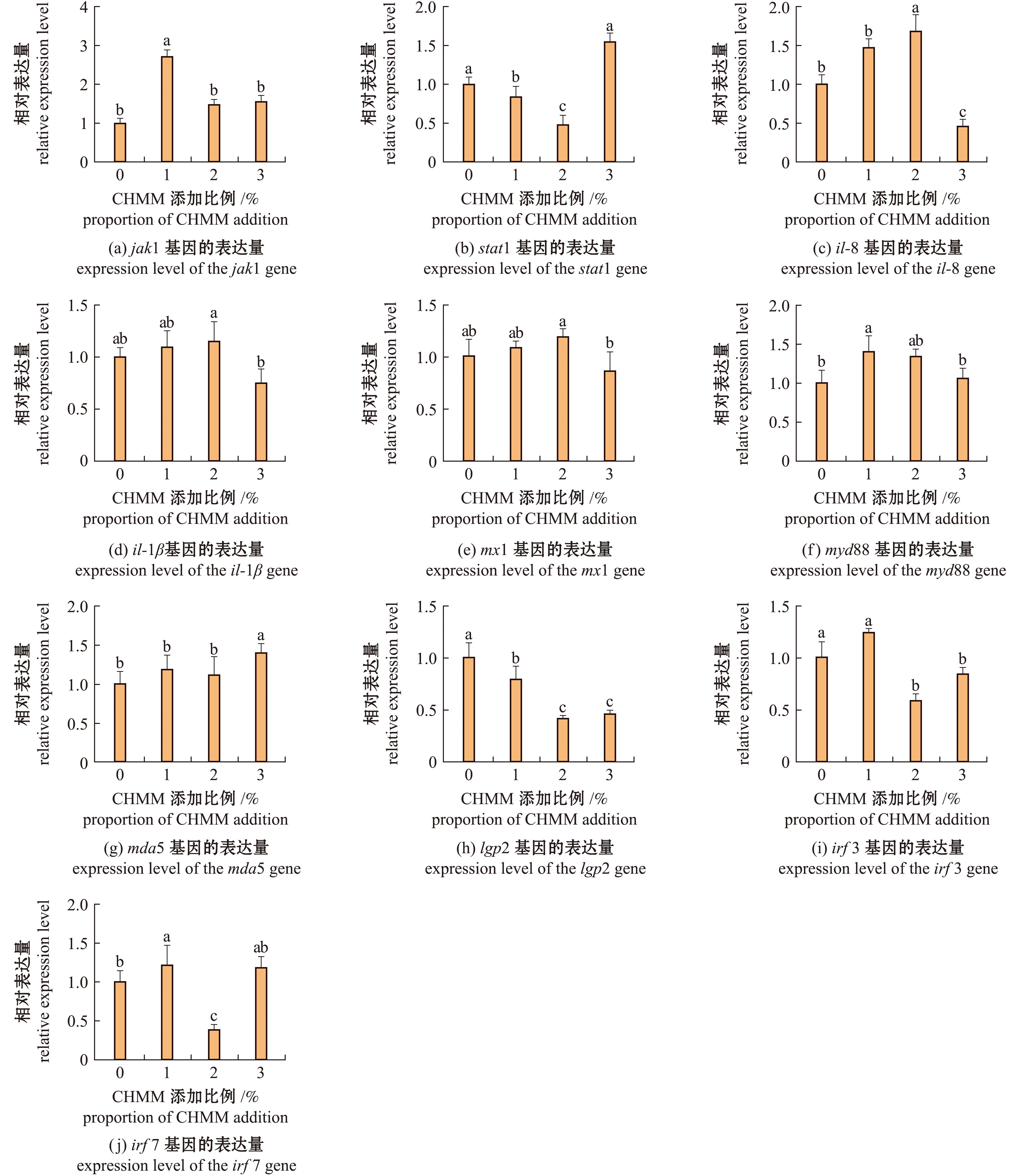
图3 复方中草药对虹鳟肠道免疫相关基因表达的影响
Fig.3 Effects of CHMM on immune-related genes expression in the intestines of rainbow trout
2.4 IHNV攻毒后复方中草药对虹鳟肠道免疫相关基因表达的影响
在本试验复方中草药与IHNV双重作用下,添加不同比例复方中草药对虹鳟肠道免疫相关基因表达的调节效果不同。添加1%复方中草药时,stat1、mx1、lgp2、il-1β、mda5、irf3和irf7基因表达量显著高于对照组(P<0.05),jak1基因表达量显著低于对照组。添加3%复方中草药时,与对照组相比,il-1β、mx1和irf3基因表达量显著降低(P<0.05),stat1、mx1、lgp2、mda5、myd88和irf7基因表达量无显著性变化(P>0.05)(图4)。
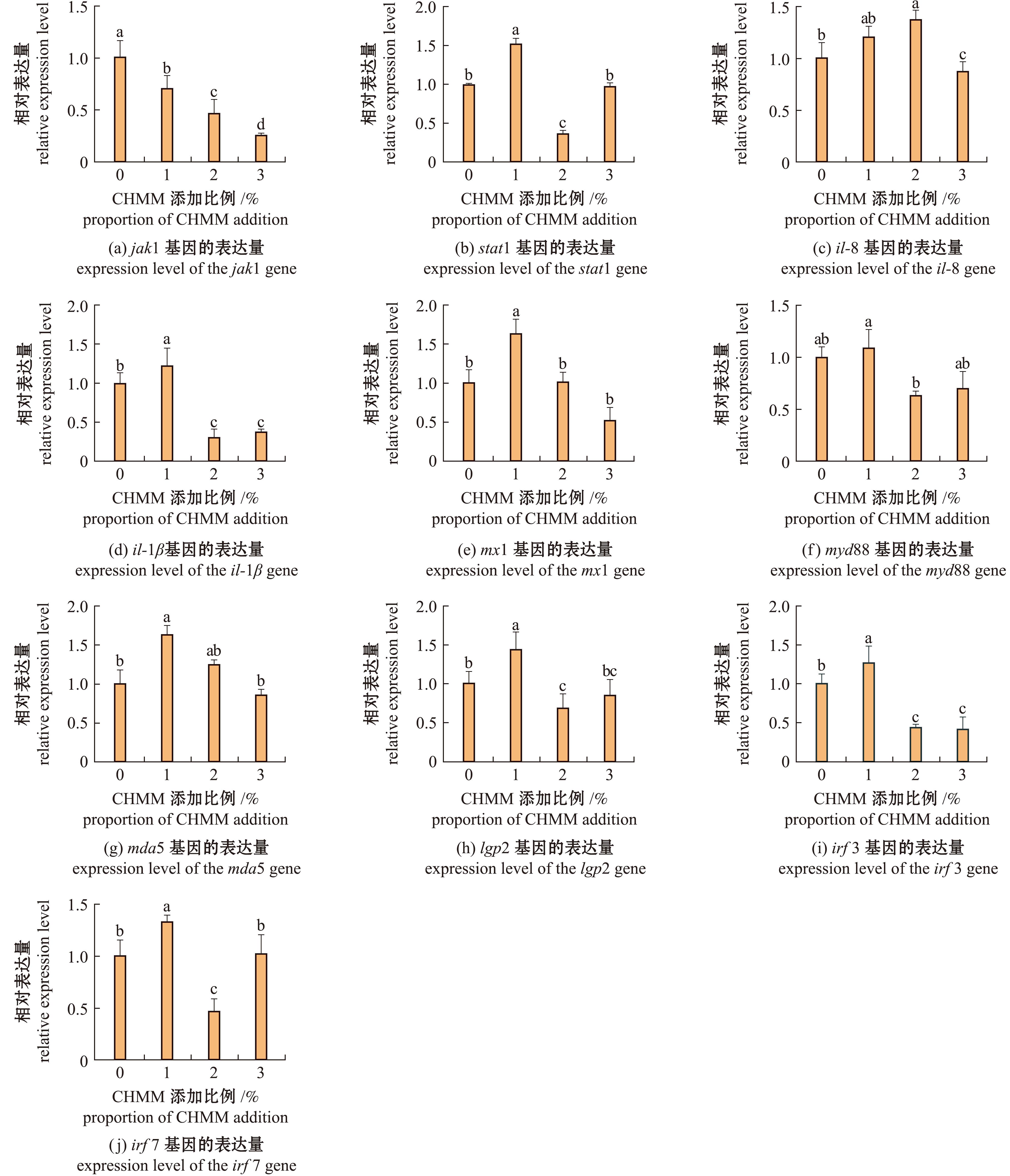
图4 IHNV攻毒后复方中草药对虹鳟肠道免疫相关基因表达的影响
Fig.4 Effects of CHMM on the immune-related genes expression in the intestines of infected rainbow trout with IHNV
3 讨论
复方中草药在水产养殖业中常用作饲料添加剂使用,其富含的多糖、黄酮类化合物及生物碱等活性成分已被证实可有效提升鱼类的生长性能与免疫调控能力。目前,针对复方中草药影响虹鳟免疫机制的研究已形成较完整的体系,现有文献多通过检测溶菌酶、SOD等生化指标,结合tlrs、tnf-α等免疫相关基因的动态表达变化,从酶活性、分子调控及细胞信号传导等多维度解析机体的免疫应答强度。本研究中选取10种已明确具有提高免疫力的中草药,分析其对虹鳟肠道抗氧化能力和免疫相关基因表达量的影响,发现其显著提升了虹鳟的抗氧化能力及免疫相关基因的表达,并增强了对IHNV的抵抗能力。
3.1 复方中草药对虹鳟肠道生化指标的影响
鱼类机体的抗氧化能力是其维持生理稳态、抵御外界胁迫的重要防御机制,其通过酶促和非酶促抗氧化系统清除过量活性氧(ROS)及自由基,防止氧化应激导致的细胞损伤。前期研究表明,向虹鳟基础饲料中加入复方中草药(红枣、山药、黄芪),能够显著提高虹鳟T-AOC、SOD和CAT活性[13]。T-AOC体现生物体内各种抗氧化物质和抗氧化酶等构成的总体抗氧化水平,其反映机体的总抗氧化能力[14]。CAT和SOD是重要的抗氧化酶,SOD作用于超氧阴离子,将其转化为过氧化氢和分子氧,再由CAT将过氧化氢分解为水和氧气,二者协同作用,消除超氧阴离子对细胞的毒害,以减轻自由基对机体的损伤[15]。有研究表明,黄芪、当归、党参中的黄芪黄酮、多糖和苷类等活性物质可以调节这些抗氧化酶的活性,从而提高机体的抗氧化能力,且添加剂量的递增表现出不同效果[16]。此外,谢远江等[17]指出,甘草黄酮也能够提高机体抗氧酶活性、抑制自由基生成。在本研究中,将复方中草药添加到虹鳟基础饲料后,其肠道T-AOC、SOD和CAT活性均高于对照组,且随添加比例的递增呈先上升后下降的趋势,并在2%组达到峰值。这表明本研究中复方中草药可以增强虹鳟肠道的抗氧化能力,并以添加2%时效果最佳。与此类似,Zheng等[18]向罗非鱼(Oreochromis niloticus)饲料中添加含有黄酮类化合物的中草药,曹丽萍等[19]向建鲤(Cyprinus carpio var. Jian)饲料中添加当归提取物,都得到与本研究相似的结果。在IHNV攻毒条件下,本研究试验组T-AOC、SOD和CAT活性均上升,综上所述,这可能与黄芪黄酮、甘草黄酮、多糖和苷类等活性物质降低抗氧化酶活性与抑制自由基生成有关,但也可能由其他原因导致,余润宇等[20]指出,黄芪的异黄酮类化合物可以通过增强机体的免疫应答来提升机体的抗氧化能力。以上研究表明,本研究复方中草药可以显著提升虹鳟的抗氧化能力,并增强其对病毒的抵抗能力。
MDA是细胞膜中不饱和脂肪酸与自由基反应形成的醛类物质,可以与蛋白质的游离氨基作用,引起蛋白质分子内与分子间交联,导致细胞损伤[21]。监测鱼类体内MDA含量可以评估其氧化应激水平和细胞损伤程度。此前的研究已经证实中草药对降低MDA含量具有积极作用。如张建明等[22]研究发现,黄芪、山楂、党参、茯苓、甘草等中草药可以显著增强鱼类的抗氧化酶活性,并降低MDA含量。曲桂娟等[23]向黄金鲫(Carassius auratus)幼鱼基础饲料中添加黄芪后,发现其SOD和CAT活性显著升高,而MDA含量显著降低。这些结果表明,中草药可以通过增强抗氧化酶活性来降低MDA含量,减轻细胞损伤。在本研究中,添加本试验复方中草药后,与对照组相比,MDA含量显著降低。这一现象可能与前文所述的抗氧化酶活性增强有关,中草药活性物质直接作用或通过增强抗氧化酶活性来清除自由基,从而降低MDA的生成。IHNV攻毒后,本试验添加复方中草药MDA含量降低,这说明本试验中复方中草药不仅可以降低正常条件下的氧化应激水平,还能在病毒感染后有效保护机体,减轻细胞损伤和氧化应激水平。综上所述,本试验复方中草药可以显著降低虹鳟的氧化应激水平,且在IHNV入侵后依然有效,能够显著降低病毒对机体的损害。
AST与ALT是机体内重要的氨基转氨酶,参与机体氨基酸的合成与分解代谢,是反映细胞氧化损伤的重要指标。王秀琴等[24]研究发现,甘草水提物可显著缓解过氧化氢所导致的细胞损伤,降低AST与ALT活性。赵珊等[25]发现,大黄素或单宁酸亦可降低鱼类AST与ALT活性。本研究中所用复方中草药含有大黄素和单宁酸,向虹鳟基础饲料添加1%本试验复方中草药时,攻毒前后AST与ALT活性均降低,这表明本试验复方中草药可以显著减轻细胞的氧化损伤。ACP是溶酶体的标志酶,在肠道上皮细胞核上区和固有层中大量分布,参与肠道对病原体的防御机制,ACP活性升高可以增强鱼类对外来入侵物质的分解能力,提高鱼类非特异性免疫能力。研究表明,黄芪、甘草等中草药对鱼类非特异性免疫指标具有显著的调节作用[26],如王凡等[27]研究发现,向虹鳟基础饲料加入含有黄芪的复方中草药,其ACP活性显著升高。在本研究中,添加2%复方中草药时,ACP活性均显著高于对照组。这可能是黄芪、甘草、茯苓等对肠道溶菌酶活性调节的结果[28]。综上所述,本试验复方中草药可以显著提高虹鳟的非特异性免疫指标,增强机体对病原体刺激的抵抗力。
3.2 复方中草药对虹鳟肠道免疫相关基因表达的影响
Toll样受体(TLRs)通路是免疫系统中至关重要的信号传导途径,当鱼体受到刺激后,TLRs通路被激活,识别病原体相关分子模式(PAMPs)。随后,MyD88被招募到TLR受体复合物。MyD88与IL-1受体相关激酶(IRAK)相互作用,启动信号转导,激活NF-κB和丝裂原活化蛋白激酶(MAPK)信号通路,促进IL-1β和IL-8的产生,以此诱导机体的炎症反应[29]。研究表明,中草药可以通过调控免疫相关基因的表达,从而增强鱼体的免疫能力。如Cai等[30]以中草药饲喂杂交石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatu♂),结果发现其肝脏、脾脏和头肾中il-8、il-1β、tnf-α等免疫基因表达上调。同样,Guo等[31]向大口黑鲈(Micropterus salmoides)饲料中加入山竹壳和石榴皮等的提取物,也得出了类似的结果。本研究中,在IHNV攻毒条件下,添加复方中草药后il-8和il-1β基因的表达量显著上调。这可能是由于病毒侵染激活宿主免疫识别受体,触发NF-κB和MAPK信号通路,诱导促炎因子快速释放以应对病原体入侵,而本试验复方中草药中的活性成分(如板蓝根多糖、甘草酸苷等)通过协同增强免疫应答效率,在病理状态下放大炎症信号以清除病毒,降低机体损伤[32]。
MDA5是一种在细胞质中识别病毒RNA的模式识别受体,它通过识别病毒RNA、激活干扰素信号通路及与其他免疫受体相互作用参与抗病毒免疫反应。LGP2与MDA5同属于RIG-I样受体家族成员,可以通过促进MDA5的活性增强干扰素的抗病毒免疫反应。章燕铃[33]研究发现,黄芪多糖可以显著上调鱼类lgp2和mda5的基因表达。如潘玉财等[34]以添加含有复方中草药(黄芪、金银花等)的饲料饲喂虹鳟,其脾脏中mda5和lgp2基因表达显著上调。在本研究中,IHNV攻毒后,mda5和lgp2基因表达量显著上调。这可能是黄芪等中草药活性成分激活RIG-I样受体信号通路,在IHNV刺激下,加强了其免疫基因表达的上调,以增强机体对病原体的识别和防御机制。IRF3和IRF7作为干扰素调节因子(IRFs)家族中的重要成员,在调控Ⅰ型干扰素的产生和抗病毒天然免疫反应中扮演着关键角色,它们在RIG-I-MAVS或TLR-MyD88信号通路被激活,从而促进Ⅰ型干扰素的产生[35]。Wang等[36]研究发现,黄芪、金银花、山楂等可以显著上调虹鳟组织中irf3和irf7的基因表达。本研究中,在IHNV攻毒和未攻毒条件下,添加1%复方中草药时虹鳟肠道irf3和irf7基因表达量均显著上调,这可能是黄酮醇类活性成分上调了其irf3和irf7的基因表达,从而促进了Ⅰ型干扰素的产生[37]。研究表明,干扰素与细胞表面受体结合,会激活JAK-STAT信号通路,使JAK1被激活,进而磷酸化STAT1,其结合到mx1基因启动子后,促进mx1的转录,使得MX1蛋白表达增加,从而发挥抗病毒的作用。杨星等[38]指出,中草药可以通过调节JAK-STAT信号通路增强人和动物的抗病能力。Song等[39]发现,中草药提取物可以显著上调鱼类jak1的基因表达,通过调节JAK-STAT信号通路增强机体免疫能力。在本研究中,攻毒后stat1和mx1基因表达显著上调,这可能与上述干扰素激活JAK-STAT通路有关,通过基因之间的相互调控,使得stat1基因表达的上调促进了mx1的基因表达。综上所述,向虹鳟基础饲料中添加复方中草药后,TLRs、NF-κB、JAK-STAT等信号通路会被激活,并通过相互调节增强机体的免疫能力。
4 结论
1)通过分析虹鳟肠道生化指标及免疫相关基因表达的变化,结果显示,添加2%本试验复方中草药对提升虹鳟肠道抗氧化能力和免疫力效果最佳。
2)本试验复方中草药能显著提高虹鳟肠道T-AOC、T-SOD、CAT和ACP活性,同时显著降低MDA含量及AST和ALT活性,增强其抗氧化能力。
3)饲喂本试验复方中草药,在IHNV攻毒前,虹鳟肠道的il-8、il-1β、myd88、irf3和irf7基因表达较对照组显著上调,mda5、lgp2和mx1基因表达无显著性变化。在IHNV攻毒后,其mda5、lgp2和mx1基因表达显著上调。
[1] 冒树泉,宋理平,许鹏,等.复方中草药对大鳞副泥鳅生长、消化酶及抗氧化能力的影响[J].大连海洋大学学报,2019,34(4):499-504.MAO S Q,SONG L P,XU P,et al.Effects of compound Chinese herbal medicines on growth,digestive enzyme activity and antioxidant ability of loach Paramisgurnus dabryanus[J].Journal of Dalian Ocean University,2019,34(4):499-504.(in Chinese)
[2] PU H Y,LI X Y,DU Q B,et al.Research progress in the application of Chinese herbal medicines in aquaculture:a review[J].Engineering,2017,3(5):731-737.
[3] 陈琼汝,高育冉,赵悦,等.鱼类应激反应的分子机理及防治措施综述[J].江苏农业科学,2024,52(3):27-34.CHEN Q R,GAO Y R,ZHAO Y,et al.Molecular mechanism of stress reaction in fish and its prevention and treatment measures:a review[J].Jiangsu Agricultural Sciences,2024,52(3):27-34.(in Chinese)
[4] 向静.黄芪多糖对黄鳝生长、消化酶活、免疫及肠道菌群的影响[D].荆州:长江大学,2023.XIANG J.Effects of Astragalus polysaccharides on growth,digestive enzyme activity,immunity and intestinal flora of swamp eel (Monopterus albus) [D].Jingzhou:Yangtze University,2023.(in Chinese)
[5] 付廷斌,来琦芳,高宝德,等.复方中草药对杂交鲟抗氧化、非特异性免疫及消化酶活性的影响[J].饲料研究,2022,45(5):58-61.FU T B,LAI Q F,GAO B D,et al.Effect of compound Chinese herbal medicine on antioxidant,nonspecific immunity and digestive enzyme activity of hybrid sturgeon[J].Feed Research,2022,45(5):58-61.(in Chinese)
[6] WANG Q,SHEN J Y,YAN Z T,et al.Dietary Glycyrrhiza uralensis extracts supplementation elevated growth performance,immune responses and disease resistance against Flavobacterium columnare in yellow catfish (Pelteobagrus fulvidraco)[J].Fish &Shellfish Immunology,2020,97:153-164.
[7] HSIEH ML,NISHIZAKI D,ADASHEK J J,et al.Toll-like receptor 3:a double-edged sword[J].Biomarker Research,2025,13(1):32.
[8] KHIEOKHAJONKHET A,SUWANNALERS P,AEKSIRI N,et al.Effects of dietary Hericium erinaceus extract on growth,nutrient utilization,hematology,expression of genes related immunity response,and disease resistance of Nile tilapia(Oreochromis niloticus)[J].Fish Physiology and Biochemistry,2024,50(6):2519-2534.
[9] 戴小连.褐点石斑鱼天然免疫增强剂筛选及黄芪对其免疫功能影响研究[D].海口:海南大学,2012.DAI X L.Screening of natural immune enhancers for Epinephelus fuscipes and study on the effect of Astragalus membranaceus on its immune function[D].Haikou:Hainan University,2012.(in Chinese)
[10] VERHELST J,HULPIAU P,SAELENS X.Mx proteins:antiviral gatekeepers that restrain the uninvited[J].Microbiology and Molecular Biology Reviews,2013,77(4):551-566.
[11] 周林,杨慧,艾有生,等.中药单体抗TNF-α介导的炎症反应机制研究进展[J].南昌大学学报(医学版),2013,53(3):72-75,78.ZHOU L,YANG H,AI Y S,et al.Research progress on anti-TNF-α-mediated inflammatory response mechanism of traditional Chinese medicine monomer[J].Journal of Nanchang University (Medical Sciences),2013,53(3):72-75,78.(in Chinese)
[12] WANG X Y,QU P,HUANGFU Y X,et al.A compound of herbs improves the growth performance,intestinal and liver histology,antioxidative capacity and immunity of juvenile large yellow croaker Larimichthys crocea[J].Aquaculture Reports,2024,36:102086.
[13] 罗其勇.重金属暴露引起鱼体氧化应激反应的研究进展[J].安徽农业科学,2018,46(25):32-35.LUO Q Y.Research progress on oxidative stress reaction of fish body caused by heavy metals[J].Journal of Anhui Agricultural Sciences,2018,46(25):32-35.(in Chinese)
[14] SILVESTRINI A,MEUCCI E,RICERCA B M,et al.Total antioxidant capacity:biochemical aspects and clinical significance[J].International Journal of Molecular Sciences,2023,24(13):10978.
[15] 周晏琳,刘洋,李亚烜,等.虾夷扇贝抗氧化酶SOD和CAT与活品贮藏稳定性的关联[J].食品工业科技,2020,41(6):254-258,271.ZHOU Y L,LIU Y,LI Y X,et al.Correlation of antioxidant enzyme SOD and CAT to live storage stability of yesso scallop (Patinopecten yessoensis)[J].Science and Technology of Food Industry,2020,41(6):254-258,271.(in Chinese)
[16] 何丽斌,杨求华,李慧耀,等.复方中草药对小丑鱼非特异性免疫、消化酶活性的影响及对刺激隐核虫杀灭效果分析[J].海洋科学,2024,48(2):32-42.HE L B,YANG Q H,LI H Y,et al.Effects of a Chinese herbal compound on nonspecific immunity,digestive enzyme activities,and extermination of the parasite Cryptocaryon irritans from Amphiprion frenatus[J].Marine Sciences,2024,48(2):32-42.(in Chinese)
[17] 谢远江,李文霞,华岩.甘草黄酮对力竭运动小鼠血清抗氧化、抗炎及免疫指标的影响[J].扬州大学学报(农业与生命科学版),2025,46(2):32-37.XIE Y J,LI W X,HUA Y.Effects of licorice flavonoids on antioxidant,anti-inflammatory and immune functions in serum of exhaustive exercise mice[J].Journal of Yangzhou University (Agricultural and Life Science Edition),2025,46(2):32-37.(in Chinese)
[18] ZHENG T,JIA R,CAO LP,et al.Alleviative effects of Ginkgo biloba extract on oxidative stress,inflammatory response and immune suppression induced by long-term glyphosate exposure in Tilapia (Oreochromis niloticus)[J].Aquaculture,2022,546:737325.
[19] 曹丽萍,贾睿,丁炜东,等.建鲤急性肝损伤模型的建立及当归提取物的保肝和抗氧化作用研究[J].大连海洋大学学报,2012,27(6):551-557.CAO L P,JIA R,DING W D,et al.Establishment of the acute hepatic injury model and antioxidant effects of extract from Angelica sinennsis in common carp Cyprinus carpio var.jian[J].Journal of Dalian Ocean University,2012,27(6):551-557.(in Chinese)
[20] 余润宇,赵文昌,杨芷胭,等.毛蕊异黄酮抗炎作用研究进展[J].中草药,2025,56(6):2238-2248.YU R Y,ZHAO W C,YANG Z Y,et al.Research progress on anti-inflammatory effects of calycosin[J].Chinese Traditional and Herbal Drugs,2025,56(6):2238-2248.(in Chinese)
[21] JOV M,MOTA-MARTORELL N,PRADAS I,et al.The advanced lipoxidation end-product malondialdehyde-lysine in aging and longevity[J].Antioxidants,2020,9(11):1132.
M,MOTA-MARTORELL N,PRADAS I,et al.The advanced lipoxidation end-product malondialdehyde-lysine in aging and longevity[J].Antioxidants,2020,9(11):1132.
[22] 张建明,张德志,田甜,等.复方中草药对长江鲟幼鱼免疫、抗氧化及抗病力的影响[J].饲料研究,2023,46(22):49-54.ZHANG J M,ZHANG D Z,TIAN T,et al.Effect of compound Chinese herbal medicine on immunity,antioxidant and disease resistance of juvenile Acipenser dabryanus[J].Feed Research,2023,46(22):49-54.(in Chinese)
[23] 曲桂娟,孟鹤媛,魏佳淇,等.复方中草药对黄金鲫幼鱼生长及抗氧化能力影响的研究[J].中国饲料,2023(23):103-106.QU G J,MENG H Y,WEI J Q,et al.Effects of compound Chinese herbal medicine on growth and antioxidant capacity of juvenile golden crucian carp[J].China Feed,2023(23):103-106.(in Chinese)
[24] 王秀琴,张春晓,鲁康乐,等.中草药对花鲈肝细胞氧化损伤的保护作用[J].集美大学学报(自然科学版),2021,26(5):408-414.WANG X Q,ZHANG C X,LU K L,et al.Protective effect of Chinese herbal medicine oxidative damaged hepatocytes in primary culture of spotted seabass (Lateolabrax maculatus)[J].Journal of Jimei University (Natural Science Edition),2021,26(5):408-414.(in Chinese)
[25] 赵珊.五甘散及其活性成分对鲤鱼生长和免疫的作用机制研究[D].沈阳:辽宁大学,2023.ZHAO S.Study on the mechanism of Wugan powder and its active components on the growth and immunity of carp[D].Shenyang:Liaoning University,2023.(in Chinese)
[26] HOU T L,LIU H R,LI C T.Traditional Chinese herb formulas in diet enhance the non-specific immune responses of yellow catfish (Pelteobagrus fulvidraco) and resistance against Aeromonas hydrophila[J].Fish &Shellfish Immunology,2022,131:631-636.
[27] 王凡,李聪歌,马雅雯,等.复方中草药对虹鳟生长和非特异性免疫功能的影响[J].水产学杂志,2021,34(2):8-14.WANG F,LI C G,MA Y W,et al.Effects of Chinese herbal compound on growth performance and non-specific immunity in rainbow trout (Oncorhynchus mykiss)[J].Chinese Journal of Fisheries,2021,34(2):8-14.(in Chinese)
[28] 线婷,王荻,刘红柏.黄芪、甘草、茯苓对施氏鲟非特异性免疫功能的影响[J].大连海洋大学学报,2018,33(3):365-369.XIAN T,WANG D,LIU H B.Effects of Chinese herbal medicines Astragalus mongholicus,Glycyrrhiza uralensis and Poria cocos on non-specific immunity in Amur sturgeon[J].Journal of Dalian Ocean University,2018,33(3):365-369.(in Chinese)
[29] 巩婷婷,司凯,刘会平,等.MAPK级联调控细胞生长及其在免疫、炎症及癌症中作用的研究进展[J].中南大学学报(医学版),2022,47(12):1721-1728.GONG T T,SI K,LIU H P,et al.Research advances in the role of MAPK cascade in regulation of cell growth,immunity,inflammation,and cancer[J].Journal of Central South University (Medical Science),2022,47(12):1721-1728.(in Chinese)
[30] CAI J,YANG Z G,HUANG Y,et al.Effects of Chinese herbal medicines on growth performance,intestinal flora,immunity and serum metabolites of hybrid grouper (Epinephelus fuscoguttatus♀×Epinephelus lanceolatu♂)[J].Fish &Shellfish Immunology,2023,140:108946.
[31] GUO H Y,CHEN J,YUAN X M,et al.The combined effect of a novel formula of herbal extracts on bacterial infection and immune response in Micropterus salmoides[J].Frontiers in Microbiology,2023,14:1185234.
[32] 赵若莲,柴琳,周宏,等.板蓝根提取物对肺炎支原体感染小鼠血清白介素-6、肿瘤坏死因子-α和白介素-17A的影响研究[J].中国当代医药,2024,31(7):14-17.ZHAO R L,CHAI L,ZHOU H,et al.Study on the effect of extract of Radix isatidis on interleukin-6,tumor necrosis factor-α,interleukin-17A of Mycoplasma pneumoniae-infected mice in serum[J].China Modern Medicine,2024,31(7):14-17.(in Chinese)
[33] 章燕铃.黄芪多糖对芙蓉鲤鲫生长、肉质及免疫的影响[D].长沙:湖南农业大学,2022.ZHANG Y L.Effects of Astragalus polysaccharide on growth,meat quality and immunity of Furong carp and crucian carp[D].Changsha:Hunan Agricultural University,2022.(in Chinese)
[34] 潘玉财,黄进强,李永娟,等.复方中草药对虹鳟脾脏非特异性免疫指标及免疫相关基因表达的影响[J].农业生物技术学报,2022,30(8):1580-1593.PAN Y C,HUANG J Q,LI Y J,et al.Effects of compound Chinese herbal medicine on non-specific immunity parameters and immune-related gene expressions in spleen of rainbow trout(Oncorhynchus mykiss)[J].Journal of Agricultural Biotechnology,2022,30(8):1580-1593.(in Chinese)
[35] CHEN X W,SHEN Y W,WU M L,et al.Irf3 from mandarin fish Thymus initiates interferon transcription[J].Fish Physiology and Biochemistry,2019,45(1):133-144.
[36] WANG Q,HUANG J Q,LI Y J,et al.Chinese herbal medicines mixture improved antioxidant enzymes,immunity and disease resistance to infectious hematopoietic necrosis virus infection in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture International,2024,32(3):3217-3232.
[37] 廖文钰.肉桂及其黄酮醇类活性成分抗大口黑鲈虹彩病毒作用及机制研究[D].钦州:北部湾大学,2024.LIAO W Y.Study on the anti-iridovirus effect and mechanism of Cinnamomum cassia and its flavonoids and alcohols[D].Qinzhou:Beibu Gulf University,2024.(in Chinese)
[38] 杨星,李淑娣,刘江凯,等.中药调控Janus激酶/信号转导和转录激活因子(JAK/STAT)信号通路防治肝细胞癌的研究现状[J].临床肝胆病杂志,2023,39(11):2718-2729.YANG X,LI S D,LIU J K,et al.Current research status of traditional Chinese medicine in the prevention and treatment of hepatocellular carcinoma by regulating the JAK/STAT signaling pathway[J].Journal of Clinical Hepatology,2023,39(11):2718-2729.(in Chinese)
[39] SONG Z X,JIAO C R,CHEN B Y,et al.Dietary Acanthopanax senticosus extracts modulated the inflammatory and apoptotic responses of yellow catfish to protect against Edwardsiella ictaluri infection[J].Aquaculture Research,2021,52(10):5078-5092.