地西泮(Diazepam,CAS 439-14-5),作为苯二氮 类药物的典型代表,于20世纪60年代引入兽药领域[1]。该药物主要作用于中枢神经系统(包括大脑皮质和脊髓等)的γ-氨基丁酸A型(GABAA receptor)受体,发挥镇静、抗惊厥及骨骼肌松弛等药理效应[2-3]。鉴于其成瘾性与中枢抑制作用,该化合物被列为国家Ⅱ类精神药品进行管控[4] 。然而,近年来监管部门发布的水产品质量安全监测数据显示,淡水养殖产品中地西泮残留超标事件呈多发态势。现行《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)中规定,地西泮不得在动物性食品中检出。2024年最新修订的《水产养殖用药明白纸》更强调禁止所有水产养殖动物使用地西泮,突显其已成为水产品安全监管的重点风险因子。
类药物的典型代表,于20世纪60年代引入兽药领域[1]。该药物主要作用于中枢神经系统(包括大脑皮质和脊髓等)的γ-氨基丁酸A型(GABAA receptor)受体,发挥镇静、抗惊厥及骨骼肌松弛等药理效应[2-3]。鉴于其成瘾性与中枢抑制作用,该化合物被列为国家Ⅱ类精神药品进行管控[4] 。然而,近年来监管部门发布的水产品质量安全监测数据显示,淡水养殖产品中地西泮残留超标事件呈多发态势。现行《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)中规定,地西泮不得在动物性食品中检出。2024年最新修订的《水产养殖用药明白纸》更强调禁止所有水产养殖动物使用地西泮,突显其已成为水产品安全监管的重点风险因子。
药理学研究表明,饲料适度添加地西泮可促进鱼类生长[5]。垂钓饵料中检出高浓度地西泮[6],水环境监测证实饮用水体、地表水、海水及污水处理系统普遍存在该药物残留[7-8]。此外,在野生头角木叶鲽(Pleuronichthys verticalis)肝脏中检测出地西泮浓度显著高于环境本底值[9],揭示水生生物具有从环境富集该药物的特性;地西泮还具备与丁香酚相似的抗应激活性[10],能缓解水生动物在环境胁迫下表现出的焦虑行为[11]。因此,地西泮对水产品的污染途径具有复杂性和多样性。
从代谢动力学角度分析,哺乳动物(包括马[12-13] 、大鼠[14]、兔[15]、猫[16]及人类[17])体内地西泮经P450酶系代谢为去甲基地西泮(Nordazepam)和替马地西泮(Temazepam),继而转化为次级代谢物奥沙地西泮(Oxazepam),且转化路径较为明确[13]。然而,水生动物代谢研究较少,现有文献局限于低浓度给药方式[18],缺乏对地西泮及主要代谢产物动态变化特征的系统解析,制约了残留溯源工作的科学判断。
监管部门在地西泮残留超标事件追溯中常面临多重障碍,包括缺乏养殖过程连续监测数据、流通链条存在记录断点等,导致难以确定违规用药责任主体。现有监测标准仅针对母体化合物,且缺乏代谢产物的动态变化数据,使得通过残留结果反推暴露时间的科学依据不足。同时,环境本底对生物的药物富集效应尚未明确,导致现行“不得检出”标准在环境暴露情景下,法律适用性存在争议。本研究中以草鱼(Ctenopharyngodon idella)为研究对象,采用药浴暴露-清水消除的试验模式,系统解析了地西泮及其代谢产物在鱼体组织中的生物累积与消除动力学特征,并据此推算休药期。同时模拟低浓度环境暴露场景,定量评估水生生物地西泮富集阈值。研究结果可为行业主管部门完善风险管控体系、优化残留监测方案提供数据支撑,且对提升水产品质量安全监管有一定实践价值。
1 材料和方法
1.1 材料
试验动物:试验草鱼体长为(25.0±2.0)cm,由漳州市华安县华丰镇草坂村养殖户提供。试验前在室内循环水养殖池内暂养2周以上,期间弃掉活力较差鱼。采用自来水进行暂养,使用前曝气24 h,水体pH值7.0~7.5、水温23 ℃±1 ℃,养殖过程不断充氧,保持水中溶解氧大于6.0 mg/L,每天换水约1/3。投喂通威集团控股份有限公司生产的鱼用膨化配合饲料(181型号浮料颗粒2~3 mm),正式试验前3 d禁食,检测饲料及试验鱼中均无地西泮及其主要代谢物残留。
试剂:地西泮、去甲地西泮、替马地西泮、奥沙地西泮标准品(纯度≥99%,Sigma);地西泮氘代内标(DZP-D5)(10 μg/mL,天津阿尔塔科技);复方地西泮片(含量1.25 mg/片,济宁市安康制药有限责任公司);甲醇、乙腈、乙酸铵、甲酸、氨水(色谱纯,德国Merck);无水硫酸镁(经650 ℃灼烧4 h于干燥器中冷却备用,国药集团化学试剂有限公司);乙酸铵缓冲液(溶解7.7 g乙酸铵于480 mL水中,用冰乙酸调节pH值到5.2,水定容到500 mL);β-葡萄糖醛酸苷酶-芳基硫酸酯酶(含β-葡萄糖醛酸苷酶134 600 U/mL,芳基硫酸酯酶5 200 U/mL,德国Merck);N-丙基乙二胺吸附剂(PSA,粒径范围40~60 μm,平均孔径100 Å)、十八烷基键合硅胶吸附剂(C18-封端,粒径范围0~60 μm,平均孔径100 Å)、石墨化炭黑吸附剂(GCB,粒径范围40~60 μm,平均孔径60 Å)(上海安谱实验科技有限公司);吸附剂1:100 mgPSA、40 mgC18和600 mg无水MgSO4;吸附剂2:100 mgPSA、50 mgC18、20 mgGCB和400 mg无水MgSO4。
主要仪器:液相色谱-串联质谱联用仪,配电喷雾离子源(TSQ QUANTUM ULTRA,美国Thermofisher);离心机(TGL-16G、TDL-40B,上海安亭);电子分析天平(AB204-E,瑞士梅特勒托利多公司);旋涡混合器(IKA MS3,上海申生科技有限公司);水浴恒温振荡器(SHA-B,常州国华电器有限公司);旋转蒸发仪(N-1300S,东京理化器械株式会社);纯水器(Milli-Q Intengral,美国Millipore公司)。
1.2 方法
1.2.1 累积消除规律 用200 ng/mL地西泮药浴草鱼7 h,期间不断曝气。分别在0.5、1、2、3、5、7 h时间点采样。药浴结束后转入清水中,在0.5、1 、2、5、8、16、24、48、72、96、192、240、288、336、432、528、624、720、816、1 008、1 344 h时间点采样。每个时间点取6尾鱼设置为一组,试验设置3组重复。采集鱼背部肌肉用均质机均质,置于样品袋中;肝脏用研钵研碎,置于10 mL塑料离心管中;鱼血用10 g/L抗肝素钠抗凝,离心取上清血浆于10 mL塑料离心管中。样品保存于-20 ℃冰箱中。
1.2.2 休药期试验 地西泮休药期的计算,采用欧洲药品管理局(European Medicines Agency,EMA)估算休药指南[19]。即lnCt=-kt+lnC0,Ct为不同时间点组织中药物浓度,C0为绘制休药期曲线组织中药物的起始浓度。EMA以动物组织中药残浓度低于最高残留限量(MRL)的时间为休药期(d)。如结果不是整数,应以“d”为单位向上取整。休药期估算使用线性回归结果,以单侧正态分布95%置信度95%容许上限计算药物在组织中不同时间点残留量水平。参与计算的数据需满足方差齐性检验、失拟检验、残差正态分布检验要求。根据国标GB 31650—2019规定,水产中地西泮限量标准(MRL)为“不得检出”。以草鱼肌肉为靶组织,选取代谢末期靶组织中地西泮浓度接近“未检出”的时间点,采用线性外推方式计算达到检测限的时间为休药期。
1.2.3 模拟鱼低浓度水平自然环境暴露 采用0.05、0.10、0.50、1.00、1.50、2.00 ng/mL等6个浓度梯度的地西泮药浴暴露72 h,每天更换50%的水体并补充等量地西泮。药浴结束后每个梯度采集6尾鱼作为一组样,设置3组重复。分别制备肌肉、血浆和肝脏样品,于-20 ℃冰箱中保存。
1.2.4 样品前处理 检测草鱼组织中地西泮及其主要代谢物的前处理方法,主要参照《出口动物源食品中多类禁用药物残留检测方法 液相色谱-质谱/质谱法》SN/T 3235—2012进行。
将冷冻保存样品于室温下自然解冻后称取样品(肌肉取2 g、血浆取0.2 g、肝脏取0.2 g)。加入内标液和8 mL乙酸铵缓冲液,涡旋30 s。加入30 μL的β-葡萄糖醛酸苷酶-芳基硫酸酯酶,37 ℃下震荡温育12 h。加入15 mL 1%氨水-乙腈溶液和5 g无水硫酸钠,涡旋混匀1 min。4 ℃下以9 500 r/min离心5 min,收集上清液于50 mL离心管中,用10 mL 1%氨水-乙腈重复提取一次残渣,合并上清液。肌肉和血浆样品提取液加入吸附剂1,肝脏样品提取液加入吸附剂2,涡旋1 min。4 ℃下以9 500 r/min离心5 min,上清液转入减压旋转蒸发仪上于42 ℃蒸发近干。加入2.0 mL 10%乙腈-水溶液溶解残渣,过0.22 μm有机相滤膜,供液相色谱-串联质谱联用仪测定。
1.2.5 仪器检测方法 色谱条件:Thermo Gold C18(2.1 mm×150 m,3.0 μm);流量:0.25 mL/min;柱温:30 ℃;进样量:10 μL;流动相:A为0.1%甲酸水溶液,B为甲醇溶液,梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Tab.1 Mobile phase gradient elution program %
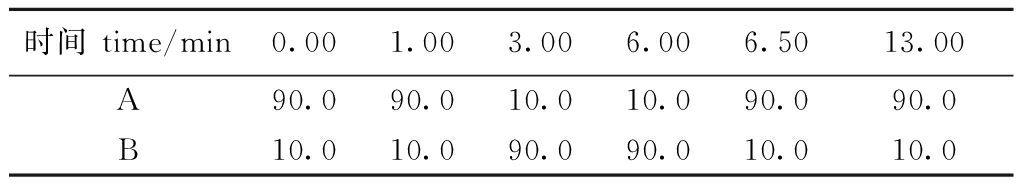
时间 time/min0.001.003.006.006.5013.00A90.090.010.010.090.090.0B10.010.090.090.010.010.0
质谱条件:离子源为电喷雾离子源(ESI);扫描方式为正离子扫描;监测方式为多反应监测(MRM);喷雾毛细管电压为3 000 V;离子传输管温度为350 ℃;鞘气流量为45 psi;辅气流量为3.33 L/min;碰撞气为氩气;定性离子对、定量离子对和碰撞能量见表2。
表2 地西泮及其代谢物多重反应监测参数
Tab.2 Multiple reaction monitoring parameters for diazepam and its metabolites
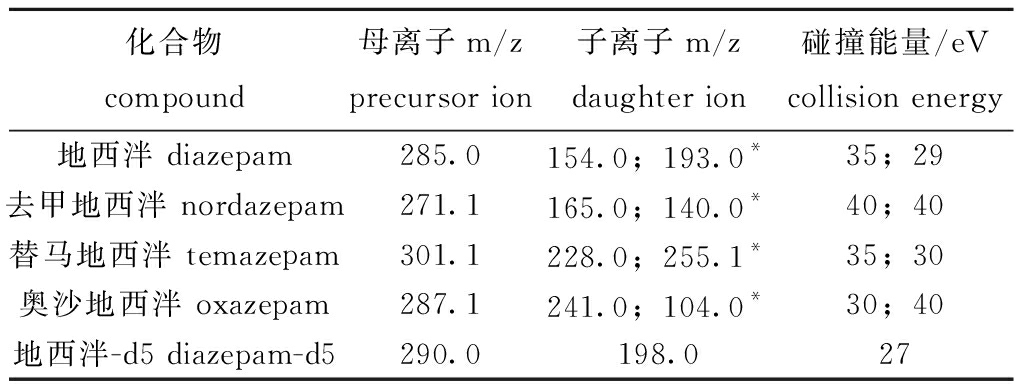
化合物compound母离子m/zprecursor ion子离子m/zdaughter ion碰撞能量/eVcollision energy地西泮 diazepam285.0154.0;193.0*35;29去甲地西泮 nordazepam271.1165.0;140.0*40;40替马地西泮 temazepam301.1228.0;255.1*35;30奥沙地西泮 oxazepam287.1241.0;104.0*30;40地西泮-d5 diazepam-d5290.0198.027
注:*为定量离子。
Note:* quantitative ions.
1.2.6 标准曲线绘制 用空白基质液配制地西泮及其3种代谢物浓度为0.05、0.5、5.0、10.0、50.0、100、200 ng/mL系列标准溶液,内标浓度均为5.0 ng/mL。绘制标准曲线计算地西泮及其代谢物含量。
1.3 数据处理
采用DAS2.0药代动力学软件进行模型拟合及计算主要代谢动力学参数。采用SPSS 22.0统计软件进行数据相关性、显著性和方差分析计算,采用Origin 9.0软件绘制线条图。
2 结果与分析
2.1 检测结果的可靠性
试验取空白组织样,加入相当于浓度为0.5、20.0、200.0 μg/kg的地西泮及其代谢物,每个浓度设置6个平行样品,地西泮回收率为88.2%~106%、相对标准偏差为4.15%~8.31%;去甲地西泮回收率为84.4%~104%、相对标准偏差为3.22%~6.24%;替马地西泮回收率为86.4%~98.2%、相对标准偏差为5.15%~7.46%;奥沙地西泮回收率为78.2%~93.4%、相对标准偏差为5.13%~7.11%。
2.2 药浴累积过程
水温23 ℃±1 ℃条件下200 ng/mL地西泮药浴暴露。草鱼肌肉、血浆、肝脏中地西泮及其代谢物累积如图1~图3所示。地西泮、去甲地西泮、替马地西泮在草鱼3种组织中累积符合一室吸收模型,相关动力学参数见表3。
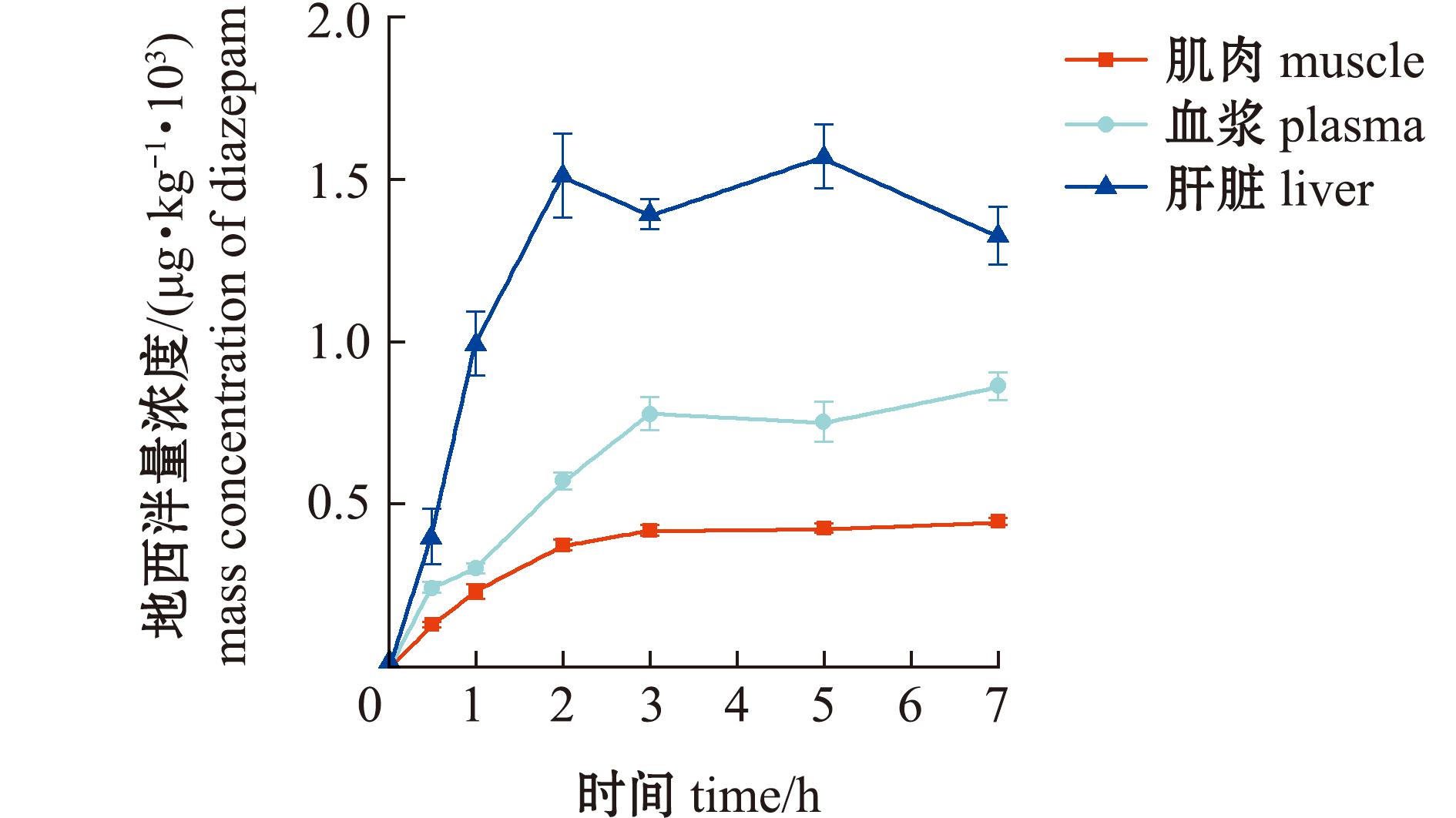
图1 药浴过程组织中地西泮药-时曲线
Fig.1 Diazepam concentration in tissues during medicinal bath
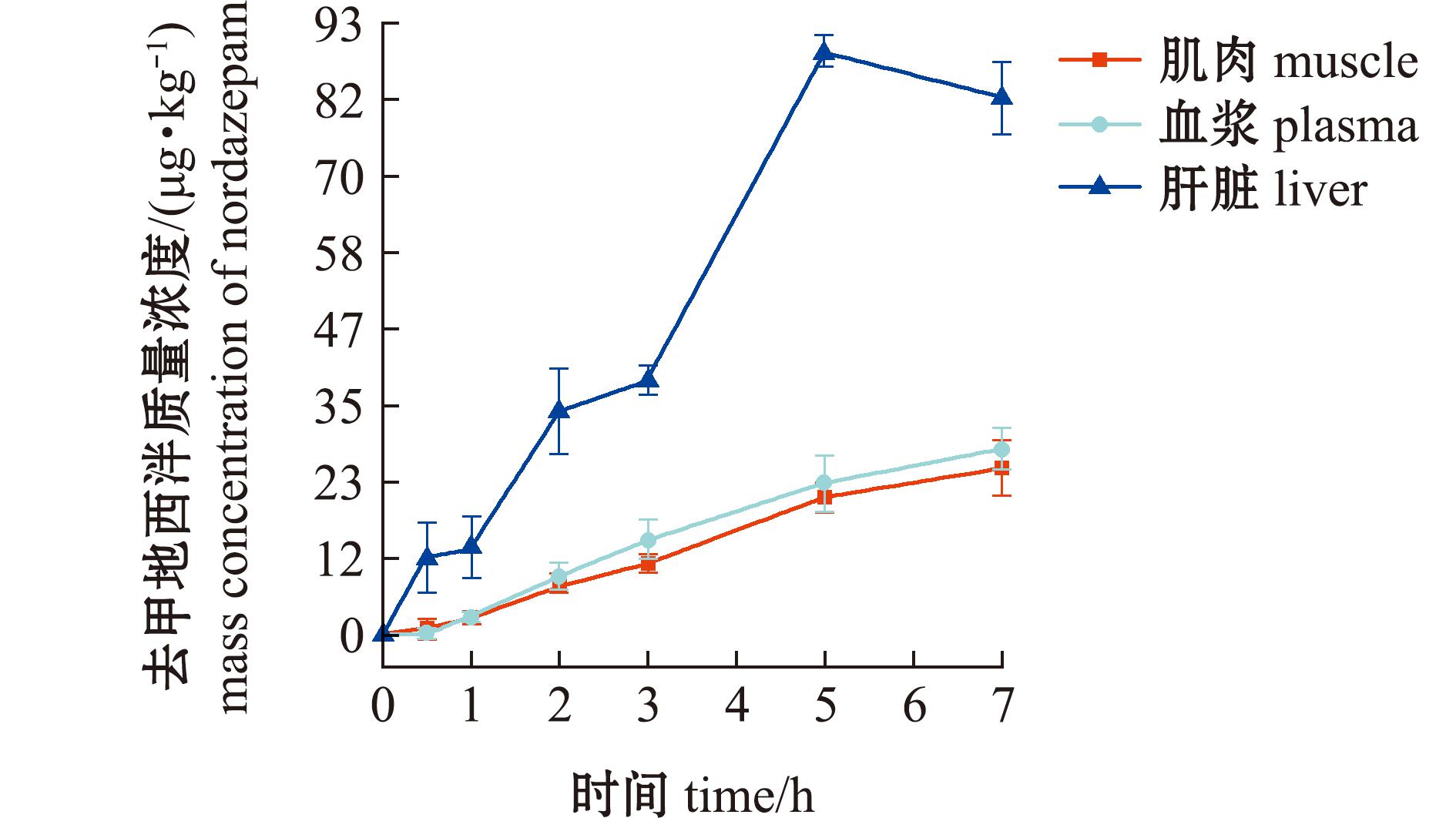
图2 药浴过程组织中去甲地西泮药-时曲线
Fig.2 Nordazepam concentration in tissues during medicinal bath
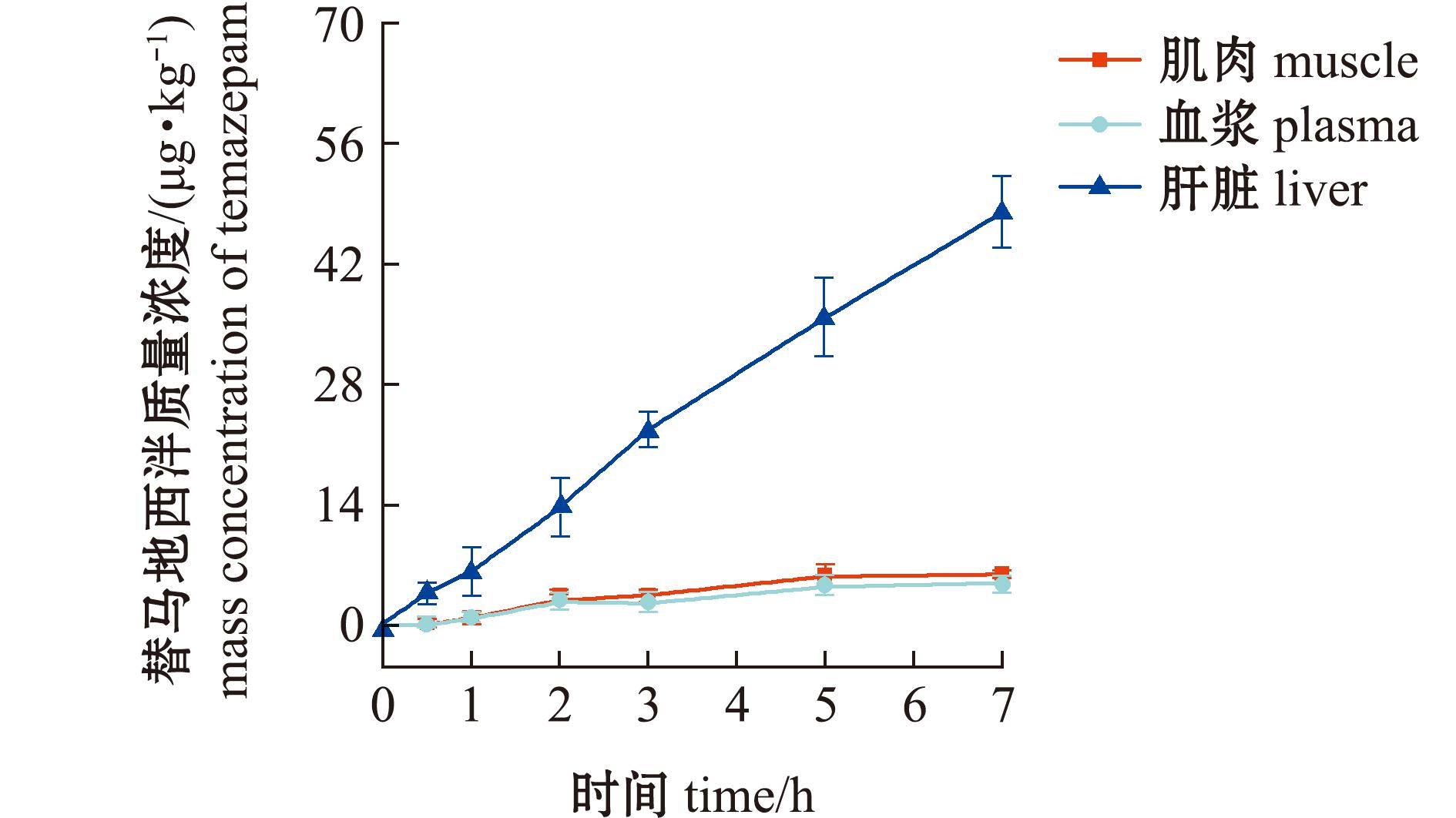
图3 药浴过程组织中替马地西泮药-时曲线
Fig.3 Temazepam concentration in tissues during medicinal bath
表3 地西泮及其代谢物药浴过程代谢动力学参数
Tab.3 Pharmacokinetic parameters of diazepam and its metabolites in fish during medicinal bath
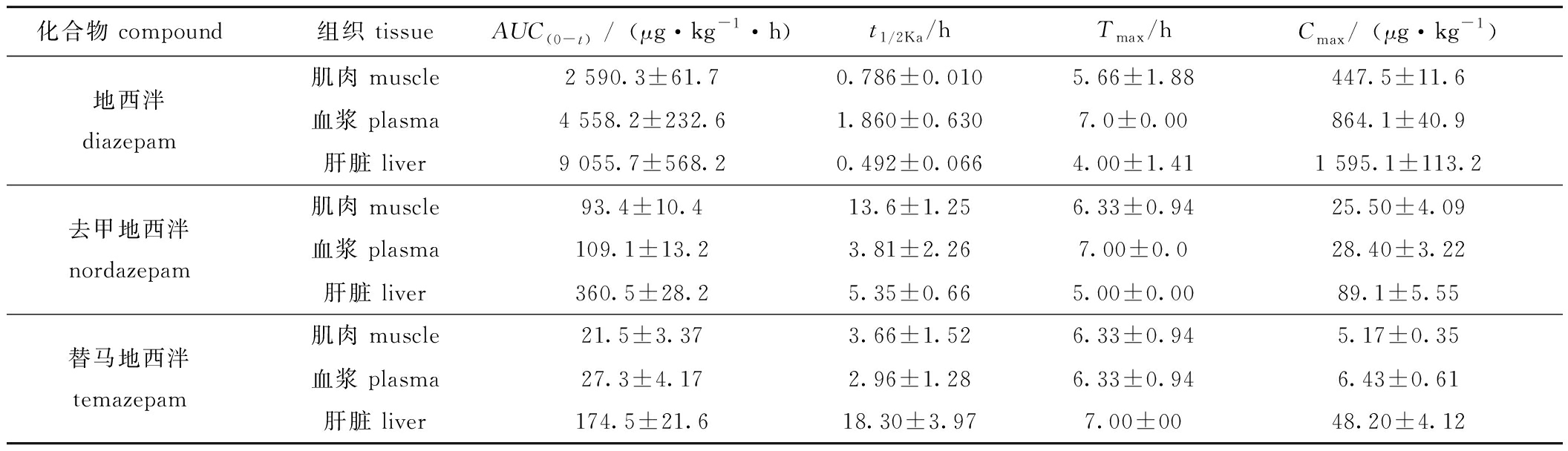
化合物 compound组织 tissueAUC(0-t)/(μg·kg-1·h)t1/2Ka/hTmax/hCmax/(μg·kg-1)肌肉 muscle2 590.3±61.70.786±0.0105.66±1.88447.5±11.6地西泮diazepam血浆 plasma4 558.2±232.61.860±0.6307.0±0.00864.1±40.9肝脏 liver9 055.7±568.20.492±0.0664.00±1.411 595.1±113.2肌肉 muscle93.4±10.413.6±1.256.33±0.9425.50±4.09去甲地西泮nordazepam血浆 plasma109.1±13.23.81±2.267.00±0.028.40±3.22肝脏 liver360.5±28.25.35±0.665.00±0.0089.1±5.55肌肉 muscle21.5±3.373.66±1.526.33±0.945.17±0.35替马地西泮temazepam血浆 plasma27.3±4.172.96±1.286.33±0.946.43±0.61肝脏 liver174.5±21.618.30±3.977.00±0048.20±4.12
注:AUC(0-t)为曲线下面积;t1/2Ka为吸收半衰期;Tmax为达峰时间;Cmax为达峰浓度。
Note:AUC(0-t) means area under the drug concentration-time curve;t1/2Ka means absorbtion half-life of drug;Tmax means time to reach peack;Cmax means maximum concentration.
药浴暴露过程3种组织中均检出地西泮、去甲地西泮和替马地西泮,但未检出奥沙地西泮。地西泮及其代谢产物在肝脏中呈现显著富集现象,其浓度水平分别为肌肉的3.51~9.32倍、血浆的1.82~7.49倍。具体而言,药浴3 h后母体药物在血浆和肌肉即达稳态分布,而肝脏更早于2 h即达到峰值浓度(1 595.1±113.2) μg/kg。代谢产物去甲地西泮在肝脏中5 h累积至(89.1±5.55)μg/kg后进入平台期,但在肌肉和血浆中保持持续上升态势,药浴结束时浓度分别达(25.50±4.09)μg/kg、(28.40±3.22)μg/kg。代谢产物替马地西泮至药浴终止时,所有组织中均未达平衡,浓度由高到低依次为肝脏(48.20±4.12)μg/kg、血浆(6.43±0.61)μg/kg、肌肉(5.17±0.35)μg/kg,其累积曲线仍呈上升趋势。
2.3 消除过程
本研究中采用药浴暴露-清水消除试验模式,揭示了地西泮及其代谢产物在草鱼体内的消除动力学特征,地西泮及其代谢物消除过程如图4~图10所示。3种组织中药-时曲线表现为多峰,不适合以房室模型进行拟合,采用统计矩对数据进行解析,参数结果见表4。
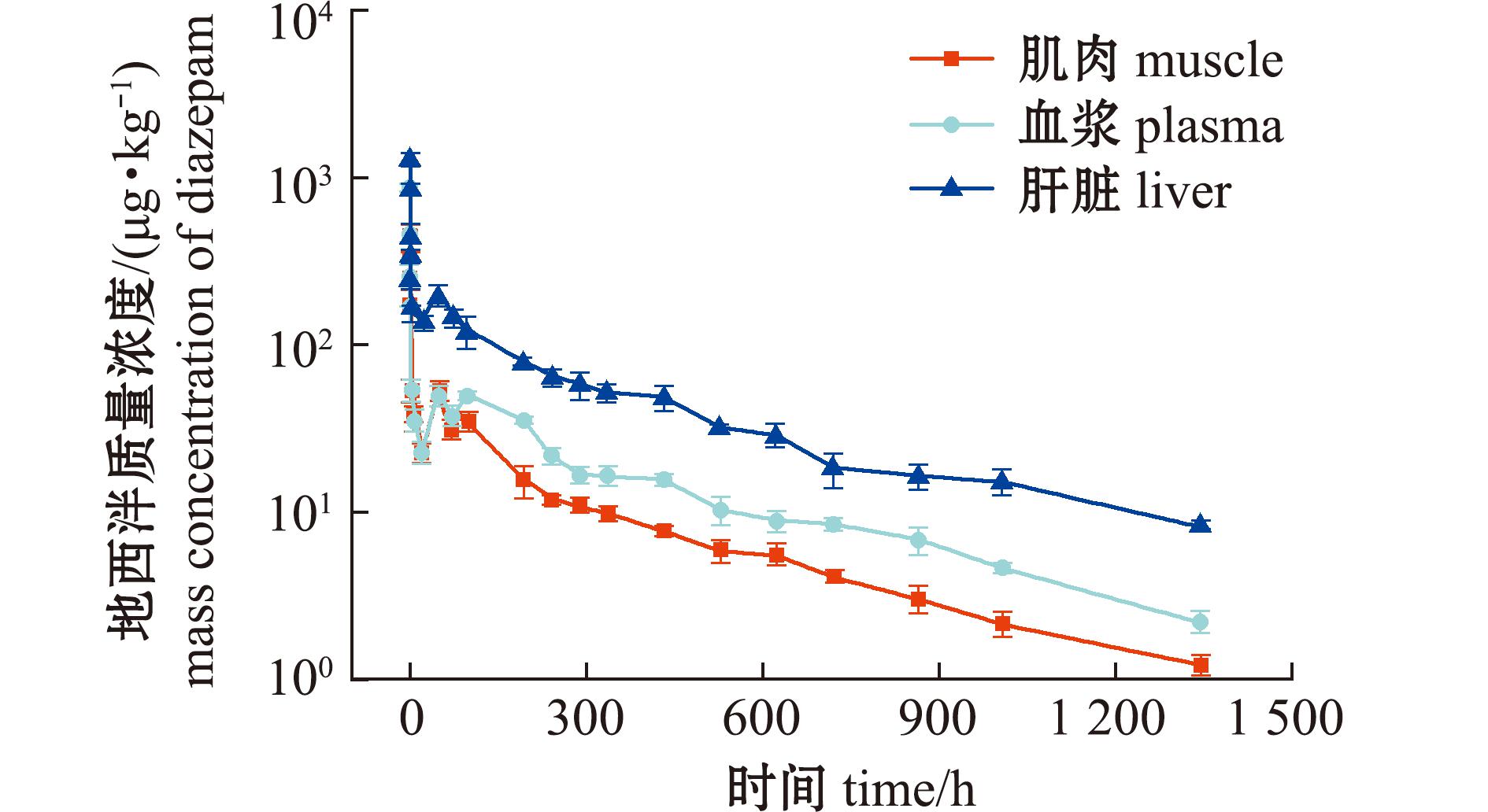
图4 消除过程组织中地西泮药-时曲线
Fig.4 Diazepam concentration in tissues during the period of elimination
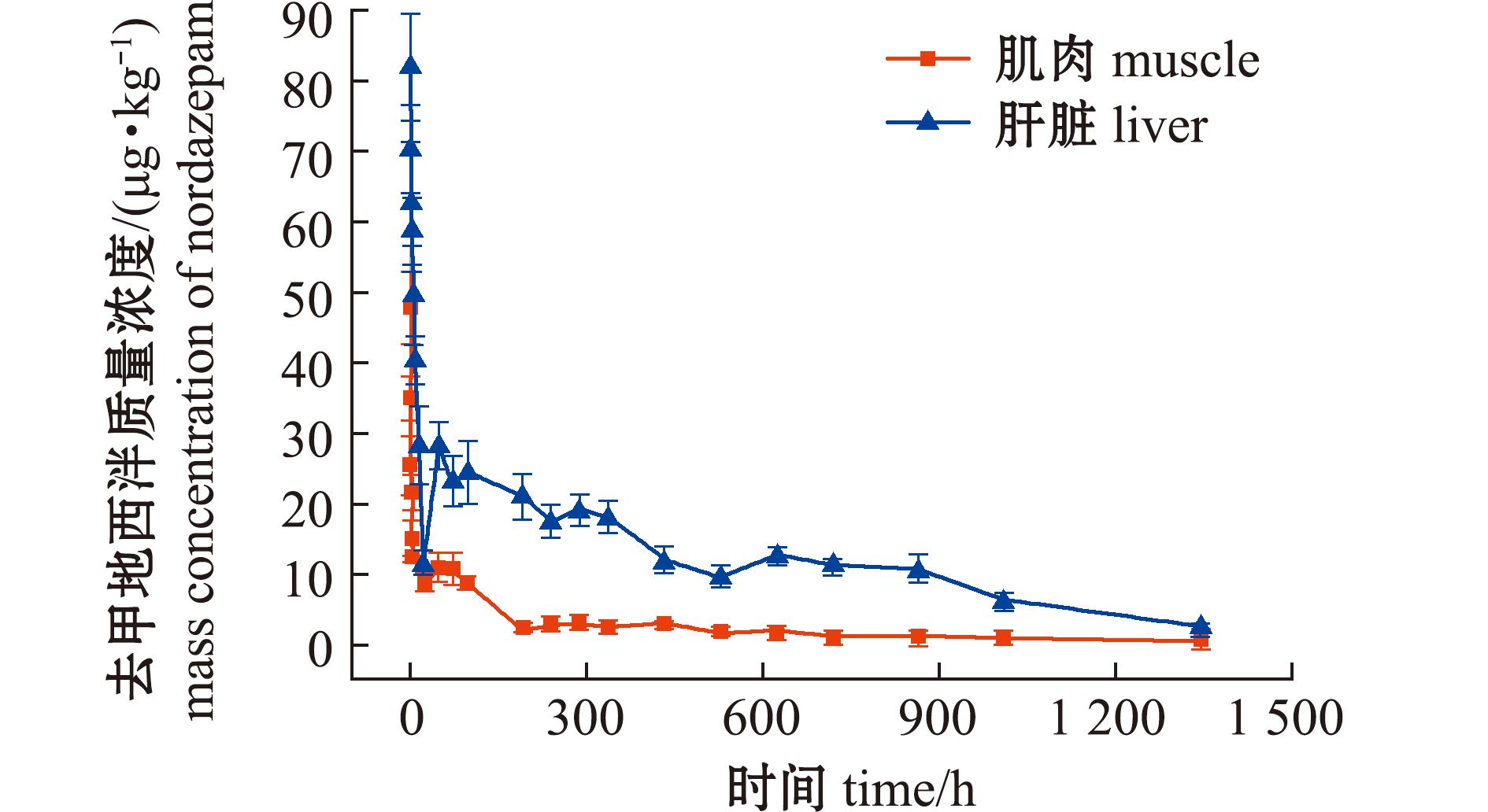
图5 消除过程肌肉和肝脏中去甲地西泮药-时曲线
Fig.5 Nordazepam concentration in muscle and liver during the period of elimination
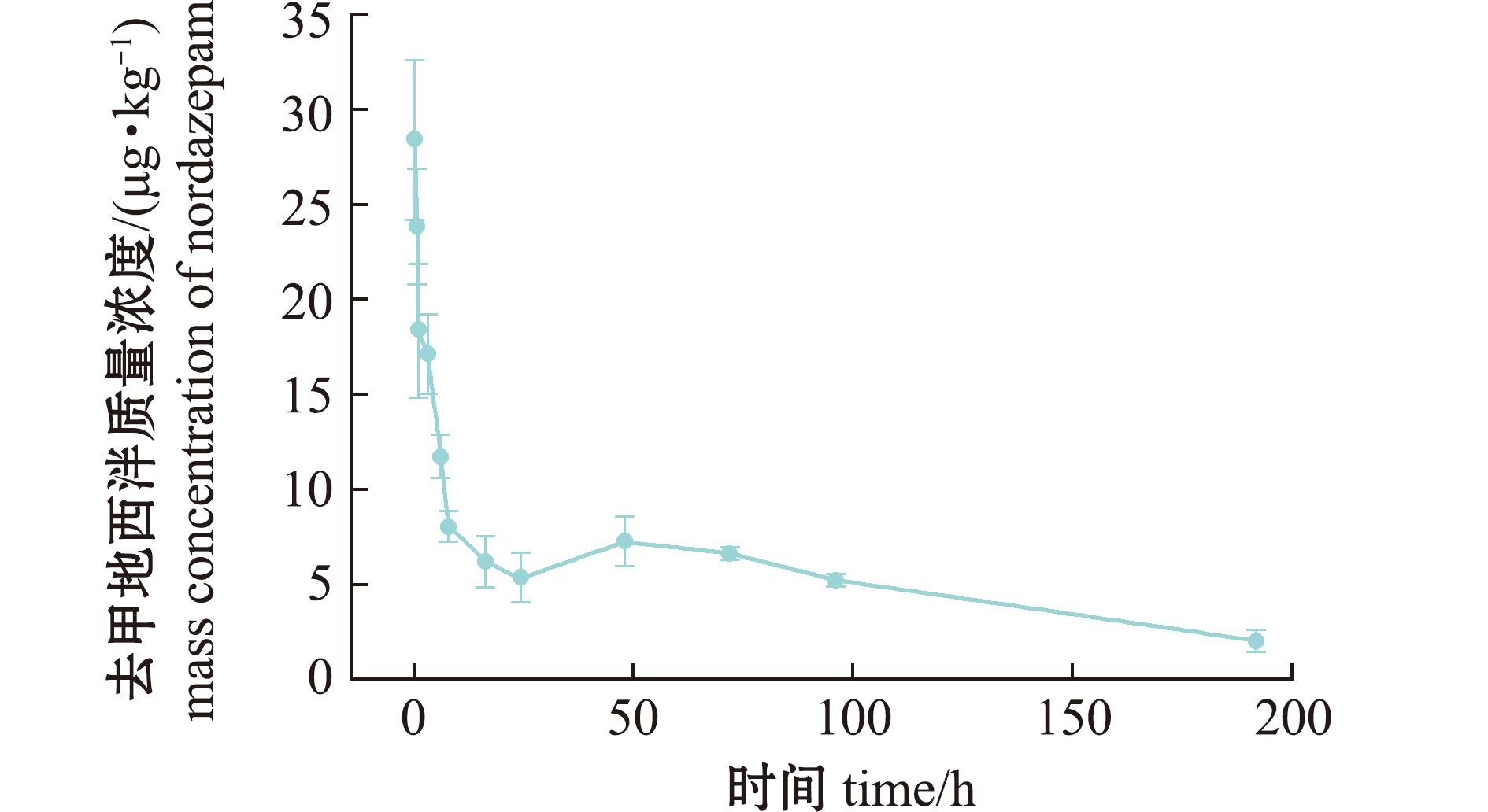
图6 消除过程血浆中去甲地西泮药-时曲线
Fig.6 Nordazepam concentration in plasma during the period of elimination
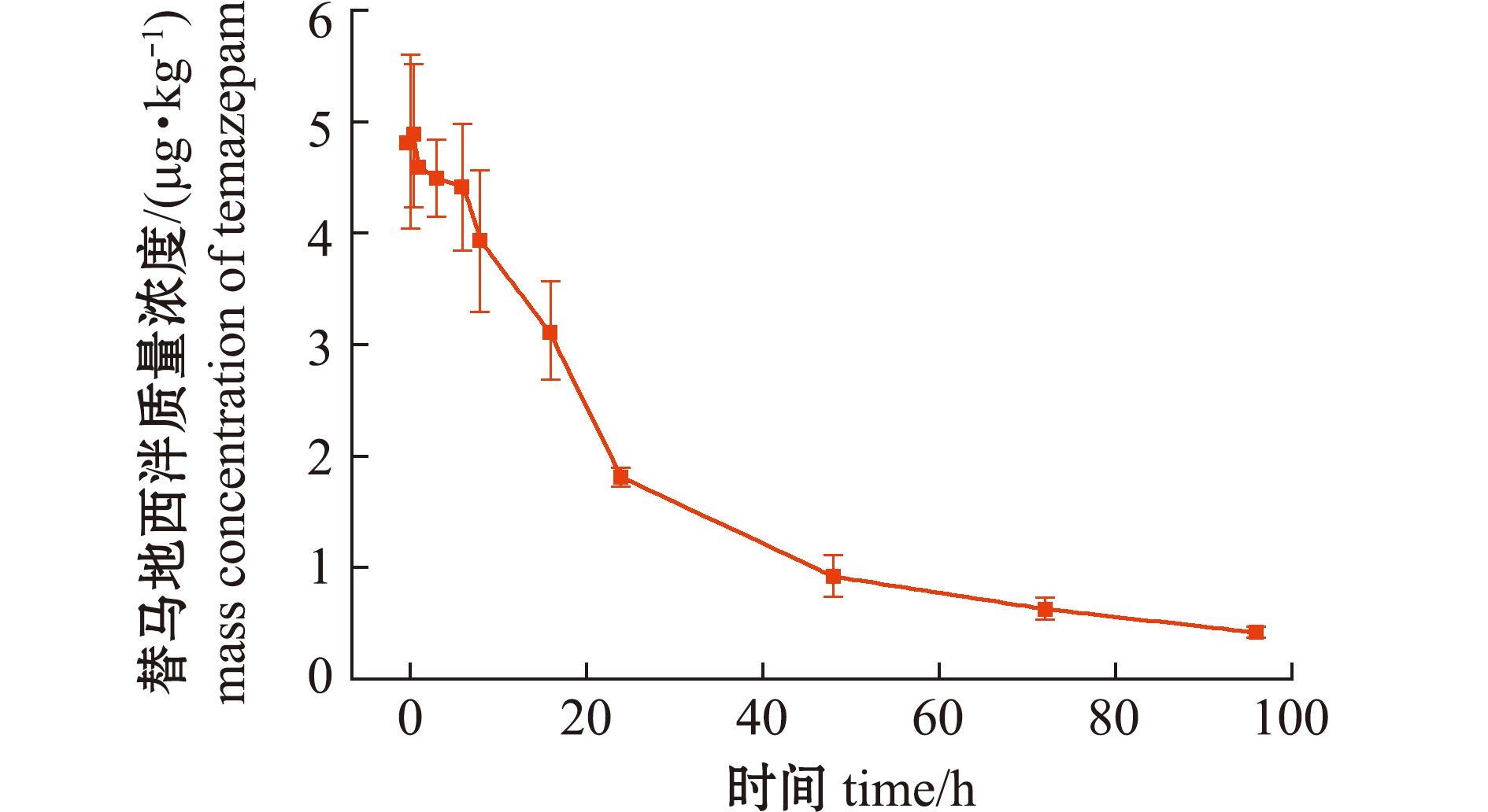
图7 消除过程肌肉中替马地西泮药-时曲线
Fig.7 Temazepam concentration in muscle during the period of elimination
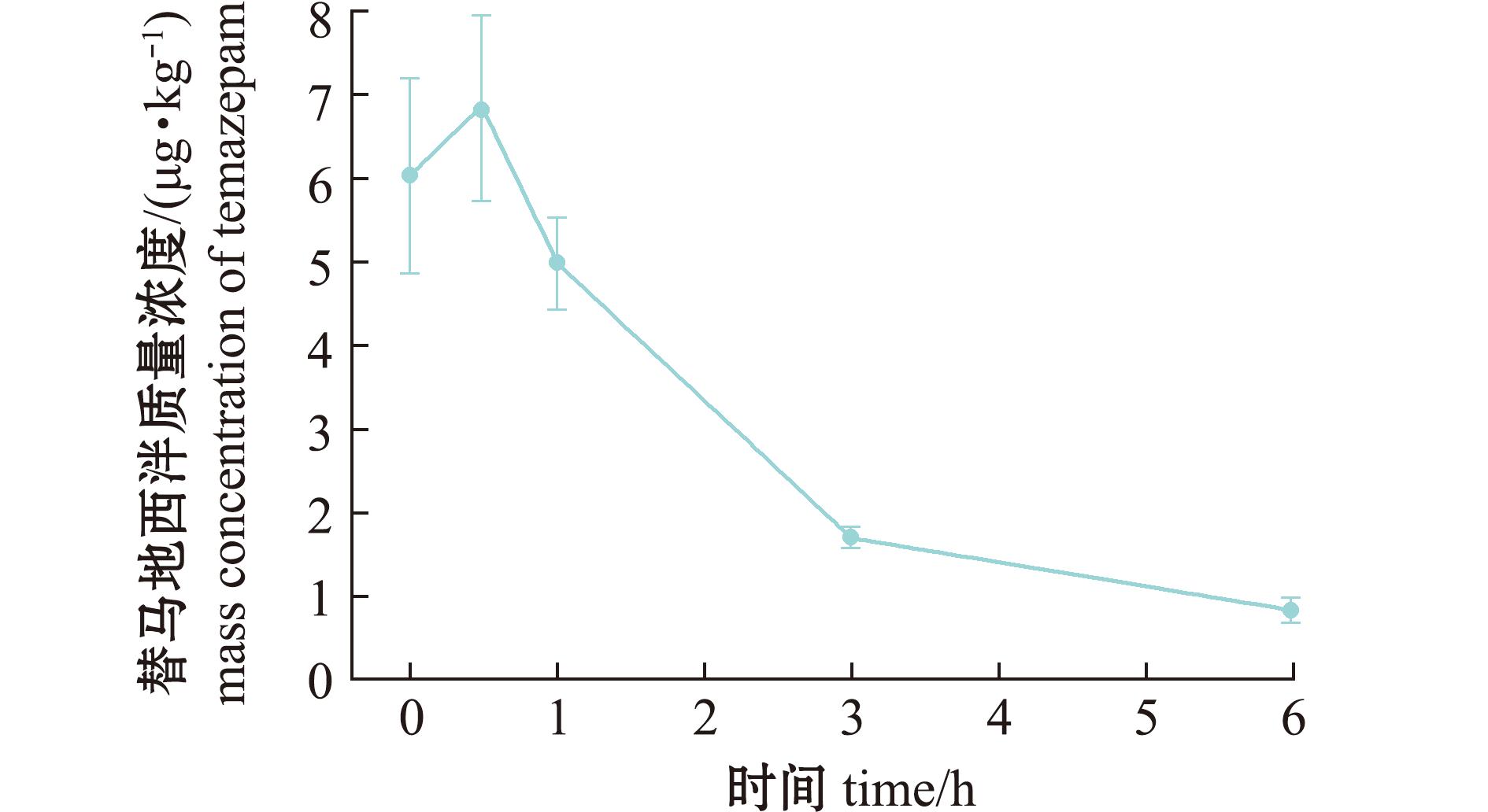
图8 消除过程血浆中替马地西泮药-时曲线
Fig.8 Temazepam concentration in plasma during the period of elimination
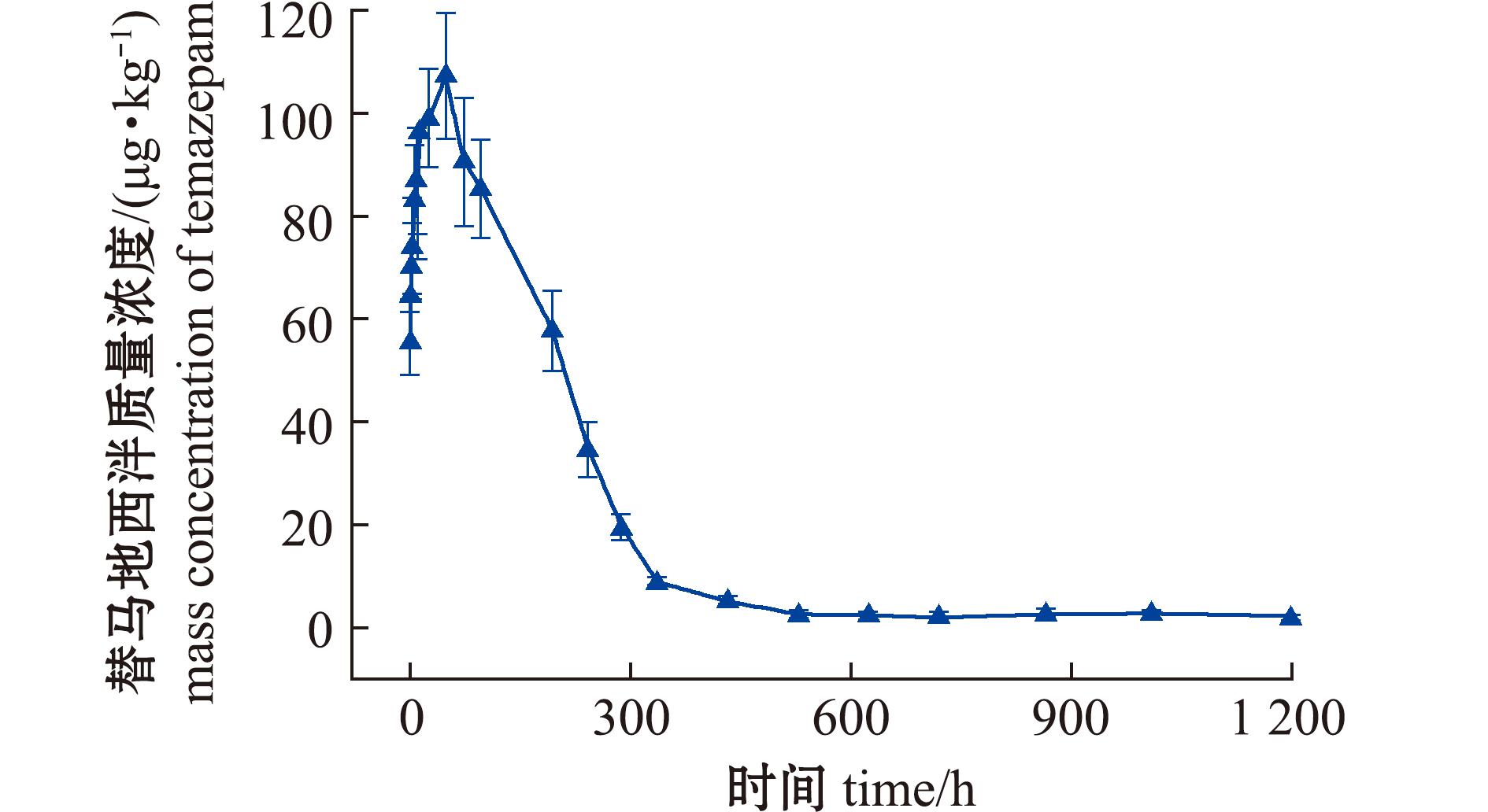
图9 消除过程肝脏中替马地西泮药-时曲线
Fig.9 Temazepam concentration in liver during the period of elimination
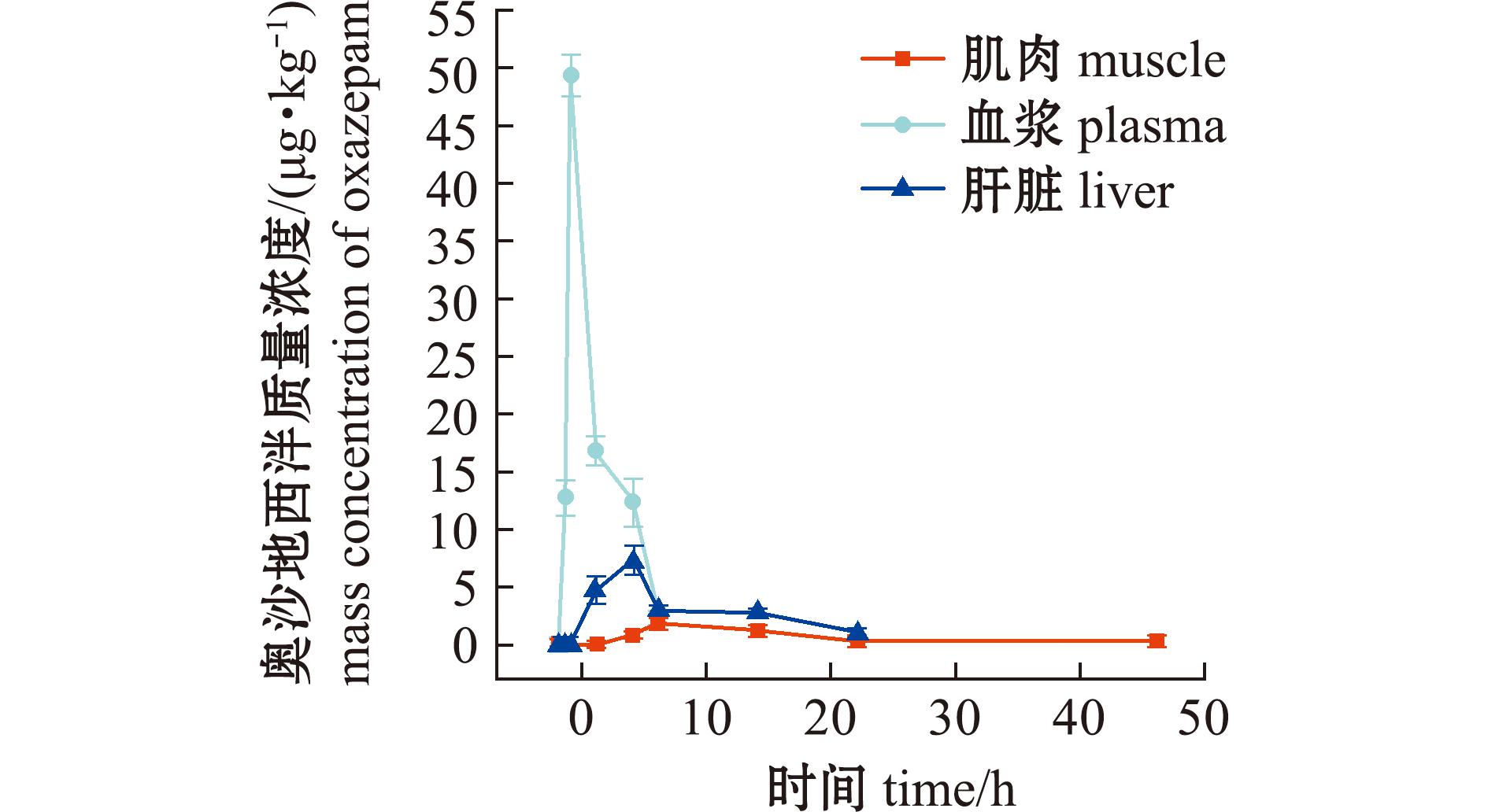
图10 消除过程组织中奥沙地西泮药-时曲线
Fig.10 Oxazepam concentration in tissues during the period of elimination
表4 降解过程地西泮及其代谢物代谢动力学参数
Tab.4 Pharmacokinetic parameters of diazepam and its metabolites during the period of elimination
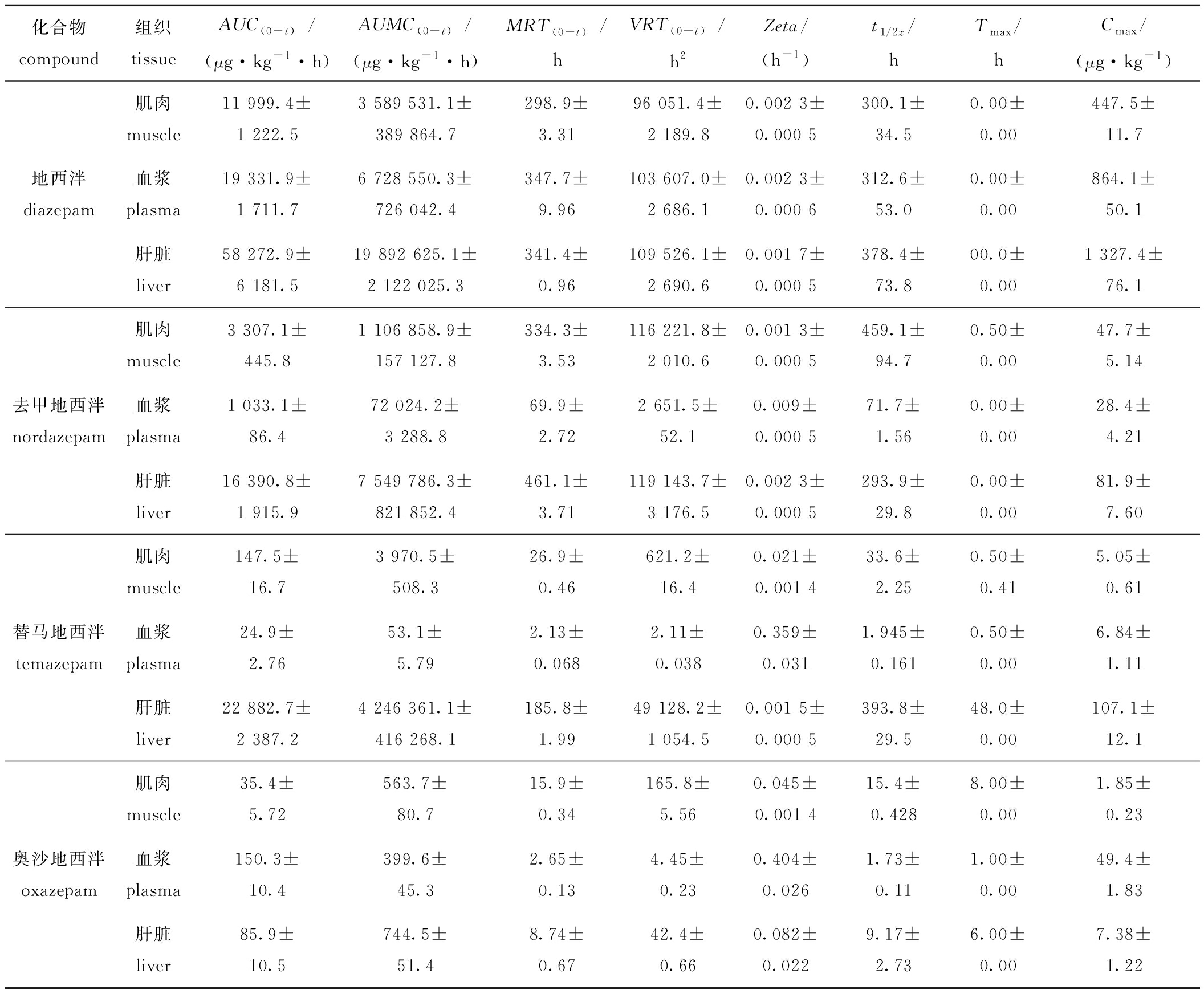
化合物compound组织tissueAUC(0-t)/(μg·kg-1·h)AUMC(0-t)/(μg·kg-1·h)MRT(0-t)/hVRT(0-t)/h2Zeta/(h-1)t1/2z/hTmax/hCmax/(μg·kg-1)肌肉 muscle11 999.4±1 222.53 589 531.1±389 864.7298.9±3.3196 051.4±2 189.80.002 3±0.000 5300.1±34.50.00±0.00447.5±11.7地西泮diazepam血浆 plasma19 331.9±1 711.76 728 550.3±726 042.4347.7±9.96103 607.0±2 686.10.002 3±0.000 6312.6±53.00.00±0.00864.1±50.1肝脏 liver58 272.9±6 181.519 892 625.1±2 122 025.3341.4±0.96109 526.1±2 690.60.001 7±0.000 5378.4±73.800.0±0.001 327.4±76.1肌肉 muscle3 307.1±445.81 106 858.9±157 127.8334.3±3.53116 221.8±2 010.60.001 3±0.000 5459.1±94.70.50±0.0047.7±5.14去甲地西泮nordazepam血浆 plasma1 033.1±86.472 024.2±3 288.869.9±2.722 651.5±52.10.009±0.000 571.7±1.560.00±0.0028.4±4.21肝脏 liver16 390.8±1 915.97 549 786.3±821 852.4461.1±3.71119 143.7±3 176.50.002 3±0.000 5293.9±29.80.00±0.0081.9±7.60肌肉 muscle147.5±16.73 970.5±508.326.9±0.46621.2±16.40.021±0.001 433.6±2.250.50±0.415.05±0.61替马地西泮temazepam血浆 plasma24.9±2.7653.1±5.792.13±0.0682.11±0.0380.359±0.0311.945±0.1610.50±0.006.84±1.11肝脏 liver22 882.7±2 387.24 246 361.1±416 268.1185.8±1.9949 128.2±1 054.50.001 5±0.000 5393.8±29.548.0±0.00107.1±12.1肌肉 muscle35.4±5.72563.7±80.715.9±0.34165.8±5.560.045±0.001 415.4±0.4288.00±0.001.85±0.23奥沙地西泮oxazepam血浆 plasma150.3±10.4399.6±45.32.65±0.134.45±0.230.404±0.0261.73±0.111.00±0.0049.4±1.83肝脏 liver85.9±10.5744.5±51.48.74±0.6742.4±0.660.082±0.0229.17±2.736.00±0.007.38±1.22
注:AUC(0-t)为曲线下面积;AUMC(0-t)为一阶矩曲线下面积;MRT(0-t)为平均驻留时间;VRT(0-t)平均滞留时间方差;Zeta 为曲线尾段斜率绝对值;t1/2z为末端消除相半衰期;Tmax为达峰时间;Cmax为达峰浓度。
Note:AUC(0-t) means area under the drug concentration-time curve;MRT(0-t) means mean residence time;VRT(0-t) means variance of mean residence time;Zeta means the absolute value of the slope at the end of the curve;t1/2z means terminal elimination half-life;Tmax means time to reach peack;Cmax means maximum concentration.
试验数据显示,当组织中地西泮浓度达平衡转入清水环境后,地西泮在肌肉、血浆、肝脏中的达峰时间(Tmax)均为消除相起点(0 h),其峰值浓度(Cmax)分别为(447.5±11.7)、(864.1±50.1)、(1 327.4±76.1)μg/kg。消除过程呈现明显的两个阶段:前8 h为快速消除阶段,消除率分别达92.8%、96.8%、86.4%;后续进入缓慢消除期。所有组织在48 h均出现二次浓度峰,提示该药物可能存在肝肠循环现象。
去甲基地西泮在肌肉、血浆和肝脏的Cmax分别为(47.70±5.14)、(28.40±4.21)、(81.90±7.60)μg/kg,其中,血浆和肝脏Tmax与母体药物同步为0 h,而肌肉存在0.5 h滞后。消除过程各组织前16 h呈快速衰减,此后在低浓度水平缓慢消除,血浆在192 h后低于检测限。肝脏消除曲线呈现显著波动特征,可能与相关酶活性节律相关。
替马地西泮在肝脏中Cmax达(107.1±12.1)μg/kg,分别为肌肉和血浆的21.9倍和15.6倍。
3种组织Tmax相对于母体药物延迟了0.5、0.5、48 h,显示持续转化特征。肝脏中消除相前300 h为快速下降阶段,而后进入长时间的缓慢消除期。相较之下,肌肉和血浆分别在96、6 h即达检测限以下,表明肝脏在该代谢物的代谢中起主导作用。
奥沙地西泮血浆中Cmax为(49.4±1.83)μg/kg,分别是肌肉和肝脏的27.3倍和6.69倍,呈现血药浓度优势分布。但可检出的窗口期显著短于其他代谢物,血浆、肌肉和肝脏分别为0.5~8.0 h、6.0~48.0 h、3.0~24.0 h。这种血药分布优势和快速消除的特性,提示奥沙地西泮可能更易通过肾小球滤过途径排泄。
曲线下面积(AUC(0-t))作为药物吸收程度的核心指标,显示地西泮在肝脏的累积量最高,AUC(0-t)排序为肝脏>血浆>肌肉,其代谢产物去甲地西泮和替马地西泮同样呈现以肝脏为主的分布特征,AUC(0-t)排序为肝脏>肌肉>血浆,表明肝脏是这些化合物在草鱼体内代谢转化的主要场所。值得注意的是,奥沙地西泮的分布模式显著异于其他代谢物,AUC(0-t)排序为血浆>肝脏>肌肉,提示其主要代谢场所可能与其他两个代谢物有所不同。
在消除动力学方面,基于一阶矩曲线下面积(AUMC)与曲线下面积(AUC)比值计算的平均驻留时间(mean residence time,MRT)(MRT=AUMC/AUC)显示,地西泮在各组织中的消除速率相近,肌肉、血浆和肝脏的MRT(0-t)分别为(298.9±3.31)、(347.7±9.96)、(341.4±0.96)h。其代谢产物则呈现显著组织差异性,去甲地西泮和替马地西泮均在肝脏滞留时间较长,肝脏MRT(0-t)分别为(461.1±3.71)、(185.8±1.99)h,分别为肌肉的1.37~6.90倍、血浆的6.59~87.2倍。而奥沙地西泮表现出以肌肉滞留较长的特性,肌肉的MRT(0-t)为(15.9±0.34)h,是血浆和肝脏的6倍和1.81倍。平均滞留时间方差(VRT(0-t))为高阶矩的参数,由于本身误差较大,应用价值小,一般代谢动力研究未将其纳入主要讨论范畴。
曲线尾段斜率绝对值(Zeta)和末端消除相半衰期(t1/2z)均是基于曲线尾段数据的计算结果,两者呈现负相关关系。地西泮在肌肉、血浆和肝脏中的t1/2z分别为(300.1±34.5)、(312.6±53.0)、(378.4±73.8)h,显著高于其代谢产物,表明该母体药物在生物体内有持久性的特征。去甲地西泮在肌肉组织中的滞留与母体药物有一定的相似性,其终末消除半衰期(t1/2z)为(459.1±94.7)h、Zeta值为0.001 3±0.000 5,与地西泮相近。药-时曲线图4~图10进一步证实,3种代谢物的组织滞留时间整体低于母体药物,而去甲地西泮在肌肉中的滞留时间则与地西泮接近。
2.4 地西泮在草鱼中的休药期
采用肌肉代谢末期地西泮接近未检出的4个时间点30、36、42、56 d,以线性外推方式计算正态分布单侧95%置信限95%容许上限,从图11可见。水温23 ℃±1 ℃下,草鱼肌肉中地西泮浓度达到0.5 μg/kg,检测限时间为87 d,休药期为2 001度·日。
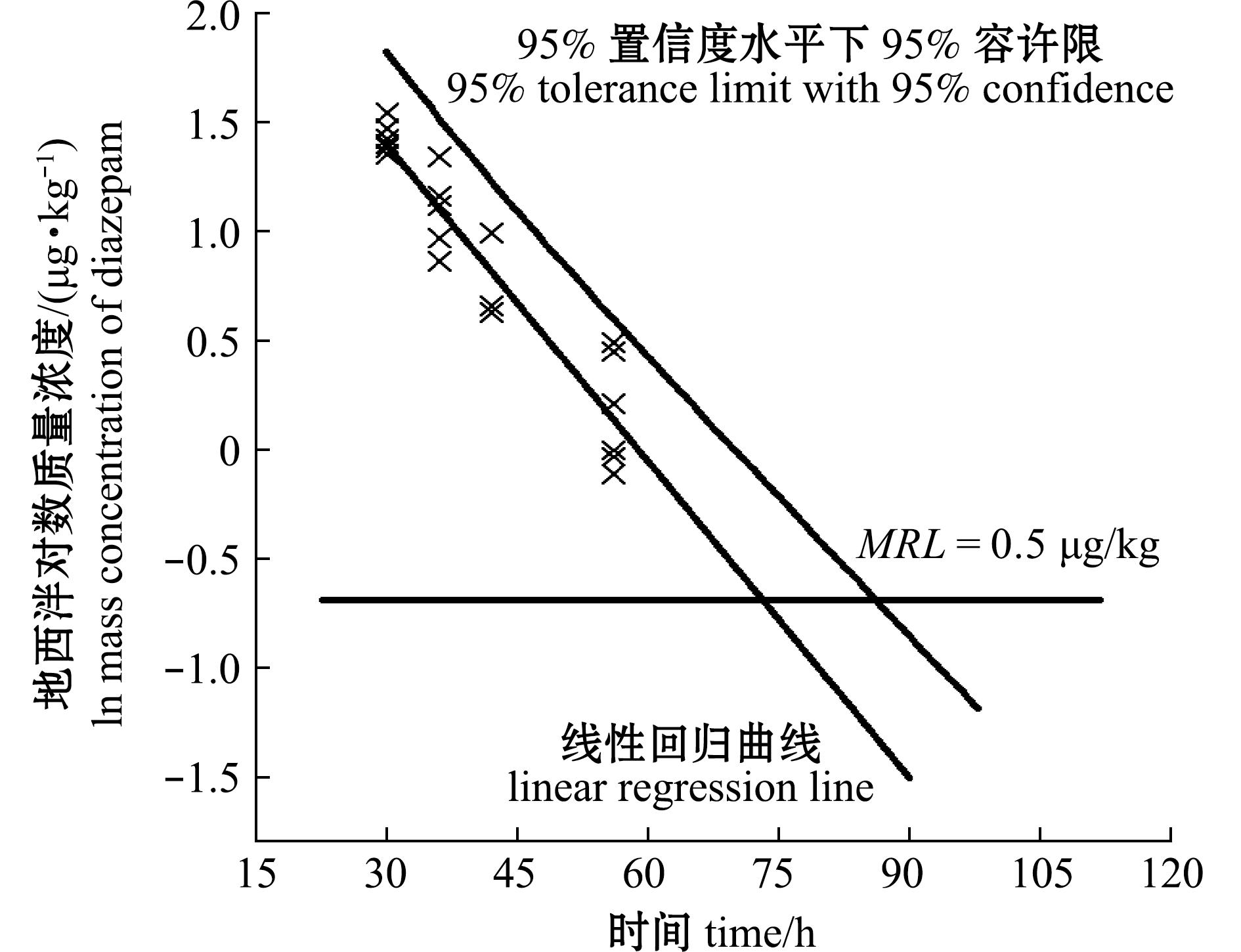
图11 肌肉休药期计算结果
Fig.11 Withdrawal period calculation for muscle
2.5 低浓度水平累积
本研究中设置0.05、0.1、0.5、1.0、1.5、2.0 ng/mL 6个梯度浓度对草鱼进行连续72 h药浴暴露试验,检测了肌肉、血浆和肝脏等组织中药物累积情况,结果如图12所示。试验结果显示在所有暴露浓度组中均未检出地西泮的主要代谢产物。该现象可能是母体药物浓度未达代谢酶促反应的激活阈值,导致其催化活性未能有效启动。0.05 ng/mL暴露组未检测到地西泮残留,表明该浓度水平下环境暴露不会引发药物生物累积。当暴露浓度≥0.1 ng/mL时,3种组织均可检出药物残留。
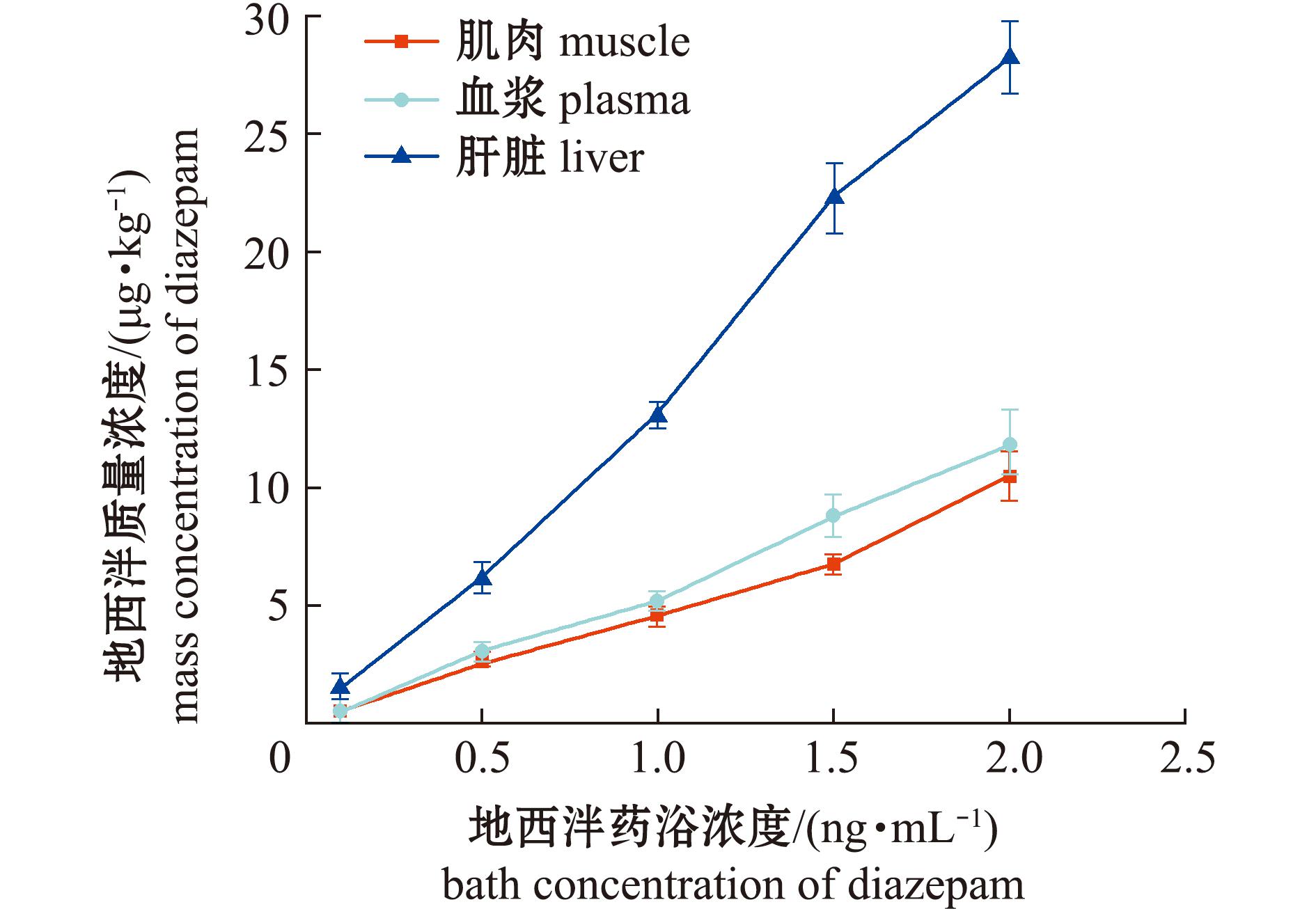
图12 不同药浴浓度下组织累积浓度
Fig.12 Accumulation of tissues by different concentrations of medicinal bath
通过线性回归分析发现,肌肉、血浆和肝脏的回归相关系数R2分别达到0.997 1、0.997 3、0.997 8,显示了良好的线性拟合度。回归方程斜率分析表明,各组织累积效率存在显著性差异。肌肉、血浆的斜率分别为4.43和5.53,表明该组织从环境中累积倍数为4~6倍,而肝脏表现出更高的累积能力,其斜率值达13.1,提示肝组织对地西泮具有较强的富集特征。根据0.05~0.1 ng/mL暴露浓度区间内药残的检出情况转变,结合回归模型的预测分析,确定草鱼从水体中累积地西泮的临界浓度阈值应为0.05~0.1 ng/mL。试验结果表明,暴露浓度与吸收效率之间存在明显的剂量依赖性关系。
3 讨论
3.1 地西泮在鱼体内的代谢过程
地西泮在动物体内的生物转化过程涉及多级酶促反应(图13)。在Ⅰ相代谢阶段,其代谢途径主要通过细胞色素P450酶系中的CYP2C19催化“N-脱烃基”氧化反应生成去甲地西泮[20];CYP3A亚家族作为关键代谢酶,选择性催化羟化反应生成替马地西泮[21]。这两种初级代谢产物可进一步通过“羟化”和“N-脱烃基”氧化生成次级代谢产物奥沙地西泮。在Ⅱ相代谢过程中,上述Ⅰ相代谢产物经肝微粒体UDP-葡萄糖醛酸转移酶催化,与葡萄糖醛酸结合形成结合型代谢物[13,22]。因此在分析生物样本时需采用β-葡萄糖醛酸苷酶水解预处理,以解离结合的代谢物。
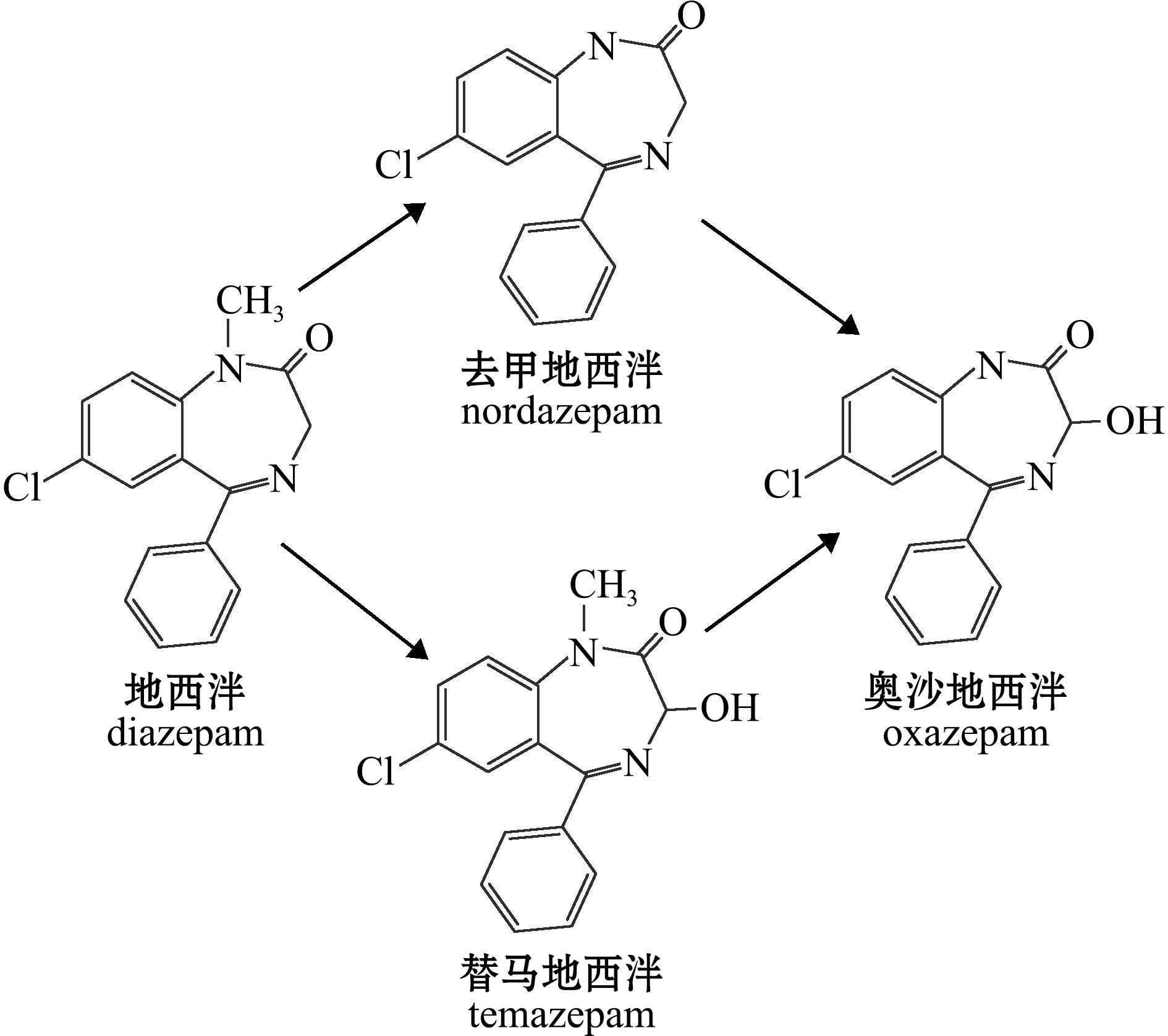
图13 地西泮的代谢
Fig.13 Metabolism of diazepam
药浴暴露0.5 h即能在血浆中检测出去甲地西泮和替马地西泮,而奥沙地西泮生成呈现明显的时间滞后效应。该次级代谢物在终止药浴0.5 h后首次出现于血浆,在肝脏和肌肉中的检出时间分别延迟至3 h和6 h。这种时空分布特征与代谢多级反应机制相吻合。奥沙地西泮的生成不仅需要前体代谢物作为底物,同时还受限于组织特异性酶活性及底物累积阈值。
3.2 地西泮在鱼体内的消除特点
终止药浴暴露后,草鱼体内地西泮呈现出两个阶段的消除模式:初期为快速降解阶段,而后为持续性缓慢消除阶段。该动力学特征与地西泮在哺乳动物(兔子[23]、马[13]、大鼠[14]和犬[24])体内代谢及丁香酚在斜带髭鲷[25]中的代谢模式具有共性。这可能是地西泮与蛋白有较高的结合率(与血浆蛋白结合率可达98%~99%)[26],形成“药库效应”,结合型地西泮通过动态解离维持游离药物浓度,导致终末消除相的延长。去甲地西泮在肌肉组织中的滞留与母体药相似,说明该代谢物在肌肉中可能类似于母体药与蛋白结合形成药物储库。地西泮在3种组织的降解过程中,48 h时均出现反复药峰,在鲫[27]、大鼠[28]、猪[29]的代谢中也出现类似情况。这可能是地西泮在动物体内存在肝肠循环所致。
基于药动学分析,肝脏作为核心代谢器官表现出显著优势。地西泮及其代谢物Cmax为(1 327.4±76.1)μg/kg(分别为肌肉的2.97倍、血浆的1.53倍),去甲地西泮(81.9±7.60)μg/kg(分别为肌肉的1.71倍、血浆的2.88倍)、替马地西泮(107.1±12.1)μg/kg(分别为肌肉的21.9倍、血浆的15.6倍);AUC(0-t)值则分别达(58 272.9±6 181.5)、(16 390.8±1 915.9)、(22 882.7±2 387.2)μg /kg·h,分别为肌肉的4.85~155倍、血浆的3.01~918倍。药物在肝脏中的蓄积是药物代谢的普遍现象,然而药物对组织选择性蓄积有所差异。如磺胺二甲基嘧啶在许氏平鲉(Sebastes schlegelii)肌肉组织中富集系数可达肝脏的1.33~1.79倍[30],说明药物在生物体内的空间分布可能受制于跨膜转运机制及特异性结合蛋白的作用。代谢物/母体药AUC比值显示,去甲地西泮为23.1%、替马地西泮为25.7%,两者生成比例相近,但前者达峰时间更短,提示CYP2C19介导的“N-脱烃基”反应效率略高于CYP3A介导的“羟化”反应。此类酶活性特征与部分哺乳动物存在显著性差异,如猫是以替马地西泮为主要代谢产物[16]。
次级代谢物奥沙地西泮呈现独特的组织分布特征。血浆Cmax达(49.4±1.83)μg/kg分别为肌肉的27.3倍、肝脏的6.69倍,AUC(0-t)为(150.3±10.4)μg /kg·h,为肌肉的4.25倍、肝脏的1.75倍,且血浆达峰时间(Tmax)为1 h,显著快于肌肉的8 h和肝脏的6 h。根据这3个参数在各组织中的比例关系,结合其代谢前体(去甲地西泮和替马地西泮)的肝脏富集特征,推测奥沙地西泮可能主要在肝外组织代谢生成。地西泮消除过程中多峰现象说明药物可能存在肝肠循环[27],由于动物肠道上皮细胞分布大量药物代谢酶,如CYP3A酶是除肝脏外含量和活性最高的器官[31],而该亚型酶正是地西泮代谢的关键酶[12]。奥沙地西泮可能在主要肠道上皮细胞代谢生成后,再通过肠壁进入血液循环系统,导致血浆的达峰时间短、达峰浓度高。同时,奥沙地西泮的亲脂性(XLogP3=2.24)相较于地西泮(XLogP3=3.0)有所降低,跨膜能力的减弱一定程度上也提高了其在血浆中的分布。
3.3 地西泮的休药期
文献数据显示,麻醉类药物丁香酚在斜带髭鲷(Hapalogenys nitens)肌肉中的平均滞留时间(MRT)为4.00 h[25];MS222在草鱼、花鲈和鲫肌肉中的MRT分别为128.0、125.3 、151.1 h[32]。在常规水产药物中,恩诺沙星在俄罗斯鲟肌肉的消除半衰期(t1/2ke)为49 h[33],磺胺嘧啶在吉富罗非鱼体内的t1/2ke为23.4 h[34]。而地西泮在草鱼肌肉中的MRT高达298.9 h,其消除速率显著低于上述麻醉剂及常规鱼用抗菌药物。跨物种比较显示,地西泮的代谢动力学特性存在明显种属差异。在小鼠体内的分布半衰期(T1/2β)仅72 min[35];成年人体内消除半衰期为40 h,老年群体延长至80 h[21]。草鱼地西泮的代谢速率显著低于哺乳动物,表明水生生物对苯二氮 类物质的代谢能力显著受限。
类物质的代谢能力显著受限。
目前,各国尚未制定地西泮在水生动物中的休药期标准。可参考的现有规范和文献包括:《农业农村部2003年第278号公告》规定,地西泮注射液休药期为28 d,马匹肌肉注射(0.2 mg/kg)休药期10 d[13];1.0 μg/L药浴暴露后鲫需74 d才能达到安全残留水平[27]。本研究中通过代谢动力学模型推算,草鱼休药期为2 001 度·日,远超恩诺沙星和磺胺类(500 度·日)等常规药物的休药期[36]。这种异常延长的残留特性,使地西泮在水产品中药残超标风险高于其他药物。
3.4 养殖鱼类从环境中累积地西泮的风险
地西泮作为抗焦虑、助睡眠的药物被临床广泛使用。该药物及其活性代谢物通过生活污水、医疗废水等输入水生环境,构成养殖鱼类药残的潜在外源性污染源。全球监测数据显示,与人类活动较密切的自然水体中普遍检出地西泮。加纳共和国“Korle Lagoon”湿地水体中地西泮平均浓度为0.005 71~0.018 96 ng/mL[37]。土耳其杰伊汉河水,秋季地西泮平均值为0.088 35 ng/mL,其他3个季节为0.000 13~0.000 25 ng/mL[38]。美国从饮用水源地到最终饮用水,地西泮平均值为未检出~0.000 43 ng/mL[39]。欧洲巴拉顿湖2017—2018年检测结果为未检出~0.000 25 ng/L[40]。上海污水处理厂进出水、黄浦江表层水和城市饮用水,地西泮残留浓度分别为0.00 3~0.015 6 ng/mL、0.004 6~0.075 5 ng/mL和0.000 5~0.003 2 ng/mL[7]。北京地表水地西泮残留平均值为0.000 9~0.007 1 ng/mL[8]。从这些检测结果看,虽然自然水体中地西泮残留广泛存在,但浓度水平一般低于0.05 ng/mL,仅在个别季节或地区峰值接近0.1 ng/mL水平。根据本研究中模拟鱼在低浓度水体中暴露的试验结果,草鱼富集环境中地西泮存在显著浓度依赖,临界浓度应为0.05~0.1 ng/mL。且0.1 ng/mL浓度水平暴露3 d的鱼体肌肉中累积量为(0.56±0.054)μg/kg,仅略高于0.5 μg/kg的限量水平。因此,尽管环境暴露可能导致养殖鱼类地西泮残留,但主要药残来源仍应归结于养殖、运输过程中与药物的直接接触。
4 结论
1)地西泮在鱼体内代谢过程呈现多途径、多级反应的特征。其代谢产物去甲地西泮和替马地西泮以肝脏为主要代谢转化场所,而次级代谢产物奥沙地西泮则通过肝外代谢途径形成。
2)从药物代谢动力学特征来看,地西泮在鱼体内呈现显著的蓄积性。依据代谢动力学模型推算,在23 ℃±1 ℃水温条件下,该药物需经历87 d的休药期方可达限量标准要求,显著高于常规水产用药。
3)水生生物通过自然水体被动吸收地西泮需达到一定阈值,当前环境中的地西泮残留绝大多数情况下处于安全范围,环境暴露途径对鱼体蓄积地西泮的影响程度较低。
[1] SHINI S.A review of diazepam and its use in the horse[J].Journal of Equine Veterinary Science,2000,20(7):443-449.
[2] CALCATERRA N E,BARROW J C.Classics in chemical neuroscience:diazepam (Valium)[J].ACS Chemical Neuroscience,2014,5(4):253-260.
[3] MASIULIS S,DESAI ![]() T,et al.GABAA receptor signalling mechanisms revealed by structural pharmacology[J].Nature,2019,565(7740):454-459.
T,et al.GABAA receptor signalling mechanisms revealed by structural pharmacology[J].Nature,2019,565(7740):454-459.
[4] 熊方武,余传隆,白秋江,等.中国临床药物大辞典:化学药卷[M].北京:中国医药科技出版社,2018:1175-1177.XIONG F W,YU C L,BAI Q J,et al.Chinese clinical drug dictionary:chemical medicine volume[M].Beijing:China Medicine Science and Technology Press,2018:1175-1177.(in Chinese)
[5] BELAL I,ASSEM H.Pharmacological mechanisms of diazepam in fish I.Effect on growth[J].Journal of Environmental Engineering and Science,2011,5:453- 459.
[6] 杨光昕,汤云瑜,程逸凡,等.鱼饵料中地西泮含量调查及其对水产品养殖影响分析[J].中国渔业质量与标准,2022,12(4):1-9.YANG G X,TANG Y Y,CHENG Y F,et al.Investigation of diazepam content in fish bait and analysis of its impact on aquaculture[J].Chinese Fishery Quality and Standards,2022,12(4):1-9.(in Chinese)
[7] WU M H,XIANG J J,QUE C J,et al.Occurrence and fate of psychiatric pharmaceuticals in the urban water system of Shanghai,China[J].Chemosphere,2015,138:486-493.
[8] WANG C C,HOU L L,LI J,et al.Occurrence of diazepam and its metabolites in wastewater and surface waters in Beijing[J].Environmental Science and Pollution Research International,2017,24(18):15379-15389.
[9] KWON J W,ARMBRUST K L,VIDAL-DORSCH D,et al.Determination of 17-ethynylestradiol,carbamazepine,diazepam,simvastatin,and oxybenzone in fish livers[J].Journal of AOAC INTERNATIONAL,2009,92(1):359-370.
[10] 杨志强,李潇轩,李志辉,等.丁香酚对锦鲤幼鱼的麻醉作用[J].渔业研究,2019,41(3):247-251.YANG Z Q,LI X X,LI Z H,et al.The anesthetic effects of eugenol on juvenile brocarded carp[J].Journal of Fisheries Research,2019,41(3):247-251.(in Chinese)
[11] BENCAN Z,SLEDGE D,LEVIN E D.Buspirone,chlordiazepoxide and diazepam effects in a zebrafish model of anxiety[J].Pharmacology Biochemistry and Behavior,2009,94(1):75-80.
[12] NAKAYAMA S M M,IKENAKA Y,HAYAMI A,et al.Characterization of equine cytochrome P450:role of CYP3A in the metabolism of diazepam[J].Journal of Veterinary Pharmacology and Therapeutics,2016,39(5):478-487.
[13] SCHENK I,MACHNIK M,BROUSSOU D,et al.Kinetic disposition of diazepam and its metabolites after intravenous administration of diazepam in the horse:relevance for doping control[J].Journal of Veterinary Pharmacology and Therapeutics,2021,44(5):733-744.
[14] MARKOWITZ G J,KADAM S D,BOOTHE D M,et al.The pharmacokinetics of commonly used antiepileptic drugs in immature CD1 mice[J].Neuroreport,2010,21(6):452-456.
[15] LI L,GORUKANTI S,CHOI Y M,et al.Rapid-onset intranasal delivery of anticonvulsants:pharmacokinetic and pharmacodynamic evaluation in rabbits[J].International Journal of Pharmaceutics,2000,199(1):65-76.
[16] VAN BEUSEKOM C D,VAN DEN HEUVEL J J M W,KOENDERINK J B,et al.Feline hepatic biotransformation of diazepam:differences between cats and dogs[J].Research in Veterinary Science,2015,103:119-125.
[17] HENNEY H R,SPERLING M R,RABINOWICZ A L,et al.Assessment of pharmacokinetics and tolerability of intranasal diazepam relative to rectal gel in healthy adults[J].Epilepsy Research,2014,108(7):1204-1211.
[18] OVERTURF C L,OVERTURF M D,HUGGETT D B.Bioconcentration and endocrine disruption effects of diazepam in channel catfish,Ictalurus punctatus[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2016,183:46-52.
[19] EUROPEAN MEDICINES AGENCY.Guideline on determination of withdrawal periods for edible tissues[EB/OL].(2018-09-13)[2020-05-20].https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-determination-withdrawal-periods-edible-tissues-revision-1_en.pdf
[20] S UPSKI W,TROCHA M,RUTKOWSKA M.Pharmacodynamic and pharmacokinetic interactions between simvastatin and diazepam in rats[J].Pharmacological Reports,2017,69(5):943-952.
UPSKI W,TROCHA M,RUTKOWSKA M.Pharmacodynamic and pharmacokinetic interactions between simvastatin and diazepam in rats[J].Pharmacological Reports,2017,69(5):943-952.
[21] GREENBLATT D J,HARMATZ J S,ZHANG Q C,et al.Slow accumulation and elimination of diazepam and its active metabolite with extended treatment in the elderly[J].The Journal of Clinical Pharmacology,2021,61(2):193-203.
[22] 李文越,王乐乐,樊哲瑜,等.地西泮及其Ⅰ、Ⅱ相代谢物在人尿液中的分解动力学[J].中国法医学杂志,2023,38(3):273-276.LI W Y,WANG L L,FAN Z Y,et al.Decomposition kinetics of diazepam and its phase Ⅰ and Ⅱ metabolites in human urine[J].Chinese Journal of Forensic Medicine,2023,38(3):273-276.(in Chinese)
[23] KAUR P,KIM K.Pharmacokinetics and brain uptake of diazepam after intravenous and intranasal administration in rats and rabbits[J].International Journal of Pharmaceutics,2008,364(1):27-35.
[24] MUSULIN S E,MARIANI C L,PAPICH M G.Diazepam pharmacokinetics after nasal drop and atomized nasal administration in dogs[J].Journal of Veterinary Pharmacology and Therapeutics,2011,34(1):17-24.
[25] 刘海新,余颖,罗方方,等.丁香酚在斜带髭鲷体内蓄积与消除规律及休药期[J].广东海洋大学学报,2020,40(1):19-28.LIU H X,YU Y,LUO F F,et al.Accumulation andelimination of regularity and withdrawal period of eugenol in Hapalogenys nitens[J].Journal of Guangdong Ocean University,2020,40(1):19-28.(in Chinese)
[26] PUBCHE M.National Center for Biotechnology Information.Diazepam (CID 3016) [EB/OL].Bethesda:National Institutes of Health,1887,(2025-3-25)[2025-2-10].https://pubchem.ncbi.nlm.nih.gov/compound/3016.
[27] 白淑艳,黄丽,李晨辉,等.地西泮在鲫鱼不同组织中的残留消除规律研究[J].食品安全质量检测学报,2023,14(15):71-77.BAI S Y,HUANG L,LI C H,et al.Study on the elimination of diazepam residues in different tissues of Carassius auratus[J].Journal of Food Safety &Quality,2023,14(15):71-77.(in Chinese)
[28] GONG W W,LIU S H,XU P X,et al.Simultaneous quantification of diazepam and dexamethasone in plasma by high-performance liquid chromatography with tandem mass spectrometry and its application to a pharmacokinetic comparison between normoxic and hypoxic rats[J].Molecules,2015,20(4):6901-6912.
[29] 廖洁丹,李西瑞,刘文字,等.地西泮在猪体内的血浆药动学及消除规律[J].中国兽医杂志,2008,44(4):26-27.LIAO J D,LI X R,LIU W Z,et al.Plasma pharmacokinetics and elimination of diazepam in pigs[J].Chinese Journal of Veterinary Medicine,2008,44(4):26-27.(in Chinese)
[30] 孙艺鸣,刘思宇,勇艳华,等.磺胺二甲嘧啶在许氏平鮋体内的富集与代谢[J].大连海洋大学学报,2024,39(5):766-771.SUN Y M,LIU S Y,YONG Y H,et al.Enrichment and metabolism of sulfamethazine in rockfish(Sebastes schlegelii)[J].Journal of DaLina Ocean University,2024 39(5):766-771.(in Chinese)
[31] 王广基.药物代谢动力学[M].北京:化学工业出版社,2005:45-46.WANG G J.Pharmacokinetics[M].Beijing:Chemical Industry Press,2005:45-46.(in Chinese)
[32] 陈永平,韩现芹,陈建,等.MS-222在草鱼、花鲈、鲫鱼组织中的富集与消除[J].水产科学,2019,38(4):527-532.CHEN Y P,HAN X Q,CHEN J,et al.Accumulation and elimination dynamics of anesthetic MS-222 in tissues of grass carp,bass and crucian carp[J].Fisheries Science,2019,38(4):527-532.(in Chinese)
[33] 詹士立,何欣,陈效燕,等.恩诺沙星在俄罗斯鲟体内残留消除规律研究[J].中国渔业质量与标准,2023,13(1):10-18.ZHAN S L,HE X,CHEN X Y,et al.Study on the rule of enrofloxacin elimination in Russian sturgeon[J].Chinese Fishery Quality and Standards,2023,13(1):10-18.(in Chinese)
[34] 王伟利,肖贺,姜兰,等.单次和连续药饵投喂方式下复方磺胺嘧啶在吉富罗非鱼体内的代谢消除规律[J].中国渔业质量与标准,2016,6(1):29-35.WANG W L,XIAO H,JIANG L,et al.Pharmacokinetic and residues of compound sulfadiazine in GIFT(Oreochromis niloticus) at single and multiple dosage[J].Chinese Fishery Quality and Standards,2016,6(1):29-35.(in Chinese)
[35] WALKER M C,TONG X,BROWN S,et al.Comparison of single- and repeated-dose pharmacokinetics of diazepam[J].Epilepsia,1998,39(3):283-289.
[36] 中华人民共和国农业部.鱼药使用规范:SC/T 1132-2016[S].北京:中国农业出版社,2016:7-8.Ministry of Agriculture and the People's Republic of China.Fishery drug use standard,SC/T 1132-2016[S].Beijing:Agricultural Publishing Press,2016:7-8.(in Chinese)
[37] ASARE E A.Status of pharmaceuticals in the Korle Lagoon and their toxicity to non-target organisms[J].Ecotoxicology,2022,31(2):299-311.
[38] GUZEL E Y,CEVIK F,DAGLIOGLU N.Determination of pharmaceutical active compounds in ceyhan river,Turkey:seasonal,spatial variations and environmental risk assessment[J].Human and Ecological Risk Assessment:an International Journal,2019,25(8):1980-1995.
[39] BENOTTI M J,TRENHOLM R A,VANDERFORD B J,et al.Pharmaceuticals and endocrine disrupting compounds in U.S.drinking water[J].Environmental Science &Technology,2009,43(3):597-603.
[40] MOLNAR E,MAASZ G,PIRGER Z.Environmental risk assessment of pharmaceuticals at a seasonal holiday destination in the largest freshwater shallow lake in Central Europe[J].Environmental Science and Pollution Research International,2021,28(42):59233-59243.