黄鳝(Monopterus albus),是中国重要的传统水产养殖物种,广泛分布于热带和亚热带地区,具有很高的营养价值[1-2]。《中国渔业统计年鉴》显示,2016年全国黄鳝养殖产量已突破38.6万 t,然而,2023年全国黄鳝养殖产量不增反减,仅有35.5万t(附图1)。同时市场上黄鳝的售价始终居高不下,主要原因之一就是黄鳝独特的性逆转生活史导致的雌雄发育不同步[3]。简单来说,黄鳝是顺序性雌雄同体鱼类,开始时均是功能性雌性,产完卵后经历间性阶段发育为雄性[4]。这种特点给养殖产业者带来了极大的挑战,一是雌性黄鳝体型较小,产卵量少;二是雄性成熟需要3~4年甚至更久,难以获得足够数量的雄性亲本[5]。
上述问题增加了黄鳝养殖者获取性状优良且稳定的雌雄亲本的难度,进而影响了人工繁殖和品种选育的进程。这不仅导致养殖苗种紧缺,而且导致一直无法培育出优良性状的黄鳝养殖品种[6];也使得只有水环境丰富,获取野生亲本较为容易的地区才能大规模发展黄鳝养殖产业。近年来,随着环境污染、大肆捕捞等现象的产生,野生黄鳝亲本的数量也越来越少[7]。因此,迫切需要新的养殖手段、养殖技术来满足日益增长的黄鳝苗种市场需求。
生殖干细胞(germline stem cells,GSCs)是位于成熟性腺中的一组高度特异性和未分化的多能细胞[8]。它们与胚胎干细胞(embryonic stem cells,ESCs)具有许多共同特征,包括高碱性磷酸酶活性及多能性标记物(如Nanos2、Nanog、Klf4)的表达[9-12]。在低等脊椎动物(包括鱼类)中,雌性和雄性GSCs均有报道,包括青鳉(Oryzias latipes)和北美鲶(Ictalurus furcatus)的精原干细胞系及斑马鱼(Danio rerio)的雌性生殖干细胞系[13-15]。目前,供体GSCs已被用于人工移植产生后代,显示了其在水产养殖中的良好应用前景。此外,在虹鳟(Oncorhynchus mykiss)中首次使用了原始生殖细胞(primordial germ cells,PGCs)移植技术[16],自此之后,生殖细胞移植(germ cell transplantation,GCT)开始广泛应用于鱼类繁殖和遗传资源保护[11,17-20]。
前期的研究中使用差异贴壁法获取黄鳝GSCs,需要4~5 d才能分离出GSCs细胞群,且此过程中会损耗一部分GSCs[5]。本研究中采用Percoll密度梯度离心法可以快速将黄鳝性腺细胞分层,通过流式细胞术分析、碱性磷酸酶染色、干性基因qPCR检测等方法鉴定GSCs富集层;其后优化黄鳝同种移植的受体制备程序,确定最佳受体的年龄、处理剂量、处理次数,然后将分离纯化的黄鳝雌性GSCs(female germline stem cells,fGSCs)移植到受体体内,从而建立黄鳝GSCs移植体系,以期为后续黄鳝同种移植提供科学参考。
1 材料与方法
1.1 材料
试验用黄鳝购自湖北省武汉市白沙洲水产大市场。4~5龄雄性黄鳝体质量为100~200 g,体长为40~60 cm;>5龄雄性黄鳝体质量为250~350 g,体长为65~75 cm。雌性黄鳝0.5龄,体质量为0~30 g,1龄为30~60 g,2龄为>60 g。黄鳝购回后,先在鱼房中适应温度12 h,之后逐渐添加恒温系统中的水使其适应水温,同时使用亚甲基蓝进行消毒,观察一周无明显疾病后转入恒温循环系统中,温度维持在26 ℃,pH值维持在7左右。每日保持14 h光照(9:00—23:00)、10 h黑暗的昼夜节律,并在系统中放置帆布提供遮光环境。所有试验程序均经中国科学院水生生物研究所批准。
1.2 方法
1.2.1 苏木精-伊红(HE)染色 分离不同年龄、性别黄鳝性腺并用 Bouin 固定液(Solarbio,中国)固定。石蜡切片制备(HE染色)委托艾康健基因技术有限公司(武汉,中国)进行。将固定的性腺用石蜡包埋并切成 5 μm的切片。将切片脱蜡并复水后用苏木精染色溶液染色。之后,将切片用水冲洗,然后用伊红溶液染色。用蔡司显微镜(Carl Zeiss AG,德国)对载玻片进行拍照。
1.2.2 生殖干细胞的分离与纯化 将雌性黄鳝用MS-222麻醉后捣毁脊髓处死。分离性腺组织并用含有2%青霉素-链霉素的DPBS(杜尔贝科磷酸盐缓冲盐水)冲洗两次。在解剖显微镜下,用镊子手动去除血管和脂肪组织。然后用微型剪刀将剩余的组织剪成2~3 mm3的碎片,然后在28 ℃下用TrypLE Express酶(Gibco,美国)消化30 min。然后加入10%胎牛血清(TransGen Biotech,中国)以停止酶促反应。将混合物以1 000 r/min离心2 min。用含有2%青霉素-链霉素的DPBS清洗沉淀物3次,然后通过40 μm细胞过滤器(Jet Biofil,中国)过滤。以1 000 r/min离心5 min后,收集细胞沉淀并用1 mL DPBS重悬浮,将细胞悬浮液上样到不连续浓度梯度(20%、30%、40%和60%)的Percoll中(赛文创新,北京),并根据已发表的方法[21]在800 g下离心30 min。从梯度中取出单个细胞部分,转移到锥形试管中,并用DPBS洗涤2次,每次2 min。
1.2.3 碱性磷酸酶(AP)染色 使用细胞碱性磷酸酶试剂盒(Sigma,美国)并根据制造商的说明进行碱性磷酸酶活性试验。简单来说,使用柠檬酸盐-丙酮-甲醛固定液浸泡固定载玻片30 s后用去离子水清洗45 s,加入碱性染料混合物,在26 ℃下避光孵育15 min,去离子水冲洗后复染2 min再次冲洗,显微镜下观察。
1.2.4 流式细胞术分析 将Percoll得到的各浓度细胞成分中加入4% PFA室温固定10 min,加入PBSA清洗5 min后以1 000 r/min离心2 min弃上清液,细胞沉淀加入90% cold MeTH透化15 min,PBSA清洗2次(5 min/次)后一抗(vasa,DIA-AN,中国,1∶500)孵育15 min,PBSA清洗重悬浮,加入荧光二抗(Alexa Fluor 488,Thermo Fisher,美国,1∶300)孵育15 min,PBSA清洗2次,流式细胞仪(BD,美国)上机检测。
1.2.5 定量实时聚合酶链反应 Vasa、nanog、klf4、nanos2基因通常被作为检测细胞干性的多能性标记物[9-12],在生殖细胞系中特异性表达,通过比较其相对表达水平来比较不同Percoll浓度层的细胞干性强弱,vasa基因的相对表达用于确定生殖细胞耗竭程度。采用实时定量PCR(qPCR)分析确定基因表达水平。使用TransScript All-in-One First-Strand cDNA合成Supermix(Transgen Biotech,中国)将总共1 μg RNA逆转录为cDNA。qPCR扩增在Bio-Rad CFX96 Touch Real-Time PCR系统(Bio-Rad,美国)上进行,重复3次。反应混合物由2×PerfectStartTM Green qPCR SuperMix 5 μL、ddH2O 3.6 μL 、正向和反向引物0.2 μL以及cDNA 1 μL 组成。所用的循环参数为94 ℃下预变性 30 s,94 ℃ 下循环变性 5 s,60 ℃ 下退火复性15 s,72 ℃下延伸 10 s,共进行40个循环。定量循环或循环阈值使用CFX Manager 3.1(Bio-Rad,美国)确定。引物长度为20~21个核苷酸,熔化温度为58 ℃~60 ℃,鸟嘌呤-胞嘧啶含量为50%~60%,产生80~200 bp的扩增子。根据前期文献选取β-actin作为内参基因[22]。所有qPCR试验重复3次,相对基因表达水平基于2-ΔΔCt方法计算。
表1 试验所用引物
Tab.1 Primers used in this study
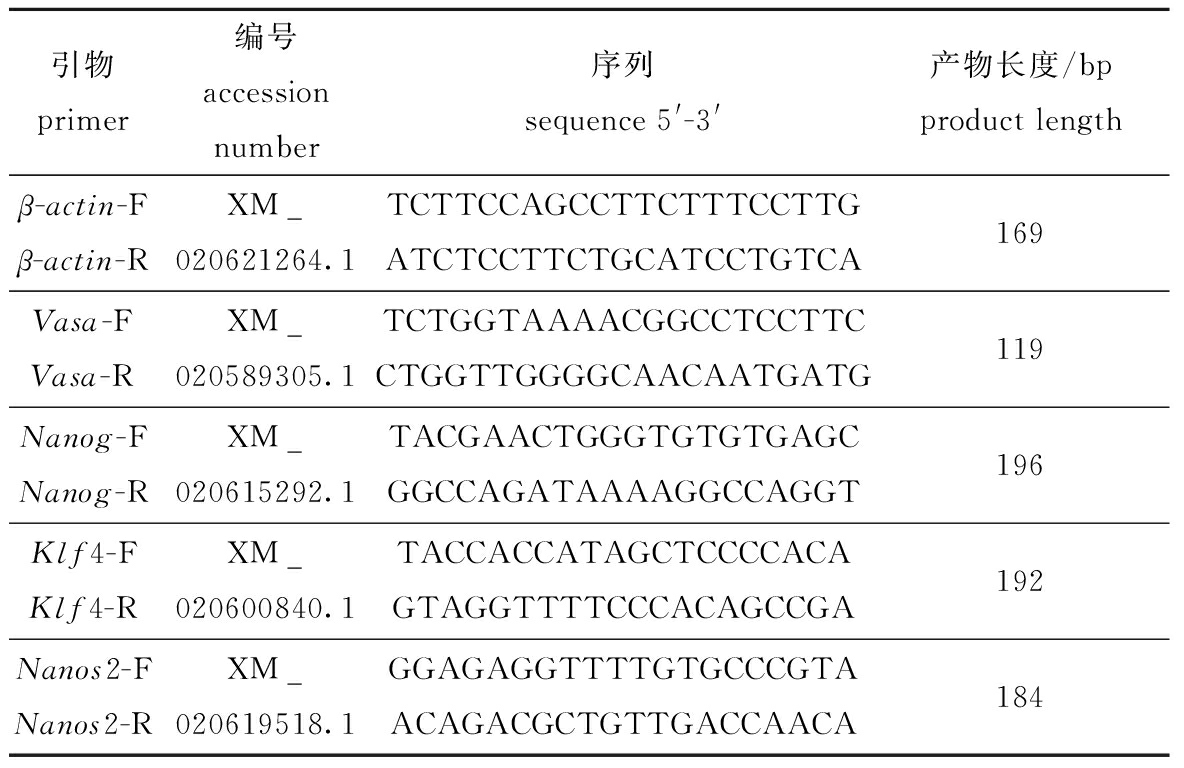
引物primer编号accessionnumber序列sequence 5'-3'产物长度/bpproduct lengthβ-actin-Fβ-actin-RXM_020621264.1TCTTCCAGCCTTCTTTCCTTGATCTCCTTCTGCATCCTGTCA169Vasa-FVasa-RXM_020589305.1TCTGGTAAAACGGCCTCCTTCCTGGTTGGGGCAACAATGATG119Nanog-FNanog-RXM_020615292.1TACGAACTGGGTGTGTGAGCGGCCAGATAAAAGGCCAGGT196Klf4-FKlf4-RXM_020600840.1TACCACCATAGCTCCCCACAGTAGGTTTTCCCACAGCCGA192Nanos2-FNanos2-RXM_020619518.1GGAGAGGTTTTGTGCCCGTAACAGACGCTGTTGACCAACA184
1.2.6 受体鱼样品的准备 首先通过台盼蓝溶液注射的方式,确定黄鳝泄殖孔与性腺的连接,将0.4%的台盼蓝溶液由泄殖孔注射进受体黄鳝性腺中,解剖观察性腺中是否有蓝色溶液。白消安-高温联合处理试验将受体按年龄分为两组,然后将各组进一步分为20、30、40 mg/kg的试验组和一个对照组,试验组10尾/组,对照组5尾/组,试验独立进行2次。在30 ℃下培养14 d,然后先向泄殖孔注射20、30、40 mg/kg(体质量)白消安溶液,白消安(MCE,美国)溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)后使用鱼用生理盐水稀释10倍,14 d后再由泄殖孔注射20、30、40 mg/kg白消安溶液。各组鱼在末次注射后30 ℃下养殖14 d,随后每天以1 ℃~2 ℃的速度将水温降至自然温度,用于制备GCT,同时设立高温空白对照组和阴性对照组(WT)。关于受体内源性生殖细胞是否耗尽的检测,首先挤压腹部,观察是否有精液流出以进行初步评估,然后从注射不同剂量白消安溶液的每个试验组中各取3尾鱼进行性腺组织切片形态学观察,并通过qPCR分析不同试验组性腺中vasa基因的差异表达。
1.2.7 生殖干细胞的标记与移植 为了标记GSCs,将收获的fGSCs用10 μmol/L PKH26细胞膜染料(赛百科,中国)染色5 min。加入等体积热灭活胎牛血清终止染色,用RPMI1640新鲜培养基洗涤2次,调整细胞浓度为1×104 cells/μL,每1 mL细胞悬液加入10 μL青霉素-链霉素。将制备好的细胞冰上保存以备移植。用200 mg/L MS-222麻醉受体鱼2~3 min,移至操作台。用1 mL注射器将GSCs悬液经泄殖孔轻轻注入受体鱼精巢。
1.2.8 免疫荧光检测 为检测受体黄鳝体内供体来源细胞的增殖情况,在移植后7、21、60 d分别取样受体鱼精巢进行免疫荧光观察,以同期非受体鱼精巢作为对照组。性腺组织标本放入液氮速冻后用滤纸吸干表面水分,进行OCT包埋,按照常规冰冻切片操作步骤进行切片,厚度为5 μm,冷冻切片风干后-20 ℃储存。冷冻切片用PBST(磷酸盐缓冲盐水,0.1% Triton X-100)清洗3次,每次5 min,然后用含5%马血清的PBST进行封闭。细胞核用DAPI(Sigma,美国,1∶1 000)染色。用徕卡激光扫描共聚焦显微镜(WETZLAR,德国)拍摄图像。
1.3 数据处理
数据均以平均值±标准误 (mean±S.E.) 表示。对于基因表达分析,使用t检验评估两组之间的平均值差异。使用单因素方差分析和双因素方差分析比较每个目标的表达水平,并使用 Tukey 事后检验确定差异。显著性差异设为0.05。使用GraphPad Prism 9.5.1软件进行统计分析并生成图表。
2 结果与分析
2.1 最佳供体的筛选
为了获取尽可能多的fGSCs,对不同年龄的雌性黄鳝进行对比分析,从图1可见,0.5龄鱼的性腺还未发育完全,性腺体指数明显低于1、2龄,如果用0.5龄鱼,需要非常大量的数目才能获得足够的fGSCs,出于动物伦理的考虑,最终放弃选择0.5龄鱼作为移植供体(图1(a))。组织切片形态学观察结果显示,1龄雌性黄鳝性腺中fGSCs的数量比2龄雌性黄鳝多。2龄雌鱼的性腺充满了成熟的卵子(图1(b)、(c))。
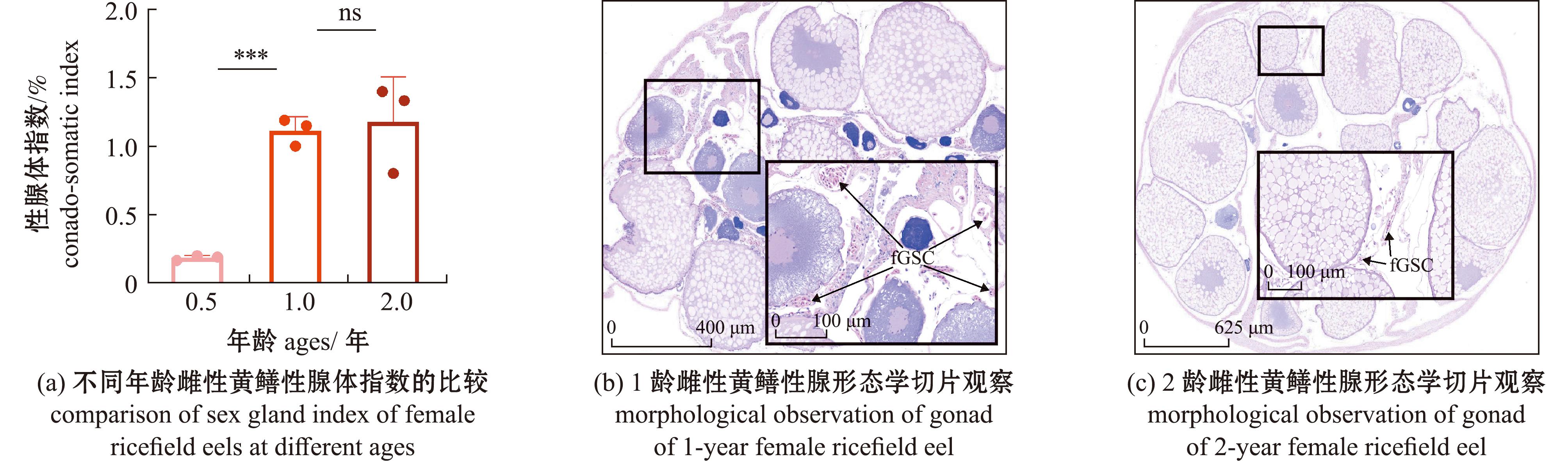
ns—无显著性差异;fGSC—雌性生殖干细胞;***表示P<0.001。
ns—No significant difference;fGSC—female germline stem cell;***means P<0.001.
图1 供体鱼的选择
Fig.1 Selection of donor fish
2.2 生殖干细胞的分离富集与鉴定
首先通过Percoll密度梯度离心法将消化后的供体性腺细胞分层(图2(a)),干性基因差异表达分析显示,40%密度层中干性标记基因vasa、nanog、klf4、nanos2的表达均显著高于其他密度组(图2(b))。显微镜下观察40%密度层细胞,发现形态与本课题组之前报道的黄鳝生殖干细胞形态相符(图2(c)),且40%浓度层细胞贴壁后,碱性磷酸酶染色将绝大部分细胞染为代表干细胞的紫色(图2(d))。同时通过流式细胞术分析发现,40%浓度层富集的Vasa阳性细胞占比为72.52%,显著高于PBS层(图2(e)、(f))。
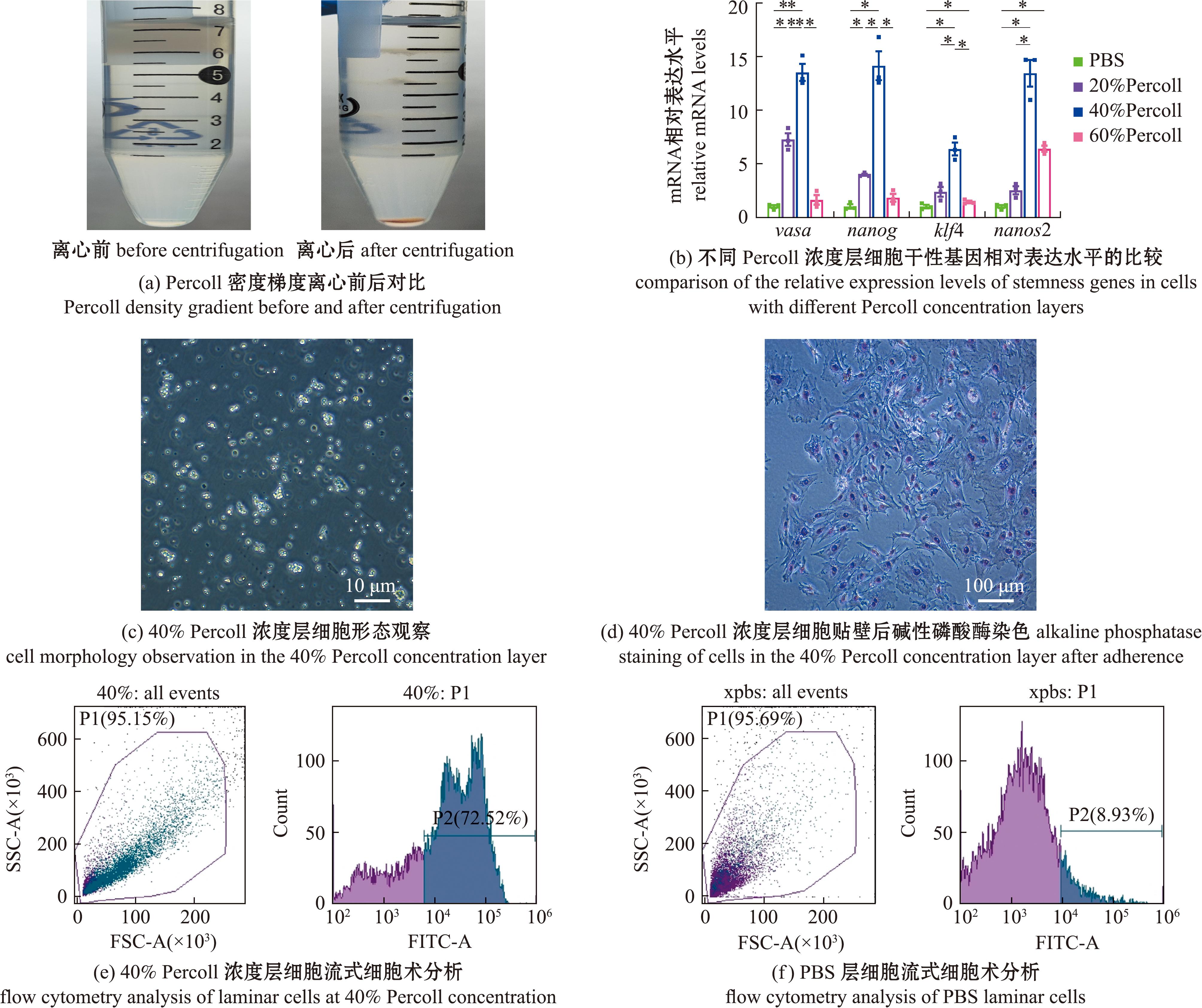
qPCR试验重复3次;*表示P<0.05;**表示P<0.01,下同。
qPCR experiment was repeated three times;*means P<0.05;**means P<0.01,et sequentia.
图2 生殖干细胞的分离、富集与鉴定
Fig.2 Isolation,enrichment and identification of germ stem cells
2.3 受体鱼样品制备条件的优化
首先,用台盼蓝注射法确定了黄鳝泄殖孔与性腺的连接,将台盼蓝注射到泄殖孔后,性腺呈蓝色(图3(a)下),而不含台盼蓝的对照组仍为正常黑色(图3(a)上)。通过泄殖孔注射白消安,其中4~5龄健壮雄性组平均存活率显著高于>5龄组,其中40 mg/kg组存活率显著低于其他试验组与高温对照组(图3(b)),试验组和对照组的存活率见表2,详细试验细节见附表1~4。通过组织学观察对比20 mg/kg组与30 mg/kg组,其中30 mg/kg组最终内源性生殖细胞处理更为干净,基本无残留(图3(c))。切片显示,30 mg/kg组一次处理后精巢中依然有生殖细胞残留,二次处理后精巢中绝大多数生殖细胞均消失(图3(d))。取出各组二次处理鱼的性腺进行vasa基因的mRNA水平表达差异分析,发现30 mg/kg组vasa基因表达量显著低于对照组(图3(e))。
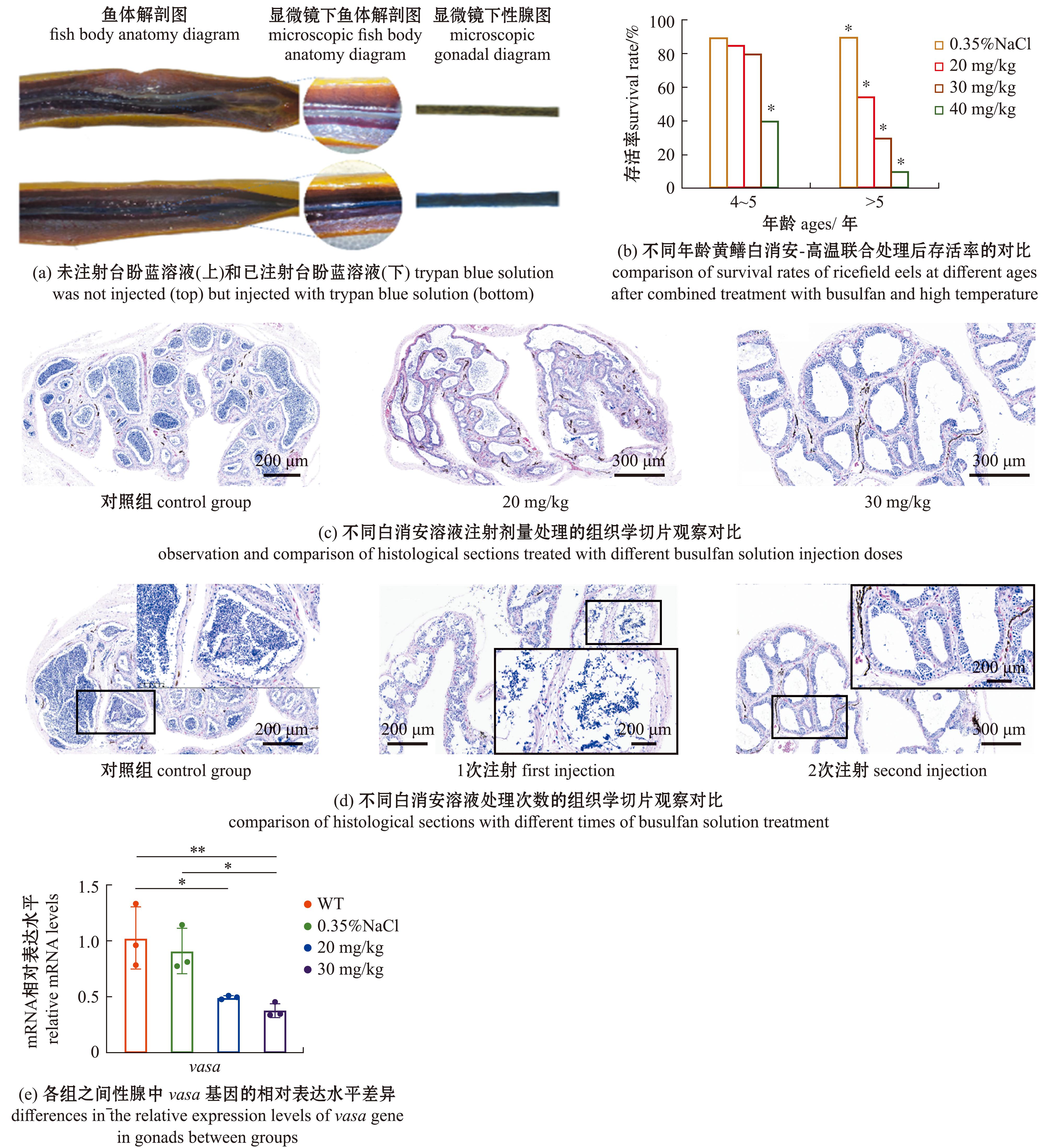
图3 受体鱼制备条件的优化
Fig.3 Optimization of preparation conditions of recipient fish
表2 白消安-高温联合处理试验各组存活率
Tab.2 Survival rate of busulfan combined with high temperature
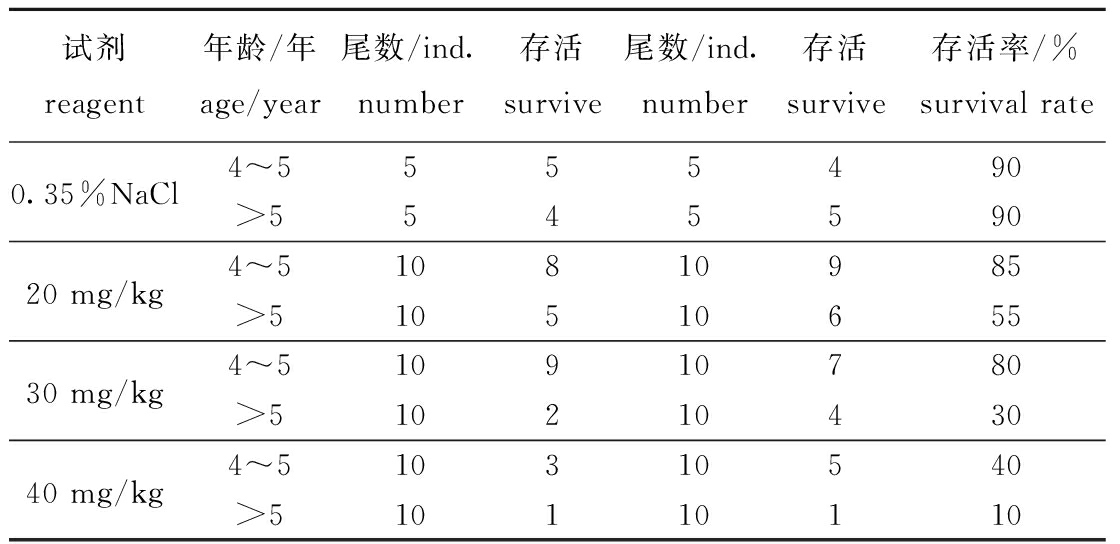
试剂reagent年龄/年age/year尾数/ind.number存活survive尾数/ind.number存活survive存活率/%survival rate0.35%NaCl4~5555490>554559020 mg/kg4~510810985>51051065530 mg/kg4~510910780>51021043040 mg/kg4~510310540>510110110
2.4 生殖干细胞的标记与移植后定植增殖情况
将供体生殖干细胞用荧光膜染料PKH26染色后,荧光显微镜下观察到所有待移植细胞均带有红色荧光(图4(a)),移植后7、21、60 d分别对受体鱼精巢取样进行冷冻切片,之后在共聚焦显微镜下进行PKH26标记生殖细胞免疫荧光检测,结果显示,移植后第7天时可以观察到生殖干细胞成功定植,移植后21 d和60 d可以观察到红色荧光细胞逐渐变多。而阴性对照组未观察到红色荧光(图4(b))。本研究中使用白消安处理了60尾黄鳝,移植了40尾黄鳝,并对12尾黄鳝进行了检测,其中9尾黄鳝观察到定殖现象,移植成功率为75%,具体见表3。
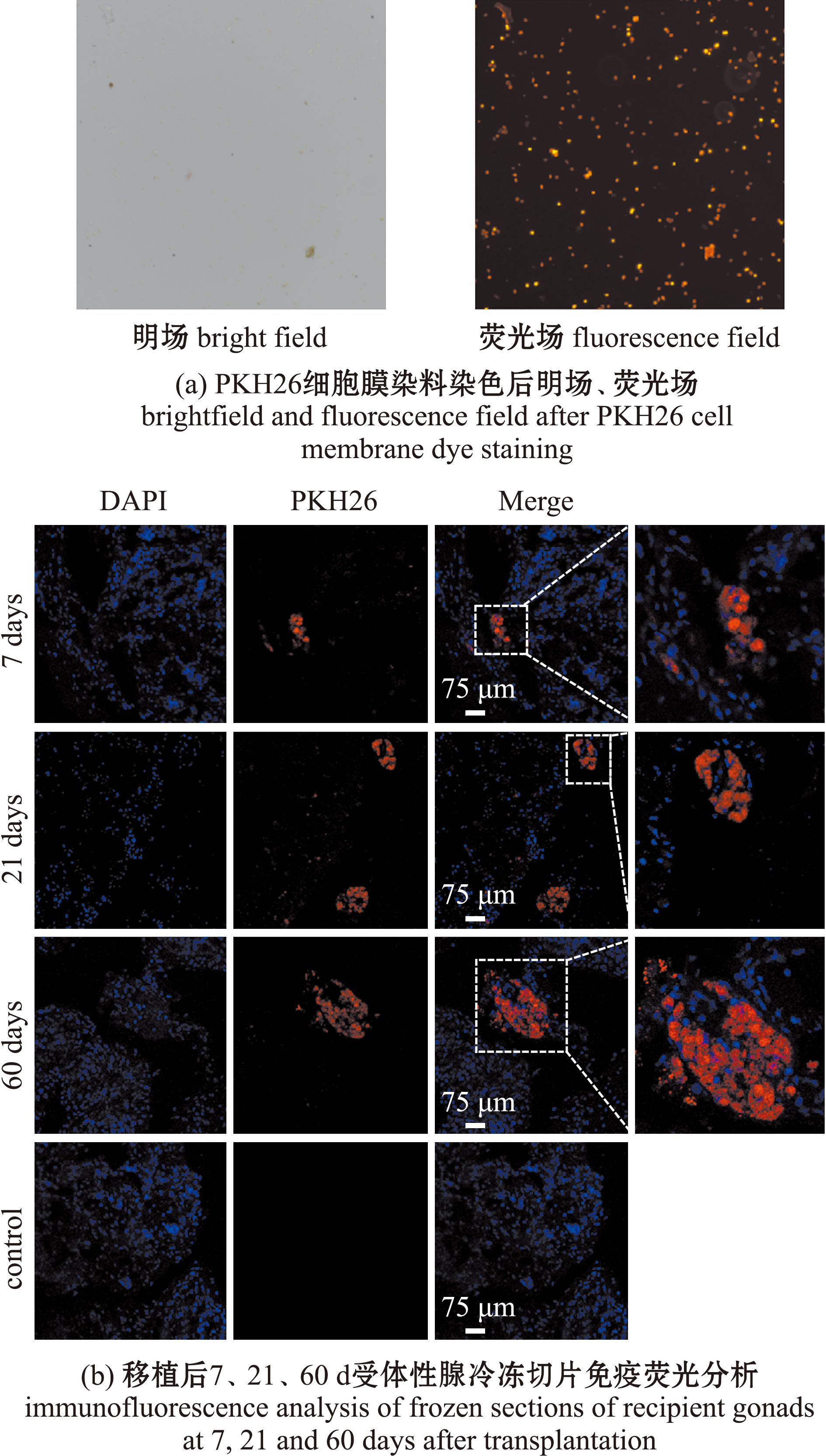
图4 移植细胞在受体中的定植、增殖和分化
Fig.4 Colonization and proliferation of transplanted cells in the recipient
表3 供体细胞的移植和定植
Tab.3 Transplantation and colonization of donor cells

编号number体质量/gweight体长/cmlength注射体积/μLinjection volume移植细胞数目/cells transplanted cells是否定植colonization1164623001×106√2157593001×106×3187653001×106√4162583001×106√5167543001×106√6111563001×106√7175533001×106×8188603001×106√9151573001×106√10122493001×106×11206653001×106√12145483001×106×
3 讨论
3.1 黄鳝雌性生殖干细胞的应用前景
FGSCs是存在于雌性鱼类卵巢中具有自我更新和分化潜能的成体干细胞,能够分化为成熟的卵母细胞并参与生殖过程[23]。随着干细胞生物学和基因编辑技术的发展,fGSCs在基础研究、水产养殖、濒危物种保护和生物技术创新等领域展现出广阔的应用前景[5,11,17-18,24-25]。
中国黄鳝养殖产量自2016年达到历史最高点后,近几年产量不增反减,远低于其他主要水产养殖鱼类,且产业分布呈现强烈的地域性,详见附图1、2(数据来源:2003—2024年中国渔业统计年鉴)。阻碍黄鳝养殖产业发展的有两大难点:一是没有成熟的养殖品种,苗种依赖于捕获野生亲本进行人工繁殖,导致缺少野生亲本的地区黄鳝养殖产业发展受限;此外,部分品种繁殖的后代质量参差不齐,造成养殖收益不稳定,养殖成本高等问题[3];二是雌雄发育不同步,导致雌鱼产卵量少,苗种获取困难[5]。研究表明,合理有效利用fGSCs可为解决上述问题提供新的思路。
关于缺乏成熟养殖品种的问题,通过GSCs或PGCs分离纯化结合CRISPR/Cas9等基因编辑技术及GCT技术[26],可以定向改良黄鳝的性状,如生长速度、抗病性或环境适应性,亦可定向调控性别相关基因(如性逆转调控基因),稳定雌性表型。同时也可以显著缩短育种周期。
关于产卵量少的问题,可通过上述提到的稳定雌性表型来提高产卵效率和数量,还可以利用体外配子发生技术[27-28],结合3D培养体系或类器官技术[28-29],诱导fGSCs分化为功能性卵子,突破黄鳝自然繁殖周期限制,目前已在青鳉等鱼类中实现体外配子发生[29],体外配子发生技术有望成为黄鳝规模化苗种生产的核心手段。此外,还可以将fGSCs移植到繁殖周期快的养殖鱼类性腺中[25],通过“借腹生子”的方式快速获取功能性配子,打破黄鳝一年一次的繁殖周期。
本研究中发现,2龄雌性黄鳝由于发育完全,性腺中充斥着大量成熟或趋于成熟的卵子,生殖干细胞的数目非常少,而1龄黄鳝的性腺中生殖干细胞数量明显较多,因此,试验选定1龄雌性黄鳝作为最佳供体,其后通过不同的Percoll密度梯度(20%、30%、40%、60%)将雌性黄鳝性腺细胞分层,并通过碱性磷酸酶染色、流式细胞术、干性基因差异表达分析等方法鉴定出fGSCs富集层为40%浓度层,其fGSCs占比高达72.52%。此前未见在黄鳝中利用Percoll密度梯度富集细胞的报道,此方法相较于传统差异贴壁法耗时更短(差异贴壁法需4~5 d,Percoll密度梯度离心法仅需1 h),fGSCs损耗更少,对细胞的损伤也更小,体外培养过程中的干性流失也有所降低。此外,生殖干细胞移植结果显示,移植成功率高达75%,说明通过此方法纯化的fGSCs具有优秀的移植潜力。
3.2 黄鳝雌性生殖干细胞移植
生殖细胞移植技术已应用于多种鱼类,目前已有的报道中大部分以幼鱼为受体[30],而成鱼受体相比幼鱼具有操作简便、繁殖时间短等优点,同时也无幼鱼需要长时间培养的压力。目前已有鲤、尼罗罗非鱼及褐牙鲆(Paralichthys olivaceus)等报道过以成鱼为受体进行生殖细胞移植[18,24-25],成鱼GCT的难点主要在于受体鱼的准备[31-32]。在哺乳动物中,目前采用了多种方法来消耗生殖细胞以准备受体,如用白消安等化学药品处理[33-35],以及采用高温、辐射等方法[36]。在鱼类中,人工诱导的三倍体因其不育性也被用作GCT的受体[37]。然而,与正常受精相比,三倍体的诱导率较低,需要特殊操作[38]。因此,大部分研究选择在生育能力正常的鱼中去除生殖细胞以准备受体。在鲤中,主要采用对一龄鱼进行热化学处理的方法[24]。在尼罗罗非鱼中,被选为受体的成鱼也接受了热化学处理,但温度为35 ℃并注射了两次白消安[18]。
黄鳝是一种在成鱼阶段发生先雌后雄自然性逆转的淡水鱼。由于其独特的生活史,黄鳝雌雄亲本发育不同步,进而使得种质资源十分匮乏,同时又很难找到与黄鳝有相似种属关系的淡水养殖鱼类,这就使得GCT技术在黄鳝中难以实现[5]。因此,有必要选择最佳的移植受体和供体,在同种条件下建立一套完善的黄鳝生殖干细胞移植体系,为后续的异种移植打下坚实基础。
在本研究中,选择4~5龄的健壮雄性黄鳝作为受体。进行热(30 ℃)-化学(30 mg/kg白消安)处理以去除内源性生殖细胞。与>5龄的鱼相比,4~5龄鱼处理后的存活率更高。对鱼体注射两次白消安溶液,注射剂量为30 mg/kg。较高剂量的白消安处理能够更好地耗竭内源性生殖细胞,但也可能因细胞毒性而增加死亡率;预试验结果表明,30 mg/kg注射剂量的处理效果好于20 mg/kg注射剂量,而40 mg/kg的过高剂量会导致黄鳝在第一次注射后大量死亡。因此,在准备受体鱼的过程中,选择处理剂量时应在生殖细胞耗竭功效和成活率之间取得平衡。
在本研究中,观察到fGSCs在雄性受体体内的定植与增殖,且定植成功率高达75%。由于时间原因,本研究未能获得供体来源的配子;前期对其他鱼类的研究表明,只要供体细胞整合到受体性腺并在性腺中形成集群,它们就可以产生精子[39-40]。因此,预计受体黄鳝性腺中的移植细胞也将继续分化并产生供体来源的精子。
4 结论
1)利用Percoll密度梯度离心法可以快速分离纯化黄鳝fGSCs,其中40%Percoll浓度层为fGSCs富集层,fGSCs占比为72.52%。
2)黄鳝生殖干细胞同种移植的最佳移植受体为4~5龄黄鳝,最佳移植供体为1龄黄鳝,最佳处理剂量为30 mg/kg(体质量),最佳处理次数为2次。
3)将纯化后的供体来源fGSCs经PKH26染色后移植到同种受体雄性的精巢中,供体细胞在受体性腺内成功定植并发生增殖,成功率高达75%,具有优秀的移植潜力。
(附图及附表参见网址https://xuebao.dlou.edu.cn)
[1] ZHOU L,GUI J F.Jian-Kang Liu:a pioneer of sex determination studies in vertebrates[J].Protein &Cell,2016,7(1):1-3.
[2] 温小波,库夭梅,李伟国.4种优质底栖淡水鱼类肌肉营养成分的比较[J].大连水产学院学报,2003,(2):99-103.WEN X B,KU Y M,LI W G.Comparative analysis of the nutritional composition in muscle of four species of excellent freshwater fishes[J].Journal of Dalian Fisheries University,2003,(2):99-103.(in Chinese)
[3] JIANG Y J,XU W,LUO H R,et al.Hydrostatic pressure shock induced tetraploids in rice field eel (Monopterus albus)[J].Aquaculture,2024,584:740636.
[4] CHENG H H,ZHOU R J.Decoding genome recombination and sex reversal[J].Trends in Endocrinology &Metabolism,2022,33(3):175-185.
[5] SUN X Y,TAO B B,WANG Y X,et al.Isolation and characterization of germline stem cells in protogynous hermaphroditic Monopterus albus[J].International Journal of Molecular Sciences,2022,23(11):5861.
[6] 徐闻,宋焱龙,蒋银军,等.黄鳝减数分裂雌核发育及子代遗传纯合度分析[J].水生生物学报,2024,48(5):820-828.XU W,SONG Y L,JIANG Y J,et al.Induction of meiogynogenesis in Monopterus albus and genetic homozygosity analysis of the gynogenic offspring[J].Acta Hydrobiologica Sinica,2024,48(5):820-828.(in Chinese)
[7] ZHANG Y M,LUO T T,SUN Y H.A temperature-induced sex reversal mechanism in ricefield eels[J].Water Biology and Security,2025:100360.
[8] LEHMANN R.Germline stem cells:origin and destiny[J].Cell Stem Cell,2012,10(6):729-739.
[9] BAI Y,YU M,HU Y,et al.Location and characterization of female germline stem cells (FGSCs) in juvenile porcine ovary[J].Cell Proliferation,2013,46(5):516-528.
[10] HUANG Y H,CHIN C C,HO H N,et al.Pluripotency of mouse spermatogonial stem cells maintained by IGF-1- dependent pathway[J].FASEB Journal,2009,23(7):2076-2087.
[11] YE H,LI C J,YUE H M,et al.Establishment of intraperitoneal germ cell transplantation for critically endangered Chinese sturgeon Acipenser sinensis[J].Theriogenology,2017,94:37-47.
[12] ZOU K,HOU L,SUN K J,et al.Improved efficiency of female germline stem cell purification using fragilis-based magnetic bead sorting[J].Stem Cells and Development,2011,20(12):2197-2204.
[13] HONG Y H,LIU T M,ZHAO H B,et al.Establishment of a normal medakafish spermatogonial cell line capable of sperm production in vitro[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(21):8011-8016.
[14] SHANG M,SU B F,PERERA D A,et al.Testicular germ line cell identification,isolation,and transplantation in two North American catfish species[J].Fish Physiology and Biochemistry,2018,44(2):717-733.
[15] WONG T T,TESFAMICHAEL A,COLLODI P.Production of zebrafish offspring from cultured female germline stem cells[J].PLoS One,2013,8(5):e62660.
[16] TAKEUCHI Y,YOSHIZAKI G,TAKEUCHI T.Generation of live fry from intraperitoneally transplanted primordial germ cells in rainbow trout[J].Biology of Reproduction,2003,69(4):1142-1149.
[17] LACERDA S,BATLOUNI S,SILVA S,et al.Germ cells transplantation in fish:the Nile-Tilapia model[J].Animal Reproduction,2006,3(2):146-159.
[18] LACERDA S M S N,BATLOUNI S R,COSTA G M J,et al.A new and fast technique to generate offspring after germ cells transplantation in adult fish:the Nile Tilapia (Oreochromis niloticus) model[J].PLoS One,2010,5(5):e10740.
[19] YOSHIZAKI G,YAZAWA R.Application of surrogate broodstock technology in aquaculture[J].Fisheries Science,2019,85(3):429-437.
[20] SATO M,MORITA T,KATAYAMA N,et al.Production of genetically diversified fish seeds using spermatogonial transplantation[J].Aquaculture,2014,422:218-224.
[21] YOSHIKAWA H,MORISHIMA K,FUJIMOTO T,et al.Chromosome doubling in early spermatogonia produces diploid spermatozoa in a natural clonal fish[J].Biology of Reproduction,2009,80(5):973-979.
[22] JIANG Y J,LUO H R,HOU M X,et al.Aromatase inhibitor induces sex reversal in the protogynous hermaphroditic rice field eel (Monopterus albus)[J].Aquaculture,2022,551:737960.
[23] WANG X,LAI F L,SHANG D T,et al.Cellular fate of intersex differentiation[J].Cell Death &Disease,2021,12(4):388.
[24] MAJHI S K.Generation of surrogate goldfish Carassius auratus progeny from common carp Cyprinus carpio parents[J].3 Biotech,2023,13(1):27.
[25] REN Y Q,SUN Z H,WANG Y F,et al.Production of donor-derived offsprings by allogeneic transplantation of oogonia in the adult Japanese flounder (Paralichthys olivaceus)[J].Aquaculture,2021,543:736977.
[26] WANG X S,ZHU J W,WANG H P,et al.Induced formation of primordial germ cells from zebrafish blastomeres by germplasm factors[J].Nature Communications,2023,14(1):7918.
[27] OIKAWA M,KOBAYASHI H,SANBO M,et al.Functional primordial germ cell-like cells from pluripotent stem cells in rats[J].Science,2022,376(6589):176-179.
[28] SAITOU M,HAYASHI K.Mammalian in vitro gametogenesis[J].Science,2021,374(6563):eaaz6830.
[29] CHEN X,KAN Y T,ZHONG Y,et al.Generation of a normal long-term-cultured Chinese hook snout carp spermatogonial stem cell line capable of sperm production in vitro[J].Biology,2022,11(7):1069.
[30] KAN Y T,ZHONG Y,JAWAD M,et al.Establishment of a Coilia nasus gonadal somatic cell line capable of sperm induction in vitro[J].Biology,2022,11(7):1049.
[31] OKUTSU T,SHIKINA S,KANNO M,et al.Production of trout offspring from triploid salmon parents[J].Science,2007,317(5844):1517.
[32] MAJHI S K,HATTORI R S,RAHMAN S M,et al.Surrogate production of eggs and sperm by intrapapillary transplantation of germ cells in cytoablated adult fish[J].PLoS One,2014,9(4):e95294.
[33] OGAWA T,DOBRINSKI I,BRINSTER R L.Recipient preparation is critical for spermatogonial transplantation in the rat[J].Tissue and Cell,1999,31(5):461-472.
[34] BRINSTER R L,AVARBOCK M R.Germline transmission of donor haplotype following spermatogonial transplantation[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(24):11303-11307.
[35] HONARAMOOZ A,BEHBOODI E,HAUSLER C L,et al.Depletion of endogenous germ cells in male pigs and goats in preparation for germ cell transplantation[J].Journal of Andrology,2005,26(6):698-705.
[36] VAN DEN AARDWEG G J,DE RUITER-BOOTSMA A L,KRAMER M F,et al.Growth and differentiation of spermatogenetic colonies in the mouse testis after irradiation with fission neutrons[J].Radiation Research,1983,94(3):447-463.
[37] HAMASAKI M,TAKEUCHI Y,YAZAWA R,et al.Production of tiger puffer Takifugu rubripes offspring from triploid grass puffer Takifugu niphobles parents[J].Marine Biotechnology,2017,19(6):579-591.
[38] ARAI K.Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan[J].Aquaculture,2001,197(1/2/3/4):205-228.
[39] OCTAVERA A,YOSHIZAKI G.Production of donor-derived offspring by allogeneic transplantation of spermatogonia in Chinese rosy bitterling[J].Biology of Reproduction,2019,100(4):1108-1117.
[40] FRAN K R,KA
K R,KA PAR V,ALI SHAH M,et al.Production of common carp donor-derived offspring from goldfish surrogate broodstock[J].Aquaculture,2021,534:736252.
PAR V,ALI SHAH M,et al.Production of common carp donor-derived offspring from goldfish surrogate broodstock[J].Aquaculture,2021,534:736252.