LCP1基因编码的L-plastin蛋白属于α-肌动蛋白家族成员,其通过EF臂结构域(钙结合基序)和串联肌动蛋白结合结构域(actin-binding domain,ABD)介导细胞骨架重塑,在免疫细胞趋化、吞噬及信号转导中发挥核心作用[1-5]。哺乳动物研究表明,L-plastin通过调控T细胞活化[6]、巨噬细胞极化及整合素介导的黏附参与炎症反应[7],通过激活JAK2/STAT3信号通路促进骨肉瘤细胞增殖和转移[8]。L-plastin表达被记录为一种遗传标记和细胞机制,在斑马鱼(Danio rerio)、小鼠(Mus musculus)和人类(Homo sapiens)中高度保守[9]。鱼类LCP1缺失可导致斑马鱼巨噬细胞迁移方向性紊乱,揭示了其对先天免疫的调控机制[10]。尽管在斑马鱼[11]和大西洋鲑(Salmo salar)[12]中,LCP1被证实参与抗菌应答,但尼罗罗非鱼(Oreochromis niloticus)中该基因的免疫调控机制仍未被系统解析,现有研究多局限于生物信息学分析(如染色体共线性与序列保守性)[13],缺乏功能验证与信号通路研究。
尼罗罗非鱼作为联合国粮农组织(FAO)重点推广的全球性经济鱼类,凭借其生长迅速、抗逆性强及肉质优良等特性,已成为水产养殖业的重要支柱物种[14-16]。中国作为全球最大的罗非鱼生产国,年产量逾180万t,占世界总产量的35%以上,其中广东、海南和广西三省区贡献了全国近80%的产量[14]。然而,随着集约化养殖规模的扩大,链球菌病的频发严重制约了该产业的可持续发展。无乳链球菌(Streptococcus agalactiae)作为主要病原体,自2009年起在中国主要养殖区持续暴发,可导致养殖群体30%~80%的累积死亡率[15-16]。研究表明,无乳链球菌不仅通过破坏宿主肠道菌群稳态(如显著提升爱德华氏菌属和假单胞菌属丰度)加剧感染进程,还可通过逃逸巨噬细胞吞噬、诱导宿主细胞凋亡及触发系统性炎症反应实现免疫逃逸[16-17]。值得注意的是,无乳链球菌兼具人兽共患特性,可引发新生儿败血症、脑膜炎及奶牛乳腺炎,其跨物种传播风险进一步凸显了防控研究的紧迫性[18-19]。目前,罗非鱼无乳链球菌病的致病机制和有效防治方法仍是国内外研究热点,亟需从免疫基因功能层面解析宿主的防御策略,为抗病分子育种提供理论依据。
尼罗罗非鱼作为典型硬骨鱼类模型,其免疫应答机制高度依赖于模式识别受体(pattern recognition receptors,PRRs),如Toll样受体(TLRs)和C型凝集素受体(C-type lectin receptors,CLRs),通过识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)激活下游信号通路[20]。近年研究表明,尼罗罗非鱼Scara3通过调控巨噬细胞吞噬功能参与细菌清除[20],TIRAP作为TLR信号适配分子介导炎症因子释放[21],而CD209通过激活NF-κB路增强抗菌应答[22]。然而,免疫调控网络的复杂性要求更多关键基因的功能解析。LCP1作为细胞骨架调控的核心基因,其功能研究有望揭示新的免疫调控节点,为完善鱼类免疫理论体系提供关键线索。
本研究中以尼罗罗非鱼为研究对象,克隆了LCP1基因(命名为OnLCP1),通过生物信息学分析、亚细胞定位及荧光定量PCR技术解析其组织分布与免疫刺激响应模式,并利用双荧光素酶报告系统探究了其对NF-κB、STAT1等信号通路的调控作用,以期深入探讨OnLCP1基因在尼罗罗非鱼抵御无乳链球菌感染中的作用,为理解其在鱼类先天免疫中的功能提供有益参考。
1 材料和方法
1.1 材料
尼罗罗非鱼样本(平均体质量为 100 g±10 g)取自广东省湛江市某养殖场。在试验开始前,试验鱼在1 000 L的玻璃钢桶中暂养4 周的,水温控制在 28 ℃±2 ℃。
从健康尼罗罗非鱼的鳃、头肾、皮肤、肌肉、肠道、脑、胸腺和脾脏等8个组织中采集样本,以探究OnLCP1基因在尼罗罗非鱼不同组织中的表达情况。
罗非鱼的攻毒试验参考了Xie等[23]和Xia等[24]的方法。具体而言,选取无乳链球菌(ZQ0910)作为免疫刺激剂。试验组罗非鱼通过腹腔注射100 μL浓度为1×107 CFU/mL的福尔马林灭活无乳链球菌悬浮液,而对照组则注射等体积的无菌PBS溶液。在免疫刺激后的0、4、8、12、24、48、72、96 h,分别从对照组和试验组罗非鱼中采集脾脏、皮肤、鳃和肠道等组织样本,每个样本均设置3个生物学重复。
采集后的组织样本立即置于液氮中冷冻,之后转移至-80 ℃的冰箱中储存,以备后续试验使用。本研究遵循了中国的实验动物管理法规原则和相关程序,确保了所有试验操作的合规性和动物福利。
1.2 方法
1.2.1 总RNA提取和cDNA合成 所有样本均根据TransZol Up Plus RNA Kit(Trans,中国)的说明书提取总RNA,然后按照反转录试剂盒的指导步骤,将提取的RNA反转录成cDNA。
1.2.2 OnLCP1基因克隆 为了扩增LCP1基因的编码序列(CDS),本研究中利用Primer Premier 5.0软件设计了两对引物:OnLCP1-1F和OnLCP1-1857R(表1)。随后,采用PCR技术对目的基因进行扩增。PCR反应条件为94 ℃下预变性5 min;94 ℃下循环变性30 s,50 ℃下退火复性30 s,72 ℃下延伸1 min 50 s,共进行33 个循环;最后于 72 ℃下延伸 10 min;在 4 ℃下保存。PCR反应完成后,通过琼脂糖凝胶电泳对产物进行分析。目标条带经过琼脂糖凝胶回收后,与pMD18-T载体连接,并转化到E.coli DH5α感受态细胞中。转化后的细胞经过培养,挑选出单个菌落进行菌落PCR鉴定。确认阳性的单克隆菌落被送往生工生物工程(广州)公司进行序列测定。
表1 本研究使用的PCR引物
Tab.1 PCR primers used in the study
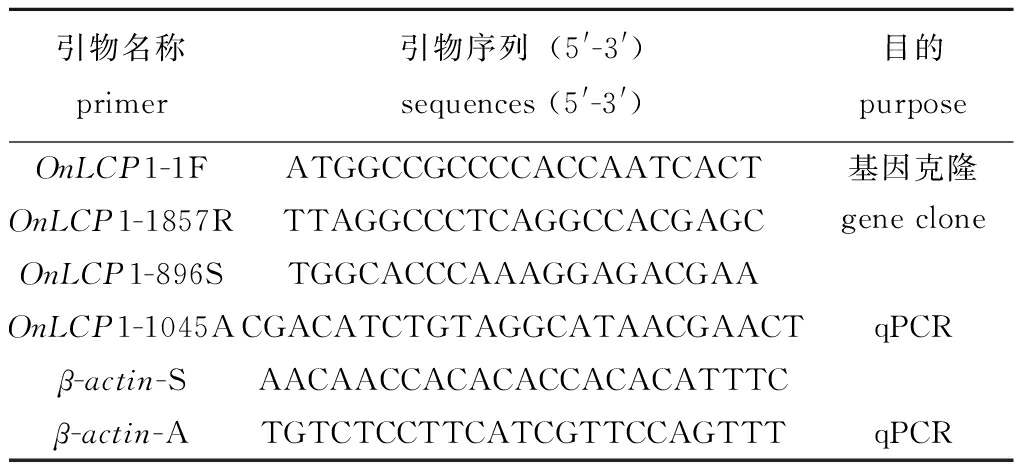
引物名称primer引物序列(5'-3')sequences (5'-3')目的purposeOnLCP1-1FATGGCCGCCCCACCAATCACT基因克隆gene cloneOnLCP1-1857RTTAGGCCCTCAGGCCACGAGCOnLCP1-896STGGCACCCAAAGGAGACGAAOnLCP1-1045ACGACATCTGTAGGCATAACGAACTqPCRβ-actin-SAACAACCACACACCACACATTTCβ-actin-ATGTCTCCTTCATCGTTCCAGTTTqPCR
本研究中克隆的OnLCP1基因序列来源于课题组罗非鱼全长转录组(未公布),该基因的序列号为Isoform_45164。
1.3 数据处理
1.3.1 生物信息学分析 测序结果通过DNASTAR软件进行序列拼接,以获得完整的OnLCP1基因序列。随后,利用Soft Berry-Psite (http://www.softberry.com/)对氨基酸基本功能位点分布预测;利用ExPASy(http://expasy.org/tools/)和InterProScan程序(http://www.ebi.ac.uk/Tools/pfa/iprscan/)对基因编码的蛋白质结构域进行分析并进行结构域预测。使用UCSC预测内含子和外显子;此外,蛋白质的二级和三级结构分别通过PORTER(http://www.distill.ucd.ie/porter)和SWISSMODEL(http://swissmodel.expasy.org/inter)进行预测。为了比较氨基酸序列的同源性,应用ClustalX和Genedoc程序进行了序列比对。随后,利用MEGA 6.0软件,基于邻接法(neighbor-joining,NJ)构建了OnLCP1基因的系统进化树。
1.3.2 OnLCP1基因表达分析 为了评估OnLCP1基因在免疫处理前后的表达情况,本研究中采用QuantStudio 6 Flex PCR定量仪(Thermo Fisher Scientific,美国),并选取了β-actin作内参基因,以实现表达水平的标准化。通过定量反转录聚合酶链反应(RT-qPCR)技术,研究者能够准确分析OnLCP1基因在多个组织样本中的表达变化,从而深入了解其在免疫应答中的潜在作用。RT-qPCR反应体系(10 μL):SYBR® Select Master Mix(5 μL),去离子水(ddH2O,3.5 μL),cDNA模板(0.5 μL),以及浓度为 200 nmol/L引物(0.5 μL)。试验中,引物与去离子水预先混合,而cDNA模板则与Master Mix混合。反应条件:94 ℃下预变性5 min;94 ℃下循环变性10 s,60 ℃下退火复性1 min,共进行40个循环。扩增完成后,进行熔解曲线分析,范围设置70 ℃~95 ℃,以确认扩增产物的一致性和特异性。每个样本均进行了3次独立重复试验以确保结果的可靠性。试验结果运用2-ΔΔCt法计算OnLCP1基因的相对表达水平,并采用SPSS 20.0统计软件进行单因素方差分析(ANOVA),以评估不同样本间表达量的统计学差异。
1.3.3 亚细胞定位 构建pDsRed-OnLCP1表达载体,用EcoRI和BamHI限制性内切酶处理载体,然后根据E.Z.N.A.® Endo-Free Plasmid DNA Mini Kit Ⅱ说明书提取质粒。
将HEK-293T细胞接种到24孔板(孔直径 15.6 mm),在培养箱中孵育 18 h 后,根据LipofectaminTM 3000 TransfectionReagent说明书分别将空载质粒pDsRed-Monomer-N1和重组质粒pDsRed-OnLCP1转染入细胞中,孵育48 h后用胰蛋白酶消化处理,重悬,吸取部分细胞于处理后的盖玻片上,继续孵育6 h。孵育结束后,先用PBS洗涤细胞2次,然后用40 mg/mL多聚甲醛固定,再滴加4′,6-二脒基-2-苯基吲哚(DAPI)进行细胞核染色。最后用PBS洗涤细胞2次,加入抗荧光猝灭封片剂封片,用激光共聚焦显微镜观察拍照。
1.3.4 信号通路验证
1)pcDNA3.1、pcDNA3.1-LCP1、真核表达载体构建及去内毒素质粒提取同前。
2)HEK-293T细胞培养并接种于24孔板。
3)细胞汇合度为80%~90%时进行细胞转染,具体参照LipofecetamineTM3000说明书进行。按照每孔250 ng的量加入去内毒素质粒,其中试验组每孔加入报告质粒pNF-κB-luc125 ng,内参质粒pRL-TK 4 ng,重组质粒pcDNA3.1-LCP1 125 ng,对照组加入报告质粒pNF-κB-luc 125 ng,内参质粒pRL-TK 4 ng,pcDNA3.1 125 ng;本试验共5个报告质粒,分别是pNF-κB-luc、STAT1、ISRE、IFN-1和IFN-3,通路检测加样方式相同,设置4个复孔。
4)转染48 h后,小心吸弃培养基,按照200 μL/孔的量加入PBS润洗后吸弃。
5)加入报告基因细胞裂解液200 μL,裂解2~3 min。
6)用移液枪吹打裂解液并吸入到新的1.5 mL 离心管中。
7)以12 000 g条件下室温离心5 min。
8)转移上清至新的离心管,-20 ℃保存备用。
9)萤火虫及海肾荧光素酶活性检测参照碧云天One-LumiTM萤火虫荧光素酶报告基因检测试剂盒操作说明。
2 结果与分析
2.1 OnLCP1基因克隆及序列分析
OnLCP1基因的开放阅读框(ORF)长度为1 857个核苷酸,分析表明,该基因编码的蛋白质不含信号肽。预测的蛋白质由618个氨基酸残基组成,其核苷酸和氨基酸序列如图1所示。进一步的物理化学性质分析揭示了OnLCP1蛋白的分子质量约为692 000,理论等电点(pI)为5.14。通过SoftBerry-Psite工具预测该序列的功能位点,发现该序列N-糖基化位点有5个,蛋白激酶C磷酸化位点有3个,酪蛋白激酶Ⅱ磷酸化位点2个,N-豆蔻酰化位点1个,酰胺化化位点1个,CAAX box 2个,C-末端定位信号序列微体1个。

图1 OnLCP1基因核苷酸序列及其推导的氨基酸序列
Fig.1 OnLCP1 nucleotide and deduced amino acid sequence
将尼罗罗非鱼的LCP1基因结构与人类、小鼠、非洲爪蟾进行比对,研究发现,LCP1基因的内含子拼接序列在结构上与其他物种相似,均含有16个外显子和15个内含子(图2)。然而,尼罗罗非鱼的内含子大小相较于其他物种较小。在结构域预测方面,OnLCP1蛋白被鉴定含有1个EF臂结构域(钙结合结构域)和两个串联的肌动蛋白结合结构域(ABD)。每个肌动蛋白结合结构域均包含两个钙调蛋白同源(CH)结构域(图3)。采用TMHMM Server 2.0进行跨膜结构域预测,结果显示,OnLCP1蛋白是一种无跨膜的细胞外蛋白。
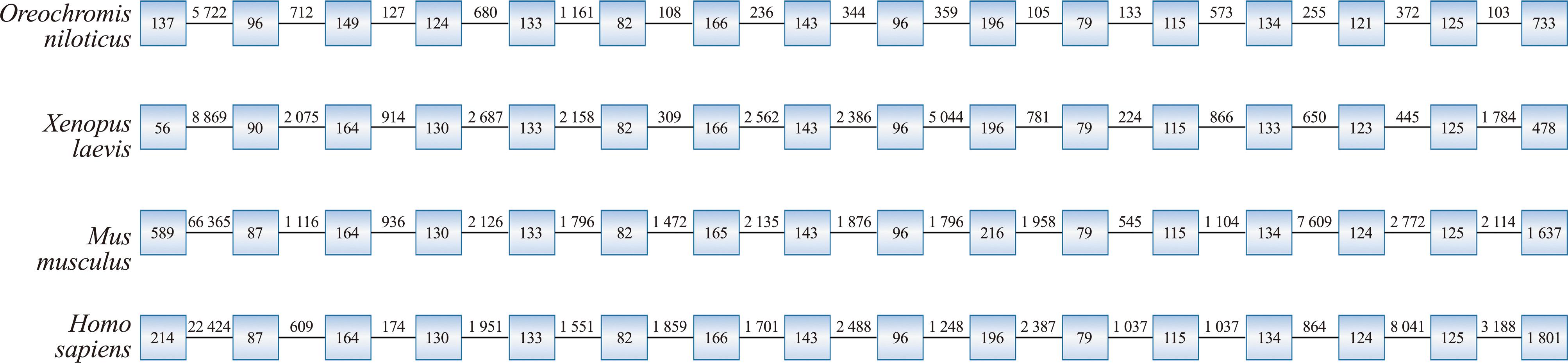
图2 OnLCP1与其他基因的内含子/外显子组织结构
Fig.2 Intron/exon organizations of OnLCP1 with others
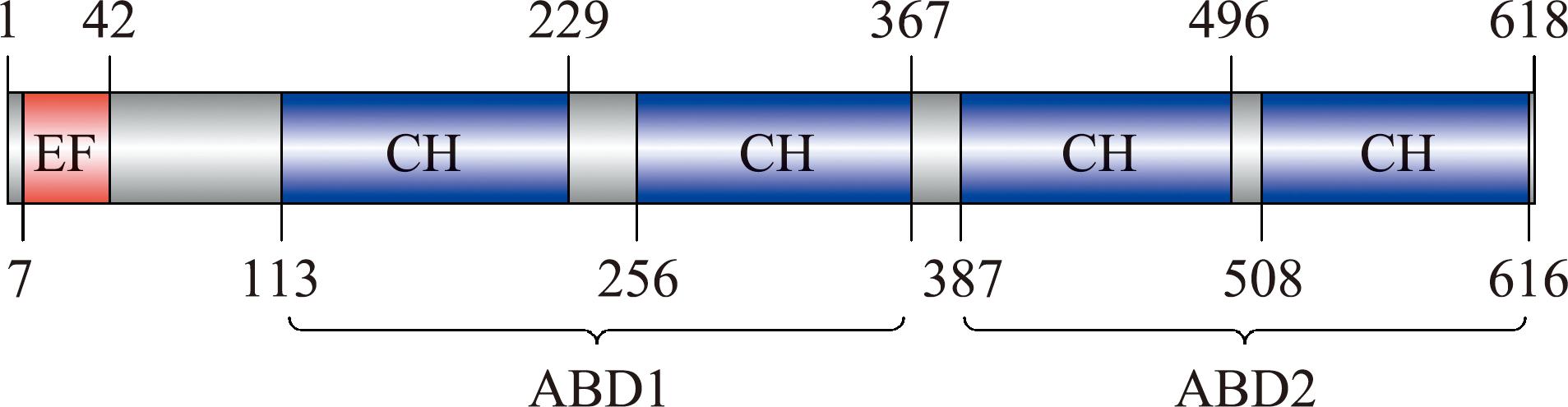
EF—EF臂结构域;CH—钙调蛋白同源结构域;ABD—肌动蛋白结合结构域。
EF—EF-hand domain;CH—Calponin homology domain;ABD—actin-binding domain.
图3 OnLCP1结构域预测
Fig.3 Prediction of the conserved domain of OnLCP1
多序列比对分析揭示,OnLCP1蛋白与人类、小鼠的相应蛋白序列具有显著的同源性,这一发现强化了其在生物学功能上的保守性(图4)。为了进一步验证这一结果,本研究中利用SWISS-MODEL在线平台进行了同源建模,随后采用PyMOL软件对模型进行了结构可视化。分析表明,OnLCP1蛋白与人类LCP1蛋白的结构高度相似,且模型与实际序列的适配度和重叠度均极高(图5)。
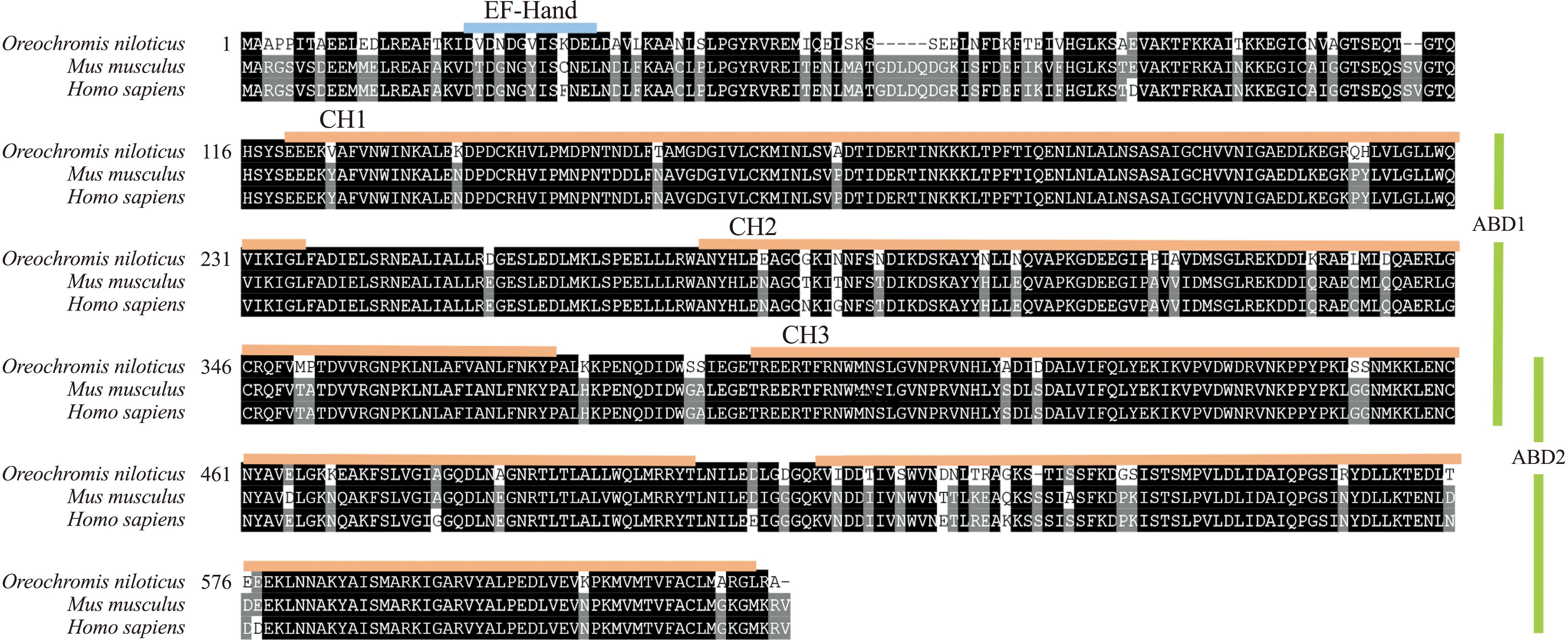
图4 OnLCP1氨基酸序列与其他基因的多重序列比对
Fig.4 OnLCP1 amino acid multiple sequence alignment with others
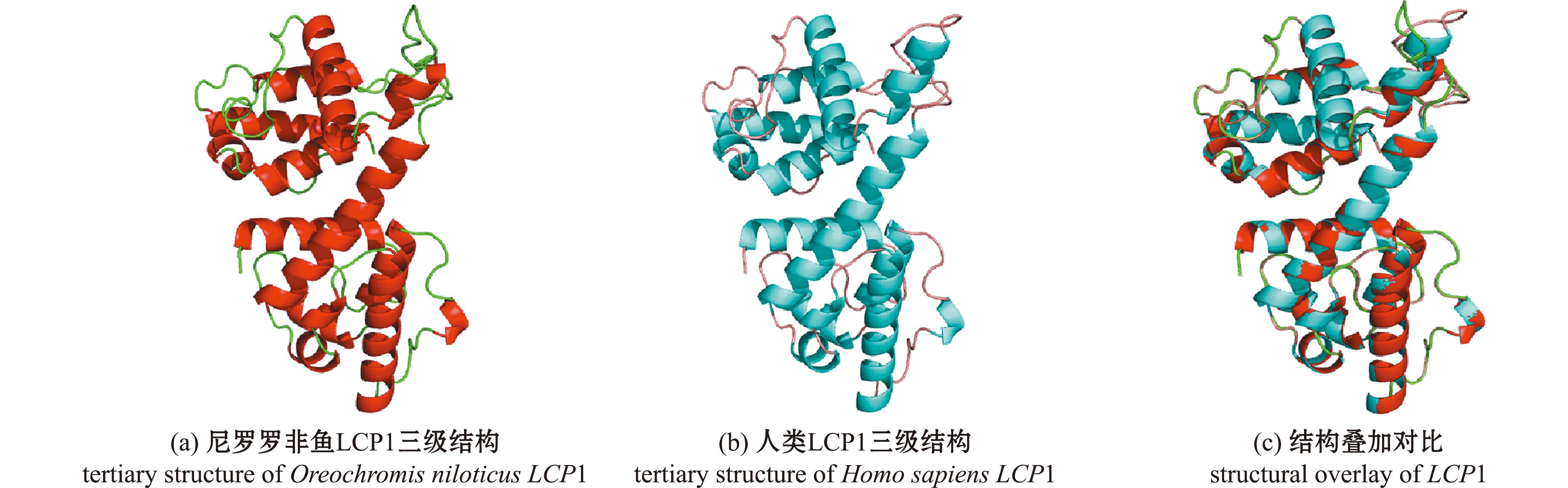
图5 人类和罗非鱼LCP1基因的三级结构
Fig.5 Tertiary structure of LCP1 in human and tilapia
利用MEGA 6.0软件构建尼罗罗非鱼与其他物种plastin蛋白家族的系统进化树,包括人类、小鼠、斑马鱼、虹鳟、扬子鳄、尼罗罗非鱼及大刺鳅等物种。选择这些物种旨在覆盖广泛的进化分支,以明确plastin蛋白家族成员的系统发育关系。结果显示(图6),脊椎动物plastin蛋白分为3个明确的进化分支,分别对应L-Plastin、T-Plastin和I-Plastin亚型。值得注意的是,尼罗罗非鱼plastin蛋白与硬骨鱼类聚为一支,而哺乳动物(如人类和小鼠)聚为一支,这一结果符合脊椎动物的进化分化规律。

图6 罗非鱼plastins的同源基因
Fig.6 Tilapia orthologs of plastins
2.2 OnLCP1基因的组织分布
通过荧光定量PCR技术,发现了OnLCP1基因在检测的所有组织中都有表达,特别是在脾脏中的表达水平最高,胸腺中次之。相对而言,OnLCP1基因在皮肤组织中的表达量最低(图7)。
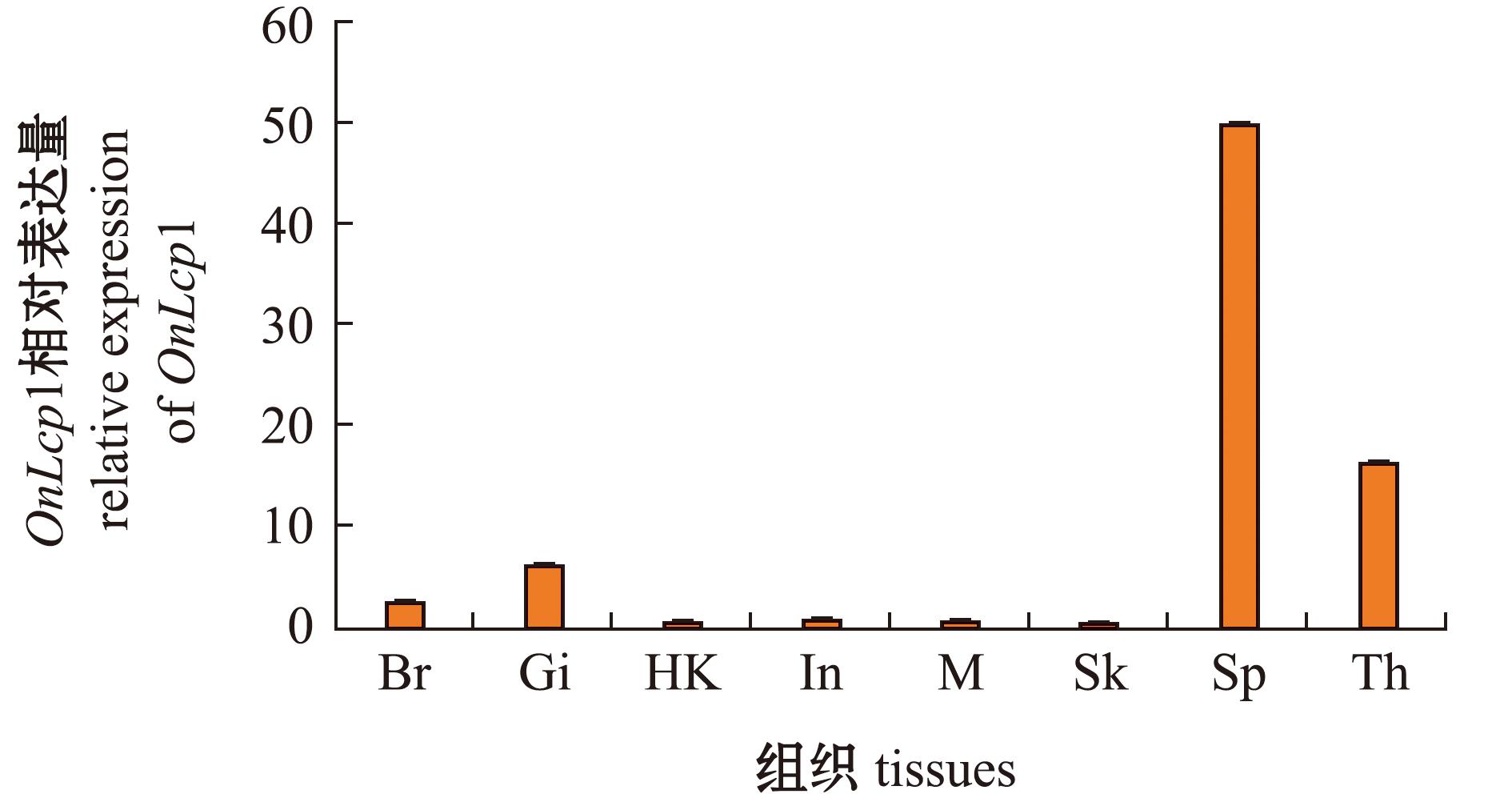
Th—胸腺;Gi—鳃;Sp—脾脏;In—肠道;HK—头肾;Br—脑;Sk—皮肤;M—肌肉。
Th—thymus;Gi—gill;Sp—spleen;In—intestine;HK—head-kidney;Br—brain;Sk—skin;M—muscle.
图7 健康鱼组织中OnLCP1的表达量
Fig.7 OnLCP1 expression in healthy fish tissues
2.3 灭活无乳链球菌免疫刺激后OnLCP1基因的表达水平
为了探究OnLCP1基因在尼罗罗非鱼抵抗无乳链球菌感染中的作用,本研究中通过实时荧光定量PCR技术检测了免疫刺激前后不同免疫器官中OnLCP1基因的相对表达量。分析结果显示,鳃中的OnLCP1基因表达量在感染后96 h内达到峰值,头肾中的表达量在感染后4 h内达到峰值,脾脏中的表达量在感染后72 h内达到峰值,肠道中的表达量在感染后12 h内达到峰值。尽管各组织和时间点的表达量有所差异,但整体趋势表现为感染初期表达量上升,随后逐渐下降(图8)。

*表示显著差异(P<0.05);**表示极显著差异(P<0.01),下同。
*means significant difference (P<0.05);**means very significant difference (P<0.01),et sequentia.
图8 灭活无乳链球菌免疫刺激后OnLCP1基因在鱼组织中的相对表达量
Fig.8 Relative expression of OnLCP1 in immune organs after Streptococcosis agalactiae stimulus
2.4 亚细胞定位
亚细胞定位试验结果显示,红色荧光主要分布于细胞质中,说明OnLCP1蛋白定位于细胞质中(图9)。
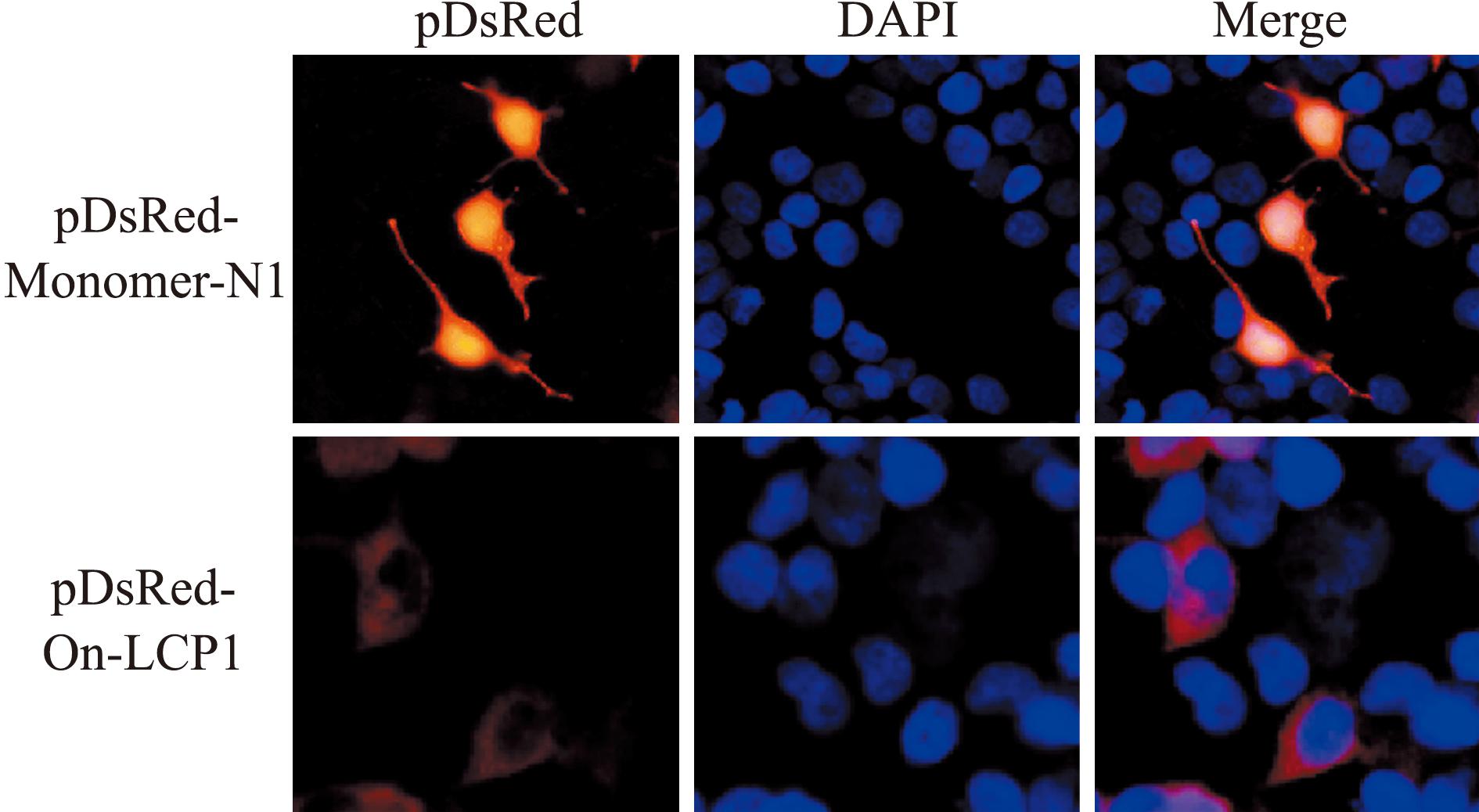
图9 OnLCP1蛋白在HEK-293T细胞中的亚细胞定位
Fig.9 Subcellular localization of OnLCP1 protein in HEK-293T cells
2.5 信号通路验证
为验证该基因的功能,采用双荧光素酶报告系统检测了过表达OnLCP1对NF-κB、STAT1、ISRE、IFN-1和IFN-3等信号通路活性的影响。结果显示(图10),过表达OnLCP1后,NF-κB信号通路的荧光值显著升高(P<0.05),表明OnLCP1具有显著上调NF-κB信号通路的活性。
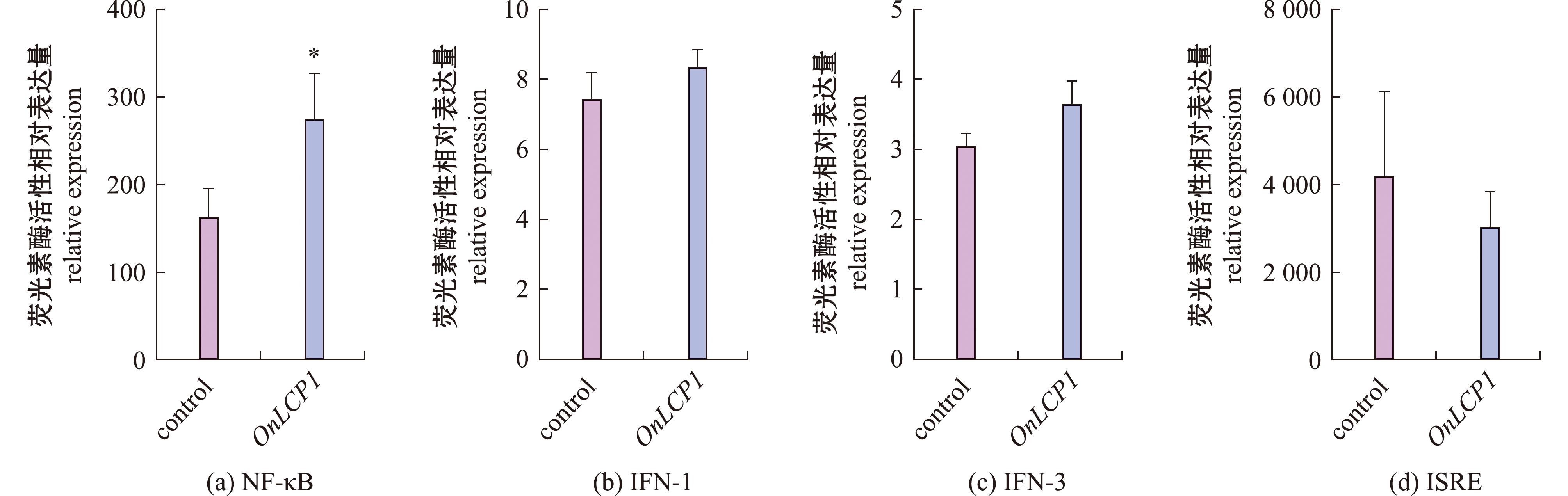
图10 OnLCP1基因的转录活性分析
Fig.10 Transcriptional activity analysis of OnLCP1 gene
3 讨论
3.1 OnLCP1基因的结构特征与进化保守性
本研究中成功克隆了尼罗罗非鱼的LCP1基因(OnLCP1),其编码的蛋白包含1个EF臂结构域(钙结合基序)和两个串联的肌动蛋白结合结构域(ABD),与人类LCP1的三维结构高度相似[25],表明其功能可能保守。现有研究表明,斑马鱼[11]和大西洋鲑[12]的LCP1蛋白均含有2个EF臂结构域,与哺乳动物LCP1蛋白的结构域组成一致。然而,尼罗罗非鱼的LCP1缺少一个EF臂结构域。EF臂结构域是钙离子结合的关键位点,在哺乳动物中参与钙依赖性信号传导[3]。这一结构差异可能反映了尼罗罗非鱼在进化过程中对钙信号调控的适应性调整。如EF结构域的减少可能影响OnLCP1的钙敏感性,但其保留的两个CH结构域(钙调蛋白同源域)可能通过其他机制维持细胞骨架的动态调控功能[26]。未来需通过钙离子结合试验和细胞迁移功能分析,进一步验证这种结构功能关系。
3.2 OnLCP1的组织分布与免疫刺激响应
在健康尼罗罗非鱼中,OnLCP1广泛表达于各组织,其中脾脏的表达量最高,胸腺次之。脾脏作为鱼类的主要免疫器官,富含巨噬细胞和淋巴细胞[27-29],其高表达水平提示OnLCP1可能在免疫细胞的趋化、吞噬及信号传导中发挥核心作用。其次,OnLCP1在胸腺中的表达量也相对较高,因为胸腺是T细胞成熟的主要位点[29],它在免疫应答中扮演着至关重要的角色。皮肤作为鱼体的第一道防线,虽然OnLCP1表达量最低,但仍保持表达。因为皮肤作为黏膜免疫系统,含有大量的T细胞和其他白细胞,这为细胞免疫反应的发生提供了条件[30]。
在灭活无乳链球菌刺激后,本试验选择脾脏、头肾、鳃和肠道进行动态检测,是因为脾脏和头肾作为系统免疫的核心组织,负责免疫细胞的生成、分化和病原体清除[31-33] 。而鳃和肠道作为病原体入侵的主要途径,具有物理屏障和黏膜免疫功能[34-35]。尽管鳃和肠道的基础表达量较低,但在免疫刺激后其OnLCP1的转录水平显著上调。如肠道中的表达量在感染后12 h达到峰值,可能与局部免疫细胞的快速激活相关;而脾脏中的表达在72 h达到峰值,提示其可能在感染后期通过调控T细胞功能增强系统性免疫应答。这种时序差异反映了不同组织在免疫防御中的分工:鳃和肠道负责早期屏障防御,而脾脏和头肾主导后期的病原清除与免疫记忆形成。免疫刺激初期,OnLCP1基因的表达量上升,随后呈现下降趋势,这种模式与ICAM-1[36]、Crtam[37]、Macro[38]等基因在尼罗罗非鱼上的表达模式相似,提示OnLCP1基因可能参与了罗非鱼先天性免疫应答过程,在罗非鱼抗无乳链球菌感染过程中发挥重要的作用。
3.3 亚细胞定位与免疫功能关联
亚细胞定位试验表明,OnLCP1蛋白主要定位于HEK-293T细胞的细胞质中。细胞质是细胞骨架网络(微丝、微管)的主要分布区域[39-40],而LCP1作为肌动蛋白结合蛋白,可能通过调控骨架重塑影响免疫细胞的迁移和吞噬功能。如在哺乳动物中,L-plastin可通过促进F-肌动蛋白的成束化,增强T细胞的趋化能力[3]。在罗非鱼中,OnLCP1在脾脏巨噬细胞中的高表达可能通过类似机制提升其吞噬效率,从而加速病原体清除。后续研究可通过体外细胞迁移试验,进一步验证这一假设。
3.4 OnLCP1通过NF-κB通路介导抗菌免疫
通过双荧光素酶报告系统,本研究中发现,过表达OnLCP1可显著上调NF-κB报告基因的活性(P<0.05)。NF-κB通路是先天免疫应答的核心调控者,其激活可促进炎症因子(如TNF-α、IL-1β)的释放,并增强巨噬细胞的吞噬功能[41]。在哺乳动物中,LCP1可通过调控免疫细胞的骨架动态间接影响NF-κB的核转位[41-42]。本研究结果提示,OnLCP1可能通过类似机制增强罗非鱼对无乳链球菌的清除能力,这一结论与前期研究一致。在斑马鱼中,LCP1缺失会导致巨噬细胞迁移紊乱,但其对干扰素通路的调控尚未明确[10]。然而,目前试验仅检测了报告基因的活性变化,未来需结合下游靶基因的转录分析和蛋白磷酸化水平检测,全面验证NF-κB通路的激活机制。
4 结论
1)本研究中成功克隆了尼罗罗非鱼的LCP1基因,证实其通过增强NF-κB通路的活性参与抗菌免疫应答。
2)OnLCP1在脾脏和头肾中的高表达及其在免疫刺激后的动态上调,提示其作为免疫调控节点的潜在价值。
3)本研究为理解LCP1基因在鱼类先天免疫中的功能提供了有益参考。后续研究需深入解析OnLCP1对免疫细胞功能的具体调控机制,以推动其在病害防控中的应用。
[1] BAUMGARTNER E A,COMPTON Z J,EVANS S,et al.Identification of regulatory elements recapitulating early expression of L-plastin in the zebrafish enveloping layer and embryonic periderm[J].Gene Expression Patterns,2019,32:53-66.
[2] GOLDSTEIN D,DJEU J,LATTER G,et al.Abundant synthesis of the transformation-induced protein of neoplastic human fibroblasts,plastin,in normal lymphocytes[J].Cancer Research,1985,45(11 Pt 2):5643-5647.
[3] MORLEY S C.The actin-binding protein L-plastin supports T-cell motility and activation[J].Immunol Reviews,2013,256(1): 48-62.
[4] LIN C S,AEBERSOLD R H,KENT S B,et al.Molecular cloning and characterization of plastin,a human leukocyte protein expressed in transformed human fibroblasts[J].Molecular and Cellular Biology,1988,8(11):4659-4668.
[5] WANG Y,YIN Q Q,YANG D C,et al.LCP1 knockdown in monocyte-derived macrophages:mitigating ischemic brain injury and shaping immune cell signaling and metabolism[J].Theranostics,2024,14(1):159-175.
[6] PAN S K,WAN M T,JIN H W,et al.LCP1 correlates with immune infiltration:a prognostic marker for triple-negative breast cancer[J].BMC Immunology,2024,25(1):42.
[7] FANG L,SHEN R,LU Y,et al.Tetrandrine alleviates inflammation and promotes macrophage M2 polarization in gouty arthritis by NF-κB-mediated Lcp1[J].Cellular and Molecular Biology,2024,70(2):205-211.
[8] GE X H,LIU W,ZHAO W E,et al.Exosomal transfer of LCP1 promotes osteosarcoma cell tumorigenesis and metastasis by activating the JAK2/STAT3 signaling pathway[J].Molecular Therapy Nucleic Acids,2020,21:900-915.
[9] KELL M J,RICCIO R E,BAUMGARTNER E A,et al.Targeted deletion of the zebrafish actin-bundling protein L-plastin (lcp1)[J].PLoS One,2018,13(1):e0190353.
[10] LINEHAN J B,ZEPEDA J L,MITCHELL T A,et al.Follow that cell:Leukocyte migration in L-plastin mutant zebrafish[J].Cytoskeleton,2022,79(4/5):26-37.
[11] CONRAD W,REMISH E,SAHIN C K,et al.The role of lymphocyte cytosolic protein 1 in a Mycobacterium marinum infection[J].The FASEB Journal,2022.https://doi.org/10.1096/fasebj.2022.36.S1.R3029.
[12] SUN B J,VAN DISSEL D,MO I,et al.Identification of novel biomarkers of inflammation in Atlantic salmon (Salmo salar L.) by a plasma proteomic approach[J].Developmental &Comparative Immunology,2022,127:104268.
[13] BAYIR M,ARSLAN G.Nile Tilapias![]() (Oreochromis niloticus) lenfosit sitosolik protein 1 (lcp1) geninin
(Oreochromis niloticus) lenfosit sitosolik protein 1 (lcp1) geninin ![]() Ürünleri Dergisi,2021,38(1):63-68.
Ürünleri Dergisi,2021,38(1):63-68.
[14] 苏友禄,刘婵,邓益琴,等.罗非鱼无乳链球菌病的研究进展[J].大连海洋大学学报,2019,34(5):757-766.SU Y L,LIU C,DENG Y Q,et al.Research on Streptococcus agalactiae disease in Tilapia:a review[J].Journal of Dalian Ocean University,2019,34(5):757-766.(in Chinese)
[15] 崔静雯,汪开毓,贺扬,等.无乳链球菌感染尼罗罗非鱼的脑膜炎模型[J].水产学报,2015,39(12):1883-1893.CUI J W,WANG K Y,HE Y,et al.Oreochromis niloticus model of meningitis in Streptococcus agalactiae infection[J].Journal of Fisheries of China,2015,39(12):1883-1893.(in Chinese)
[16] 黎铭,马春霞,黎建斌,等.无乳链球菌对罗非鱼肠道菌群的影响[J].南方农业学报,2019,50(8):1647-1656.LI M,MA C X,LI J B,et al.Effects of Streptococcus agalactiae on intestinal flora of Tilapia[J].Journal of Southern Agriculture,2019,50(8):1647-1656.(in Chinese)
[17] 祝璟琳,邹芝英,李大宇,等.尼罗罗非鱼无乳链球菌病的病理学研究[J].水产学报,2014,38(11):1937-1944.ZHU J L,ZOU Z Y,LI D Y,et al.Pathological changes in Tilapia (Oreochromis niloticus) naturally infected by Streptococcus agalactiae[J].Journal of Fisheries of China,2014,38(11):1937-1944.(in Chinese)
[18] 邓永强,汪开毓.鱼类无乳链球菌病的研究进展[J].中国畜牧兽医,2016,43(9):2490-2495.DENG Y Q,WANG K Y.Research progress on fish Streptococcus agalactiae disease[J].China Animal Husbandry &Veterinary Medicine,2016,43(9):2490-2495.(in Chinese)
[19] 石杰,黎洁,张永安.鱼类无乳链球菌病流行病学及防控技术研究进展[J].水生生物学报,2025,49(1):156-167.SHI J,LI J,ZHANG Y A.Research progress on the epidemiology and prevention and control technology of Streptococcus agalactiae disease in fish[J].Acta Hydrobiologica Sinica,2025,49(1):156-167.(in Chinese)
[20] 胡惠玲,汪志文,黎源,等.尼罗罗非鱼清道夫受体基因Scara3的克隆及病原微生物刺激后的表达响应[J].大连海洋大学学报,2022,37(1):71-79.HU H L,WANG Z W,LI Y,et al.Cloning and expression response of Scara3 gene to pathogenic microorganism stimulation in Nile Tilapia Oreochromis niloticus[J].Journal of Dalian Ocean University,2022,37(1):71-79.(in Chinese)
[21] 刘洁,高风英,卢迈新,等.尼罗罗非鱼TIRAP基因克隆、组织表达及其在无乳链球菌、脂多糖和聚肌胞苷酸刺激下的免疫应答[J].大连海洋大学学报,2020,35(6):857-865.LIU J,GAO F Y,LU M X,et al.Cloning and expression of TIRAP gene and immune response in Nile Tilapia Oreochromis niloticus to Streptococcus agalactiae,lipopolysaccharides and polyinosinic polycytidylic acid stress[J].Journal of Dalian Ocean University,2020,35(6):857-865.(in Chinese)
[22] 罗国玲,王孝谦,简纪常,等.尼罗罗非鱼CD209基因的克隆、表达及功能鉴定[J].大连海洋大学学报,2021,36(3):374-382.LUO G L,WANG X Q,JIAN J C,et al.Cloning,expression and functional identification of CD209 gene in Nile Tilapia Oreochromis niloticus[J].Journal of Dalian Ocean University,2021,36(3):374-382.(in Chinese)
[23] XIE C X,WANG Z W,LI Y,et al.Conservation of structural and interactional features of CD226 and Necl5 molecules from Nile Tilapia (Oreochromis niloticus)[J].Fish &Shellfish Immunology,2021,116:74-83.
[24] XIA H L,LI Y,WANG Z W,et al.Expression and functional analysis of tumor necrosis factor receptor (TNFR)-associated factor 5 from Nile Tilapia,Oreochromis niloticus[J].Fish &Shellfish Immunology,2019,93:781-788.
[25] LIN S L,CHIEN C W,HAN C L,et al.Temporal proteomics profiling of lipid rafts in CCR6-activated T cells reveals the integration of actin cytoskeleton dynamics[J].Journal of Proteome Research,2010,9(1):283-297.
[26] PINTO C S,MISHIMA M,SAMPATH K.Tools of the trade:studying actin in zebrafish[J].Histochemistry and Cell Biology,2020,154(5):481-493.
[27] BJØRGEN H,KOPPANG E O.Anatomy of teleost fish immune structures and organs[J].Immunogenetics,2021,73(1):53-63.
[28] F M F.A cold-blooded view of adaptive immunity[J].Nature reviews Immunology,2018,18(7):438-453.
[29] HUMPHREY J D.Systemic pathology of fish:a text and atlas of normal tissues in teleosts and their response in disease[J].Journal of Fish Diseases,2007,30(6):381-382.
[30] MERINO-CONTRERAS M L,GUZMAN-MURILLO M A,RUIZ-BUSTOS E,et al.Mucosal immune response of spotted sand bass Paralabrax maculatofasciatus (Steindachner,1868) orally immunised with an extracellular lectin of Aeromonas veronii[J].Fish &Shellfish Immunology,2001,11(2):115-126.
[31] 王卫卫,吴谡琦,孙修勤,等.硬骨鱼免疫系统的组成与免疫应答机制研究进展[J].海洋科学进展,2010,28(2):257-265.WANG W W,WU S Q,SUN X Q,et al.Progress in research for components of the immune system and mechanism of the immune response in teleost[J].Advances in Marine Science,2010,28(2):257-265.(in Chinese)
[32] GAN Z,WANG B,LU Y S,et al.Molecular characterization and expression of CD2BP2 in Nile Tilapia (Oreochromis niloticus) in response to Streptococcus agalactiae stimulus[J].Gene,2014,548(1):126-133.
[33] 李康.转录因子c-Myc调控罗非鱼T细胞免疫的分子机制[D].上海:华东师范大学,2023.LI K.Molecular mechanism of transcription factor c-Myc regulating T cell immunity in Tilapia[D].Shanghai:East China Normal University,2023.(in Chinese)
[34] TODD E M,DEADY L E,MORLEY S C.Intrinsic T- and B-cell defects impair T-cell-dependent antibody responses in mice lacking the actin-bundling protein L-plastin[J].European Journal of Immunology,2013,43(7):1735-1744.
[35] CARROLL S L,PASARE C,BARTON G M.Control of adaptive immunity by pattern recognition receptors[J].Immunity,2024,57(4):632-648.
[36] 陆枝,黎源,汪志文,等.尼罗罗非鱼ICAM-1基因克隆及其mRNA表达分析[J].基因组学与应用生物学,2021,40(sup 2):2557-2564.LU Z,LI Y,WANG Z W,et al.Cloning of ICAM-1 gene from Nile Tilapia and analysis of its mRNA expression[J].Genomics and Applied Biology,2021,40(sup 2):2557-2564.(in Chinese)
[37] 吴凡,谢彩霞,汪志文,等.尼罗罗非鱼Crtam基因的克隆鉴定与mRNA表达分析[J].基因组学与应用生物学,2021,40(sup 1):1943-1951.WU F,XIE C X,WANG Z W,et al.Cloning,identification and mRNA expression analysis of Crtam gene from Nile Tilapia[J].Genomics and Applied Biology,2021,40(sup 1):1943-1951.(in Chinese)
[38] 杨观健,汪志文,黎源,等.尼罗罗非鱼marco基因克隆、亚细胞定位及表达分析[J].广东海洋大学学报,2022,42(5):27-37.YANG G J,WANG Z W,LI Y,et al.Molecular cloning,subcellular localization and expression analysis of marco gene in Nile Tilapia(Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2022,42(5):27-37.(in Chinese)
[39] 谢朝晖,陈兰英.细胞骨架研究进展[J].癌变·畸变·突变,2011,23(4):315-318.XIE Z H,CHEN L Y.Research progress of cytoskeleton[J].Carcinogenesis,Teratogenesis &Mutagenesis,2011,23(4):315-318.(in Chinese)
[40] LI J W,SU L L,JIANG J,et al.RanBP2/Nup358 mediates sumoylation of STAT1 and antagonizes interferon-α-mediated antiviral innate immunity[J].International Journal of Molecular Sciences,2023,25(1):299.
[41] KUMARI S,BISWAS A,MAITI T K,et al.Induction of PD-1 and CD44 in CD4+T cells by circulatory extracellular vesicles from severe dengue patients drives endothelial damage via the NF-kB signaling pathway[J].Journal of Virology,2025,99(2):e01861-24.
[42] ZHANG S,ZHAO J,et al.Gama-aminobutyric acid (GABA) alleviates hepatic inflammation via GABA receptors/TLR4/NF-κB pathways in growing-finishing pigs generated by super-multiparous sows[J].Animal Nutrition,2022,9(2):280-290.