鱼类性别判断是进行繁育、选育及单性化养殖的重要基础,而性别判断和鉴定的前提是了解雌雄性别差异[1-2],不同性别同一物种间在形态特征、生物学习性、生长速率和营养需求等方面存在的明显差异被称为“性别二态性”[3]。根据鱼类性别二态性进行性别鉴定是重要的研究思路,目前,性别鉴定最准确的方法是对第一性征开展对比[4],利用性腺组织显微镜观察和切片分析的方法可精确地判定鱼类性别,但需对鱼类进行解剖,造成样本浪费,且操作繁琐、时间消耗长[5-6];除传统方法外,分子生物学技术如分子标记辅助[7]、DNA条形码法[8],以及超声呈像[9]等均广泛应用于性别鉴定中,其优势在于高准确性和可重复性,但采样成本高、对试验设备和操作环境要求高,限制了其在科研和实际生产中的广泛应用[10]。
形态学作为一种传统而直观的性别鉴定方法,不仅能够解决上述技术手段的缺陷,还能在不损伤鱼体和较短时间内,提供快速且高效的性别鉴定方案[11]。在许多鱼类中,雄性和雌性在体型、体色、鳍条、鳞片和骨骼结构等方面均有明显差异,这些形态学特征不仅有助于区分性别,还能够为物种的性别鉴定提供重要依据[3]。传统形态学研究主要依赖于肉眼观察和标本测量,获取一些常规的形态学数据,如体长、体宽、体高、鳍条长度等,这些传统方法具有较为直观的优点,但同时也存在测量精度差、标准化困难和形态特征难以量化等问题[12-13],而几何形态学作为一种新的形态学分析方法,在生物学研究中得到了广泛应用。几何形态学通过精确的几何模型对生物体的形态进行量化分析,不仅能够更加准确地描述个体的形态差异,还能消除不同个体之间因尺寸差异带来的误差[14-15]。因此,传统形态学和几何形态学相结合的方法,成为鱼类性别鉴定更加精准和系统的分析方法。
绿鳍马面鲀(Thamnaconus septentrionalis)隶属鲀形目单角鲀科马面鲀属,曾是中国仅次于带鱼,产量排在第二的海洋经济鱼类,俗称“剥皮鱼”“橡皮鱼”“耗儿鱼”,并以其无肌间刺的特点深受广大消费者青睐[16-17]。该鱼营养价值和经济价值高,肉质鲜嫩,且蛋白含量高,脂肪含量低[18],其鱼皮轻薄柔软、透气防水可制鱼皮革[19]。近年来,为弥补因过度捕捞导致其野生资源量大幅下降的问题,众多学者针对绿鳍马面鲀的人工繁育[20]、养殖模式[21]、营养生理[18]、生物学信息[22]等方面开展了相关研究。但绿鳍马面鲀基于形态特征的性别二态性并不明显,且目前针对其雌雄形态学差异的系统性研究也尚显不足[23]。因此,为深入理解绿鳍马面鲀的生物学特性,探究其雌雄个体在形态上的差异,本研究中拟采用传统形态(TM)学和几何形态学(GM)研究方法分别对绿鳍马面鲀的雌雄个体形态差异开展研究,筛选出雌雄差异较大的形态学特征,以期为绿鳍马面鲀人工繁育和选育过程中性别判断提供理论依据,两种形态学研究思路也可为其他鱼类的性别鉴定提供科学参考。
1 材料方法
1.1 材料
2023年11月在山东省烟台市东口码头附近采集鳍条齐全、体质肥壮、活力较好的野生个体,使用活鱼运输箱分批次运输至上海市水产研究所启东科研基地,在室内养殖循环水车间中进行为期4个月暂养育肥。试验开始前将所有群体进行抽样,确保试验所选择绿鳍马面鲀的体长均大于220 mm,以减少规格对形态特征的影响。随后将选择的样本使用麻醉剂MS-222分批麻醉,首先进行统一的传统形态学测量和几何图像获取,之后将样本活体解剖,观察性腺颜色、细胞和组织形态,准确判断每个样本的性别,并将结果与测量的形态数据和几何图像一一对应,采样的不同性别绿鳍马面鲀样本信息见表1。
表1 采样绿鳍马面鲀的样本信息
Tab.1 Information of Thamnaconus septentrionalis specimens used in this study
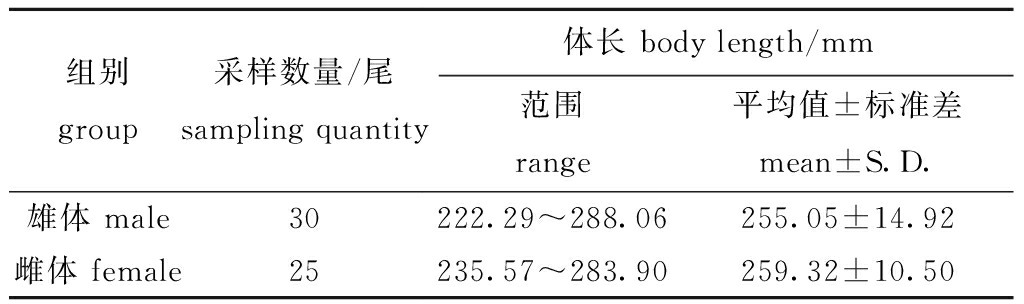
组别group采样数量/尾sampling quantity体长 body length/mm范围range平均值±标准差mean±S.D.雄体 male30222.29~288.06255.05±14.92雌体 female25235.57~283.90259.32±10.50
1.2 方法
1.2.1 形态特征参数的测量 鱼体麻醉后,使用干毛巾擦干样本体表水分,每个性别的样本轮流进行形态特征参数的测量,全部测量均由一人完成,全程使用游标卡尺进行准确测量。每个样本总计共测量18个形态学特征,测量示意图如图1所示。
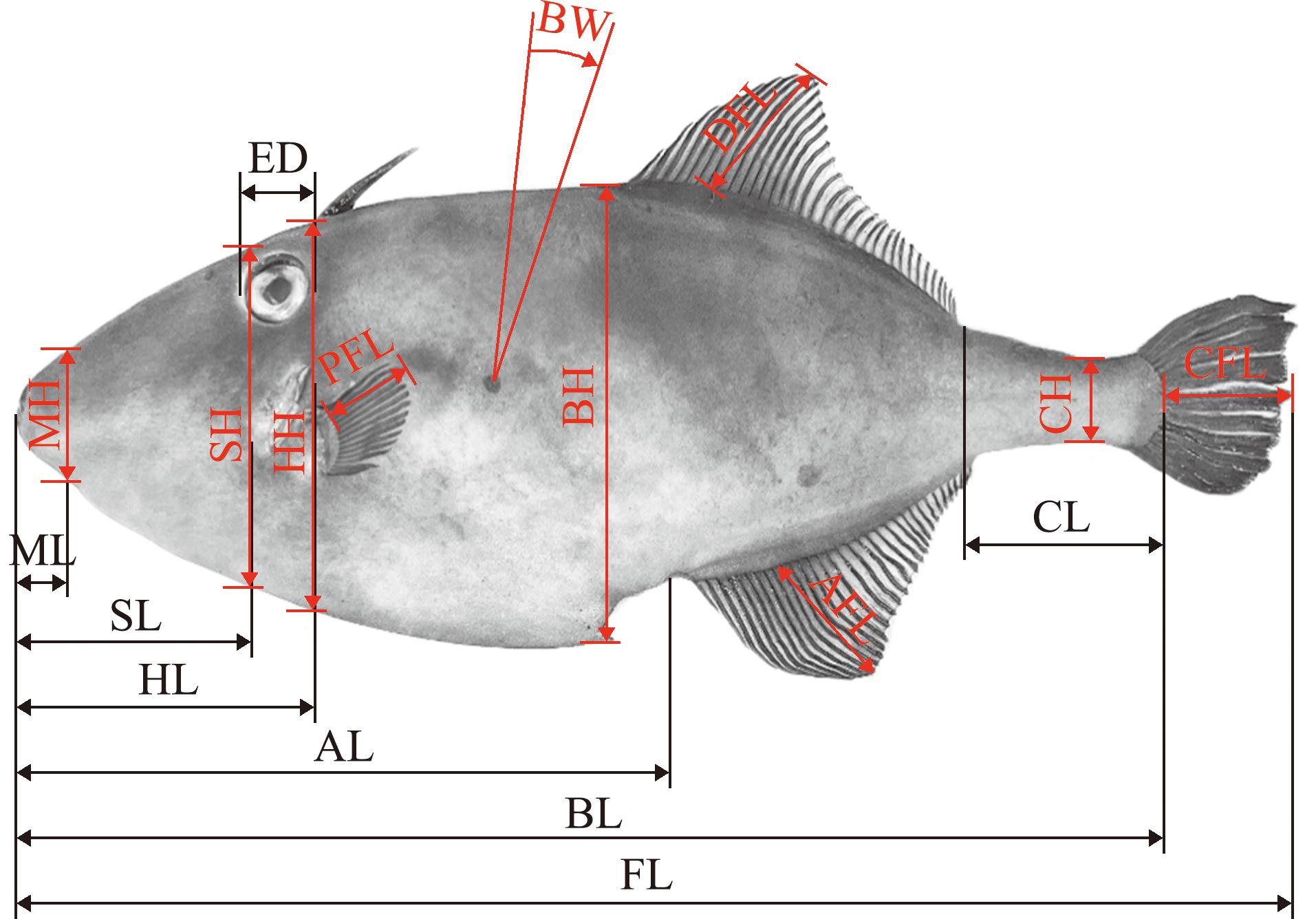
ED—眼径;ML—嘴长;SL—吻长;HL—头长;AL—肛长;BL—体长;FL—全长;CL—尾柄长;MH—嘴高;SH—吻高;HH—头高;BH—体高;CH—尾柄高;PFL—胸鳍长;DFL—背鳍长;CFL—尾鳍长;AFL—臀鳍长;BW—体宽。
ED-eye diameter;ML-mouth length;SL-snout length;HL-head length;AL-anal length;BL-body length;FL-full length;CL-caudal peduncle length;MH-mouth height;SH-snout height;HH-head height;BH-body height;CH-caudal peduncle height;PFL-pectoral fin length;DFL-dorsal fin length;CFL-caudal fin length;AFL-anal fin length;BW-body weight.
图1 绿鳍马面鲀形态特征参数测量示意图
Fig.1 Morphometric parameters of Thamnaconus septentrionalis
1.2.2 图像拍摄和地标点建立 鱼体形态特征测量完毕后,放置在已固定单反相机(Canon 5D Mark Ⅱ)的载物台上进行二维影像的拍摄,拍摄前整理鱼体和鱼鳍形态,使其自然伸展,鱼体放置于成像区域的正中位置,与单反相机的距离保持在30 cm左右,所有样本拍摄时的摆放位置及相机聚焦部位均一致。根据地标点选取特征明显性、代表性、稳定性和可重复性的原则,共选取25个地标点,各具体地标点的位置如图2所示,使用tpsUtil软件将所有拍摄的图像进行数据处理并建立tps文件,使用tpsDig软件在已处理图像上依次按顺序建立地标点,获取所有样本地标点的x,y坐标值并建立数据文件后进行数据处理。

地标点的选取无先后次序,图中数字仅为地标点编号。
Information collection of landmark points are unordered,figures in the picture are landmark numbers only.
图2 绿鳍马面鲀地标点位置图
Fig.2 Landmark points of Thamnaconus septentrionalis
1.3 数据处理
1.3.1 传统形态学数据分析 首先进行形态特征值的数据标准化处理,即将每个个体所测量的17个形态特征值除以自身体长(BL),并计算8个主要形态特征的特殊比值,如吻高和吻长、头高和头长的比值,所有数据均用平均值±标准差(mean±S.D.)表示,采用SPSS 24.0软件对不同性别绿鳍马面鲀形态特征数据进行处理,进行方差分析前采用Levene法进行方差齐性检验,当不满足齐性方差时对百分比数据采用反正弦或平方根处理,采用Independent T-test法进行多重比较,显著性差异设为0.05。
将不同性别绿鳍马面鲀校正后的17个形态特征值和8个特殊比值的数据输入SPSS 24.0软件中进行主成分分析,获得各主成分的贡献率和累积贡献率,并按照累积贡献率大于80%为原则,确定主成分的提取个数,采用Prism 9软件绘制主成分贡献率和累积贡献率的柱形图。同时采用最大方差旋转法得到因子载荷矩阵,获得不同形态特征在第1和第2主成分上的载荷值,并采用Prism 9软件绘制柱形图。为比较不同性别绿鳍马面鲀的形态特征差异程度,将雌雄贡献率最大的第1主成分和第2主成分使用Origin Pro软件绘制简单散点图。
由于所测量的形态特征较多,为筛选雌雄绿鳍马面鲀主要形态特征差异,采用SPSS 24.0软件分别对不同性别绿鳍马面鲀校正后的17个形态特征值和8个特殊比值的数据进行逐步判别分析。首先筛选出对差异判别贡献较大的形态特征参数,依次获得判别方程的系数,建立判别公式,随后将所已测定数据代入判别公式中以统计不同性别判别准确率。
1.3.2 几何形态学数据分析 采用tpsRelw软件获得绿鳍马面鲀的平均型和重叠型,同时采用CoordGen 8软件经普氏叠加得出地标点的分布情况,对每个样本的地标点进行平移置中、旋转和缩放等处理,去除非形状差异并得到标准化数据。为清晰了解雌雄形态差异,利用Paleontological Statistics 4软件进行薄板样条分析,绘出雌、雄体和平均型之间相互变换的网格变形图,方便对其进行可视化分析。
同样采用Paleontological Statistics 4软件对标准化地标点数据进行主成分分析,并保存软件生成的相对扭曲得分(relative warp scores,RW),采用Prism 9软件绘制主成分贡献率和累积贡献率的柱形图。将雌雄贡献率最大的第1相对扭曲(RW1)和第2相对扭曲(RW2)使用Origin Pro软件绘制简单散点图。采用SPSS 24.0软件对保存的各样本所有相对扭曲得分进行逐步判别分析,判别方法采用Bayes法,以获得绿鳍马面鲀不同性别的判别方程系数和判别分类结果。
2 结果与分析
2.1 传统形态学分析
2.1.1 单因素方差分析 绿鳍马面鲀雌雄17个标准化形态特征值和8个特殊比值的差异见表2,在测量的17个标准化形态特征值中共有7个具有显著性差异(P<0.05),主要集中在头部和鳍条,其中雄体的吻长、头长、嘴高、尾鳍长、背鳍长和臀鳍长均显著高于雌体(P<0.05),而头高显著低于雌体(P<0.05);8个特殊比值中共有4个具有显著性差异(P<0.05),分别是嘴高/嘴长、吻高/吻长、头高/头长、嘴高/体高,其中雌体吻高/吻长、头高/头长显著高于雄体(P<0.05),而嘴高/嘴长、嘴高/体高显著低于雄体(P<0.05)。
表2 不同性别绿鳍马面鲀形态特征差异
Tab.2 Morphological indices of Thamnaconus septentrionalis with different gender
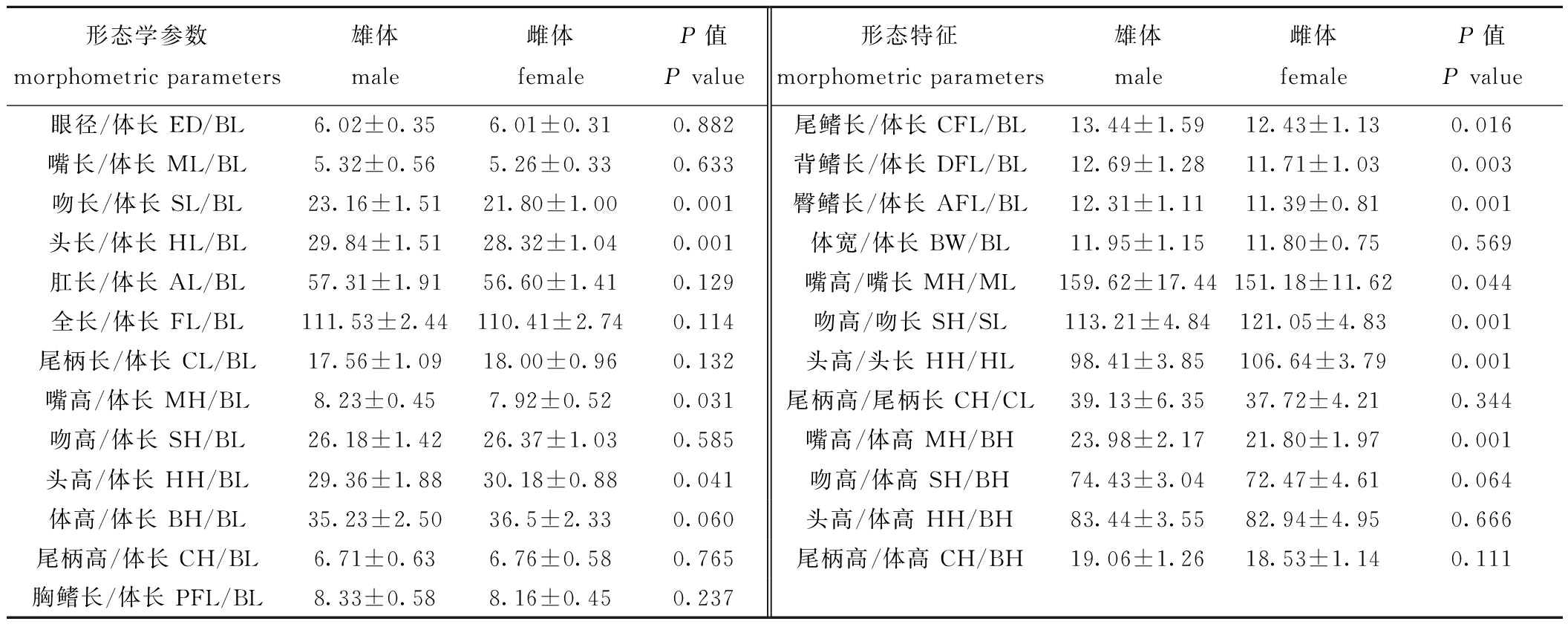
形态学参数morphometric parameters雄体male雌体femaleP值P value形态特征morphometric parameters雄体male雌体femaleP值P value眼径/体长 ED/BL6.02±0.356.01±0.310.882尾鳍长/体长 CFL/BL13.44±1.5912.43±1.130.016嘴长/体长 ML/BL5.32±0.565.26±0.330.633背鳍长/体长 DFL/BL12.69±1.2811.71±1.030.003吻长/体长 SL/BL23.16±1.5121.80±1.000.001臀鳍长/体长 AFL/BL12.31±1.1111.39±0.810.001头长/体长 HL/BL29.84±1.5128.32±1.040.001体宽/体长 BW/BL11.95±1.1511.80±0.750.569肛长/体长 AL/BL57.31±1.9156.60±1.410.129嘴高/嘴长 MH/ML159.62±17.44151.18±11.620.044全长/体长 FL/BL111.53±2.44110.41±2.740.114吻高/吻长 SH/SL113.21±4.84121.05±4.830.001尾柄长/体长 CL/BL17.56±1.0918.00±0.960.132头高/头长 HH/HL98.41±3.85106.64±3.790.001嘴高/体长 MH/BL8.23±0.457.92±0.520.031尾柄高/尾柄长 CH/CL39.13±6.3537.72±4.210.344吻高/体长 SH/BL26.18±1.4226.37±1.030.585嘴高/体高 MH/BH23.98±2.1721.80±1.970.001头高/体长 HH/BL29.36±1.8830.18±0.880.041吻高/体高 SH/BH74.43±3.0472.47±4.610.064体高/体长 BH/BL35.23±2.5036.5±2.330.060头高/体高 HH/BH83.44±3.5582.94±4.950.666尾柄高/体长 CH/BL6.71±0.636.76±0.580.765尾柄高/体高 CH/BH19.06±1.2618.53±1.140.111胸鳍长/体长 PFL/BL8.33±0.588.16±0.450.237
2.1.2 主成分分析 绿鳍马面鲀形态特征的贡献率和累计贡献率如图3(a)所示,按照累计贡献率大于80%的原则共提出6个主成分,在第4主成分时累计贡献率均达60%,其中第1主成分和第2主成分的累计贡献率分别为20.83%和39.03%;形态特征的第1和第2主成分散点图如图3(b)所示,雄体和雌体并未分别形成独立集中区域,均存在部分散点形成交叉,但通过主成分分析大体可以将雌体与雄体进行区分。
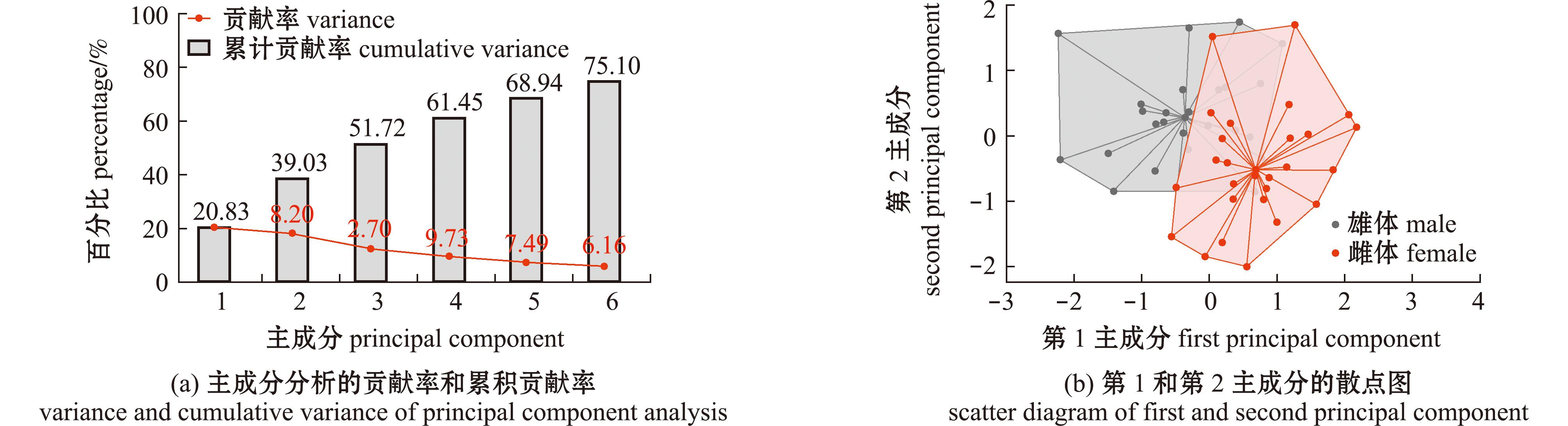
图3 不同性别绿鳍马面鲀形态特征的主成分贡献率和第1、第2主成分散点图
Fig.3 Variance and scatter diagram of first and second principal component for the morphological parameters of Thamnaconus septentrionalis with different gender
不同主成分与原有变量指标间的关联程度可以由因子载荷值体现,图4为经正交旋转变化第1和第2主成分的因子载荷矩阵,第1主成分在吻长/体长、头长/体长和胸鳍长/体长上的载荷值较大,即第1主成分与以上形态性状相关程度较高,而第2主成分与头高/体长、吻高/体长、头高/头长和吻高/吻长的相关程度较高,这些指标可以在一定程度上代表绿鳍马面鲀雌雄之间的形态差异情况。
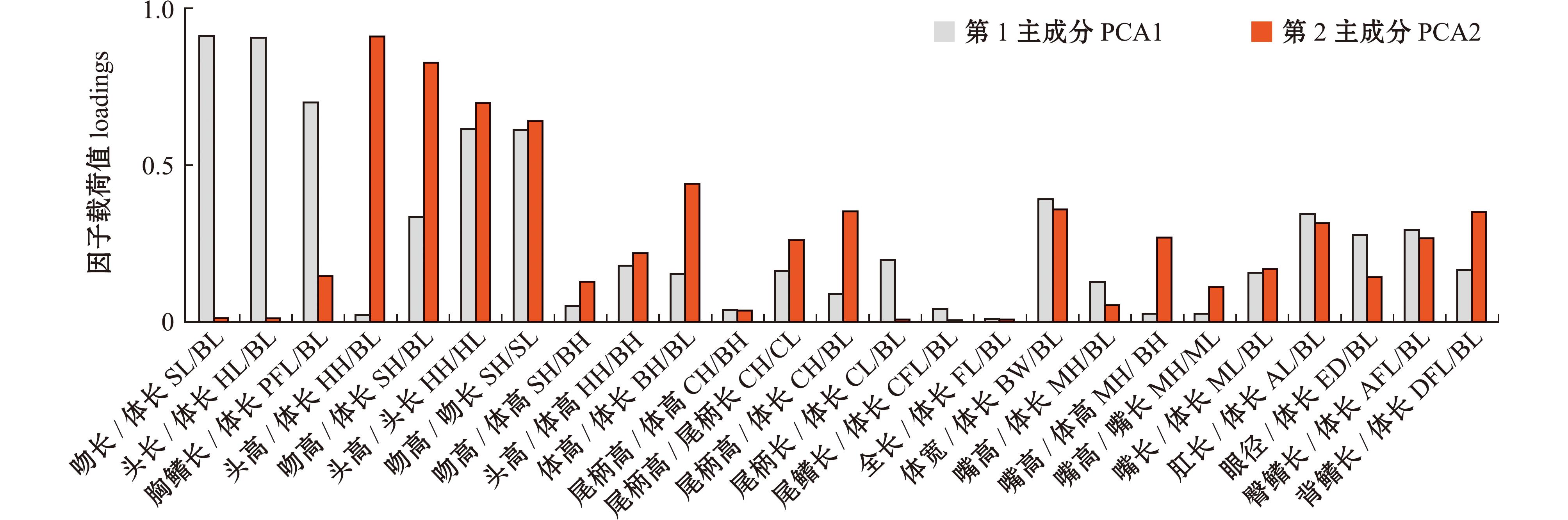
图4 不同性别绿鳍马面鲀形态特征第1和第2主成分的因子载荷值
Fig.4 Loadings of first and second principal component for the morphological parameters of Thamnaconus septentrionalis with different gender
2.1.3 传统判别分析 逐步判别分析的判别方程系数和分类结果见表3,从17个标准化形态特征值中共筛选出对雌雄绿鳍马面鲀区分判别贡献率较大的变量,分别为尾柄长/体长、体宽/体长、头高/头长、嘴高/体高,可根据上述4个形态特征比值的判别方程系数建立雌雄判别方程,其中,雄鱼判别方程为F1=22.60(CL/BL)+11.98(BW/BL)+7.67(HH/HL)+3.39(MH/BH)-686.02;雌鱼的判别方程为F2=24.48(CL/BL)+10.48(BW/BL)+8.45(HH/HL)+2.43(MH/BH)-759.48。
表3 不同性别绿鳍马面鲀形态特征的判别方程系数和判别分类
Tab.3 Discriminant function coefficients and classification results for the morphological parameters of Thamnaconus septentrionalis with different gender
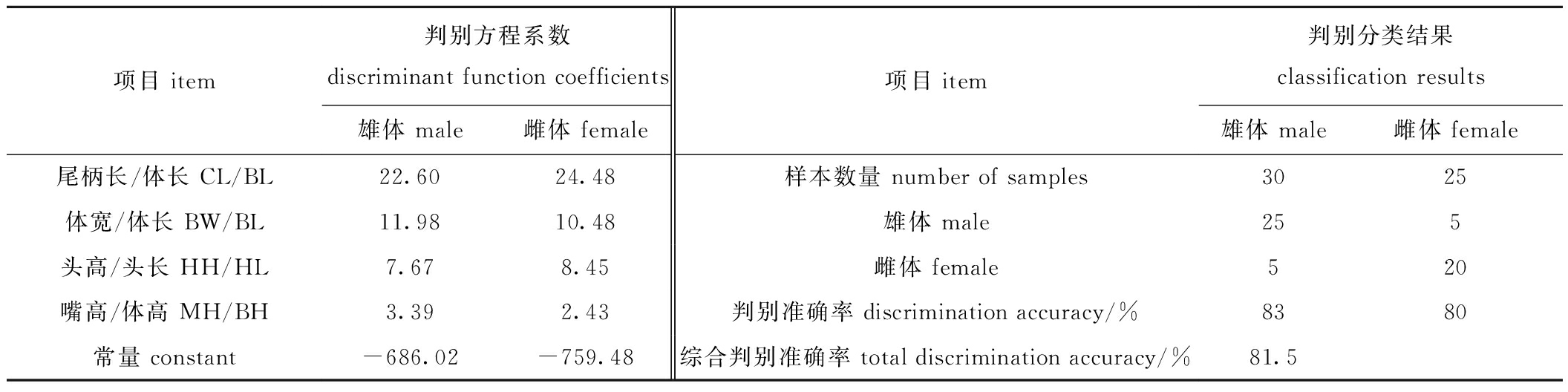
项目 item判别方程系数discriminant function coefficients雄体 male雌体 female项目 item判别分类结果classification results雄体 male雌体 female尾柄长/体长 CL/BL22.6024.48样本数量 number of samples 3025体宽/体长 BW/BL11.9810.48雄体 male255头高/头长 HH/HL7.678.45雌体 female520嘴高/体高 MH/BH3.392.43判别准确率 discrimination accuracy/%8380常量 constant-686.02-759.48综合判别准确率 total discrimination accuracy/%81.5
判别方程建立后,将形态特征值代入判别公式中来统计对不同性别的判别准确率,其中,雄体的判别准确率为83%,雌体的判别准确率略低为80%,雌雄综合判别准确率达到81.5%,也从侧面反映出该判别方程具有较高的可靠性和可行性。
2.2 地标点分析
2.2.1 变形图 采用tpsRelw软件将所有样本的地标点数据进行标准化处理,得到所有样本的平均型如图5(a)所示,图5(a)直观展现了雌雄绿鳍马面鲀的典型形态特征,为后续的分析提供基础参照。图5(b)展示了所有地标点矢量化重叠效果,发现不同地标点的重叠程度存在差异,某些位置的地标点重叠程度较高,在形态上具有较高的相似性,如地标点3、4、5、24等,而有些位置的地标点重叠程度相对较低,不同样本间形态存在差异如地标点7、8、18、19、20等。

图5 不同性别绿鳍马面鲀地标点的平均型和叠加型
Fig.5 Mean shape and vectorization shape of all landmarks of Thamnaconus septentrionalis with different gender
为了更好展现雌雄绿鳍马面鲀的差异可视化,利用Paleontological Statistics 4软件根据地标点数据绘制了雄体、雌体和平均型之间相互变换的网格变形图(图6),其中图6(a)代表雄体相对于平均型的变化,相较于平均型,地标点5、21和24也均表现出向内伸展,直观体现了雄体头高较短,而地标点7、8、13、14和18位置周围表现出向外伸展,即雄体背鳍、尾鳍和臀鳍均较长;其中图6(b)代表雌体相对于平均型的变化,雌体与平均型的变化趋势与雄体正好相反,即地标点5、21和24也均表现出向外伸展,而地标点7、8、13、14和18位置周围表现出向内伸展;图6(c)表示雄体相对于雌体的变化,整体趋势与图6(a)类似,但各地标点的差异程度相较于雄体与平均型的变化更为明显;图6(d)表示雌体相对于雄体的变化,同样的整体变化趋势与图6(b)相同,且差异更为明显。
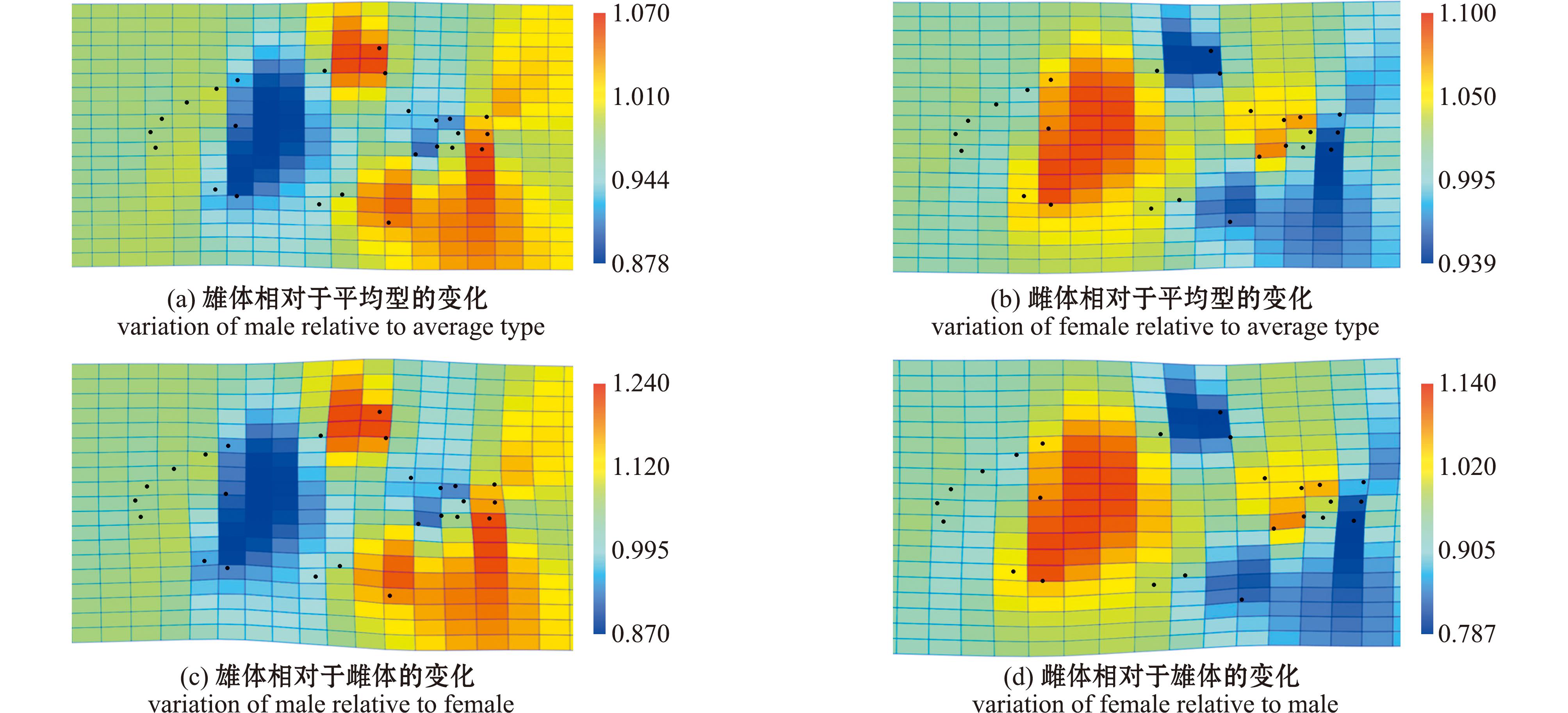
图6 不同性别绿鳍马面鲀地标点的网格变形图和变异可视化
Fig.6 Grid deformation and variation visualization of all landmarks of Thamnaconus septentrionalis with different gender
2.2.2 主成分分析 绿鳍马面鲀地标点的贡献率和累计贡献率如图7(a)所示,利用Paleontological Statistics 4软件对标准化地标点数据进行的主成分分析中,按照累计贡献率大于80%的原则共提出7个主成分,在第4主成分时累计贡献率均达60%以上,其中,第1主成分和第2主成分的累计贡献率分别为23.56%和40.00%,降维效果较好;地标点的第1和第2相对扭曲的散点图如图7(b)所示,雄体和雌体虽然未形成独立集中区域,但只存在少数散点会形成交叉,相较于传统形态学测量方法主成分分析结果而言,雌雄两组分离得更加清晰。
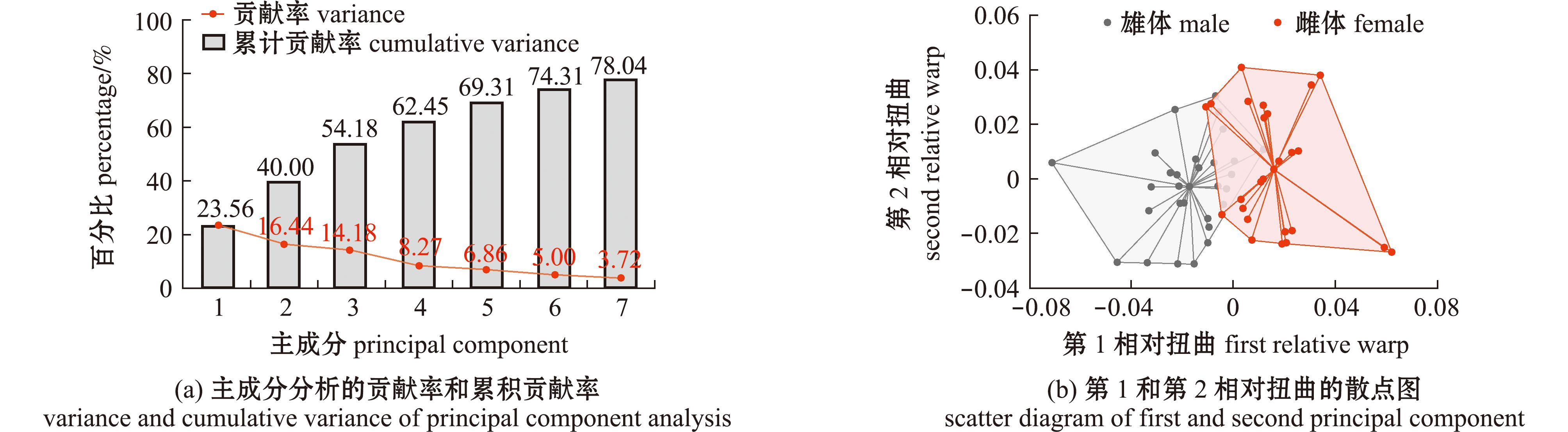
图7 不同性别绿鳍马面鲀地标点的主成分贡献率和第1、2相对扭曲散点图
Fig.7 Variance and scatter diagram of first and second relative warp for all ladmarks of Thamnaconus septentrionalis with different gender
2.2.3 判别分析 使用各样本地标点的相对扭曲得分进行逐步判别分析,得到的判别方程系数和分类结果见表4,共筛选出4个对雌雄绿鳍马面鲀区分判别贡献率较大的变量,并据此建立判别方程,其中雄鱼判别方程为F1=-20.26(RW1)-44.94(RW2)+109.72(RW3)+56.10(RW4)-1.38;雌鱼的判别方程为F1=24.31(RW1)+55.93(RW2)-131.66(RW3)-67.32(RW4)-1.69。判别分析结果表明,雄体的判别准确率为90%,雌体的准确率为92%,雌雄综合判别准确率达到91%,高于传统形态学测量方法的判别准确率,说明采用地标点法进行雌雄判别具有更高的准确性。
表4 不同性别绿鳍马面鲀地标点的判别方程系数和判别分类
Tab.4 Discriminant function coefficientsand classification results for the all landmarks of Thamnaconus septentrionalis with different gender
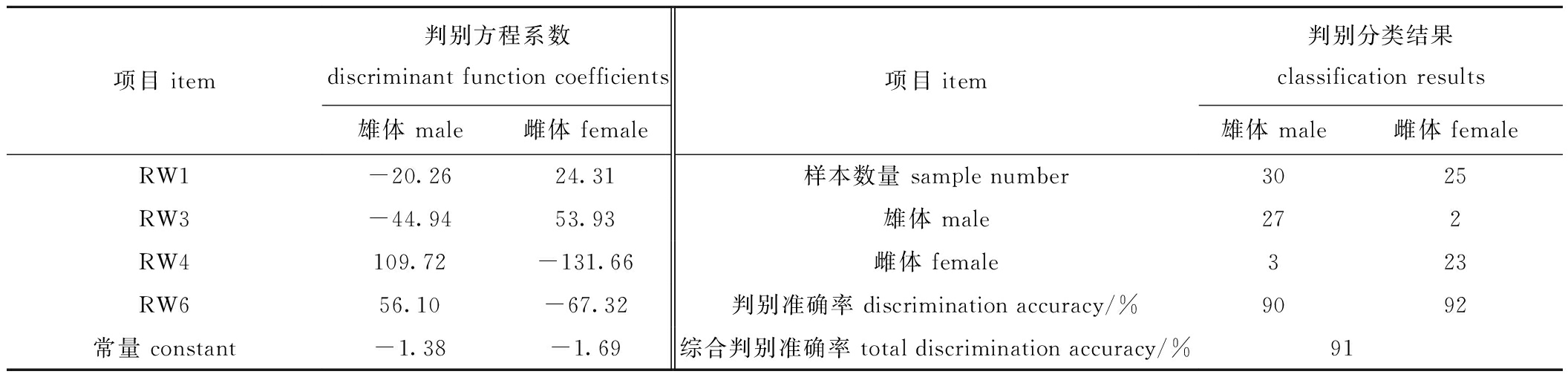
项目 item判别方程系数discriminant function coefficients雄体 male雌体 female项目 item判别分类结果classification results雄体 male雌体 femaleRW1-20.2624.31样本数量 sample number3025RW3-44.9453.93雄体 male272RW4109.72-131.66雌体 female323RW656.10-67.32判别准确率 discrimination accuracy/%9092常量 constant-1.38-1.69综合判别准确率 total discrimination accuracy/% 91
3 讨论
3.1 传统形态学分析雌雄个体形态差异
传统形态性状测量结合多元统计学分析由于操作简便、成本较低的显著优势已被广泛应用于水生生物的性别鉴定中[12-13]。周惠强等[24]测量了大刺鳅(Mastacembelus armatus)13个可量形态性状并运用差异显著性分析、主成分分析、聚类分析和判别分析对雌雄形态特征差异进行分析,并建立了性别判断方程,综合判别准确率为69.2%,为大刺鳅的人工繁殖、选育提供了合理科学的评价指标;Çoban等[25]同样采用传统形态学测量方法对欧洲舌齿鲈(Dicentrarchus labrax)形态特征的雌雄差异进行了对比,发现雌雄个体在前臀鳍长度、后臀鳍长度及后背鳍长度上存在形态差异,并据此确定了雌雄判别标准。在本研究中,通过单因素方差分析从17个标准化形态特征中筛选出7个具有显著差异的特征,主要集中在头部和鳍条,其中雌体头高/头长的比值显著高于雄体。主成分分析中,发现第1主成分与尾柄高、体高、头高和吻高的相关程度较高,这些指标可在一定程度上代表绿鳍马面鲀雌雄间的形态差异情况。逐步判别分析筛选出对雌雄绿鳍马面鲀区分判别贡献率较大的变量,分别为尾柄长/体长、体宽/体长、头高/头长、嘴高/体高,且雌雄判别方程的准确率分别为83%和80%,说明在实际生产上仅测量上述4个形态特征比值即可基本实现雌雄绿鳍马面鲀的性别鉴定,这为雌雄快速性别鉴定提供了基础数据支撑。
3.2 几何形态学分析雌雄个体形态差异
几何形态学主要通过采集个体的几何数据,结合数学模型进行分析,从而揭示物种个体间的形态差异,该方法不仅可以定量化地描述物种的形态特征,还能够为形态差异提供更加全面的视角[26-27],除广泛应用于同一物种不同群体[28]及不同物种[29]之间的形态鉴别外,其在性别鉴定中也具有广泛应用,如殷兴俊等[14]使用基于地标点的几何形态测量方法对雌雄秋刀鱼(Cololabis saira)的形态差异进行研究,结果表明,雌、雄个体的形态差异主要表现在眼部、躯干前部和尾部,这也表明几何形态测量学的地标点法用于秋刀鱼形态分析和性别鉴定是切实可行的;Balazadeh等[30]使用几何形态测量法对北美短吻鲟(Acipenser brevirostrum)头部同源地标点进行研究,确定了成熟短鼻鲟具有明显的性别二态性,并建立了准确率为83%的判别方程。本研究中从绿鳍马面鲀躯体上选择了25个地标点进行雌雄形态差异分析,可直观发现雌雄差异主要位于头部和背鳍、尾鳍和臀鳍上,雌雄综合判别准确率为91%,这也表明通过地标点法可以对雌雄进行更为有效的区分,且可视化的研究结果能够更清晰地观察和理解雌雄个体间的形态差异,为性别鉴定提供更直观的依据。
3.3 两种形态学方法鉴别效果比较
本研究中使用了两种方法对绿鳍马面鲀雌雄差异展开研究,两种方法均证实绿鳍马面鲀雌雄个体在头部和鳍条上存在显著性差异。对比两种方法的判别准确率可发现,几何形态学的综合判别准确率为91%,优于传统形体学方法综合判别准确率的81.5%,且几何形态学主成分分析的散点图中雌雄两组分离得更加清晰。究其原因,可能是传统形态学研究方法仅仅依靠有限的形态学指标,无法涵盖其形态的所有方面和捕捉细微差异,在全面反映形态特征方面存在不足[12-13]。而几何形态学通过数值化的方式避免了传统形态学中观察者主观因素的干扰,可视化效果好,其性别鉴定结果更加稳定和可重复[15,31]。虽然传统形态学方法判别准确率相对较低,但传统形态学方法操作简便、数据获取快速、结果直观、对试验条件要求低,适用于野外现场初步鉴定及对大量样本进行快速筛选[4,25]。因此在实际应用中,应根据研究目的、样本条件和技术能力等因素,合理选择或综合使用两种形态学分析方法,充分发挥两者的优势,提高绿鳍马面鲀及其他鱼类性别鉴定的准确性和效率。
3.4 雌雄个体形态差异原因
学者普遍认为,遗传基因、性别选择和生态适应性等因素的共同作用,导致了绿鳍马面鲀雌雄形态间显著的形态差异[13,32]。遗传因素是决定绿鳍马面鲀雌雄形态差异的基础,在长期进化过程中性别决定基因的差异表达直接导致了雌雄个体在发育过程中的性别二态性[33]。吴丹等[22]研究表明,amh、cyp17和star可能在绿鳍马面鲀雄性精子发生过程中起关键作用,bmp2、foxl2、cyp19a、figla和hsd17b1在雌性卵子发生和卵巢类固醇生成过程中发挥重要作用。这些与性腺发育相关的基因,不仅调控生殖器官的形成,还可能通过性激素信号通路间接影响身体其他部位的生长和形态塑造。雌雄形态差异也可能源于其对繁殖策略适应性进化,雌性个体需承担卵子发育与产卵的能量消耗,其体腔扩张与腹部柔韧性的增强有利于提高繁殖效率[34];而雄性更偏向于通过展示明显的外部特征,如更大的鳍条和鲜艳的颜色,来适应种内对稀缺生殖资源的竞争[35]。Im等[36]也发现,在恒河青鳉(Oryzias dancena)中雄体的背鳍和臀鳍生长速度和长度显著高于雌体,在本研究中雌雄绿鳍马面鲀在背鳍、尾鳍和臀鳍上的差异,或许也与雄鱼的求偶炫耀有关。同时食物资源、栖息环境及捕食压力,也可能对雌雄个体的形态差异产生影响[37]。在食物资源有限和环境压力较高的条件下,雌性个体可能会优先保证繁殖相关的生理活动,而雄性个体可能通过更灵活或敏捷的体型来提高觅食效率或逃避捕食者的捕捉,从而在生长和生存竞争方面做出更多投入,这进一步加剧了雌雄个体的形态差异[38]。
4 结论
1)本研究中采用“传统”和几何形态学分析方法对雌雄绿鳍马面鲀的形态特征差异进行了分析,传统形态学研究结果表明,雌体头高/头长的比值显著高于雄体,并筛选了判别贡献率较大的变量,分别为尾柄长/体长、体宽/体长、头高/头长、嘴高/体高,且据此建立了绿鳍马面鲀的判别方程,可快速进行雌雄性别鉴定。
2)几何形态学研究结果表明,雌雄差异主要位于头部、背鳍、尾鳍和臀鳍上,且几何形体学判别分析的综合判别准确率(91%)高于传统形态学的综合判别准确率(81.5%),表明几何形态学是一种更为准确的判别方法,但实际应用过程中可考虑结合传统方法使用,充分发挥两者的优势。
[1] 武兆文,郑翔,张佳佳,等.杂交黄颡鱼“黄优1号” 形态指标体系的建立及雌雄差异判别[J].海洋渔业,2019,41(5):578-588.WU Z W,ZHENG X,ZHANG J J,et al.Establishment of morphological index system of hybrid yellow catfish “Huangyou-1” (Pelteobagrus vachelli ♂×P.fulvidraco ♀) and discrimination of male and female differences[J].Marine Fisheries,2019,41(5):578-588.(in Chinese)
[2] LIANG T,SHI L,BEMPAH G,et al.Sexual size dimorphism and its allometry in Chinese lizards[J].Evolutionary Ecology,2021,35(2):323-335.
[3] 仲崇虎.半刺厚唇鱼雌雄形态差异和胚胎发育研究[D].南京:南京农业大学,2022.ZHONG C H.Study on the morphological differences and embryonic development of Acrossocheilus hemispinus[D].Nanjing:Nanjing Agricultural University,2022.(in Chinese)
[4] 毕宜慧,张鑫宇,李杰,等.暗纹东方鲀雌雄个体形态差异及其判别分析[J].海洋渔业,2021,43(5):563-572.BI Y H,ZHANG X Y,LI J,et al.Analysis of morphological index and discrimination of male and female Takifugu fasciatus[J].Marine Fisheries,2021,43(5):563-572.(in Chinese)
[5] 蒋小珍,韦嫔媛,陈晓汉,等.卵形鲳鲹性腺组织学观察及简易性别判定方法建立[J].西南农业学报,2015,28(1):428-432.JIANG X Z,WEI P Y,CHEN X H,et al.Histological observation of Trachinotus ovatus and methodical construction of simple method of early sex identification[J].Southwest China Journal of Agricultural Sciences,2015,28(1):428-432.(in Chinese)
[6] 韩伟国,刘新富,孟振,等.醋酸洋红染色技术在大菱鲆幼鱼生理性别鉴定中的应用[J].渔业科学进展,2011,32(6):37-42.HAN W G,LIU X F,MENG Z,et al.Application of the aceto-carmine technique for the identification of phenotypic sex in turbot Scophthalmus maximus L.young fish[J].Progress in Fishery Sciences,2011,32(6):37-42.(in Chinese)
[7] CHEN S L,DENG S P,MA H Y,et al.Molecular marker-assisted sex control in half-smooth tongue sole (Cynoglossus semilaevis)[J].Aquaculture,2008,283(1/2/3/4):7-12.
[8] LIU Z J,CORDES J F.DNA marker technologies and their applications in aquaculture genetics[J].Aquaculture,2004,238(1/2/3/4):1-37.
[9] BLYTHE B,HELFRICH L A,BEAL W E,et al.Determination of sex and maturational status of striped bass (Morone saxatilis) using ultrasonic imaging[J].Aquaculture,1994,125(1/2):175-184.
[10] GABI N M,MOR
N M,MOR N P,FERN
N P,FERN NDEZ A I,et al.Identification of genomic regions regulating sex determination in Atlantic salmon using high density SNP data[J].BMC Genomics,2019,20(1):764.
NDEZ A I,et al.Identification of genomic regions regulating sex determination in Atlantic salmon using high density SNP data[J].BMC Genomics,2019,20(1):764.
[11] 陈宇舒.尖头塘鳢(Eleotris oxycephala)雌雄个体形态差异分析[J].渔业研究,2023,45(4):346-355.CHEN Y S.Analysis on morphological indices and discrimination of male and female Eleotris oxycephala[J].Journal of Fisheries Research,2023,45(4):346-355.(in Chinese)
[12] 吴波,张敏智,邓思平,等.金钱鱼雌雄个体的形态差异分析[J].上海海洋大学学报,2014,23(1):64-69.WU B,ZHANG M Z,DENG S P,et al.Analysis of morphological index and discrimination of male and female Scatophagus argus[J].Journal of Shanghai Ocean University,2014,23(1):64-69.(in Chinese)
[13] 赵仲孟,黄志鹏,赵瀚,等.祁连山裸鲤(Gymnocypris chilianensis)雌雄群体的形态差异分析[J].中国农学通报,2023,39(5):142-147.ZHAO Z M,HUANG Z P,ZHAO H,et al.Morphological differences between male and female populations of Gymnocypris chilianensis[J].Chinese Agricultural Science Bulletin,2023,39(5):142-147.(in Chinese)
[14] 殷兴俊,花传祥,朱清澄.基于几何形态测量学的秋刀鱼雌雄个体形态差异分析和鉴定[J].南方水产科学,2024,20(6):104-111.YIN X J,HUA C X,ZHU Q C.Analysis of morphological differences and discrimination between female and male Cololabis saira based on geometric morphometrics[J].South China Fisheries Science,2024,20(6):104-111.(in Chinese)
[15] 刘莹,于超勇,赵文溪,等.基于几何形态测量学方法的大菱鲆不同群体形态变异分析[J].中国海洋大学学报(自然科学版),2025,55(1):66-75.LIU Y,YU C Y,ZHAO W X,et al.Geometric morphometric analysis of morphological variation in populations of Scophthalmus maximus[J].Periodical of Ocean University of China(Natural Science Edition),2025,55(1):66-75.(in Chinese)
[16] 陈会娟,冯灿,杨盼蕊,等.绿鳍马面鲀养殖研究现状及展望[J].江苏海洋大学学报(自然科学版),2023,32(2):25-29.CHEN H J,FENG C,YANG P R,et al.Current situation and prospect of the research on the culture of Thamnaconus modestus[J].Journal of Jiangsu Ocean University (Natural Science Edition),2023,32(2):25-29.(in Chinese)
[17] 陈莹,李凤辉,张广明,等.急性低盐胁迫对绿鳍马面鲀幼鱼存活、鳃组织结构及肝脏抗氧化能力的影响[J].大连海洋大学学报,2024,39(2):250-258.CHEN Y,LI F H,ZHANG G M,et al.Effects of acute low salt stress on survival,gill structure and hepatic antioxidant capacity of juvenile bluefin leatherjacket(Thamnaconus septentrionalis)[J].Journal of Dalian Ocean University,2024,39(2):250-258.(in Chinese)
[18] 徐大凤,刘琨,王鹏飞,等.绿鳍马面鲀肌肉营养成分分析和营养评价[J].海洋科学,2018,42(5):122-129.XU D F,LIU K,WANG P F,et al.Analysis of nutritional composition in the muscle of Thamnaconus septentrionalis[J].Marine Sciences,2018,42(5):122-129.(in Chinese)
[19] 胡琼,潘鲁莹,王晓然,等.绿鳍马面鲀鱼皮特性及制革应用分析[J].安徽农业科学,2023,51(22):193-196.HU Q,PAN L Y,WANG X R,et al.Characteristics of Thamnaconus septentrionalis skin and its applications in leather industry[J].Journal of Anhui Agricultural Sciences,2023,51(22):193-196.(in Chinese)
[20] 关健,陈志信,张家男,等.绿鳍马面鲀(Thamnaconus modestus)仔、稚鱼生长发育特征研究[J].海洋与湖沼,2011,42(4):561-566.GUAN J,CHEN Z X,ZHANG J N,et al.Post-embryonic development of filefish Thamnaconus modestus[J].Oceanologia et Limnologia Sinica,2011,42(4):561-566.(in Chinese)
[21] 刘琨,张乐乐,张庆文,等.绿鳍马面鲀工厂化养殖研究[J].渔业现代化,2017,44(3):35-40.LIU K,ZHANG L L,ZHANG Q W,et al.Study on Thamnaconus septentrionalis under industrial aquaculture condition[J].Fishery Modernization,2017,44(3):35-40.(in Chinese)
[22] 吴丹,陈四清,柯翎,等.绿鳍马面鲀雌雄性腺转录组比较分析[J].渔业科学进展,2024,45(4):53-64.WU D,CHEN S Q,KE L,et al.Comparative analysis of the male and female gonadal transcriptome of Thamnaconus septentrionali[J].Progress in Fishery Sciences,2024,45(4):53-64.(in Chinese)
[23] 李凤辉,刘琨,王鹏飞,等.绿鳍马面鲀外部形态特征与染色体核型分析[J].南方水产科学,2019,15(3):104-112.LI F H,LIU K,WANG P F,et al.Morphological structure and karyotype of Thamnaconus septentrionalis[J].South China Fisheries Science,2019,15(3):104-112.(in Chinese)
[24] 周惠强,李芬,舒琥,等.大刺鳅雌雄个体形态差异分析[J].广东海洋大学学报,2019,39(1):1-6.ZHOU H Q,LI F,SHU H,et al.Analysis on morphological indexes and discrimination of male and female Mastacembelus armatus[J].Journal of Guangdong Ocean University,2019,39(1):1-6.(in Chinese)
[25] COBAN D,YILDIRIM ![]() ,KAMACI H O,et al.External morphology of European seabass (Dicentrarchus labrax) related to sexual dimorphism[J].Turkish Journal of Zoology,2011,35(2):255-263.
,KAMACI H O,et al.External morphology of European seabass (Dicentrarchus labrax) related to sexual dimorphism[J].Turkish Journal of Zoology,2011,35(2):255-263.
[26] MARTINEZ-LEIVA L,LANDEIRA J M,FATIRA E,et al.Energetic implications of morphological changes between fish larval and juvenile stages using geometric morphometrics of body shape[J].Animals,2023,13(3):370.
[27] FARR M,TUSET V M,MAYNOU F,et al.Geometric morphology as an alternative for measuring the diversity of fish assemblages[J].Ecological Indicators,2013,29:159-166.
M,TUSET V M,MAYNOU F,et al.Geometric morphology as an alternative for measuring the diversity of fish assemblages[J].Ecological Indicators,2013,29:159-166.
[28] 张秀霞,朱巧莹,赵俊.利用几何形态测量学方法分析唐鱼群体的形态变异[J].水产学报,2017,41(9):1365-1373.ZHANG X X,ZHU Q Y,ZHAO J.Geometric morphometric analysis of body-form variability in populations of Tanichthys albonubes[J].Journal of Fisheries of China,2017,41(9):1365-1373.(in Chinese)
[29] CAVALCANTI M J,MONTEIRO L R,LOPES P R.Landmark-based morphometric analysis in selected species of serranid fishes (Perciformes: Teleostei)[J].Zoological Studies,1999,38(3):287-294.
[30] BALAZADEH K,LITVAK M K.Using geometric morphometrics for sex determination on adult shortnose sturgeon (Acipenser brevirostrum)[J].Aquaculture,2018,487:89-96.
[31] 朱国平,刘芳沁.几何形态测量学及其在鱼类生态学研究中的应用进展[J].上海海洋大学学报,2022,31(5):1180-1189.ZHU G P,LIU F Q.Geometric morphometrics and its application in fish ecology:a review[J].Journal of Shanghai Ocean University,2022,31(5):1180-1189.(in Chinese)
[32] LANDE R.Sexual dimorphism,sexual selection,and adaptation in polygenic characters[J].Evolution,1980,34(2):292-305.
[33] 李永婧,吴利敏,李学军.硬骨鱼类性别决定与分化相关基因研究进展[J].河南师范大学学报(自然科学版),2017,45(4):72-78.LI Y J,WU L M,LI X J.A review on the genes related with sex determination and differentiation in teleosts[J].Journal of Henan Normal University (Natural Science Edition),2017,45(4):72-78.(in Chinese)
[34] KIM Y J,ZHANG C I,PARK I S,et al.Sexual dimorphism in morphometric characteristics of Korean chub Zacco koreanus (Pisces,Cyprinidae)[J].Journal of Ecology and Environment,2008,31(2):107-113.
[35] KOKITA T,MIZOTA T.Male secondary sexual traits are hydrodynamic devices for enhancing swimming performance in a monogamous filefish Paramonacanthus japonicus[J].Journal of Ethology,2002,20(1):35-42.
[36] IM J H,GIL H W,LEE T H,et al.Morphometric characteristics and fin dimorphism between male and female on the marine medaka,Oryzias dancena[J].Development &Reproduction,2016,20(4):331-347.
[37] SCHARNWEBER K,WATANABE K,SYV RANTA J,et al.Effects of predation pressure and resource use on morphological divergence in omnivorous prey fish[J].BMC Evolutionary Biology,2013,13:132.
RANTA J,et al.Effects of predation pressure and resource use on morphological divergence in omnivorous prey fish[J].BMC Evolutionary Biology,2013,13:132.
[38] TAKAHASHI T,OTA K,KOHDA M,et al.Some evidence for different ecological pressures that constrain male and female body size[J].Hydrobiologia,2012,684(1):35-44.