海洋双壳贝类在世界沿海广泛分布,富含多种营养和功能物质[1- 2],是大众喜爱的海产品。蛤类广泛分布在中国南北海区[3],据统计,2023年中国蛤的养殖产量高达444.9 万t,是四大海产贝类之一[4]。菲律宾蛤蜊(Ruditapes philippinarum)俗称“花蛤”“杂色蛤”等,其生长迅速、养殖周期短、适应性强[5],富含丰富的蛋白质、必需氨基酸、维生素和必需矿物质元素,具有多种保健功能[6],是一种优质经济贝类。山东省和福建省作为蛤主产省份,2023年山东省蛤养殖产量为128.46 万t,福建省为52.6 万t[4],其中,福建省是菲律宾蛤蜊苗种主要产区[7]。青岛产红岛蛤蜊主要由福建苗种养成,属于地理标志产品,其营养丰富,皮薄、肉嫩、味道鲜美[8]。研究表明,产地环境差异会影响贝类营养物质[9- 10],但目前关于青岛和福建产菲律宾蛤蜊营养品质研究甚少。
前期关于菲律宾蛤蜊营养品质研究主要是基本营养成分和呈味物质分析,如Chen等[11]采用主成分分析(principal component analysis,PCA)和系统聚类分析对不同月份菲律宾蛤蜊的基本营养成分和呈味物质进行了评价,筛选出脂肪酸、多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)、呈味有机酸和核苷酸4个关键特征指标。组学技术是一种新兴领域,已广泛应用于食品产地溯源[12]、食品认证及特征鉴定[13]、水产品品质研究[14]及农产品营养品质检测[15]等,为饮食、药物和疾病的影响提供了新的技术支持。Liu等[16]通过脂质组学探究3个海域长牡蛎的脂质特征,表明地理差异对脂质含量、组成及脂质分子分布有显著影响,并进一步筛选出45种脂质分子作为不同海域长牡蛎脂质的鉴别标志物。有研究采用代谢组学方法分析了不同产地的海参体壁成分和4个不同品种的海参代谢产物差异,结果表明,4个海参品种间脂肪酸、磷脂和糖等营养物质存在差异,且脂质代谢、氨基酸代谢和蛋白质代谢差异与不同地理来源密切相关[17- 18]。Ye等[19]和Wu等[20]利用代谢组学技术分别比较了池塘养殖和自然水域中华绒螯蟹及野生和养殖大黄鱼的营养特征差异。目前,运用代谢组学在蛤蜊营养品质中的研究鲜有报道,因此,本研究中运用代谢组学方法解析不同产地菲律宾蛤蜊营养代谢物的差异,以期为阐明蛤蜊的品质特征提供数据基础。
1 材料与方法
1.1 材料
菲律宾蛤蜊于春季取自青岛海域(QD)和厦门海域(XM),依据GB/T 30891—2014《水产品抽样规范》,每份样品采集3 kg。
试验试剂:质谱纯纯水、甲酸、乙酸铵、甲酸铵(美国Fisher公司);质谱纯甲醇、乙腈(德国Merck公司);L-2-氯苯丙氨酸(纯度≥98%)(上海安谱实验科技股份有限公司);20种氨基酸标准品(纯度≥99%)(德国Dr.Ehrenstorfer公司);20种氨基酸内标混合标准品-13C,15N(767964-1EA)(德国Sigma-Aldrich公司)。
试验仪器:Hclass-UHPLC超高效液相(Waters公司);Triple TOF 5600+高分辨质谱(SCIEX公司);SIGMA1-14离心机(德国SIGMA公司);电子天平(德国赛多利斯公司);SCIENTZ-48L研磨仪(宁波新芝生物科技股份有限公司);KQ-300E超声仪(昆山市超声仪器有限公司);Milli-Q超纯水仪(美国Millipore公司);ACQUITY UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm)(美国Waters公司);ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)(美国Waters公司);QTRAP 5500 三重四极杆串联质谱仪(美国SCIEX公司);Imtakt Intrada Amino Acid 色谱柱(100 mm×3.0 mm,3.0 μm)(美国Imtakt公司)。
1.2 方法
1.2.1 代谢物提取
1)代谢组学前处理方法。每组取10份规格相同的蛤蜊去壳,每份取200 mg贝肉与1 000 μL提取液(甲醇∶乙腈∶水=2∶2∶1)混合,再加入20 μL内标L-2-氯苯丙氨酸,将混合物涡旋30 s。加入钢珠,45 Hz研磨仪处理4 min,冰水浴超声5 min,以上步骤重复2~3遍。在-20 ℃下静置1 h,然后在4 ℃下以13 000 r/min离心15 min,取上清液500 μL于EP管中,在真空浓缩器中进行干燥;向干燥后的代谢物加入100 μL提取液(乙腈∶水=1∶1)复溶,涡旋30 s,冰水浴超声10 min。将样品置于4 ℃下以13 000 r/min离心15 min;取60 μL上清于进样瓶,每个样品各取10 μL混合成QC样本上机检测。
2)氨基酸靶向质谱分析前处理方法。参照本课题组前期研究[21]进行处理测定。
1.2.2 色谱条件
1)代谢组学色谱条件。①Amide体系:ACQUITY UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm);进样量2 μL;流速0.5 mL/min;流动相:A为水相(含25 mmol/L醋酸铵及25 mmol/L氨水),B为乙腈;流动相洗脱程序为0~0.5 min(5%A),0.5~7 min(5%~35%A),7~8 min(35%~60%A),8~9 min(60%A),9.1~12 min(5%A)。②C18体系:ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);进样量3 μL(POS),4 μL(NEG);流速0.3 mL/min;正离子模式流动相:A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液;负离子模式流动相:A为5 mmol/L乙酸铵水溶液,B为乙腈;流动相洗脱程序为0~1.5 min(99%A),1.5~13 min(99%~1%A),13~16.5 min(1%A),16.5~16.6 min(1%~99%A),16.6~20 min(99%A)。
2)氨基酸靶向色谱条件。Imtakt Intrada Amino Acid 色谱柱(100 mm×3.0 mm,3.0 μm);进样量2 μL;流速0.5 mL/min;流动相:A为水相(含100 mmol/L甲酸铵),B为95%乙腈水(含0.3%甲酸);流动相洗脱程序为0~3 min(12%~17%A),3~7 min(17%~38%A),7.1~13 min(100%A),13.1~16 min(12%A)。
1.2.3 质谱分析
1)代谢组学。采用Triple TOF 5600+质谱仪进行代谢组学检测,分别在正、负离子模式下进行数据采集,电喷雾离子源的参数设置如下:雾化气压力60 psi;辅助气压力60 psi;气帘气压力35 psi;离子源温度650 ℃;正离子模式:喷雾电压5 000 V;负离子模式:喷雾电压-4 000 V。基于数据依赖性(intelligent data acquisition,IDA)功能进行一级、二级质谱数据采集。
2)氨基酸靶向分析质谱方法。采用SCIEX 5500 Qtrap 质谱,MRM非衍生内标法测定,质谱参数参照本课题组前期研究[21]。
1.3 数据处理
使用MetaboAnalyst 6.0(https://www.metaboanalyst.ca/MetaboAnalyst/)对预处理后的代谢组学数据进行主成分分析(PCA)和正交偏最小二乘鉴别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),再依据变量投影重要性(variable importance in projection,VIP)值。通过二级质谱数据库对峰进行物质鉴定,以VIP>1、P<0.05为阈值筛选出显著差异代谢物。采用KEGG数据库对差异代谢物进行注释,结合Pathway分析筛选差异代谢通路。氨基酸靶向分析数据采用SPSS 27.0软件进行T-test差异分析,采用Origin 2021软件作图。
2 结果与分析
2.1 Amide色谱体系结果分析
2.1.1 多元统计分析 正、负离子模式下分别提取离子峰1 566、1 429个,识别出的代谢物分别为228、140个。对预处理后的数据进行PCA,如图1所示,正、负离子模式下,所有QC样本均集中分布在坐标轴中间,说明样品间分离是由于组间的差异变量,而非分析过程中的差异造成。
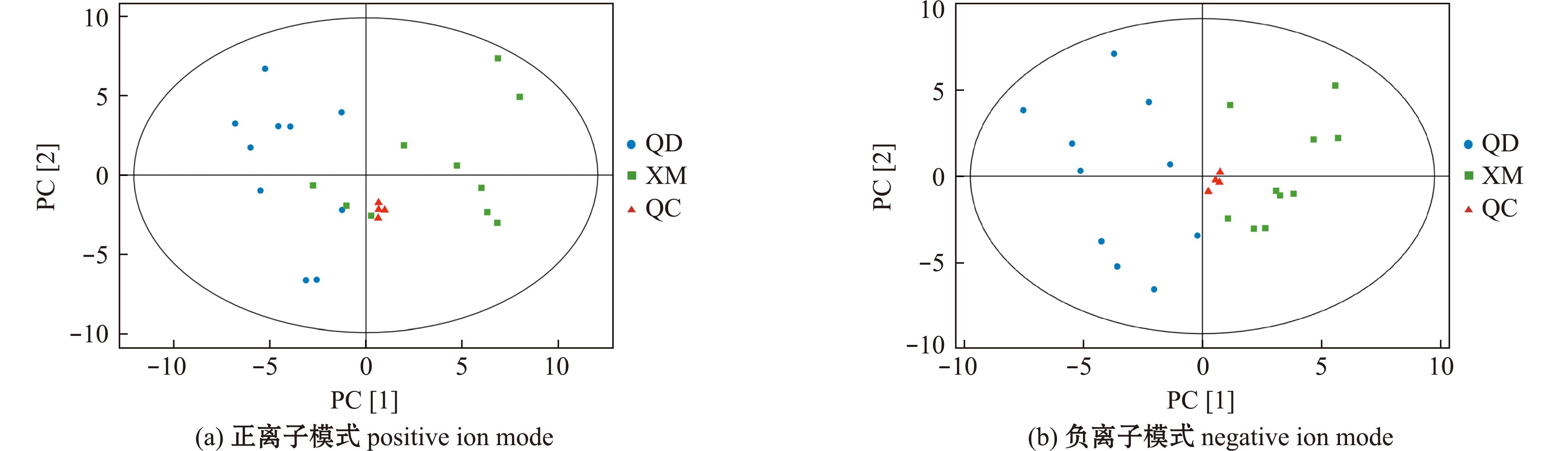
图1 正、负离子模式下青岛和厦门菲律宾蛤蜊中代谢物PCA分布图
Fig.1 PCA score plots of metabolites in Ruditapes philippinarum from Qingdao and Xiamen in positive ion and negative ion modes
OPLS-DA结果显示,两组样本间均能明显分离,说明两组样本有明显的组间差异。OPLS-DA的R2X、R2Y、Q2在正(负)离子模式下分别为25.3%、97.6%和81.3%(28.8%、97%和84%),表明该模型拟合效果良好。对OPLS-DA模型进行200次置换检验分析,正、负离子模式下Q2分别为-1、-1.23,两种模式下Q2均<0.05,证明OPLS-DA模型可靠,青岛和厦门蛤蜊中的代谢物有显著性差异(P<0.05)。
2.1.2 差异代谢物筛选与途径分析 基于VIP>1、P<0.05对差异物进行筛选,从图2可见,在正离子模式下共检测到51种差异代谢物,主要包括维生素及其衍生物类、氨基酸及其衍生物类,其中26种代谢物在青岛蛤蜊样品中丰度高,25种代谢物在厦门蛤蜊样品中丰度高;负离子模式下,共检测到33种差异代谢物,主要包括氨基酸类、糖类及其衍生物类,其中16种代谢物在青岛蛤蜊样品中丰度高,17种代谢物在厦门产蛤蜊中丰度高。在上述84种差异代谢物中,青岛蛤蜊样品中有42种代谢物含量显著高于厦门蛤蜊,主要包括维生素A、视黄醛、S-腺苷甲硫氨酸、谷氨酰胺等;其余42种反之,主要包括组氨酸、脯氨酸和羟脯氨酸等。
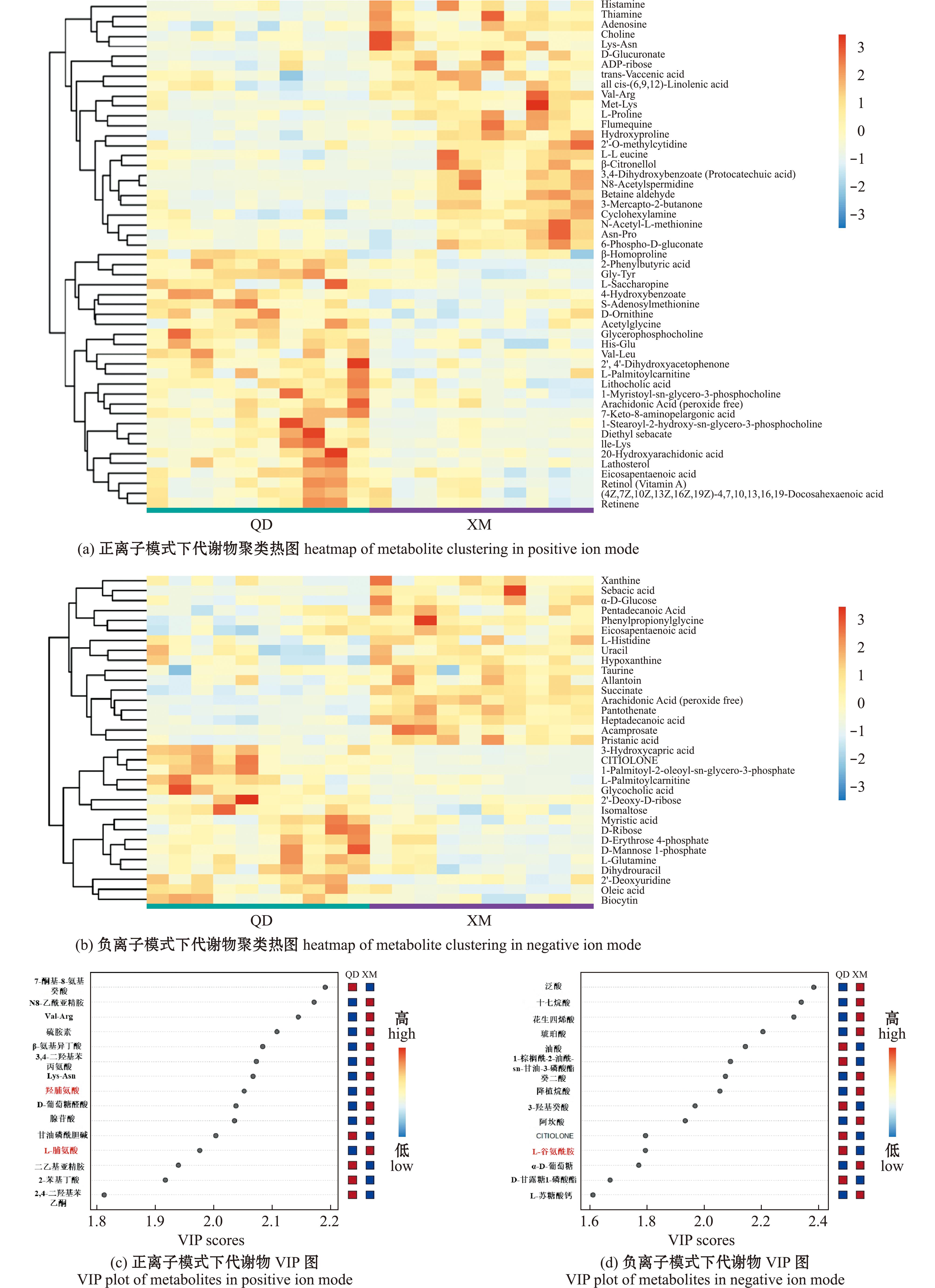
图2 正、负离子模式下代谢物聚类热图和VIP图
Fig.2 Heatmap and VIP plots of metabolite clustering in positive ion and negative ion modes
为比较不同产地蛤蜊样品的差异代谢物,如图3所示,在正离子模式下,QD-VS-XM共检测到340种差异代谢物,其中160种上调,180种下调;负离子模式下,共检测到273种差异代谢物,其中127种上调,146种下调。分别将青岛产蛤蜊与厦门产蛤蜊代谢物进行Pathway分析和KEGG富集分析。图中较大较红的圆点为差异代谢物主要的代谢通路。从图4可见,正离子模式下一共富集到14条通路,有2条差异显著的通路(P<0.05),分别是视黄醇代谢、精氨酸和脯氨酸代谢,通路中命中的差异代谢物为维生素A、视黄醛、脯氨酸、S-腺苷甲硫氨酸和羟脯氨酸;负离子模式下共富集到20条代谢通路,有2条差异显著通路(P<0.05),分别是戊糖磷酸途径、氮代谢,其差异代谢物为脱氧核糖、D-核糖、赤藓糖-4-磷酸、L-谷氨酰胺和L-组氨酸。
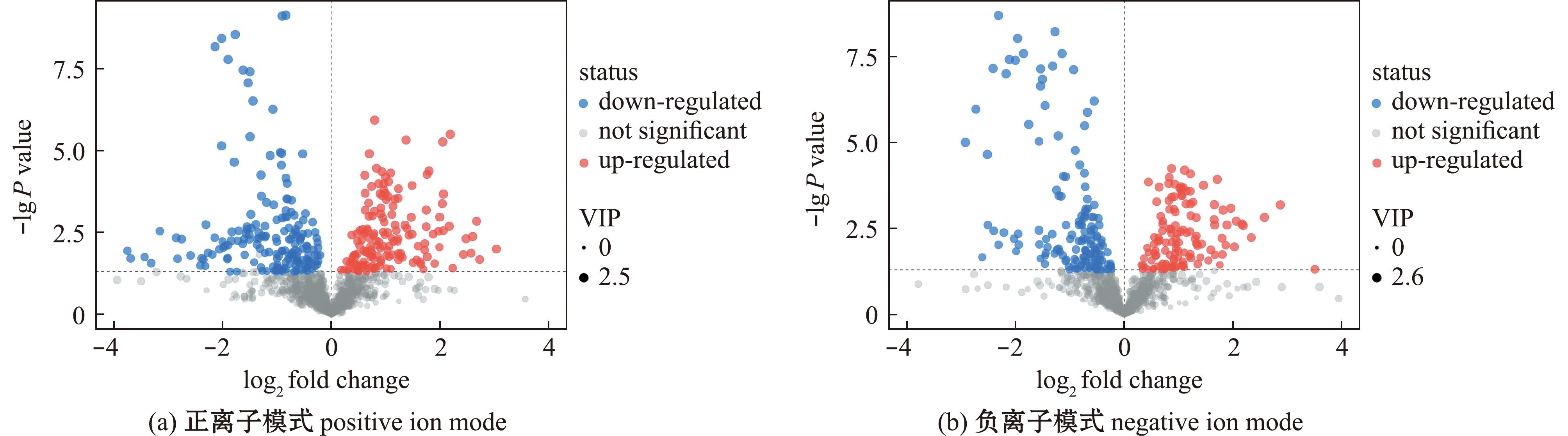
图3 正、负离子模式下差异代谢物火山图
Fig.3 Volcano plots of differential metabolites in positive ion and negative ion modes
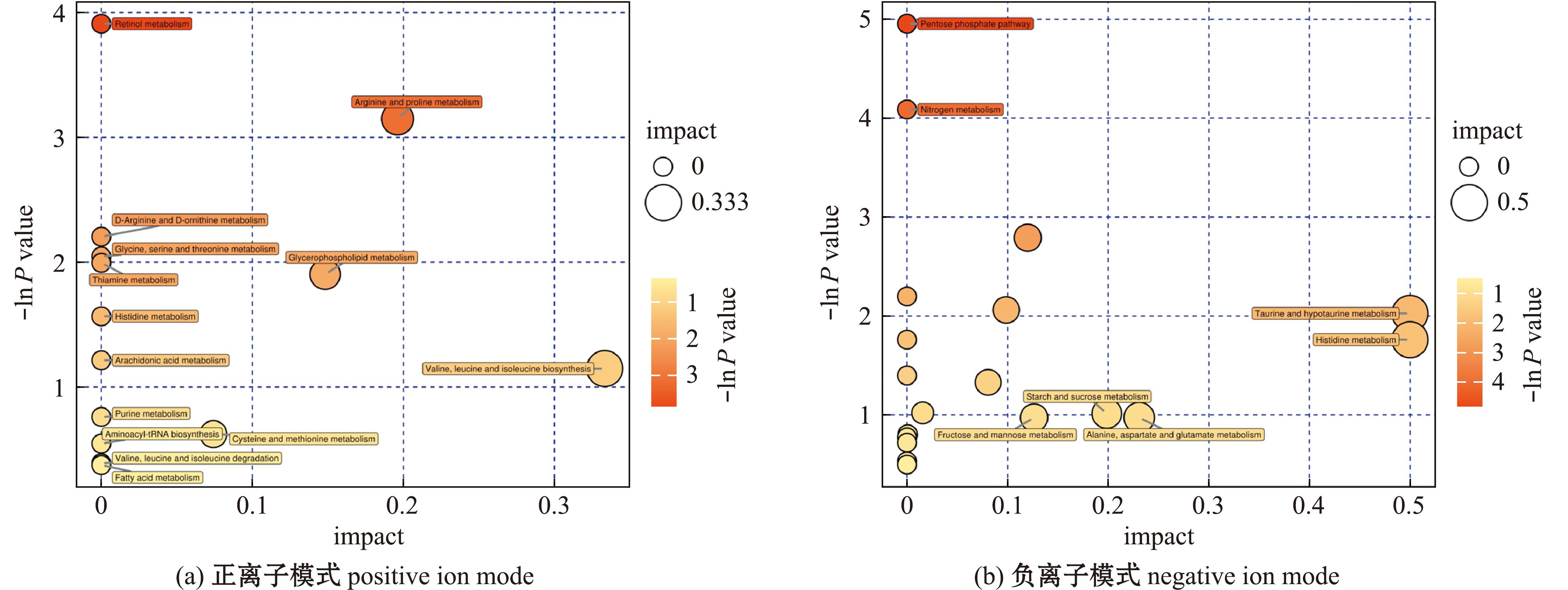
图4 正、负离子模式下差异代谢物富集代谢通路
Fig.4 Metabolic pathways of differential metabolites in positive ion and negative ion modes
2.2 C18色谱体系结果分析
2.2.1 多元统计分析 以下分析均采用与上述色谱体系结果相同的分析方法,正离子模式下提取离子峰1 464个,识别代谢物254个;负离子模式下提取离子峰1 746个,识别出的代谢物120个。正、负离子模式下,所有QC样本集中分布(图5),说明样品间分离是由于组间的差异变量,而非分析过程中的差异造成。
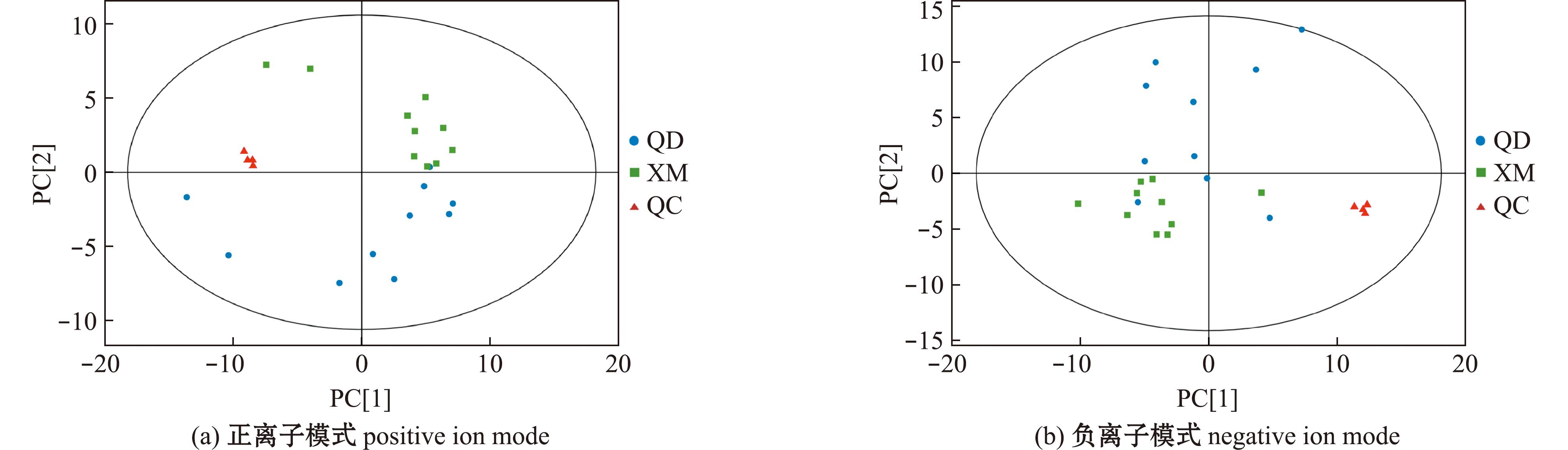
图5 正、负离子模式下代谢物PCA分布图
Fig.5 PCA score plots of metabolites in positive ion and negative ion modes
OPLS-DA结果显示,两组样本有明显的组间差异。正(负)离子模式下R2X、R2Y、Q2为43.3%、92.1%和72.8%(26%、98%和81.5%),OPLS-DA模型拟合效果良好。200次置换检验分析结果显示正、负离子模式下Q2分别为-1.07、-1.13,证明OPLS-DA模型具有可行性。
2.2.2 差异代谢物筛选与代谢途径分析 从图6可见,正离子模式下,青岛与厦门样品中共检测到30种差异代谢物,包括核酸类、磷脂类、糖类及其衍生物类等。其中,13种代谢物在青岛产蛤蜊中丰度高,17种代谢物在厦门产蛤蜊中丰度高;负离子模式下,共检测到18种差异代谢物,包括氨基酸类、嘌呤类、核苷类等。其中,8种代谢物在青岛产蛤蜊中丰度高,10种代谢物在厦门产蛤蜊中丰度高。在上述筛选出的48种差异代谢物中,青岛蛤蜊有21种代谢物的含量显著高于厦门蛤蜊,主要包括甘油磷酸胆碱、尿苷二磷酸-N-乙酰葡萄糖胺、谷氨酰胺、胞磷胆碱和鸟苷酸等;其余27种反之,主要包括组氨酸和次黄嘌呤等。
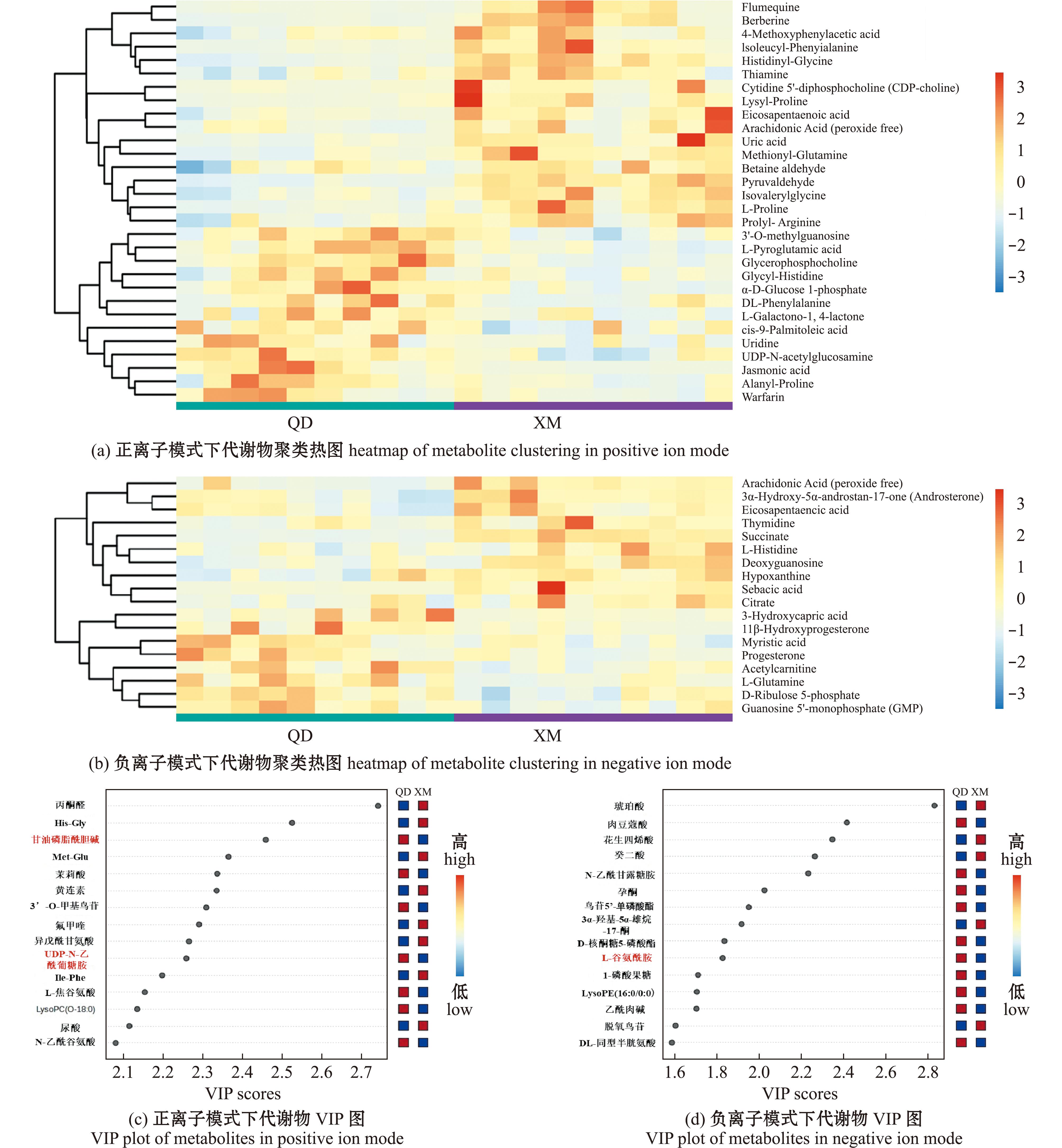
图6 正、负离子模式下代谢物聚类热图和VIP图
Fig.6 Heatmap and VIP plots of metabolite clustering in positive ion and negative ion modes
在正离子模式下,QD-VS-XM共检测到177种差异代谢物,其中93种上调,84种下调;负离子模式下,QD-VS-XM共检测到317种差异代谢物,其中142种上调,175种下调(图7)。分别将青岛产蛤蜊和厦门产蛤蜊代谢物进行Pathway分析和KEGG富集分析。从图8可见,正离子模式下一共富集到14条通路,有2条差异显著的通路(P<0.05),分别是甘油磷脂代谢、氨基糖和核苷酸糖代谢,其通路中命中的差异代谢物为甘油磷酸胆碱和胞磷胆碱,1-磷酸葡萄糖和尿苷二磷酸-N-乙酰氨基葡萄糖;负离子模式下共富集到10条代谢通路,有2条差异显著通路(P<0.05),为嘌呤代谢、氮代谢,两条通路中命中的差异代谢物为谷氨酰胺、鸟苷酸、次黄嘌呤、脱氧尿苷和L-组氨酸。
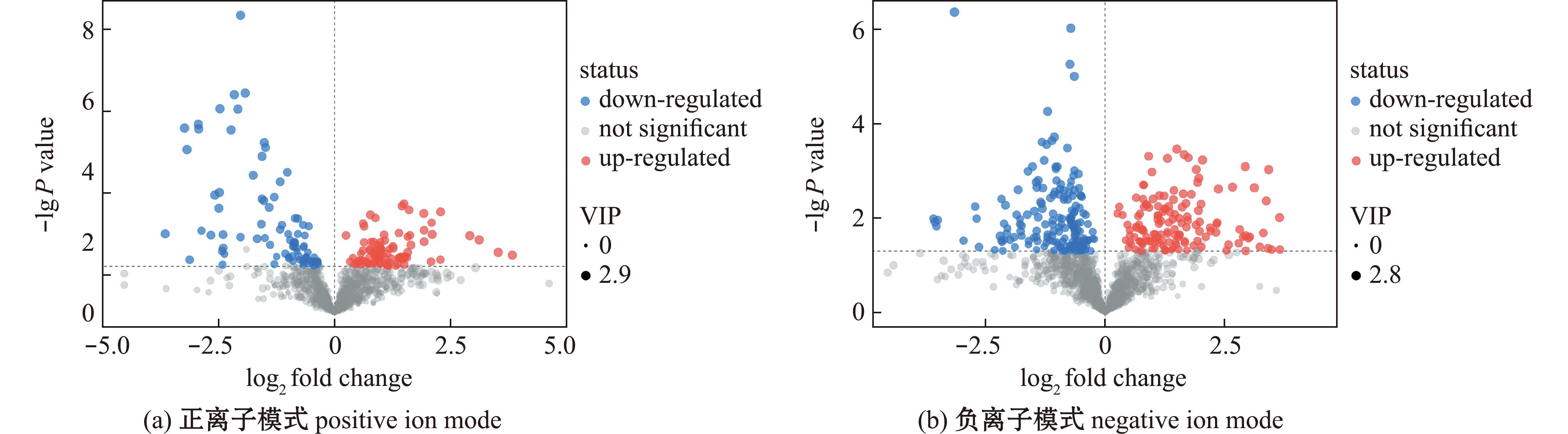
图7 正、负离子模式下差异代谢物火山图
Fig.7 Volcano plots of differential metabolites in positive ion and negative ion modes
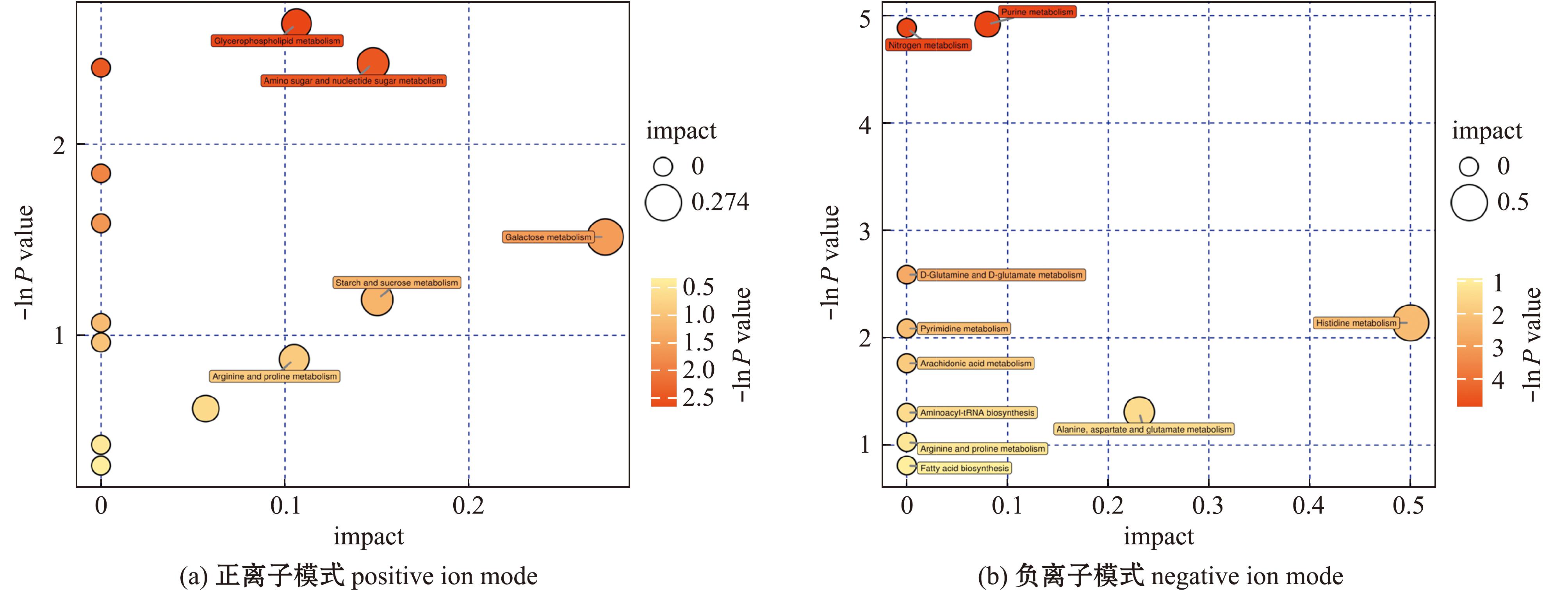
图8 正、负离子模式下差异代谢物富集代谢通路
Fig.8 Metabolic pathways of differential metabolites in positive ion and negative ion modes
2.3 Amide体系和C18体系比较结果
对两种体系进行比较,结果见表1。两个体系提取到的离子峰和识别出的代谢物数量相近。筛选出来的差异代谢物进行比较,Amide体系正、负离子模式下分别筛选出51种、33种差异代谢物,C18体系在正、负离子模式下分别筛选出30种和18种差异代谢物。C18体系两种模式下提取离子峰数量多于Amide体系,但在识别代谢物、筛选差异代谢物和显著差异代谢物方面,Amide体系均优于C18体系,可能是由于该色谱柱具有较高的灵敏度,可以捕获到更多代谢物。
表1 Amide体系和C18体系下蛤蜊差异物及通路分析
Tab.1 Results of differential expression and pathway analysis in Amide system and C18 system of clams
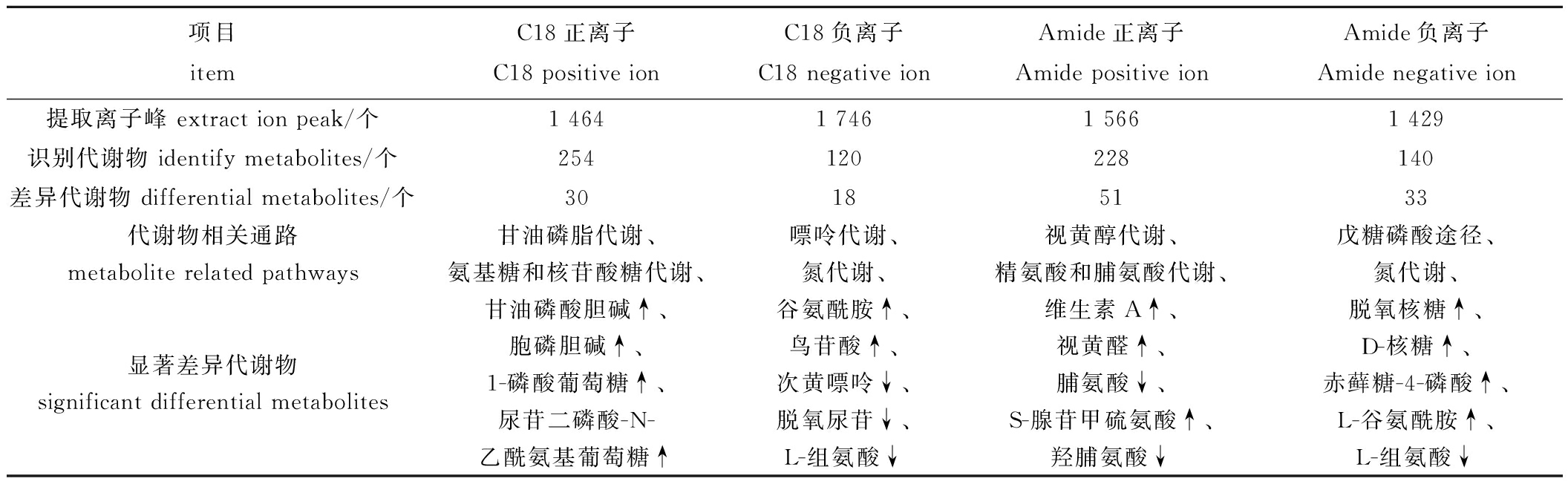
项目itemC18正离子C18 positive ionC18负离子C18 negative ionAmide正离子Amide positive ionAmide负离子Amide negative ion提取离子峰 extract ion peak/个1 4641 7461 5661 429识别代谢物 identify metabolites/个254120228140差异代谢物 differential metabolites/个30185133代谢物相关通路metabolite related pathways甘油磷脂代谢、氨基糖和核苷酸糖代谢、嘌呤代谢、氮代谢、视黄醇代谢、精氨酸和脯氨酸代谢、戊糖磷酸途径、氮代谢、显著差异代谢物significant differential metabolites甘油磷酸胆碱↑、胞磷胆碱↑、1-磷酸葡萄糖↑、尿苷二磷酸-N-乙酰氨基葡萄糖↑谷氨酰胺↑、鸟苷酸↑、次黄嘌呤↓、脱氧尿苷↓、L-组氨酸↓维生素A↑、视黄醛↑、脯氨酸↓、S-腺苷甲硫氨酸↑、羟脯氨酸↓脱氧核糖↑、D-核糖↑、赤藓糖-4-磷酸↑、L-谷氨酰胺↑、L-组氨酸↓
注:↑表示该物质在青岛蛤蜊中的相对含量高于厦门蛤蜊;↓表示该物质在青岛蛤蜊中的相对含量低于厦门蛤蜊。
Note:↑means the relative content of substance in QD clams is higher than that in XM clams;↓means the relative content of this substance in QD clams is lower than that in XM clams.
2.4 呈味氨基酸靶向代谢组学测定分析结果
对呈味氨基酸进行靶向代谢组学分析,结果见表2。味觉活性值(taste activity value,TAV)可以直接反映呈味物质对食品整体口感的影响程度,TAV为样品中呈味物质的测定值与该呈味物质味道阈值的比值。当TAV>1时,表明该物质对呈味具有较大的贡献[22]。据此计算菲律宾蛤蜊中氨基酸TAV值(表2)。结果显示,谷氨酸、甘氨酸和丙氨酸TAV值在青岛蛤蜊和厦门蛤蜊中均>1。根据差异分析结果,选取青岛和厦门两地蛤蜊中差异显著氨基酸(P<0.05)进行分析,含量差异如图9所示。
表2 菲律宾蛤仔的呈味氨基酸组成
Tab.2 Taste Amino Acid compositions of Ruditapes philippinarum
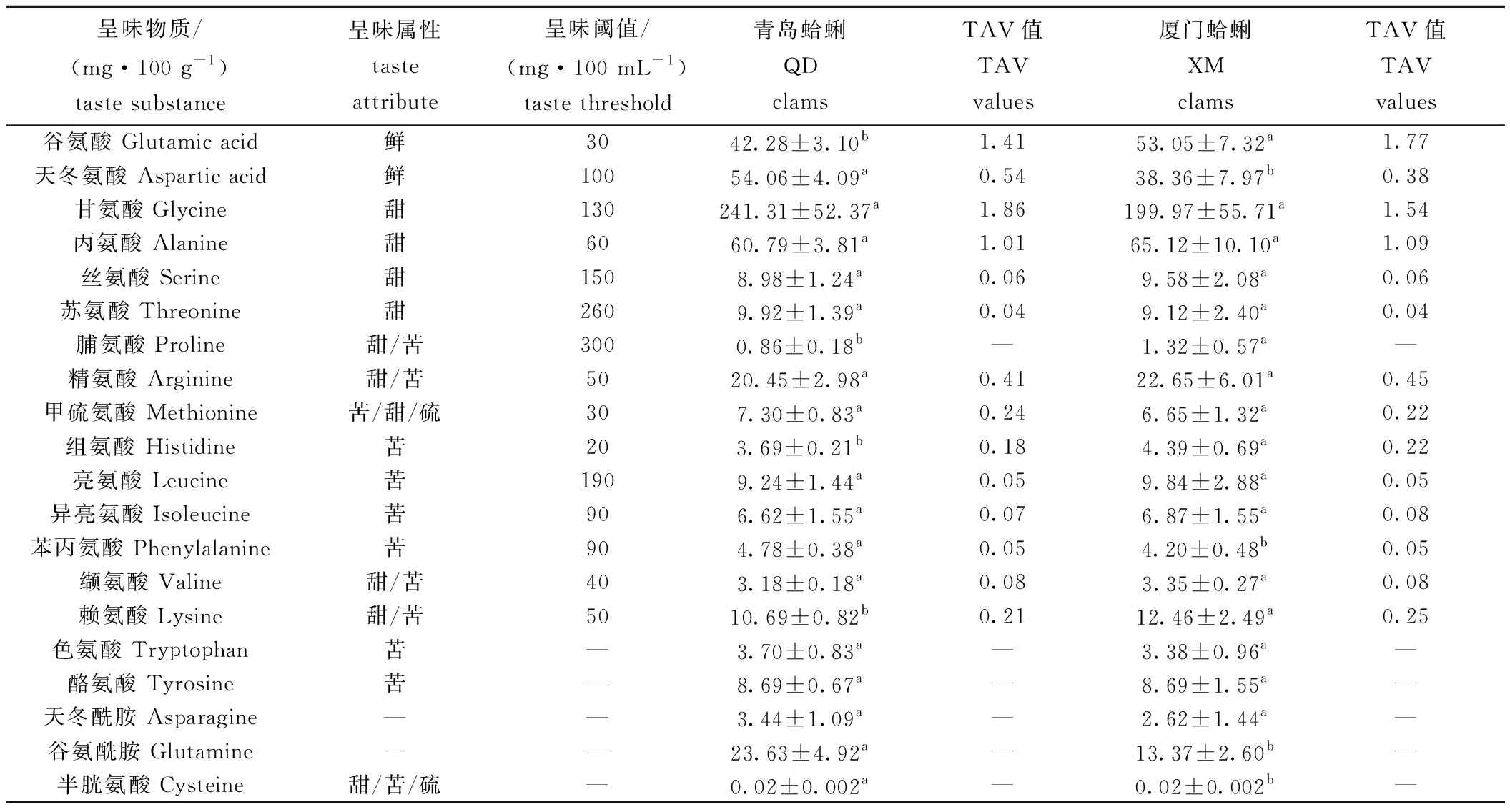
呈味物质/(mg·100 g-1)taste substance呈味属性taste attribute呈味阈值/(mg·100 mL-1)taste threshold青岛蛤蜊QD clamsTAV值TAV values厦门蛤蜊XM clamsTAV值TAV values谷氨酸 Glutamic acid鲜3042.28±3.10b1.4153.05±7.32a1.77天冬氨酸 Aspartic acid鲜10054.06±4.09a0.5438.36±7.97b0.38甘氨酸 Glycine甜130241.31±52.37a1.86199.97±55.71a1.54丙氨酸 Alanine甜6060.79±3.81a1.0165.12±10.10a1.09丝氨酸 Serine甜1508.98±1.24a0.069.58±2.08a0.06苏氨酸 Threonine甜2609.92±1.39a0.049.12±2.40a0.04脯氨酸 Proline甜/苦3000.86±0.18b—1.32±0.57a—精氨酸 Arginine甜/苦5020.45±2.98a0.4122.65±6.01a0.45甲硫氨酸 Methionine苦/甜/硫307.30±0.83a0.246.65±1.32a0.22组氨酸 Histidine苦203.69±0.21b0.184.39±0.69a0.22亮氨酸 Leucine苦1909.24±1.44a0.059.84±2.88a0.05异亮氨酸 Isoleucine苦906.62±1.55a0.076.87±1.55a0.08苯丙氨酸 Phenylalanine苦904.78±0.38a0.054.20±0.48b0.05缬氨酸 Valine甜/苦403.18±0.18a0.083.35±0.27a0.08赖氨酸 Lysine甜/苦5010.69±0.82b0.2112.46±2.49a0.25色氨酸 Tryptophan苦—3.70±0.83a—3.38±0.96a—酪氨酸 Tyrosine苦—8.69±0.67a—8.69±1.55a—天冬酰胺 Asparagine——3.44±1.09a—2.62±1.44a—谷氨酰胺 Glutamine——23.63±4.92a—13.37±2.60b—半胱氨酸 Cysteine甜/苦/硫—0.02±0.002a—0.02±0.002b—
注:同行中标有不同小写字母表示组间有显著性差异(P<0.05),标有相同小写字母表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same line are significant differences at the 0.05 probability level,and the means with the same letters within the same line are not significant differences.
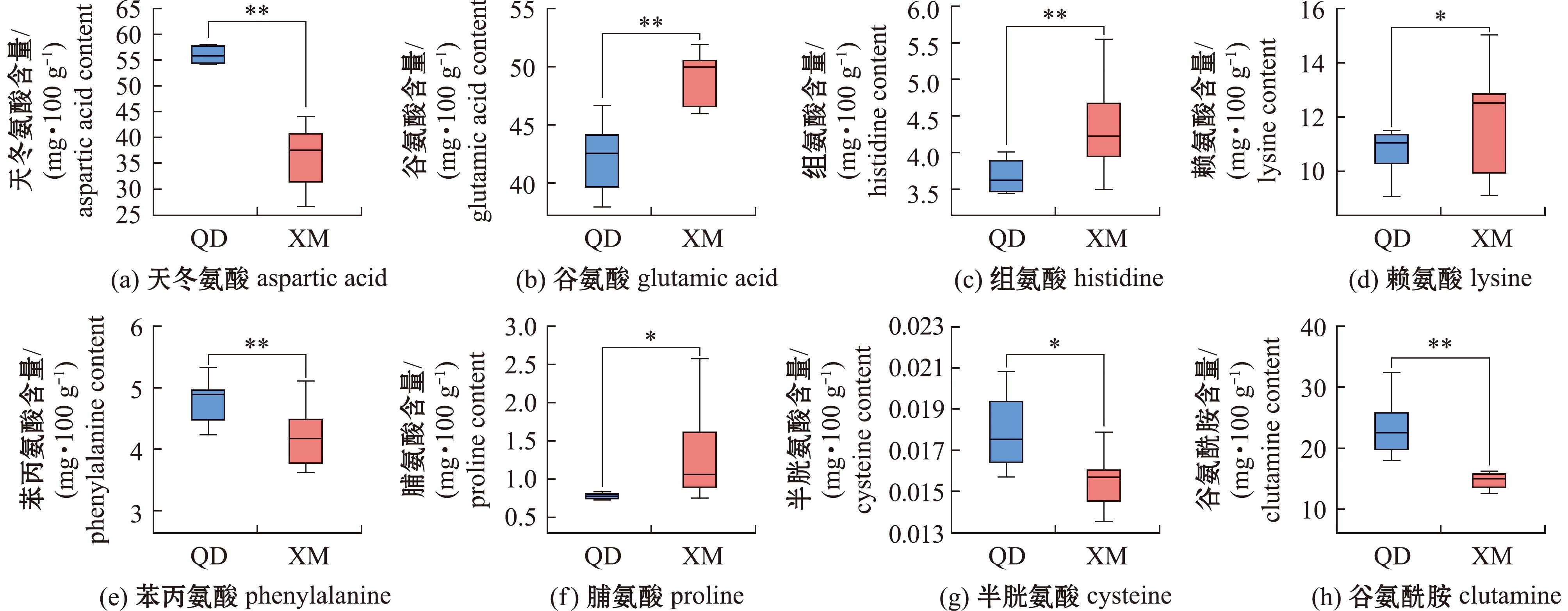
*表示两组间有显著性差异(P<0.05);**表示两组间有极显著性差异(P<0.01)。
*means significant difference between the two groups(P<0.05);**means very significant difference between the two groups(P<0.01).
图9 显著性差异氨基酸分析
Fig.9 Analysis of significant different Amino Acids
结果表明,天冬氨酸、半胱氨酸、谷氨酰胺、苯丙氨酸在青岛蛤蜊中的含量显著高于厦门蛤蜊(P<0.05)。
3 讨论
3.1 不同产地对蛤蜊差异代谢物和代谢通路影响
上述显著差异代谢物主要包括5大类,分别是胆碱类(甘油磷酸胆碱、胞磷胆碱)、维生素类(维生素A、视黄醛)、糖类(1-磷酸葡萄糖、尿苷二磷酸-N-乙酰氨基葡萄糖、脱氧核糖、D-核糖、赤藓糖-4-磷酸)、氨基酸类(谷氨酰胺、L-组氨酸、脯氨酸、S-腺苷甲硫氨酸、羟脯氨酸)和核苷酸及其衍生物类(鸟苷酸、次黄嘌呤、脱氧鸟苷)。其中胆碱类代谢物主要参与甘油磷脂代谢途径,维生素类代谢物主要参与视黄醇代谢,糖类化合物主要参与磷酸戊糖途径及氨基糖和核苷酸糖代谢,氨基酸类代谢物主要参与氮代谢和氨基酸代谢途径,核苷酸及衍生物类化合物主要参与嘌呤代谢。
对其差异代谢物相对含量进行比较,在基本营养代谢物方面,甘油磷酸胆碱、S-腺苷甲硫氨酸、尿苷二磷酸-N-乙酰葡萄糖胺3种基本营养代谢物的含量为青岛样品高于厦门样品,而组氨酸、脯氨酸、羟脯氨酸含量则相反;谷氨酰胺、胞磷胆碱、维生素A、视黄醛作为功能营养成分,其含量为青岛样品高于厦门样品;此外,青岛样品中鸟苷酸的含量高于厦门样品,而次黄嘌呤的含量则相反。
糖原是贝类中能量储存的形式之一,也是影响贝类风味特征的重要因子[23]。1-磷酸葡萄糖和尿苷二磷酸-N-乙酰氨基葡萄糖均参与氨基糖和核苷酸糖代谢途径,且相对含量上调,可以直接或间接促进糖原合成,两种物质含量均表现为青岛蛤蜊高于厦门蛤蜊,其原因可能与地域水质、蛤蜊自身的生理代谢和摄食习惯等因素有关[24]。此外,脱氧核糖、核糖和赤藓糖-4-磷酸在磷酸戊糖途径中显著上调,减缓葡萄糖的分解,以储存能量。磷脂酰胆碱作为胃肠黏膜屏障主要脂质,具有保护黏膜、调节炎症的生理功能[25]。胞磷胆碱、甘油磷酸胆碱作为磷脂酰胆碱的前体物质在甘油磷脂代谢途径中呈上调状态,表明其在维持正常生理功能中发挥作用。肌苷酸(IMP)和鸟苷酸(GMP)是主要的呈味核苷酸,也是影响贝类风味的因子之一[26]。不同产地菲律宾蛤蜊呈味核苷酸关联化合物存在差异,GMP在嘌呤代谢途径中处于上调状态,表明对青岛蛤蜊的风味发挥了重要的作用。而次黄嘌呤(Hx)呈下调状态,可能是由于厦门蛤蜊呈味物质HxR经过AMP→腺苷→HxR→Hx的降解途径生成苦味物质Hx速度加快,降低了菲律宾蛤蜊体内HxR的含量,使Hx含量积累[27]。L-谷氨酰胺参与了嘌呤代谢和氮代谢两条代谢途径,且相对含量显著上调。有研究报道,谷氨酰胺可以提供机能,提高抗氧化能力[28]。维生素A和作为维生素A活性形式的视黄醛在视黄醇代谢中呈显著上调状态,维生素A在维持正常的视觉功能及调节机体免疫力等方面起着至关重要的作用[29]。参与精氨酸和脯氨酸代谢的显著差异代谢物主要包括脯氨酸、S-腺苷甲硫氨酸和羟脯氨酸,其中S-腺苷甲硫氨酸在代谢通路中显著上调,其他两种代谢物下调。S-腺苷甲硫氨酸作为含硫氨基酸,在脱氧硫酶作用下分解产生甲硫醇,是许多挥发性香味化合物的合成前体[30],脯氨酸作为苦味氨基酸其相对含量下调,说明青岛蛤蜊的风味要优于厦门蛤蜊。
3.2 不同液相色谱分离体系对质谱组学结果影响
两种体系中显著的代谢通路和显著差异代谢物不同。C18体系对非极性和中等极性化合物有较好的分离能力[31],T3色谱柱适用于中小极性化合物的保留和分离[32],因而核苷、嘌呤类等极性适中化合物易在C18体系检出。Amide色谱柱基于亲水互作模式,适用于极性物质的分离[33]。Amide色谱柱采用酰胺键合独特的键合技术具有更高的稳定性[34],且游离氨基酸类属于水溶性小分子化合物,Amide色谱柱为这些分子提供更好的保留效果,因此在Amide体系中筛选出来的氨基酸种类比较多。两种体系结合,可以扩大代谢产物的检测范围,以获得更加全面的代谢物种类及含量信息。
3.3 不同产地对蛤蜊呈味氨基酸的影响
氨基酸属于基本营养成分,而某些氨基酸具有特殊的风味,因此可作为食品品质评价的重要指标之一[35]。靶向代谢组学结果表明,菲律宾蛤蜊中显著性差异的鲜味氨基酸为谷氨酸(TAV>1),而青岛蛤蜊中谷氨酸含量低于厦门蛤蜊,符合从南到北含量逐渐减少的趋势,与前期研究结果一致[36]。鲜味氨基酸除谷氨酸外还包括天冬氨酸,其含量表现为青岛高于厦门蛤蜊,以上两种氨基酸含量总体上呈现为青岛蛤蜊高于厦门蛤蜊,因此,在鲜味方面青岛蛤蜊可能优于厦门蛤蜊。靶向结果显示,青岛蛤蜊中甲硫氨酸的含量高于厦门蛤蜊,而甲硫氨酸可以进一步转化成S-腺苷甲硫氨酸,因此,青岛蛤蜊中S-腺苷甲硫氨酸含量高于厦门蛤蜊。脯氨酸、组氨酸、赖氨酸、精氨酸、酪氨酸、亮氨酸和缬氨酸等属于苦味氨基酸,厦门蛤蜊样品中此类氨基酸含量高于青岛蛤蜊样品,可能是由于盐度的差异引起风味特征成分的差异[36-37]。作为芳香族氨基酸的苯丙氨酸分解会产生香味[35,38],而青岛蛤蜊中该氨基酸含量高于厦门蛤蜊,可能使青岛蛤蜊气味优于厦门。厦门和青岛两地存在水温、盐度等环境因素差异,影响水环境中饵料藻的种类和数量及贝的摄食率,样品采集时厦门水温较青岛高,饵料藻相对旺盛,贝类摄食丰富导致两地主要氨基酸含量基本呈现为南高北低的趋势[36,39]。
4 结论
1)研究使用Amide和C18色谱柱两种分离体系分别对青岛和厦门两地菲律宾蛤蜊差异营养代谢物进行非靶向代谢组学分析,Amide体系在识别差异代谢物等方面优于C18体系。
2)青岛产蛤蜊在胆碱类(如甘油磷酸胆碱、胞磷胆碱)、维生素类(如维生素A、视黄醛)等营养代谢物和某些氨基酸类(如谷氨酰胺、S-腺苷甲硫氨酸)、核苷酸类(如鸟苷酸)等呈味物质方面优于厦门产蛤蜊,而在其他氨基酸类(如组氨酸、脯氨酸等)、核苷酸类(如次黄嘌呤、脱氧鸟苷)等呈味物质方面逊于厦门产蛤蜊。
3)呈味氨基酸液质靶向分析显示,青岛蛤蜊中天冬氨酸、苯丙氨酸、半胱氨酸和谷氨酰胺含量显著高于厦门蛤蜊,谷氨酸、组氨酸、赖氨酸和脯氨酸的含量低于厦门蛤蜊。本研究揭示了产地对蛤蜊营养代谢物的影响,为评价不同产地蛤蜊品质、指导蛤蜊生产和消费提供了一定的科学参考。
[1] GOLDEN C D,ZACHARY KOEHN J,SHEPON A,et al.Aquatic foods to nourish nations[J].Nature,2021,598(7880):315-320.
[2] VENUGOPAL V,GOPAKUMAR K.Shellfish:nutritive value,health benefits,and consumer safety[J].Comprehensive Reviews in Food Science and Food Safety,2017,16(6):1219-1242.
[3] 吴耀泉.中国近海菲律宾蛤仔的生态研究[J].海洋科学集刊,1995(1):213-216.WU Y Q.Ecological studies on Ruditapes philippinarum in the Chinese coast[J].Studia Marina Sinica,1995(1):213-216.(in Chinese)
[4] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2024中国渔业统计年鉴[M].北京:中国农业出版社,2024.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2024 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2024.(in Chinese)
[5] LIU Y,SONG L,SONG G J,et al.Feeding selectivity of Ruditapes philippinarum on phytoplankton[J].Fishes,2022,7(5):222.
[6] 栾合密,吴皓,方东,等.蛤蜊化学成分及其生物活性研究进展[J].中国海洋药物,2008,27(6):57-61.LUAN H M,WU H,FANG D,et al.Research progress on chemical constituents and biological activities of clam[J].Chinese Journal of Marine Drugs,2008,27(6):57-61.(in Chinese)
[7] 林位琅,连晨阳,陈志,等.福建菲律宾蛤仔产业发展报告[J].中国水产,2022(11):50-53.LIN W L,LIAN C Y,CHEN Z,et al.Report on the industrial development of Ruditapes philippinarum in Fujian Province[J].China Fisheries,2022(11):50-53.(in Chinese)
[8] 刘青,张越,付鑫,等.菲律宾蛤仔的研究进展[J].河北渔业,2011(1):56-59.LIU Q,ZHANG Y,FU X,et al.Research progress of Ruditapes philippinarum[J].Hebei Fisheries,2011(1):56-59.(in Chinese)
[9] BARRENTO S,MARQUES A,TEIXEIRA B,et al.Effect of season on the chemical composition and nutritional quality of the edible crab Cancer Pagurus[J].Journal of Agricultural and Food Chemistry,2009,57(22):10814-10824.
[10] SARDI A E,SANDRINI-NETO L,DA CUNHA LANA P,et al.Seasonal variation of oxidative biomarkers in gills and digestive glands of the clam Anomalocardia flexuosa and the mangrove oyster Crassostrea rhizophorae[J].Marine Pollution Bulletin,2020,156:111193.
[11] CHEN L P,YU F,SUN S H,et al.Evaluation indicators of Ruditapes phil ippinarum nutritional quality[J].Journal of Food Science and Technology,2021,58(8):2943-2951.
[12] 陈羽红,张东杰,张桂芳,等.代谢组学技术在食品产地溯源中的研究进展[J].粮食与饲料工业,2016(7):16-19,28.CHEN Y H,ZHANG D J,ZHANG G F,et al.Review on metabonomics techniques in food origin traceability[J].Cereal &Feed Industry,2016(7):16-19,28.(in Chinese)
[13] 王晓宇,杜仁鹏,王瑶,等.代谢组学技术在食品认证及特征鉴定中的应用[J].中国农学通报,2016,32(32):61-65.WANG X Y,DU R P,WANG Y,et al.Application ofmetabolomics technology in food certification and characteristic identification[J].Chinese Agricultural Science Bulletin,2016,32(32):61-65.(in Chinese)
[14] 李锐,孙祖莉,杨贤庆,等.代谢组学在水产品品质与安全中的研究进展[J].生物技术通报,2020,36(11):155-163.LI R,SUN Z L,YANG X Q,et al.Advances in the applications of metabolomics technologies in aquatic products quality and safety research[J].Biotechnology Bulletin,2020,36(11):155-163.(in Chinese)
[15] 许彦阳,姚桂晓,刘平香,等.代谢组学在农产品营养品质检测分析中的应用[J].中国农业科学,2019,52(18):3163-3176.XU Y Y,YAO G X,LIU P X,et al.Review on theapplication of metabolomic approaches to investigate and analysis the nutrition and quality of agro-products[J].Scientia Agricultura Sinica,2019,52(18):3163-3176.(in Chinese)
[16] LIU Z Q,ZHAO M T,WANG X W,et al.Investigation of oyster Crassostrea gigas lipid profile from three sea areas of China based on non-targeted lipidomics for their geographic region traceability[J].Food Chemistry,2022,386:132748.
[17] ZHAO G H,ZHAO W F,HAN L S,et al.Metabolomics analysis of sea cucumber (Apostichopus japonicus) in different geographical origins using UPLC-Q-TOF/MS[J].Food Chemistry,2020,333:127453.
[18] XING L L,SUN L N,LIU S L,et al.Comparative metabolomic analysis of the body wall from four varieties of the sea cucumber Apostichopus japonicus[J].Food Chemistry,2021,352:129339.
[19] YE Y H,WANG Y L,LIU P Y,et al.Uncovering the nutritive profiles of adult male Chinese mitten crab (E.sinensis) harvested from the pond and natural water area of Qin Lake based on metabolomics[J].Foods,2023,12(11):2178.
[20] WU Y L,DENG H X,YANG W,et al.Non-targeted metabolomics based on liquid chromatography-mass spectrometry to evaluate the metabolites of wild and farmed large yellow croakers (Larimichthys crocea)[J].Journal of Food Measurement and Characterization,2023,17(6):6393-6404.
[21] SONG D R,PENG J X,ZHAO X N,et al.Quality and safety profiles of Chlamys farreri cultured in the Shandong peninsula:Analysis of nutritional content,flavor,and hazards[J].Journal of Food Composition and Analysis,2023,118:105193.
[22] WANG Q,SUN C,CHEN L P,et al.Evaluation of microalgae diets on flavor characteristics of Pacific oysters (Crassostrea gigas) during fattening[J].Food Chemistry,2022,391:133191.
[23] 林海生,秦小明,章超桦,等.中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J].南方水产科学,2019,15(2):110-120.LIN H S,QIN X M,ZHANG C H,et al.Comparative analysis of nutritional components and flavor characteristics of cultivated oyster from different coastal areas of China[J].South China Fisheries Science,2019,15(2):110-120.(in Chinese)
[24] COCHET M,BROWN M,KUBE P,et al.Understanding the impact of growing conditions on oysters:a study of their sensory and biochemical characteristics[J].Aquaculture Research,2015,46(3):637-646.
[25] 赖盼建,张维溪,李小兵.胞嘧啶核苷二磷酸胆碱对新生大鼠坏死性小肠结肠炎的治疗作用[J].浙江医学,2020,42(15):1579-1582,1681.LAI P J,ZHANG W X,LI X B.Cytidine diphosphate choline for treatment of necrotizing enterocolitis in neonatal rats[J].Zhejiang Medical Journal,2020,42(15):1579-1582,1681.(in Chinese)
[26] 王潇,韩刚,张小军,等.不同水域中华绒螯蟹雄体营养成分及风味成分差异性研究[J].大连海洋大学学报,2019,34(5):688-696.WANG X,HAN G,ZHANG X J,et al.Nutritional composition and flavor components of male Chinese mitten handed crab Eriocheir sinensis from different waters[J].Journal of Dalian Ocean University,2019,34(5):688-696.(in Chinese)
[27] 郑惠娜,章超桦,秦小明,等.马氏珠母贝肉蒸煮液主要呈味成分分析[J].食品科技,2012,37(2):151-155.ZHENG H N,ZHANG C H,QIN X M,et al.Analysis of taste-active components of the cooking liquor of Pinctada martensii meat[J].Food Science and Technology,2012,37(2):151-155.(in Chinese)
[28] LÜ D H,XIONG X,YANG H S,et al.Effect of dietary soy oil,glucose,and glutamine on growth performance,amino acid profile,blood profile,immunity,and antioxidant capacity in weaned piglets[J].Science China Life Sciences,2018,61(10):1233-1242.
[29] CARAZO A,MAC KOV
KOV K,MATOU
K,MATOU OV
OV K,et al.Vitamin A update:forms,sources,kinetics,detection,function,deficiency,therapeutic use and toxicity[J].Nutrients,2021,13(5):1703.
K,et al.Vitamin A update:forms,sources,kinetics,detection,function,deficiency,therapeutic use and toxicity[J].Nutrients,2021,13(5):1703.
[30] LEDUC F,TOURNAYRE P,KONDJOYAN N,et al.Evolution of volatile odorous compounds during the storage of European seabass (Dicentrarchus labrax)[J].Food Chemistry,2012,131(4):1304-1311.
[31] 秦美玲,高欢欢,柴爽爽,等.基于亲水作用色谱和反相色谱四极杆-飞行时间质谱技术的水稻叶片代谢轮廓分析[J].分析化学,2018,46(4):479-485.QIN M L,GAO H H,CHAI S S,et al.Metabolicprofiling analysis of rice leaf based on hydrophilic interaction chromatography combined with reversed phase liquid chromatography quadrupole-time-of-flight mass spectrometry[J].Chinese Journal of Analytical Chemistry,2018,46(4):479-485.(in Chinese)
[32] 宋青青,张珂,李婷,等.反相-亲水作用色谱-定制多反应监测法同步测定肉苁蓉多成分含量[J].分析化学,2020,48(11):1573-1593.SONG Q Q,ZHANG K,LI T,et al.Simultaneousdetermination of multiple components of cistanches herba based on reversed phase-hydrophilic interaction chromatography-tailored multiple reaction monitoring[J].Chinese Journal of Analytical Chemistry,2020,48(11):1573-1593.(in Chinese)
[33] FEI F,BOWDISH D M E,MCCARRY B E.Comprehensive and simultaneous coverage of lipid and polar metabolites for endogenous cellular metabolomics using HILIC-TOF-MS[J].Analytical and Bioanalytical Chemistry,2014,406(15):3723-3733.
[34] CHRISTOPHER H,CHERYL B,JIM C,等.BEH Amide柱:使碳水化合物的分析更简单、快速、高效[J].食品安全导刊,2010(7):40-41.CHRISTOPHER H,CHERYL B,JIM C,et al.BEH Amide column:make the analysis of carbohydrates simpler,faster and more efficient[J].China Food Safety,2010(7):40-41.(in Chinese)
[35] 友胜军,张映萍,秦晓威,等.不同产地草果理化特性及游离氨基酸组分分析[J].热带农业科学,2024,44(6):35-42.YOU S J,ZHANG Y P,QIN X W,et al.Analysis of the physicochemical properties and free amino acid composition of Amomum tsao-ko from different origins[J].Chinese Journal of Tropical Agriculture,2024,44(6):35-42.(in Chinese)
[36] 张安国,李太武,苏秀榕,等.不同地理种群文蛤的营养成分研究[J].水产科学,2006,25(2):79-81.ZHANG A G,LI T W,SU X R,et al.Thenutritive contents in various populations of clam Meretrix meretrix[J].Fisheries Science,2006,25(2):79-81.(in Chinese)
[37] CHEN L P,ZHANG H W,SHI H H,et al.The flavor profile changes of Pacific oysters (Crassostrea gigas) in response to salinity during depuration[J].Food Chemistry:X,2022,16:100485.
[38] ARDÖ Y.Flavour formation by amino acid catabolism[J].Biotechnology Advances,2006,24(2):238-242.
[39] 王俊,姜祖辉,张波,等.菲律宾蛤仔生理生态学研究Ⅱ.温度、饵料对同化率的影响[J].海洋水产研究,1999,20(2):42-47.WANG J,JIANG Z H,ZHANG B,et al.Studies on physiological ecology of short- necked clam(Ruditapes philippinarum) Ⅱeffects of temperature,and food on assimilation efficiency[J].Marine Fisherries Reseach,1999,20(2):42-47.(in Chinese)