罗非鱼原产于非洲尼罗河流域,为温水性中小型鱼类,具有食性广、无肌间刺、环境适应性强、生长速度快、繁殖能力强等优点。1957年以来,中国先后引进了多个品种的罗非鱼,目前已成为世界上最大的罗非鱼人工养殖国[1]。近年来,由无乳链球菌(Streptococcus agalactiae)引起的罗非鱼链球菌病严重阻碍了罗非鱼产业的发展。在养殖过程中,罗非鱼无乳链球菌病具有死亡率高、传播速度快等特点,一旦感染无乳链球菌病,通常会造成罗非鱼30%~90%的死亡率[2]。因此,开展罗非鱼抗病或致病相关功能基因研究对罗非鱼抗病机理解析具有重要意义。前期本团队通过尼罗罗非鱼感染无乳链球菌前后的血浆蛋白组学分析,发现显著差异蛋白EGFR为多个信号通路的中心蛋白[3],推测其在尼罗罗非鱼无乳链球菌病感染过程中可能发挥着重要作用,因此有必要进一步研究该基因,为罗非鱼EGFR基因的功能解析提供基础。
EGFR属于细胞表面酪氨酸激酶受体,隶属于ERBB家族,ERBB家族包含EGFR/ERBB1、ERBB2/HER2neu、ERBB3/Her3及ERBB4/HER4 [4]。EGFR蛋白主要包含胞外区、跨膜区、胞内区和羟基末端4部分,其中在胞内区含有典型的ATP结合位点和保守的酪氨酸激酶区;糖基化的胞外区折叠成4个亚区,由配体结合位点和2个含有半胱氨酸区域所构成,能结合多种配体,主要包括表皮生长因子(EGF)、转化生长因子α(tansfoming growth factor α,TGF-α)、B细胞生长因子(B-cell growth factor,BCGF)、肝素结合表皮生长因子样生长因子(heparin-binding epidermal growth factor-like growth factor,HBEGF)和表皮调节素 (epiregulin,EPR)[5],它们与配体结合后激活胞内的酪氨酸激酶区,激活引发一系列信号转导过程,参与细胞增殖、分化、迁移及凋亡等生物学过程[6]。目前EGFR基因已在多个物种中发现,人类EGFR基因的研究主要集中在肿瘤细胞的增殖、分化、转移及信号转导途径分析等领域[7]。研究发现,软体动物EGFR基因编码的蛋白能够促进细胞的迁移、增殖和伤口愈合,且与提高机体生长速度相关[8]。此外,斑马鱼(Danio rerio)的EGFR基因在调节肝祖细胞(hepatic progenitor cell,HPC)增殖、分化和迁移中也发挥着重要作用[9]。但是目前在罗非鱼中尚未见有该基因的相关报道。
本研究中以尼罗罗非鱼表皮生长因子受体EGFR基因为研究对象,通过PCR扩增,获得了该基因序列,解析了其蛋白结构域,并获得了其mRNA剪接异构体。同时通过荧光定量及免疫荧光等技术研究了其组织分布和细胞定位,以期为罗非鱼EGFR基因的功能解析提供基础数据。
1 材料与方法
1.1 材料
试验罗非鱼均来自广东罗非鱼良种场。选取健康的尼罗罗非鱼吉富品系(Oreochromis niloticus,GIFT strain)500尾(体质量为80 g±20 g,体长为12 cm±2 cm)。试验前暂养2周,水温保持在30 ℃±1 ℃,于每日早晚各投喂1次饲料,按照常规条件饲养管理。
1.2 方法
1.2.1 样本采集 暂养结束后,随机分成对照组和试验组,每组随机选取6尾健康罗非鱼,解剖获取心脏、鳃、脑、肝脏、脾脏、中肾、中肠、胃、皮肤、肌肉和血液等组织,装入含有Trizol(Magen,广州美基生物科技有限公司)的1.5 mL无酶管中,后立即进行研磨,-80 ℃下保存备用。
1.2.2 无乳链球菌攻毒试验 将复苏的无乳链球菌(本实验室保存,编号WC1535)[10]接种至血平板中,置于37 ℃培养箱,培养至16 h后,用磷酸缓冲液(phosphate buffered saline,PBS)将菌体冲洗下来,并用PBS调至菌悬液浓度为5×106 CFU/mL备用。将上述“1.1节”中健康罗非鱼选取180尾,随机分成对照组和试验组,对照组罗非鱼每尾腹腔注射100 μL的PBS溶液,试验组每尾腹腔注射100 μL的无乳链球菌悬液,每组设置3个重复。并分别于注射0、8、24、48、72、96 h,每组随机各取3尾鱼,按要求采集鱼体鳃、肾脏、脾脏、肝脏和肠道5个组织,将其置于1.5 mL无酶管中,并迅速于液氮中速冻后转入-80 ℃下保存备用。
1.2.3 腹腔注射LPS(Sigma,美国)和Poly I∶C(Sigma,美国) 同“1.2.2节”操作选取180尾健康罗非鱼,将其随机分为3组,分别为LPS试验组、Poly I∶C试验组和对照组,每组各60尾。对照组的每尾罗非鱼腹腔注射100 μL的PBS溶液,LPS和Poly I∶C试验组每尾鱼体分别腹腔注射100 μL用PBS配制好的1 mg/mL的LPS和Poly I∶C,并于注射后0、8、24、48、72 h,每组每个时间点选取3尾鱼,采集鱼体的肠道、鳃、肾脏、脾脏,迅速置于液氮中速冻,并转入-80 ℃下保存。
1.2.4 总RNA提取及cDNA合成 根据RNA提取试剂盒(Magen,广州美基生物科技有限公司)说明书,提取上述各个组织样品的总RNA,之后使用紫外分光光度计检测其纯度和浓度,并使用琼脂糖凝胶电泳检测其完整性,检测合格后,使用All-in-One First-Strand Synthesis Master Mix(with dsDNase)试剂盒(广州欣凯莱生物技术有限公司)反转录成cDNA,合成好的cDNA置于-80 ℃冰箱中保存备用。
1.2.5 EGFR cDNA全长克隆 根据NCBI来源的EGFRX1基因片段序列(GenBank登录号NC_031982.2),设计9对引物F1~F9、R1~R9(表1),用以进行分段扩增。以健康尼罗罗非鱼脑组织cDNA为模板,扩增获取EGFR基因的序列。反应条件为95 ℃下预变性5 min,94 ℃下变性25 s,55 ℃下变性25 s,72 ℃下延伸15 s,共进行34个循环,72 ℃下再延伸5 min,经琼脂糖凝胶电泳检测合格后,送至广州天一辉远基因科技有限公司测序。利用序列拼接软件对PCR扩增得到的EGFR片段进行拼接及人工校对,获得EGFR cDNA全长序列。
1.2.6 生物信息学分析 将测序获得的mRNA序列在NCBI数据库进行Blast比对分析。采用DNAMAN软件对氨基酸序列进行多重比对分析;选取Ncbi中Blast比对相似度排名靠前的20种鱼类氨基酸序列,采用MEGA 11.0软件邻位相接法(Neighbor-Joining)构建系统进化树。蛋白的理化性质采用Expasy进行分析;信号肽预测采用SignalP 4.1 Server;采用TMHMM Server v.2.0分析跨膜区;蛋白结构域分析采用Smart。蛋白三级结构构建与分析利用SWISSM-MODEL。
1.2.7 实时荧光定量PCR 根据EGFR基因cDNA序列,利用NCBI primer-BLAST设计特异性引物EGFR-F和EGFR-R(表1)。以反转录的cDNA作为模板进行RT-qPCR,以EF-1α基因(Elongation Factor-1α)(表1)作为内参基因,设置3个生物学重复。PCR反应体系:SYBR混合试剂10 μL、ddH2O 8.2 μL、上下游引物各0.4 μL、cDNA模板1 μL。RT-qPCR程序为95 ℃下预变性30 s,95 ℃下变性10 s,56 ℃下退火10 s,72 ℃下延伸30 s,共进行40个循环。
表1 尼罗罗非鱼egfr cdna基因克隆所用引物
Tab.1 Primers used for the cloning of egfr cdna in tilapia

引物 primer序列 sequence(5'~3')用途 usageF1CAAGCCAGTAGTTTGTCCTCAEGFR cDNA 1~70 bp片段扩增R1GCTCCACCTCCTCTCAGATamplification of EGFR cDNA 1~70 bpF2GAGAGGAGGTGGAGCTGTCAAAEGFR cDNA 39~567 bp片段扩增R2AGCAGCTTGAGTCACATTTTCCamplification of EGFR cDNA 39~567 bpF3ACTGCACCGTAGTGTTGGAGEGFR cDNA 387~1 135 bp片段扩增R3CACACATGCGCCGTAATCAGamplification of EGFR cDNA 387~1 135 bpF4TGGCTCATGTTGGTCACCTGEGFR cDNA 799~2 292 bp片段扩增R4CTTGGAGTGAGGGGTTCGACamplification of EGFR cDNA 799~2 292 bpF5ACGATGCGCTAGTGTGGAAAEGFR cDNA 2 013~2 752 bp片段扩增R5TGCCAAGTCACGATGCACTAamplification ofEGFR cDNA 2 013~2 752 bpF6TGTGTGCAGATAGCCAAGGGEGFR cDNA 2 660~3 254 bp片段扩增R6ATTCATCAGCGTCCACAGCAamplification ofEGFR cDNA 2 660~3 254 bpF7GCCTCGTTTCCGAGAACTCAEGFR cDNA 3 127~4 406 bp片段扩增R7GCCGACTGTACATCCCCTACamplification of EGFR cDNA 3 127~4 406 bpF8TGTGTTGGTGGAGGAATGCTEGFR cDNA 4 188~4 839 bp片段扩增R8ATGACGCCGTTTTTGCTTGTamplification of EGFR cDNA 4 188~4 839 bpF9TGGAGACCCACAAAGCGAGAEGFR cDNA 4 685~5 402 bp片段扩增R9AAAGCTGTGAGTGGAACACCTTamplification of EGFR cDNA 4 685~5 402 bpEGFR-FGCCCGCTCCAGGCTACATART-qPCREGFR-RGGGAAGAAGGGTGCGAGGTRT-qPCREF-1α-senseGGAAATCCGTCGTGGATACGRT-qPCR内参基因EF-1α-antiseAAACTTGGGGCTGTCCTCAART-qPCR内参基因
1.2.8 EGFR表达质粒构建、重组蛋白诱导表达及多克隆抗体制备 将罗非鱼EGFR基因目的基因连接至pET-B2M载体中,构建重组质粒pET-B2M-EGFR,转入大肠杆菌TOP10感受态细胞,经链霉素(streptomycin,StrR)抗性筛选,挑取阳性菌落,并进行菌落PCR鉴定。将构建好的重组融合表达质粒pET-B2M-EGFR热激转化至Rosetta感受态细胞中,加入800 μL预热的LB液体培养基中,以158 r/min培养50 min,6 000 r/min离心4 min去上清,将剩余菌液涂布至含有卡那毒素的LB平板上,37 ℃下培养12 h。
挑取阳性单菌落接种至3 mL的LB培养液(含有AMP)中,于37 ℃培养至对数生长期,菌液的OD600 nm达到0.6。取部分菌液为对照组,余下菌液加入终浓度为1 mmol/L异丙基-β-D-硫代半苷(Isopropyl-beta-D-Thiogalactopyranoside,IPTG)诱导剂中,37 ℃下培养3 h,12 000 g离心2 min收集菌体,SDS-PAGE胶检测蛋白表达。
取100 μL成功诱导表达的菌液,将其接种200 mL液体培养基中,于37 ℃培养至OD600nm达到0.6,加入IPTG诱导剂至终浓度0.5 mmol/L,8 000 r/ min离心3 min,收集沉淀,用预冷过的NTA-0缓冲液(pH 8.0)重悬,置于冰浴中30 min,200 W超声破菌体,工作3 s,暂停4 s,时间25 min。在4 ℃下以16 000 r/min离心50 min,分别收集上清液和沉淀,并进行SDS-PAGE电泳检测。
根据凝胶电泳条带大小确定重组蛋白以包涵体形式存在,将沉淀进行包涵体蛋白纯化。以50 mL NTA-0缓冲液重悬,加入二硫苏糖醇(DL-Dithiothreitol,DTT)至终浓度1 mmol/L,超声参数设置为功率200 W,工作3 s,暂停3 s,时间10 min。破碎好的菌体在4 ℃下以10 000 r/min离心10 min去上清(重复3次直至透明),沉淀用PBS重悬超声破碎。4 ℃下以16 000 r/min离心10 min去上清。用3 mL 6 mol/L盐酸胍重悬包涵体,加入DTT至终浓度5 mmol/L,在37 ℃下以220 r/min震荡3 h至包涵体全部溶解,在4 ℃下以10 000 r/min离心10 min,取上清,进行浓度测定,之后送至武汉金开瑞制备兔抗EGFR多克隆抗体。
1.2.9 免疫荧光检测 依据“1.2.2节”步骤,尼罗罗非鱼人工感染无乳链球菌24 h后,分别从试验组和对照组随机各选取6尾鱼,采集鱼体中肠组织,并浸泡于4%多聚甲醛,固定24 h后进行常规脱水、浸蜡、包埋处理。将凝固后的蜡块从包埋框中取出并修整,使用石蜡切片机(RM2016,上海徕卡仪器有限公司)切至厚度为4 μm的组织切片。
依次将上述切片进行常规脱蜡、蒸馏水洗后,将切片置入浓度为10 mmol/L柠檬酸抗原修复液(pH 6.0)中进行抗原修复,放入微波炉(高火)中蒸煮5 min,待其自然冷却。将切片置于PBS(pH 7.4)中,通过脱色摇床上晃动洗涤5 min,设置3次重复。稍甩干切片后,用组化笔在组织周边画圈,滴加3%的BSA封闭30 min。之后向组织滴加稀释后的一抗(浓度为3.34 μg/mL),并将切片平放于湿盒内,4 ℃条件下孵育过夜。之后,把切片置于PBS(pH 7.4)中,在脱色摇床上晃动,洗涤3次,每次5 min。接着加入二抗Alexa Fluor 488标记的山羊抗兔IgG,避光室温孵育50 min。孵育完成后,再次将切片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。加入DAPI染液,避光室温孵育10 min后,加入抗荧光淬灭封片剂进行封片。利用荧光显微镜(Nikon Eclipse C1,日本尼康)和软件Aipathwell、slideview对组织中荧光阳性信号的定位进行拍照、分析。其中,阳性面积比和阳性面分布密度相关参数分析参照文献[11]和文献[12],阳性面积比=阳性面积/组织面积,反映阳性面积的多少;阳性面分布密度=累积光密度值/组织像素面积,反映待测量组织区域内阳性的平均深浅。
1.3 数据处理
EGFR基因在各组织中的相对表达量采用2-ΔΔCt法计算,同时利用GraphPad 8.0.2软件中的t检验对不同组基因表达水平进行差异显著性分析,显著性差异设为0.05。
2 结果与分析
2.1 EGFR基因序列分析
本试验扩增获得EGFR基因cDNA序列为5 405 bp (图1),开放阅读框为3 621 bp,可编码1 206个氨基酸,与NCBI EGFR基因DNA比对发现,EGFR基因包含28个外显子、27个内含子。且该基因含有3种不同的剪切异构体EGFRX1、EGFRX2和EGFRX3,比对发现,EGFRX1和EGFRX2虽均具有28个外显子及27个内含子,但EGFRX2相较于其他剪接体,在第12个外显子26 629 bp位置缺少3个碱基;而EGFRX3仅有16个外显子,15个内含子,与EGFRX1和EGFRX2相比,EGFRX3缺失了第17个外显子及其后的序列(图2)。通过PCR技术对EGFRX1基因的cDNA进行扩增,所获得的cDNA序列与NCBI预测序列的EGFRX1、EGFRX2、EGFRX3的结果一致性分别为100%、99.31%、99.38%。

大写字母表示氨基酸序列及ORF,小写字母表示非编码区;黑色方框内ATG、TGA分别表示起始密码子和终止密码子。
Capital letters represent amino acid sequence and the ORF,while lowercase letters indicate non-coding regions;the ATG and TGA within the black box represent the start codon and stop codon,respectively.
图1 EGFR基因cDNA序列及其编码的氨基酸序列
Fig.1 Nucleotide sequence and coding amino acid sequence of EGFR gene

图2 尼罗罗非鱼EGFRX1、EGFRX2、EGFRX3基因的基因组结构
Fig.2 Genomic structure of EGFRX1,EGFRX2,and EGFRX3 genes in O.niloticus
EGFR的3个转录本EGFRX1、EGFRX2、EGFRX3的序列组分及蛋白质的理化性质见表2。信号肽预测发现,EGFRX1、EGFRX2、EGFRX3基因均存在信号肽,且预测的信号肽区域切割位点均为35~36位氨基酸,不稳定系数分别为43.60、44.07、41.27,属于不稳定蛋白。
表2 egfrx1、egfrx2、egfrx3转录本理化性质分析
Tab.2 Analysis of physicochemical properties of egfrx1,egfrx2,and egfrx3 transcripts
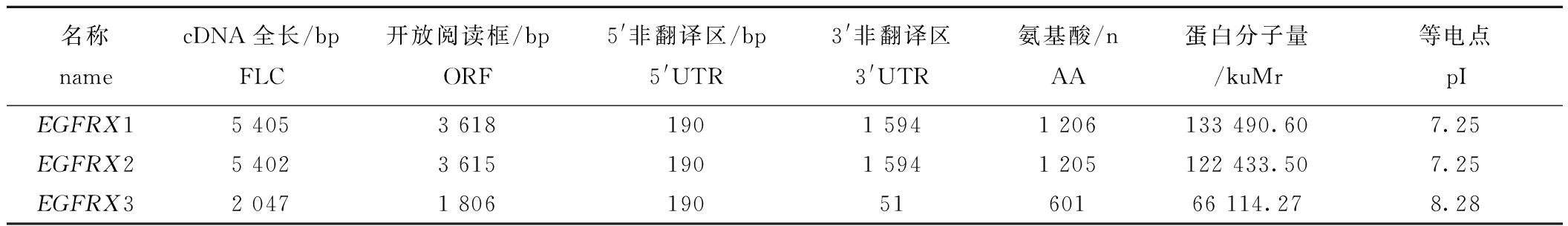
名称namecDNA全长/bpFLC开放阅读框/bpORF5'非翻译区/bp5'UTR3'非翻译区3'UTR氨基酸/nAA蛋白分子量/kuMr等电点pIEGFRX15 4053 6181901 5941 206133 490.607.25EGFRX25 4023 6151901 5941 205122 433.507.25EGFRX32 0471 8061905160166 114.278.28
通过Smart分析发现,EGFRX1和EGFRX2基因均含有1个跨膜结构域,而EGFRX3无跨膜结构域。EGFRX1、EGFRX2、EGFRX3的蛋白结构中均存在FU结构域,其中EGFRX1和EGFRX2含有5个FU结构域,1个LCD结构域,以及1个TyrKc结构域;EGFRX3含有4个FU结构域(图3)。
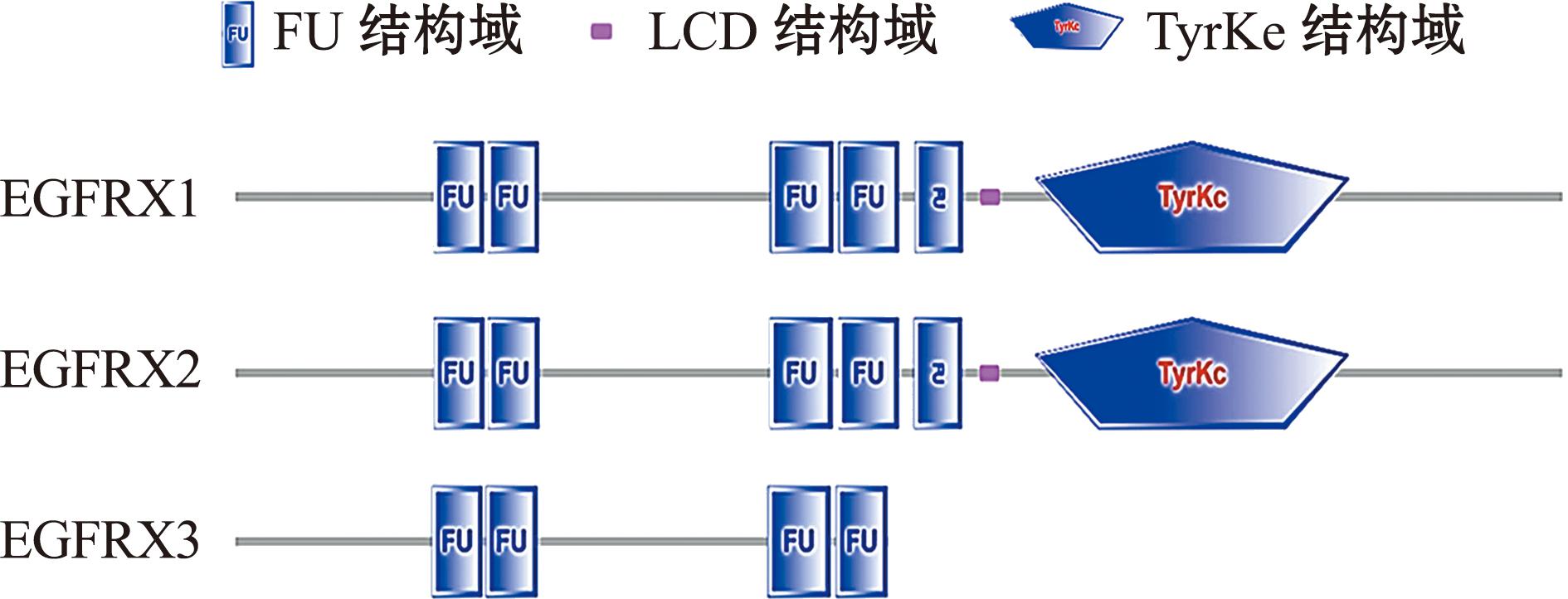
图3 EGFRX1、EGFRX2、EGFRX3蛋白结构域分析
Fig.3 Protein domain analysis of EGFRX1,EGFRX2,and EGFRX3
2.2 EGFRX1、EGFRX2、EGFRX3氨基酸序列同源比对及系统进化树
尼罗罗非鱼EGFRX1、EGFRX2、EGFRX3氨基酸序列同源比对显示:罗非鱼EGFRX1、EGFRX2、EGFRX3的氨基酸序列之间一致性为77.86%;本文扩增获得的EGFR与奥利亚罗非鱼(Oreochromis aureus)EGFR氨基酸一致性为99.42%,与布氏新灿鲷(Neolamprologus brichardi)一致性为98.51%,与斑马鱼一致性为71.15%,与草鱼(Ctenopharyngodon idella)一致性为72.41%,其他与非洲爪蛙(Xenopus laevis)、鸡(Gallus gallus)、人(Homo sapiens)、鲨鱼(Carcharodon carcharias)、蜥蜴(Zootoca vivipara),以及小鼠(Mus musculus)EGFR氨基酸一致性分别为60.2%~63.27%(表3)。系统进化分析发现,尼罗罗非鱼EGFR与慈鲷科鱼类EGFR基因亲缘关系较近,聚类为一大支,与奥利亚罗非鱼最为接近,聚类为一小支(图4)。
表3 尼罗罗非鱼egfrx1与其他物种egfr氨基酸序列的相似性分析
Tab.3 Similarity analysis of the amino acid sequence of egfrx1 in O.niloticus with egfr in other species
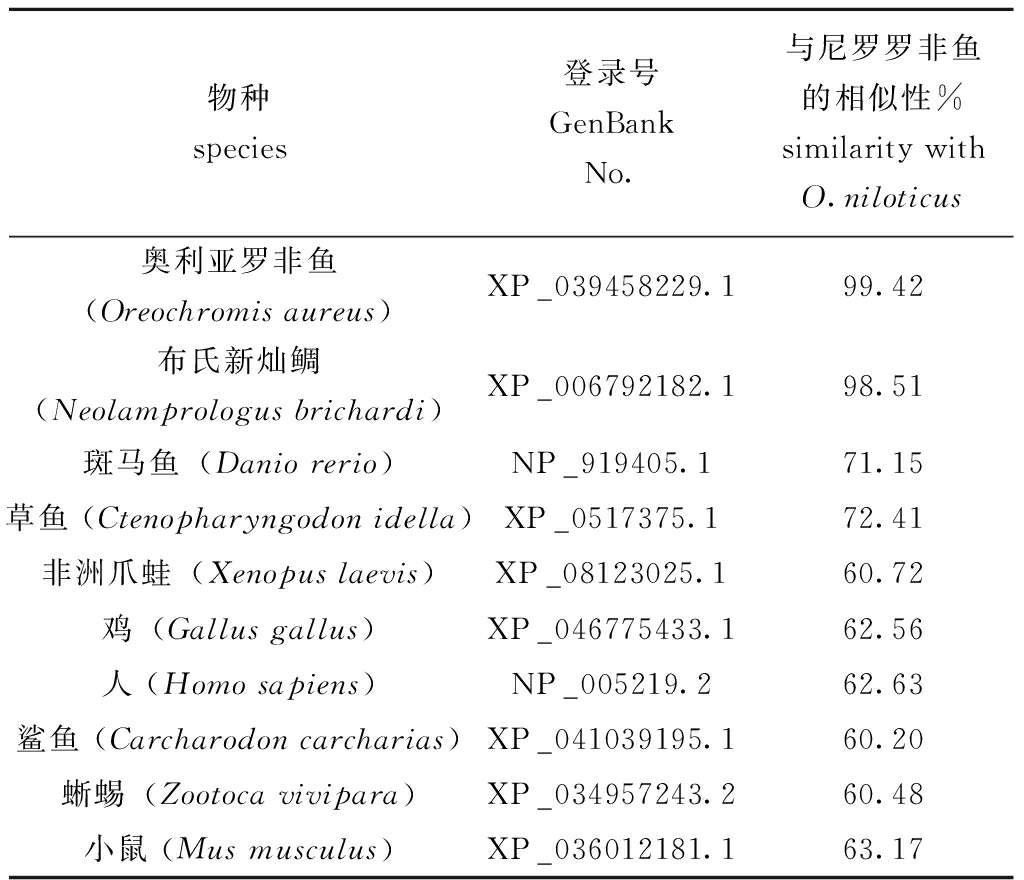
物种species登录号GenBank No.与尼罗罗非鱼的相似性%similarity with O.niloticus奥利亚罗非鱼(Oreochromis aureus)XP_039458229.199.42布氏新灿鲷(Neolamprologus brichardi)XP_006792182.198.51斑马鱼(Danio rerio)NP_919405.171.15草鱼 (Ctenopharyngodon idella)XP_0517375.172.41非洲爪蛙(Xenopus laevis)XP_08123025.160.72鸡(Gallus gallus)XP_046775433.162.56人 (Homo sapiens)NP_005219.262.63鲨鱼 (Carcharodon carcharias)XP_041039195.160.20蜥蜴(Zootoca vivipara)XP_034957243.260.48小鼠 (Mus musculus)XP_036012181.163.17
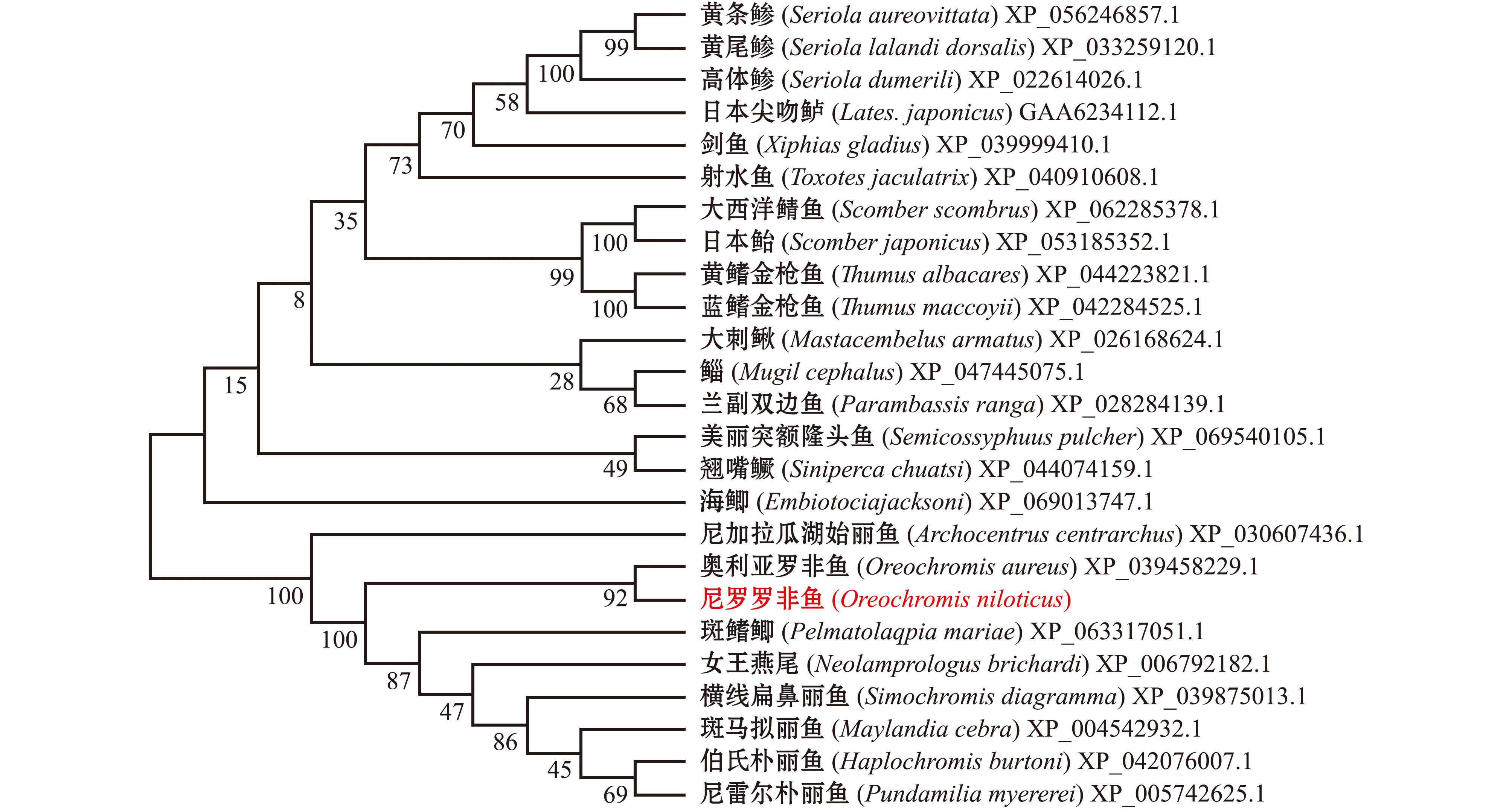
图4 尼罗罗非鱼与其他鱼类EGFR氨基酸序列的NJ系统进化分析
Fig.4 Neighbor-Joining phylogenetic analysis of the EGFR amino acid sequences among O.niloticus and other fish species
2.3 罗非鱼EGFR组织表达分布
EGFR在健康尼罗罗非鱼不同组织中的表达分布模式如图5所示,该基因在罗非鱼脑、心脏、中肾、肠道、胃、皮肤、鳃、脾脏及肌肉9个组织中均有表达。其中,皮肤表达量最高,其次是肌肉、肠道、胃和脾脏等,在肝和血液中表达量最低。

标有不同字母者表示组织间有显著性差异(P<0.05),标有相同字母者表示组织间无显著性差异(P>0.05)。
The means with different letters are significantly different among tissues at the 0.05 probability level,and the means with the same letters are not significant differences.
图5 EGFR基因在健康罗非鱼不同组织中的表达分布
Fig.5 EGFR gene expression distribution in different tissues of healthy O.niloticus
2.4 罗非鱼人工感染无乳链球菌后EGFR基因的表达变化
进一步研究EGFR基因在罗非鱼黏膜和免疫器官中的表达变化发现,罗非鱼人工腹腔感染无乳链球菌8、24、48、72、96 h,EGFR基因在鳃、肾、肠、脾、肝均有不同程度的表达变化(图6)。与对照组相比,脾脏组织EGFR基因8~96 h的表达量显著降低(P<0.05);鳃和肾组织中,EGFR基因8~96 h表达水平均无显著性差异;而在感染无乳链球菌后24 h的肝和肠组织中,EGFR基因表达量显著升高,且具有极显著性差异(P<0.01)。
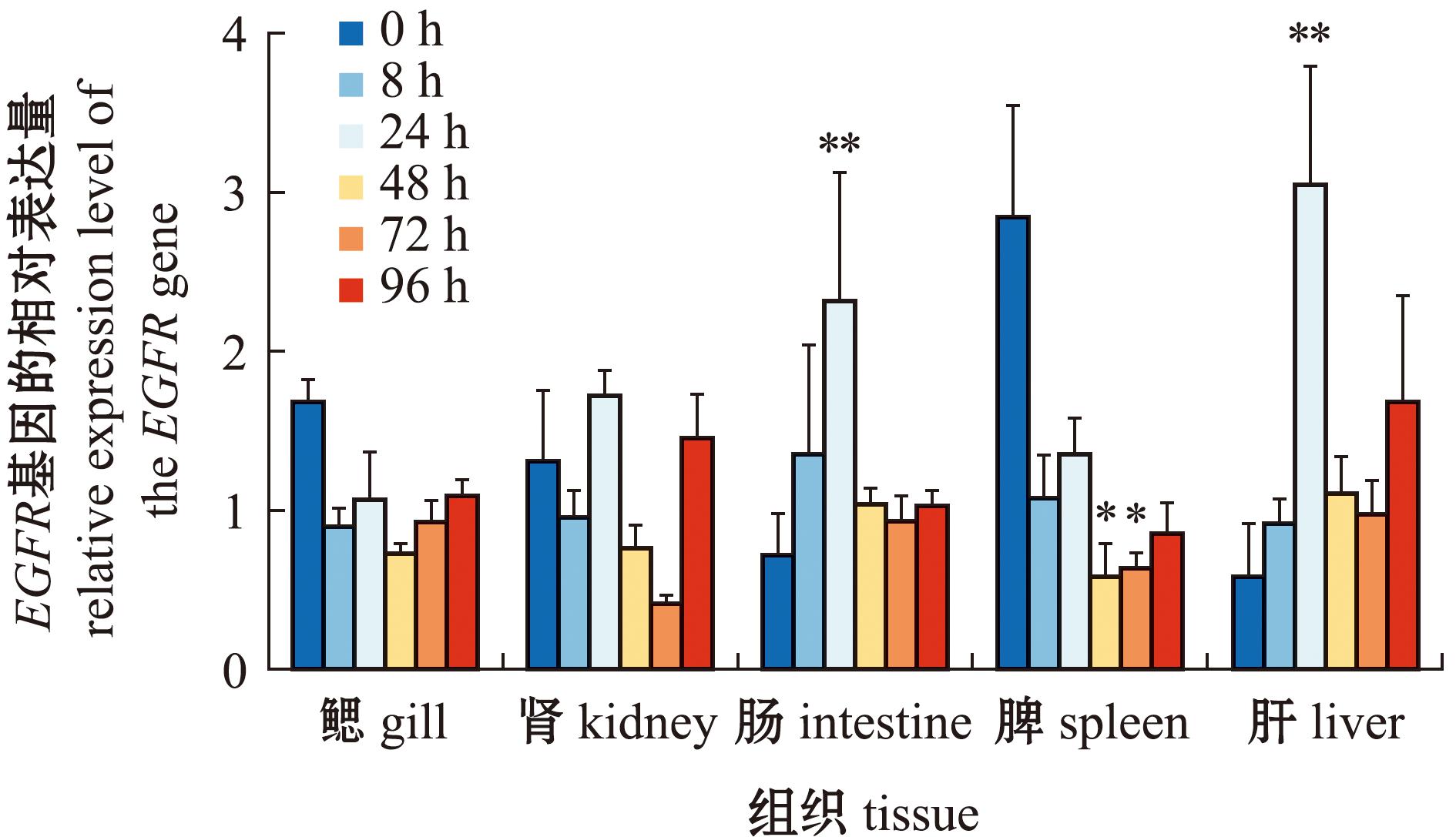
*表示显著性差异(P<0.05);**表示极显著性差异(P<0.01),下同。
*means significant difference (P<0.05);**means very significant difference(P<0.01),et sequentia.
图6 感染无乳链球菌前后EGFR基因在罗非鱼组织的表达变化
Fig.6 Expression changes of EGFR gene in O.niloticus tissues before and after Streptococcus agalactiae infected
2.5 LPS刺激后罗非鱼EGFR基因的组织表达变化
从图7可见,经LPS刺激后,在0、8、24、48、72 h,尼罗罗非鱼EGFR基因的表达量在肠、脾、肾和鳃组织中不同时间点虽有波动变化,但均无显著性差异(P>0.05)。

图7 LPS刺激后罗非鱼EGFR基因在不同组织的表达变化
Fig.7 Expression changes of EGFR gene in different O.niloticus tissues after LPS stimulation
2.6 Poly I∶C刺激后罗非鱼EGFR基因的组织表达变化
经Poly I∶C刺激后,在0、8、24、48、72 h,尼罗罗非鱼肾组织中EGFR的表达水平呈先下降后上升的趋势,但各时间点间均无显著性差异(图8)。肠组织中,经Poly I∶C刺激后,EGFR表达量显著上调,且在8 h时达到峰值。在鳃组织中,经Poly I∶C刺激后,EGFR基因表达量呈先上升(8 h)再下降(24~48 h)再上升趋势(72 h),其中8 h上升水平与对照组相比,具有显著性差异(P<0.05),72 h上升水平与对照组相比,具有极显著性差异(P<0.01)。脾组织中EGFR的表达量变化趋势与鳃组织相似。
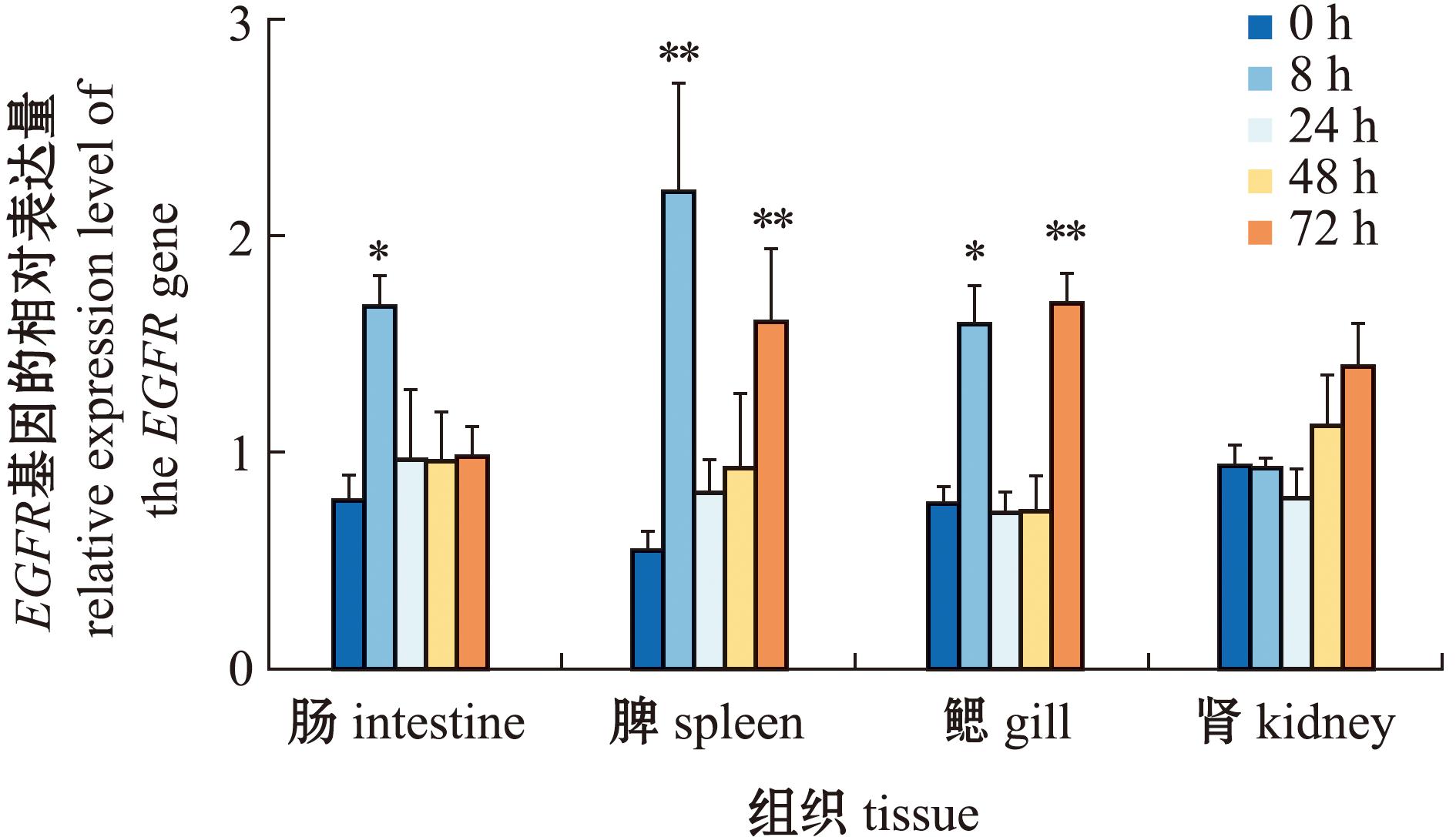
图8 Poly I∶C刺激后罗非鱼EGFR基因在不同组织不同时间的表达变化
Fig.8 Expression change of EGFR in different O.niloticus tissues at different time after Poly I∶C stimulation
2.7 重组EGFR蛋白和抗体Western blot验证
经SDS-PAGE电泳结果显示,EGFR重组表达蛋白62 000位置(标签蛋白为17 000),与预期表达蛋白大小一致(图9A)。与重组抗原Western blot检测显示在约62 000处有特异性识别,与预期信号相符(图9B)。
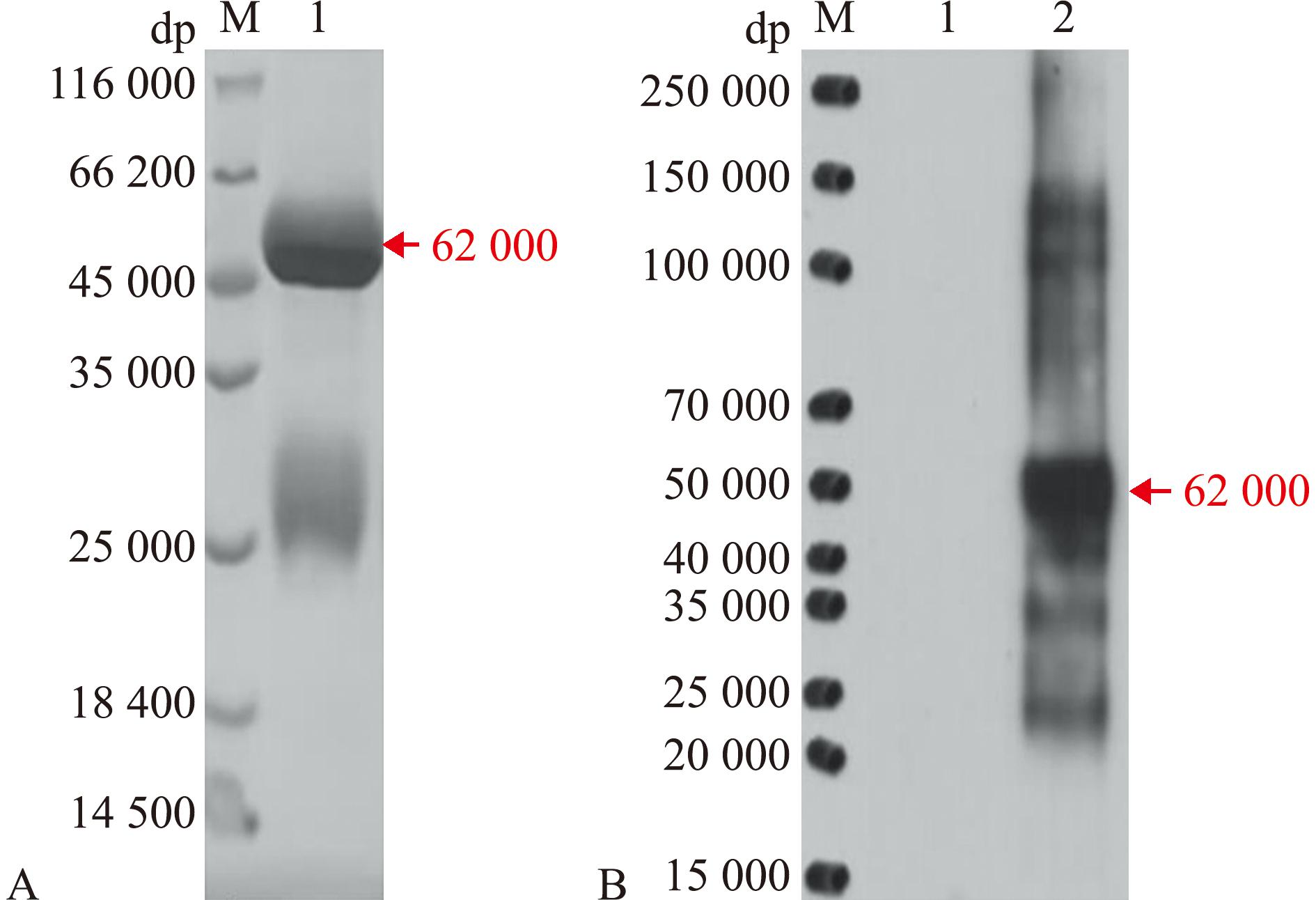
图A中1—重组EGFR蛋白兔纯化抗体4倍稀释。图B中1—重组EGFR蛋白50 ng与2 μg/mL免前抗体孵育;2—重组蛋白EGFR50 ng与兔抗体2 μg/mL孵育。M—蛋白质分子量标准。
A 1—4x diluted purified rabbit antibody against EGFR.B 1—50 ng of EGFR incubated with 2 μg/mL of pre-immunization antibody;2—50 ng of EGFR incubated with 2 μg/mL of rabbit antibody.M—protein molecular weight standards.
图9 Western blot分析EGFR多克隆抗体特异性
Fig.9 Western blot analysis of EGFR polyclonal antibody specificity
2.8 EGFR蛋白在肠组织的免疫荧光定位分析
2.8.1 EGFR蛋白在罗非鱼肠道组织中的定位分析 免疫荧光检测发现,在健康的尼罗罗非鱼肠中,EGFR蛋白在浆膜层、肌肉层、黏膜下层和黏膜层均有阳性表达,且浆膜层与肌肉层EGFR蛋白分布的阳性面积比和分布密度存在显著性差异(P<0.05),其中肌肉层的阳性面积比(58.11%)和分布密度(0.065 8)更大,浆膜层的阳性面积比为32.94%,分布密度为0.039 3。此外,EGFR蛋白在健康罗非鱼肠道黏膜下层和黏膜层的分布密度和阳性面积比无显著性差异。
人工腹腔感染无乳链球菌24 h后,与对照组相比,尼罗罗非鱼肠道浆膜层中的EGFR蛋白分布密度和阳性面积比呈显著上升趋势(P<0.05),而肌肉层、黏膜下层和黏膜层的EGFR蛋白分布密度和面积比则无显著性变化(图10)。
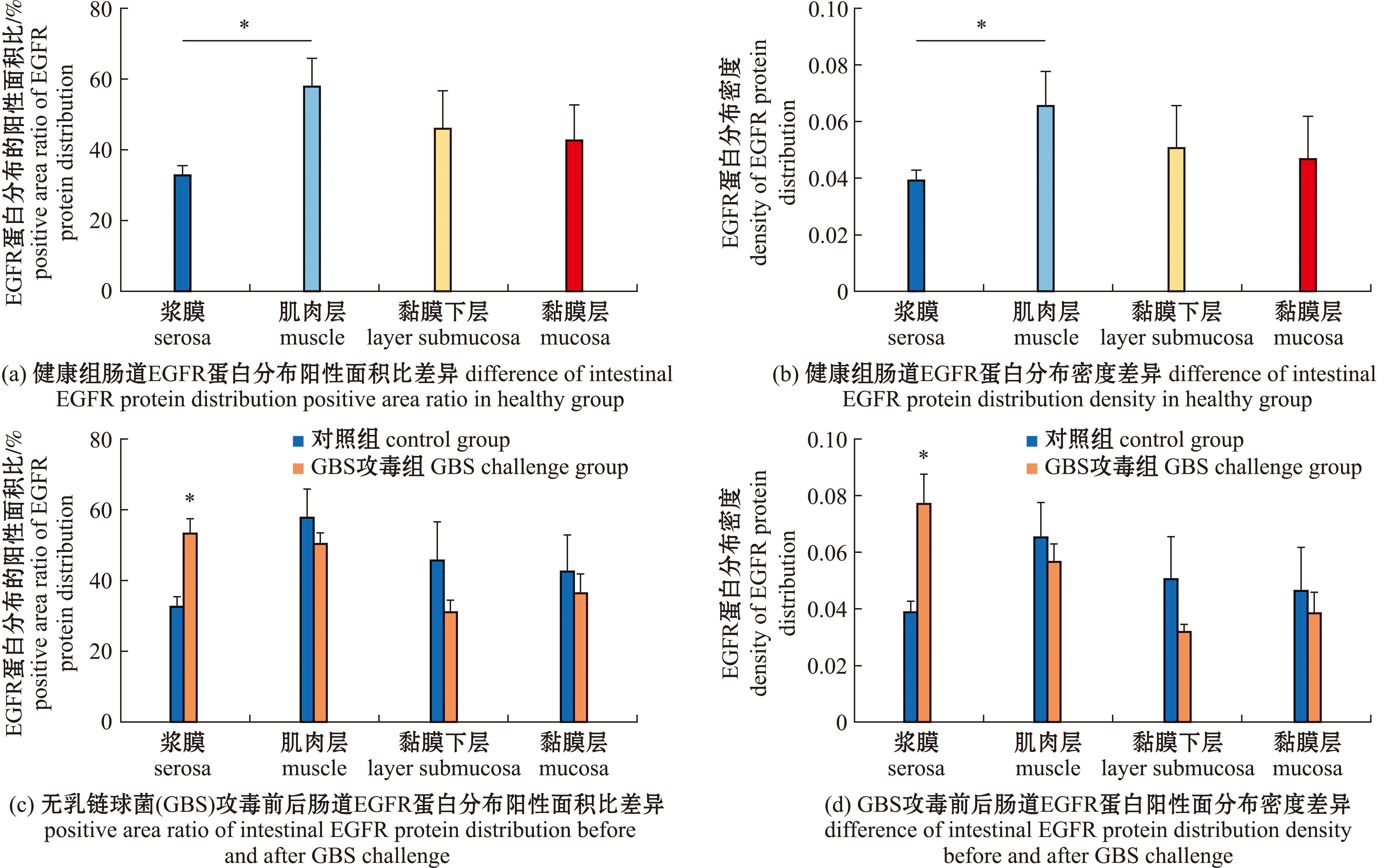
图10 EGFR蛋白在罗非鱼肠道不同组织层的阳性面积比和密度差异
Fig.10 Positive area ratio and density variation of EGFR protein in different intestinal tissue layers of O.niloticus
2.8.2 EGFR蛋白在罗非鱼肠道组织细胞水平的表达变化 免疫荧光检测发现,EGFR蛋白在对照组和攻毒24 h后的罗非鱼肠壁的不同层次结构中均有表达,从图11可见,其中浆膜层(s)单层扁平上皮细胞、结缔组织,肌肉层(m)外纵肌层、内环肌层肌细胞等,黏膜下层(sm)疏松结缔组织,黏膜层(mu)中的柱状上皮细胞、杯状细胞等均有明显表达信号,其中攻毒后鱼体肠道组织黏膜层的杯状细胞显著增多,EGFR蛋白在杯状细胞内的阳性表达与对照组相比相对增强。
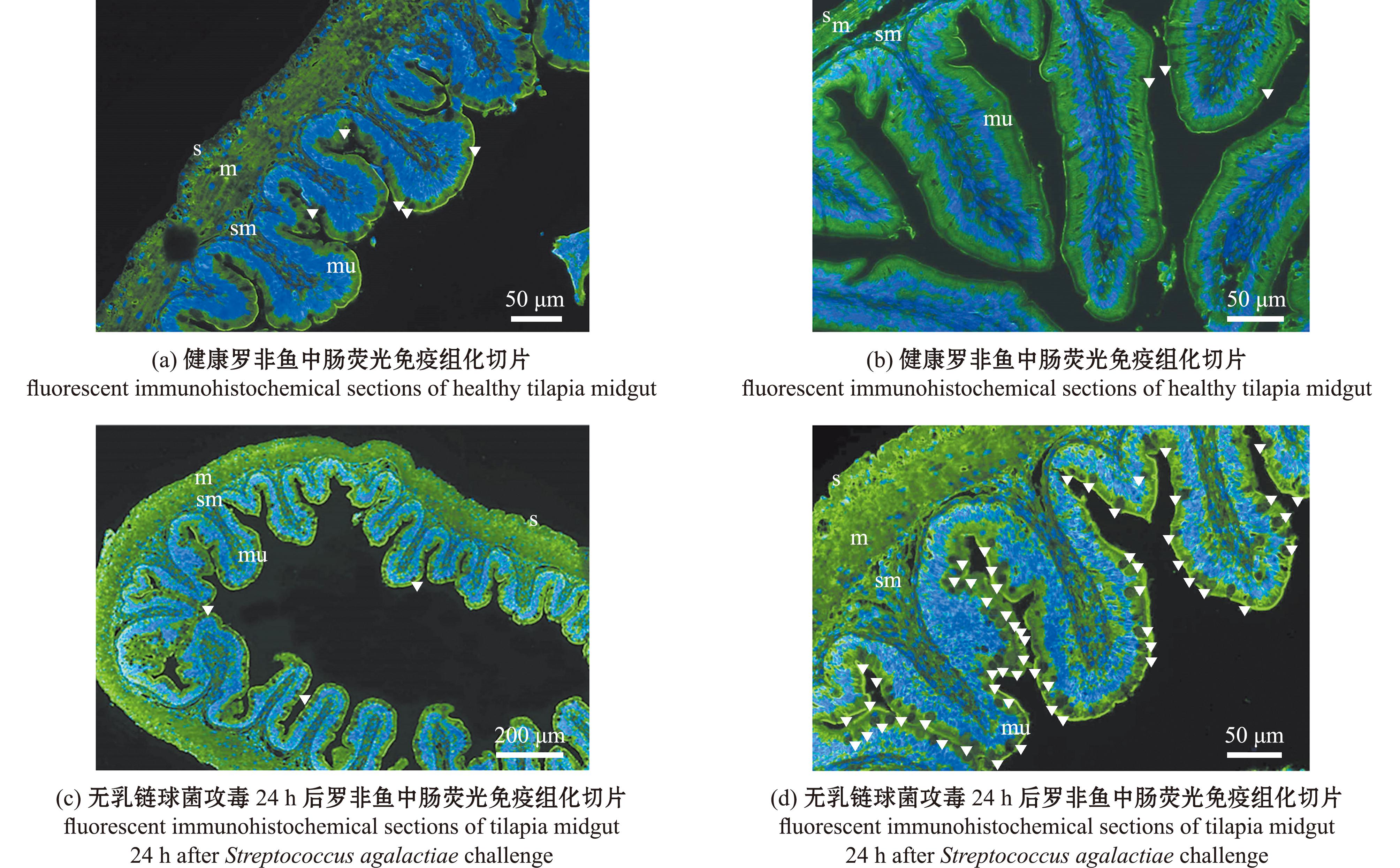
s—浆膜层;m—肌肉层;sm—黏膜下层;mu—黏膜层;箭头所指为杯状细胞。
s—serosa layer;m—muscular layer;sm—submucosa;mu—mucous layer;The arrows point to goblet cells.
图11 EGFR蛋白在罗非鱼中肠组织的阳性表达分布
Fig.11 Positive expression distribution of EGFR protein in the midgut tissue of O.niloticus
3 讨论
3.1 尼罗罗非鱼EGFR基因的序列分析
尼罗罗非鱼EGFR的cDNA序列全长5 405 bp,可编码氨基酸1 206个,与NCBI预测序列EGFRX1一致。对其3个不同剪接体比较分析后发现,EGFRX2基因缺少3个碱基,EGFRX3基因从第17个外显子开始缺失,这表明EGFR不同剪切体可能存在功能差异。同源性分析显示,尼罗罗非鱼EGFR与鱼类的一致性为65%以上,与哺乳类一致性超过56%,与两栖类一致性在55%以上,说明EGFR基因在进化过程具有较强保守性。系统进化分析发现,尼罗罗非鱼EGFR与慈鲷科鱼类聚为一大支,其中与奥利亚罗非鱼的亲缘关系最为密切。
结构域分析显示,EGFR蛋白具有跨膜结构且存在信号肽序列,EGFRX1含有5个FU结构域,1个low complexity结构域,1个TyrKc结构域。研究发现,半胱氨酸富集区域能识别氨基酸序列的特异性,能够激活重要的多肽和蛋白前体[13],并参与酪氨酸激酶受体信号转导。而酪氨酸蛋白激酶可以将磷酸基团从ATP转移至酪氨酸残基上,进而在细胞的生长、分化、代谢、增殖及存活中发挥重要作用。
3.2 尼罗罗非鱼EGFR基因组织表达及分布特性
目前,鱼类EGFR基因的相关研究报道较为缺乏,本研究中发现,EGFR基因在健康尼罗罗非鱼鳃、脑、肠、皮肤、肝、脾、肾、肌肉、心脏、血液、胃等11个组织均有表达,其中皮肤中表达量最高。其他物种如刺参(Apostichopus japonicus)研究中发现,其表皮EGFR基因的表达量也显著高于其他组织[14],其次人类皮肤中EGFR基因同样呈现高表达水平[15],推测这可能与EGFR基因参与皮肤生长发育、功能结构维持及创伤修复有关[15-16]。此外,EGFR基因在罗非鱼肌肉和肠道中表达水平仅次于皮肤,处于次高表达水平,这与斑马鱼中肌肉EGFR表达结果一致[17]。EGFR基因在人类心脏、脑、鳃、脾、肾等器官中均有表达,且参与包括神经系统在内的各种组织和器官的生长、分化、维持和修复[18]。人类除造血系统外[19],EGFR在其他组织中的表达较为丰富,与本研究结果一致。
人工腹腔感染无乳链球菌后,鱼体肠道EGFR基因表达量在感染后24 h显著上调并达到峰值。肠道上皮细胞具有免疫调节、分泌激素和黏膜屏障功能,在肠黏膜免疫应答中发挥关键作用[20-21],EGFR的上调表达可加快结肠黏膜的修复,恢复肠上皮屏障功能,减少黏膜上皮直接接触肠腔内各种抗原,减轻炎症反应,促进肠黏膜上皮细胞增殖,从而修复黏膜损伤[22]。此外,EGFR是TNF调控的肠上皮细胞抗凋亡信号的关键介质之一,EGFR介导的环氧合酶-2(COX-2)对肠上皮损伤后的修复等也具有重要作用[23-25]。
肝脏是无乳链球菌感染罗非鱼的关键靶器官之一,尼罗罗非鱼在感染无乳链球菌24 h后,其肝脏中的EGFR表达量显著上调。研究表明,EGFR与EGF配体结合后,能够促进宿主肝细胞DNA合成和增殖,加速肝组织损伤后的再生和修复[26]。大鼠腹腔注射苯比芘后,肝脏出现炎性浸润,免疫荧光显示大鼠肝脏中EGFR表达增强[27]。这与本研究中罗非鱼感染无乳链球菌后,鱼体肝脏在24 h时EGFR表达显著上升的结果一致。
LPS是革兰氏阴性菌保守的分子结构,属于病原体相关分子模式(pathogen-associated molecular patterns,PAMP)[28],宿主免疫系统可通过识别不同PAMP的分子结构来发挥作用。有研究表明,LPS刺激48 h后,人晶状体上皮细胞中EGFR的表达显著上升[29]。而下调小鼠EGFR的表达,则会降低TLR4响应LPS激活NF-kB的能力[30]。本研究中,尼罗罗非鱼经LPS刺激后,其肠、鳃、肾和脾等组织中EGFR的表达量未见显著性差异。推测可能是因为相对于易感的革兰氏阳性无乳链球菌,LPS对罗非鱼各组织表皮细胞的刺激相对较弱。
Poly I∶C[31]是一种具有双链RNA结构的免疫刺激剂[32],能够被细胞的模式识别受体识别,从而激活免疫反应。在Poly I∶C刺激试验中,鱼体肠道的EGFR表达量在刺激8 h时先升高,随后呈降低趋势。研究表明,Poly I∶C可刺激肠上皮细胞产生肠道干细胞的EGFR配体,进而促进肠道上皮细胞的损伤修复[33]。在鳃组织Poly I∶C刺激试验中,EGFR表达量在0~48 h呈先升高后降低趋势,而在72 h时再次显著上调并达到峰值。在本文中,脾脏的EGFR表达趋势与鳃组织一致。脾脏是鱼类重要的免疫器官,研究发现,大口黑鲈(Micropterus salmoides)注射Gefitinib(EGFR酪氨酸激酶抑制剂)后,在腹腔注射感染传染性脾肾坏死病毒(ISKNV),其脾脏中ISKNV的病理变化相较对照组症状相对较轻[34],罗非鱼和大口黑鲈同属鲈形目,因此推测罗非鱼的EGFR基因表达可能与脾脏组织的免疫修复相关。
此外,EGFR可诱导调节病原体的入侵,酪氨酸激酶能够将细胞外的信号转化为细胞内的信号,激活PI3K(磷脂酰肌醇3激酶),进而启动PI3K-AKT信号通路,这是细胞侵袭的重要途径。抑制EGFR/PI3K信号转导和细胞骨架反应,可阻断无乳链球菌的感染,降低其在体内的致病性[34]。上述结果表明,罗非鱼的EGFR基因表达参与调控病原感染的免疫应答。
3.3 尼罗罗非鱼EGFR蛋白肠道分布定位分析
无乳链球菌感染可进入罗非鱼胃肠的上皮细胞和固有层巨噬细胞[35],在本研究中,通过EGFR蛋白组织细胞定位检测发现,与健康组相比,罗非鱼感染无乳链球菌24 h后,其肠道EGFR蛋白在浆膜层的阳性面积比显著上升,而黏膜层、黏膜下层和肌肉层感染前后的差异并不明显。研究表明,在断奶21 d的普通家兔(Oryctolagus cuniculus)中,其浆膜层中EGFR的表达强度高于断奶35 d的家兔[36]。此外,EGFR能够被多种配体激活,包括表皮生长因子(EGF)、转化生长因子(TGF)-α、双调蛋白、β细胞素和表皮调节蛋白等。通过EGFR信号通路的激活,可使上皮细胞分化为产生黏蛋白的杯状细胞[37]。本研究中也发现,罗非鱼感染无乳链球菌后,其肠道黏膜层杯状细胞显著增多。研究表明,EGFR在胎儿小肠黏膜上皮细胞、黏膜下层血管内皮细胞、浆膜上皮细胞的胞浆,以及胞外基质中均有分布[38]。EGFR的激活能够促使杯状细胞产生黏蛋白[39]。杯状细胞分泌的黏蛋白会形成黏液层,将腔内物质与肠上皮隔开来,从而在肠黏膜中起到屏障作用,防止病原微生物的侵入。
肠道黏膜层的上皮层主要由柱状细胞构成,这些柱状细胞产生的糖蛋白能够在微绒毛表面形成细胞衣,细胞衣中的糖蛋白与脂质对肠上皮细胞具有保护作用[40],并通过形成机械屏障发挥功能。罗非鱼肠道的柱状细胞主要以分泌功能为主,能够分泌消化酶等物质,从而对食物进行消化[41]。在自然感染条件下,无乳链球菌入侵罗非鱼体内主要是通过胃肠道途径,细菌能够穿透肠和胃的黏液层,并最终黏附、定植和侵入胃肠道上皮[35]。本研究中发现,EGFR蛋白在罗非鱼肠道的杯状细胞、柱状细胞中均有表达,这表明EGFR蛋白的表达与肠道黏膜相关免疫功能的发挥密切相关。
4 结论
1)克隆获得罗非鱼EGFR基因cDNA全长为5 405 bp,开放阅读框3 621 bp,可编码1 206个氨基酸,对其3个不同剪接体比较分析后发现,EGFRX2缺少3个碱基,EGFRX3基因从第17个外显子处开始缺失,表明EGFR不同剪切体可能存在功能差异。
2)经无乳链球菌感染后,尼罗罗非鱼脾表达量显著降低(P<0.05);肠、肝脏24 h表达量显著升高(P<0.05);Ploy I∶C刺激后,肠组织表达量显著升高,8 h达峰值。鳃、脾EGFR基因表达量均呈先上升后下降再上升趋势,表明EGFR基因的表达与罗非鱼黏膜免疫功能相关。
3)EGFR蛋白在尼罗罗非鱼中肠浆膜、黏膜层、黏膜下层及肌肉层广泛分布,其中肌肉层阳性面积占比及分布密度显著高于浆膜层。无乳链球菌攻毒后,鱼体浆膜层EGFR蛋白分布密度显著上升(P<0.05),黏膜层杯状细胞数量增加,表明罗非鱼EGFR可能通过促进黏液分泌来促进肠道屏障修复。
[1] 包特力根白乙.中国罗非鱼养殖产业发展及市场前景[J].安徽农业科学,2014,42(33):11956-11958.BAO T.The development and market prospects of Tilapia aquaculture industry in China[J].Journal of Anhui Agricultural Sciences,2014,42(33):11956-11958.(in Chinese)
[2] 卢迈新.罗非鱼链球菌病研究进展[J].南方水产,2010,6(1):75-79.LU M X.Review of research onstreptococcosis in Tilapia[J].South China Fisheries Science,2010,6(1):75-79.(in Chinese)
[3] 张美燕,朱伟娟,刘志刚,等.罗非鱼感染无乳链球菌前后血浆蛋白组学的差异表达分析[J].大连海洋大学学报,2024,39(4):559-567.ZHANG M Y,ZHU W J,LIU Z G,et al.Differential expression analysis of plasma proteomics in Nile Tilapia(GIFT) before and after infection with Streptococcus agalactiae[J].Journal of Dalian Ocean University,2024,39(4):559-567.(in Chinese)
[4] 柏素云,王蔚林,李冠武,等.EGFR-STAT3信号转导通路与肿瘤[J].肿瘤防治杂志,2004,11(9):989-991.BAI S Y,WANG W L,LI G W,et al.EGFR-STAT3 signaling pathway and tumor[J].Journal of Qilu Oncology,2004,11(9):989-991.(in Chinese)
[5] DUTTA P R,MAITY A.Cellular responses to EGFR inhibitors and their relevance to cancer therapy[J].Cancer Letters,2007,254(2):165-177.
[6] ODA K,MATSUOKA Y,FUNAHASHI A,et al.A comprehensive pathway map of epidermal growth factor receptor signaling[J].Molecular Systems Biology,2005,1:2005.0010.
[7] 褚晗,于德新.EGFR在肾癌中的研究进展[J].临床泌尿外科杂志,2012,27(11):873-876.CHU H,YU D X.Research progress of EGFR in renal cell carcinoma[J].Journal of Clinical Urology,2012,27(11):873-876.(in Chinese)
[8] 卫侃韵.缢蛏EGFR基因表达特征及促生长功能初探[D].上海:上海海洋大学,2018.WEI K Y.Expression characteristics of EGFR gene in Sinonovacula sinonovacula and its growth-promoting function[D].Shanghai:Shanghai Ocean University,2018.(in Chinese)
[9] SO J,KIM M,LEE S H,et al.Attenuating the epidermal growth factor receptor-extracellular signal-regulated kinase-sex-determining region Y-box 9 axis promotes liver progenitor cell-mediated liver regeneration in zebrafish[J].Hepatology,2021,73(4):1494-1508.
[10] 张德锋,卢迈新,可小丽,等.一种无乳链球菌WC1535△cps及其构建和应用:CN107603933A[P].2018-01-19.ZHANG D F,LU M X,KE X L,et al.A Streptococcus agalactiae WC1535△cps and its construction and application: CN107603933A[P].2018-01-19.
[11] MEI S Y,XU Q Y,HU Y,et al.Integrin β3-PKM2 pathway-mediated aerobic glycolysis contributes to mechanical ventilation-induced pulmonary fibrosis[J].Theranostics,2022,12(14):6057-6068.
[12] LUO W,AI L,WANG B F,et al.High glucose inhibits myogenesis and induces insulin resistance by down-regulating AKT signaling[J].Biomedicine &Pharmacotherapy,2019,120:109498.
[13] 王涛,赵晶,杨安钢.弗林蛋白酶:一种广泛参与前体蛋白切割的内切蛋白酶[J].医学分子生物学杂志,2006,28(3):202-205.WANG T,ZHAO J,YANG A G.Furin:an endoprotease involved in processing of A wide variety of precursor proteins[J].Journal of Medical Molecular Biology,2006,28(3):202-205.(in Chinese)
[14] 李霞,王雪,秦艳杰,等.仿刺参EGFR基因的克隆与表达分析[J].水产学报,2012,36(1):41-49.LI X,WANG X,QIN Y J,et al.Cloning and expression analysis of the EGFR gene in Apostichopus japonicus[J].Journal of Fisheries of China,2012,36(1):41-49.(in Chinese)
[15] 陈伟,付小兵,孙同柱,等.表皮细胞生长因子及其受体在胎儿皮肤组织内的表达特征及其意义[J].中国临床康复,2002,6(8):1128-1129,1236.CHEN W,FU X B,SUN T Z,et al.The expression characteristics and their biological significance of epidermal growth factor and its receptor in fetal and postnatal skins[J].Modern Rehabilitation,2002,6(8):1128-1129,1236.(in Chinese)
[16] SUN L L,HUAN P,WANG H X,et al.An EGFR gene of the Pacific oyster Crassostrea gigas functions in wound healing and promotes cell proliferation[J].Molecular Biology Reports,2014,41(5):2757-2765.
[17] WANG Y J,GE W.Cloning of epidermal growth factor (EGF) and EGF receptor from the zebrafish ovary:evidence for EGF as a potential paracrine factor from the oocyte to regulate activin/follistatin system in the follicle cells[J].Biology of Reproduction,2004,71(3):749-760.
[18] ROMANO R,BUCCI C.Role of EGFR in the nervous system[J].Cells,2020,9(8):1887.
[19] 孟庆祥.表皮生长因子受体研究进展[J].国外医学输血及血液学分册,1999,22(1):34-37.MENG Q X.Research progress in epidermal growth factor receptor[J].Foreign Medical Sciences Blood Transfusion and Hematology,1999,22(1):34-37.(in Chinese)
[20] 罗伟,甘西,朱佳杰,等.无乳链球菌感染吉富品系尼罗罗非鱼的病理学研究[J].南方农业学报,2018,49(2):375-382.LUO W,GAN X,ZHU J J,et al.Pathological research of GIFT Tilapia infected by Streptococcus agalactiae[J].Journal of Southern Agriculture,2018,49(2):375-382.(in Chinese)
[21] 尚沁沁,李雅丽,史艳云,等.益生菌对动物肠上皮细胞免疫功能的研究进展[J].中国畜牧杂志,2014,50(13):87-90.SHANG Q Q,LI Y L,SHI Y Y,et al.Research progress on probiotics for the immune function of intestinal epithelial cells in animal[J].Chinese Journal of Animal Science,2014,50(13):87-90.(in Chinese)
[22] 滑永志,王志刚,陆敏,等.达康灌肠方对溃疡性结肠炎大鼠肠黏膜HGF、c-Met、EGFR及PCNA表达的影响[J].上海中医药杂志,2015,49(3):72-75,84.HUA Y Z,WANG Z G,LU M,et al.“Dakang Formula” on expressions of HGF,c-Met,EGFR and PCNA in rats with ulcerative colitis[J].Shanghai Journal of Traditional Chinese Medicine,2015,49(3):72-75,84.(in Chinese)
[23] YAMAOKA T,YAN F,CAO H W,et al.Transactivation of EGF receptor and ErbB2 protects intestinal epithelial cells from TNF-induced apoptosis[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(33):11772-11777.
[24] 陆宁.巨噬细胞中表皮生长因子受体激活对细胞因子及实验性结肠炎的调节作用[D].天津:天津医科大学,2014.LU N.Regulation of epidermal growth factor receptor activation in macrophages on cytokines and experimental colitis[D].Tianjin:Tianjin Medical University,2014.(in Chinese)
[25] 谢文文,刘振华,张得香,等.表皮生长因子信号调控隐窝-绒毛轴更新和再生的研究进展[J].动物营养学报,2021,33(7):3726-3734.XIE W W,LIU Z H,ZHANG D X,et al.Recent advances in epidermal growth factor signal regulating renewal and regeneration of crypt-villous axis[J].Chinese Journal of Animal Nutrition,2021,33(7):3726-3734.(in Chinese)
[26] BALKWILL F R,MANTOVANI A.Cancer-related inflammation:Common themes and therapeutic opportunities[J].Seminars in Cancer Biology,2012,22(1):33-40.
[27] 邓燕霞,古盼,刘海龙,等.苯并芘诱导肝脏的炎症损伤及EGFR的表达变化[J].癌变·畸变·突变,2017,29(5):383-386.DENG Y X,GU P,LIU H L,et al.Expression of EGFR in benzopyrene-induced hepatic inflammation[J].Carcinogenesis,Teratogenesis &Mutagenesis,2017,29(5):383-386.(in Chinese)
[28] REBL A,GOLDAMMER T,SEYFERT H M.Toll-like receptor signaling in bony fish[J].Veterinary Immunology and Immunopathology,2010,134(3/4):139-150.
[29] 王哲文,施小茹,李婷钰,等.LPS和PMA对人眼晶状体上皮细胞增殖和EGFR表达的影响[J].吉林大学学报(医学版),2008,34(4):665-667,731.WANG Z W,SHI X R,LI T Y,et al.Effects of LPS and PMA on proliferation of human len epithelial cells and expression of epidermal growth factor receptor in human len epithelial cells[J].Journal of Jilin University (Medicine Edition),2008,34(4):665-667,731.(in Chinese)
[30] DE S,ZHOU H,DESANTIS D,et al.Erlotinib protects against LPS-induced endotoxicity because TLR4 needs EGFR to signal[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(31):9680-9685.
[31] 李景芬,刘莉,曹访.PolyI∶C体外诱导草鱼PKR基因的克隆与表达[J].安徽农业科学,2011,39(33):20514-20516,20529.LI J F,LIU L,CAO F.Cloning and expression of PKR gene ofCtenopharyngodon idellus induced by PolyI:C in vitro[J].Journal of Anhui Agricultural Sciences,2011,39(33):20514-20516,20529.(in Chinese)
[32] ZHOU Z X,ZHANG B C,SUN L.Poly(I:C) induces antiviral immune responses in Japanese flounder (Paralichthys olivaceus) that require TLR3 and MDA5 and is negatively regulated by Myd88[J].PLoS One,2014,9(11):e112918.
[33] JIN Y H,HA N T,FOR S M,et al.EGFR/ras signaling controls Drosophila intestinal stem cell proliferation via Capicua-regulated genes[J].PLoS Genetics,2015,11(12):e1005634.
S M,et al.EGFR/ras signaling controls Drosophila intestinal stem cell proliferation via Capicua-regulated genes[J].PLoS Genetics,2015,11(12):e1005634.
[34] NIU Y J,FU X Z,LIN Q,et al.Gefitinib inhibits infectious spleen and kidney necrosis virus infection in vivo and vitro by blocking virus endocytosis[J].Aquaculture,2021,539:736614.
[35] IREGUI C A,COMAS J,V SQUEZ G M,et al.Experimental early pathogenesis of Streptococcus agalactiae infection in red Tilapia oreochromis spp[J].Journal of Fish Diseases,2016,39(2):205-215.
SQUEZ G M,et al.Experimental early pathogenesis of Streptococcus agalactiae infection in red Tilapia oreochromis spp[J].Journal of Fish Diseases,2016,39(2):205-215.
[36] VACHKOVA E,BIVOLARSKI B,GULUBOVA M,et al.Immunohistochemical localisation of EGF receptors in the intestinal tract of growing rabbits in relation to age[J].Livestock Science,2011,142(1/2/3):216-221.
[37] NADEL J A.Role of epidermal growth factor receptor activation in regulating mucin synthesis[J].Respiratory Research,2001,2(2):85.
[38] 陈伟, 付小兵, 孙同柱, 等. 表皮细胞生长因子及其受体在胎儿和成人肠道组织中的表达特征[J]. 中国修复重建外科杂志, 2003, 17(4): 289-292.CHEN W,FU X B, SUN T Z, et al. Expressive characteristics of epidermal growth factor and its receptor in tissues of fetal and adult intestines[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2003, 17(4): 289-292. (in Chinese)
[39] WANG L H,CAO H L,LIU L P,et al.Activation of epidermal growth factor receptor mediates mucin production stimulated by p40,a Lactobacillus rhamnosus GG-derived protein[J].Journal of Biological Chemistry,2014,289(29):20234-20244.
[40] 李志刚.半胱胺对罗非鱼肠粘膜结构及非特异性免疫功能的影响[D].福州:福建农林大学,2008.LI Z G.Effects of cysteamine on intestinal mucosal structure and nonspecific immune function of Tilapia[D].Fuzhou:Fujian Agriculture and Forestry University,2008.(in Chinese)
[41] 房慧伶,曾文宗.尼罗罗非鱼肠道的细微结构及组织化学的研究[J].广西农业大学学报,1992,11(3):121-126.FANG H L,ZENG W Z.Studies on ultrastructure and histochemistry of the intestine of Tilapia nilotica l[J].Genomics and Applied Biology,1992,11(3):121-126.(in Chinese)