棘皮动物(Echinodermata)作为后口动物(Deuterostomia)的典型代表,其独特的五辐射对称体型和钙质内骨骼系统在无脊椎动物进化中占据关键分支位置,为发育生物学与比较基因组学研究提供了重要模型[1-2]。现存约17 990种棘皮动物全部为海洋或河口底栖生境特化类群[3]。其中,海参纲、海胆纲和海星纲的许多种类兼具有生态功能与食药同源经济价值而备受关注[4-5],据《2025年中国渔业统计年鉴》统计,2024年中国海参和海胆养殖产量分别为326 172、7 376 t,养殖面积合计超过28.5万hm2[6]。近年来,全球气候变化和渔业过度(或不可持续的)采捕导致许多棘皮动物的自然资源面临枯竭危机,至少有18种已被列入世界自然保护联盟(International Union for Conservation of Nature,IUCN)红色名录[7-8],凸显了资源可持续管理的紧迫性。
重要经济种(如海参和海胆)的增养殖实践及关键种的保护策略制定,亟需通过长期生物样本监测获取种群层面的基础生物学参数。年龄信息既是基础生物学的重要组成部分,也是生物种群动力学和生态学研究的基本参数,其重要性不容忽视[9]。从个体生长规律(如Von-Bertalanffy生长方程)到死亡分析(如虚拟种群分析Virtual population analysis)以及各种渔业资源评估和管理模型的建立(如Beverton-Holt世代产量模型和Ricker分析模型),年龄信息都是不可或缺的关键参数[9-10]。目前已知不同类群的棘皮动物寿命跨度较大,如海参的自然寿命通常为8~9年[11],一些海星的寿命可达10多年[12];而大多海胆相对都是棘皮动物中的长命物种,如生活在北美西海岸的巨紫球海胆(Strongylocentrotus franciscanus)的最大年龄已被证实超过100年[13]。随着海洋脊椎动物年龄鉴定技术体系的日益发展,棘皮动物的年龄鉴定方法不断得到借鉴完善,但因其内骨骼普遍缺乏典型生长纹导致传统年龄鉴定往往面临精度局限和类群适用性窄两个瓶颈问题。为此,本文回顾了棘皮动物典型类群的年龄鉴定关键技术原理,通过系统比较不同鉴定方法的优点与应用局限性,整合了生殖板显微结构分析、钙质鳞片年轮计数等跨类群技术方法,并结合放射性同位素标记与代谢组学标志物,提出多尺度年龄鉴定框架,为棘皮动物资源管理提供方法论支撑与借鉴。
1 文献检索和结果
通过使用Web of Science网站核心数据库对1975—2025年发表的论文进行检索,收集有关年龄鉴定、研究方法、分类群(海胆sea urchin、海参sea cucumber、海星starfish/sea star、海蛇尾ophiuroid和海百合crinoidea)及该方法是否经过验证或证实的数据。文献检索关键词包括“年龄鉴定(age determination)”“生长带(growth rings)”“生长纹(growth lines)”,并分别与所研究的5个分类群一一对应,同时通过检索到的文献所引用的参考文献进行二次补充,补充或删减可能遗漏的文章或不相关的文章。此次文献综述共收集到 35 篇论文,其中关于海胆年龄鉴定的相关文献最多(23篇),其次是海参年龄鉴定(6篇)。
2 海洋动物年龄鉴定一般方法概述
海洋动物常见的年龄鉴定方法包括硬组织鉴定法、自然长度分布法和标志重捕法。其中,鱼类的年龄鉴定研究最早。18世纪初期,许多科学家开始使用鱼类的骨质结构(如耳石、鳞片等)鉴定年龄,至今已有数百年历史。随着计算机技术的发展,新方法、新技术被应用于该领域,鉴定技术体系日趋完善,鉴定精度逐步提高,为无脊椎动物年龄鉴定方法提供了重要借鉴[14]。其中在虾蟹类等甲壳动物的年龄鉴定中得到了充分的体现,鉴定方法主要有硬组织鉴定法[15](如眼柄、胃磨等)、体长频率法[16]、标志重捕法[17]、放射性同位素标记法[18]和脑-脂褐素分析法[19],而体长频率法是甲壳类动物获取年龄信息的主要方法(约占80%以上)[20]。在软体动物中,尤其是具有钙化结构(如贝壳、耳石和厣等)的贝类,季节性或周期性形成的生长线纹的呈现则是估计贝类年龄使用最广泛的方法[21];而棘皮动物的年龄鉴定方法也借鉴于海洋动物。
3 棘皮动物年龄估计之自然长度分布法
自然长度分布曲线法对鱼类的年龄鉴定适用性广泛,又称为年龄-体长换算表法,主要是通过测量大量已知年龄的鱼体全长构建生长方程(表1),进而估算鱼类的年龄。棘皮动物的几何形态多样,具体应用时往往结合体长、体宽和体质量等多种数量性状分析,通常可作为年龄鉴定的辅助方法。在海参类棘皮动物中,Herrero-Pérezrul等[22]2008年采用测量已知年龄的墨西哥海参(Isostichopus fuscus)的体长,构建体长与年龄相对应的频率分布进行年龄鉴定;2012年,Morgan等[24]利用体长数据结合生长模型估算澳洲海参(Australostichopus mollis)的年龄,但其体长数据往往难以精确测量而导致较高的变异系数;2014年,Poot-Salazar等[25]首次引入用平方根的长度宽度乘积(SLW)作为复合指标分析墨西哥海参的生长,有效缩减了体长变异系数,从而提高了年龄估算的准确性;在2024年,Azevedo等[26]为了评估东北大西洋海洋保护区内3个商业海参物种[岩刺参(Holothuria mammata)、黑海参(H.forskali)和H.arguinensis]的种群管理,由潜水员在水下对放松状态的海参进行长度测量,使用统计计算软件“R”(3.5.1版)中TropFishR软件包进行优化模拟退火的ELEFAN程序(the optimized simulated annealing ELEFAN procedure)对长度-频率数据拟合了一个von-Bertalanffy模型,该模型对年龄较小组群的拟合效果较好,对年龄较大组群的拟合效果并不明显,但是如果样本量足够大,该模型对年龄较大组群的鉴定结果仍然具有一定可信性。此外,体长分析法还可以配合标记重捕法,即通过对生物体进行物理、化学或生物标记计算动物生长量,从而建立增长曲线推测年龄[24]。
表1 水生动物生长方程极简描述
Tab.1 A brief description of the growth equations of aquatic animals

常用方程common equation适用领域scope of application方程一般形式general formula of the equation参数含义meaning of parameters冯贝塔朗菲生长方程(von-Bertalanffy growth equation)描述生物体随着年龄增长的体长或体质量增长的非线性模型L(t)=L∞×{1-e^[-k×(t-t0)]}该生长方程在动物体质量(W)与体长(L)幂函数关系为W=AL3的假设条件下提出,实践中经常以W=ALb代之,使其具有更普遍的意义。其中,L(t)为时间t的长度,L∞为生物体的极限体长,k为瞬时相对生长率,t0为理论上的时间原点(通常被解释为生物体在出生后开始生长前的年龄)逻辑斯谛生长方程(Logistic growth equation)描述种群生长的模型,其中种群生长速度随着种群规模的增长而减慢,直到达到一定的最大规模N(t)=K1+K-N0N0×e^(-r×t)N(t)为在时间t的种群数量,K为种群的最大数量(称为环境承载量),N0为初始种群数量,r为种群的内禀增长率克拉克生长方程(Clarks growth equation)描述生物体体质量随年龄增长的模型,对于一些特定的动物种群和人类,这个模型常常可以得到非常好的拟合效果W(t)=a×[1-e^(-b×t)]^cW(t)为在时间t的体质量,a,b和c为需要根据数据进行估计的参数
4 棘皮动物年龄鉴定之放射性同位素分析法
放射性同位素鉴定是一种通过测量放射性同位素的衰变和释放的辐射来确定材料年龄、成分或起源的科学方法,这种技术广泛应用于考古学、地质学、环境科学等领域,以追溯物质的历史和变化。14C是放射性同位素的一种,广泛存在于自然界中,1940年由美国科学家Ruben和Kamen发现[27],后由Libby测算出其半衰期,经过研究整理,于1949年创立放射性同位素14C的测年方法[28]。14C在自然界中存在比例极低,但20世纪50—60年代的核武器大气试验显著提高了大气中14C浓度,进而为许多海洋动物提供了一个年龄估计和鉴定的有效标记,相关研究在鱼类和海洋哺乳类动物中已有许多应用[14]。放射性元素鉴定法在无脊椎动物中的研究应用较少,目前仅于海胆类棘皮动物的年龄与生长中有少量报道。Ebert等[13]在1989—1992年对巨紫球海胆(Strongylocentrotus franciscanus)进行了四环素标记重捕并测量齿(亚里士多德提灯)的生长增量,利用Tanaka函数模型拟合海胆的生长曲线,同时以全球14C水平的增加作为时间标尺,以从20世纪90年代采集时(相对较高的C含量)到原子弹大气试验前(相对较低的C含量)的时间跨度,基于稳定同位素分析对δ13C为-3的修正,放射性碳测量的平均精度(1个标准差)为4.2‰(范围3.0~7.9),测量巨紫球海胆齿(亚里士多德提灯Aristotles lantern)中放射性元素14C的含量。最后,放射性14C元素测定结果支持根据四环素标记和使用Tanaka函数进行的年龄估计,结合模型估算和试验数据推断验证巨紫球海胆的寿命远超以往估计的7~10年。尽管使用了增强的14C信号进行验证,但仍然存在一些潜在问题。首先,在1年的标记时间内,体型较大海胆生长增量非常小(<0.01 cm),以及难以辨识生长纹,这可能导致年龄估算的误差。其次,环境因素(如海洋流动和温度变化)可能弱化了14C标记在所有地区的生物样本中的响应,从而影响了年龄的准确性,因此,后期可进一步校正改进对采样区域间的碳水平差异,以提高年龄鉴定的准确性。
5 棘皮动物年龄鉴定之硬组织鉴定法
5.1 棘皮动物的骨骼系统特征
通常,动物的骨骼等硬组织生长得比其他组织更为稳定[29],环境的周期性变化和生物自身的生长节律往往会导致硬组织形成特定的微结构或微化学“标记”。许多海洋动物具有发达的骨骼或硬组织[30-31],如鱼类的鳞片、耳石、鳍条骨和晶状体等硬组织都是年龄鉴定的可靠材料[32]。
棘皮动物的骨骼系统属内骨骼,其由中胚层产生的大量微小骨片(微米级)或骨板(毫米级)经结缔组织连接成多孔的三维立体网格状结构(图1),大多位于体壁的真皮层[33],主要成分是一种富含镁元素(3~43.5 mol% MgCO3)的碳酸钙晶体——富镁方解石(magnesium-rich calcite)[34],小骨片多有穿孔,从而兼具轻质与强度,能够为软组织提供支撑并参与运动[35]。通常,每块小骨片都可随动物的生长而增大,骨片的大小、形状等微观结构都取决于真皮细胞的结构和排列。从海参体壁中的微小而离散的骨针(或骨片),到海蛇尾类和海星类由韧带和肌肉组织连接的一排排高度契合的骨片(或骨板),再到大部分海胆类和海百合类相互固定在一起的硬质骨板。可见,棘皮动物骨骼系统特征(大小和钙化程度)依类群而异,骨片或骨板的大小、形态和排列方式因种类而异[36]。因此,基于硬组织的棘皮动物年龄鉴定方法和技术细节往往不同,以往的研究对象多聚焦于硬组织较为发达的种类。

A—蛇尾纲(Ophiocoma echinata)的臂椎骨;B—海百合纲(Antedon mediterranea)的骨板;C—海星纲(Astropecten duplicatus)的外骨板;D—海胆纲(Tripneustes ventricosus)的步带板;E~J—分别为刺参(Apostichopus japonicus)的桌形体、扣形体、杆状体、长孔状体、花纹状体、复合盘状骨片。
A—arm ossicle of( Ophiocoma echinata )(Class Ophiuroidea);B—skeletal plate of (Antedon mediterranea )(Class Crinoidea);C—external skeletal plate of (Astropecten duplicatus) (Class Asteroidea);D—ambulacral plate of (Tripneustes ventricosus) (Class Echinoidea);E-J—table-shaped ossicles,button-shaped ossicles,rod-shaped ossicles,long hole-like body ossicles,rosste-shaped ossicles and composite discoid ossicles of (Apostichopus japonicus) (Class Holothuroidea),respectively,each.
图1 不同种类的棘皮动物骨骼扫描电镜图[35,37]
Fig.1 Scanning electron micrographs of the skeletons in different species of echinoderms[35,37]
5.2 海胆纲的年龄鉴定
海胆类的骨骼由有序排列的碳酸钙骨片组成,可分为三大类:1)外部棘刺和棘刺基;2)步带与间步带(ambulacra and interambulacra)、顶系(apical system)(图2),包括围肛部(periproct)、5个生殖板(genital plates)和5个眼板(ocular plate);3)齿(亚里士多德提灯)。一般而言,海胆的鉴定方法大都基于这些硬组织开展。当海胆在春、夏季营养丰富的生长盛期时,硬组织生长速度较快,生长纹间隔较宽且透光性好(呈现亮带),而在秋、冬季营养匮乏,生长速度减缓时,硬组织的生长纹排列紧密(呈现暗带)。因此,大多硬组织其上或内部会呈现明暗相间的环纹,通常可以明暗交界处作为年龄标志。
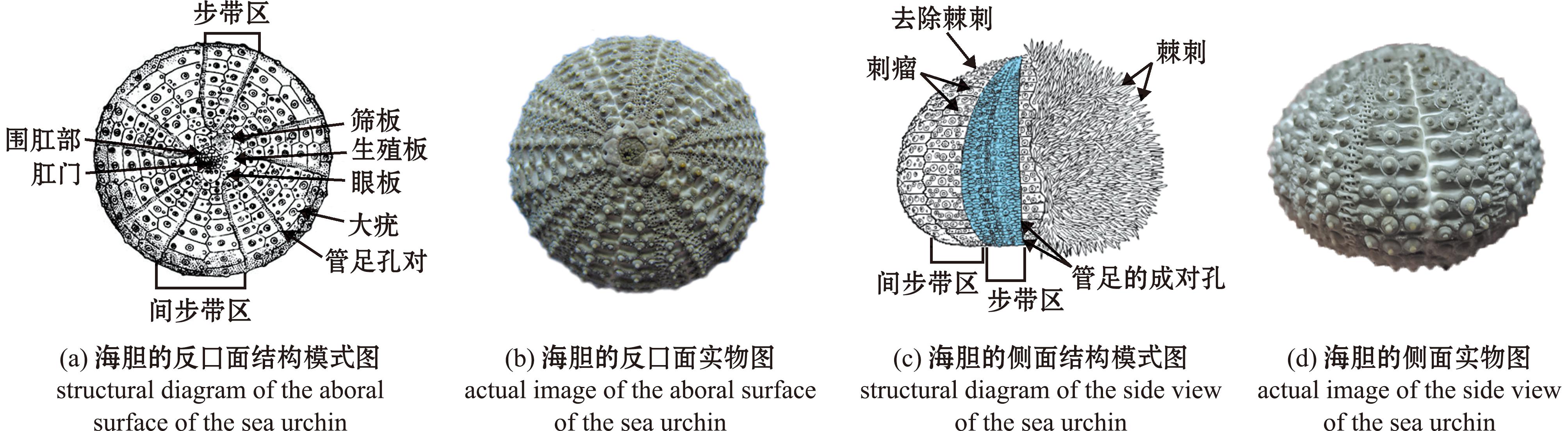
图(a)、(b)、(d)为去除棘刺后的海胆;图(b)为生殖板位于反口面的最顶部。
The spines of sea urchins in (a),(b),and (d) are all removed;(b)the genital plates located at the very top of the aboral surface.
图2 海胆外部形态结构
Fig.2 External morphology of sea urchin
1926年,Deutler[38]提出,在大多数的海胆物种中,棘刺、步带板、间步带板、生殖板和齿的骨片上均有生长纹的存在,并用次氯酸钠溶液清洗、乙醇脱水、香脂包埋、研磨和抛光,然后用松油醇-甲基苯甲酸酯混合物(22∶1)浸泡,最后通过显微镜检观察的方法确认了生长纹的存在。1935年,Moore[39]使用二甲苯代替了松油醇-甲基苯甲酸酯混合物来使生殖板上的生长纹更明显(图3A)。1969年,Jensen[40]基于Moore的方法提出另一种方法,将生殖板在乙醇火焰中加热0.5~2 min直到生殖板变成深棕色,冷却后用二甲苯保存,观察到的生长纹更加明显,便于辨认估计年龄。至2018年,Balboa等[41]仍在使用硬组织法对智利海胆(Loxechinus albus)的生殖板上的生长纹进行观察,用于研究种群的生长模式,便于渔业管理政策的制定。
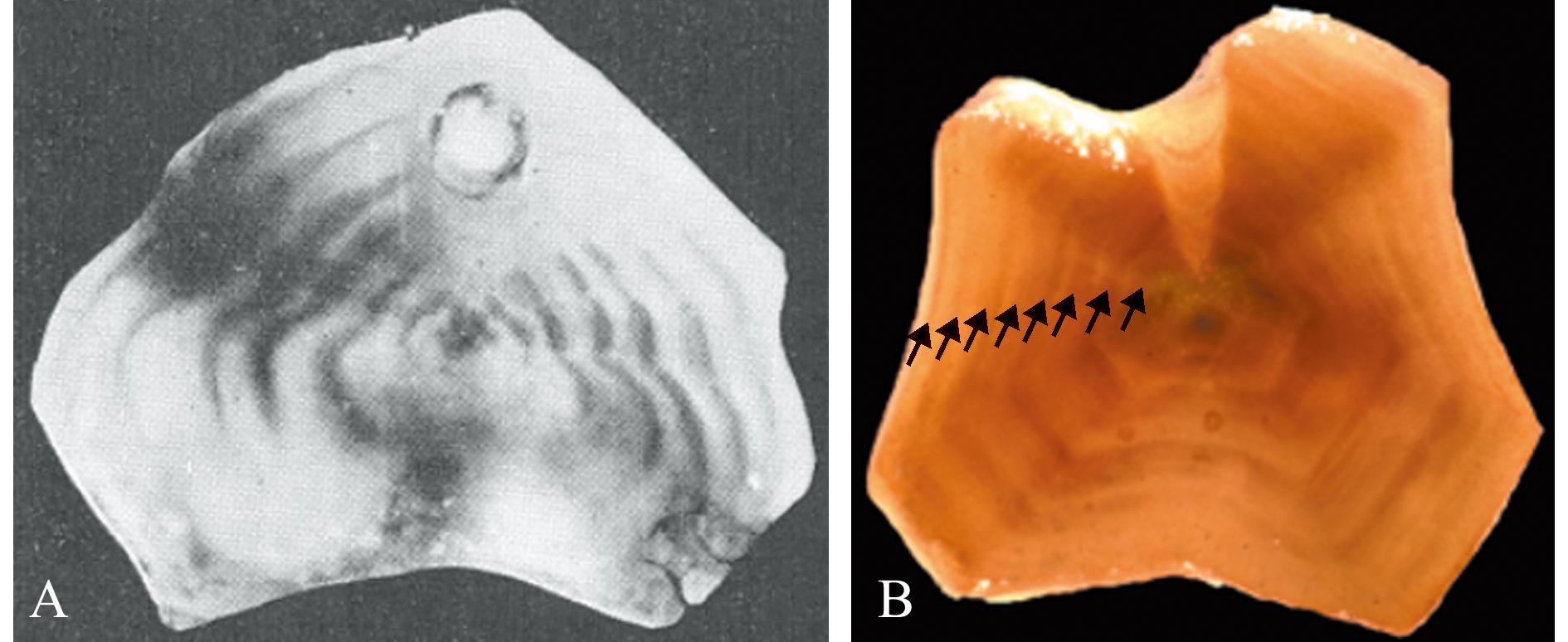
A—1935年Echinus esculentus海胆的6龄生殖板水平截面图;B—2013年Paracentrotus lividus的8龄生殖板(长度为77 mm,用箭头标示出8个生长纹)。
A—a transverse section of reproductive plates from a 6-year-old Echinus esculentus dated 1935;B—reproductive plates of a 8-year-old Paracentrotus lividus from 2013 (length of 77 mm,arrows indicate eight growth lines).
图3 海胆生殖板的水平截面图[39,43]
Fig.3 Transverse section view of reproductive plates in the sea urchin[39,43]
生殖板位于海胆反口面中央,呈五边形片状,从海胆幼虫变态便已存在,并贯穿海胆个体的整个生命周期,是目前鉴定海胆年龄最常用的硬组织结构[42](图3)。基于生殖板类硬组织的海胆纲动物年龄鉴定方法主要包括两种方法:一种是Moore法[39],即通过次氯酸钠溶液清洗,细砂纸打磨,二甲苯浸泡后,最后用显微镜观察;另一种是Jensen法[40],即在打磨前增加热处理(如酒精灯加热),使生殖板碳化以利于生长纹凸显,更易于观察计数(图4)。这种以生殖板(或步带板、间步带板)上周期性排列的生长纹鉴定年龄的方法(图3B和图5)易于掌握,鉴定结果重复性和可靠性强,已用于多种海胆的年龄鉴定(表2)。
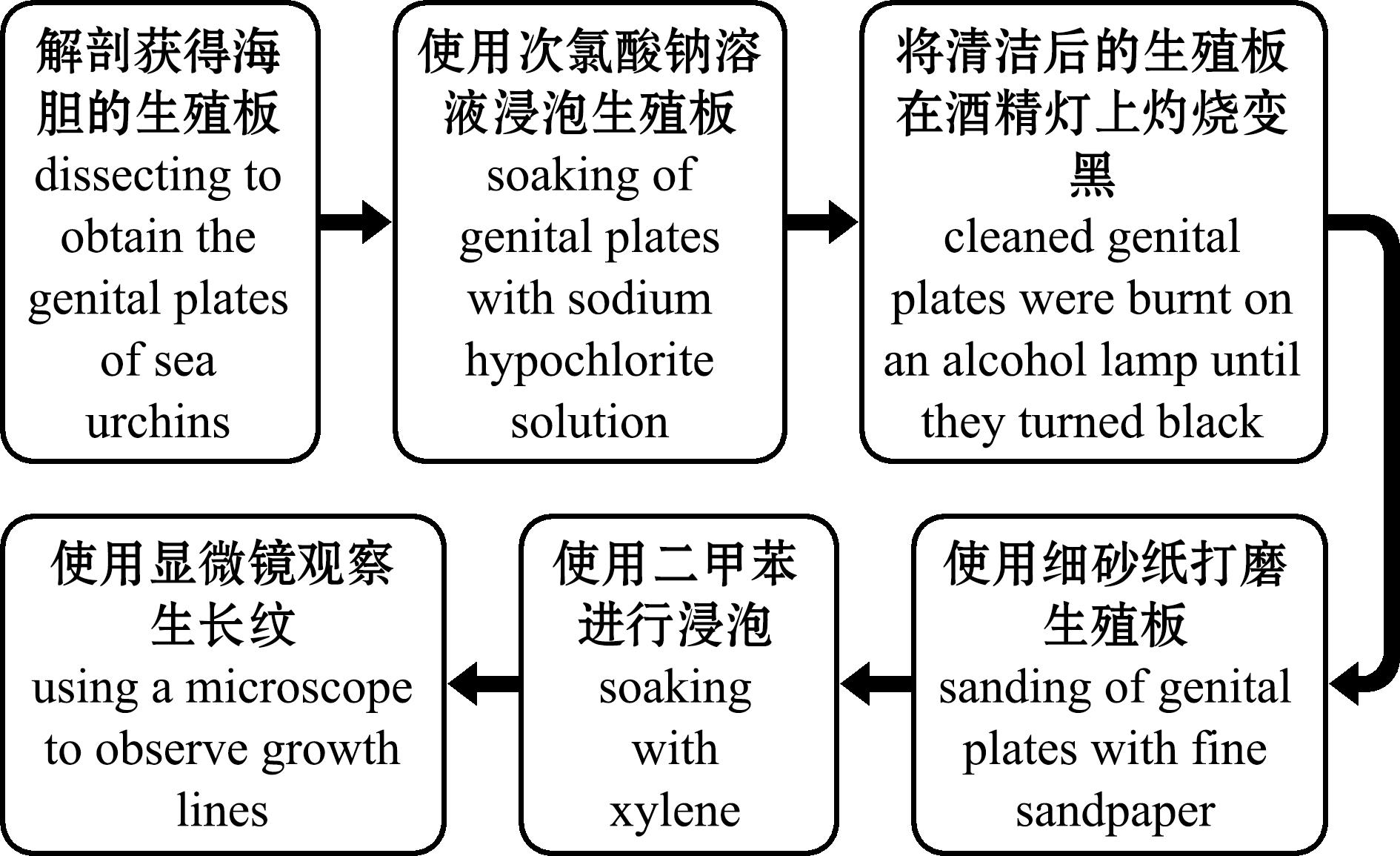
图4 海胆硬组织年龄鉴定方法流程图(生殖板为例)
Fig.4 Flowchart of age determination method for the hard tissue of sea urchins (genital plates as an example)

A—间步带板在紫外光下拍摄显示四环素标记(白色带);B—灼烧炭化后的间步带板(1、2表示第一和第二条主要暗带)。
A—interambulacral plates photographed under ultraviolet light,showing the tetracycline tag as a white band;B—same interambulacral plates after burning and carbonization(1,2 means the first and second major dark bands).
图5 栗色沙海胆的间步带板[45]
Fig.5 Interambulacral plates of Psammechinus miliaris[45]
表2 常见棘皮动物的年龄鉴定概况
Tab.2 Age determination of common echinoderms

纲class物种species鉴定方法method鉴定依据basis年龄years参考文献references黑海胆(Arbacia lixula)—[40]杂色海胆(Lytechinus variegatus)—[40]小粒沙海胆(Psammechinus microtuberculatus)生殖板、步带板、间步带板—[40]尖锐刺海胆(Echinus acutus)—[40]栗色沙海胆(P.miliaris)—[40]绿海胆(Strongylocentrotus droebachiensis)20[40,57]亚里士多德提灯[57]青灰拟球海胆(Paracentrotus lividus)生殖板、步带板、间步带板15[40,58-59]海胆纲(Echinus affinis)硬组织鉴定法28[43]食用海胆(E.esculentus)生殖板10[60](E.acutus var.norvegicus)75∗[60]紫球海胆(Sphaerechinus granularis)间步带板10[61-63]马粪海胆(Hemicentrotus pulcherrimus)生殖板4[64-65]智利海胆(Loxechinus albus)生殖板、亚里士多德提灯11[66]生殖板[41]深海海胆(Echinosigra phiale)间步带板15[67](Hemiaster expergitus)10[67]巨紫球海胆(Strongylocentrotus franciscanus)生殖板>100∗[13,68]放射性元素分析法亚里士多德提灯[13]葙参(Psolus fabricii)硬组织鉴定法骨片>28∗[55]墨西哥刺参(Isostichopus fuscus)体长与体质量5[22-23]新西兰软刺参(Australostichopus mollis)4[24]海参纲岩刺参(Holothuria mammata)体型分析法10∗[26]黑海参(H. forskali)体长8∗[26]黑海参(H. arguinensis)10∗[26]美国肉参(Isostichopus badionotus)体长、体宽、体质量13[25]仿刺参(Apostichopus japonicus)年龄分子标志物法脂肪酸3[11]棘冠海星(Acanthaster planci)硬组织鉴定法棘刺—[45]海星纲棘冠海星(Acanthaster cf.solaris)8[46]年龄分子标志物法相对端粒长度—[56]海蛇尾(O.victori)22[47]蛇尾纲海蛇尾(O.gracilis)硬组织鉴定法触腕骨骼8[48]萨氏真蛇尾(O.sarsii)27[49]海蛇尾(O.sericeum)25[49]
注:年龄为仅在文献中所鉴定到的最大年龄。*表示预测的最大年龄;—表示缺失。
Note:Age is the maximum age identified only in the literature.*means the predicted maximum age;—means indicates absence.
5.3 海星纲和蛇尾纲的年龄鉴定
海星纲及蛇尾纲中,种类众多,通常具有5个或更多的放射状肢体,这些肢体从中心盘向外放射,其体壁由肌肉和胶原韧带相互连接的方解石小骨片(或板)组成[32]。其中,棘冠海星(Acanthaster planci)的体型较大,成体的辐径可达甚或超过50 cm,触腕密布长达45~50 mm的棘刺(图6A)。1990年,Stump等[44]率先尝试利用荧光色素(四环素)标记室内饲养1年的棘冠海星反口面的棘刺作为年龄鉴定材料,经10%次氯酸钠(NaClO)溶液清洗后,将棘刺打磨成200 μm的薄片,然后观察棘刺有无明显的荧光生长带并计数,最后通过已知时间和荧光生长带的长度进行最小二乘回归(least squares regression)数学模型计算,发现棘冠海星的棘刺生长遵循明显的线性关系,证明棘刺可用于棘冠海星年龄鉴定的有效材料。然而,这种由于生长而产生的色素沉积带是否具有季节性周期特征还有待进一步验证。直至2017年,Macneil等[46]通过标记-重捕法验证了3~5龄的棘冠海星棘刺平均每年增加1条色素带(图6B、C),为基于棘刺鉴定棘冠海星的年龄相关研究与应用提供了必要依据,但有关色素带的形成机制及初始色素带形成的时间仍有待探索。

A—棘冠海星(Acanthaster planci);B,C—从两个海星中选择棘刺进行带状计数(显示出1~4.5和1~2.5的不同条带数)[46]。
A—Acanthaster planci sea star;B,C—spines from two sea stars selected for band counting(showing different numbers of bands from 1 to 4.5 and 1 to 2.5)[46].
图6 棘冠海星的棘及其上的色素带
Fig.6 Spines and the pigment bands of crown-of-thorns starfish Acanthaster planci
蛇尾纲动物年龄鉴定的主要硬组织是腕基部的椎骨(图7),即最靠近体盘边缘下的插入部分的骨骼。1998年,Dahm等[47]首次观察到海蛇尾腕基部的椎骨具有生长纹。2003年,Gage[48]通过扫描电镜观察蛇尾(Ophiocten gracilis)腕基部的椎骨生长纹以确定年龄,在所鉴定的样本个体中最大年龄为8龄。
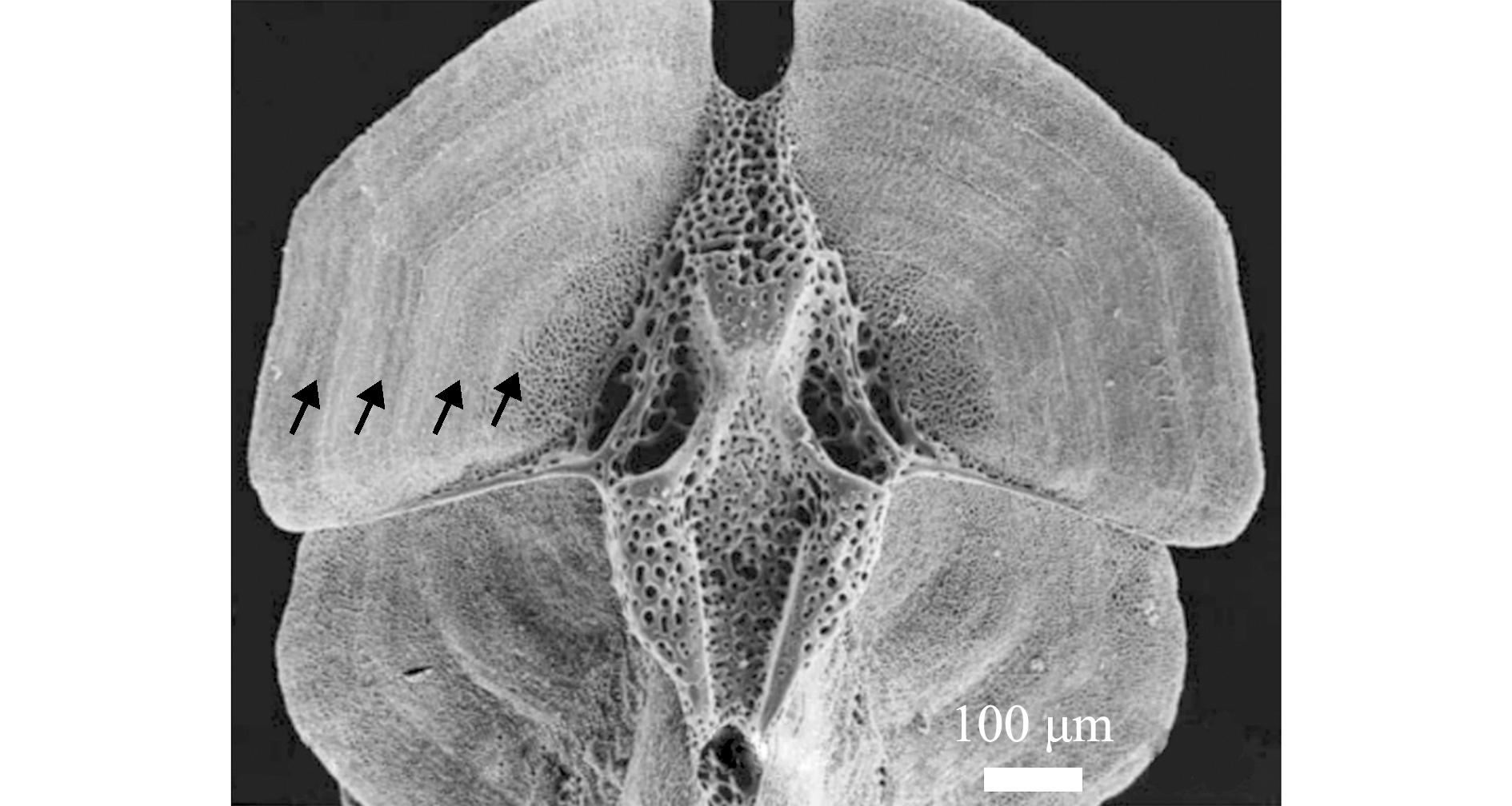
直径为9.2 mm,用箭头标示出4个生长纹。
Diameter of 9.2 mm is shown,arrows indicate four growth lines.
图7 蛇尾触腕椎骨的扫描电镜图[48]
Fig.7 Scanning electron microscope images of the arm vertebrae of Ophiocten gracilis[48]
2017年,Ravelo等[49]采用同样方法,观察了萨氏真蛇尾(Ophiura sarsii)和丝状海蛇尾(O.sericeum)的年龄(最大年龄分别为27、25龄)。
5.4 海参纲的年龄鉴定
相较海胆和海星类棘皮动物,绝大部分海参纲缺乏明显的外骨骼或硬组织,海参体壁真皮层离散分布的微小骨针或骨片(ossicles),包括数量最多的桌形体(table)、扣状体(button)、花纹样体(rosette)及杆状体(rod)等特征类型[50-51](图1F~J),目前公认古老或胚胎期骨骼的存留,在保护血管与神经结构及支持触手运动方面具有重要作用。
鉴于内骨骼是海参唯一的钙化组织,具有一定的非细胞性和代谢惰性,会随着个体生长发育不断钙化;当环境或生理的变化打破个体生长节奏时,极有可能在内骨骼上形成特定的微结构或微化学“标记”,反映了个体生活史所经历的如初次摄食、附着变态、栖息地转换等重要事件或关键阶段。国外学者很早就发现海参幼体和成体的骨片在大小和形状上有所不同,推测海参内骨骼(骨片和石灰环)可随个体生长而发生形态变化,并着重描述了楯手目海参的特征骨片(如桌形体、杆状体等)有“大小”(越来越大或越来越小)和“有无”(幼体有而成体无,或反之亦然)变化,石灰环有内径大小之变化,据此将海参内骨骼划分成若干阶段[52-53]。近年来,国内学者在研究海参骨片形态学时也发现,1~3龄海参各组织间的骨片类型及其相对比例存在一定差异[37]。因此,海参内骨骼有望成为年龄鉴定的可靠材料。
此外,有研究发现,分布于北大西洋和北冰洋枝手目(Dendrochirotida)葙参科(Psolidae)的葙参(Psolus fabricii),体呈卵圆形,背部区域覆有重叠的钙质鳞片(plates)(图8(a)、(b)),常栖息于低潮线至大约150 m深的坚硬底质上[54]。2019年,Sun等[55]首次描述了葙参背部钙质鳞片的形态特征及一年增加一层的生长模式,并通过直接观测和室内培育验证了背部中央鳞片生长纹可以作为年龄鉴定的重要依据。具体而言,通过扫描电镜(SEM)对比观察不同年龄阶段的海参,包括实验室饲养的幼体(3—40个月)和野生成年个体(4—28年)的钙质鳞片中的生长层数,确认了生长环的形成模式为一年一层(图8(c)、(d))。这种年度生长环的确认为海参类棘皮动物年龄鉴定提供了可直接验证的生长标记,具有重要的生态学和生物学意义。研究表明,该方法不仅成功应用于葙参,还可为其他具有钙质结构(如口石灰环和小骨片)的海参纲动物的年龄识别和生长模式研究提供参考。
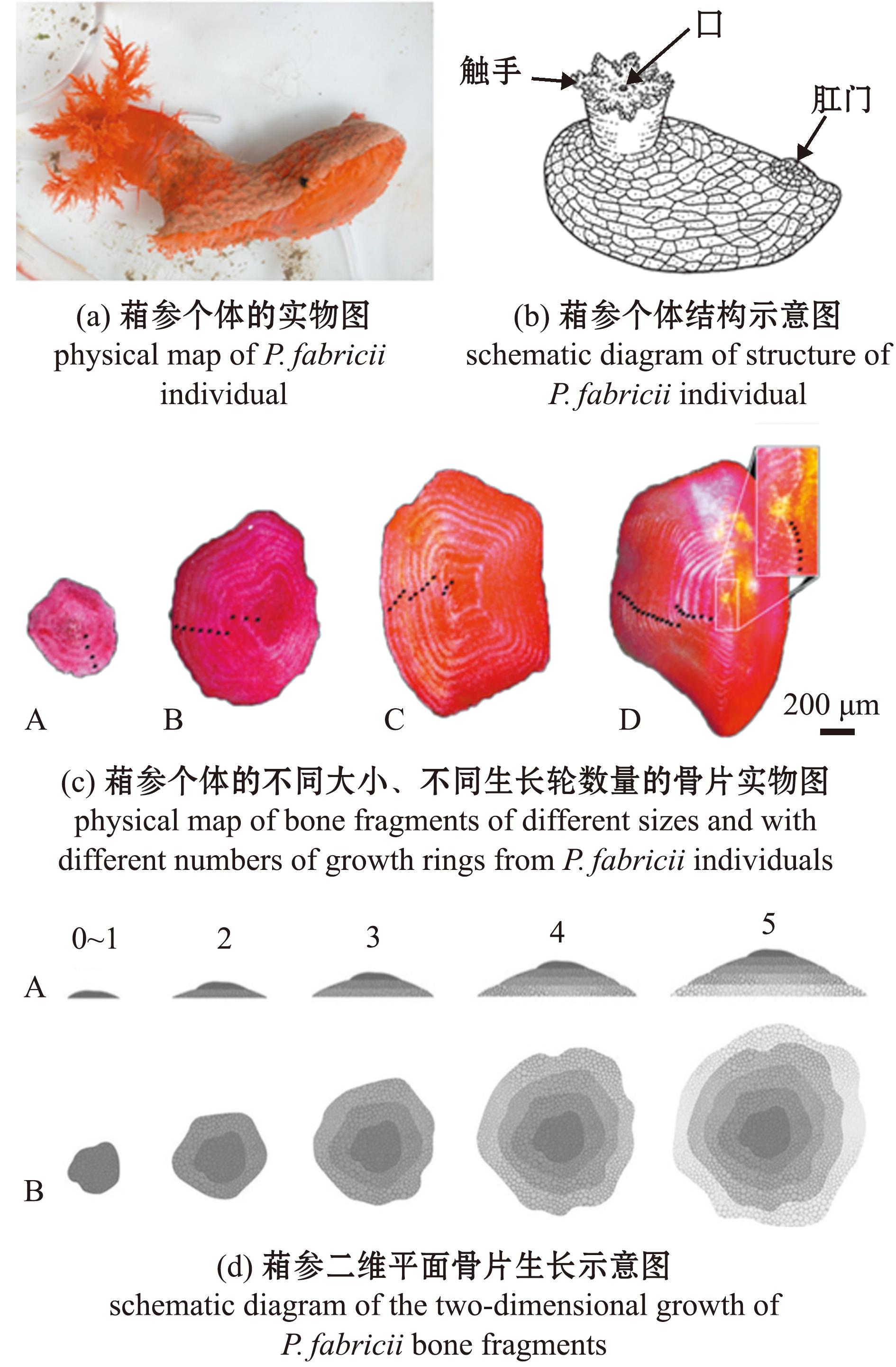
(a)来源:www.marinespecies.org;(c)其中一对深色和浅色的年轮组合,代表了1年的生长。(d)A为侧视图(每年垂直增加一层),B为俯视图(新生长的年轮在逐渐增大,面板上方的值对应于相对年份)。
(a)source:www.marinespecies.org;(c)one pair of dark and light annual rings represents one year of growth;(d)A is a side view (a new layer added vertically each year),B is a top view (the newly grown annual rings gradually increasing in size,the values at the top of the panel correspond to the relative years).
图8 葙参的外部形态和硬组织实物及二维生长示意图[55]
Fig.8 Illustration depicting the external morphology of P.fabricii,along with physical representations of hard tissues and a schematic diagram of its two-dimensional growth[55]
综上所述,基于棘皮动物硬组织年龄鉴定各种方法的技术特点和适用类群虽有不同,但基本原理和方法基本相似,即选择可视化适宜钙质材料的微观形貌,然后关联验证其与个体生长发育的实际龄期。
6 棘皮动物年龄相关生物标志物
生物标志物是指生物体在分子、细胞或个体层面上因环境因素而出现的特定改变,通常用于生理医学和转化医学领域,能够反映生物体的衰老过程及其健康状况。目前,年龄相关分子标志物已经拓展应用于生物学、生态学和环境科学等研究领域。2023年,Kwong等[56]测量了不同年龄组棘冠海星(Acanthaster cf.solaris)的相对端粒长度(relative telomere length,rTL),并确认了棘冠海星的rTL会随着年龄的增加而变短,可用于年龄的鉴定。同年,Yang等[11]发现,不同龄期(1、2、3龄)的刺参体壁代谢物有明显差异,其中,硫胺素、核黄素、硫辛酸、磷脂酰胆碱(三碳酸/十八碳酸五烯酸)、磷脂酰胆碱(十一碳酸/十二碳酸)、溶血磷脂酰胆碱(二十碳五烯酸)和乙酰左旋肉碱水平随年龄增加,反之,反式-10-庚十二烯酸、十八碳酸、十五碳酸、癸二酸二丁酯和8,15-二羟二十碳烯酸水平则随年龄减少。据此推测,基于代谢组学等多组学时空联动分析有望发掘海参类棘皮动物年龄相关的潜在生物标志物。
7 总结与展望
7.1 棘皮动物年龄鉴定方法的优点与局限性
纵观国内外棘皮动物年龄相关研究现状,相同分类群不同物种的年龄鉴定方法往往表现出明显的物种特异性,这也是无脊椎动物(如软体动物、甲壳动物等)年龄鉴定存在的普遍特性,集中体现在骨骼系统明显退化的海参纲动物。表3总结了棘皮动物年龄鉴定主要方法的优点和局限性。总体而言,体长或形态相关数量参数的自然长度分析是棘皮动物年龄估计的一种经典方法,但考虑到动物的生长发育通常受到环境和内生因素的共同影响,特别是棘皮动物生命早期阶段经历的重要事件,乃至幼体补充的年际波动差异等,建议具体应用时可与硬组织鉴定法相结合。相对而言,放射性14C元素鉴定法的精度较高,但其成本较高且对设备和操作技术有较高的要求,且多数动物获取所需的鉴定材料也存在一定的限制,未来的应用范围仍有待探究。当前,棘皮动物年龄鉴定研究主要聚焦于具有发达骨骼系统的类群,其硬组织(如骨片、骨板等钙质结构)生长纹或生长环带等微结构特征仍是鉴定或估计动物年龄的主要依据。然而,硬组织生长纹带的形成有时会受到多元因素(如物理要素、化学要素、生物间的正负向相互作用等)的影响[69]。如Agatsuma等[64]通过实验室模拟温度变化发现,海胆年轮的生长带形成存在个体差异,且与温度间未呈严格的线性关系。此外,研究发现高龄海胆生殖板生长纹有时难以辨识,如Gage[45]对海胆(Psammechinus miliaris)的研究表明,对于生长较缓的高龄海胆,其生殖板上的明暗生长带难以区分,推测归因于此类海胆的生殖板上普遍存在细小的暗线,容易导致年龄估计的误差偏大[70]。由此可见,生境变化和个体差异都可能增加年龄鉴定结果的不确定性,相关瓶颈问题或可通过增加样本量并建立更加精确的模型,进而通过机器学习实现可靠的可视化结果加以完善。
表3 棘皮动物年龄鉴定主要方法的优点与局限性
Tab.3 Advantages and disadvantages of age determination methods for various echinoderms

鉴定方法determination method数据来源data source适用物种applicable species优点advantage局限性limitation参考文献references自然长度分析法体长或体质量频率数据海参、海胆适用性高,可为其他鉴定方法进行佐证准确度较低,需要大批量的渔获物体型数据,难以获得各个年龄段的动物[22-25]生长纹海胆、海蛇尾材料易取,制备简单无法鉴定年龄较大、生长缓慢的个体[38-44]硬组织鉴定法棘刺色素带棘冠海星材料多、易获得棘刺上初始色素带形成的时间未被证实,年龄鉴定基于假设[45-46]钙质鳞片年轮葙参取材方便,准确度较高,年轮明显已发现海参中仅葙参科体表具有钙质鳞片[55]放射性14C元素鉴定法骨骼中放射性元素海胆精确度和准确度高鉴定成本高,对仪器设备要求高、操作复杂[13]生物标志物法相关标志物棘冠海星、刺参可长期监测记录,适用范围广不同个体之间受遗传、环境和生理状态的影响,生物标志物的表现可能存在显著性差异[11,56]
7.2 棘皮动物年龄鉴定新方法亟待开发
现代分子生物学和生物信息学的快速发展,已经成功解析了许多棘皮动物的参考基因组。最近,跨代表观遗传学的研究表明,表观遗传信息可以在水生动物中代代相传(如DNA甲基化、组蛋白修饰和非编码RNA),并参与应对环境挑战、维持遗传多样性、改进育种策略、对抗近亲繁殖衰退和进行年龄测定[71],基于表观遗传学和比较基因组学有望发掘更多潜在的年龄相关的生物标志物,如DNA甲基化[72],一般表现为衰老与甲基化水平的变化关系。在驼背大麻哈鱼(Oncorhynchus gorbuscha)的年龄鉴定研究中发现,DNA甲基化水平随着年龄的增长而减少[73]。目前,在脊椎动物领域甲基化规律的研究相对较多,对无脊椎动物研究则比较匮乏,有研究发现,刺参不同组织间甲基化差异程度较小,甲基化位点分布及类型一致性较高[74],这一发现有望为海参的DNA甲基化年龄鉴定方法奠定研发基础。同时,关于端粒的研究表明,生物体中端粒长度与年龄之间存在明显相关性[75],这为棘皮动物的年龄鉴定提供了新的思路。此外,水生动物年龄与脂肪酸含量也有一定相关性,通常情况下,水生动物中饱和脂肪酸与单不饱和脂肪酸在脂肪酸总含量中的比例会随着年龄的增加而逐渐降低。有研究表明,枝角类大型溞(Daphnia magna)中,脂肪酸C14:0和C16:0的相对丰度随着年龄的增加而增多[76],而钩虾(Gammarus locusta)中,脂肪酸C18:1n9的相对丰度随年龄的增长逐渐增加[77]。然而,目前尚未见棘皮动物中脂肪酸与年龄相关性的研究,因此,寻找和发现有价值的年龄相关生物标志物有望成为棘皮动物年龄鉴定研究的一个新方向。
此外,利用先进的成像技术,如高分辨率扫描电子显微镜和X射线计算机断层扫描,可以研究棘皮动物的骨骼结构[32]。海参的真皮表层包含有称为骨片或骨针的内骨骼,这是海参纲最重要的特征。研究表明,刺参在养殖过程中,骨片形态与结构随年龄增长而发生变化[78],这一发现为海参年龄判断提供了初步依据,并可能有助于不具有外骨骼或拥有较大骨片的海参纲动物的年龄鉴定。
随着人工智能和机器学习的飞速发展,机器学习模型可以从大量数据中学习并预测年龄,有望提升传统鉴定方法的精确度[79],大数据和人工智能算法有望在棘皮动物年龄鉴定中发挥更重要的作用。综上所述,棘皮动物年龄鉴定方法有效性和年龄相关研究的精确性需要包括生物学、信息科技和环境科学等多学科领域的深度交叉融合。
[1] SMITH A B.Echinoderm roots[J].Nature,2004,430(6998):411-412.
[2] PAWSON D L.Phylum Echinodermata[J].Zootaxa,2007,1668(1):749-764.
[3] HORTON T,KROH A,AHYONG S,et al.World register of marine species[EB/OL].2024.
[4] 王静凤,张珣,李辉,等.海参岩藻聚糖硫酸酯抗肿瘤转移作用研究[J].中国海洋药物,2012,31(2):14-18. WANG J F,ZHANG X,LI H,et al.Inhibitory effects of fucoidan,a sulfated polysaccharides from Cucumaria frondosa on experimental metastasis in mice[J].Chinese Journal of Marine Drugs,2012,31(2):14-18.(in Chinese)
[5] LI X M,LUO L,CAI Y,et al.Structural elucidation and biological activity of a highly regular fucosylated glycosaminoglycan from the edible sea cucumber Stichopus herrmanni[J].Journal of Agricultural and Food Chemistry,2017,65(42):9315-9323.
[6] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2025中国渔业统计年鉴[M].北京:中国农业出版社,2025. Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center,China Society of Fisheries.2025 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2025.(in Chinese)
[7] HAMEL J F,MERCIER A,CONAND C,et al.Holothuria scabra.The IUCN Red List of Threatened Species 2013:e.T180257A1606648[EB/OL].2013.http://dx.doi.org/10.2305/IUCN.UK.2013-1.RLTS.T180257A1606648.en.
[8] HAMEL J F,MERCIER A.The IUCN red list of threatened species 2013:e.T180424A1629389[EB/OL].2013.http://dx.doi.org/10.2305/IUCN.UK.2013-1.RLTS.T180424A1629389.en
[9] HIGGINS K,HASTINGS A,BOTSFORD L W.Density dependence and age structure:nonlinear dynamics and population behavior[J].The American Naturalist,1997,149(2):247-269.
[10] ONO K,LICANDEO R,MURADIAN M L,et al.The importance of length and age composition data in statistical age-structured models for marine species[J].ICES Journal of Marine Science,2015,72(1):31-43.
[11] YANG X Y,HAN L S,ZHANG J Y,et al.Differences in body wall metabolites of Apostichopus japonicus of different ages in liquid chromatography-tandem mass spectrometry[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2023,47:101109.
[12] 姚秋翠,余克服,廖芝衡,等.棘冠海星暴发及其对珊瑚礁的生态影响研究进展[J].生态学报,2022,42(18):7517-7528. YAO Q C,YU K F,LIAO Z H,et al.A review of research on crown-of-thorns starfish and their ecological effects on coral reefs[J].Acta Ecologica Sinica,2022,42(18):7517-7528.(in Chinese)
[13] EBERT T,SOUTHON J.Red sea urchins (Strongylocentrotus franciscanus) can live over 100 years:confirmation with A-bomb 14 carbon[J].Fishery bulletin-national oceanic and atmospheric administration,2003,101(4):915-922.
[14] 谢玺,鲍枳月,王庆志.鱼类年龄硬组织鉴定方法研究应用进展[J].大连海洋大学学报,2021,36(6):1071-1080. XIE X,BAO Z Y,WANG Q Z.Advances on research and application of age determination by hard tissues in fish:a review[J].Journal of Dalian Ocean University,2021,36(6):1071-1080.(in Chinese)
[15] KILADA R,REISS C S,KAWAGUCHI S,et al.Validation of band counts in eyestalks for the determination of age of Antarctic krill,Euphausia superba[J].PLoS One,2017,12(2):e0171773.
[16] ABELE L G.The biology of Crustacea:2.Embryology,morphology and genetics[M].New York:Academic Press,1982:440-441.
[17] WEINGARTNER D L.A field-tested internal tag for crayfish (Decapoda,Astacidea)[J].Crustaceana,43(2):181-188.
[18] ERNST B,ORENSANZ J L,ARMSTRONG D A.Spatial dynamics of female snow crab (Chionoecetes opilio) in the eastern Bering Sea[J].Canadian Journal of Fisheries and Aquatic Sciences,2005,62(2):250-268.
[19] MCGAFFIN A F,NICOL S,VIRTUE P,et al.Validation and quantification of extractable age pigments for determining the age of Antarctic krill (Euphausia superba)[J].Marine Biology,2011,158(8):1743-1755.
[20] KILADA R,DRISCOLL J G.Age determination in crustaceans:a review[J].Hydrobiologia,2017,799(1):21-36.
[21] GOSLING E M.Marine bivalve molluscs[M].2nd ed.Chichester:John Wiley &Sons,2015.
[22] HERRERO-P REZRUL M D,REYES-BONILLA H.Weight-Length relationship and relative condition of the holothurian Isostichopus fuscus at Espíritu Santo Island,Gulf of California,México[J].Revista de Biología Tropical,2008,56(3):273-280.
REZRUL M D,REYES-BONILLA H.Weight-Length relationship and relative condition of the holothurian Isostichopus fuscus at Espíritu Santo Island,Gulf of California,México[J].Revista de Biología Tropical,2008,56(3):273-280.
[23] RAM REZ-GONZ
REZ-GONZ LEZ J,MOITY N,ANDRADE-VERA S,et al.Estimation of age and growth and mortality parameters of the sea cucumber Isostichopus fuscus (Ludwig,1875) and implications for the management of its fishery in the Galapagos Marine Reserve[J].Aquaculture and Fisheries,2020,5(5):245-252.
LEZ J,MOITY N,ANDRADE-VERA S,et al.Estimation of age and growth and mortality parameters of the sea cucumber Isostichopus fuscus (Ludwig,1875) and implications for the management of its fishery in the Galapagos Marine Reserve[J].Aquaculture and Fisheries,2020,5(5):245-252.
[24] MORGAN A D.Use of a growth model to estimate size at age in the temperate sea cucumber Australostichopus mollis[J].SPC Beche-de-mer Information Bulletin,2012,32:24-32.
[25] POOT-SALAZAR A,HERN NDEZ-FLORES
NDEZ-FLORES  ,ARDISSON P L.Use of the SLW index to calculate growth function in the sea cucumber Isostichopus badionotus[J].Scientific Reports,2014,4:5151.
,ARDISSON P L.Use of the SLW index to calculate growth function in the sea cucumber Isostichopus badionotus[J].Scientific Reports,2014,4:5151.
[26] AZEVEDO E SILVA F,BRITO A C,SIM ES T,et al.Estimating age and growth parameters for three commercial NE-Atlantic sea cucumbers,Holothuria mammata,H.forskali and H.arguinensis,in a marine protected area[J].Frontiers in Marine Science,2024,11:1295196.
ES T,et al.Estimating age and growth parameters for three commercial NE-Atlantic sea cucumbers,Holothuria mammata,H.forskali and H.arguinensis,in a marine protected area[J].Frontiers in Marine Science,2024,11:1295196.
[27] CURRELL M J,HAN D M,CHEN Z Y,et al.Sustainability of groundwater usage in northern China:dependence on Palaeowaters and effects on water quality,quantity and ecosystem health[J].Hydrological Processes,2012,26(26):4050-4066.
[28] LIBBY W F,ANDERSON E C,ARNOLD J R.Age determination by radiocarbon content:world-wide assay of natural radiocarbon[J].Science,1949,109(2827):227-228.
[29] CHESWORTH J M,STUCHBURY T,SCAIFE J R.Regulation and manipulation of growth and development in animals[M]//An Introduction to Agricultural Biochemistry.Dordrecht:Springer Netherlands,1998:421-445.
[30] 蒋瑞,刘必林,张健,等.甲壳类年龄鉴定方法研究进展[J].海洋渔业,2017,39(4):471-480. JIANG R,LIU B L,ZHANG J,et al.Advance on methods for the age identification of crustaceans[J].Marine Fisheries,2017,39(4):471-480.(in Chinese)
[31] 倪震宇,刘必林,张健,等.利用眼柄微结构研究虾蟹类年龄和生长的进展[J].大连海洋大学学报,2019,34(1):139-144. NI Z Y,LIU B L,ZHANG J,et al.Current progresses direct age determination and growth of shrimps and crabs using microstructure of eyestalks:a review[J].Journal of Dalian Ocean University,2019,34(1):139-144.(in Chinese)
[32] 张学健,程家骅.鱼类年龄鉴定研究概况[J].海洋渔业,2009,31(1):92-99. ZHANG X J,CHENG J H.Survey on study of the fish age determination[J].Marine Fisheries,2009,31(1):92-99.(in Chinese)
[33] BLOWES L M,EGERTOV M,LIU Y K,et al.Body wall structure in the starfish Asterias rubens[J].Journal of Anatomy,2017,231(3):325-341.
M,LIU Y K,et al.Body wall structure in the starfish Asterias rubens[J].Journal of Anatomy,2017,231(3):325-341.
[34] DONNAY G,PAWSON D L.X-ray diffraction studies of echinoderm plates[J].Science,1969,166(3909):1147-1150.
[35] NEBELSICK J H,DYNOWSKI J F,GROSSMANN J N,et al.Echinoderms:hierarchically organized light weight skeletons[M]//Evolution of Lightweight Structures.Dordrecht:Springer Netherlands,2015:141-155.
[36] O’LOUGHLIN P M,ST![]()
![]()
![]() M,et al.A new genus and four new species of sea cucumbers (Echinodermata) from Admiralty Bay,King George Island[J].Polish Polar Research,34(1):67-86.
M,et al.A new genus and four new species of sea cucumbers (Echinodermata) from Admiralty Bay,King George Island[J].Polish Polar Research,34(1):67-86.
[37] 张莉恒,丁君,韩昭衡,等.仿刺参骨片的种类和形态学研究[J].海洋科学,2015,39(4):8-14. ZHANG L H,DING J,HAN Z H,et al.Classification and morphology of ossicles of sea cucumber(Apostichopus japonicus)[J].Marine Sciences,2015,39(4):8-14.(in Chinese)
[38] DEUTLER F.Über das wachstum des seeigel skeletons[J].Zoologische Jahrbücher.Abteilung für Anatomie und Ontogenie der Tiere.Abteilung für Anatomie und Ontogenie der Tiere,1926,48,119-200.
[39] MOORE H B.A comparison of the biology of Echinus esculentus in different habitats.part Ⅱ[J].Journal of the Marine Biological Association of the United Kingdom,1935,20(1):109-128.
[40] JENSEN M.Age determination of echinoids[J].Sarsia,1969,37(1):41-44.
[41] BALBOA C,MOLINET C,BARAHONA N,et al.Using growth ring formation to study growth patterns of exploited sea urchin (Loxechinus albus) populations[J].Fisheries Research,2018,201:88-97.
[42] GAGE J D,TYLER P A.Growth and recruitment of the deep-sea urchin Echinus affinis[J].Marine Biology,1985,90(1):41-53.
[43] OUR NS R,FLORES L,FERN
NS R,FLORES L,FERN NDEZ L,et al.Habitat and density-dependent growth of the sea urchin Paracentrotus lividus in Galicia (NW Spain)[J].Journal of Sea Research,2013,76:50-60.
NDEZ L,et al.Habitat and density-dependent growth of the sea urchin Paracentrotus lividus in Galicia (NW Spain)[J].Journal of Sea Research,2013,76:50-60.
[44] STUMP R J W,LUCAS J S.Linear growth in spines from Acanthaster planci (L.) involving growth lines and periodic pigment bands[J].Coral Reefs,1990,9(3):149-154.
[45] GAGE J D.Skeletal growth zones as age-markers in the sea urchin Psammechinus miliaris[J].Marine Biology,1991,110(2):217-228.
[46] MACNEIL M,CHONG-SENG K R,PRATCHETT D,et al.Age and growth of an outbreaking Acanthaster cf.solaris population within the great barrier reef[J].Diversity,2017,9(1):18.
[47] DAHM C,BREY T.Determination of growth and age of slow growing brittle stars (Echinodermata:Ophiuroidea) from natural growth bands[J].Journal of the Marine Biological Association of the United Kingdom,1998,78(3):941-951.
[48] GAGE J D.Growth and production of Ophiocten gracilis (Ophiuroidea:Echinodermata) on the Scottish continental slope[J].Marine Biology,2003,143(1):85-97.
[49] RAVELO A M,KONAR B,BLUHM B,et al.Growth and production of the brittle stars Ophiura sarsii and Ophiocten sericeum (Echinodermata:Ophiuroidea)[J].Continental Shelf Research,2017,139:9-20.
[50] 廖玉麟.中国动物志:棘皮动物门:海参纲[M].北京:科学出版社,1997. LIAO Y L.Fauna Sinica:Phylum Echinodermata:Class Holothuroidea[M].Beijing:Science Press,1997.(in Chinese)
[51] PURCELL S,SAMYN Y,CONAND C.Commercially important sea cucumbers of the world[M].Food and Agriculture Organization,2012.
[52] CUTRESS B M.Changes in dermal ossicles during somatic growth in the Caribbean littoral sea cucumbers (Echinoidea:Holothurioidea:Aspidochirotida) [J].Bulletin of Marine Science,1996,58(1):44-116.
[53] MASSIN C,MERCIER A,HAMEL J F.Ossicle change in Holothuria scabra with a discussion of ossicle evolution within the Holothuriidae (Echinodermata)[J].Acta Zoologica,2000,81(1):77-91.
[54] BRINKHURST R O.A preliminary guide to the littoral and sublittoral marine invertebrates of Passamaquoddy Bay[M].St.Andrews,NB:Huntsman Marine Laboratory,1976.
[55] SUN J M,HAMEL J F,GIANASI B L,et al.Age determination in echinoderms:first evidence of annual growth rings in holothuroids[J].Proceedings Biological Sciences,2019,286(1906):20190858.
[56] KWONG S L T,VILLACORTA-RATH C,PRATCHETT M,et al.Telomere dynamics in the Pacific crown-of-thorns seastar (Acanthaster cf.solaris):effect of age,diet,and tissue type[J].Coral Reefs,2023,42(5):977-985.
[57] BRADY S M,SCHEIBLING R E.Changes in growth and reproduction of green sea urchins,Strongylocentrotus droebachiensis (Müller),during repopulation of the shallow subtidal zone after mass mortality[J].Journal of Experimental Marine Biology and Ecology,2006,335(2):277-291.
[58] CRAPP G B,WILLIS M E.Age determination in the sea urchin Paracentrotus lividus (Lamarck),with notes on the reproductive cycle[J].Journal of Experimental Marine Biology and Ecology,1975,20(2):157-178.
[59] F RIEL S,HABIB L,DANIELLE P.
RIEL S,HABIB L,DANIELLE P. ge et croissance de l’oursin Paracentrotus lividus Lamarck,1816 (Echinodermata-Echinoidea) dans le Golfe de Tunis (Méditerranée)[J].Oceanologica Acta,2000,23(5):607-613.
ge et croissance de l’oursin Paracentrotus lividus Lamarck,1816 (Echinodermata-Echinoidea) dans le Golfe de Tunis (Méditerranée)[J].Oceanologica Acta,2000,23(5):607-613.
[60] SIME A A T,CRANMER G J.Age and growth of north sea echinoids[J].Journal of the Marine Biological Association of the United Kingdom,1985,65(3):583-588.
[61] JORDANA E,GUILLOU M,LUMINGAS L J L.Age and growth of the sea urchin Sphaerechinus granularis in southern Brittany[J].Journal of the Marine Biological Association of the United Kingdom,1997,77(4):1199-1212.
[62] LUMINGAS L J L,GUILLOU M.Growth zones and back-calculation for the sea urchin,Sphaerechinus granularis,from the Bay of Brest,France[J].Journal of the Marine Biological Association of the United Kingdom,1994,74(3):671-686.
[63] SOUALILI D L,GUILLOU M,SEMROUD R.Age and growth of the echinoid Sphaerechinus granularis from the Algerian coast[J].Journal of the Marine Biological Association of the United Kingdom,1999,79(6):1139-1140.
[64] AGATSUMA Y,NAKATA A.Age determination,reproduction and growth of the sea urchin Hemicentrotus pulcherrimus in Oshoro Bay,Hokkaido,Japan[J].Journal of the Marine Biological Association of the United Kingdom,2004,84(2):401-405.
[65] AGATSUMA Y,NAKABAYASHI N,MIURA N,et al.Growth and gonad production of the sea urchin Hemicentrotus pulcherrimus in the fucoid bed and algal turf in northern Japan[J].Marine Ecology,2005,26(2):100-109.
[66] GEBAUER P,MORENO C A.Experimental validation of the growth rings of Loxechinus albus (Molina,1782) in southern Chile (Echinodermata:Echinoidea)[J].Fisheries Research,1995,21(3/4):423-435.
[67] GAGE J D.Growth of the deep-sea irregular sea urchins Echinosigra phiale and Hemiaster expergitus in the Rockall Trough (N.E.Atlantic Ocean)[J].Marine Biology,1987,96(1):19-30.
[68] BLUHM B A,PIEPENBURG D,VON JUTERZENKA K.Distribution,standing stock,growth,mortality and production of Strongylocentrotus pallidus (Echinodermata:Echinoidea) in the northern Barents Sea[J].Polar Biology,1998,20(5):325-334.
[69] NARVAEZ C A,JOHNSON L E,SAINTE-MARIE B.Growth bands are an unreliable indicator of sea urchin age:evidence from the laboratory and the literature[J].Limnology and Oceanography:Methods,2016,14(8):527-541.
[70] SHELTON A O,WOODBY D A,HEBERT K,et al.Evaluating age determination and spatial patterns of growth in red sea urchins in southeast Alaska[J].Transactions of the American Fisheries Society,2006,135(6):1670-1680.
[71] LI F C,ZHANG J F,CHENG X B,et al.Epigenetic resources:gaps in aquatic animal germplasm research[J].Reviews in Aquaculture,2025,17(1):e12994.
[72] 张云丽,周传江.DNA甲基化与鱼类年龄[J].河南水产,2021(6):20-23. ZHANG Y L,ZHOU C J.DNA methylation and age of fish[J].Henan Fisheries,2021(6):20-23.(in Chinese)
[73] BERDYSHEV G D,KOROTAEV G K,BOIARSKIKH G V,et al.Nucleotide composition of DNA and RNA from somatic tissues of humpback and its changes during spawning[J].Biokhimiia,1967,32(5):988-993.
[74] 李玉强,王睿甲,李语丽,等.基于MethylRAD-Seq技术对仿刺参DNA甲基化图谱的研究[J].中国海洋大学学报(自然科学版),2018,48(9):41-50. LI Y Q,WANG R J,LI Y L,et al.Genome-wide profiling of DNA methylation in Apostichopus japonicas based on MethylRAD-seq[J].Periodical of Ocean University of China(Natural Science Edition),2018,48(9):41-50.(in Chinese)
[75] 程春松.基于端粒研究的人参年限鉴定及其数学模型的构建[D].合肥:安徽中医药大学,2013. CHENG C S.Identification of ginseng age based on telomere research and construction of its mathematical model[D].Hefei:Anhui University of Chinese Medicine,2013.(in Chinese)
[76] BARATA C,CARLOS NAVARRO J,VARO I,et al.Changes in antioxidant enzyme activities,fatty acid composition and lipid peroxidation in Daphnia magna during the aging process[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2005,140(1):81-90.
[77] CORREIA A D,COSTA M H,LUIS O J,et al.Age-related changes in antioxidant enzyme activities,fatty acid composition and lipid peroxidation in whole body Gammarus locusta (Crustacea:Amphipoda)[J].Journal of Experimental Marine Biology and Ecology,2003,289(1):83-101.
[78] 王锦锦,廖梅杰,王印庚,等.仿刺参骨片种类及结构随月龄的变化规律研究[J].科学养鱼,2023(3):73-75. WANG J J,LIAO M J,WANG Y G,et al.Study on the variety and structure of Apostichopus japonicus bone fragments with age[J].Scientific Fish Farming,2023(3):73-75.(in Chinese)
[79] 李磊,潘其乐,蔡广,等.人工智能与专家Greulich-Pyle图谱法骨龄评估的一致性比较[J].中国组织工程研究,2024,28(28):4436-4440. LI L,PAN Q L,CAI G,et al.Consistency between artificial intelligence and expert Greulich-Pyle atlas method for bone age assessment[J].Chinese Journal of Tissue Engineering Research,2024,28(28):4436-4440.(in Chinese)