浮游动物是以原生动物和后生动物为食的生物群体,浮游动物将初级生产力转化为可提供其他生物利用的能量,使生态系的能量流动得以延续,在海洋生态系统中发挥关键作用[1]。浮游动物群落结构在决定初级生产力及初级生产者与高营养性消费者之间的能量转移方面发挥着至关重要的作用[2],其将初级生产力与高营养水平的物种相互联系,为自然界中能量从低级到高级的转化提供了重要的途径[3-4]。物种间的相互竞争被视为影响物种组成、群落规模和多样性的重要因素之一,在环境稳定且缺乏捕食者的情况下,浮游动物群落的演替可能导致某些单一优势种的形成[5]。此外,作为海洋生物泵的组成部分,浮游动物在推动碳的垂直运输上发挥着核心作用,对海洋碳循环做出了显著贡献[6],它们对海洋生态系统及生物地球化学循环具有深远影响,并在海洋二氧化碳分压低于大气时,帮助缓解大气中二氧化碳过量的问题。然而,长期以来这也可能导致海洋酸化[7]。绝大多数浮游动物的生命周期短暂,并且对环境和气候变化极为敏感,人类活动对海洋的影响会迅速反映在浮游生物生态中,这种敏感性不仅有助于研究者监测环境变化,也使人们能够及时采取应对措施保护海洋环境。
靖海湾位于山东省威海市文登区,是一个半封闭式的海湾,总面积约140 km2,由于其地理位置靠近陆地与海洋,靖海湾的物理化学特性在两者相互作用的影响下变得更加复杂[8]。夏斌等[2]对靖海湾松江鲈鱼种质资源保护区的生态质量进行了评估,结果显示,表层海水的溶解无机氮和总磷的平均浓度均超出了Ⅰ级海水水质标准。结合环境因子与营养盐相关性分析,研究表明靖海湾的营养来源主要来自陆地径流的输入。作为全国最大的度夏鲍鱼种苗基地,靖海湾年产鲍鱼苗量超过440亿粒,苗种在国内市场的占有率超过40%。靖海镇是鲍鱼的主要产地之一,并于2023年6月入选为本年度全国鲍鱼产业强镇。然而鲍鱼养殖业可产生氨氮有机物,这种有机氮化合物在废水中释放,从而对靖海湾的水质造成影响[9]。氨氮的过量排放可引发水体富营养化,导致藻类大量繁殖,从而改变水体的透明度和光照条件;藻类的死亡和分解会大量消耗水中溶解氧,对浮游动物等水生生物造成生存压力和氧气竞争。此前,Doney等[10]研究发现,靖海湾的潮流主要受到湾内地形影响,而水温和盐度的变化则与潮汐变化大致相似。刘阳等[11]2015年研究发现,靖海湾的水质相比于2013年呈现出改善的趋势;根据对污染物排放源的研究,春季的氨氮和总磷浓度最低,然而夏季作为丰水期,会有大量周边河流携带农村和城市的废水进入靖海湾,导致污染程度加重。Steinberg等[12]对靖海湾海域的生物群落展开调查,共发现24种生物,且多样性分析结果显示该区域的生物群落结构稳定,环境质量良好。陈学杨等[13]的研究指出,靖海湾存在富营养化问题,尤其是在2022年夏季,靖海湾出现严重的富营养化现象,显著影响了浮游动物的丰度,且盐度变化对浮游动物造成了季节性影响。
通过监测沿海水域特别是海湾地区浮游动物的变化,可以深入了解其种类和数量分布,从而有效评估水域的生态环境。浮游动物是水生生态系统的重要组成部分,其分布和数量不仅能够反映水体的营养水平,还能揭示水质和光照条件等关键因素。这些信息对于预测水域中其他生物的生长和繁殖具有重要意义,为渔业资源的保护与可持续利用提供了科学依据。此外,浮游动物在净化环境污染物方面也发挥着重要作用,通过对浮游动物进行调查,能够更好地了解水中污染物的分布和浓度,进而有助于维护和稳定生态系统的健康。许多浮游动物还是经济鱼类等水生动物的主要食物来源,因此,对浮游动物的研究不仅能够揭示鱼类的饵料迁移路线,还能帮助确定最佳捕鱼季节和渔场,提高渔业生产效率,并为水域的管理和保护提供科学依据。
1 材料与方法
1.1 材料
本研究数据来源于对靖海湾(37°00′00″~37°01′12″N,122°11′24″~122°12′00″E)两个调查航次,共计9个站点(图1)。两个航次的调查时间分别为2023年的5月(春季)和2023年8月(夏季)。调查中水温、盐度和溶解氧等采用多参数水质仪(ProDSS YSI,美国)进行测量。浮游动物的调查规格按照《海洋调查规范第6部分:海洋生物调查》(GB/T 12763.6—2007)进行[14],使用浅水型Ⅰ型浮游生物网垂直采集浮游生物样品,浅水型Ⅰ型浮游生物网装有经校准的流量计(Hydrobios),以保证采集时测量海水体积的准确性。用最终浓度为5%甲醛溶液在500 mL乙烯瓶内固定浮游动物样品,置于黑暗环境中保存后将其送往实验室进行分析。使用10 L Niskin瓶采集表层水样品(深度约2 m),然后通过0.45 μm直径的醋酸纤维素膜过滤器(47 mm)过滤样品,存放在150 mL乙烯瓶中,静置于-20 ℃冷藏条件下,以备进一步处理。使用500 mL海水样品通过低真空压力(<0.04 MPa)提取和定量叶绿素a(Chl-a),使用Whatman GF/F滤膜(25 mm)进行过滤。过滤后的样品立即于-20 ℃冷冻,等待进一步分析。所有生物和环境参数均在同一Niskin瓶中采集的水样品上进行测量。
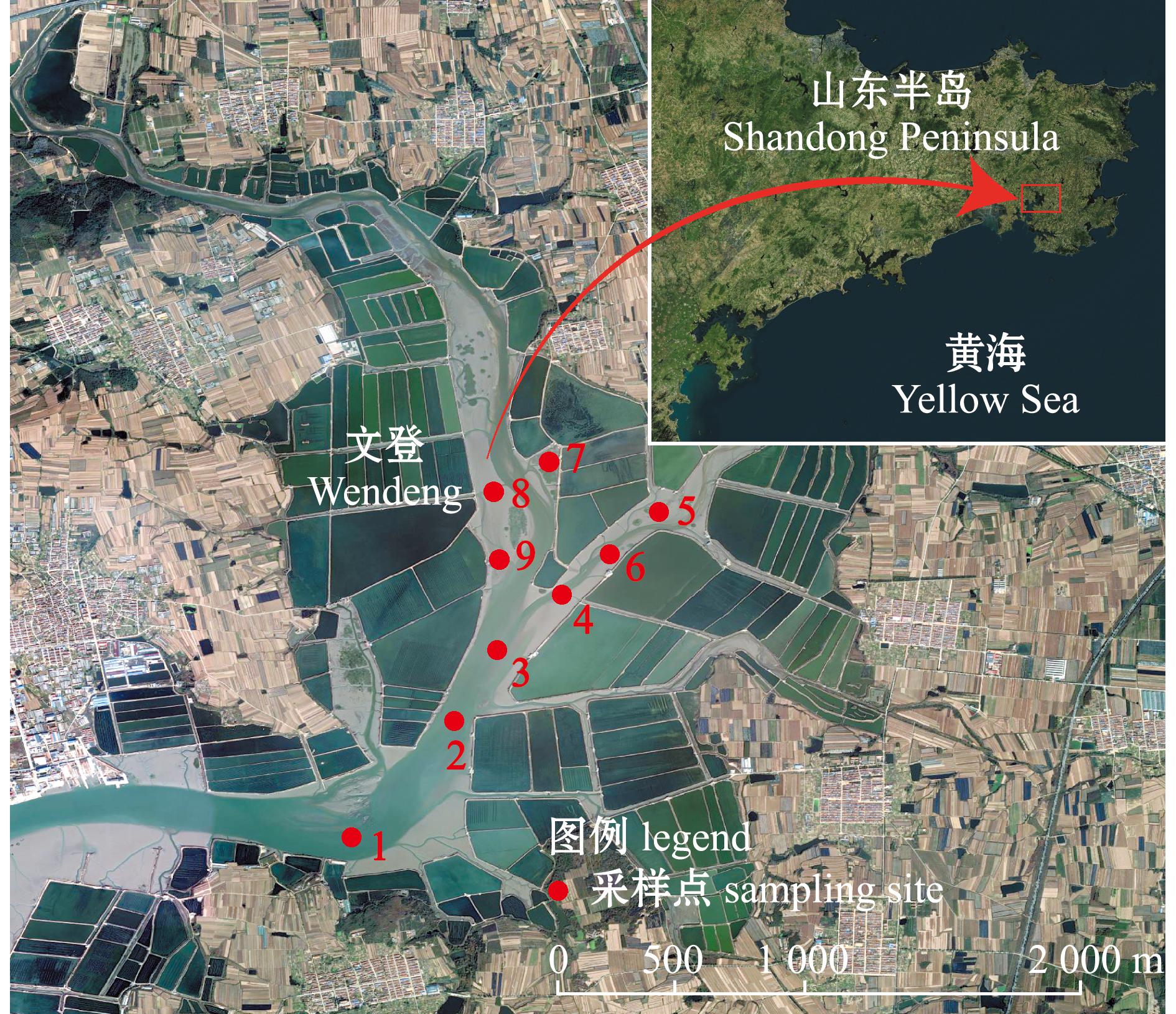
图1 靖海湾站位分布
Fig.1 Jinghai Bay station distribution map
1.2 方法
1.2.1 实验室分析方法 实验室测定时使用0.01 g精密天平对浮游生物生物量进行湿重法称重[15]。营养盐的测定中,主要包括铵盐![]() 硝酸盐
硝酸盐![]() 亚硝酸盐
亚硝酸盐![]() 和磷酸盐
和磷酸盐![]() 通过Technicon AA3自动分析仪(Bran+Luebbe)基于经典比色法在CE Turner荧光仪上进行分析和测定,其中采用水杨酸钠法测定铵盐[16],采用镉柱法测定硝酸盐[17],采用萘乙二胺法测定亚硝酸盐[18],采用磷钼蓝法测定磷酸盐[19]。铵盐、硝酸盐、亚硝酸盐和磷酸盐的检出限分别为0.04、0.015、0.003和0.024,溶解无机氮(DIN)为铵盐、硝酸盐和亚硝酸盐的浓度之和,磷酸盐代表溶解无机磷(DIP)的浓度。将浮游动物样本放置在倒置显微镜(Motic AE2000,40~100倍)下鉴定和计数。在显微分析之前,先将部分大型浮游动物,如水母等挑选出来,再进行定量。随后,至少将剩余浮游生物样品体积的1%放置在浮游生物计数架上,并在Motic AE 2000倒置显微镜下进行检查。在4 ℃黑暗条件下使用5 mL浓度为90%的丙酮溶液萃取24 h后,进行Chl-a样品的提取,根据Welschmeyer [20]的荧光法在CE Turner荧光仪上测定Chl-a的浓度。
通过Technicon AA3自动分析仪(Bran+Luebbe)基于经典比色法在CE Turner荧光仪上进行分析和测定,其中采用水杨酸钠法测定铵盐[16],采用镉柱法测定硝酸盐[17],采用萘乙二胺法测定亚硝酸盐[18],采用磷钼蓝法测定磷酸盐[19]。铵盐、硝酸盐、亚硝酸盐和磷酸盐的检出限分别为0.04、0.015、0.003和0.024,溶解无机氮(DIN)为铵盐、硝酸盐和亚硝酸盐的浓度之和,磷酸盐代表溶解无机磷(DIP)的浓度。将浮游动物样本放置在倒置显微镜(Motic AE2000,40~100倍)下鉴定和计数。在显微分析之前,先将部分大型浮游动物,如水母等挑选出来,再进行定量。随后,至少将剩余浮游生物样品体积的1%放置在浮游生物计数架上,并在Motic AE 2000倒置显微镜下进行检查。在4 ℃黑暗条件下使用5 mL浓度为90%的丙酮溶液萃取24 h后,进行Chl-a样品的提取,根据Welschmeyer [20]的荧光法在CE Turner荧光仪上测定Chl-a的浓度。
1.2.2 生物多样性指数分析方法 运用多样性指数(H′)、均匀度指数(J)和优势度指数(Y)分析浮游动物的群落组成,计算公式为
式中:S代表每个样本中浮游动物的种类总数;N表示所有样本中物种的总丰度;ni为i种物种的个体数量;Pi为i种物种的丰度;fi为i种物种在每个样本中出现的频率,最终结果选优势度Y≥0.02的作为优势种[13]。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,试验数据调查所涉及的站位分布图由ArcMap 10.8制作,而Pearson相关性分析则采用Origin软件进行。同时,冗余分析(redundancy analysis,RDA)使用Canoco 5软件按照国际通用标准完成,以分析研究海域浮游动物优势种与环境因子之间的关系[4]。平面分布图亦由Ocean Data View绘制。
2 结果与分析
2.1 环境因子
靖海湾不同季节间的变化,尤其是夏季丰水期,显著影响环境变量,并对浮游动物群落结构的变化起着决定性作用。靖海湾地处大陆与海洋的交汇地带,加之周边的人为养殖活动和工业生产废水排放,以及流清河等径流的汇入,均对该湾的化学特征产生了显著影响。图2和表1分别展示了2023年靖海湾春、夏季的环境参数及其具体平面分布情况。靖海湾海域受季节影响,春季气温较低,夏季则气温较高。此外,由于地理位置差异,研究区域西北部站位水温普遍高于其他站位(图2 (a)和(d))。盐度方面,春季整体呈现由北向南逐渐递增趋势,夏季亦然,但B7站位盐度却低于25,这可能是由于夏季丰水期青龙河等周边径流带入大量淡水,汇入靖海湾北部,进一步降低了该站位的盐度(图2(b)和(e))。
表1 2023年春、夏季靖海湾环境因子
Tab.1 Environmental Factors of Jing Bay in spring and summer of 2023
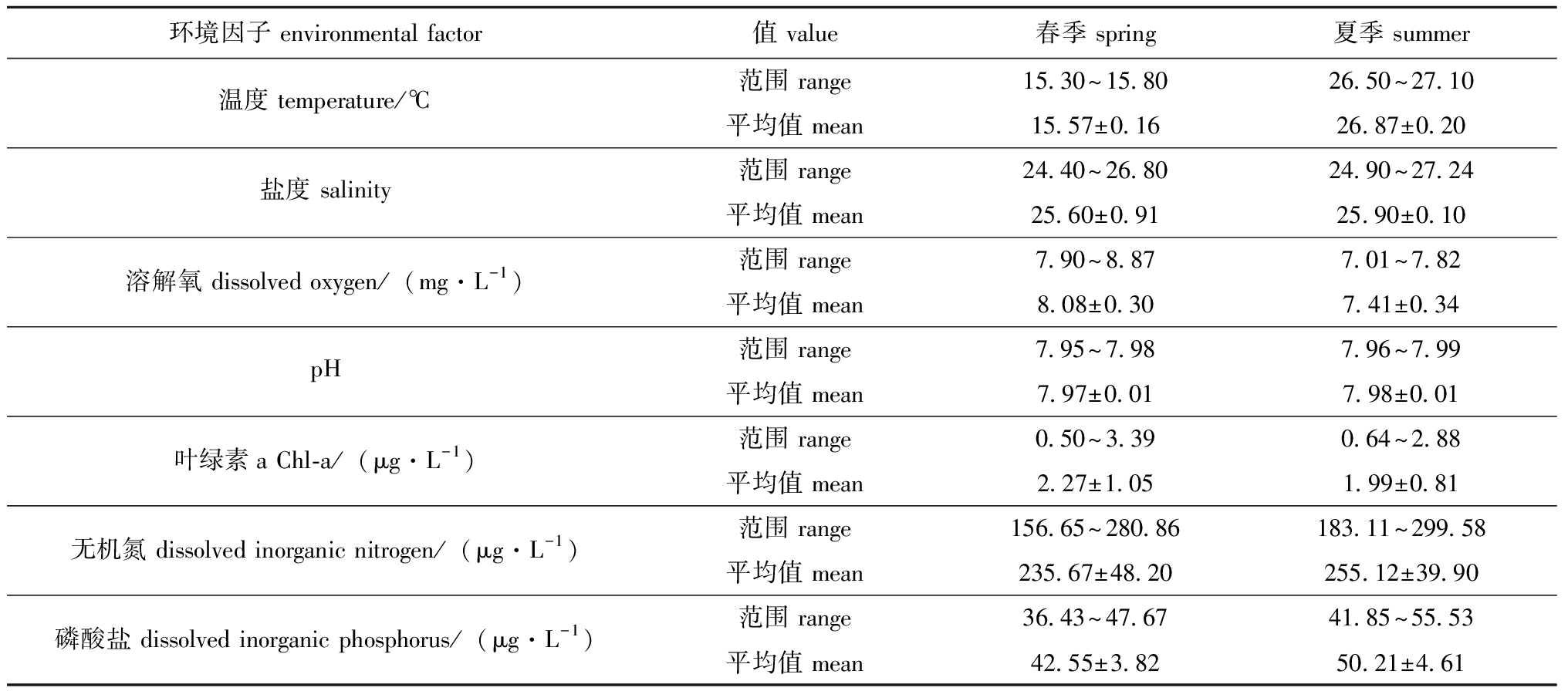
环境因子 environmental factor值 value春季 spring夏季 summer温度 temperature/℃范围 range15.30~15.8026.50~27.10平均值 mean15.57±0.1626.87±0.20盐度 salinity范围 range24.40~26.8024.90~27.24平均值 mean25.60±0.9125.90±0.10溶解氧 dissolved oxygen/(mg·L-1)范围 range7.90~8.877.01~7.82平均值 mean8.08±0.307.41±0.34pH范围 range7.95~7.987.96~7.99平均值 mean7.97±0.017.98±0.01叶绿素a Chl-a/(μg·L-1)范围 range0.50~3.390.64~2.88平均值 mean2.27±1.051.99±0.81无机氮 dissolved inorganic nitrogen/(μg·L-1)范围 range156.65~280.86183.11~299.58平均值 mean235.67±48.20255.12±39.90磷酸盐 dissolved inorganic phosphorus/(μg·L-1)范围 range36.43~47.6741.85~55.53平均值 mean42.55±3.8250.21±4.61

图2 2023年靖海湾春、夏季环境因子平面分布
Fig.2 Plane distribution of environmental factors in spring and summer in Jinghai Bay in 2023
总体来说,pH和溶解氧在空间分布上存在明显差异,呈现南高北低的趋势(图2(c)和(f);图2(g)和(k)),而在季节变化上,pH值则保持稳定,春季的pH范围为7.95~7.98,夏季为7.96~7.99,均属于碱性水平。溶解氧的变化幅度较大,春季由东向西递增,而夏季则由北向南递增。春季Chl-a的浓度为0.50~3.39 μg/L,平均为(2.27±1.05)μg/L(表1),而夏季的浓度范围为0.64~2.88 μg/L,平均为(1.99±0.81)μg/L。研究海域春、夏两季Chl-a的空间分布差异显著,春季Chl-a由北向南逐步降低,变化明显;而在夏季,东北部出现了次高值,整体分布显得不均匀。特别值得注意的是,春季的B9站位和夏季的B4站位均高于其他站位(图2(h)和(l))。无机氮的浓度在不同季节变化上并无显著性差异,其波动幅度约为20 μg/L,春季的平均浓度为(235.67±48.20)μg/L,夏季则为(255.12±39.90)μg/L(表1)。在空间分布上,春、夏季无机氮浓度基本表现为由北向南逐步降低,春季的最高浓度出现在研究区域的东北部,而夏季则主要集中在正北方向,这可能与该区域靠近陆地,与人类活动影响及无机物排放较多有关(图2(i)和(m))。关于磷酸盐,春季的平均浓度最低,为(42.55±3.82) μg/L,而夏季则达到最高值(50.21±4.61) μg/L(表1)。春、夏两季的磷酸盐空间分布较为一致,总体趋势是由东北部向西南部逐渐降低。值得一提的是,在春季,研究区域的最东北部略高的磷酸盐浓度表现出异常,峰值通常出现在研究海域的中部,基本上呈现自北向南贯穿研究区域的趋势(图2(j)和(n))。
2.2 浮游动物的丰度与生物量
靖海湾海域的浮游动物丰度与生物量在季节和空间上均呈现出不同程度的差异(图3)。在春季,两者的分布模式极为相似,最低值均出现在研究海域的东南部,且春、夏两季的最低值分布面积基本一致(图3(a)和(c))。然而,夏季的浮游动物丰度和生物量在空间上的差异则更加明显。尽管研究区域中部的丰度呈中等水平,但生物量却显著较高,显示出明显的不一致性。夏季丰度的最高值位于研究区域的西南部,而生物量在东南部达到最高值的同时,中部也显示出较高数值(图3(b)和(d))。总体而言,夏季浮游动物的生物量在分布上表现出不均匀和较大变化。靖海湾海域浮游动物丰度在季节上也存在差异(表2)。春季丰度波动范围为4.17×103~105.83×103 ind./m3,平均为(36.23±32.54)×103 ind./m3;而夏季的丰度波动范围则为7.5×103~159.17×103 ind./m3,平均为(73.70±54.61)×103 ind./m3,显示出夏季的波动幅度超过春季。浮游动物的生物量同样存在显著的季节差异(表2),其中,春季的最低值与夏季的最高值形成鲜明对比。春季生物量波动范围为5~172.5 mg/m3,平均为(58.70±57.57) mg/m3;而夏季则在127.50~506.67 mg/m3间波动,平均为(321.30±137.83) mg/m3,表明夏季的生物量明显高于春季。以上数据表明,浮游动物的丰度与生物量在空间和季节上的差异均颇为显著。线性回归模型显示,丰度与生物量之间存在显著正相关关系(P≤0.001)(图3(e))。夏季浮游动物丰度与生物量的差距明显(表2),生物量不仅受到丰度的影响,还与浮游动物个体的大小密切相关。
表2 春、夏季浮游动物丰度和生物量的变化范围和平均值
Tab.2 Range and mean values of zooplankton abundance and biomass in spring and summer
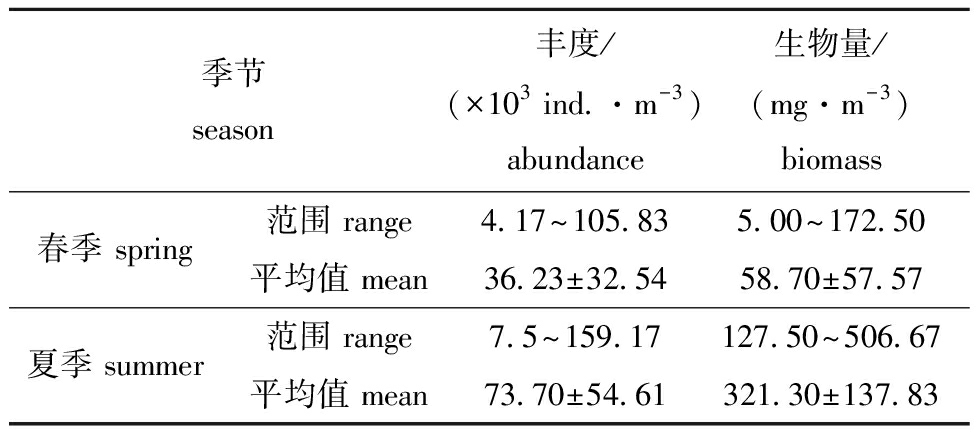
季节season丰度/(×103 ind.·m-3)abundance生物量/(mg·m-3)biomass春季 spring范围 range4.17~105.835.00~172.50平均值 mean36.23±32.5458.70±57.57夏季 summer范围 range7.5~159.17127.50~506.67平均值 mean73.70±54.61321.30±137.83
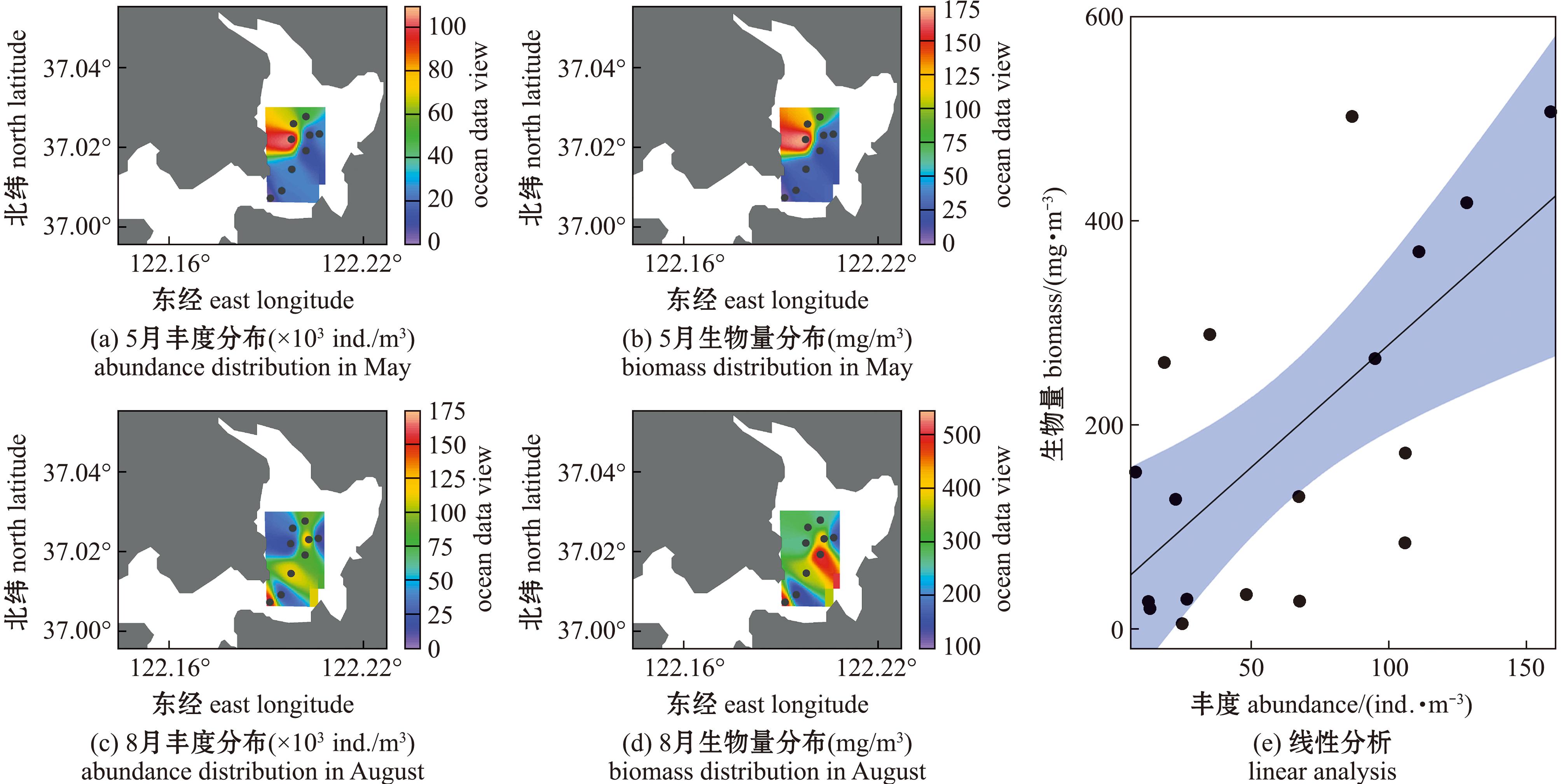
图3 2023年靖海湾浮游动物丰度与生物量平面分布图及线性分析
Fig.3 Plot and linear analysis of zooplankton abundance and biomass in Jinghai Bay in 2023
2.3 浮游动物的群落结构
在2023年5月和2023年8月的两个航次中,靖海湾共检测到浮游动物10类38种。其中,浮游幼虫的种类最多,共有16种,其次是桡足类12种,刺胞动物6种,端足目2种,涟虫目1种,以及毛颚动物1种。2023年5月的调查中,识别出4类15种浮游动物,而在2023年8月识别出6类23种,浮游幼虫占居了最高比例,桡足类紧随其后(表3)。本研究选取优势度Y≥0.02的物种作为优势种。2023年5月共识别出3种优势种,分别是太平洋真宽水蚤(Eurytemora pacifica)、捷氏歪水蚤(Tortanus derjugini)和短尾类蚤状幼体(Zoea larva Brachyura);2023年8月优势种同样为3种,分别是太平洋纺锤水蚤(Acartia pacifica)、捷氏歪水蚤和短尾类蚤状幼体。值得注意的是,捷氏歪水蚤和短尾类蚤状幼体在两个航次中均被认定为优势种,表明这两种浮游动物在靖海湾海域可能保持主导地位。此外,浮游幼虫、端足目和刺胞动物的种类数量均呈现上升趋势,而桡足类则表现出下降趋势。这一变化反映了浮游动物群落结构的动态变化。
表3 靖海湾浮游动物物种组成
Tab.3 Species composition of zooplankton in Jinghai Bay
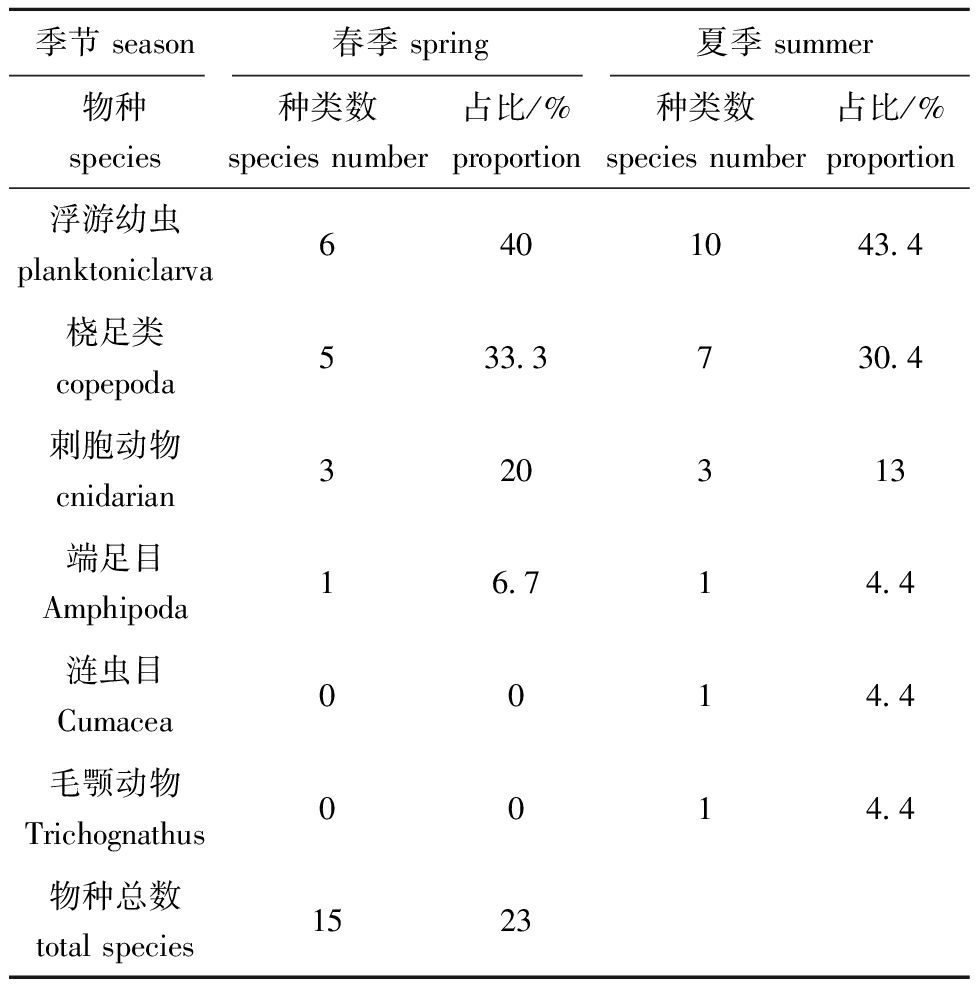
季节 season春季 spring夏季 summer物种species种类数species number占比/%proportion种类数species number占比/%proportion浮游幼虫planktoniclarva6401043.4桡足类copepoda533.3730.4刺胞动物cnidarian320313端足目Amphipoda16.714.4涟虫目Cumacea0014.4毛颚动物Trichognathus0014.4物种总数total species1523
对浮游动物群落结构的评价主要依赖于Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)这两个关键指标。在本次调查中,靖海湾的浮游动物群落展现出显著的空间和季节差异(图4和表3)。总体而言,靖海湾在春、夏季节的H′指数和J指数在空间分布上表现出较大变化。从空间分布来看,春季H′指数较高的站位主要位于B2和B6站位(图4(a)),而其他站位之间的差异则明显减小,表明这些站位的群落结构趋于同质化。然而,到了夏季,调查区域内H′指数的空间分布则显得更为多样化(图4(c))。在夏季,尽管多样性指数较高,但均匀度指数却相对较低,显示出该区域的浮游动物种类丰富,但分布却不均匀。与此形成鲜明对比的是,春季的浮游动物种类相对较少,但其分布却相对均匀。靖海湾海域H′指数和J指数的平均值亦展现出明显的季节变化(图4和表4)。在春季,H′指数较低且变动幅度有限,波动范围为1.62~2.46,平均值为2.05±0.28(表4)。而夏季H′指数有所上升,但变动范围扩大至0.47~3.04,平均值降至1.87±0.76。春季的J指数在空间分布上与夏季存在较大差异,但变动幅度则小于夏季,春季的J指数波动范围为0.54~0.96,平均值为0.80±0.14;而夏季的波动范围则为0.20~0.94,平均值为0.61±0.23。值得注意的是,研究区域春季的J指数最大值出现在东南部,相较于夏季,其分布更为广泛,显示出更好的均匀度,这表明该海域春季的浮游动物分布相较于夏季更为均匀(图4(b)和图3(d))。
表4 春、夏季浮游动物H′指数和J指数变化范围和平均值
Tab.4 Variation range and average value of H′ index and J index of zooplankton in spring and summer
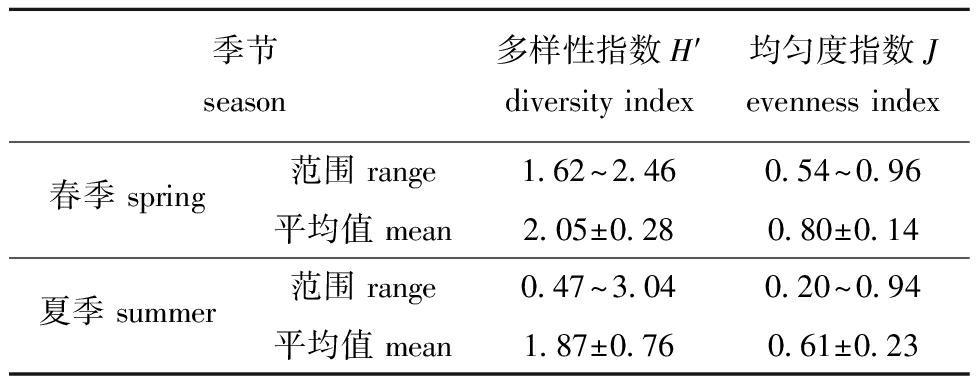
季节season多样性指数H′diversity index 均匀度指数Jevenness index春季 spring范围 range1.62~2.460.54~0.96平均值 mean2.05±0.280.80±0.14夏季 summer范围 range0.47~3.040.20~0.94平均值 mean1.87±0.760.61±0.23
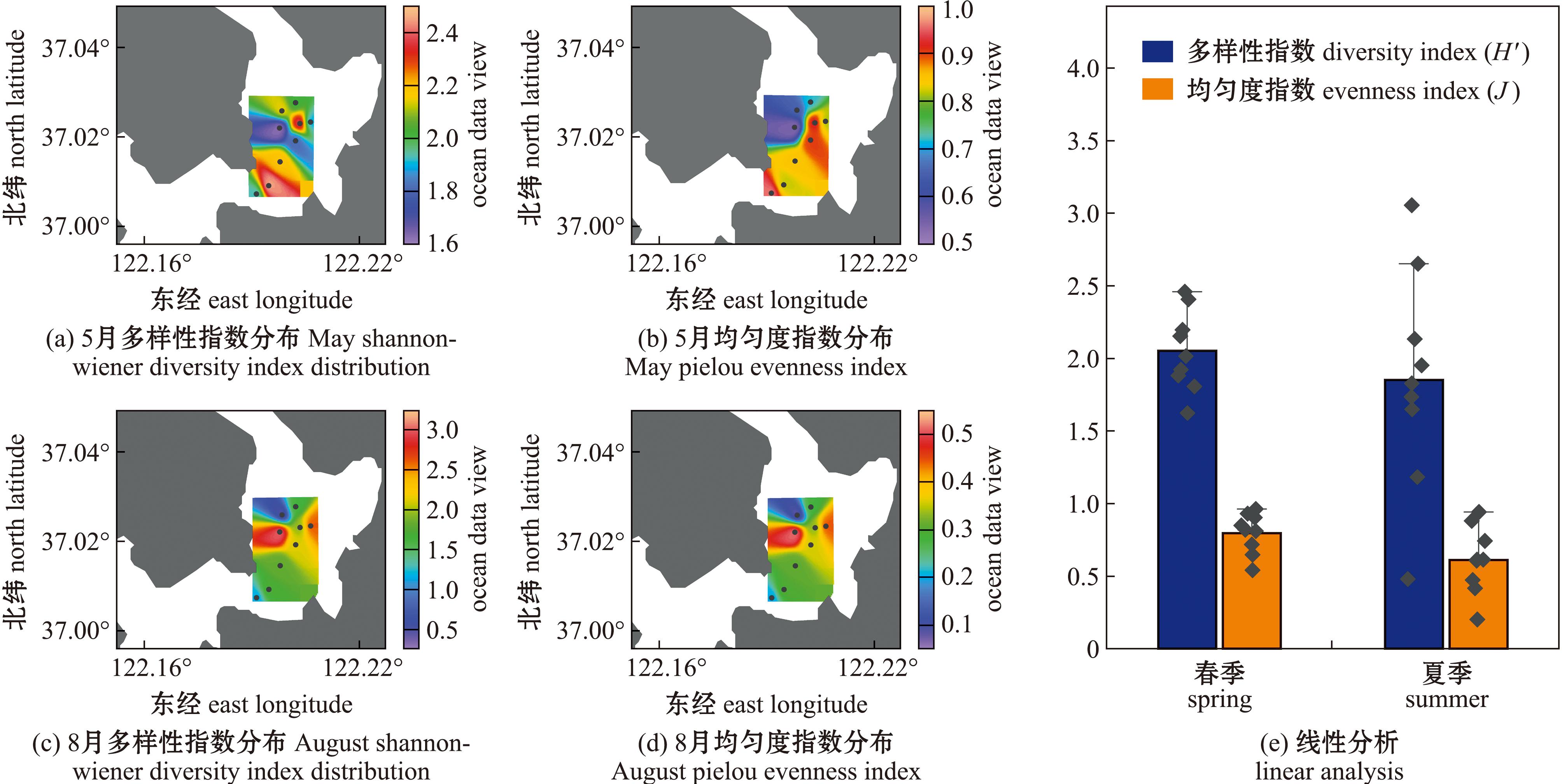
图4 2023年靖海湾Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)的空间分布及季节变化
Fig.4 Spatial distribution and seasonal variation of Shannon-Wiener diversity index (H′) and Pielou evenness index (J) in Jinghai Bay in 2023
2.4 浮游动物群落与环境因子的相关性分析
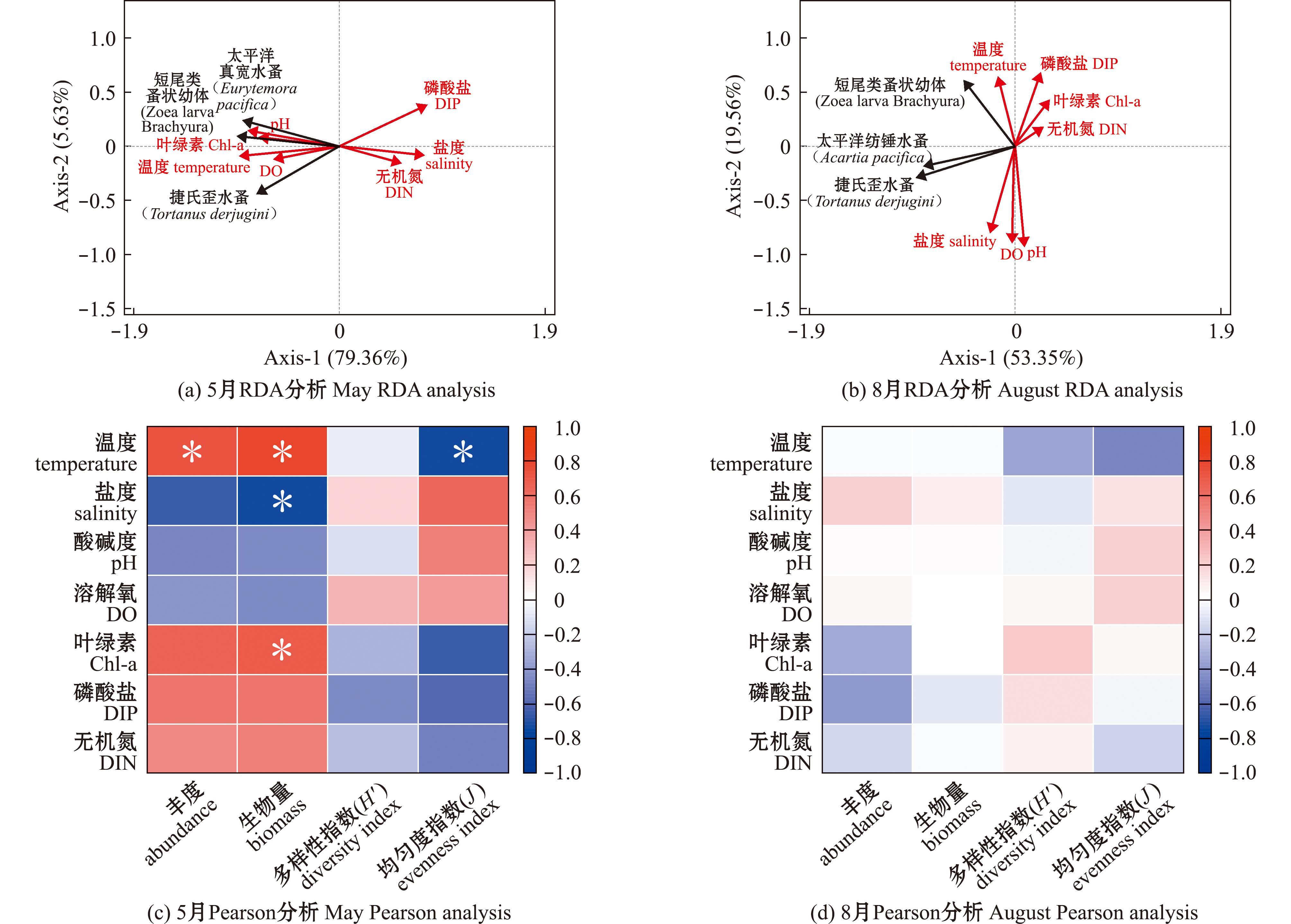
为了深入探讨环境因子对靖海湾浮游动物群落的影响,笔者对靖海湾浮游动物及其环境因子进行了冗余分析(RDA)。根据优势种与环境因子之间的RDA分析结果(图5)可知,春季3种优势种太平洋真宽水蚤、捷氏歪水蚤和短尾类蚤状幼体均与水温、溶解氧、pH值和Chl-a呈正相关关系。值得注意的是,太平洋真宽水蚤和短尾类蚤状幼体与pH和Chl-a之间存在显著相关性。夏季3种优势种中太平洋纺锤水蚤则与Chl-a、无机氮和磷酸盐呈现负相关,这一特征与春季优势种捷氏歪水蚤相似。短尾类蚤状幼体在春季和夏季调查中均与水温呈现正相关,表明水温可能是影响其生长与繁殖的一个关键因素。在春季和夏季的两次调查中,捷氏歪水蚤和短尾类蚤状幼体均为优势种。具体而言,春季捷氏歪水蚤和短尾类蚤状幼体与磷酸盐、无机氮和盐度呈现负相关;而在夏季,短尾类蚤状幼体与盐度呈负相关,与水温则呈现出正相关,尽管其相关性明显弱于春季。这一结果表明,水温的变化可能对短尾类蚤状幼体的生活状态产生了一定影响。
*表示P≤0.05;**表示P≤0.01。*means P≤0.05;**means P≤0.01.
图5 2023年靖海湾浮游动物优势种与环境因子的冗余分析(RDA)及环境因子与生物参数的Pearson分析
Fig.5 Redundancy analysis (RDA) of zooplankton dominant species with environmental factors and Pearson analysis of environmental factors and biological parameters in Jinghai Bay in 2023
Pearson相关性分析表明,2023年靖海湾海域浮游动物群落丰度、生物量、H′指数和J指数的季节变化会受到各种环境变量的影响。春季水温与Chl-a呈现出显著的正相关(P≤0.01)(图5(a))且Chl-a可以表示浮游植物的生物量,因此可以通过检测水体中Chl-a含量,根据Chl-a与生物参数的相关性,判断研究期间浮游植物对浮游动物的影响。根据Pearson相关性分析,春季浮游动物的生物量与该海域的Chl-a呈现出正相关(P≤0.05)(图5(a)),这说明浮游动物的生物量可能与浮游植物的Chl-a密切相关,另一方面,这也可能表明浮游植物的生长有利于靖海湾海域浮游动物的生长,除了Chl-a以外,春季浮游动物的生物量和盐度呈现出负相关(P≤0.05)(图5(a)),这意味着靖海湾春季浮游动物生物量在一定程度上可能会受到盐度变化的影响。此外,无论春季还是夏季浮游动物都能较好地适应不同浓度的无机氮和磷酸盐,浮游动物的生物量与丰度并不会受到两者浓度变化的影响,也就是说两者的浓度并不会对浮游动物的生长情况有太大影响。值得注意的是,春季浮游动物丰度和生物量均与水温呈现出正相关(P≤0.05)(图5(a))这表明水温的变化可能会对浮游动物的生长存在有利影响,但是水温与浮游动物的均匀度呈现出负相关,这表明春季偏低的水温似乎并不利于浮游动物的分布。综上所述,Chl-a、水温和盐度可能是影响春季浮游动物生长的关键因素,而水温可能是影响浮游动物分布情况的关键因素。
3 讨论
3.1 环境因子变化的影响
众所周知,与海洋淡水湖泊等生态系统相比,海湾等沿海生态系统的结构更为复杂,且更易受到外部因素的干扰,这使得其生态功能往往显得不太稳定[21]。海洋浮游动物在维持海洋生命系统的正常运行中扮演着关键角色,因此,深入研究环境因子对海洋浮游动物的影响显得尤为重要。浮游动物群落结构受到季节变化的显著影响[22],这些变化主要体现在Chl-a、水温和盐度等因素中[23]。水温被广泛认为是海洋生态系统中最重要的物理变量之一[3],对浮游动物的生长和繁殖具有重要影响。研究表明,浮游生物群落的组成、丰度和营养效率与水温密切相关,这不仅体现在其直接的生理反应上,伴随全球变暖,越来越多的研究指出,高温会在不同程度上影响单细胞生物的承载能力和体积,导致浮游生物最大细胞数可能随温度的上升而减少[24],进而降低生物的丰度。已有研究表明,浮游动物的多个方面都会受到水温的影响,如分布、代谢、发育、繁殖、生长及食物供应等[25]。此外,有研究指出,水温和盐度是影响中国近海区域浮游动物群落结构的重要环境因素[26]。已有研究表明,海洋水温的上升(即气候变暖)将对海洋浮游动物产生深远影响。海水温度的变化可能会对浮游动物的生理功能、酶活性和新陈代谢造成影响。这种间接影响可能导致海水上层水体出现层化现象,使浮游动物直接暴露在紫外线辐射下,进而影响其生长和繁殖等生理活动[27],本研究结果也表明,水温在一定程度上直接影响着浮游动物的生存和分布(图5)。本研究中发现,水温与浮游动物分布的均匀度呈现出负相关关系。随着水温的升高,浮游动物的基础代谢率也随之增加,并且随着温度的上升会影响营养物质的分布,从而影响其分布情况[10]。本研究中的RDA相关性分析(图5)显示,靖海湾海域春季的优势种与水温间呈现出正相关关系,而在夏季,仅有一种优势种与水温呈现正相关,这表明,靖海湾春、夏两季,水温可能是影响浮游动物群落分布的关键因素。在两个季节调查中的6个优势种中,4个是桡足类。已有研究表明,桡足类浮游动物与水温间存在负相关关系,此外,1959—1992年对渤海长达30年的研究中也发现了类似现象[28],在笔者收集的数据中,夏季浮游动物对水温的响应并不显著,这在一定程度上解释了为何夏季优势种中有三分之二为桡足类,但其对水温无明显的倾向。一个群落的结构通常是由优势种所决定的,根据RDA相关性分析(图5),在两个航次的调查中,短尾类蚤状幼体始终是优势种,并且与水温呈现出明显的相关性,尤其在春季尤为突出,这可能是导致生物量与丰度在两个季节均呈现正相关的原因之一。体型大小与生物体的适应性、生态和生理特征密切相关,被视为主要特征之一[29],试验研究也显示,水温对浮游动物的结构和组成具有重要影响。有学者提出,全球变暖可能导致海洋中小型浮游动物的比例增加。这是因为全球变暖可能间接加大鱼类的捕食压力,从而减少了大型浮游动物的数量。研究表明,温度变化会影响浮游动物体型的大小,实验室分析也确认,变温动物的体型与温度之间存在密切关联。此外,在胶州湾和黄海沿海的浮游动物研究中发现,小型桡足类浮游动物数量增加,平均体型普遍下降,这与全球变暖对海洋系统影响的预测一致[30]。
温度不仅直接影响浮游动物的代谢率和存活率,还会对水的物理和化学性质(如盐度和溶解氧等)产生深远影响,进而影响鱼类、浮游植物及大型植物群落的组成,最终对浮游动物的丰度和生物量产生连锁反应。除水温外,盐度同样是影响浮游动物群落变化的重要因素。有研究表明,盐度与浮游动物种类数量间存在显著关系,且盐度影响水生生物的渗透调节能力[31]。咸水环境的一个显著特征是环境条件的高度不稳定,这主要取决于水体中盐度。浮游动物群落的物种组成和分布在很大程度上受到海水中盐浓度的影响[32]。许多浮游动物在面对过高或过低的盐度时,往往会选择避免不利环境,从而影响其丰度等生态指标。此外,浮游动物的数量和多样性变化可能直接或间接地受到海水盐度变化的影响。这些因素共同塑造了浮游动物在海洋生态系统中的分布格局和动态。
3.2 其他因素的影响
靖海湾独特的地理位置使其每年夏季都会受到极端天气的影响,如2023年夏季,靖海湾遭受了雷暴大风的侵袭。顾书瑞等[33]研究表明,强降雨前后会对水温、盐度和营养盐等环境因子产生不同程度的影响。这些变化不仅会改变水体的初级生产力,还会通过此过程进一步影响浮游动物的群落结构。Hoover等[34]对夏威夷卡内奥赫湾的研究表明,经过强降雨和大风的影响,表层海水中能够保持较高的营养盐浓度,因此会对浮游植物分布产生影响。水生生态系统中的食物链以浮游植物为基础,它们通过吸收太阳能并将其转化为生物化学能,成为海洋生态系统中的初级生产者[35],虽然浮游生物位于食物链的底层,但浮游动物依赖捕食浮游植物以维持生存。这一生物相互作用保证了能量在生态系统中的传递,从较低水平向较高水平流动。这也使得浮游动物的密度与浮游植物的生物量产生直接关系,而浮游植物的生物量可以通过Chl-a浓度进行有效计算[21]。研究表明,靖海湾还面临着严重的富营养化问题,这一现象是浮游动物群落变化的重要影响因素[13],富营养化的环境为植食性浮游动物提供了丰富的食物资源,无论是直接还是间接方面,都对浮游动物的群落结构产生了显著影响[36]。
4 结论
1)调查海域浮游动物的丰度与生物量在空间分布和季节变化上存在显著性差异,反映出该生态系统的复杂性和动态特性。
2)调查海域浮游动物群落结构呈现显著的时空动态特征,其中春季的空间分布均匀性明显高于夏季。
3)调查海域浮游动物的生长动态受水温等多元环境因子的协同调控,证实环境胁迫在其生态适应过程中具有关键作用。
[1] WEI Y Q,CHEN X Y,LIU Y,et al.Key determinants controlling the seasonal variation of coastal zooplankton communities:a case study along the Yellow Sea[J].Marine Pollution Bulletin,2023,193:115-175.
[2] 夏斌,马绍赛,崔毅,等.2008年夏季靖海湾松江鲈鱼种质资源保护区生态环境质量综合评价[J].海洋环境科学,2010,29(5):762-766. XIA B,MA S S,CUI Y,et al.Synthetic evaluation on environment quality in Trachidermus fasciatus Heckel germplasm resource protection area of Jinghai Bay,in summer,2008[J].Marine Environmental Science,2010,29(5):762-766.(in Chinese)
[3] RICHARDSON A J.In hot water:zooplankton and climate change[J].ICES Journal of Marine Science,2008,65(3):279-295.
[4] CHEN X Y,CUI Z G,ZHANG Y,et al.Contrasting effects of river inflow and seawater intrusion on zooplankton community structure in Jiaozhou bay,the Yellow Sea[J].Marine Environmental Research,2023,192:106194.
[5] GAUZE G F.The struggle for existence[M].Baltimore:The Williams &Wilkins company,1934.
[6] SHI Y Q,WANG J,ZUO T,et al.Seasonal changes in zooplankton community structure and distribution pattern in the Yellow Sea,China[J].Frontiers in Marine Science,2020,7:391.
[7] WEI Y Q,ZHANG G C,CHEN J,et al.Dynamic responses of picophytoplankton to physicochemical variation in the eastern Indian Ocean[J].Ecology and Evolution,2019,9(8):5003-5017.
[8] MCLUSKY D S,ELLIOTT M.The estuarine ecosystem: ecology, threats and management[M].Oxford:Oxford University Press,2004.
[9] LI H T,YU G Q,LIU X Y.Distribution characteristics of nutrients in Wuleidao Bay and Jinghai Bay,Wendeng,China[J].Aquatic Science and Technology,2014,3(1):1.
[10] DONEY S C,RUCKELSHAUS M,EMMETT DUFFY J,et al.Climate change impacts on marine ecosystems[J].Annual Review of Marine Science,2012,4:11-37.
[11] 刘阳,李洪涛,于国庆,等.2015年靖海湾及五垒岛湾海域表层海水化学要素时空分布特征及潜在富营养化评价[J].河北渔业,2019(10):41-46. LIU Y,LI H T,YU G Q,et al.Spatial-temporal distribution of chemical parameters and eutrophication evaluation in surface water of Jinghai Bay and Wuleidao Bay in 2015[J].Hebei Fisheries,2019(10):41-46.(in Chinese)
[12] STEINBERG D K,LANDRY M R.Zooplankton and the ocean carbon cycle[J].Annual Review of Marine Science,2017,9:413-444.
[13] 陈学杨,丁东生,崔正国,等.靖海湾富营养化海域浮游动物群落变化及其影响因素[J].渔业科学进展,2024,45(2):14-27. CHEN X Y,DING D S,CUI Z G,et al.Changes and influencing factors of the zooplankton community in the eutrophic waters of Jinghai Bay[J].Progress in Fishery Sciences,2024,45(2):14-27.(in Chinese)
[14] 中华人民共和国国家质量监督检验检疫总局:GB 18688—2002海洋沉积物质量标准[S].北京:中国标准出版社.2002. General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.GB 18688—2002 Marine Sediment Quality Standards[S].Beijing:Standards Press of China,2002.
[15] ALCARAZ M,SAIZ E,CALBET A,et al.Estimating zooplankton biomass through image analysis[J].Marine Biology,2003,143(2):307-315.
[16] VERDOUW H,VAN ECHTELD C J A,DEKKERS E M J.Ammonia determination based on indophenol formation with sodium salicylate[J].Water Research,1978,12(6):399-402.
[17] JONES M N.Nitrate reduction by shaking with cadmium Alternative to cadmium columns[J].Water Research,1984,18(5):643-646.
[18] MISKO T P,SCHILLING R J,SALVEMINI D,et al.A fluorometric assay for the measurement of nitrite in biological samples[J].Analytical Biochemistry,1993,214(1):11-16.
[19] CROUCH S R,MALMSTADT H V.Mechanistic investigation of molybdenum blue method for determination of phosphate[J].Analytical Chemistry,1967,39(10):1084-1089.
[20] WELSCHMEYER N A.Fluorometric analysis of chlorophyll a in the presence of chlorophyll b and pheopigments[J].Limnology and Oceanography,1994,39(8):1985-1992.
[21] LU Y L,YUAN J J,LU X T,et al.Major threats of pollution and climate change to global coastal ecosystems and enhanced management for sustainability[J].Environmental Pollution,2018,239:670-680.
[22] TACHIBANA A,ISHIMARU T,ITOH H,et al.Seasonal and annual change in community structure of meso-sized copepods in Tokyo Bay,Japan[J].Journal of Oceanography,2013,69(5):545-556.
[23] SUN J,FENG Y,ZHOU F,et al.Top-down control of spring surface phytoplankton blooms by microzooplankton in the Central Yellow Sea,China[J].Sea Research Part Ⅱ Topical Studies in Oceanography.2013,97,51-60.
[24] SAVAGE V M,GILLOLY J F,BROWN J H,et al.Effects of body size and temperature on population growth[J].The American Naturalist,2004,163(3):429-441.
[25] ZHAO Q Y,LIU S T,NIU X L.Effect of water temperature on the dynamic behavior of phytoplankton-zooplankton model[J].Applied Mathematics and Computation,2020,378:125211.
[26] ANTON-PARDO M,ARMENGOL X.Effects of salinity and water temporality on zooplankton community in coastal Mediterranean ponds[J].Estuarine,Coastal and Shelf Science,2012,114:93-99.
[27] BOYD P W,COLLINS S,DUPONT S,et al.Experimental strategies to assess the biological ramifications of multiple drivers of global ocean change:a review[J].Global Change Biology,2018,24(6):2239-2261.
[28] WANG W C,SUN S,ZHANG F,et al.Zooplankton community structure,abundance and biovolume in Jiaozhou Bay and the adjacent coastal Yellow Sea during summers of 2005-2012:relationships with increasing water temperature[J].Journal of Oceanology and Limnology,2018,36(5):1655-1670.
[29] BROWN J H,GILLOOLY J F,ALLEN A P,et al.Toward a metabolic theory of ecology[J].Ecology,2004,85(7):1771-1789.
[30] GARZKE J,ISMAR S M H,SOMMER U.Climate change affects lowtrophic level marine consumers:warming decreases copepod size and abundance[J].Oecologia,2015,177(3):849-860.
[31] SCHALLENBERG M,HALL C J,BURNS C W.Consequences of climate-induced salinity increases on zooplankton abundance and diversity in coastal lakes[J].Marine Ecology Progress Series,2003,251:181-189.
[32] LANCE J.Effects of water of reduced salinity on the vertical migration of zooplankton[J].Journal of the Marine Biological Association of the United Kingdom,1962,42(2):131-154.
[33] 顾书瑞,李琦,孙涵,等.强降雨对胶州湾浮游动物群落结构的影响[J].海洋环境科学,2016,35(2):190-195. GU S R,LI Q,SUN H,et al.Impact ofrainstorm on community structure of zooplankton in Jiaozhou Bay[J].Marine Environmental Science,2016,35(2):190-195.(in Chinese)
[34] HOOVER R S,HOOVER D,MILLER M,et al.Zooplankton response to storm runoff in a tropical estuary:bottom-up and top-down controls[J].Marine Ecology Progress Series,2006,318:187-201.
[35] JAKHAR P.Role of phytoplankton and zooplankton as health indicators of aquatic ecosystem:a review[J].International Journal of Innovation Research Study,2013,2(12),489-500
[36] JONES R H,FLYNN K J.Nutritional status and diet composition affect the value of diatoms as copepod prey[J].Science,2005,307(5714):1457-1459.