海洋线虫具有生活周期短、终生营底栖且扩散能力弱、数量多、多样性高、分布范围广等特点[1-2],并成为生态学和生物学中重要的研究材料。其食物来源丰富,能以底栖硅藻、有机碎屑、细菌和真菌等为食,从而占据不同营养级,进而促进底栖生态系统和底层-水层间的物质循环和能量流动;同时,线虫特有的生殖对策在底栖生态系统营养循环、二次生产、泥沙输送和矿化作用中,尤其是碳和氮等关键成分的循环中发挥着重要作用[3-5]。另一方面,线虫耐受极端能力强,可作为海洋底栖环境监测中响应气候变化和适应新环境的指示物种[6]。尽管海洋线虫具有极大的物种多样性,但基于其个体小、可用于分类的特征较少等特点,其分类工作在海洋无脊椎动物类群中的研究仍不够充分。
日照沿海地处黄海中部,沿岸有多条河流携带陆源碎屑汇入,同时受黄海冷水团、黄海暖流的影响,营养物质充足,海洋生物蕴藏量极为丰富[7-8]。海洋底质复杂多样,差异化的底质为不同生态类型的海洋底栖生物尤其是线虫提供了适宜的栖息环境,是研究底栖生态系统和底栖生物的理想场所。然而,近年来仅郝映东[9]和Huang等[10-13]在日照沿海潮下带及潮间带的万宝赶海园沙滩、岚山多岛海等站位进行了新种的描述,而对该海域的底栖生物群落结构及线虫分类缺乏较为系统的研究。据估计,中国海洋线虫常见种有1 000余种,现仅报道500余种[14],仍有大量的新种、新纪录种未得到描述,因此,做好线虫的种类调查、摸清底数仍是目前研究的首要任务。
本研究中对采集自日照沿海潮间带12个站位的未受扰动的沉积物样品进行了分析,对小型底栖生物的种类组成及群落结构,尤其是自由生活海洋线虫进行了分类研究,共鉴定出262种,该研究为中国海洋线虫的研究提供了基础数据,对海洋生物多样性研究和资源保护具有重要意义。
1 材料与方法
1.1 材料
2022年5月和8月,在日照沿海(35°4′48″~35°30′24″ N,119°18′38″~119°36′58″ E)潮间带采集小型底栖生物样品,对其中12个站位沉积物样品中的自由生活海洋线虫进行了种类组成和多样性研究。
1.2 方法
1.2.1 样品采集 用改装的2.6 cm直径注射器作为取样管,分别按0~2 cm和2~8 cm分层收集,各取4个重复样,加入等体积的10% 海水福尔马林固定,用于线虫的形态学研究,将样品分别装入提前编号的125 mL的塑料样品瓶中,并做好相应记录。另外,刮取0~5 cm表层沉积物样品固定于150 mL的塑料样品瓶中,用于线虫的定性研究。
1.2.2 样品分选及类群计数 加入虎红染色,然后将样品依次通过500 μm和42 μm的网筛,用自来水冲洗,选取500 μm网筛滤过、42 μm网筛截留的样品;截留样品用Ludox溶液转移至离心管中,离心后取上清液,重复该步骤离心3次,将上清液离心合并后过滤掉Ludox溶液,用蒸馏水把样品转移到培养皿中,将小型底栖生物按线虫类、桡足类、多毛类和其他类分开并计数。将各类群的丰度换算为ind./10 cm2,生物量换算为 μg dwt/10 cm2。
1.2.3 制片 线虫中加入透明液(甘油、乙醇和水的混合液),虫体透明后滴加甘油,选取与虫体直径大致相同的玻璃珠支撑虫体,加盖盖玻片后用封片制成永久装片。
1.2.4 分类鉴定 在微分干涉显微镜(蔡司,Axiscope-5)下进行虫体的观察和测量,测量虫体的长、宽、尾、化感器和交接刺等形态学参数,并计算“德曼”值,借助平板(苹果公司,iPad 2020)用Zeiss软件绘图。根据De Ley等[15]线虫分类系统、查询Worms(https://www.marine species.org)网站以及相关文献,对线虫进行分类鉴定。
1.3 数据处理
甲醛固定样品通过初步分选,获得小型底栖生物各类群的种类和个体数量,计算各类群的丰度、生物量、生产量等,并进一步分析样品采集海域的环境状况。
对线虫进行观察和鉴定后,得到该海域线虫的物种分布信息,使用Primer 6.0软件分析线虫的多样性特征。
2 结果与分析
2.1 底栖动物种类组成及群落结构
在12个站位的沉积物样品中,分选得到9个小型底栖生物类群(表1),分别为线虫类、缓步类、桡足类、多毛类、介形类、双壳类、涡虫类、寡毛类及其他类群,平均丰度为(1 079±128) ind./10 cm2。线虫类在小型底栖生物丰度中占绝对优势(91.1%),平均丰度为(983±112) ind./10 cm2,缓步类为第二位(5%),桡足类次之(1.6%)。小型底栖生物生物量和生产量计算中的平均干质量结果显示线虫为最多,占小型底栖生物总生物量和生产量的41.6%;缓步类第二,占小型底栖生物总生物量和生产量的20.1%;而多毛类为第三位,占13.8%。
表1 日照沿海潮间带小型底栖生物的数量特征
Tab.1 Quantitative characteristics of meiofauna in Rizhao intertidal zone
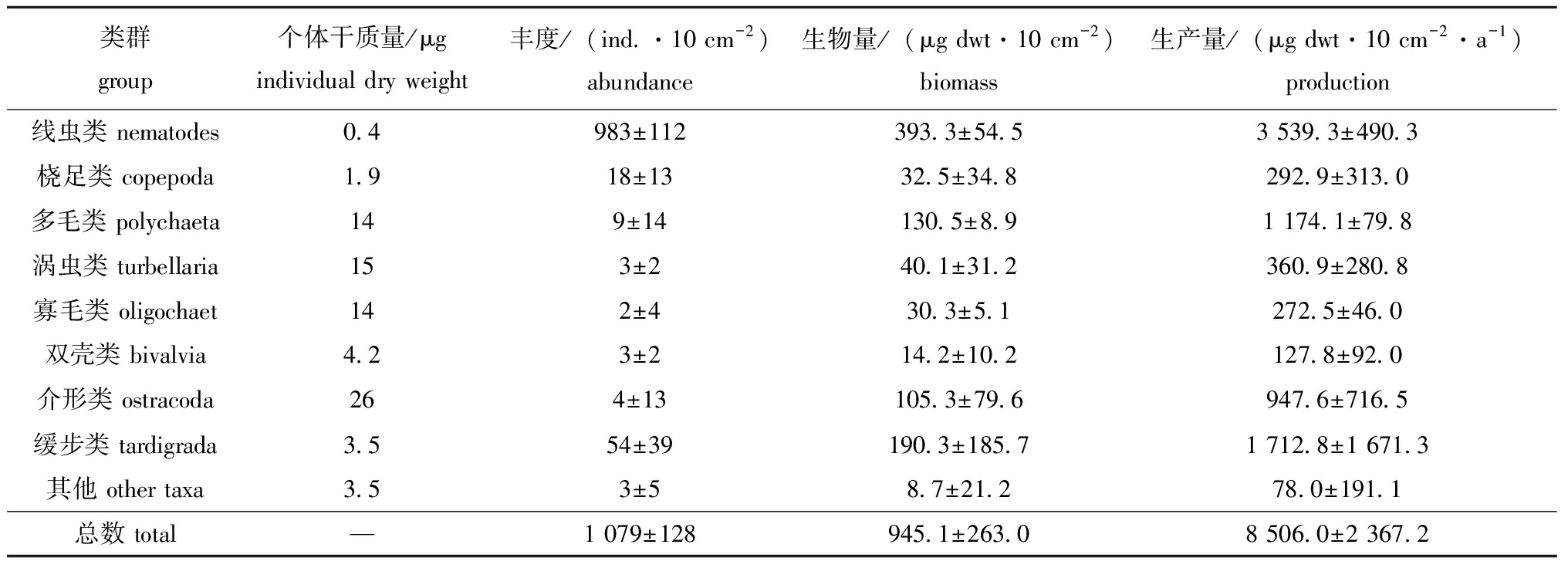
类群group个体干质量/μgindividual dry weight丰度/(ind.·10 cm-2)abundance生物量/(μg dwt·10 cm-2)biomass生产量/(μg dwt·10 cm-2·a-1)production线虫类 nematodes0.4983±112393.3±54.53 539.3±490.3桡足类 copepoda1.918±1332.5±34.8292.9±313.0多毛类 polychaeta149±14130.5±8.91 174.1±79.8涡虫类 turbellaria153±240.1±31.2360.9±280.8寡毛类 oligochaet142±430.3±5.1272.5±46.0双壳类 bivalvia4.23±214.2±10.2127.8±92.0介形类 ostracoda264±13105.3±79.6947.6±716.5缓步类 tardigrada3.554±39190.3±185.71 712.8±1 671.3其他 other taxa3.53±58.7±21.278.0±191.1总数 total —1 079±128945.1±263.08 506.0±2 367.2
2.2 自由生活海洋线虫种类及丰度
在12个站位的沉积物样品中,线虫占总丰度的91.1%,为最优势的类群,其雌雄比例为1.1∶1,幼体在总数中占比为53.4%;从线虫口腔类型上分析,非选择性沉积食性者型口腔种类最多,有100种,刮食者或硅藻捕食者型口腔线虫数量最多,有13 348条(占线虫总数量的61.2%),推测日照沿海线虫主要是以沉积物中的腐烂有机碎屑和底栖硅藻类为食。
研究中发现并鉴定出自由生活线虫262种(或分类实体),隶属于9目39科127个属。吞咽线虫属(Daptonema)为最优势属(占比为15.6%),其次为微咽线虫属(Microlaimus)、球咽线虫属(Bolbolaimus),占比分别为11.8%和9.8%;最优势种为大球咽线虫(Bolbolaimus major),数量上占比为9.8%,其次为诺曼底吞咽线虫(Daptonema normandicum)和德国近色矛线虫(Chromadorina germanica),占比分别为8.5%和6.2%。
2.3 4个新纪录种描述
在12个站位的沉积物样品中,发现4个新纪录种:异化感器玛瑙线虫(Onyx disparamphis)、弯曲伽马线虫(Gammanema curvata)、盖氏囊咽线虫(Sphaerolaimus ganymede)和霍氏拟合瘤线虫(Synonchiella hopperi),分别描述如下。
2.3.1 异化感器玛瑙线虫(Onyx disparamphis) 如图1和图2所示。
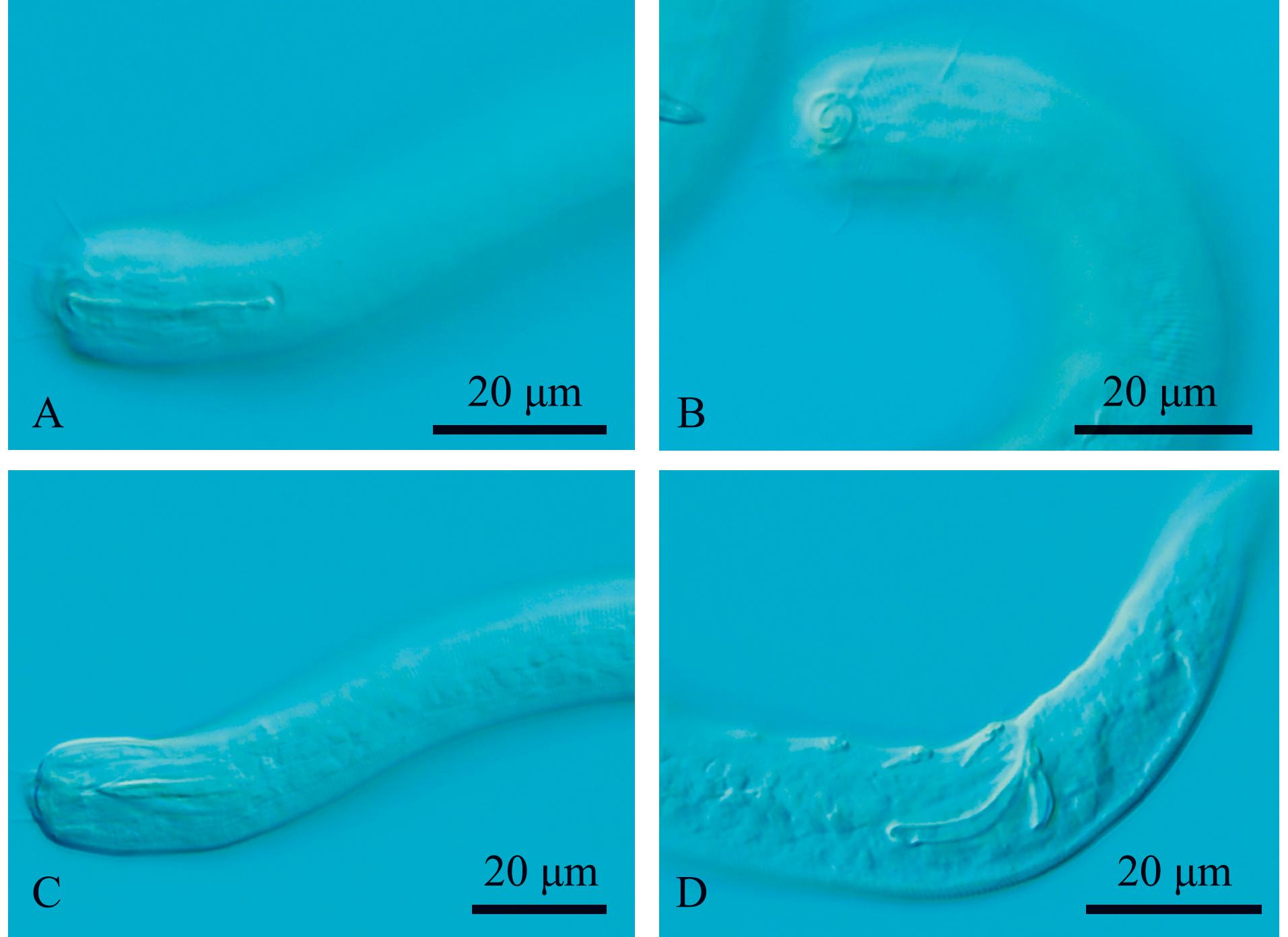
A—雄体前端,示头刚毛和化感器;B—雌体前端,示体表和化感器;C—雄体前端,示口腔和齿;D—雄体尾端,示交接刺、引带和肛前辅器。
A—lateral view of male anterior region,showing cephalic setae andamphidial fovea;B—lateral view of female anterior region,showing cuticle and amphidial fovea;C—lateral view of male anterior region,showing buccal cavity and tooth;D—lateral view of male poterior region,showing spicules,gubernaculum and precloacal supplements.
图1 异化感器玛瑙线虫显微镜图
Fig.1 Microscopic image of the sample of Onyx disparamphis
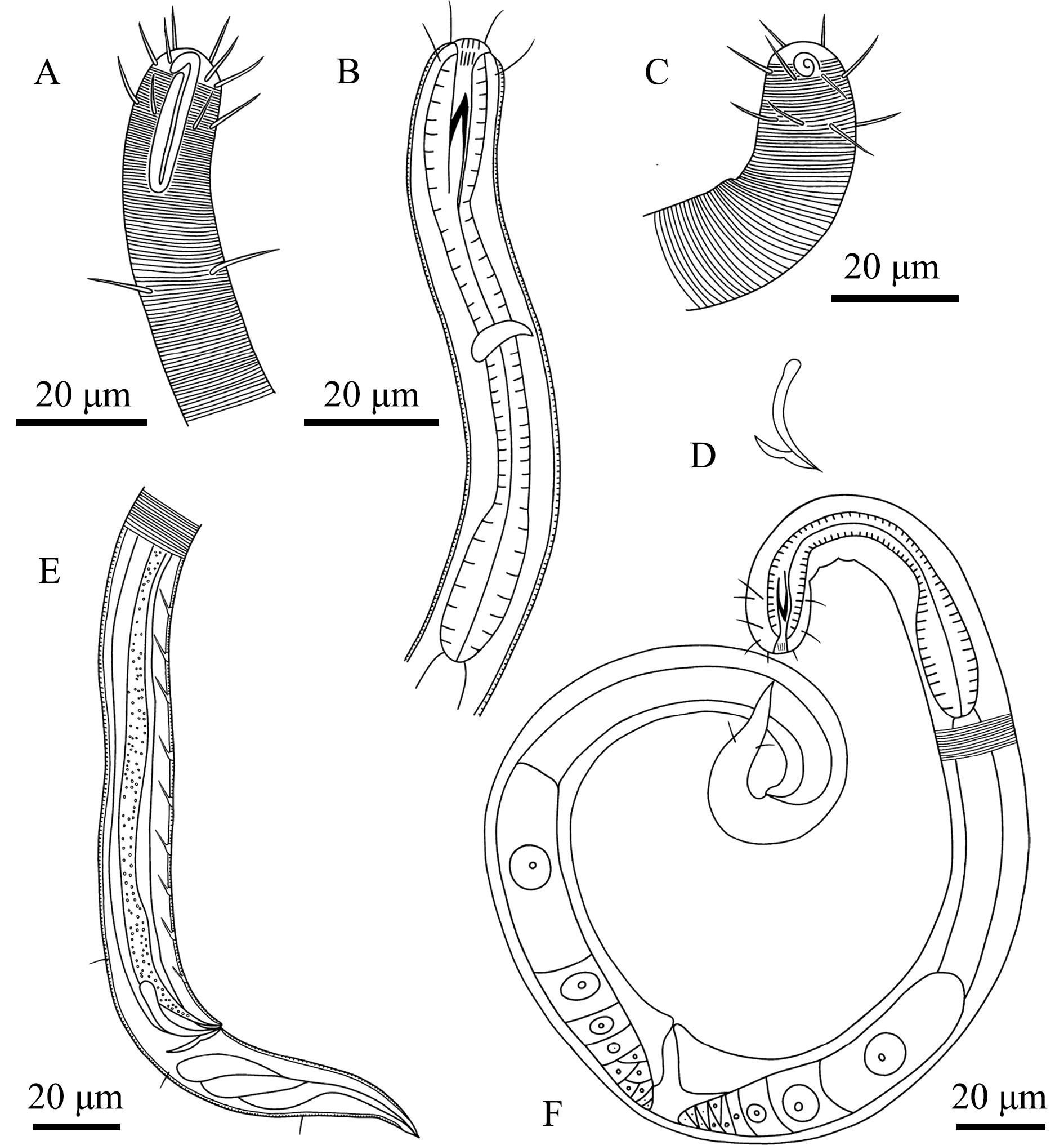
A—雄体前端,示化感器和表皮;B—雄体前端,示口腔、齿和咽球;C—雌体前端,示化感器和表皮;D—交接刺和引带;E—雄体尾端,示交接刺、引带和肛前辅器;F—雌体,示卵巢及雌孔。
A—lateral view of male anterior region,showing amphidial fovea and cuticle;B—lateral view of male anterior region,showing buccal cavity,tooth and pharingeal bulb;C—lateral view of female anterior region,showing amphidial fovea and cuticle;D—showing spicules and gubernaculum;E—lateral view of male poterior region,showing spicules,gubernaculum and precloacal supplements;F—lateral view of female whole body,showing ovaries and vulva.
图2 异化感器玛瑙线虫手绘图
Fig.2 Drawing of the sample of Onyx disparamphis
隶属链环目(Desmodorida)。
链环线虫科(Desmodoridae)。
指爪线虫属(Onyx)。
该研究标本采自金沙岛海滨浴场北(JSDB:35°15′43″ N,119°24′21″ E)的砂质沉积物表层(0~8 cm),受周围养殖业及旅游、生活垃圾排放影响,该区域可能含有过量氮、磷、钾等营养元素及镉、镍和铅等重金属元素。根据线虫不同的生活史策略划分[16],Onyx线虫属的c-p值为3,具有世代时间较长、对外界扰动比较敏感的特点。
研究中发现并测量了4个雄体和3个雌体。凭证标本号分别为JSDB2-2-27,JSDB2-1-39,JSDB2-1-25,JSDB2-2-34,JSDB2-1-46,JSDB2-1-22和JSDB2-2-44。测量数据见表2。
表2 异化感器玛瑙线虫个体特征测量值(μm,除a、b、c、c′ 和V%)
Tab.2 Individual measurements of Onyx disparamphis (in μm,except a、b、c、c′ and V%)
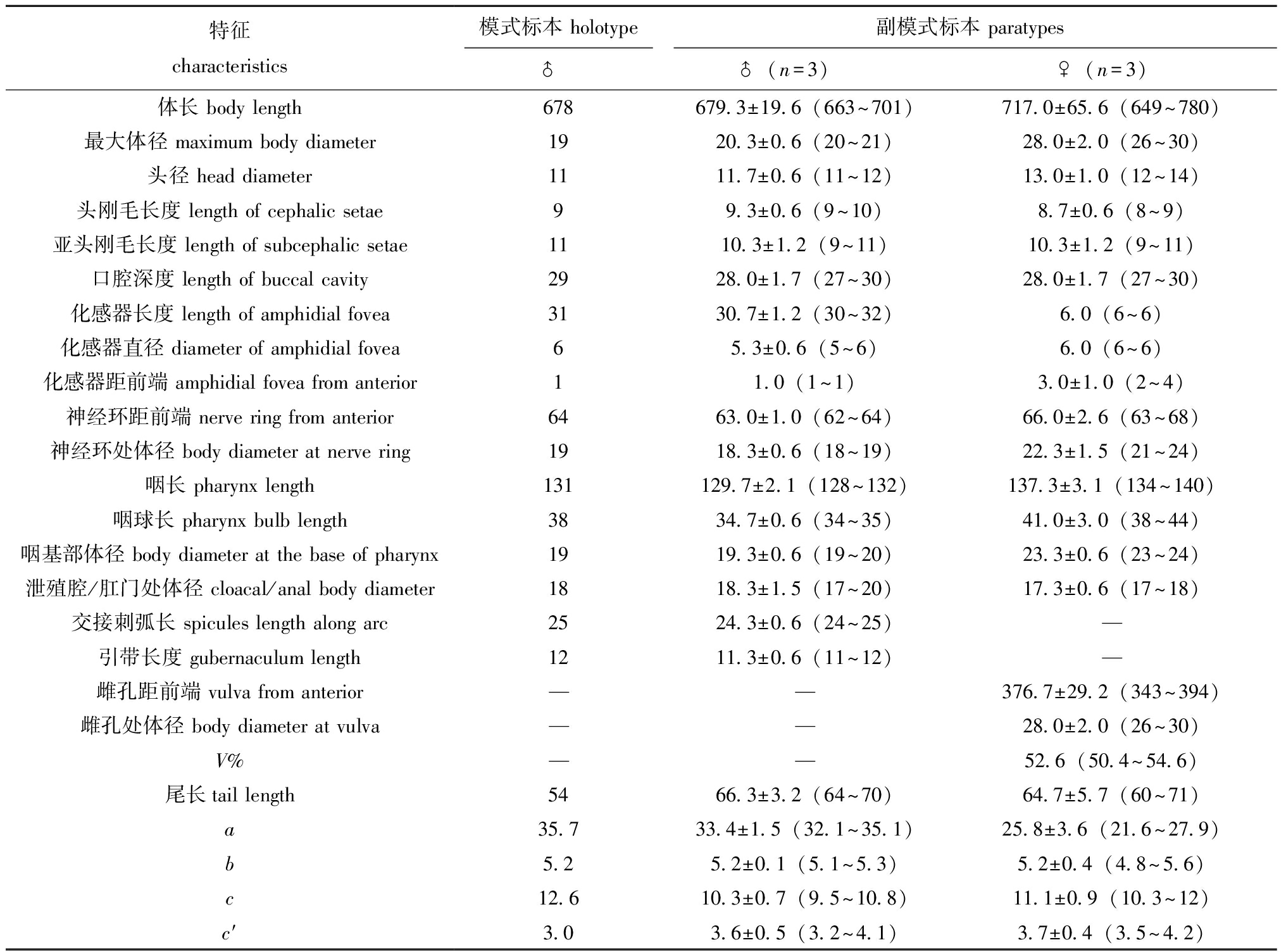
特征characteristics模式标本 holotype副模式标本 paratypes ♂♂(n=3)♀(n=3)体长 body length678679.3±19.6(663~701)717.0±65.6(649~780)最大体径 maximum body diameter1920.3±0.6(20~21)28.0±2.0(26~30)头径 head diameter1111.7±0.6(11~12)13.0±1.0(12~14)头刚毛长度 length of cephalic setae99.3±0.6(9~10)8.7±0.6(8~9)亚头刚毛长度 length of subcephalic setae1110.3±1.2(9~11)10.3±1.2(9~11)口腔深度 length of buccal cavity2928.0±1.7(27~30)28.0±1.7(27~30)化感器长度 length of amphidial fovea 3130.7±1.2(30~32)6.0(6~6)化感器直径 diameter of amphidial fovea 65.3±0.6(5~6)6.0(6~6)化感器距前端 amphidial fovea from anterior11.0(1~1)3.0±1.0(2~4)神经环距前端 nerve ring from anterior6463.0±1.0(62~64)66.0±2.6(63~68)神经环处体径 body diameter at nerve ring 1918.3±0.6(18~19)22.3±1.5(21~24)咽长 pharynx length131129.7±2.1(128~132)137.3±3.1(134~140)咽球长 pharynx bulb length3834.7±0.6(34~35)41.0±3.0(38~44)咽基部体径 body diameter at the base of pharynx1919.3±0.6(19~20)23.3±0.6(23~24)泄殖腔/肛门处体径 cloacal/anal body diameter1818.3±1.5(17~20)17.3±0.6(17~18)交接刺弧长 spicules length along arc2524.3±0.6(24~25)—引带长度 gubernaculum length1211.3±0.6(11~12)—雌孔距前端 vulva from anterior——376.7±29.2(343~394)雌孔处体径 body diameter at vulva——28.0±2.0(26~30)V%——52.6(50.4~54.6)尾长tail length5466.3±3.2(64~70)64.7±5.7(60~71)a35.7 33.4±1.5(32.1~35.1)25.8±3.6(21.6~27.9)b5.2 5.2±0.1(5.1~5.3)5.2±0.4(4.8~5.6)c12.6 10.3±0.7(9.5~10.8)11.1±0.9(10.3~12)c′3.03.6±0.5(3.2~4.1)3.7±0.4(3.5~4.2)
注:副模式标本数据为平均值±标准差(最小值~最大值);a表示体长与最大体宽比;b表示体长与咽长比;c表示体长与尾长比;c′表示尾长与肛门处相应体径比;V%表示雌孔距头端占体长百分比;—表示该个体无此特征值,下同。
Note:The data of the paratypes are presented as mean±S.D. (minimum-maximum);a means the ratio of body length to maximum body width;b means the ratio of body length to pharyngeal length;c means the ratio of body length to tail length;c′ means the ratio of tail length to the corresponding body diameter at the anus;V% means position of vulva from anterior body end to total body length;—indicates no characteristic value for this item,et sequentia.
1)雄体。虫体较小,圆柱状,头端圆钝,尾锥状,长663~701 μm,最大体宽为19~21 μm。体表具较细环纹,无侧装饰。内唇刚毛不明显;外唇刚毛乳突状;4根头刚毛较长,9~10 μm,位于头的顶端;两组亚头刚毛长度一致(9~11 μm),每组各八根,位于头刚毛后。咽部和尾部具稀疏体刚毛。化感器长环状,前端靠近口腔开口,向后延伸,长为30~32 μm,占相应体径的27.8%~37.3%。
口腔前部为杯状,具纵向皱褶;后部为锥状,具一角质化的矛状大背齿。咽长为128~132 μm,前端略膨大,后部膨大成一个长咽球,34~38 μm。神经环位于咽中部,距前端为咽长的47%~50%。贲门和排泄系统不明显。尾呈短锥状,长为54~70 μm,具稀疏短的尾刚毛,但无尾端刚毛,3个尾腺细胞。
生殖系统具一个向前直伸的精巢。两个交接刺等长,弓形,交接刺近端头状,远端渐尖,24~25 μm。引带略短,新月形,11~12 μm,与交接刺远端平行。肛前有11~12个“S”型辅器,每个长10~12 μm,均匀排列,间距约10 μm,第一个位于泄殖腔前128 μm处,最后一个位于泄殖腔前4 μm处。
2)雌体。特征与雄体相似。但化感器为螺旋形,2.5~3圈,6×6 μm,占相应体径的30%~33.3%。生殖系统具有两个相对排列的反折的卵巢,均位于肠的左侧。雌孔位于身体的中部偏后,距头端为体长的50.4%~54.6%。
2.3.2 弯曲伽马线虫(Gammanema curvata) 如图3和图4所示。
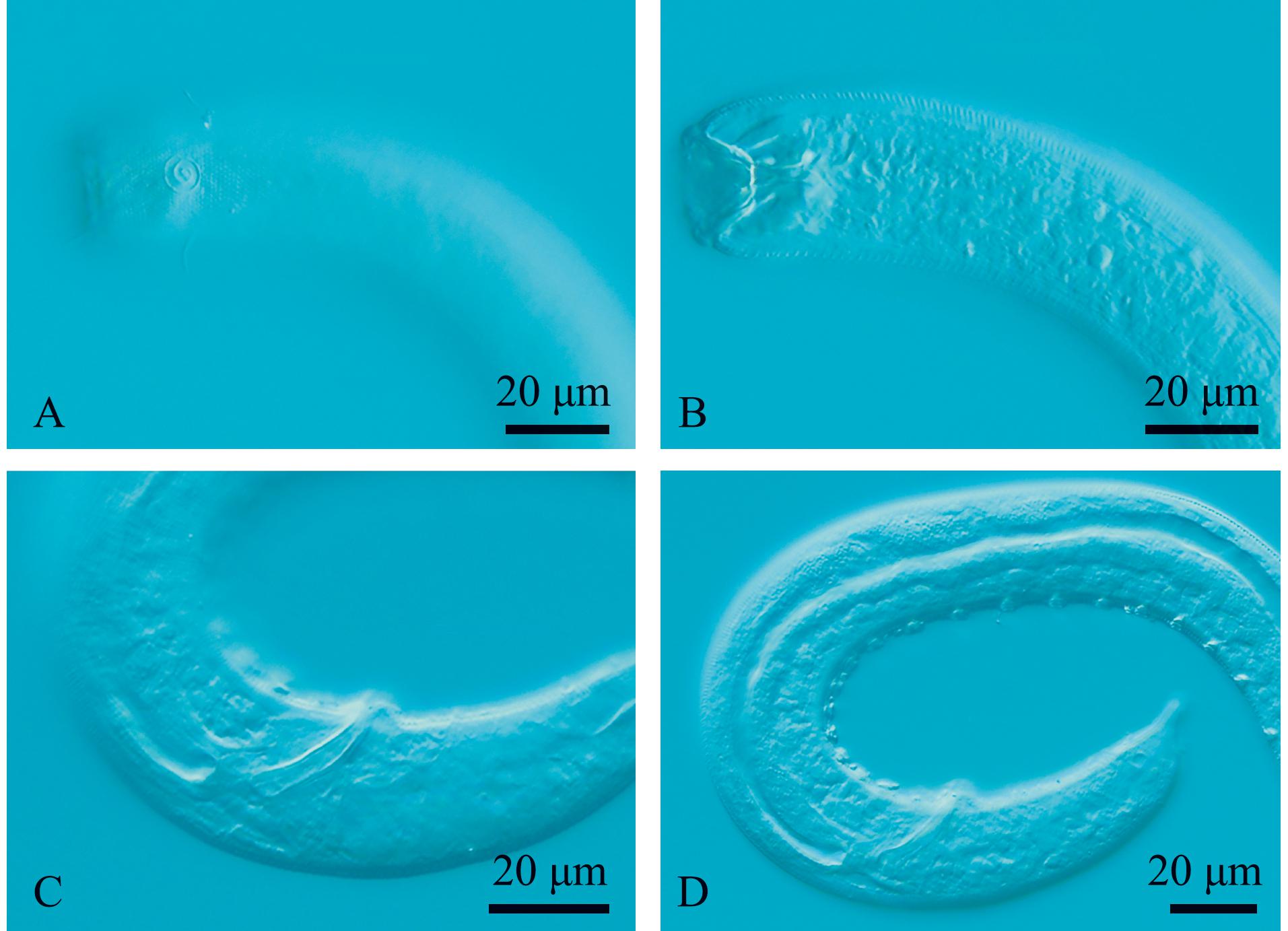
A—雄体前端,示化感器;B—雄体前端,示口腔;C—雄体尾端,示交接刺和引带;D—雄体尾端,示肛前辅器。
A—lateral view of male anterior region,showingamphidial fovea;B—lateral view of male anterior region,showing buccal cavity;C—lateral view of male poterior region,showing spicules and gubernaculum;D—lateral view of male poterior region,showing precloacal supplements.
图3 弯曲伽马线虫显微镜图
Fig.3 Microscopic image of the sample of Gammanema curvata
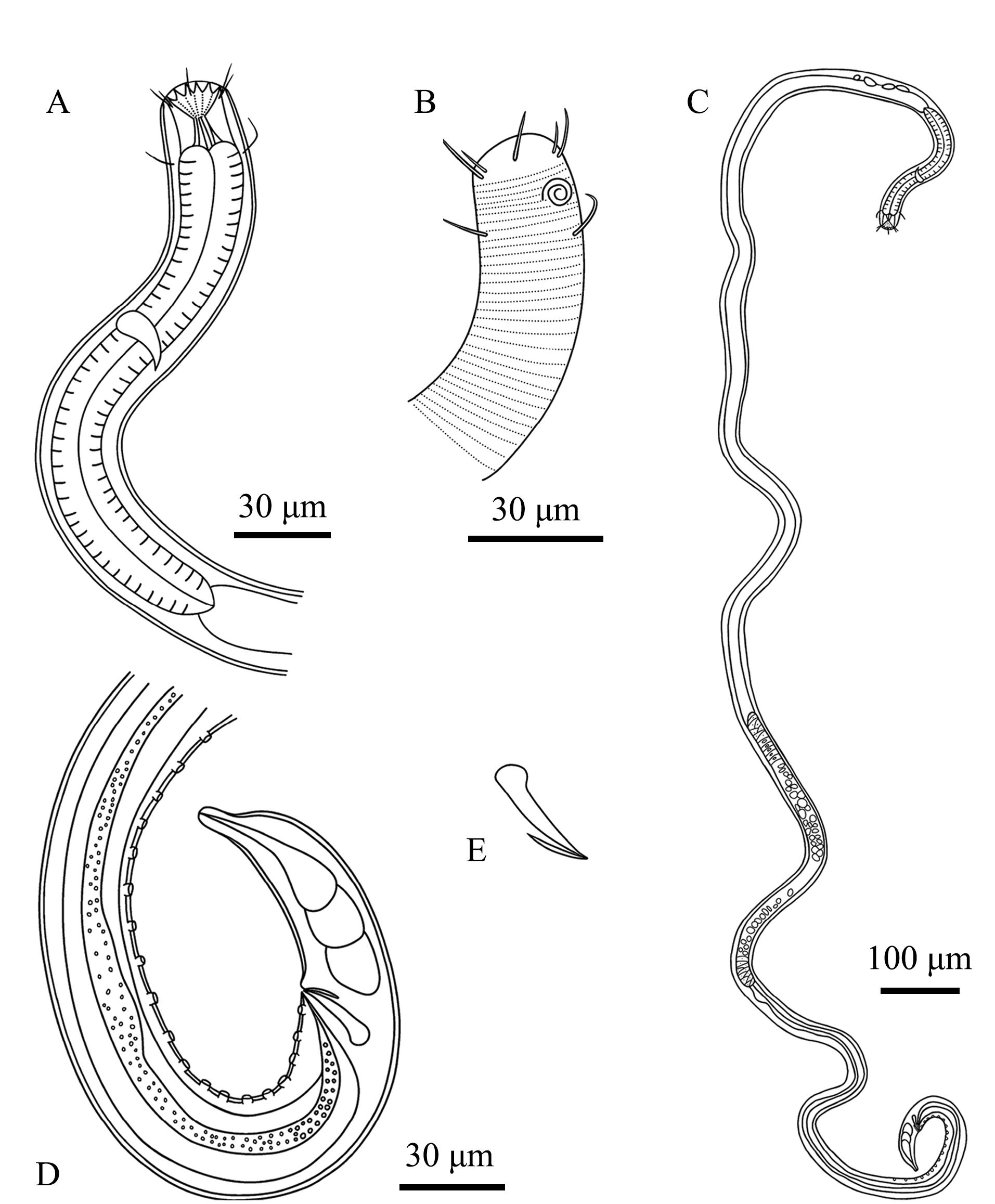
A—雄体前端,示咽部;B—雄体前端,示化感器;C—雄体;D—雄体尾端,示肛前辅器;E—交接刺和引带。
A—lateral view of male anterior region,showing pharyngeal region;B—lateral view of male anterior region,showing amphidial fovea;C—lateral view of male whole body;D—lateral view of male poterior region,showing precloacal supplements;E—showing spicules and gubernaculum.
图4 弯曲伽马线虫手绘图
Fig.4 Drawing of the sample of Gammanema curvata
隶属色矛目(Chromadorida)。
色拉支线虫科(Selachinematidae)。
伽马线虫属(Gammanema)。
该研究标本采自多岛海赶海园(DDH:35°4′48″ N,119°18′38″ E)的泥砂质沉积物(2~8 cm)中,受周围旅游、河流入海口等影响,该区域可能含有较高的有机物。根据线虫不同的生活史策略划分,Gammanema线虫属的c-p值为3,具有世代时间较长,对外界扰动比较敏感的特点。
研究中发现并测量了2个雄体,凭证标本号分别为DDH12-2-2和DDH12-2-1。测量数据见表3。
表3 弯曲伽马线虫Gammanema curvata个体特征测量值(μm,除a、b、c 和c′)
Tab.3 Measurements of Gammanema curvata(in μm,except a,b,c and c′)

特征characteristics模式标本holotype副模式标本paratypes♂1♂2体长 body length2 6853 194最大体径 maximum body diameter3336头径 head diameter2121头刚毛长度 length of cephalic setae119亚头刚毛长度 length of subcephalic setae810口腔深度 length of buccal cavity2322化感器直径 diameter of amphidial fovea88化感器处体径 body diameter at amphidial fovea2829化感器距前端 amphidial fovea from anterior1216神经环距前端 nerve ring from anterior 9799神经环处体径 body diameter at nerve ring2932咽长 pharynx length228231咽基部体径 body diameter at the base of pharynx2832交接刺弧长 spicules length along arc2725引带长度 gubernaculum length1211泄殖腔处体径 cloacal/Anal body diameter 2827尾长 tail length6874a81.488.7b11.813.8c39.443.2c′2.42.7
1)雄体。虫体为圆柱形,两端钝圆,长为2 685~3 194 μm,最大体宽为33~36 μm。表皮较厚,具环状排列的圆点,无侧装饰。内唇感受器为乳突状,6根外唇感受器与4根头刚毛排列在1圈,9~10 μm。口腔较大,分为两个部分;前室较宽,为杯状,具角质化的棒状结构,深12~13 μm;后室狭窄且角质层加厚,呈垂直圆柱状,深为10~11 μm。螺旋形化感器,2.5~3圈,最大直径为8 μm,为相应体径的27.6%~28.6%,位于口腔基部,距前端12~16 μm。咽柱状,长为228~231 μm,无明显咽球。神经环位于咽的中前部,距头端为咽长的42.5%~42.9%。贲门和排泄系统未观察到。尾锥柱状,短且钝,长为68~74 μm,柱状部分较短,仅占13.5%~16.2%。3个尾腺细胞较大,共同开口于尾末端。
生殖系统具两个相对排列且直伸的精巢。交接刺粗短,为25~27 μm(0.9~1 a.b.d.),略向腹部弯曲,近端为头状膨大,远端渐细。交接刺稍弓形弯曲,近端头状,远端渐尖。引带较小,为板状,无引带突,平行于交接刺远端,11~12 μm。具18~19个杯状肛前辅器,肛前第一个辅器距泄殖腔处为7 μm,最后一个为322 μm,各辅器间隔相等。
2)雌体。未观察到。
2.3.3 盖氏囊咽线虫(Sphaerolaimus ganymede) 如图5和图6所示。
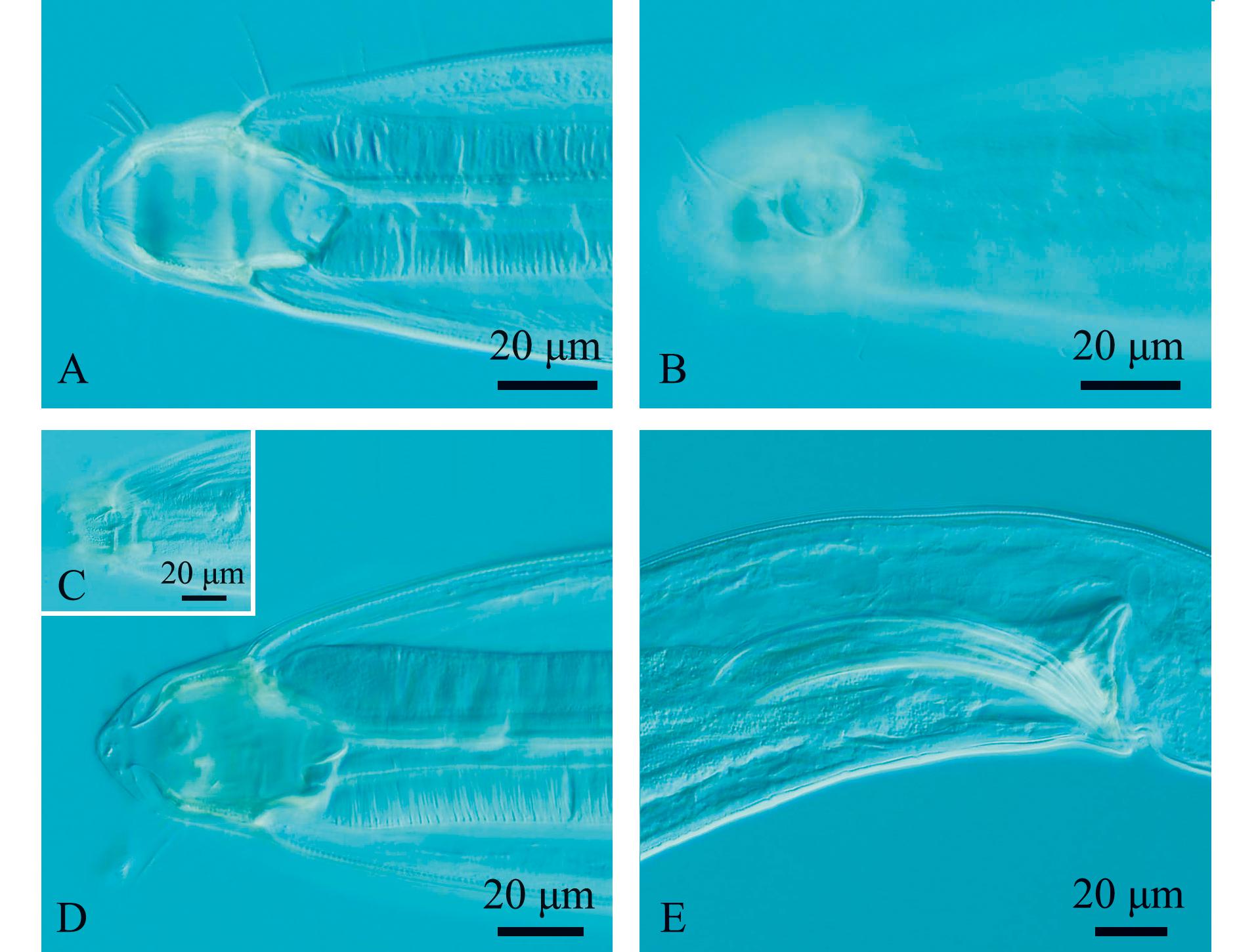
A—雄体前端,示口腔;B—雄体前端,示化感器和头刚毛;C—雌体前端,示口腔;D—雌体前端,示化感器和头刚毛;E—雄体尾端,示交接刺和引带。
A—lateral view of male anterior region,showing buccal cavity;B—lateral view of male anterior region,showingamphidial fovea and cephalic setae;C—lateral view of female anterior region,showing buccal cavity;D—lateral view of female anterior region,showing amphidial fovea and cephalic setae;E—lateral view of male poterior region,showing spicules and gubernaculum.
图5 盖氏囊咽线虫显微镜图
Fig.5 Microscopic image of the sample of Sphaerolaimus ganymede
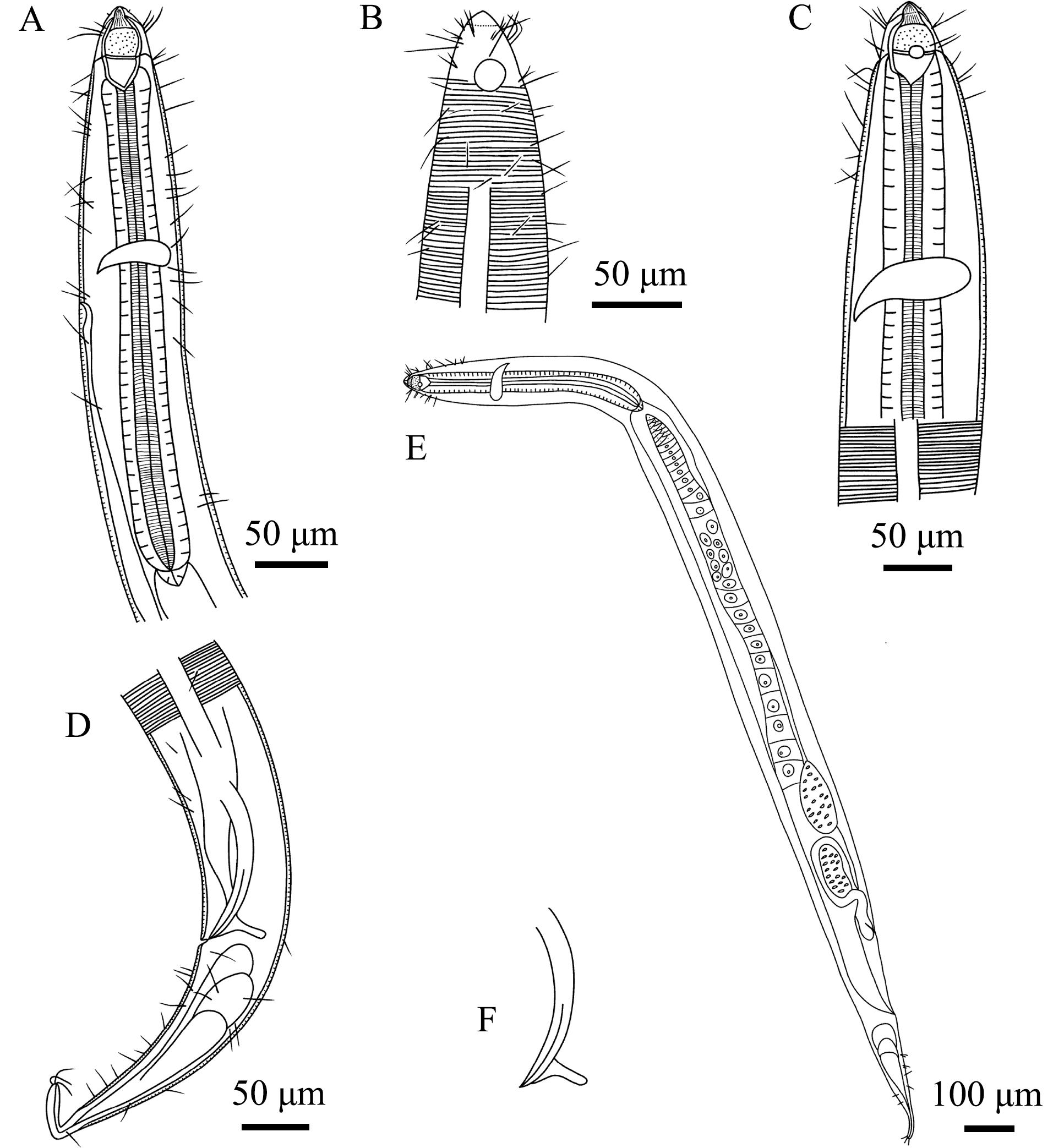
A—雄体前端,示咽部;B—雄体前端,示化感器和头刚毛;C—雌体前端,示化感器和咽;D—雄体尾端;E—雌体;F—交接刺和引带。
A—lateral view of male anterior region,showing pharyngeal region;B—lateral view of male anterior region,showing amphidial fovea and cephalic setae;C—lateral view of female anterior region,showing amphidial fovea and pharyngeal region;D—lateral view of male poterior region;E—lateral view of female whole body;F—showing spicules and gubernaculum.
图6 盖氏囊咽线虫手绘图
Fig.6 Drawing of the sample of Sphaerolaimus ganymede
隶属单宫目(Monhysterida)。
囊咽线虫科(Sphaerolaimidae)。
囊咽线虫属(Sphaerolaimus)。
该研究标本采自近海1(H1:35°27′58″ N,119°36′57″ E)的泥质沉积物(2~8 cm)中,根据线虫不同的生活史策略划分,Sphaerolaimus线虫属的c-p值为3,具有世代时间较长,对外界扰动比较敏感的特点。
研究中发现并测量了1个雄体和1个雌体,凭证标本号为H17-4-31。测量数据见表4。
1)雄体。虫体圆柱形,长为1 606 μm,最大体径达81 μm。表皮具不明显的横纹,侧装饰为纵向的凸起,宽约15 μm,自咽中部起至尾的泄殖腔后。体刚毛较短,稀疏,8~19 μm。内唇感受器乳突状;外唇感受器刚毛状,长为2 μm;头刚毛长为8 μm。8组亚头刚毛,每组2~3根,17~25 μm长。圆形化感器具角质化的外轮廓,位于口腔基部,距头前端22 μm,宽17 μm,为相应体径的42.5%。口腔桶状,57 μm×27 μm,具角质化的内壁,口腔前部具角质化的纵脊。咽圆柱状,长为366 μm,咽壁角质化加厚。神经环位于咽中前部,距前端为170 μm,为咽长的46.4%。贲门锥形,较小。排泄孔开口位于神经环后,排泄细胞位于贲门下部。尾椎柱状,长为238 μm,为泄殖腔处体直径的3.7倍;具稀疏尾刚毛,长为8~10 μm;尾柱状部分较短,仅占尾长的22.3%;3个尾腺细胞共同开口于尾的末端;3根尾端刚毛长为12~14 μm。
生殖系统具有单精巢,直伸,交接刺微弯,近端略宽,无膨大远端逐渐变细,110 μm长,为泄殖腔处体直径的1.5倍。引带较小,具尾背突,长26 μm。无肛前辅器。
2)雌体。特征与雄体基本相似,雌体虫体略大于雄体,长2 208 μm,体较宽,为139 μm。化感器较小,8 μm宽,为相应体径的17.4%,位于口腔基部。生殖系统只有一个直伸的前卵巢,位于表4 盖氏囊咽线虫个体特征测量值(μm,除a、b、c、c′和V%)
Tab.4 Measurements of Sphaerolaimus ganymede(in μm,except a,b,c,c′ and V%)

特征characteristics模式标本holotype副模式标本paratypes♂1♀1体长 body length1 6062 208最大体径 maximum body diameter81139头径 head diameter2736外唇刚毛长度 length of outer labial setae23头刚毛长度 length of cephalic setae811口腔深度 length of buccal cavity5755化感器直径 diameter of amphidial fovea178化感器处体径 body diameter at amphidial fovea 4046化感器距前端 amphidial fovea from anterior 2231神经环距前端 nerve ring from anterior 170187神经环处体径 body diameter at nerve ring7297咽长 pharynx length366468咽基部体径 body diameter at the base of pharynx77102泄殖腔/肛门处体径 cloacal/Anal body diameter6472交接刺弧长 spicules length along arc110—引带长度 gubernaculum length26—雌孔距前端 vulva from anterior—1 739雌孔处体径 body diameter at vulva—106V%—78.8尾长 tail length238279a19.815.9b5.45.7c6.77.9c′3.73.9
肠的右侧。子宫内具两个长卵形的精子囊,成熟卵长椭圆形。雌孔位于身体的后部,距头端为体长的78.8%。
2.3.4 霍氏拟合瘤线虫(Synonchiella hopperi) 如图7和图8所示。

A—雄体前端,示化感器;B—雄体前端,示口腔;C—雄体前端,示颚;D—雄体尾端,示交接刺和引带;E—雄体尾端,示交接刺和肛前辅器。
A—lateral view of male anterior region,showing amphidial fovea;B—lateral view of male anterior region,showing buccal cavity;C—lateral view of male anterior region,showing mandible;D—lateral view of male poterior region,showing spicules and guberna culum;E—lateral view of male poterior region,showing spicules and precloacal supplements.
图7 霍氏拟合瘤线虫显微镜图
Fig.7 Microscopic image of the sample of Synonchiella hopperi
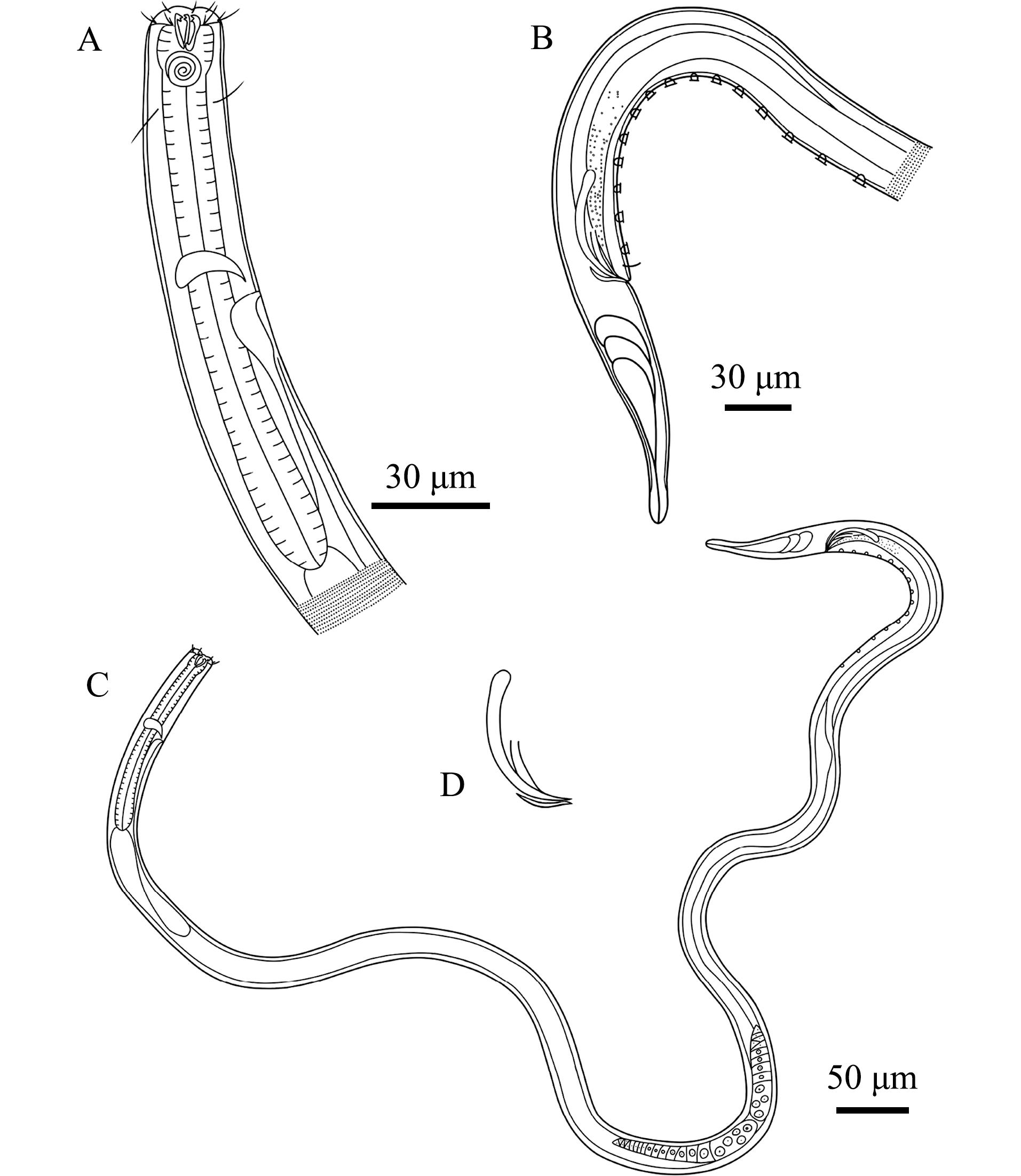
A—雄体前端,示化感器和咽部;B—雄体尾端,示肛前辅器;C—雄体;D—交接刺和引带。
A—lateral view of male anterior region,showing amphidial fovea and pharyngeal region;B—lateral view of male posterior body,showing precloacal supplements;C—lateral view of male whole body;D—showing spicules and gubernaculum.
图8 霍氏拟合瘤线虫手绘图
Fig.8 Drawing of the sample of Synonchiella hopperi
隶属色矛目(Chromadorida)。
色拉支线虫科(Selachinematidae)。
同大线虫属(Synonchiella)。
该研究标本采自多岛海赶海园(DDH:35°4′48″ N,119°18′38″ E)的泥砂质沉积物(0~8 cm)中,受周围旅游、河口入海交汇处等影响,该区域可能含有较高的有机物。根据线虫不同的生活史策略划分,Synonchiella线虫属的c-p值为4,具有世代时间长、可透过的表皮及对污染物反应敏感的特点。
在本研究中发现并测量了5个雄体,凭证标本号分别为DDH12-1-4,DDH12-3-9,DDH12-1-12,DDH12-1-6和DDH12-2-21。测量数据见表5。
表5 霍氏拟合瘤线虫个体特征测量值(μm,除a、b、c、c′)
Tab.5 Measurements of Synonchiella hopperi(in μm,except a,b,c and c′)

特征characteristic模式标本holotype副模式标本paratypes♂♂(n=4)体长 body length1 9621 772.5±76.4 (1 701~1 843)最大体径 maximum body diameter3432.0±1.4 (30~33)头径 head diameter1921.3±1.3 (20~23)内唇刚毛长度 length of inner labial setae33.0 (3~3)外唇刚毛长度 length of outer labial setae33.0 (3~3)头刚毛长度 length of cephalic setae810±0.8 (9~11)亚头刚毛长度 length of subcephalic setae99.0±0.0 (9~9)口腔深度 length of buccal cavity1514.5±1 (13~15)化感器直径 diameter of amphidial fovea 1311.5±0.6 (11~12)化感器处体径 body diameter at amphidial fovea 2425.0±0.8 (24~26)化感器距前端 amphidial fovea from anterior 1514.5±0.6 (14~15)神经环距前端 nerve ring from anterior9383.0±5.0 (79~90)神经环处体径 body diameter at nerve ring 2828.5±0.6 (28~29)咽长 pharynx length211206.8±7.4 (199~216)咽基部体径 body diameter at the base of pharynx2829.0±0.8 (28~30)泄殖腔/肛门处体径 cloacal/Anal body diameter2826.3±0.5 (26~27)交接刺弧长 spicules length along arc643461.0±0.8 (60~62)30.3±1.7 (28~32)引带长度 gubernaculum length2220.0±0.8 (19~21)尾长 tail length125126.8±4.3 (121~131)a57.755.4±1.6 (53.2~57.1)b9.38.6±0.6 (7.9~9.3)c15.714.0±0.9 (13.3~15.2)c′4.54.8±0.1 (4.7~5)
1)雄体。虫体为圆柱形,头端圆钝,尾端渐尖,体长为1 701~1 962 μm,最大体径为30~34 μm。体表自唇部后至尾端均具横向排列的小圆点,无侧装饰。内唇刚毛刚毛样3 μm;6根外唇刚毛为3 μm,与4根头刚毛(8~11 μm)排列成1圈,位于头的顶端;4根亚头刚毛长度一致为9 μm,位于头刚毛后。无体刚毛。化感器为螺旋形,3.3~4圈,直径为11~13 μm,占相应体径的44.0%~55.2%。口腔桶状,深13~15 μm。口腔具3个角质化的颚,一个背侧颚,两个亚腹颚,大小相等,长12~14 μm。每个颚近端膨大有两个钩状结构,具小齿,远端齿基部也具钩状结构。咽圆柱状,长为199~216 μm,前端围绕口腔膨大成前咽球,长17~20 μm,后部膨大但未形成明显咽球。神经环位于咽前部,距前端为咽长的38.4%~44.1%。贲门不明显。排泄孔距前端为93~101 μm,位于神经环后。尾为锥柱状,长为121~131 μm,柱状部分仅占1/3。尾具3个尾腺细胞,共同开口于尾端。
生殖系统具两个相对伸展的精巢。交接刺微弯,成对但不等长,分别为60~64 μm,28~34 μm,近端无膨大,远端逐渐变细。引带简单,“S”形,长为19~22 μm。具一肛前刚毛,长约5 μm。肛前辅器为杯状,14~16个,未见腺体。第一个辅器距泄殖腔为9 μm,最后一个为187 μm,每个辅器间隔约为10 μm。
2)雌体。未观察到。
3 讨论
3.1 小型底栖生物种类组成及群落结构分析
本研究中,日照沿海沉积物中小型底栖生物类群个数明显少于深海或浅海,但与潮间带结果相差不大。这可能与潮汐和生境差异导致的潮间带空间异质性(如沉积物组成差异)相关,进而造成底栖生物的种类组成及群落结构的不同[17]。小型底栖生物的平均丰度高于2013年南黄海冷水团海域等大多数深海或浅海中的平均丰度[18],但低于2019—2021年黄海潮间带和北黄海潮间带[9]及2021年黄海潮间带青岛沿岸[19]的研究结果;从黄海小型底栖生物研究结果分析,深海海域小型底栖生物丰度远低于近海、潮间带的丰度,但深海多样性高于近海、潮间带,且深海、近海和潮间带中线虫丰度始终占绝对优势。本研究中的小型底栖生物的丰度略低,但线虫在丰度上同样占绝对优势。综合郝映东[9]在2019年和2021年所采集的日照沿海两个站位小型底栖生物的类群结果得出:日照沿海小型底栖生物类群的数量偏低,远少于潮下带的小型底栖生物种类数,这可能是受到深海与近海、潮间带环境差异所致,有待于进一步结合环境因子进行比较分析。
3.2 自由生活海洋线虫种类及丰度分析
线虫的种类和丰度会受到沉积物粒径大小、有机质含量高低、水深情况、季节温度变化和海域盐度情况等多种因素的影响,导致同种沉积物环境下线虫的丰度在潮间带要高于潮下带。与近年来黄海海域对线虫的研究结果相比,本研究中,2022年日照沿海线虫的丰度明显高于大多数黄海海域潮下带的线虫丰度,种类数相对高于2003年以来黄海海域研究中线虫的种类数[20],低于2015—2021年潮间带的线虫丰度[21]。但优势种为Bolbolaimus major Guo[22],明显不同于以往的研究;在本研究中砂质相对较粗的站位,线虫丰度受影响较大,明显低于其余站位。从日照沿海12个站位线虫分布情况分析,由于受到钢铁工厂污染排放、生活及旅游垃圾排放等因素的影响,线虫水平分布情况差别较大;受含氧量、食物和温度等因素的影响,线虫垂直分布情况基本一致,线虫均较集中地分布于表层沉积物中;年龄结构和性别比例方面,雌体和雄体整体数量相差不大,而幼体占比较高,处于繁殖阶段,且日照沿海生态环境相对稳定;根据线虫的口腔类型和营养结构分析,推测该海域线虫主要以沉积物中的腐烂的有机碎屑和底栖硅藻类为食。
3.3 新纪录种分析
异化感器玛瑙线虫标本特征与韩国济州岛发现并描述的模式标本在化感器位置、形状和大小、德曼比值“a、b、c”及交接刺和引带的形状方面的特征基本吻合[23]。本研究中,标本与模式标本的区别在于虫体稍短,长为649~789 μm (模式标本虫体稍长,长度为 695~1 014 μm),交接刺略短,长度为24~25 μm (模式标本交接刺略长,长度为33~40 μm),肛前辅器数量上略少,为11~12个(模式标本肛前辅器略多,为14~19个)。弯曲伽马线虫与发现于地中海的标本特征相比,在虫体的形状和大小、化感器的大小和位置,以及交接刺和引带的形状等方面基本吻合[24],因此作为新纪录种。本研究中,标本与模式标本的区别在于头刚毛略短,长约9~11 μm (模式标本头刚毛长为15~17 μm);体径稍小,德曼“a”值为81.4~88.7 (模式标本德曼“a”值为 64~71);尾更长,长为68~74 μm(模式标本头刚毛长为46~59 μm)。盖氏囊咽线虫与发现于越南北部的模式种相比,在化感器的位置和大小、交接刺和引带形状等方面基本吻合[25],因此作为新纪录种。本研究中,标本与模式标本的区别在于虫体较大,长为1 606~2 208 μm (模式标本虫体长为1 329~1 456 μm);头刚毛长度较长,为8~11 μm(模式标本头刚毛长为5 μm);交接刺稍长,为1.5 a.b.d.(模式标本交接刺长为1.1~1.2 a.b.d.);尾较短,德曼“c”值为 6.7~7.9(模式标本德曼“c”值为 7.7~7.9)。霍氏拟合瘤线虫与美国北卡罗来纳州潮间带的标本特征模式种相比,在化感器的位置和大小、交接刺和引带形状等方面基本吻合[26],因此作为新纪录种。本研究中标本与模式标本的区别在于虫体较大,长为1 606~2 208 μm(模式标本虫体长为1 329~1 456 μm);头刚毛长度较长,为8~11 μm(模式标本头刚毛长为5 μm);交接刺稍长,为1.5 a.b.d.(模式标本交接刺长为1.1~1.2 a.b.d.);尾较短,德曼“c”值为 6.7~7.9(模式标本德曼“c”值为 7.7~7.9)。
4 结论
1)通过对日照沿海12个站位的底栖生物类群和自由生活线虫较为系统的研究,初步获得了一定的基础数据资料,但研究站位主要集中于潮间带,潮下带研究开展甚少;群落结构分布特征缺乏结合环境因子数据的支撑。
2)今后将开展日照沿海小型底栖生物和海洋线虫不同季节、不同深度连续多年的沉积物样品研究,并结合环境因子分析开展线虫的分选与鉴定,以获得更大时间和空间尺度上线虫的分布特征,分析群落结构形成的驱动因素,以发现其内在规律,更好地保护和开发利用海洋资源。
[1] 徐奎栋.海洋微型底栖生物的多样性与地理分布[J].生物多样性,2011,19(6):661-675. XU K D.Biodiversity and biogeography of marine microbenthos:progress and prospect[J].Biodiversity Science,2011,19(6):661-675.(in Chinese)
[2] 黄勇,张志南.中国自由生活海洋线虫新种研究[M].北京:科学出版社,2019. HUANG Y,ZHANG Z N.New species of free-living marine nematodes from China[M].Beijing:Science Press,2019.(in Chinese)
[3] MONTAGNA P A.Rates of metazoan meiofaunal microbivory:a review[J].Vie et Milieu,1995,45(1):1-9.
[4] WARWICK R M.The nematode/copepod ratio and its use in pollution ecology[J].Marine Pollution Bulletin,1981,12(10):329-333.
[5] DU Y F,GAO S,WARWICK R M,et al.Ecological functioning of free-living marine nematodes in coastal wetlands:an overview[J].Chinese Science Bulletin,2014,59(34):4692-4704.
[6] HONG J H,SEMPRUCCI F,JEONG R,et al.Meiobenthic nematodes in the assessment of the relative impact of human activities on coastal marine ecosystem[J].Environmental Monitoring and Assessment,2020,192(2):81.
[7] 王琦,吕亚男,张建华.山东省日照县近岸沉积物的物质来源及扩散方向[J].山东海洋学院学报,1978,8(2):41-50,103-104. WANG Q,LÜ Y N,ZHANG J H.Material source and diffusion direction of coastal sediments in rizhao county,Shandong Province [J].Periodical of Ocean University of China,1978,8(2):41-50,103-104.(in Chinese)
[8] 乔璐璐.冬季大风事件下渤黄海环流及泥沙输运过程研究[D].青岛:中国海洋大学,2008. QIAO L L.Study on circulation and sediment transport process in Bohai Sea and Yellow Sea under strong wind events in winter[D].Qingdao:Ocean University of China,2008.(in Chinese)
[9] 郝映东.黄海潮间带自由生活线虫分类和群落结构研究[D].聊城:聊城大学,2022. HAO Y D.Study on classification and community structure of free-living nematodes in the intertidal zone of the Yellow Sea[D].Liaocheng:Liaocheng University,2022.(in Chinese)
[10] HUANG Y,ZHANG Z N.Two new species of Xyalidae (Nematoda) from the Yellow Sea,China[J].Journal of the Marine Biological Association of the United Kingdom,2010,90(2):391-397.
[11] HUANG Y,LI J.Two new free-living marine nematode species of the genus Pseudosteineria (Monohysterida:Xyalidae) from the Yellow Sea,China[J].Journal of Natural History,2010,44(41/42):2453-2463.
[12] HUANG Y,XU K D.Two new free-living nematode species (Nematoda:Cyatholaimidae) from intertidal sediments of the Yellow Sea,China[J].Cahiers de Biologie Marine,2013,54(1):1-10.
[13] HUANG Y,WANG H X.Review of Onyx cobb (Nematoda:Desmodoridae) with description of two new species from the Yellow Sea,China[J].Journal of the Marine Biological Association of the United Kingdom,2015,95(6):1127-1132.
[14] 张志南,周红.自由生活海洋线虫的系统分类学[J].青岛海洋大学学报(自然科学版),2003,33(6):891-900. ZHANG Z N,ZHOU H.The systematics of free-living marine nematodes[J].Journal of Ocean University of Qingdao(Natural Science Edition),2003,33(6):891-900.(in Chinese)
[15] DE LEY P,BLAXTER M L.Proceedings of the Fourth International Congress of Nematology-Nematology Monographs &Perspectives:A new system for Nematoda:combining morphological characters with molecular trees,and translating clades into ranks and taxa[C].Spain:Koninklijke Brill NV,2004.
[16] BONGERS T,ALKEMADE R,YEATES G W.Interpretation of disturbance-induced maturity decrease in marine nematode assemblages by means of the maturity index[J].Marine Ecology Progress Series,1991,76:135-142.
[17] 李慧峰,杨文波,袁立来,等.莱州湾南部胶莱河口潮间带大型底栖动物群落结构特征[J].大连海洋大学学报,2018,33(5):674-682. LI H F,YANG W B,YUAN L L,et al.Intertidal macrozoobenthic community structural features in Jiaolai estuary of south Laizhou Bay[J].Journal of Dalian Ocean University,2018,33(5):674-682.(in Chinese)
[18] 许嫚,刘晓收,刘清河,等.夏秋季南黄海冷水团小型底栖动物类群组成与分布[J].应用生态学报,2015,26(2):616-624. XU M,LIU X S,LIU Q H,et al.Assemblage composition and distribution of meiofauna in the southern Yellow Sea cold water mass during summer and autumn[J].Chinese Journal of Applied Ecology,2015,26(2):616-624.(in Chinese)
[19] 褚梦迪.黄渤海海藻附植线虫的分类及多样性研究[D].聊城:聊城大学,2023. CHU M D.Study on classification and diversity of phytal nematodes in the seagrass from the intertidal zone of the Yellow Sea and Bohai Sea[D].Liaocheng:Liaocheng University,2023.(in Chinese)
[20] 张艳.南黄海小型底栖生物群落结构与多样性的研究[D].青岛:中国海洋大学,2006. ZHANG Y.Study on community structure and diversity of meiobenthos in the South Yellow Sea China[D].Qingdao:Ocean University of China,2006.(in Chinese)
[21] 高群.胶州湾小型底栖动物生态学和自由生活线虫分类研究[D].聊城:聊城大学,2017. GAO Q.Studies on meiofauna ecology and taxonomy of free-living nematodes from the Jiaozhou Bay[D].Liaocheng:Liaocheng University,2017.(in Chinese)
[22] GUO W,LIANG H X,YANWEI L V,et al.Description of Bolbolaimus major sp.nov.(Nematoda),from the Yellow Sea,China and phylogenetic analysis in Microlaimidae[J].Zootaxa,2023,5353(2):176-186.
[23] TCHESUNOV A V,JEONG R,LEE W.Onyx disparamphis sp.n.(Nematoda,Desmodorida) from South Korea with a taxonomic review of the genus[J].Peer J,2022,10:e13010.
[24] GAGARIN V G,KLERMAN A K.New species of predatory chromadorids (Nematoda,Chromadorida) from the Mediterranean Sea[J].![]()
[25] ZOGRAF J K,PAVLYUK O N,TREBUKHOVA Y A,et al.Description of three new Sphaerolaimus species (Nematoda:Sphaerolaimidae) form the South China Sea[J].Zootaxa,2020,4755(3):491-514.
[26] OTT J A.Twelve new species of nematodes from an intertidal sandflat in north Carolina[J].Internationale Revue der Gesamten Hydrobiologie und Hydrographie,1972,57(3):463-496.