随着水产养殖业的快速发展,环境保护与养殖之间的矛盾愈发突出,合理利用水资源已成为一个亟待解决的热点问题,人们对绿色可持续新型水产养殖系统的需求日益迫切。循环水养殖系统(recirculating aquaculture system,RAS)是一种通过人工调控技术手段,在封闭或半封闭环境中实现水资源循环利用的绿色养殖系统。RAS水处理环节可以有效去除悬浮物、氨氮、亚硝酸盐等有害物质[1],水质调控模块可以精确控制水温、溶解氧(DO)等环境参数,为养殖动物创造了最适宜的生长条件。与传统的粗放型养殖方式相比,RAS不仅显著提高了养殖效率与产量,还降低了养殖动物疾病发生的风险,且对环境无负面影响[2-4]。由于其高效、安全和可持续的特点,RAS在国内水产企业中的应用正不断增加。
通过对水产养殖系统中各单元的关键元素收支进行量化,并开展质量平衡分析,可以深入了解该元素在系统内的积累与转化过程。碳作为构成生物体最基本的化学元素,在参与生态系统各种物质转化和能量转换过程中发挥着重要作用[5]。碳元素的收支平衡不仅关系到个体生物的代谢活动,还对整个生态系统的稳定性和可持续性产生了深远影响。当前,关于养殖系统中元素收支的研究主要集中于氮和磷元素[6-7],关于碳收支的研究较少。养殖系统碳收支研究主要涉及沿海和内陆养殖池塘中的虾蟹混养[8]、鱼虾混养[9],以及鱼类和多毛类生物混养领域[10]。此外,也有一些研究关注近海围堰养殖[11]和网箱养殖[12],然而,针对封闭式循环水系统中碳收支的研究尚不多见。
在封闭式RAS中,饲料通常是系统中碳的主要输入源,碳元素的动态变化直接反映了系统内的物质迁移转化情况,并与养殖效率密切相关。研究RAS中的碳收支有助于优化饲料利用效率,减少碳排放,从而推动RAS的健康发展。本研究从稳定运行的珍珠龙胆石斑鱼(Epinephelus lanceolatus♂×Epinephelus fuscoguttatus♀)循环水养殖系统入手,分别进行24 h的短周期试验和7 d的长周期试验,旨在讨论RAS中碳收支及其各单元内碳的转化规律,以期为提高RAS的资源利用效率和优化系统设计提供科学依据。
1 材料与方法
1.1 材料
本试验所构建的循环水养殖系统由养殖池-微滤机-生物滤池-紫外线杀菌池组成(图1)。养殖池为圆筒形与漏斗形组合,半径为0.75 m,上下部分高度均为0.4 m。养殖池使用气泵曝气,气泵功率为50 W,排气量为60 L/min;转鼓式微滤机滚筒尺寸为20 cm(直径)×55 cm,滤网孔径为0.08 mm;固定床生物膜反应器(fixed bed bioreactor,FBBR)即生物滤池由两个100 cm×50 cm×100 cm水池串联而成,内设涤纶复合纤维毛刷作为基质,毛刷比表面积为7 000~8 000 m2/g,采用自然挂膜法培养硝化微生物,在毛刷表面形成生物膜;蛋白质分离器悬挂于紫外线杀菌池内壁。系统构建完成后稳定运行3个月,运行期间水流量为200 L/h,温度控制在25 ℃。
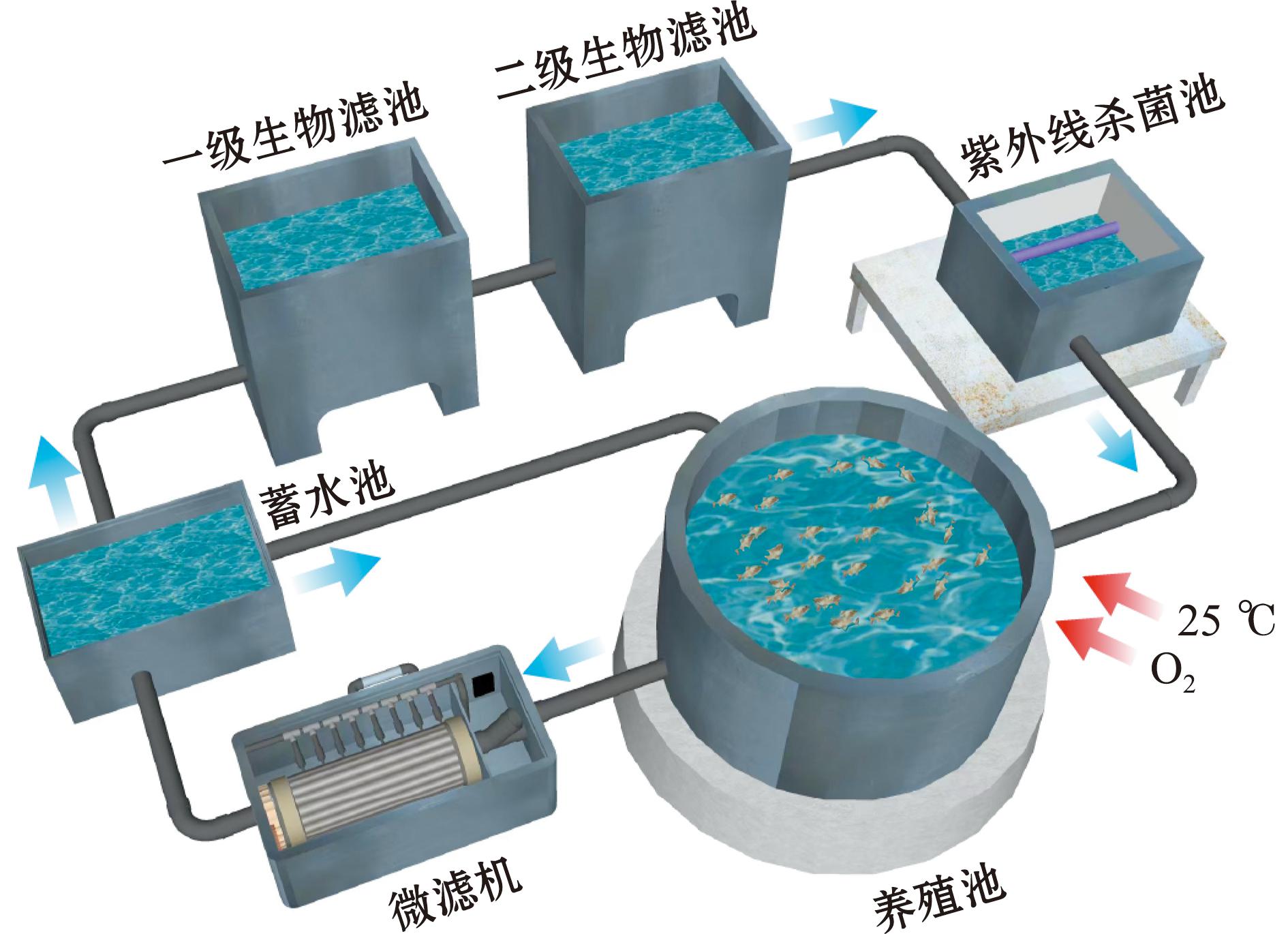
图1 循环水系统装置示意图
Fig.1 Model diagram of recirculating aquaculture system
本研究选取珍珠龙胆石斑鱼作为试验对象。相较于其他石斑鱼品种,珍珠龙胆石斑鱼不仅具备优异的生长性能和抗病优势[13],而且肉质细嫩,广受市场欢迎。试验用鱼购自山东日照红旗水产有限公司,选取初始平均体质量为323.10 g、体态健康且无损伤的珍珠龙胆石斑鱼,在稳定运行的循环水系统中驯化30 d,养殖密度为30 ind./m3。
1.2 方法
使用上述设计的近零换水RAS进行为期7 d的长周期试验和24 h短周期试验。以30 ind./m3的密度投放驯养的珍珠龙胆石斑鱼,试验开始前禁食1 d,试验开始和结束时记录初始体质量及终末体质量。试验期间,系统持续运行7 d,每日采集污泥、饲料等固体样品,各单元水样及试验末期鱼体样本用于检测有机碳(POC)含量,定时采集养殖池和生物滤池气体以检测CO2、CH4通量;短周期试验在长周期试验的第3天进行,自当日首次投饵后每隔3 h取系统各单元水样,共取8次,用以检测短时间内有机碳含量变化。试验期间,每日定时测量水温(T)、溶解氧、盐度(S)、pH及水质指标;每日9:00、17:00各投喂一次,日均投喂率为石斑鱼体质量的1.5%,每次投喂后记录实际摄食量,并根据实际摄食量作适量调整以最大程度减少残饵量;由于蒸发损耗,试验期间每日向养殖池中补充部分源水至标定水位。
1.2.1 鱼体、饲料、污泥固体样品 分别在试验第0天和第7天对珍珠龙胆石斑鱼总质量进行测定,并随机选取3尾鱼,用丁香酚麻醉并处死后置入烘箱60 ℃烘至恒重,充分研磨并过150 μm筛,冷冻保存于-20 ℃冰箱待测。试验期间每日收集微滤机产生的残饵和污泥,使用布氏漏斗过滤,将富集污泥的滤纸60 ℃烘干至恒重,记录质量以计算试验期间产生的污泥总量。干燥后的污泥收集,充分研磨过150 μm筛,置于-20 ℃冰箱待测。试验期间记录投喂饲料总量,采用5点取样法采集饲料袋内饲料,将样品60 ℃烘干至恒重,充分研磨过150 μm筛,置于-20 ℃冰箱待测。鱼体、饲料、污泥样品均使用元素分析仪(Flash HT Plus,Themo,美国)测定碳元素含量,使用氧弹量热仪(6100 Compensated Calorimeter,Parr,美国)测定能量。
1.2.2 养殖水样品 试验期间,于每日9:00及第3 天投喂后的0、3、6、9、12、15、18、21、24 h,分别采集系统各处理单元出水口水样,每次取10 mL水样,经WhatmanGF/F玻璃纤维膜(450 ℃灼烧)过滤后,使用TOC分析仪测定水体DOC含量;将滤膜干燥后,使用元素分析仪测定水体POC含量。
1.2.3 气体样品 试验第2、4、6 天的12:00—12:40,采用静态箱法[14]采集气样。以高密度塑料制作成底部直径为20 cm,高为40 cm的圆柱体集气罩,并将其固定并嵌入鱼池中,集气罩下部分8 cm完全没入水中,上半部分留有一定空气,在集气罩顶部外接管口连接塑料胶管,最后连接大气采样泵。采样前关闭曝气装置,于采样箱嵌入鱼池后的0、10、20、30、40 min开始采集养殖池及生物滤池气体样本,每次采样200 mL,气体储存于0.2 L铝箔气袋中,并于24 h内使用气体分析仪(GGA-315高精度CO2、CH4、N2O分析仪,唯思德光学,北京)测定样品CO2、CH4含量,其单位时间(d)内排放通量F使用以下公式计算[15]
。
(1)
式中:F为气体排放通量(μmol/m2·d);P为背景环境大气压力(kPa);F1为该气体在空气中体积比转化成在空气中分压的单位转换系数(0.000 971);F2为时间转换系数(86 400);V为箱内空气体积(m3);P0为标准大气压(101.33 kPa);R为普适气体常数(0.082 057 L atm/mol·K);T0为标准状态下空气的绝对温度(273.15 K);T为箱内温度(℃);A为静态箱基底面积(m2)。计算后根据待测气体(CO2、CH4)的摩尔质量换算成质量浓度通量(mg/m2·d)。
1.2.4 系统碳收支 系统有机碳收支通过碳元素的输入量和输出量计算公式为
C收入=C饲料+C补水
。
(2)
式中:C收入为系统有机碳总收入量(g);C饲料为投放饲料中所含碳元素总量(g);C补水为试验期间通过补水注入系统的碳元素总量(g)。
C支出=C鱼体同化+C固废+C废水+C气体+C其他
。
(3)
式中:C支出为系统有机碳支出总量(g);C鱼体同化为鱼体经过摄食等活动体内增长的碳元素含量(g);C固废为微滤机流出的固体废弃物中所含碳元素总量(g);C废水为微滤机流出的废水中所含碳元素总量(g);C气体为系统溢出的气体中所含碳元素总量(g);C其他为系统以其他方式消耗的碳元素总量(g),包括试验期间水体中积累碳含量等。
1.3 数据处理
试验数据均采用平均值±标准差(mean±S.D.)表示;采用GraphPad Prism10软件对数据进行单因子方差分析(one-way ANOVA),采用Duncan’s 多重比较检验组间差异,显著性差异设为0.05。
2 结果与分析
2.1 系统有机碳周期转化规律
在短周期(24 h)试验中,系统4个单元中的颗粒有机碳、溶解有机碳(DOC)及总有机碳(TOC)呈波动平衡状态(图2)。投喂前(0 h),系统各单元碳含量以鱼池最高,其次分别为微滤机、生物滤池及紫外线消毒池。经24 h系统运转后,各单元TOC含量逐渐趋于一致(图2(a));DOC含量变化则与TOC高度吻合,由从鱼池至紫外线消毒池逐级降低,最终达到4个单元的近似水平(图2(b));而POC含量在周期内保持波动平衡状态,各单元物变化趋势较为明显(图2(c))。
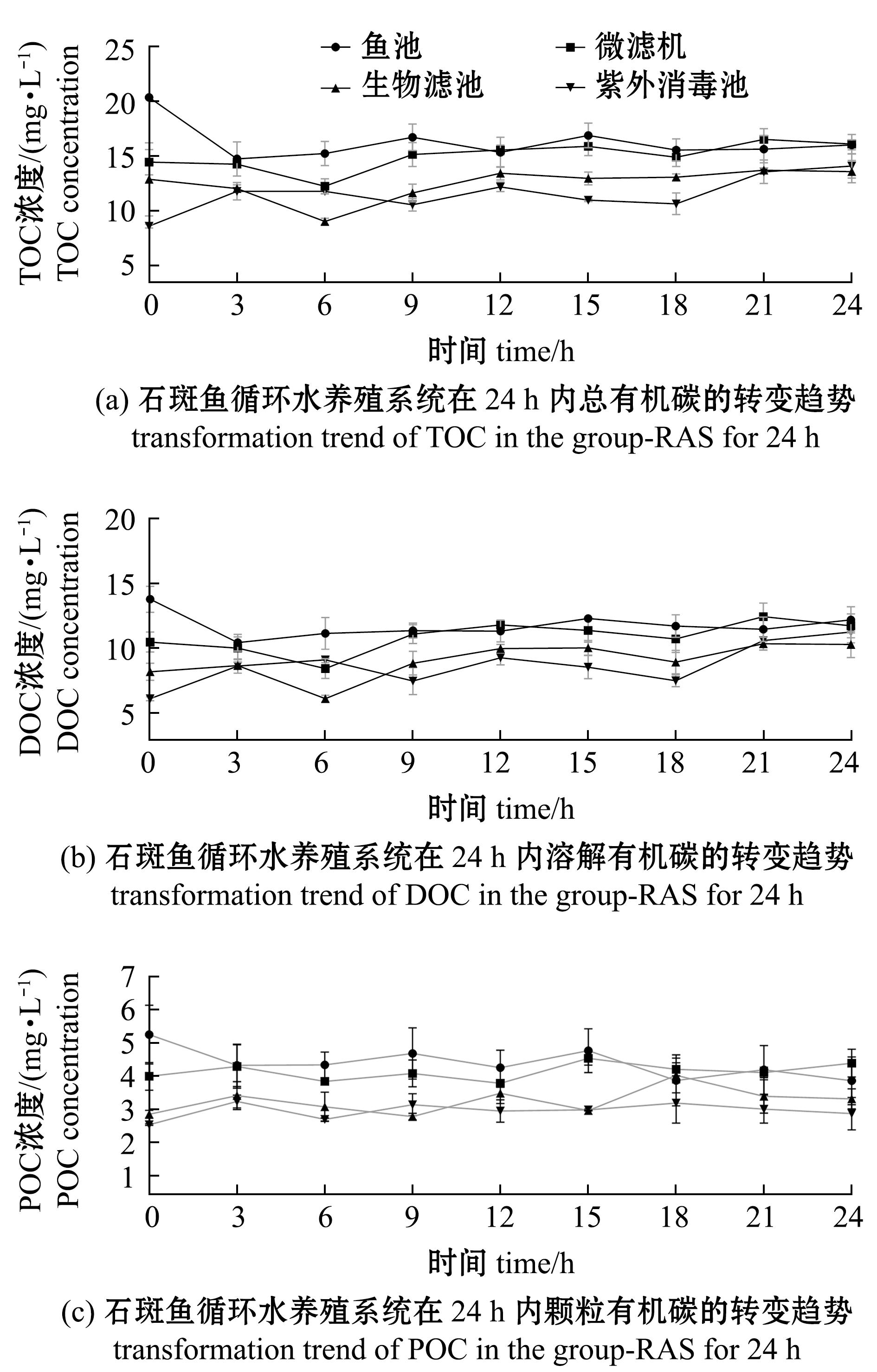
图2 石斑鱼循环水养殖系统短周期内碳元素转变趋势
Fig.2 Transformation trend of carbon in the grouper-RAS for 24 h
在长周期(7 d)试验中,系统4个单元内POC、DOC和TOC含量随着时间延长呈现出特定变化(图3)。试验初期,各单元内碳元素含量依次为鱼池>微滤机>生物滤池>紫外线消毒池;自试验第3 天开始,各单元内POC、DOC和TOC含量趋于平衡,此后保持相对稳定的浓度变化;至试验第7 天,各单元内碳元素浓度发生改变,鱼池内POC、DOC和TOC含量最高,而紫外线消毒池内POC、DOC和TOC含量最低。整个周期内,各单元的碳元素含量始终保持波动平衡状态。
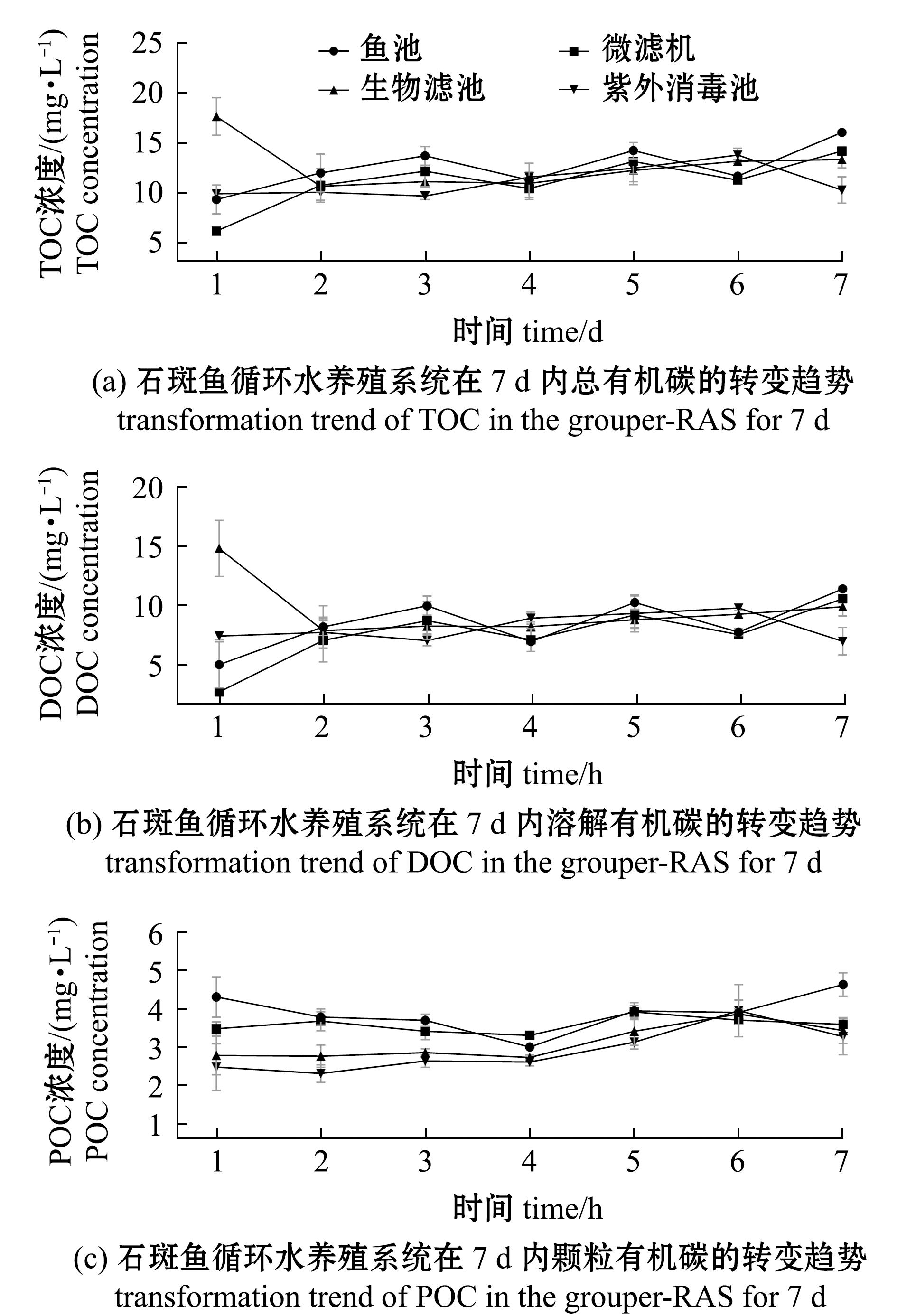
图3 石斑鱼循环水养殖系统长周期内碳元素转变趋势
Fig.3 Transformation trend of carbon in the grouper-RAS for 7 d
2.2 系统有机碳空间转化规律
图4展示了RAS中不同单元在短周期内的有机碳浓度。投喂前(0 h),系统4个单元的有机碳含量呈阶梯式递减;生物滤池内有机碳浓度显著低于微滤机内有机碳浓度(P<0.05),投喂后24 h,生物滤池与微滤机的有机碳含量始终保持显著性差异。系统内鱼池、生物滤池的温室气体排放通量见表1,生物滤池的二氧化碳排放量高于鱼池排放量。
表1 鱼池、各级生物滤池的温室气体排放通量
Tab.1 CO2,CH4 emission fluxes of fish tank and biofilter mg C/m2·d
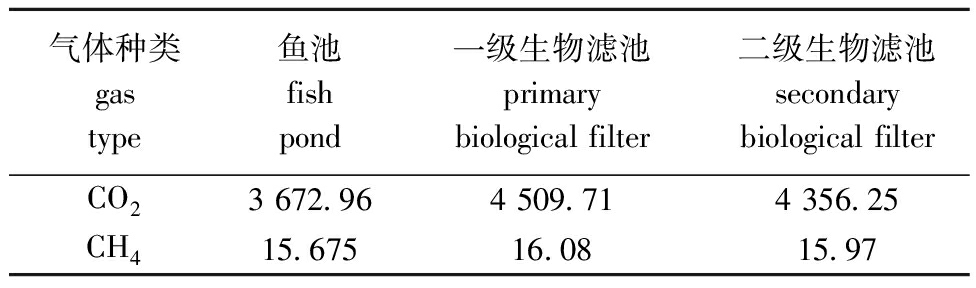
气体种类gas type鱼池fish pond一级生物滤池primary biological filter二级生物滤池secondary biological filterCO23 672.964 509.714 356.25CH415.67516.0815.97
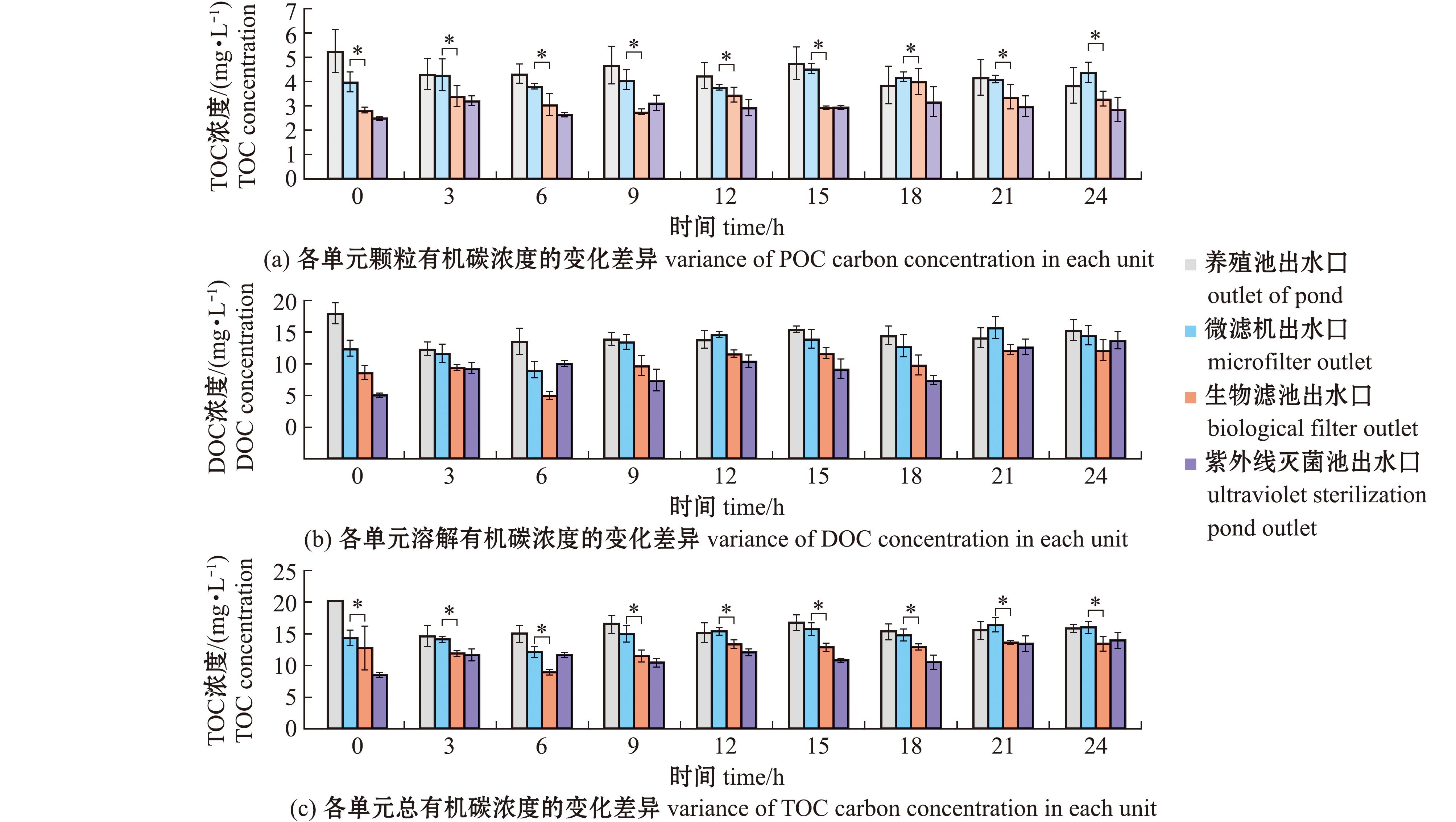
*表示组间有显著性差异(P<0.05)。*means significant difference in the groups(P<0.05).
图4 系统各单元碳浓度短周期变化
Fig.4 Variance of carbon concentration in each unit of the RAS for 24 h
2.3 系统碳元素收支和能量收支
试验期间共投喂饲料1 282.52 g,总碳含量为522.48 g,占RAS碳输入的99.89%;通过补水输入碳含量为0.58 g,占RAS碳输入的0.11%。系统碳元素输出和能量收支及占比如表2、表3所示,从表中可见,与碳转化相比,鱼体对饲料的能量同化能力大于对饲料的碳转化能力。
表2 石斑鱼循环水养殖系统中的碳收支
Tab.2 Input and output of carbon in the grouper-RAS
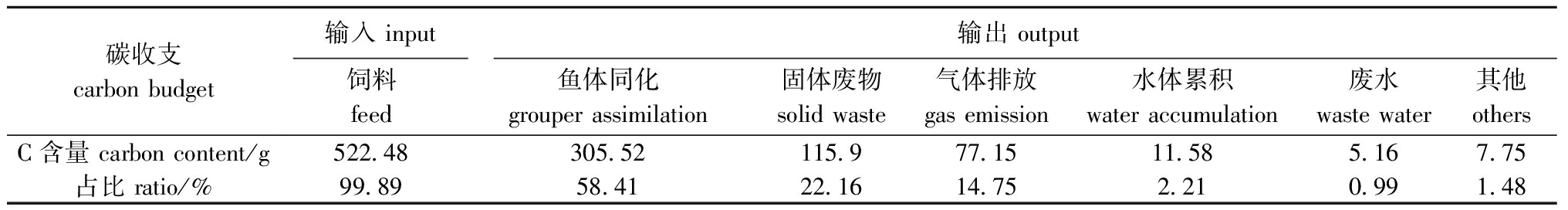
碳收支carbon budget输入 input输出 output饲料feed鱼体同化grouper assimilation固体废物solid waste气体排放gas emission水体累积water accumulation废水waste water其他othersC含量 carbon content/g522.48305.52115.977.1511.585.167.75占比 ratio/%99.8958.4122.1614.752.210.991.48
表3 石斑鱼循环水养殖系统中的能量收支
Tab.3 Input and output of energy in the grouper-RAS
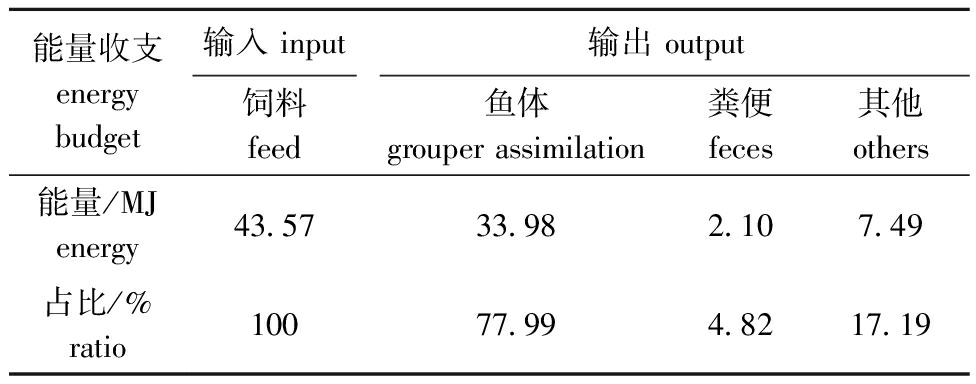
能量收支energy budget输入 input输出 output饲料feed鱼体grouper assimilation粪便feces其他others能量/MJenergy43.5733.982.107.49占比/%ratio10077.994.8217.19
鱼体同化是系统有机碳的主要输出途径,试验期间鱼体同化量为305.52 g,占系统总碳消耗的58.41%;其次是固体废物和气体排放,分别为115.9、77.15 g,占碳输出的22.16%和14.75%;养殖水体积累和微滤机洗脱废水的碳输出占比较低,分别为2.21%和0.99%;其他形式的碳消耗含量为7.75 g,占总碳支出的1.48%(表2)。试验期间,通过饲料输入的能量为43.57 MJ,其中77.99%被鱼体同化,4.82%由固体废物输出,17.19%则因其他原因损耗(表3)。
3 讨论
3.1 碳元素和能量的系统收支分析
在传统开放养殖模式(如池塘、湖泊等)中,浮游植物和周丛植物的初级生产贡献了系统总有机碳输入的58%~78%[16-18],然而,在RAS中,由于系统的封闭性,碳输入主要依赖饲料投喂。在本试验中,饲料贡献高达99.89%,符合封闭式循环水养殖系统特性。有机碳的利用方面,不同养殖方式下有机碳的流向和利用率各不相同。普通户外养殖中,浮游生物呼吸占据总有机碳输出的65%左右[19],部分有机碳主要以沉积物形式积累在底部,养殖生物对其的利用率仅为3%~18%[8-9,19]。Alongi等[20]通过对印尼海水网箱养殖有机碳收支的研究发现,40%~70%的有机碳转化为底泥沉积。何志辉[21]对吉林池塘淡水养殖系统的生态转化研究发现,输入有机碳的28.3%~51.4%进入底泥累积。而在本试验的RAS中,大部分有机碳被鱼体同化,石斑鱼对碳的利用率达58%,远超传统池塘养殖的碳利用率,沉积物仅占总碳支出的22.16%,低于其他研究,这体现了RAS的高效性。此外,本研究中14.75%的有机碳以温室气体形式排出,其中最主要的是CO2和CH4的排放。在封闭式RAS系统中,养殖生物和异养微生物的呼吸作用是水体CO2的主要来源,同时也是影响水-气界面CO2通量的最主要因素[22],而在较高水温条件下,水-气界面CO2通量会随着养殖动物的呼吸代谢增强而上升[23]。在本研究中,由于循环水系统水温在试验过程中保持在25 ℃,养殖动物和微生物保持了一定代谢强度,因此系统保持了一定的CO2通量。水体环境中CH4排放量变化与水体含氧量变化有着显著关系[24],通常情况下氧含量低的时候水体会排放较多的CH4。本研究中,在鱼池和生物滤池单元提供了相对强度的曝气增氧,因此CH4的产生量较少。笔者发现,相较于鱼池,有更多厌氧菌生存的生物滤池CH4通量并未明显增多,这可能是鱼池曝气不均的原因。本试验采用气泵接人工气石进行增氧,而石斑鱼属凶猛性鱼类,在摄食或其他行为过程中会接触到增氧设备,这可能导致鱼池部分区域出现溶解氧过饱和或溶解氧不足的现象,从而刺激产甲烷菌产生CH4。
能量收支方面,本研究在室内封闭式RAS中进行,能量收入的100%来自饵料投喂,碳收支和能量收支的结果显示,RAS对饲料中能量的利用率大于碳利用率,这或许受试验动物和饲料组分配比的影响。前期的研究表明,大多数肉食鱼类对饵料中的脂质和蛋白质利用率大于碳水化合物的利用率[25-26],本研究中,试验对象珍珠龙胆石斑鱼生性凶猛,食肉,对饲料中高热量的蛋白质和脂质吸收率较高。同时,Letelier-gordo等[27]的研究中发现,不同蛋白能量比(P/E)的饲料会影响鱼粪便中提取的碳成分含量,因此饲料中的组分配比可能是导致碳收支和能量收支差异的原因之一。此外,在饲料中添加一些膳食成分能改变养殖动物的能量利用配比,Chen等[28]在饲料中添加生物絮凝体后发现,海参对饲料的能量利用率得以提高,生长性能进一步优化。除饵料影响动物能量利用外,水质也会影响养殖动物的能量代谢。对梭鲈的研究发现,在水体高硝酸盐水平条件下,梭鲈代谢能增加,自身储存的能量会被消耗[29]。在本研究中,石斑鱼对饲料的能量利用率达到77.99%(图5),饲料中的能量大部分被鱼体同化,而试验期间监测的亚硝酸盐氮、氨氮等水质指标均在合适浓度范围内,这或许是石斑鱼能量利用率高的原因之一。然而,由于系统的复杂性,养殖密度[30]、饲料配给[31]等也能影响到RAS中生物体的能量吸收和消耗,该方向还需深入研究和探讨。
3.2 系统有机碳时空转化规律
本试验观察到,无论是长周期还是短周期试验,系统4个单元(鱼池、微滤机、生物滤池、紫外线消毒池)的TOC含量均呈现随时间推移趋于相近的现象,但并未有大幅变化,小幅的波动主要表现在DOC含量的变化。POC在各单元均有截留,呈现出层级递减趋势,而DOC含量则逐渐趋同(图2(b),图3(b))。此现象可能与投饵量有关,循环水系统中有机碳的最主要来源为饵料,过量投饵会显著导致水中悬浮颗粒物及硝酸盐、亚硝酸盐、氨氮等污染物积累[32],残饵的囤积会显著提高水体有机碳含量。本试验中,投饵量根据每日实际摄食情况做出了适量调整,因此残饵产生量较少,适当的饵料投喂与各级水处理单元的过滤作用相结合,使水中有机污染物水平降低,各单元有机碳含量达到波动平衡状态。然而,在长周期内,各单元TOC浓度呈上升趋势,这可能是由于系统去除有机碳能力有限,有机碳积累所致。此外,养殖动物的活动,鱼池会出现溶解氧不均匀情况,这也可能从侧面影响水体CO2通量,从而导致系统有机碳的留存,此方向还需进一步的研究。
微滤机的过滤作用会对循环水系统中有机碳的迁移产生较大影响。研究显示,微滤机可过滤养殖尾水中大于60 μm的颗粒,对有机物及固体颗粒物的去除率达70%以上[33]。因此,在短周期和长周期内,微滤机出水中所含POC量均低于鱼池出水,体现了微滤机对颗粒物的有效截留。
生物滤池在一个完整的循环水系统中起着关键作用,对维持水质至关重要。RAS通过生物滤池中微生物的降解作用去除有害物质,包括硝化细菌对氨氮、亚硝酸盐的氧化[34],以及其他一些异养细菌对残留有机物的分解[35]。本研究中相比于其他相邻单元,只有生物滤池有机碳含量显著低于微滤机(P<0.05)(图3),表明生物滤池有机碳去除率大于其他水处理单元。同时,生物滤池中微生物的分解作用能将有机化合物转化为CO2或CH4气体释放[36],结合本试验各单元气体排放通量可知,二级生物滤池温室气体释放量(尤其是CO2)均大于鱼池,这可能是试验养殖密度低,生物滤池内微生物呼吸及对有机质的分解作用较强导致。而在一般商业规模的RAS中,鱼池产生的CO2含量则比生物滤池高出约14%[37]。此外,FBBR拥有固定的毛刷型基质,对水流中的POC截留具有一定效果,短周期内生物滤池POC含量显著低于微滤机现象也证实了上述观点。
除生物滤池内有机碳的显著变化外,紫外线消毒池内有机碳浓度也有所下降。紫外线(UV)照射可以灭活微生物,池中蛋白分离器也可将部分有机碳以泡沫形式移出系统,降低了系统整体有机碳水平。除紫外线消毒法外,一些其他循环水养殖系统也采用臭氧(O3)进行消毒。有研究证明,通过向系统内注入O3或O3+UV共同处理,可降低约40% DOC浓度[38],能有效去除循环水养殖系统内过量的有机碳。
4 结论
1)有机碳支出主要包含鱼体同化、固体废物输出、温室气体排放等,分别占总输入的58.41%、22.16%、14.75%;饲料中77.99%的能量被鱼体同化,4.82%由固体废物输出。
2)有机碳的空间迁移和转化受到RAS中微滤机、生物滤池等单元拦截的影响,有机碳浓度在空间上随着各单元正向流动逐级递减,生物滤池对其去除率效果最明显。
3) 有机碳在时间上的变化表现出短周期内波动平衡,长周期内随时间的推移少量积累。
[1] VAN RIJN J.Waste treatment in recirculating aquaculture systems[J].Aquacultural Engineering,2013,53:49-56.
[2] SUANTIKA G,SITUMORANG M L,SAPUTRA F I,et al.Metabolite profiling of whiteleg shrimp Litopenaeus vannamei from super-intensive culture in closed aquaculture systems:a recirculating aquaculture system and a hybrid zero water discharge-recirculating aquaculture system[J].Metabolomics,2020,16(4):49.
[3] SUPRIYONO E,ADIYANA K,THESIANA L.A study of environmentally friendly recirculating aquaculture system on lobster Panulirus homarus nursery[J].Polish Journal of Environmental Studies,2023,32(5):4805-4811.
[4] LAINE C,OLLIKAINEN M,KANKAINEN M,et al.Social net benefits from aquaculture production:a comparison of net cage cultivation and recirculating aquaculture systems[J].Aquaculture Economics &Management,2024,28(1):1-31.
[5] WILKINSON J F.Carbon and energy storage in bacteria[J].Journal of General Microbiology,1963,32:171-176.
[6] 柳磊.组合湿地-池塘循环水养殖系统氮磷收支研究[D].北京:中国农业科学院,2022. LIU L.Study on nitrogen and phosphorus budget of combined wetland-pond recirculating aquaculture system [D].Beijing:Chinese Academy of Agricultural Sciences,2022.(in Chinese)
[7] 孙国祥,李甍,刘鹰.投喂负荷对循环水养殖大西洋鲑生长及氮、磷收支的影响[J].渔业现代化,2014,41(2):1-6. SUN G X,LI M,LIU Y.Effects of feeding load on growth,nitrogen and phosphorus budgets of Atlantic salmon(Salmo salar) in recirculating aquaculture systems[J].Fishery Modernization,2014,41(2):1-6.(in Chinese)
[8] ZHANG K,TIAN X L,DONG S L,et al.An experimental study on the budget of organic carbon in polyculture systems of swimming crab with white shrimp and short-necked clam[J].Aquaculture,2016,451:58-64.
[9] DAVID F S,PROENÇA D C,FLICKINGER D L,et al.Carbon budget in integrated aquaculture systems with Nile Tilapia (Oreochromis niloticus) and Amazon river prawn (Macrobrachium amazonicum)[J].Aquaculture Research,2021,52(11):5155-5167.
[10] HU F W,SUN M,FANG J H,et al.Carbon and nitrogen budget in fish-polychaete integrated aquaculture system[J].Journal of Oceanology and Limnology,2021,39(3):1151-1159.
[11] LI J W,DONG S L,GAO Q F,et al.Total organic carbon budget of integrated aquaculture system of sea cucumber Apostichopus japonicus,jellyfish Rhopilema esculenta and shrimp Fenneropenaeus chinensis[J].Aquaculture Research,2014,45(11):1825-1831.
[12]  NORDI G,GLUD R N,GAARD E,et al.Environmental impacts of coastal fish farming:carbon and nitrogen budgets for trout farming in Kaldbaksfjorour (Faroe Islands)[J].Marine Ecology Progress Series,2011,431:223-241.
NORDI G,GLUD R N,GAARD E,et al.Environmental impacts of coastal fish farming:carbon and nitrogen budgets for trout farming in Kaldbaksfjorour (Faroe Islands)[J].Marine Ecology Progress Series,2011,431:223-241.
[13] SUN Y,GUO C Y,WANG D D,et al.Transcriptome analysis reveals the molecular mechanisms underlying growth superiority in a novel grouper hybrid (Epinephelus fuscogutatus♀×E.lanceolatus♂)[J].BMC Genetics,2016,17:24.
[14] 高航.基于碳氮循环的“鱼-菌-藻” 共生系统性能强化研究[D].济南:山东大学,2020. GAO H.Study on strengthening the performance of fish-bacteria-algae symbiotic system based on carbon and nitrogen cycle[D].Jinan:Shandong University,2020.(in Chinese)
[15] 李航,王晓锋,袁兴中,等.淡水生态系统温室气体通量监测方法综述[J].湖泊科学,2023,35(4):1153-1175. LI H,WANG X F,YUAN X Z,et al.Review on monitoring methods for greenhouse gases fluxes in freshwater ecosystems[J].Journal of Lake Sciences,2023,35(4):1153-1175.(in Chinese)
[16] BOYD C E,TUCKER C S.Pond aquaculture water quality management[M].US:Springer Science &Business Media,1998.
[17] YANG P,TANG K W,YANG H,et al.Insights into the farming-season carbon budget of coastal earthen aquaculture ponds in southeastern China[J].Agriculture,Ecosystems &Environment,2022,335:107995.
[18] YOSHIKAWA T,EGUCHI M.Planktonic processes contribute significantly to the organic carbon budget of a coastal fish-culturing area[J].Aquaculture Environment Interactions,2013,4(3):239-250.
[19] ADHIKARI S,SAHU B C,MAHAPATRA A S,et al.Nutrientbudgets and effluent characteristics in giant freshwater prawn (Macrobrachium rosenbergii) culture ponds[J].Bulletin of Environmental Contamination and Toxicology,2014,92(5):509-513.
[20] ALONGI D M,MCKINNON A D,BRINKMAN R,et al.The fate of organic matter derived from small-scale fish cage aquaculture in coastal waters of Sulawesi and Sumatra,Indonesia[J].Aquaculture,2009,295(1/2):60-75.
[21] 何志辉.吉林镇贲养鱼场鱼池生态系的分析[J].水产学报,1993,17(1):24-35. HE Z H.Analysison the fish pond ecosystems in Zhenlai fish farm of Jilin province[J].Journal of Fisheries of China,1993,17(1):24-35.(in Chinese)
[22] 仓晟楠,吕欣蓝,胡鑫,等.循环水养殖系统中二氧化碳对鱼类的影响及去除方法[J].渔业现代化,2024,51(4):27-36. CANG S N,LÜ X L,HU X,et al.Effects and solutions of carbon dioxide on fish in recirculating aquaculture systems[J].Fishery Modernization,2024,51(4):27-36.(in Chinese)
[23] 朱小明,叶乐,李少菁.生物能量学理论及其虾蟹类的研究进展[J].厦门大学学报(自然科学版),2006,45(sup2):162-169. ZHU X M,YE L,LI S J.Bioenergetics and some recent progress in studies of decapod crustaceans[J].Journal of Xiamen University (Natural Science Edition),2006,45(sup2):162-169.(in Chinese)
[24] SCHRIER-UIJL A P,VERAART A J,LEFFELAAR P A,et al.Release of CO2 and CH4 from lakes and drainage ditches in temperate wetlands[J].Biogeochemistry,2011,102(1):265-279.
[25] GARC A-GALLEGO M,BAZOCO J,SU
A-GALLEGO M,BAZOCO J,SU REZ M D,et al.Utilization of dietary carbohydrates by fish:a comparative study in eel and trout[J].Animal Science,1995,61(2):427-436.
REZ M D,et al.Utilization of dietary carbohydrates by fish:a comparative study in eel and trout[J].Animal Science,1995,61(2):427-436.
[26] L PEZ L M,TORRES A L,DURAZO E,et al.Effects of lipid on growth and feed utilization of White Seabass (Atractoscion nobilis) fingerlings[J].Aquaculture,2006,253(1/2/3/4):557-563.
PEZ L M,TORRES A L,DURAZO E,et al.Effects of lipid on growth and feed utilization of White Seabass (Atractoscion nobilis) fingerlings[J].Aquaculture,2006,253(1/2/3/4):557-563.
[27] LETELIER-GORDO C O,LARSEN B K,DALSGAARD J,et al.The composition of readily available carbon sources produced by fermentation of fish faeces is affected by dietary protein:energy ratios[J].Aquacultural Engineering,2017,77:27-32.
[28] CHEN J H,LIU P,LI Y Q,et al.Effects of dietary biofloc on growth,digestibility,protein turnover and energy budget of sea cucumber Apostichopus japonicus (Selenka)[J].Animal Feed Science and Technology,2018,241:151-162.
[29] STEINBERG K,ZIMMERMANN J,STILLER K T,et al.Elevated nitrate levels affect the energy metabolism of pikeperch (Sander lucioperca) in RAS[J].Aquaculture,2018,497:405-413.
[30] LIU B L,LIU Y,LIU Z Y,et al.Influence of stocking density on growth,body composition and energy budget of Atlantic salmon Salmo salar L.in recirculating aquaculture systems[J].Chinese Journal of Oceanology and Limnology,2014,32(5):982-990.
[31] HAN D,XIE S Q,LEI W,et al.Effect of ration on the growth and energy budget of Chinese longsnout catfish,Leiocassis longirostris Günther[J].Aquaculture Research,2004,35(9):866-873.
[32] STEINBERG K,ZIMMERMANN J,MEYER S,et al.Start-up of recirculating aquaculture systems:how do water exchange rates influence pikeperch (Sander lucioperca) and water composition?[J].Aquacultural Engineering,2018,83:151-159.
[33] ZHOU Z,SONG X F,DONG D P,et al.Occurrence,distribution and sources of microplastics in typical marine recirculating aquaculture system (RAS) in China:The critical role of RAS operating time and microfilter[J].Water Research,2024,255:121476.
[34] SCHREIER H J,MIRZOYAN N,SAITO K.Microbial diversity of biological filters in recirculating aquaculture systems[J].Current Opinion in Biotechnology,2010,21(3):318-325.
[35] RUI Z P,VIDAL J ![]() D,et al.Overview and future perspectives of nitrifying bacteria on biofilters for recirculating aquaculture systems[J].Reviews in Aquaculture,2020,12(3):1478-1494.
D,et al.Overview and future perspectives of nitrifying bacteria on biofilters for recirculating aquaculture systems[J].Reviews in Aquaculture,2020,12(3):1478-1494.
[36] ZHU W Q,ZHANG P Y,DONG H Y,et al.Effect of carbon source on nitrogen removal in anaerobic ammonium oxidation (anammox) process[J].Journal of Bioscience and Bioengineering,2017,123(4):497-504.
[37] SUMMERFELT S T,SHARRER M J.Design implication of carbon dioxide production within biofilters contained in recirculating salmonid culture systems[J].Aquacultural Engineering,2004,32(1):171-182.
[38] XUE W Q,ZHANG C J,ZHOU D D.Positive and negative effects of recirculating aquaculture water advanced oxidation:O3 and O3/UV treatments improved water quality but increased antibiotic resistance genes[J].Water Research,2023,235:119835.