麦穗鱼(Pseudorasbora parva)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鮈亚科(Gobioninae)麦穗鱼属 (Pseudorasbora),几乎遍布中国各主要水系[1],是一种分布广泛的淡水小型鱼类,在已有的鱼类养殖生产中属于野杂鱼,并经常被视为清除对象[2]。麦穗鱼生长快,无论是室内还是室外均易于养殖,且具有较少的肌间刺,肉质细嫩、味道鲜美,近年来作为火焙鱼需求旺盛,深受消费者喜欢,其养殖前景逐步显现。因此,实现麦穗鱼规模化人工繁殖有着重要的意义。同时,麦穗鱼具有较强的环境耐受能力,且对化学物质具有较强的敏感性,这些特性使其具有开发为一种新型模式鱼种的潜力[3]。
目前,对麦穗鱼的研究主要集中在生物学[4-5]、遗传结构[3,6]、毒性试验[7-8]和养殖技术[9-10]等方面,也有学者对麦穗鱼人工繁殖进行了探索,但麦穗鱼规模化人工繁育技术仍未取得实质性突破[11-12],主要原因在于麦穗鱼人工繁殖过程中存在性腺发育同步性差、绝对怀卵量低(绝对繁殖力平均值为417粒)、催产药物及剂量难把握等问题[13]。掌握麦穗鱼的人工繁殖技术,本试验观察了其胚胎发育过程,并研究了催产药物、剂量、注射次数、注射针距、催情水温、雄鱼注射催情药物后精子活力的变化,以及接卵方式和孵化方式等人工繁殖的关键性技术,以期为麦穗鱼的规模化人工繁殖提供技术参考。
1 材料与方法
1.1 材料
2023、2024年4—6月在辽宁省辽阳县兴大养殖场进行试验。麦穗鱼亲鱼在该养殖场池塘中通过地笼网(网目0.5 cm)捕捞获得。亲鱼运回养殖车间后,采用浓度为10 mg/L的高锰酸钾进行15 min的药浴处理,然后将其放入规格为4.0 m×4.0 m×1.5 m的水泥池中暂养。该水泥池水深为0.7 m,水温控制在14 ℃~20 ℃,使用气泵充气增氧,溶氧为6.0 mg/L及以上。2023年从暂养的亲鱼中随机选取70尾雌亲鱼、2024年共随机选取68尾雌亲鱼,测量其体长、体质量、性腺质量等形态性状,统计其成熟率和成熟系数。
1.2 方法
1.2.1 雌雄及其成熟度鉴别 在非繁殖季节,麦穗鱼的雌雄个体难以鉴别。当进入繁殖季节时,雄鱼体型较雌鱼稍大,且在其头部吻端、下颌及鳃盖底部均会出现角质追星,脸颊部则呈现紫红色,体色为灰黑色。此外,性成熟的雄鱼在腹部受到挤压时,会有少量乳白色精液流出。雌鱼的体色为浅黄色,卵巢轮廓明显,腹部膨大且柔软。对于成熟度好的雌鱼,在腹部受到轻微挤压时,会有卵粒淌出(图1)。

A—雄鱼;B—雌鱼。
A—male;B—female.
图1 繁殖期雌、雄麦穗鱼特征
Fig.1 Characteristics of male and female Pseudorasbora parva in the reproductive season
1.2.2 人工催产 人工催产对比试验均设置3个平行,每个平行雌鱼和雄鱼各30尾。
1)催产药物及剂量对比试验。在水温为14 ℃~20 ℃的条件下,试验设计了两种催产药物组合。第一种组合为促黄体素激素释放激素类似物2号(LHRH-A2)6~14 μg/kg +地欧酮(DOM)6~14 mg/kg+绒毛膜促性腺激素(HCG)1 000~2 000 IU/kg;第二种组合为LHRH-A2 8~14 μg/kg+HCG 1 000~2 000 IU/kg。试验鱼采用背鳍基部注射,至效应时间后,通过挤压雌鱼腹部产卵的方式统计每个药物组合的催产率。雄鱼的催产药物同雌鱼,但剂量减半。试验用所有催产药物均来自宁波第二激素厂。
2)注射针距和注射方式试验。在14 ℃~20 ℃条件下,根据催产药物组合得到的结果进行注射针距对比试验。在注射针距试验中,共设置11个梯度(6、8、10、12、14、16、18、20、22、24、26 h),每个梯度间隔为2 h。其中,第一针注射药物剂量均为LHRH-A2 2 μg/kg。根据注射针距得到的结果,进行一次注射与二次注射方式的对比试验。至效应时间后,通过挤压雌鱼腹部产卵的方式统计注射针距和每组注射方式的催产率。
3)人工催产最适水温试验。为了确定人工催产的最适水温,在水温13 ℃~29 ℃共设计5个梯度(13 ℃、17 ℃、21 ℃、25 ℃、29 ℃)水温试验,每个梯度间隔4 ℃。在试验中,采用控温加热棒控温。至效应时间后,通过挤压腹部产卵的方式统计每组水温的催产率。
4)注射催情药物后不同时间内精子活力的变化。在17 ℃条件下,采用混合药物LHRH-A2 4 μg/kg+HCG 1 000 IU/kg注射100尾雄鱼,注射催情药物后放入暂养池暂养,然后每隔4 h取6尾雄鱼进行精液采集。用消毒后的解剖针取微量麦穗鱼精液于载玻片上,并向精液中心滴1滴0.9%的NaCl溶液,迅速盖上盖玻片,然后,将其置于显微镜(Olympus CX21,10×10倍镜)下观察。同时,用秒表进行计时,并记录精子激活率、快速运动时间和寿命,以确定麦穗鱼雄鱼的最佳受精时间。每个试验组设置3个平行。
1.2.3 不同鱼巢接卵试验 在水族箱(1.0 m×0.5 m×0.4 m)中设置5组产卵附着物作为人工鱼巢。其中,A组参照鲤(Cyprinus carpio)悬挂棕榈树皮作为鱼巢的自然接卵方式[14];B组参照江河等[15]方法放置直径为22 cm的PVC管;C组放置蚌壳;D组悬挂竹杆;E组在水族箱底部及周围铺设筛绢布。使鱼自然产卵,自然授精。接卵过程中,A~D组鱼巢每2~3 h更换一次鱼巢,E组鱼巢上的产卵密度达2 000 粒/m2时及时更换鱼巢,直到亲鱼不再产卵为止。
1.2.4 两种孵化方法对比试验
1)塑料盆(1.4 m×0.7 m×0.3 m)静水充气孵化。将附着有受精卵的PVC管、蚌壳和竹竿置于塑料盆中,静水充气孵化,溶解氧浓度始终保持在6 mg/L及以上。在孵化期间,每2 d更换一次新水,每次换水1/3。同时,将水温控制在18 ℃~21 ℃,直至破膜。
2)孵化篓孵化。使用刮板将附着在筛绢布上的受精卵剥离下来,并将其置于锥形筛绢(孔径为0.245 mm)孵化篓内,该孵化篓的设计为上端圆柱体(直径为60 cm,高为20 cm),下部为圆锥体(高为80 cm,最底部直径为5 cm),底部包裹气石。在孵化期间,气量需调整至使卵粒能够全面翻滚,确保无死角。每个孵化篓内放置的受精卵数量为25~30万粒。在孵化期间,需及时更换或清洗孵化篓,保持水质清洁。若遇到孵化篓内受精卵感染水霉情况严重时,需将受精卵倒出并进行重新漂洗,直至清理完毕。在整个孵化期间,水温需保持在18 ℃~21 ℃,直至破膜。
1.2.5 胚胎发育观察 采用显微镜 (Olympus CX 21,10×10倍镜)对麦穗鱼的胚胎发育过程进行拍照观察。每次试验均取样30粒以上受精卵,当观察到50%受精卵出现新发育特征时即进行拍照,并记录该发育时期至新时期的起始时间点。
1.2.6 人工繁殖效率及精子活力评价
产卵密度=单位面积内卵粒量×卵巢的总面积,
(1)
成熟率![]()
成熟系数![]()
催产率![]()
受精率![]()
孵化率=![]()
(6)
精子激活率(activation rate,AR)为
快速运动时间(fast movement time,FT)为精子激活到70%时精子转入慢速运动的时间;寿命时间(life span,LT)为精子开始活动至大约90%时精子停止运动的时间。
1.3 数据处理
所有试验数据均以平均值±标准差(mean±S.D.)表示。试验数据采用Excel 2021软件进行统计和作图分析。采用SPSS 24.0软件进行单因素方差分析(one-way ANOVA),并使用Duncan法对多组间的样本进行差异显著性分析,显著性水平设为0.05。利用Adobe Photoshop 2020 软件对获取的胚胎图像进行必要处理和精确测量。
2 结果与分析
2.1 麦穗鱼亲鱼的规格和选择
2023、2024年繁殖季节共随机选取138尾雌亲鱼,统计其规格和成熟情况。从表1可见:麦穗鱼雌亲鱼平均体长为(64.23±7.83)mm,平均体质量为(5.27±1.97)g,平均成熟系数为17.40%±4.57%。其中,成熟系数总体范围在8%~29%,其中成熟系数15%~20%占比最大,达40.58%;其次为10%~15%,占比27.54%;20%~30%时,仅占比27.54%(图2)。亲鱼平均成熟率较低,仅为29.00%±1.41%。
表1 麦穗鱼亲鱼的规格和成熟情况
Tab.1 Size and maturity of parent Pseudorasbora parva
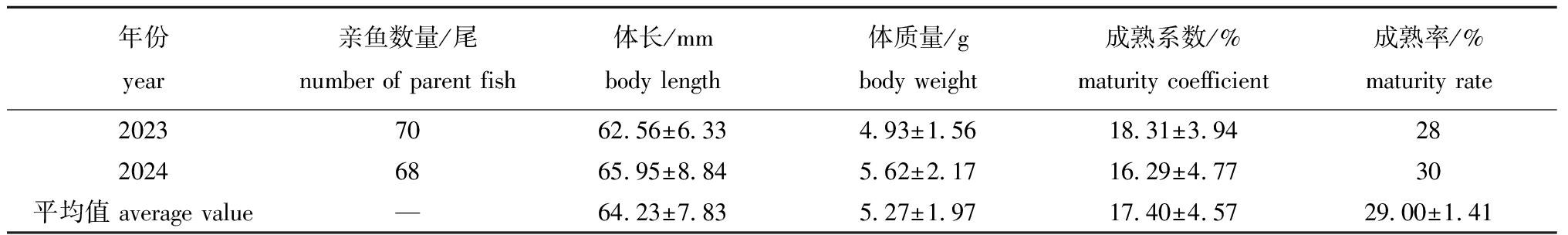
年份year亲鱼数量/尾number of parent fish体长/mmbody length体质量/gbody weight成熟系数/%maturity coefficient成熟率/%maturity rate20237062.56±6.334.93±1.5618.31±3.942820246865.95±8.845.62±2.1716.29±4.7730平均值 average value—64.23±7.835.27±1.9717.40±4.5729.00±1.41
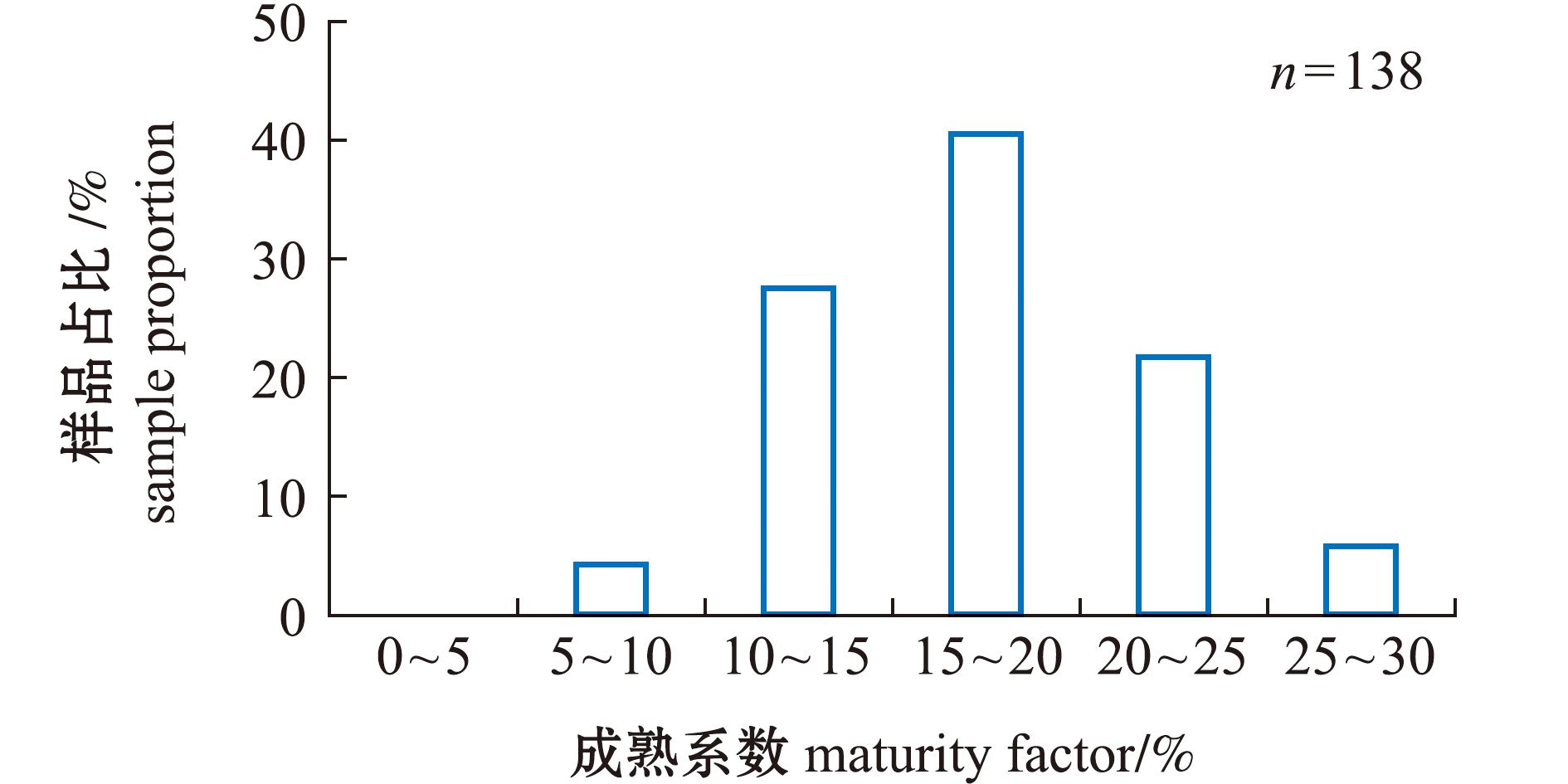
图2 繁殖季节麦穗鱼成熟系数分布状况
Fig.2 Distribution of maturity coefficient of Pseudorasbora parva in the reproductive season
2.2 催产药物、剂量及注射方式的比较研究
2023年4月9日—6月6日,在辽阳兴大养殖场进行麦穗鱼催产药物的筛选。从表2可见,麦穗鱼采用LHRH-A2+HCG混合药物的平均催产率可达57.00%±3.46%,显著高于LHRH-A2+DOM+HCG混合药物(P<0.05),LHRH-A2+DOM+HCG混合药物的平均催产率仅为16.67%±3.76%。使用LHRH-A2+HCG混合药物进行一次和二次注射方式对比试验,结果表明,二次注射平均催产率可达70.33%±7.51%,显著高于一次注射(P<0.05)。在二次注射方式中,混合药物LHRH-A2 8 μg/kg+HCG 2 000 IU/kg剂量组催产率显著高于其他剂量组(P<0.05),可达78.00%±5.77%。
表2 催产药物及剂量筛选
Tab.2 Oxytocic drugs and dose selection
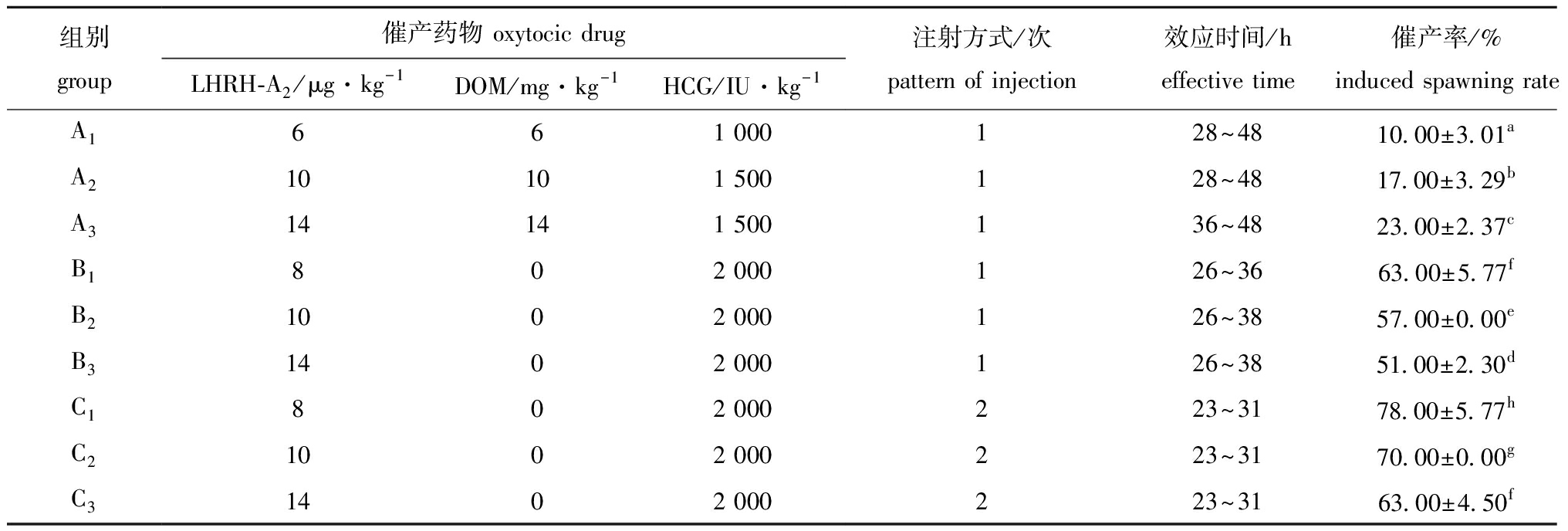
组别group催产药物 oxytocic drugLHRH-A2/μg·kg-1DOM/mg·kg-1HCG/IU·kg-1注射方式/次pattern of injection效应时间/heffective time催产率/%induced spawning rateA1661 000128~4810.00±3.01aA210101 500128~4817.00±3.29bA314141 500136~4823.00±2.37cB1802 000126~3663.00±5.77fB21002 000126~3857.00±0.00eB31402 000126~3851.00±2.30dC1802 000223~3178.00±5.77hC21002 000223~3170.00±0.00gC31402 000223~3163.00±4.50f
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),下同。
Note:The means with different letters within the same column are significant differences at 0.05 probability level,et sequentia.
2.3 注射针距试验
从图3可见,在二次注射方式中,随着第一针与第二针注射针距的增加,催产率呈先升高后降低的趋势。在针距为8 h时,催产率最高,达77.00%±2.00%。当针距超过16 h时,催产率显著降低(P<0.05)。这表明,在二次注射方式中,注射第一针与注射第二针的最适针距为8 h。
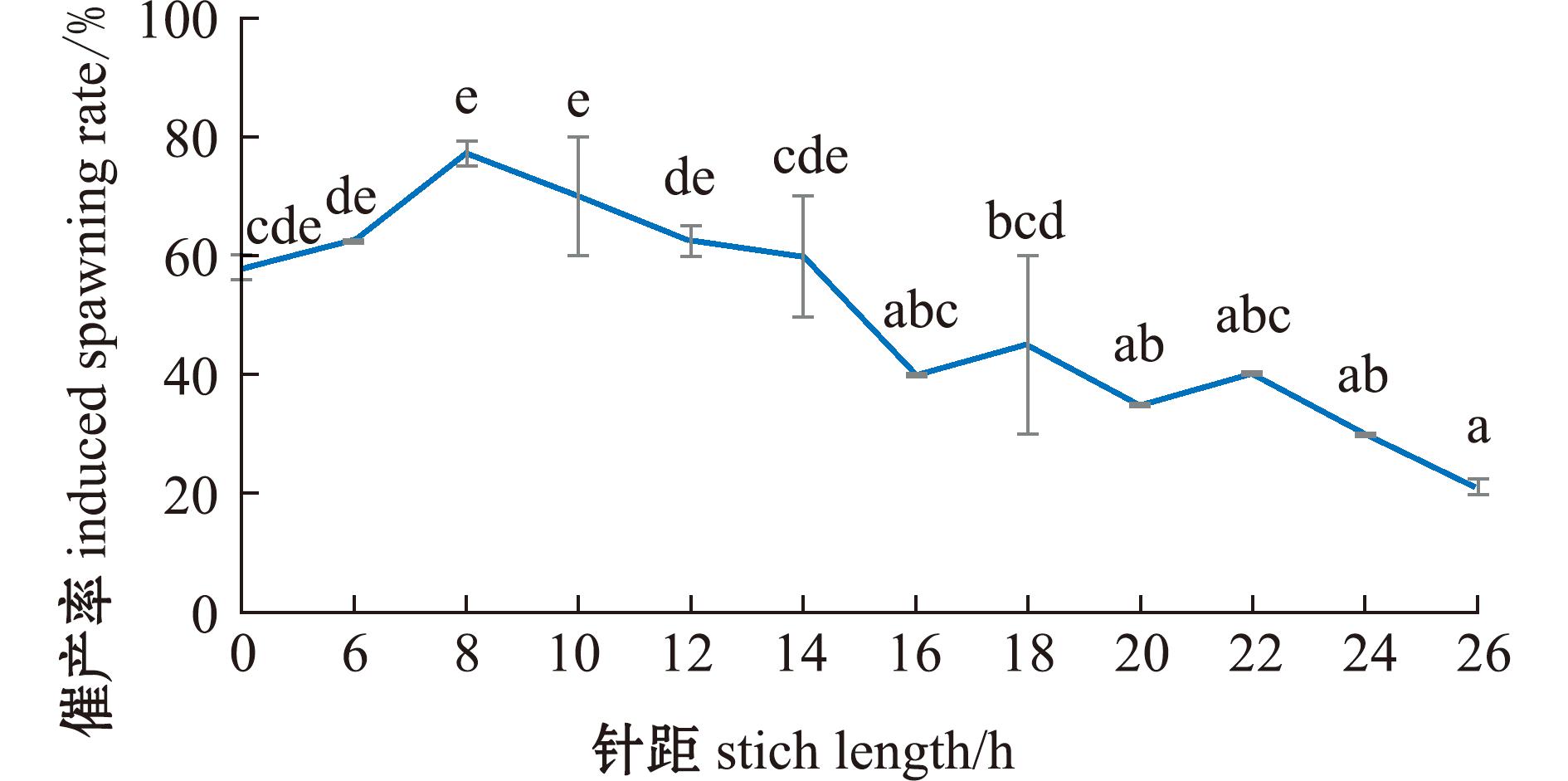
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
图3 二次注射针距对麦穗鱼催产率的影响
Fig.3 Effect of interval between two injections on the induced spawning rate of Pseudorasbora parva
2.4 注射催情药物对精子活力的影响
从图4可见,在水温17 ℃条件下,麦穗鱼雄鱼注射催情药物后,在0~52 h时,其精子激活率(AR)均高于80%,且无显著性差异。注射后16 h时,精子快速运动时间(FT)达到最大值,为(89.50±0.50)s。注射后24 h时,精子寿命时间(LT)达到最大值,为(132.00±15.04)s。这表明,16~24 h为麦穗鱼雄鱼的适宜人工授精时间,其中16 h为最佳授精时间。
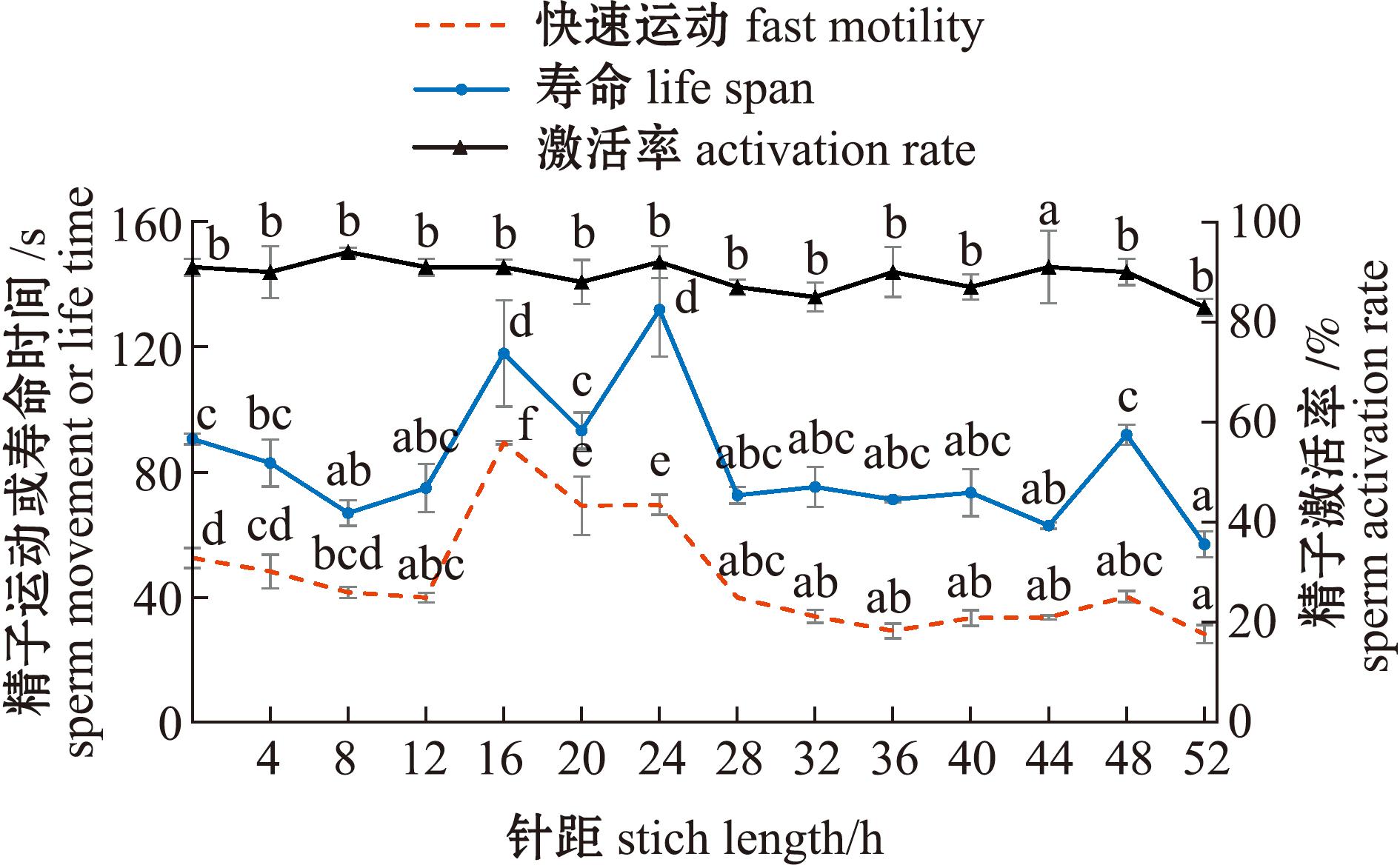
图4 注射催产药物对麦穗鱼精子活力的影响
Fig.4 Effect of injection of oxytocic drugs on sperm motility of Pseudorasbora parva
2.5 水温对催产率的影响
从图5可见,在水温为13 ℃~29 ℃时,随着水温从13 ℃升至21 ℃,催产率显著提高(P<0.05);当水温为17 ℃时,催产率达到最大值,为78.00%±3.54%;随着水温继续升高至29 ℃,催产率显著下降(P<0.05)。这表明,其最适催情水温为17 ℃。
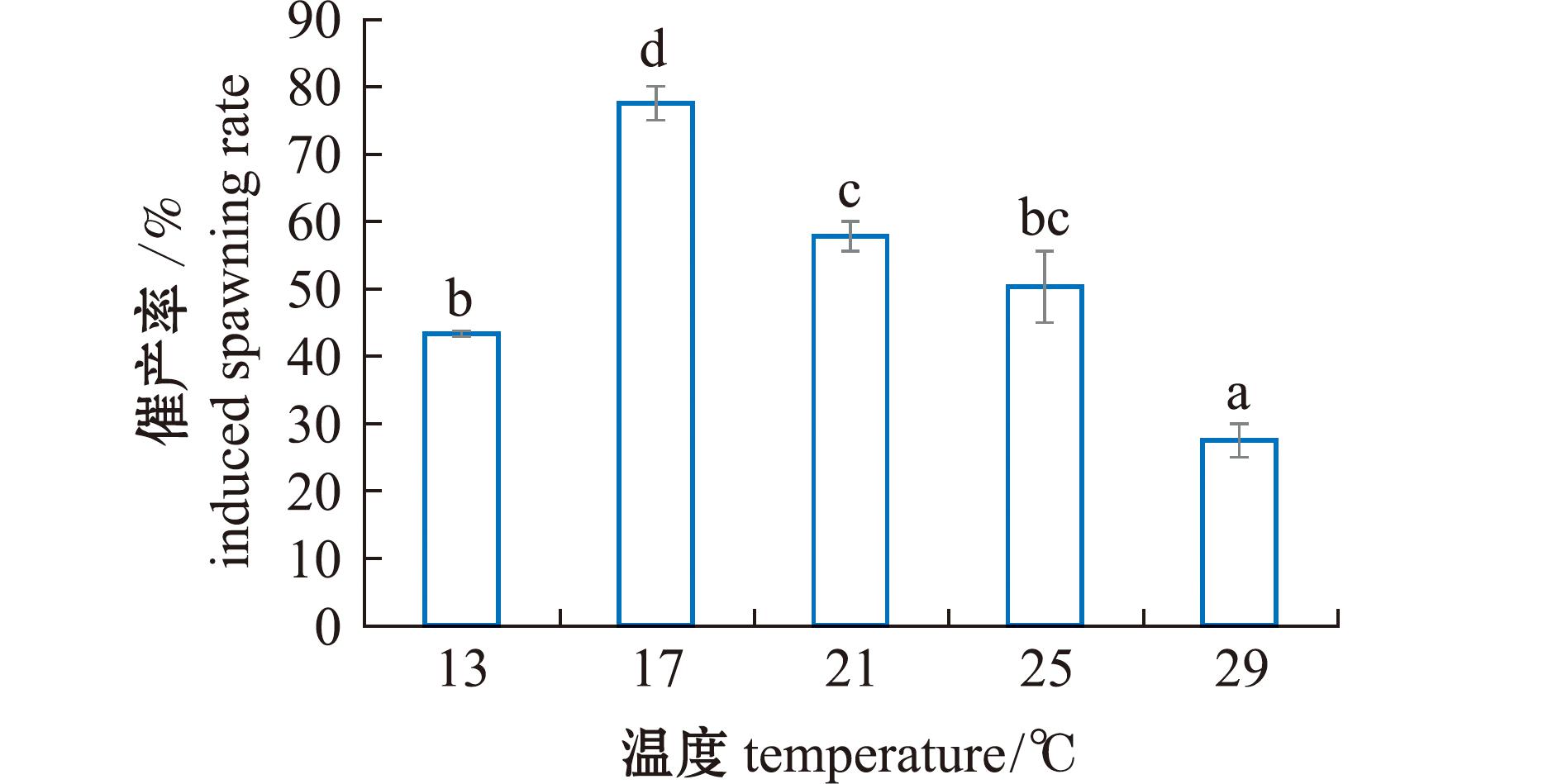
图5 水温对麦穗鱼催产率的影响
Fig.5 Effect of water temperature on the induced spawning rate of Pseudorasbora parva
2.6 人工鱼巢接卵和孵化效果比较
从表3和图6A~D可见,注射催产药物至效应时间后,B、C、D和E组水族箱中的PVC管、蚌壳、竹竿及筛绢布这4种接卵鱼巢均能起到接卵效果,此外,麦穗鱼还在水泥池壁上产卵(图6E)。E组底铺筛绢布接卵率达98.00%±0.02%,显著高于其他组。A组,即传统的棕榈鱼巢接卵率为0,说明麦穗鱼不喜棕榈鱼巢。使用E组底铺筛绢布接卵鱼巢,在刮卵后,剥离下的卵粒可置于孵化篓孵化,其孵化率达80.00%±8.12%,显著高于塑料盆静水充气孵化(P<0.05)(表3)。
表3 4种鱼巢接卵和孵化效果比较
Tab.3 Effectiveness comparison of egg attachment and hatching among four types of fish nests %
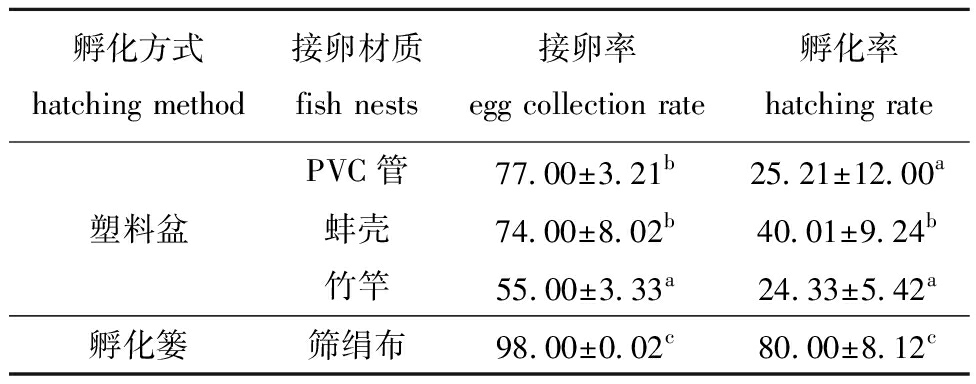
孵化方式hatching method接卵材质fish nests接卵率egg collection rate孵化率hatching ratePVC管77.00±3.21b25.21±12.00a塑料盆蚌壳74.00±8.02b40.01±9.24b竹竿55.00±3.33a24.33±5.42a孵化篓筛绢布98.00±0.02c80.00±8.12c
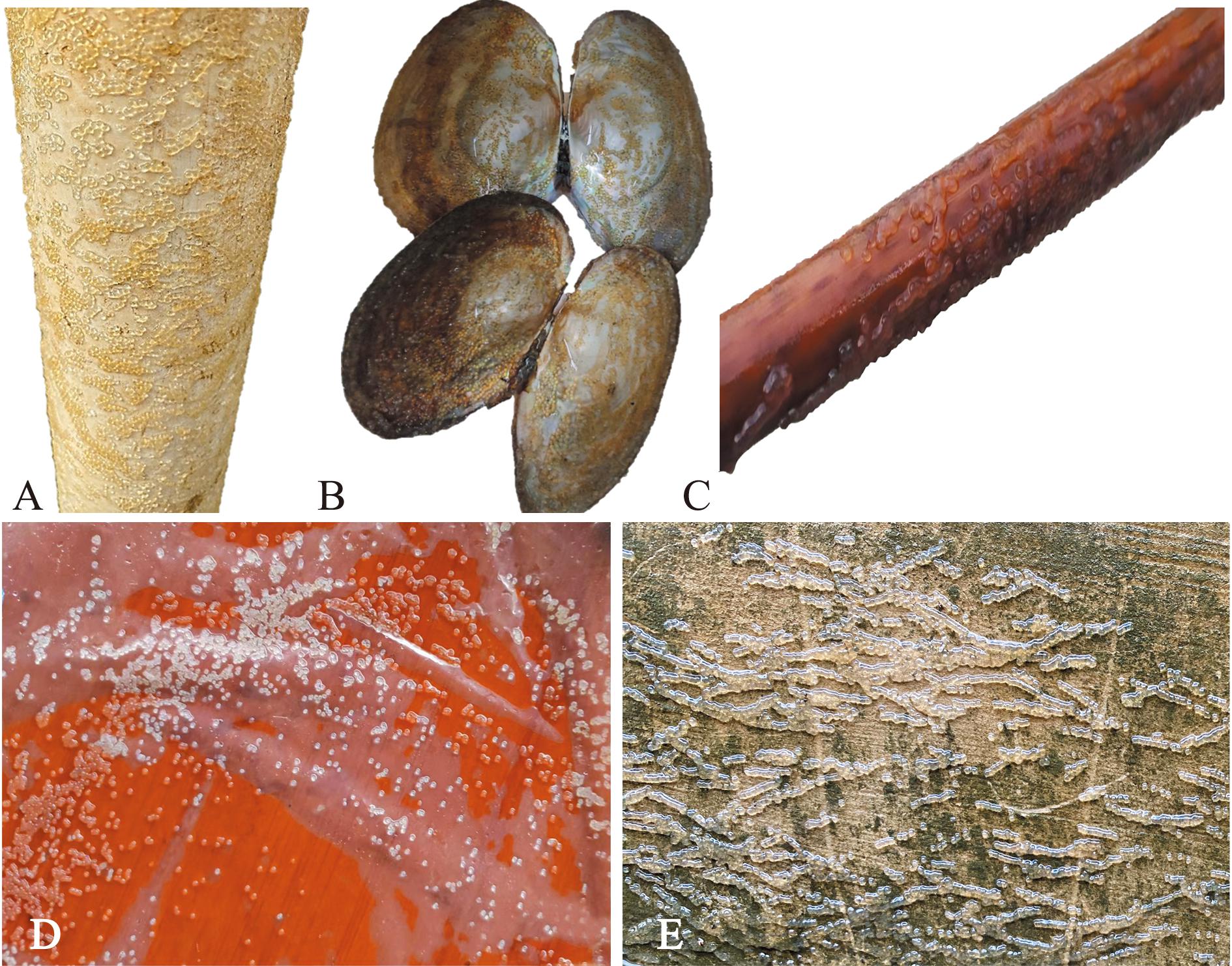
A—PVC管;B—蚌壳;C—竹竿;D—198 μm筛绢布;E—池壁。
A—PVC pipes;B—mussel shells;C—small bamboo poles;D—198 μm sieve silk cloth;E—pool walls.
图6 4种鱼巢接卵效果比较
Fig.6 Comparison of the effects of egg grafting in four fish nests
2.7 麦穗鱼规模化人工繁殖试验
2024年应用前期的最佳试验条件,即于水温17 ℃,采用针距为8 h的二次注射的方法,注射LHRH-A2 8 μg/kg+HCG 2 000 IU/kg混合药物,然后采用筛绢布接卵,孵化篓孵化的方法,进行了3批次繁殖试验。从表4可见:3批次试验共催产406尾,获卵40万粒卵,平均催产率为78.00%±2.65%,平均受精率为84.00%±2.65%,平均孵化率为76.17%±1.84%,共获水花25.5万尾。
表4 麦穗鱼人工繁殖试验
Tab.4 Artificial propagationtest of Pseudorasbora parva
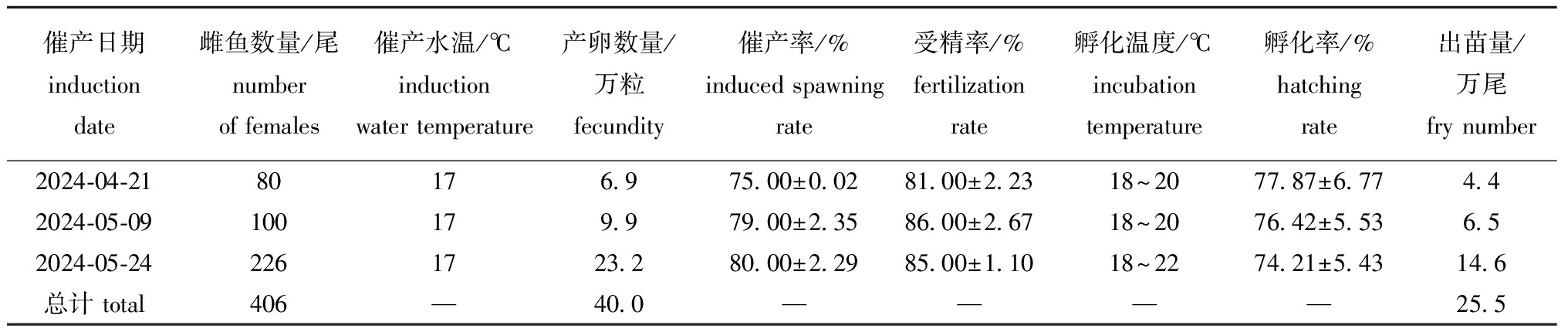
催产日期induction date雌鱼数量/尾number of females催产水温/℃inductionwater temperature产卵数量/万粒fecundity催产率/%induced spawningrate受精率/%fertilizationrate孵化温度/℃incubationtemperature孵化率/%hatchingrate出苗量/万尾fry number2024-04-2180176.975.00±0.0281.00±2.2318~2077.87±6.774.42024-05-09100179.979.00±2.3586.00±2.6718~2076.42±5.536.52024-05-242261723.280.00±2.2985.00±1.1018~2274.21±5.4314.6总计 total406—40.0————25.5
2.8 麦穗鱼的胚胎发育
麦穗鱼卵为椭圆形,颜色为浅黄色,其平均直径为(1.08±0.23)mm。当受精卵遇水后会产生黏性,且其卵膜呈现透明状态。在水温为18 ℃时,受精卵在水中约55 min后,卵膜会因吸水而膨胀,同时卵质逐渐汇聚至动物极,此时受精卵的平均直径为(1.68±0.13) mm。在水温为18 ℃~21 ℃条件下,整个胚胎发育过程历时199 h 58 min,其所需的孵化总积温为3 811.62 ℃·h,初孵仔鱼的全长为(5.01±0.32)mm(图7)。根据胚胎发育过程中各个阶段的具体形态特征变化,可将麦穗鱼的胚胎发育过程分为胚盘隆起、卵裂期,囊胚期、原肠胚期、神经胚期、器官形成期和孵化出膜期7个阶段27个时期。各时期的胚胎发育特征见表5。麦穗鱼从心跳期至出膜前期共经历120 h 37 min,占整个胚胎发育总时长的60.32%。
表5 麦穗鱼的胚胎发育时序(18 ℃~21 ℃)
Tab.5 Embryonic development of Pseudorasbora parva(18 ℃~21 ℃)

发育时期embryonic development stage发育时间development time积温/(℃·h-1)accumulative temperature各发育期主要特征main characteristics of different stages图序figuie No.受精卵 fertilized egg00受精卵呈椭圆形,卵膜遇水迅速膨胀,且外观呈现黄色透明状7-A胎盘期 blastodisc stage55 min11.55 ℃·h原生质发生向动物极的定向迁移并聚集,进而形成帽状胚盘7-B2-细胞期 2-cell stage1 h 24 min6.09 ℃·h胚盘第1次分裂,形成2个体积相近的细胞7-C4-细胞期 4-cell stage1 h 42 min3.78 ℃·h胚盘历经第2次分裂,此次分裂与第一次分裂方向垂直相交,最终形成4个体积相近的细胞7-D8-细胞期 8-cell stage2 h 14 min6.72 ℃·h胚盘第3次分裂,两个分裂面与第一次分裂面保持平行,由此将4个分裂球进一步分裂成8个体积相近的细胞7-E16-细胞期 16-cell stage2 h 36 min4.62 ℃·h胚盘第4次分裂,形成16个体积相近的细胞,单个细胞体积明显变小7-F32-细胞期 32-cell stage2 h 59 min5.29 ℃·h胚盘第5次分裂,形成32个体积相近的细胞,单个细胞体积进一步缩小7-G64-细胞期 64-cell stage3 h 17 min4.14 ℃·h胚盘第6次分裂,形成64个体积相近的细胞,单个细胞体积继续缩小7-H128-细胞期 128-cell stage3 h 32 min3.15 ℃·h胚盘第7次分裂,形成128个体积相近的细胞,单个细胞体积继续缩小7-I多细胞期 multicellular stage3 h 49 min7.36 ℃·h胚盘不断分裂,单个细胞体积逐渐变小1-J桑葚期 morula4 h 15 min5.46 ℃·h胚盘继续分裂,在卵黄上方堆积并隆起,形成类似桑葚的形态,称桑椹胚1-K囊胚早期 early-blastula stage4 h 35 min9.66 ℃·h卵黄表面上聚集了大量的细胞,使胚层隆起较高7-L囊胚中期 mid-blastula stage5 h 42 min22.47 ℃·h细胞持续进行分裂,胚层的高度逐渐降低,细胞间的界限变得不再清晰7-M囊胚后期 late-blastula stage8 h 44 min63.63 ℃·h胚盘细胞开始向卵黄表面扩展和下包,胚盘逐渐变薄,下包至卵黄约1/3处,外形变得扁平7-N原肠早期 early gastrula stage12 h 46 min73.57 ℃·h胚层下包至卵黄约1/2处,胚盘边缘处增厚,胚环明显7-O原肠中期 mid-gastrula stage16 h 21 min65.54 ℃·h胚层继续下包至卵黄约2/3处,胚盾明显7-P原肠晚期 late gastrula stage17 h 19 min10.61 ℃·h胚层继续下包至卵黄约4/5处7-Q神经胚期 neurula stage21 h 19 min73.20 ℃·h胚体完全下包,出现胚体雏形和卵黄栓7-R胚孔关闭期 blastopore closing stage27 h 11 min115.53 ℃·h胚层完全封闭,形成脊索柱状结构,其前部呈现明显的凹槽7-S肌节出现期 appearance of myomere29 h 26 min39.35 ℃·h身体中部形成多个肌节7-T眼囊期 appearance optic capsule30 h1 min22.86 ℃·h胚体前出现眼囊7-U尾芽期 tail-bud stage45 h 59 min285.11 ℃·h尾部与卵黄囊分离,出现尾芽7-V耳囊期 otocyst stage48 h 51 min59.44 ℃·h在胚体的后脑两侧,可观察到椭圆形的听囊结构出现,中脑隆起7-W肌肉效应期 muscle effect stage52 h 20 min63.88 ℃·h胚体出现无规律扭动,体节数量增加7-X晶体出现期 formation of eye lens64 h 27 min226.92 ℃·h眼囊逐渐变圆,囊内开始形成圆形的晶体原基7-Y心脏跳动期 heart-beating stage79 h 21 min290.66 ℃·h胚体出现规律心跳,初始心跳60 次/min7-Z眼色素出现期 eye pigment stage105 h 30 min477.08 ℃·h眼囊部位色素开始出现,卵黄囊进一步吸收,表面可见大量卵质化开并随血液流动,血液流动加快7-a出膜期 embryo hatching stage199 h 58 min1 853.85 ℃·h仔鱼通过头部或尾部破膜而出,通体透明7-b
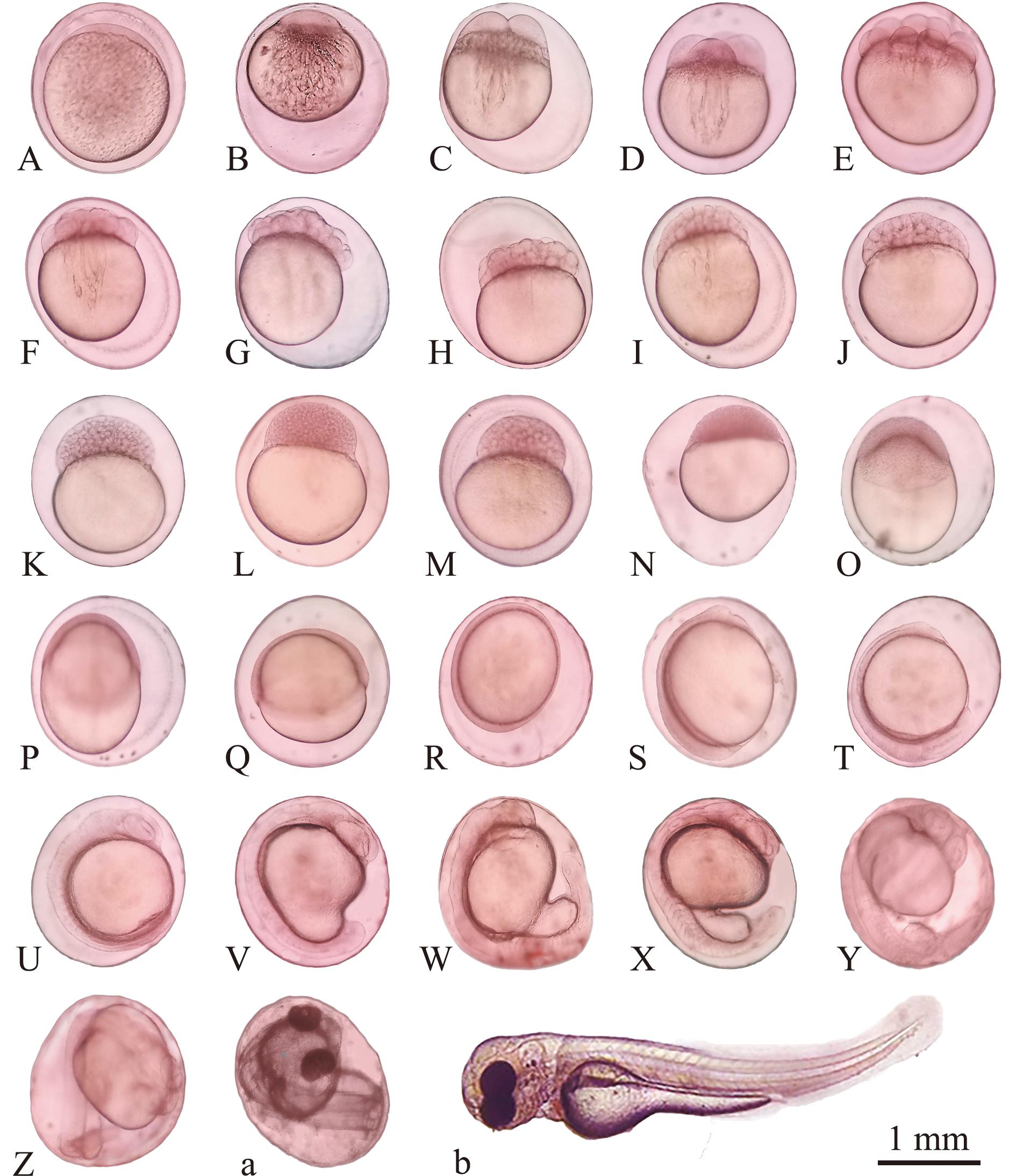
A—受精卵;B—胎盘期;C—2-细胞期;D—4-细胞期;E—8-细胞期;F—16-细胞期;G—32-细胞期;H—64-细胞期;I—128细胞期;J—多细胞器;K—桑葚期;L—囊胚早期;M—囊胚中期;N—囊胚后期;O—原肠早期;P—原肠中期;Q—原肠晚期;R—神经胚期;S—胚孔关闭期;T—肌节出现期 U—眼囊期 V—尾芽期;W—耳囊期;X—肌肉效应期;Y—晶体出现期;Z—心脏跳动期;a —眼色素形成期;b—出膜期。
A—fertilized egg;B—blastodisc stage;C—2-cell stage;D—4-cell stage;E—8-cell stage;F—16-cell stage;G—32-cell stage;H—64-cell stage;I—128-cell stage;J—multicellular stage;K—morula phase;L—early—blastula stage;M—mid—blastula stage;N—Late—blastula stage;O—early gastrula stage;P—mid—gastrula stage;Q—late gastrula stage;R—neurula stage;S—blastopore closing stage;T—appearance of myomere;U—appearance optic capsule;V—tail-bud stage;W—otocyst stage;X—muscle effect stage;Y—formation of eye lens;Z—heart—beating stage;a—eye pigment stage;b—embryo hatching stage.
图7 麦穗鱼胚胎发育图
Fig.7 Embryonic development of Pseudorasbora parva
3 讨论
3.1 麦穗鱼亲鱼成熟情况和繁殖行为观察
成熟系数能够反映鱼类性腺的成熟程度,成熟系数越高,表明性腺成熟度越好。本研究中,麦穗鱼成熟系数普遍较低,其成熟系数大于20%的比例仅占比27.54%,且其平均成熟率较低,仅为29%±1.41%,这种现象给规模化人工繁殖时挑选出合格种鱼带来了较大难度。造成这种现象的原因可能是:1)麦穗鱼属于分批产卵鱼类,在繁殖季节,亲鱼卵巢中有处于不同发育时相的卵母细胞,这些卵母细胞分批成熟,分批产出[16]。这种分批产卵的繁殖策略使麦穗鱼个体成熟时间不一致,以至于很难批量挑选出合格的种鱼进行批量繁殖。2)本试验亲鱼来源于与拉氏鱥(Phoxinus lagowskii)混养模式培育的亲鱼,没有专门针对其亲鱼培育的营养强化措施,这可能也是影响其成熟的原因。鱼类性腺在发育过程中容易受到温度、盐度、光照周期、营养因子等因素的影响[14]。为解决麦穗鱼性腺发育不同步的问题,沈蓓杰等[11]通过逐步控温(从6 ℃提高至20 ℃)、控光(12 h光照∶12 h黑暗延长至18 h光照∶6 h黑暗)的方法,促进了麦穗鱼性腺同步发育。但这种方法在池塘养殖过程中难以实行,通过探寻单池培育、最适放养密度和强化培育方法,能否提高其成熟率还有待进一步探索。
在人工繁殖行为上,笔者观察到,试验至效应期,一尾雄鱼追逐一尾雌鱼在鱼巢处往返不停游动,追逐过程中,雄鱼利用其吻部轻碰撞雌鱼的腹部;产卵时,雌鱼会快速振动其躯体的后半部分,然后通过挤压其腹部将卵成排的产于PVC管、蚌壳或池壁等较为硬质的物体上,排成一单层并紧密地黏贴在一起,每一排产卵11~15粒;雄鱼跟在雌鱼后面将其生殖孔接触到卵子表面,同时释放精液完成授精,整个过程持续2~3 h,雌鱼产完卵后,即行离去,雄鱼留在鱼巢周围进行护卵,麦穗鱼雄鱼具有护卵习性,这种现象在其他鱼类如黄颡鱼(Pelteobagrus fulvidraco)[17]、鸭绿沙塘鳢(Odontobutis yaluensis)[18]等中也存在。这种亲鱼护卵现象,能有效提高其野外条件下受精卵的生存能力。
3.2 麦穗鱼适宜催产药物及催情水温
在鱼类的人工繁殖过程中,催产药物起着至关重要的作用。确定最优的催产药物组合、适宜的注射次数、合理的注射间距及适宜的催产剂量,是实现鱼类规模化人工繁殖的关键技术[19]。张林达[13]采用单一催产药物LHRH-A2对麦穗鱼进行催产,未获得较好的催产效果;史文竞等[12]采用LHRH-A2 30 μg/kg+HCG 1 500 IU/g混合药物对麦穗鱼进行催产,获得催产率为35%的较好效果。相关研究中,鮈亚科鱼类通常采用LHRH-A2+DOM+HCG混合催产药物进行人工催产[20-21]。本研究中,采用LHRH-A2+HCG催产药物组合的催产率显著高于LHRH-A2+DOM+HCG混合催产药物组合(P<0.05),这表明马来酸地欧酮(DOM)可能不适合用来催产麦穗鱼。在二次注射方式中,第一针只注射LHRH-A2 2 μg/kg,而第一针注射LHRH-A2剂量的增减或第一针应用复合催产药物注射是否会有更好的催产效果还有待进一步研究。
水温能够对鱼类下丘脑-垂体-性腺轴的各个层面直接产生作用,是绝大多数鱼类整个生殖周期中的重要影响因素之一[22]。适宜的水温可以促使鱼类分泌激素诱导性腺发育成熟并排出卵子或精子[23]。当水温过低或过高时则会影响脑垂体的促性腺激素(GTH)分泌与合成,使性腺对GTH的敏感性下降,阻碍鱼类性腺成熟或发生卵严重过熟而难产的情况,进而使人工催产效率下降[24],因此,确定麦穗鱼人工催产时的最适水温,对于提高其人工繁殖效率至关重要。在本研究中,当采用最优催产药物剂量且水温为17 ℃时,麦穗鱼的催产率达到78.00%±3.54%。据此推测,在接近17 ℃的水温条件下,麦穗鱼对外源激素的敏感性增强,从而加快了性腺的成熟速度,进而提高了人工催产效率,使亲鱼更容易排出卵粒。
3.3 人工鱼巢接卵和孵化效果比较
有研究表明,麦穗鱼对鱼巢的选择性不强,喜将卵产在稍微平整的硬质鱼巢上[5,15]。本研究中,除棕榈树皮未见有卵附着外,其他人工鱼巢均有卵附着,说明亲鱼催产后,放置鱼巢模拟其自然繁殖环境是可行的。PVC管、蚌壳和竹竿因其接卵面积较小,部分鱼卵会产于水族箱箱壁上或掉落于箱底;筛绢布接卵率为98.00%±0.02%,接卵效果较好。此外使用不同材质的鱼巢接卵,卵的受精率无显著性差异。在试验过程中,笔者发现,筛绢布上的受精卵易剥离且剥离后不堆积,这使得麦穗鱼分批产的卵能够及时收集起来,在一定程度上减小了麦穗鱼亲鱼吃掉受精卵的可能,而且剥离后用孵化篓孵化管理简单,不易大片感染水霉,孵化率较高。PVC管、蚌壳和竹竿上的受精卵不易剥离,在使用塑料盆静水充气孵化的过程中,其因管理繁琐、受精卵密度大且容易大片感染水霉,导致孵化率降低。
3.4 麦穗鱼胚胎发育特点
麦穗鱼的卵为黏性卵,呈椭圆形,扁平,透明,淡黄色,卵裂方式为盘状卵裂。麦穗鱼胚胎发育过程历经7个阶段:即胚盘隆起期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期及出膜期,这一过程符合硬骨鱼类胚胎发育的一般规律。从表6可见:麦穗鱼胚胎发育时间较长,共历时199 h 58 min(18 ℃~21 ℃),长于同亚科的圆口铜鱼(Coreius guichenoti)48 h 50 min(19.8 ℃~20.1 ℃)[25],华鳈(Sarcocheilichthys sinensis)73 h 3 min(22.5 ℃~25.0 ℃)[28]、蛇鮈(Saurogobio dabryi)81 h(15.5 ℃~17.5 ℃)[27]和川西黑鳍鳈(Sarcocheilichthys nigripinnis)142 h 15 min(19.9 ℃~27.2 ℃)[30]、与稀有鮈鲫(Gobiocypris rarus)204 h 10 min(15 ℃)[31]、唇![]() (Hemibarbus labeo)195 h(12.5 ℃~18.5 ℃) [32]的胚胎发育时长较为接近。不同鱼类胚胎发育时间的差异是鱼类种属遗传特性之一。从表6可见,麦穗鱼从心跳期至出膜前期共经历120 h 37 min,占整个胚胎发育总时长的60.32%,高于华鳈(57.91%)和稀有鮈鲫(54.44%),远高于同亚科的圆口铜鱼(30.33%)、蛇鮈(30.25%)和银鮈(Squalidus argentatus)(20.00%)[26]。麦穗鱼从心跳期至出膜前期在胚胎发育总时长中占比较大,这种现象可能是麦穗鱼的一种胚胎适应策略,其在胚胎内发育时间较长,器官分化会更加完善,出膜后初孵仔鱼能较快适应游泳和摄食活动,增强了仔鱼破膜后对外界环境的适应能力,提高了仔鱼成活率。
(Hemibarbus labeo)195 h(12.5 ℃~18.5 ℃) [32]的胚胎发育时长较为接近。不同鱼类胚胎发育时间的差异是鱼类种属遗传特性之一。从表6可见,麦穗鱼从心跳期至出膜前期共经历120 h 37 min,占整个胚胎发育总时长的60.32%,高于华鳈(57.91%)和稀有鮈鲫(54.44%),远高于同亚科的圆口铜鱼(30.33%)、蛇鮈(30.25%)和银鮈(Squalidus argentatus)(20.00%)[26]。麦穗鱼从心跳期至出膜前期在胚胎发育总时长中占比较大,这种现象可能是麦穗鱼的一种胚胎适应策略,其在胚胎内发育时间较长,器官分化会更加完善,出膜后初孵仔鱼能较快适应游泳和摄食活动,增强了仔鱼破膜后对外界环境的适应能力,提高了仔鱼成活率。
表6 鮈亚科鱼类胚胎发育时长
Tab.6 Embryonic development duration of fish Gobioninae
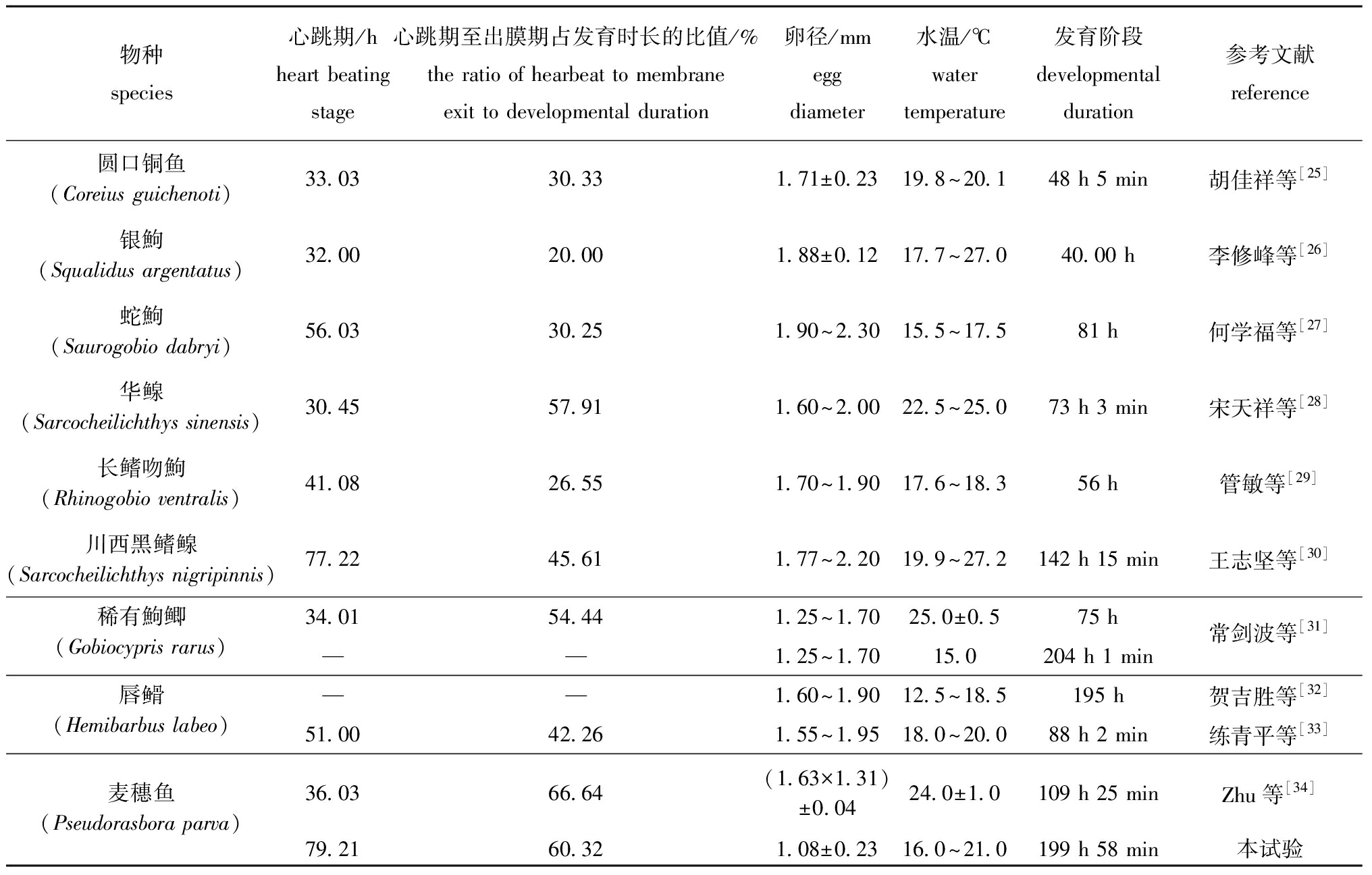
物种species心跳期/hheart beating stage心跳期至出膜期占发育时长的比值/%the ratio of hearbeat to membrane exit to developmental duration卵径/mmegg diameter水温/℃water temperature发育阶段developmental duration参考文献reference圆口铜鱼(Coreius guichenoti)33.0330.331.71±0.2319.8~20.148 h 5 min胡佳祥等[25]银鮈(Squalidus argentatus)32.0020.001.88±0.1217.7~27.040.00 h李修峰等[26]蛇鮈(Saurogobio dabryi)56.0330.251.90~2.3015.5~17.581 h何学福等[27]华鳈(Sarcocheilichthys sinensis)30.4557.911.60~2.0022.5~25.073 h 3 min宋天祥等[28]长鳍吻鮈(Rhinogobio ventralis)41.0826.551.70~1.9017.6~18.356 h管敏等[29]川西黑鳍鳈(Sarcocheilichthys nigripinnis)77.2245.611.77~2.2019.9~27.2142 h 15 min王志坚等[30]稀有鮈鲫(Gobiocypris rarus)34.0154.441.25~1.7025.0±0.575 h常剑波等[31]——1.25~1.7015.0204 h 1 min唇(Hemibarbus labeo)——1.60~1.9012.5~18.5195 h贺吉胜等[32]51.0042.261.55~1.9518.0~20.088 h 2 min练青平等[33]麦穗鱼(Pseudorasbora parva)36.0366.64(1.63×1.31)±0.0424.0±1.0109 h 25 minZhu等[34]79.2160.321.08±0.2316.0~21.0199 h 58 min本试验
鱼类胚胎的孵化出膜过程主要依靠孵化酶的作用,而温度作为影响鱼类胚胎发育的重要环境因素,可通过调节鱼类胚胎孵化酶的合成及分泌,进而影响胚胎孵化时间[35]。本研究发现,麦穗鱼受精卵在水温为17 ℃~21 ℃时,经199 h 58 min出膜,在水温为24 ℃±1 ℃时,经109 h 25 min出膜[34],这与在水温为 16.4 ℃~17.2 ℃和 17.6℃~18.3 ℃时,长鳍吻鮈(Rhinogobio ventralis)受精卵分别经72 h、56 h出膜[29];在水温为12.5 ℃~18.5 ℃和18 ℃~20 ℃时,唇![]() 受精卵分别经195 h、88 h 20 min出膜[32-33];在水温为15 ℃和25 ℃±0.5 ℃时,稀有鮈鲫受精卵分别经204 h 10 min、75 h出膜的胚胎发育现象类似[30]。由此可见,在一定温度范围内,鱼类胚胎的孵化时间与温度呈负相关关系,即当水温升高时,胚胎发育时间缩短,发育速度加快;当温度降低时,胚胎发育时间延长,发育延缓或滞育。
受精卵分别经195 h、88 h 20 min出膜[32-33];在水温为15 ℃和25 ℃±0.5 ℃时,稀有鮈鲫受精卵分别经204 h 10 min、75 h出膜的胚胎发育现象类似[30]。由此可见,在一定温度范围内,鱼类胚胎的孵化时间与温度呈负相关关系,即当水温升高时,胚胎发育时间缩短,发育速度加快;当温度降低时,胚胎发育时间延长,发育延缓或滞育。
4 结论
1) 辽阳地区麦穗鱼繁殖最适水温为17 ℃,最适人工催产药物和剂量组合为LHRH-A2 8 μg/kg+HCG 2 000 IU/kg,最适催产方法为二次注射,且针距为8 h。
2) 在水温为18 ℃~21 ℃条件下,相对于一般鲤科鱼类胚胎发育,麦穗鱼胚胎期较长,约199 h 58 min。麦穗鱼从心跳期至出膜前期共经历120 h 37 min,占整个胚胎发育总时长的60.32%。
3) 麦穗鱼亲鱼成熟率较低,制约了其规模化人工繁殖效果,如何提高亲鱼成熟率将是未来麦穗鱼规模化繁殖急需解决的问题。
[1] 解玉浩.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:160-162. XIE Y H.Freswater fishes in northeast region of China[M].Shenyang:Liaoning Science and Technology Press,2007:160-162.(in Chinese)
[2] 杨坤,祝东梅,王卫民.麦穗鱼鳍条组织培养及染色体Ag-NORs和C-带研究[J].南方水产科学,2013,9(3):20-25. YANG K,ZHU D M,WANG W M.Studies on fin tissues cultivation,Ag-NORs and C-banding patterns of Pseudorasbora parva[J].South China Fisheries Science,2013,9(3):20-25.(in Chinese)
[3] 杨坤,王子健,祝东梅,等.麦穗鱼的组型分析和DNA含量测定[J].华中农业大学学报,2012,31(3):371-375. YANG K,WANG Z J,ZHU D M,et al.Karyotypic analysis and cellular DNA contents of Pseudorasbora parva[J].Journal of Huazhong Agricultural University,2012,31(3):371-375.(in Chinese)
[4] ZHU D M,YANG K,GUL Y,et al.Effect of photoperiod on growth and gonadal development of juvenile Topmouth Gudgeon Pseudorasbora parva[J].Environmental Biology of Fishes,2014,97(2):147-156.
[5] 秦玉丽,李林春,黄荣静.麦穗鱼的生物学特性及养殖技术[J].江苏农业科学,2005,33(3):114-116. QIN Y L,LI L C,HUANG R J.Biological characteristics and culture techniques of Pseudorasbora parva [J].Jiangsu Agricultural Sciences,2005,33(3):114-116.(in Chinese)
[6] KOGA K,GOTO A.Genetic structures of allopatric and sympatric populations in Pseudorasbora pumila pumila and Pseudorasbora parva[J].Ichthyological Research,2005,52(3):243-250.
[7] 王艳,斯晓琴,殷红梅,等.不同剂型氯虫苯甲酰胺对麦穗鱼的急性毒性试验[J].水产养殖,2024,45(5):31-34. WANG Y,SI X Q,YIN H M,et al.Acute toxicity test of different dosage forms of chlorantraniliprole to Pseudorasbora parva[J].Journal of Aquaculture,2024,45(5):31-34.(in Chinese)
[8] 张海艳,骆美蓉,李霞.2种常用药物对麦穗鱼的急性毒性和SDS对麦穗鱼的遗传毒性[J].贵州农业科学,2012,40(7):154-157. ZHANG H Y,LUO M R,LI X.Theacute toxicity of two drugs to Pseudorasbora parva and the genetic toxicities of SDS[J].Guizhou Agricultural Sciences,2012,40(7):154-157.(in Chinese)
[9] 章星明,周洵.麦穗鱼、幼蟹、泥鳅生态养殖技术研究[J].中国水产,2016(4):76-77. ZHANG X M,ZHOU X.Research on ecological breeding technology of Pseudorasbora parva,Eriocheir sinensis Milne-Edwards and Misgurnus anguillicaudatus[J].China Fisheries,2016(4):76-77.(in Chinese)
[10] 章星明,周慧芳,周洵.河蟹、青虾、麦穗鱼生态养殖技术研究[J].中国水产,2016(5):72-73. ZHANG X M,ZHOU H F,ZHOU X.Study on ecological culture technology of Eriocheir sinensis Milne-Edwards,Macrobrachium nipponense and Pseudorasbora parva[J].China Fisheries,2016(5):72-73.(in Chinese)
[11] 沈蓓杰,王贵元,柴继芳,等.麦穗鱼人工繁殖和苗种培育技术研究(上)[J].科学养鱼,2014(10):6-8. SHEN B J,WANG G Y,CHAI J F,et al.Study on artificial propagation and fry cultivation technology of Pseudorasbora parva(Ⅰ)[J].Scientific Fish Farming,2014(10):6-8.(in Chinese)
[12] 史文竞,王怡,曾妮,等.麦穗鱼人工繁育技术[J].科学养鱼,2024(7):17-18. SHI W J,WANG Y,ZENG N,et al.Artificial breeding technology of Pseudorasbora parva [J].Scientific Fish Farming,2024(7):17-18.(in Chinese)
[13] 张林达.麦穗鱼繁殖生物学研究及其应用潜力评价[D].贵阳:贵州大学,2009. ZHANG L D.Study on reproductive biology and evaluation of its application potential of Pseudorasbora parva[D].Guiyang:Guizhou University,2009.(in Chinese)
[14] 骆小年.鱼类人工繁育[M].北京:科学出版社,2023:148-149. LUO X N.Artificial propagation and breeding of fish[M].Beijing:Science Press,2023:148-149.(in Chinese)
[15] 江河,王贵元,陈冬林,等.麦穗鱼人工繁殖和苗种培育技术研究(下)[J].科学养鱼,2014(11):10-11. JIANG H,WANG G Y,CHEN D L,et al.Study on artificial propagation and fry cultivation technology of Pseudorasbora parva (Ⅱ)[J].Scientific Fish Farming,2014(11):10-11.(in Chinese)
[16] 龚启祥,宋越舜,毛羽.麦穗鱼卵母细胞发生及其产卵类型的研究[J].浙江水产学院学报,1983,2(2):95-103,4. GONG Q X,SONG Y S,MAO Y.Studies on the development of oocytes and the type of spawning of Pseudorasbora parva[J].Journal of Zhejiang College of Fisheries,1983,2(2):95-103,4.(in Chinese)
[17] 骆小年,徐忠源.人工条件下黄颡鱼繁殖行为的初步观察[J].中国水产,2004(1):46-57. LUO X N,XU Z Y.Preliminary observation on reproductive behavior of Pelteobagrus fulvidraco under artificial conditions[J].China Fisheries,2004(1):46-57.(in Chinese)
[18] 王吉桥,史建国,姜玉声,等.鸭绿沙塘鳢繁殖习性的观察及性腺发育周期的组织学研究[J].水产科学,2008,27(8):379-385. WANG J Q,SHI J G,JIANG Y S,et al.Observation of the reproductive habits and histological gonad development cycle of dark sleeper(Odontobutis yaluensis)[J].Fisheries Science,2008,27(8):379-385.(in Chinese)
[19] 骆小年,赵兴文,段友健.中国主要养殖经济鱼类人工催产药物使用进展[J].大连海洋大学学报,2020,35(1):10-18. LUO X N,ZHAO X W,DUAN Y J.Application of artificial hormones in induction to spawn in economically important main fishes in China:a review[J].Journal of Dalian Ocean University,2020,35(1):10-18.(in Chinese)
[20] 张海龙,樊启学,张云龙,等.蛇鮈人工繁殖试验及其仔鱼异速生长模式的研究[J].淡水渔业,2018,48(2):73-79. ZHANG H L,FAN Q X,ZHANG Y L,et al.Researches on artificial propagation breeding and allometric pattern in Saurogobio dabryi Bleeker[J].Freshwater Fisheries,2018,48(2):73-79.(in Chinese)
[21] 徐伟,李池陶,耿龙武,等.乌苏里江唇![]() 的全人工繁育[J].中国水产科学,2009,16(4):550-556. XU W,LI C T,GENG L W,et al.Growth and reproduction of reared Hemibarbus labeo in the Wusuli River[J].Journal of Fishery Sciences of China,2009,16(4):550-556.(in Chinese)
的全人工繁育[J].中国水产科学,2009,16(4):550-556. XU W,LI C T,GENG L W,et al.Growth and reproduction of reared Hemibarbus labeo in the Wusuli River[J].Journal of Fishery Sciences of China,2009,16(4):550-556.(in Chinese)
[22] LAM T J.Environmental influences on gonadal activity in fish[C].//HOAR W S,RANDALL D J,DONALDSON E M.Fish Physiology,Part B Reproduction-Behavior and Fertility Control.New York:Academic Press,1983:65-116.
[23] 温海深,林浩然.环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J].应用生态学报,2001,12(1):151-155. WEN H S,LIN H R.Effect of environmental factors on gonadal maturation as well as its ovulation and spawning in teleosts[J].Chinese Journal of Applied Ecology,2001,12(1):151-155.(in Chinese)
[24] 刘焕亮,黄樟翰.中国水产养殖学[M].北京:科学出版社,2008:367-383. LIU H L,HUANG Z H.Aquaculture in China[M].Beijing:Science Press,2008:367-383.(in Chinese)
[25] 胡佳祥,张植元,王雄延,等.长江上游圆口铜鱼人工繁殖和胚胎发育研究[J].安徽农学通报,2021,27(6):75-80. HU J X,ZHANG Z Y,WANG X Y,et al.Study on the artificial propagation andembryonic development of Coreius guichenoti in the Upper Yangtze River[J].Anhui Agricultural Science Bulletin,2021,27(6):75-80.(in Chinese)
[26] 李修峰,黄道明,谢文星,等.汉江中游银鮈的胚胎发育[J].大连水产学院学报,2005,20(3):181-185. LI X F,HUANG D M,XIE W X,et al.The embryonic development of Squalidus argentatus in the middle reaches of Hanjiang River[J].Journal of Dalian Fisheries University,2005,20(3):181-185.(in Chinese)
[27] 何学福,宋昭彬,谢恩义.蛇鮈的产卵习性及胚胎发育[J].西南师范大学学报(自然科学版),1996,21(3):276-281. HE X F,SONG Z B,XIE E Y.The breeding habits and embryonic development of longnose gudgeon (Saurogobio dabryi Bleeker)[J].Journal of Southwest China Normal University (Natural Science Edition),1996,21(3):276-281.(in Chinese)
[28] 宋天祥,马骏.华鳈人工繁殖和早期发育的研究[J].湖泊科学,1996,8(3):260-267. SONG T X,MA J.Artificial propagation and early development of Sarcocheilichthys sinensis[J].Journal of Lake Science,1996,8(3):260-267.(in Chinese)
[29] 管敏,肖衎,胡美宏,等.长鳍吻鮈(Rhinogobio ventralis)胚胎发育和仔鱼发育[J].渔业科学进展,2015,36(4):57-64. GUAN M,XIAO K,HU M H,et al.Study on theembryonic and early larval development of Rhinogobio ventralis[J].Progress in Fishery Sciences,2015,36(4):57-64.(in Chinese)
[30] 王志坚,张耀光,廖承红.涪江下游川西黑鳍鱼泉胚胎和幼鱼发育研究[J].西南师范大学学报(自然科学版),2000,25(5):590-595. WANG Z J,ZHANG Y G,LIAO C H.Embryonic and larval development of Sarcocheilichthys nigriopinnis davidi (Sauvage) in lower reaches of Fujiang River[J].Journal of Southwest China Normal University (Natural Science Edition),2000,25(5):590-595.(in Chinese)
[31] 常剑波,王剑伟,曹文宣.稀有鮈鲫胚胎发育研究[J].水生生物学报,1995,19(2):97-103. CHANG J B,WANG J W,CAO W X.The embryonic development of Gobiocpris rarus[J].Acta Hydrobiologica Sinica,1995,19(2):97-103.(in Chinese)
[32] 贺吉胜,何学福,严太明.涪江下游唇![]() 胚胎发育研究[J].西南师范大学学报(自然科学版),1999,24(2):225-226. HE J S,HE X F,YAN T M.Observations on the embryonic development of Hemibarbus labeo(Pallas) in lower reaches of FuJiang River[J].Journal of Southwest China Normal University (Natural Science Edition),1999,24(2):225-226.(in Chinese)
胚胎发育研究[J].西南师范大学学报(自然科学版),1999,24(2):225-226. HE J S,HE X F,YAN T M.Observations on the embryonic development of Hemibarbus labeo(Pallas) in lower reaches of FuJiang River[J].Journal of Southwest China Normal University (Natural Science Edition),1999,24(2):225-226.(in Chinese)
[33] 练青平,宓国强,姚子亮,等.瓯江唇![]() 全人工繁殖与胚胎发育研究[J].江西农业大学学报,2014,36(1):181-186. LIAN Q P,MI G Q,YAO Z L,et al.A study on artificial propagation and embryonic development of Hemibarbus labeo in Oujiang River[J].Acta Agriculturae Universitatis Jiangxiensis,2014,36(1):181-186.(in Chinese)
全人工繁殖与胚胎发育研究[J].江西农业大学学报,2014,36(1):181-186. LIAN Q P,MI G Q,YAO Z L,et al.A study on artificial propagation and embryonic development of Hemibarbus labeo in Oujiang River[J].Acta Agriculturae Universitatis Jiangxiensis,2014,36(1):181-186.(in Chinese)
[34] ZHU D M,YANG K,SUN N,et al.Embryonic and larval development of the topmouth gudgeon,Pseudorasbora parva (Teleostei:Cyprinidae)[J].Zoologia,2018,35:1-8.
[35] 樊廷俊,史振平.鱼类孵化酶的研究进展及其应用前景[J].海洋湖沼通报,2002,24(1):48-56. FAN T J,SHI Z P.Advances and prospect in fish hatching enzyme research[J].Transaction of Oceanology and Limnology,2002,24(1):48-56.(in Chinese)