刺参(Apostichopus japonicus)是中国北方沿海主要海水养殖品种之一,其体内富含多糖、多肽、皂苷等活性物质,是极具营养价值的水产经济品种[1]。近年来,随着市场对刺参需求的不断攀升,刺参的养殖面积和产量呈现逐年递增的趋势[2]。随之而来的是刺参优质饵料的短缺。据统计,2019—2023年,马尾藻(Sargassum)的进口数量从2.14万t增加至4.74万t,进口金额从555万美元提升至1 312万美元,这极大地限制了刺参养殖业的发展(海关总署,2024)。大型藻类及其副产物替代马尾藻成为研究热点。然而,大多数替代后的配合饲料都存在营养单一、氨基酸失衡、适口性差和具有抗营养因子等缺点,使得替代效果一直不佳[3]。
微生物发酵饲料技术是2006年欧盟全面禁止在畜禽饲料中添加抗生素后发展起来的一项新技术,饲料经乳酸菌、酵母菌、芽孢杆菌等有益菌的发酵,不仅可以提高饲料的适口性和消化率,还可以提高饲料的营养价值[4]。刺参配合饲料中含有大量的粗纤维和蛋白质,经发酵后可以将大分子物质分解为小分子物质,如氨基酸、小分子肽和还原糖等,使饲料更易被机体消化吸收[5]。碳源在发酵过程中起着至关重要的作用,它不仅为微生物的生长和繁殖提供了能量和碳成分,还影响代谢产物的合成和发酵速率的提高[6]。不同有机碳源因其所具有的能量及代谢途径不同,对发酵速率和产物的影响也存在差异。Wang等[7]以糖蜜或葡萄糖作为碳源,经过14 d的固态发酵后,玉米秸秆和稻草的营养价值提升最为显著。杨秋月等[8]在发酵培养基中分别添加2%的葡萄糖、红糖、麸皮、可溶性淀粉、蔗糖为碳源,发现以葡萄糖为碳源时酸溶性蛋白含量显著高于其他组。宋立立等[9]通过单因素试验对枯草芽孢杆菌产中性蛋白酶的发酵条件进行优化,证明麦芽糖是最佳碳源。本试验中首先在刺参配合饲料发酵过程中添加5种不同的碳源,并以酸溶蛋白含量和还原糖含量为评价指标,筛选最优发酵效果的碳源;然后以不同比例的发酵饲料替代基础饲料,研究发酵饲料对刺参生长性能、消化及非特异性免疫能力的影响,以期为发酵饲料的进一步推广提供数据支持。
1 材料与方法
1.1 材料
以白鱼粉、海带渣和豆粕为主要蛋白源,以鱼油为脂肪源,设计粗蛋白质含量为18.05%、粗脂肪含量为0.93%的基础饲料,配方及营养组成见表1。以上述基础饲料为发酵底物,以枯草芽孢杆菌为发酵菌种,以葡萄糖、蔗糖、麦芽糖、可溶性淀粉和低聚果糖为发酵碳源。其中,菌种接种量为3%、料液比为1.0 g/mL∶0.3 g/mL、碳源添加量为2%,在发酵袋中35 ℃下发酵5 d。发酵过程中每天观察室温、料层温度、感官等指标,并对发酵饲料进行翻动,每天采样检测饲料酸溶蛋白和还原糖含量。试验所用枯草芽孢杆菌(200亿CFU/g)购自北京百欧博伟生物技术有限公司。试验用低聚果糖(纯度≥90%)、葡萄糖(纯度≥99%)、蔗糖(纯度≥99%)、麦芽糖(纯度≥95%)和可溶性淀粉(试剂级)购于上海麦克林生化科技有限公司。
表1 基础饲料配方及营养组成(风干物质)
Tab.1 Proximate composition and ingredients of the basic diets (air dried matter)
%
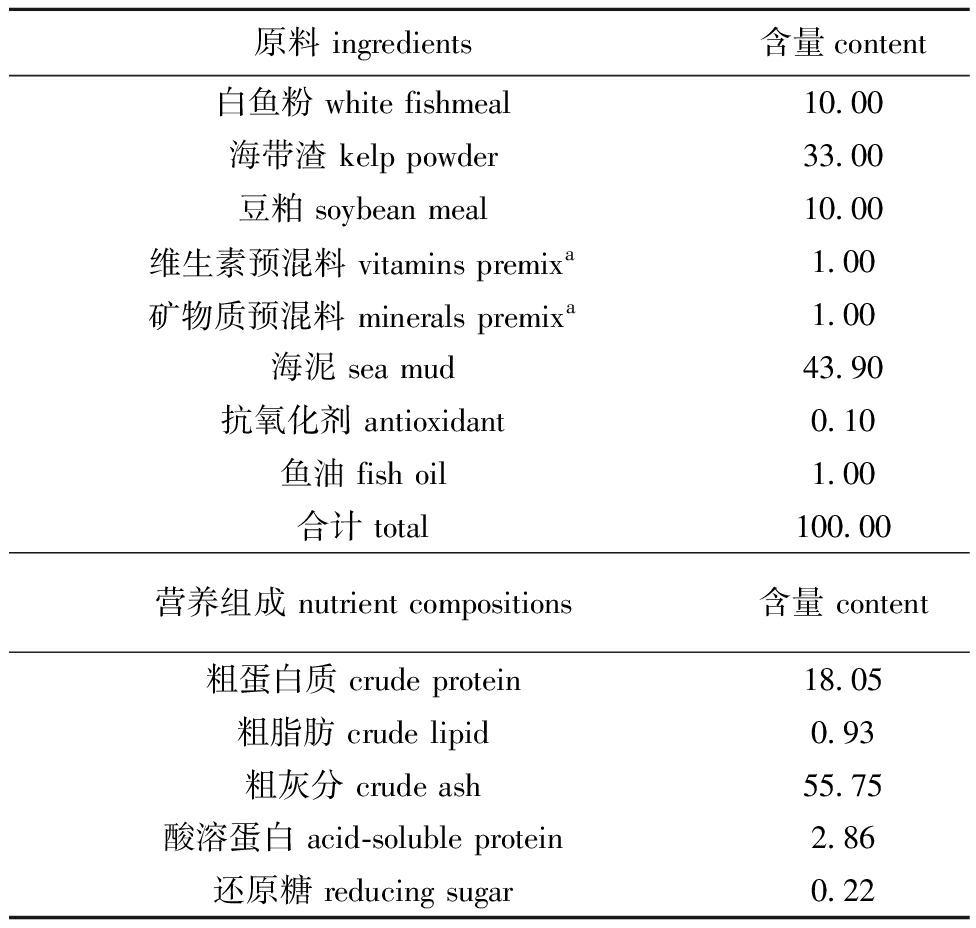
原料 ingredients含量content白鱼粉 white fishmeal10.00海带渣 kelp powder33.00豆粕 soybean meal10.00维生素预混料 vitamins premixa1.00矿物质预混料 minerals premixa1.00海泥 sea mud43.90抗氧化剂 antioxidant0.10鱼油 fish oil1.00合计 total100.00营养组成 nutrient compositions含量 content粗蛋白质 crude protein18.05粗脂肪 crude lipid0.93粗灰分 crude ash55.75酸溶蛋白 acid-soluble protein2.86还原糖 reducing sugar0.22
注:a表示多维多矿配方[10]。
Note:a means a multi-dimensional and multi-mineral formula[10].
在基础饲料中分别添加0、5%、10%、20%、30%、40%的发酵饲料配制成6组试验饲料,分别命名为D1(对照组)、D2、D3、D4、D5和D6组。试验所用固体原料经超微粉碎后过75 μm标准筛,加入鱼油及适量蒸馏水,充分混匀,制成直径为7 mm长条状饲料,60 ℃烘干后破碎成直径为0.5 mm的小颗粒,密封保存备用。
1.2 方法
1.2.1 饲养管理 养殖试验在山东省海洋资源与环境研究院东营试验基地循环水养殖系统中进行,试验时间为2023年11月15日—2024年1月8日,共计55 d。试验用刺参购自山东安源种业科技有限公司。正式试验前,用基础饲料驯养刺参1周,使其适应试验环境。试验开始前所有刺参禁食24 h,体质量为(27.03±0.12)g的刺参360头被随机分配到18个圆柱形循环水养殖桶(直径×高为65 cm×60 cm)中。试验分为6组,每组设置3个重复,每个重复设置20头刺参,每桶放2个刺参养殖筐。养殖期间,每天16:00饱食投喂1次,初始投喂量为刺参体质量的3%,根据每日刺参的摄食情况调整次日投喂量。每2天换1次水,换水量为水体的1/2。养殖期间,水温控制在16 ℃~19 ℃,溶解氧含量不低于6 mg/L,pH为7.4~8.2,室内保持弱光环境。
1.2.2 样品采集 试验结束后,禁食48 h,分别对每桶刺参称总重并记录刺参数量。取样时,从每桶随机选取8头刺参,逐一称重后进行解剖,分离肠道和体壁并称重,计算肠壁比和肠体壁。将体壁和肠道于-20 ℃下保存,分别用于体成分和肠道酶活性的测定。
切取刺参中前肠部位(位置相同)0.4 cm,放在Bouin’s液中1 d,再放入70%乙醇中长期保存。
1.2.3 指标测定
成活率(survival rate,SR,%)为
RSR=Nt/N0×100%。
(1)
增重率(weight gain rate,WG,%)为
RWG=(Wt-W0)/W0×100%。
(2)
特定生长率(specific growth rate,SGR,%/d)为
RSGR=(lnWt-lnW0)/t×100%。
(3)
肠壁比(ratio of intestine weight to body wall weight,IBR,%)为
RIBR=Wi/Ww×100%。
(4)
式中:Nt为终末头数(ind.);N0为初始头数(ind.);Wt为终末体质量(final body weight,FBW)(g);W0为初始体质量(initial body weight,IBW)(g);t为养殖试验天数(d);Wi为取样肠道质量(g);Ww为取样体壁质量(g)。
采用105 ℃恒重法测定(GB/T 6435—2014)试验饲料及刺参体壁水分含量,采用凯氏定氮法测定(GB/T 6432—2018)粗蛋白质含量,采用索氏抽提法测定(GB/T 6433—2006)粗脂肪含量,采用550 ℃灼烧法测定(GB/T6438—2007)粗灰分含量,采用3,5-二硝基水杨酸(DNS)法测定还原糖含量[11],采用QB/T 2653—2004标准测定酸溶蛋白含量,采用梅特勒托利多台式pH计检测pH值。
采用南京建成试剂盒测定肠道中蛋白酶、消化酶及非特异性免疫酶活性,酶活单位及具体操作步骤参考试剂盒说明书。
肠道切片通过脱水、透明、透蜡和包埋处理后,切为10 μm厚的切片,再通过苏木精-伊红染色和中性树脂封片。每个样品选取10个非连续的切片,在40×物镜下观察,采用Leica DM500图像采集系统测量皱襞数量(number of fold,nF)及皱襞高度(height of fold,hF)。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件对试验数据进行正态检验和方差齐性检验,数据具有齐性后再进行单因素方差分析(one-way ANOVA),采用Duncan’s多重比较分析不同处理组间的差异显著性,显著性水平设为0.05。
2 结果与分析
2.1 不同碳源对发酵饲料营养成分的影响
从表2可见,随着发酵天数的增加,发酵饲料中酸溶蛋白和还原糖含量均先升高后降低,在第4 天达最大值,其中,酸溶蛋白含量从2.86%提高到11.88%,还原糖含量从0.22%提升至2.13%。
表2 枯草芽孢杆菌对发酵饲料营养成分的影响
Tab.2 Effects of Bacillus subtilis on nutrient composition of fermented feed %

营养成分nutrient composition发酵时间 fermentation time未发酵1 d2 d3 d4 d5 d酸溶蛋白 acid soluble protein2.86±0.18a8.29±0.12b9.05±0.21c10.48±0.44d11.88±0.12e11.63±0.17e还原糖 reducing sugar0.22±0.05a0.36±0.12a1.23±0.17b1.75±0.18c2.13±0.11d1.82±0.09c
注:粗蛋白质、酸溶蛋白和还原糖含量为干基含量,同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters in the same line are significantly different among the groups at the 0.05 probability level,and the means with the same letter within the same line are not significant differences,et sequentia.
从表3可见,发酵后1、3、4 d,低聚果糖组酸溶蛋白显著高于其他各组(P<0.05),发酵后2 d和4 d,可溶性淀粉组酸溶蛋白显著低于其他各组(P<0.05)。与未添加碳源相比,各试验组酸溶蛋白含量均有提升。随着发酵天数的增加,低聚果糖组酸溶蛋白含量先升高后降低,在发酵第3 天达到最大值13.46%。
表3 不同碳源对发酵饲料酸溶蛋白含量的影响
Tab.3 Effects of different carbon sources on acid-soluble protein content in fermented feed %
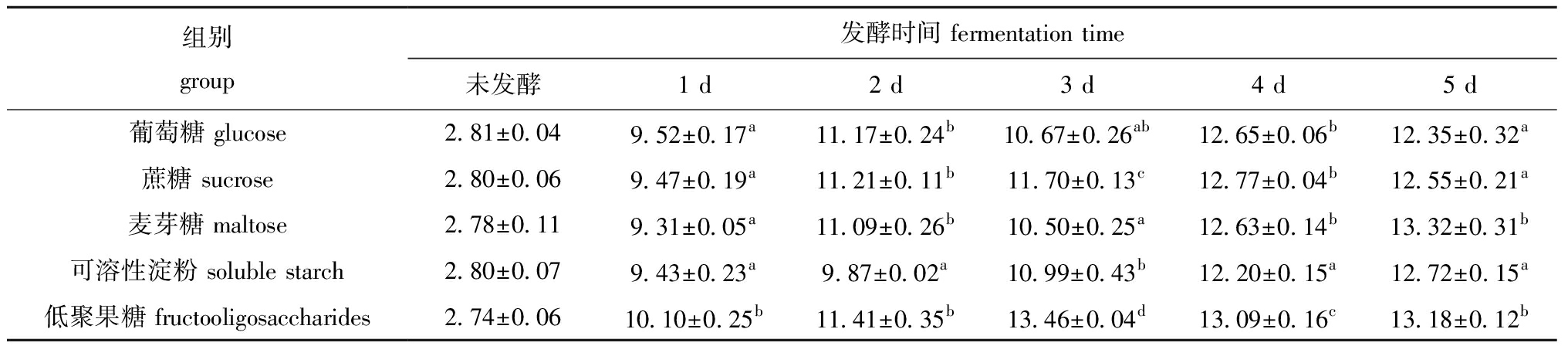
组别group发酵时间 fermentation time未发酵1 d2 d3 d4 d5 d葡萄糖 glucose2.81±0.049.52±0.17a11.17±0.24b10.67±0.26ab12.65±0.06b12.35±0.32a蔗糖 sucrose 2.80±0.069.47±0.19a11.21±0.11b11.70±0.13c12.77±0.04b12.55±0.21a麦芽糖 maltose2.78±0.119.31±0.05a11.09±0.26b10.50±0.25a12.63±0.14b13.32±0.31b可溶性淀粉 soluble starch2.80±0.079.43±0.23a9.87±0.02a10.99±0.43b12.20±0.15a12.72±0.15a低聚果糖 fructooligosaccharides2.74±0.0610.10±0.25b11.41±0.35b13.46±0.04d13.09±0.16c13.18±0.12b
从表4可见,随着发酵天数的增加,葡萄糖组和麦芽糖组还原糖含量先降低后升高再降低,且分别在第2 天和第4 天达到最大值。除第5 天外,可溶性淀粉组还原糖含量均显著低于其他各组(P<0.05)。低聚果糖组还原糖含量先升高后降低,在发酵第3 天达到最大值3.15%。
表4 不同碳源对发酵饲料还原糖含量的影响
Tab.4 Effects of different carbon sources on reducing suger content in fermented feed %
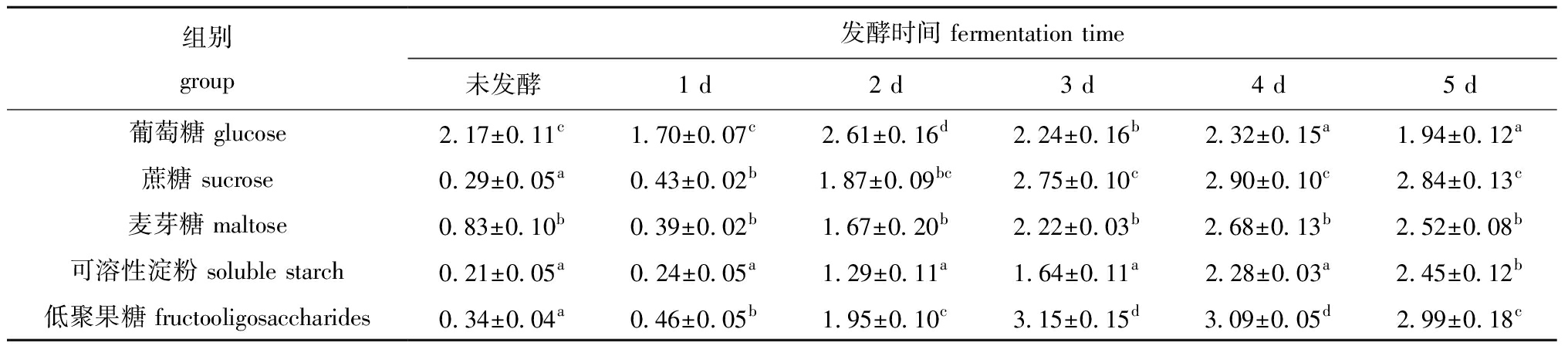
组别group发酵时间 fermentation time未发酵1 d2 d3 d4 d5 d葡萄糖 glucose2.17±0.11c1.70±0.07c2.61±0.16d2.24±0.16b2.32±0.15a1.94±0.12a蔗糖 sucrose0.29±0.05a0.43±0.02b1.87±0.09bc2.75±0.10c2.90±0.10c2.84±0.13c麦芽糖 maltose0.83±0.10b0.39±0.02b1.67±0.20b2.22±0.03b2.68±0.13b2.52±0.08b可溶性淀粉 soluble starch0.21±0.05a0.24±0.05a1.29±0.11a1.64±0.11a2.28±0.03a2.45±0.12b低聚果糖 fructooligosaccharides0.34±0.04a0.46±0.05b1.95±0.10c3.15±0.15d3.09±0.05d2.99±0.18c
2.2 发酵饲料对刺参生长性能的影响
从表5可见,各组刺参存活率无显著性差异(P>0.05)。随着发酵饲料替代比例的升高,刺参的增重率(WG)和特定生长率(SGR)均先升高后降低,WG在D4组出现最大值为78.93%,对照组WG和SGR显著低于其他各组(P<0.05)。D5组刺参肠壁比显著高于D1组(P<0.05)。
表5 发酵饲料对刺参生长性能及形体指标的影响
Tab.5 Effects of dietary fermented feed on the growth performance and body index of sea cucumber Apostichopus japonicus
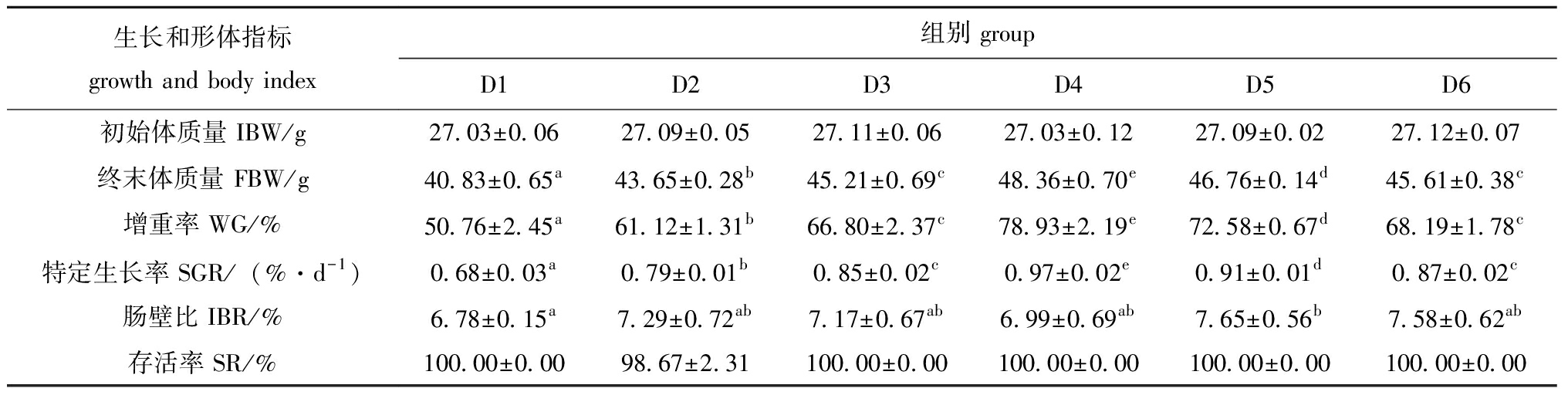
生长和形体指标growth and body index组别 groupD1D2D3D4D5D6初始体质量 IBW/g27.03±0.0627.09±0.0527.11±0.0627.03±0.1227.09±0.0227.12±0.07终末体质量 FBW/g40.83±0.65a43.65±0.28b45.21±0.69c48.36±0.70e46.76±0.14d45.61±0.38c增重率 WG/%50.76±2.45a61.12±1.31b66.80±2.37c78.93±2.19e72.58±0.67d68.19±1.78c特定生长率 SGR/(%·d-1)0.68±0.03a0.79±0.01b0.85±0.02c0.97±0.02e0.91±0.01d0.87±0.02c肠壁比 IBR/%6.78±0.15a7.29±0.72ab7.17±0.67ab6.99±0.69ab7.65±0.56b7.58±0.62ab存活率 SR/%100.00±0.0098.67±2.31100.00±0.00100.00±0.00100.00±0.00100.00±0.00
以WG为评价指标,经一元二次回归分析得出,初始体质量为(27.03±0.12)g的刺参饲料中发酵饲料的最适替代比例为24.69%(图1)。
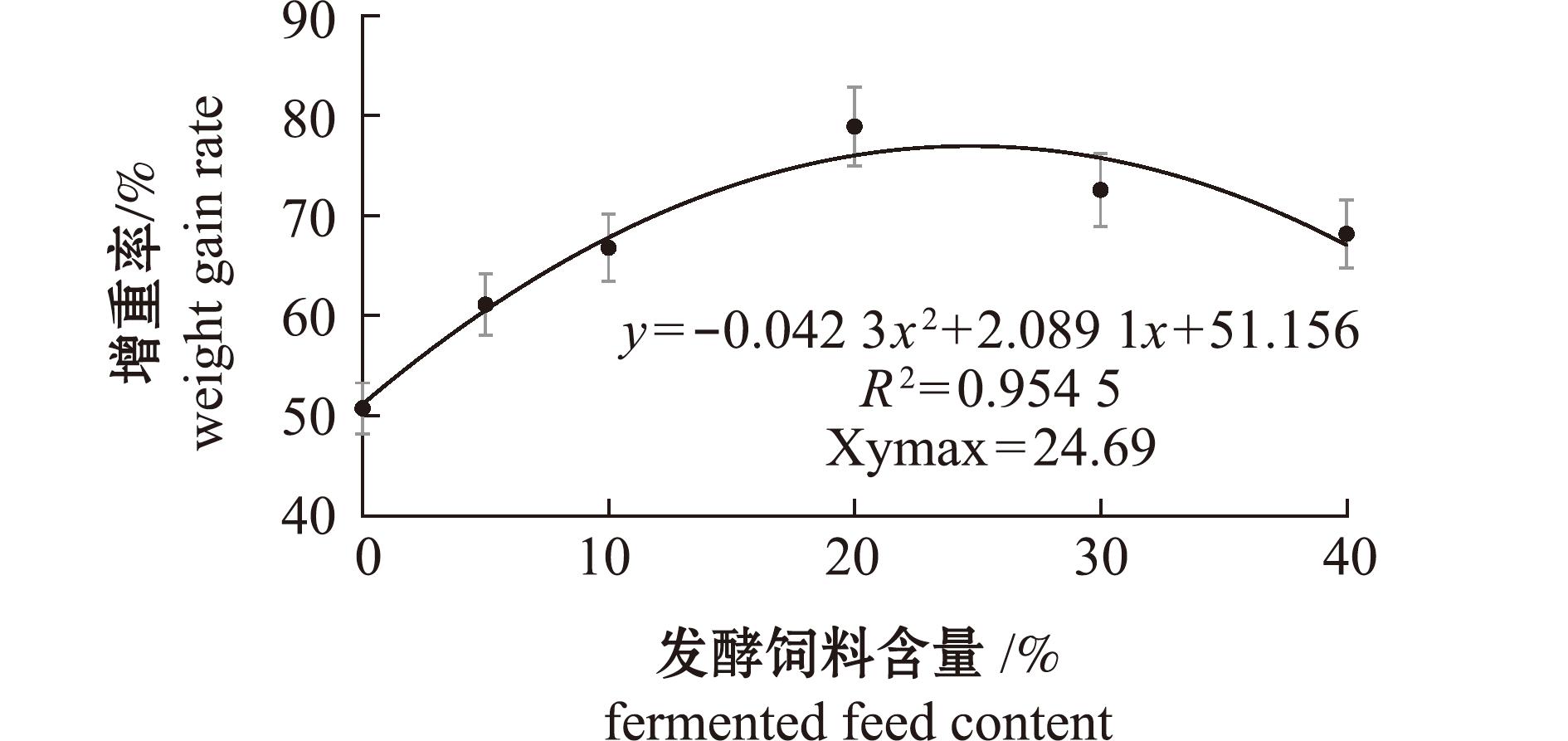
图1 刺参增重率与发酵饲料替代比例的回归分析
Fig.1 Regression analysis between fermentation feed substitution ratio and weight gain rate (WG) of sea cucumber Apostichopus japonicus
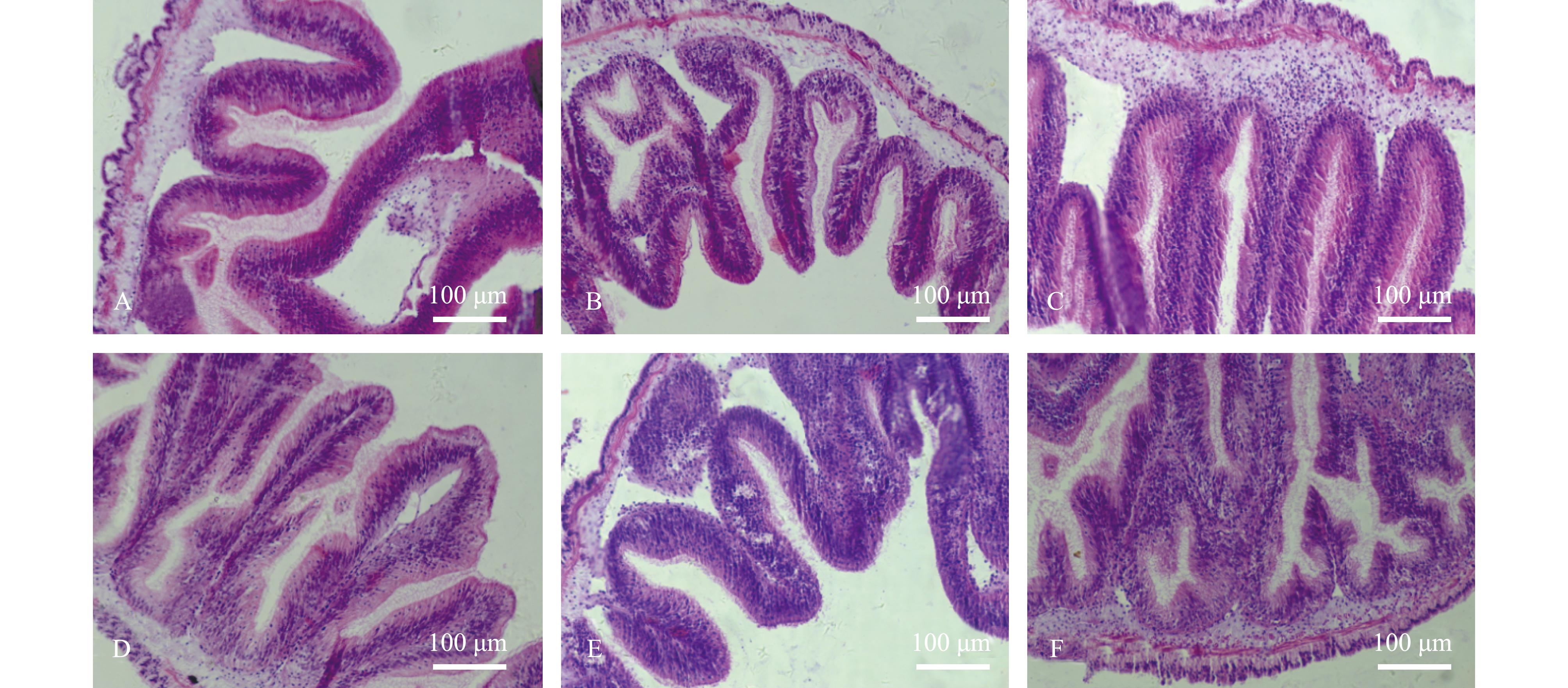
A~F—分别表示刺参肠道在0、5%、10%、20%、30%和40%发酵饲料影响下的组织形态。hF—皱襞高度;nF—皱襞数量。
A-F—Show the intestinal morphology of Apostichopus japonicus under the influence of 0,5%,10%,20%,30% and 40% fermented feed,respectively.hF—height of fold;nF—number of fold.
图2 发酵饲料对刺参肠道组织形态的影响(×40)
Fig.2 Effects offermented feed on intestinal morphology of sea cucumber Apostichopus japonicus(×40)
2.3 发酵饲料对刺参体壁基本营养成分的影响
从表6可见,各组刺参体壁水分、粗蛋白质、粗脂肪和粗灰分含量均无显著性差异(P>0.05)。
表6 发酵饲料对刺参体壁基本成分的影响
Tab.6 Effects of dietary fermented feed on approximate composition of body wall of sea cucumber Apostichopus japonicus
g
体壁成分body composition组别 groupD1D2D3D4D5D6水分 moisture90.92±0.1390.52±0.2890.80±0.1390.60±0.1990.83±0.6190.56±0.33粗蛋白质 crude protein49.24±1.2749.69±0.7149.48±0.8448.63±0.6348.22±0.6248.65±1.85粗脂肪 crude lipid3.37±0.153.36±0.193.27±0.083.28±0.233.24±0.083.38±0.21粗灰分 crude ash31.53±1.6130.49±0.5432.78±1.7931.91±0.7032.32±2.2031.65±1.87
2.4 发酵饲料对刺参肠道消化生理的影响
从表7可见,刺参肠道蛋白酶和淀粉酶活性分别在D5组和D4组出现最大值,D3~D5组蛋白酶和D2~D5组淀粉酶活性显著高于其他各组(P<0.05)。D4~D6组纤维素酶活性无显著性差异(P>0.05),显著高于其他各组(P<0.05)。
表7 发酵饲料对刺参肠道消化酶活性的影响
Tab.7 Effects of dietary fermented feed on the digestive enzyme activity of sea cucumber Apostichopus japonicus U/mg·prot

肠道消化酶inteintestinal digestive enzyme组别 groupD1D2D3D4D5D6蛋白酶 protease1 344.94±54.32a1 483.16±187.04ab1 714.32±127.96bc1 708.60±170.47bc1 812.82±167.02c1 529.58±120.30ab纤维素酶 cellulase1.53±0.16a2.15±0.07b1.90±0.03b2.74±0.22c2.88±0.14c2.99±0.13c淀粉酶 amylase0.22±0.02a0.28±0.01b0.27±0.01b0.30±0.02b0.28±0.03b0.24±0.01a
从表8可见,刺参肠道的皱襞高度和数量随发酵饲料替代比例的升高呈先上升后下降的趋势,皱襞高度在D4组出现最大值,其中,D3组和D4组显著高于其他组(P<0.05)。皱襞数量在D5组出现最大值,D6组皱襞数量显著低于其他各组(P<0.05)。
表8 发酵饲料对刺参肠道结构的影响
Tab.8 Effects of dietary fermented feed on the structure of intestinal of sea cucumber Apostichopus japonicus

肠道结构intestinal structure组别 groupD1D2D3D4D5D6皱襞高度/μm hF200.56±26.54a221.30±38.25a368.20±42.13b435.30±28.89c245.89±32.40a211.74±47.63a皱襞数量/个 nF12.00±1.00b13.33±1.53b16.00±2.00c17.33±1.15cd19.67±1.53d9.33±0.58a
2.5 发酵饲料对刺参肠道非特异性免疫酶活性的影响
从表9可见,随着发酵饲料替代比例的升高,肠道T-SOD活性呈上升趋势,D1组显著低于其他各组(P<0.05);AKP活性先上升后下降,D5组有最大值;D4组和D5组ACP活性显著高于其他各组(P<0.05),但两组之间无显著性差异(P>0.05);MDA含量呈先下降后上升的趋势,D3、D4组显著低于其他各组(P<0.05)。
表9 发酵饲料对刺参肠道非特异性免疫酶活性的影响
Tab.9 Effects of dietary fermented feed on the intestinal non-specific immune enzyme activity of sea cucumber Apostichopus japonicus
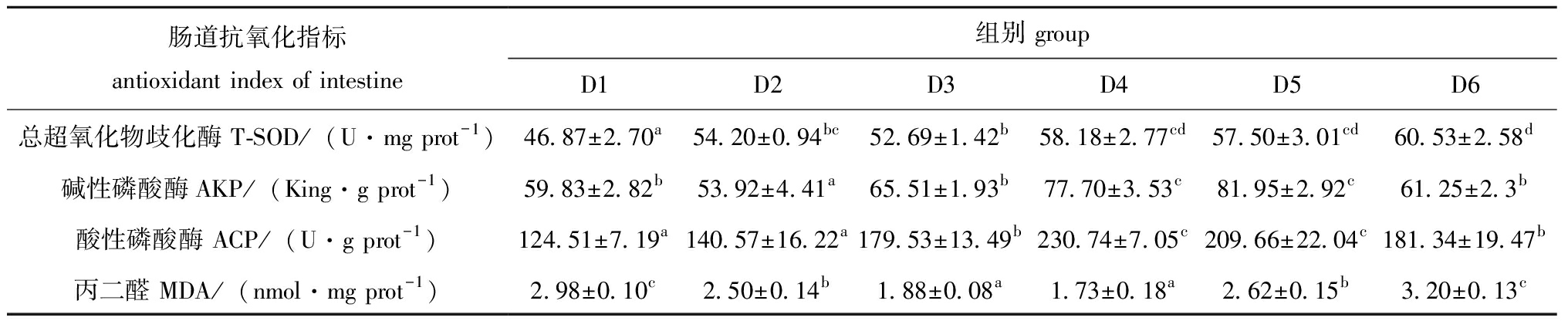
肠道抗氧化指标antioxidant index of intestine组别 groupD1D2D3D4D5D6总超氧化物歧化酶 T-SOD/(U·mg prot-1)46.87±2.70a54.20±0.94bc52.69±1.42b58.18±2.77cd57.50±3.01cd60.53±2.58d碱性磷酸酶AKP/(King·g prot-1)59.83±2.82b53.92±4.41a65.51±1.93b77.70±3.53c81.95±2.92c61.25±2.3b酸性磷酸酶 ACP/(U·g prot-1)124.51±7.19a140.57±16.22a179.53±13.49b230.74±7.05c209.66±22.04c181.34±19.47b丙二醛 MDA/(nmol·mg prot-1)2.98±0.10c2.50±0.14b1.88±0.08a1.73±0.18a2.62±0.15b3.20±0.13c
3 讨论
3.1 不同碳源对发酵饲料营养成分的影响
刺参配合饲料含有大量的粗纤维,且纤维素和蛋白紧密结合在一起降低了刺参对营养物质的利用率。枯草芽孢杆菌发酵饲料时,会产生一些代谢产物,如蛋白酶、纤维素酶等各种水解酶,可将纤维素、蛋白质等大分子物质水解成单糖、小肽和氨基酸等,提高了饲料的营养价值[12]。本试验中,未添加碳源组发酵进行到4 d时,酸溶蛋白和还原糖含量均达到最大值,分别从2.86%、0.22%提高到11.88%、2.13%,表明发酵改善了饲料的营养价值。碳源不仅构成微生物的细胞物质和代谢产物,而且为发酵初期微生物生命活动提了供能量,保证其正常生长。不同碳源对微生物的生长代谢及产物具有重要影响,诸多微生物培养基优化研究的目的亦是以获得最多目的产物为出发点。本研究中,发酵效果最好的为低聚果糖,葡萄糖、麦芽糖和蔗糖次之,可溶性淀粉最差。葡萄糖是应用广泛的能源和碳源,能被菌体快速利用,但高浓度的葡萄糖会对枯草芽孢杆菌发酵产酶存在浓度依赖阻遏效应,从而影响其酶解产物生成。枯草芽孢杆菌对麦芽糖、蔗糖的利用率较低,较难分解大分子蛋白和纤维素等。与未添加碳源相比,添加低聚果糖后发酵时间由4 d缩短至3 d,表明低聚果糖可促进枯草芽孢杆菌的快速繁殖,加速发酵反应进程。同时,添加低聚果糖后,发酵饲料中酸溶蛋白从11.88%提高至13.46%,还原糖含量从2.13%提高至3.15%,发酵饲料的营养价值得到提高。Peng等[13]以低聚果糖作为碳源,采用红茶菌发酵豆乳,结果发现,发酵后总酚、大豆异黄酮、核黄素含量均有所提高。陈韫慧等[14]研究发现,益生元能明显促进植物乳杆菌的增长,其中低聚果糖与低聚半乳糖最优。
3.2 发酵饲料对刺参生长和体成分的影响
本研究结果表明,发酵饲料替代20%~30%基础饲料时显著提高了刺参的生长性能,以WG为评价指标,经一元二次回归分析得出,刺参饲料中发酵饲料的最适替代比例为24.69%。有研究显示,生物发酵饲料在日本沼虾(Macrobrachium nipponense)[15]、卵形鲳鲹(Trachinotus ovatus)[16]饲料中的最适替代比例均为25%,在罗氏沼虾(Macrobrachuim rosenbergii)饲料中的最适替代比例为20%~30%[17],本试验与以上研究结果相似。但也有研究发现,尼罗罗非鱼(Oreochromis niloticus)[18]、斑点叉尾鮰(Ictalurus punctatus[19]、鲤(Cyprinus carpio)[20]和鳙(Aristichthys nobilis)[21]发酵饲料的最适替代比例为15%~20%,低于本试验的24.69%,这可能与刺参的肠道结构有关。相比于鱼类,刺参和虾类的肠道结构较为简单,对大分子营养物质的消化能力相对较低,从而不利于生长,发酵饲料的替代比例适当升高可能会对此产生缓解作用。此外,本试验中,当发酵饲料替代比例超过30%时,刺参的WG和SGR显著降低。大量研究表明,饲料经过微生物发酵后,一方面可以提高饲料的营养价值,提高水产动物对蛋白等营养物质的利用率[22];另一方面,饲料经发酵后具有芳香味,具有一定的诱食性,可以提高水产动物的摄食量[23]。适宜的发酵饲料替代比例可以促进刺参的生长,过量的发酵饲料释放出的葡萄糖和氨基酸等小分子物质含量可能超过了刺参的正常吸收值,从而导致其生长下降[24]。本试验中,发酵饲料替代比例的升高并未对刺参体壁水分、粗蛋白质、粗脂肪和粗灰分含量产生显著影响,该结果与鲤[20]、罗氏沼虾[17]和中华鳖[25]中的研究一致。
3.3 发酵饲料对刺参肠道消化酶活性和肠道结构的影响
肠道是刺参消化吸收营养物质的主要场所,内含有多种消化酶,其活性决定了刺参获取和利用营养物质的能力。大量研究表明,发酵饲料可以提高水产动物肠道消化酶的活性,如在斑节对虾(Penaeus monodon)饲料中用发酵玉米蛋白粉替代14.20%的鱼粉时,肠道蛋白酶、脂肪酶和淀粉酶的活性均达到最高[26];在鲤的研究中表明,添加15%和20%酵母发酵家禽副产品均显著增加了肠道脂肪酶、淀粉酶和蛋白酶的活性[27]。本研究中,随着发酵饲料替代比例的升高,胰蛋白酶和淀粉酶活性分别在D5组和D4组出现最大值,且D4~D5组蛋白酶和淀粉酶活性显著高于对照组,表明20%~30%发酵饲料有助于提高刺参的消化能力。当发酵饲料替代比例超过30%时,蛋白酶和淀粉酶的活性急剧下降。其原因可能是发酵饲料中含有大量的外源性消化酶,它和内分泌的消化酶一起作用于营养物质,过量的发酵饲料会加快肠道的消化速率,机体的营养需求得到快速补充,进而通过神经调节减少肠道消化酶的合成[28]。
肠道是消化和免疫的重要器官,在刺参中发挥作用,维持肠道结构的完整性对刺参健康至关重要,肠道皱襞高度和数量的变化直接与肠道吸收面积的大小相关,所以皱襞高度和数量可以作为评价动物消化能力的指标[29]。本试验中,发酵饲料显著提高了刺参肠道的皱襞高度和数量,皱襞高度和数量分别在替代比例为20%和30%时出现最大值。结果说明,饲料中添加20%~30%的发酵饲料显著增加了刺参肠道吸收面积,改善了刺参肠道结构,进一步提高了肠道对营养物质的吸收能力。
3.4 发酵饲料对刺参肠道抗氧化功能的影响
刺参作为无脊椎动物,主要依靠非特异性免疫系统来维持机体的健康,非特异性免疫酶活性可以反映刺参机体的健康程度[30]。研究表明,饲料经发酵后产生的多肽等被动物摄食后会产生多种生理活性物质和抗氧化物质,维持肠道菌群平衡,提升机体的免疫力[31]。本试验中,饲喂发酵饲料后,刺参肠道AKP、ACP和T-SOD活性较对照组均有显著提升,肠道AKP和ACP活性总体呈先升高后下降趋势,且D4组和D5组酶活性显著高于其他各组,表明添加20%~30%的发酵饲料可以提升刺参机体的免疫能力。大量研究表明,动物摄入发酵饲料后可以提高机体抗氧化能力。杨燕云等[32]研究发现,用菊芋全粉发酵饲料投喂刺参后显著提高了酚氧化酶、SOD和总一氧化氮合酶的活性。此外,在陆生动物牛[33]、猪[34]和羊[35]中也有相关报道。本试验中,适宜的发酵饲料替代比例显著升高了肠道T-SOD的活性,降低了MDA的含量。T-SOD是一种二聚体酶,可以解毒、清除超氧阴离子自由基,通过其活性可以判断机体清除氧自由基的能力[36]。机体内MDA含量可以反映脂质过氧化程度,也能间接反映机体细胞受氧自由基攻击的程度,其含量过高时,对细胞的毒害作用就会产生,免疫力也会因此下降[37]。本研究结果表明,适宜的发酵饲料会提升刺参机体的抗氧化能力。
4 结论
1 )在刺参配合饲料发酵过程中添加低聚果糖作为碳源发酵效果最佳。与未加碳源相比,添加2%的低聚果糖可将发酵时间从4 d缩短至3 d,酸溶蛋白含量从11.88%提高至13.46%,还原糖含量从2.13%提升至3.15%。
2 )饲料中添加20%~30%的发酵饲料可以提高刺参对营养物质的消化能力,增强刺参的抗氧化性能,进而促进刺参的生长,以增重率为评价指标,经一元二次回归分析得出,体质量为(27.03±0.12)g的刺参饲料中发酵饲料的最适替代比例为24.69%。
[1] LU C,WANG X Y,MA J H,et al.Chemical substances and their activities in sea cucumber Apostichopus japonicus:a review[J].Archiv der Pharmazie,2024,357(1):2300427.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2024中国渔业统计年鉴[M].北京:中国农业出版社,2024. Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2024 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2024.(in Chinese)
[3] 王晓艳,乔洪金,黄炳山,等.5种海藻在刺参幼参饲料中的应用研究[J].渔业科学进展,2019,40(3):160-167. WANG X Y,QIAO H J,HUANG B S,et al.Application research of five seaweeds in juvenile sea cucumber Apostichopus japonicus (selenka)[J].Progress in Fishery Sciences,2019,40(3):160-167.(in Chinese)
[4] SIDDIK M A B,JULIEN B B,MAJHARUL ISLAM S M,et al.Fermentation in aquafeed processing:Achieving sustainability in feeds for global aquaculture production[J].Reviews in Aquaculture,2024,16(3):1244-1265.
[5] WANG J H,GUO H,ZHANG T R,et al.Growth performance and digestion improvement of juvenile sea cucumber Apostichopus japonicus fed by solid-state fermentation diet[J].Aquaculture Nutrition,2017,23(6):1312-1318.
[6] 韩珍琼,任飞,贺新生.碳源和氮源对红平菇菌丝体营养成分的影响[J].食品工业,2015,36(12):172-176. HAN Z Q,REN F,HE X S.Effect of carbon and nitrogen sources on the nutritional component of Pleurotus djamor Mycelium[J].The Food Industry,2015,36(12):172-176.(in Chinese)
[7] WANG Y,YU J,LI Q,et al.Screening the carbon source type in solid-state fermentation with Phanerochaete chrysosporium to improve the forage value of corn straw and rice straw[J].Animals,2023,13(5):888.
[8] 杨秋月,刘双,许剑,等.一株高效降解豆粕菌株的分离鉴定及发酵条件优化[J].中国饲料,2023(15):130-137. YANG Q Y,LIU S,XU J,et al.Isolation and identification of a high efficiency soybean meal degradation strain and optimization of fermentation conditions[J].China Feed,2023(15):130-137.(in Chinese)
[9] 宋立立,李志国.响应面法优化枯草芽孢杆菌产蛋白酶的发酵条件[J].饲料研究,2020,43(7):81-85. SONG L L,LI Z G.Optimization of fermentation conditions for protease production by Bacillus subtilis using response surface methodology[J].Feed Research,2020,43(7):81-85.(in Chinese)
[10] 王际英,李宝山,张德瑞,等.饲料中添加精氨酸对仿刺参幼参生长、免疫能力及消化酶活力的影响[J].水产学报,2015,39(3):410-420. WANG J Y,LI B S,ZHANG D R,et al.Effects of dietary arginine on growth performance,immune responses and digestive enzyme of juvenile sea cucumber Apostichopus japonicus Selenka[J].Journal of Fisheries of China,2015,39(3):410-420.(in Chinese)
[11] 程柳,李静.3,5-二硝基水杨酸法测定山楂片中还原糖和总糖含量[J].轻工科技,2016,32(3):25-28. CHENG L,LI J.Determination of reducing sugar and total sugar in hawthorn tablets by 3,5-dinitrosalicylic acid method[J].Light Industry Science and Technology,2016,32(3):25-28.(in Chinese)
[12] SARAVANAKUMAR S,PRABAKARAN N N,ASHOKKUMAR R,et al.Unlocking the gut’s treasure:lipase-producing Bacillus subtilis probiotic from the intestine of Microstomus kitt (lemon sole)[J].Applied Biochemistry and Biotechnology,2024,196(7):4273-4286.
[13] PENG X H,YANG S,LIU Y W,et al.Application of kombucha combined with fructo-oligosaccharides in soy milk:colony composition,antioxidant capacity,and flavor relationship[J].Food Bioscience,2023,53:102527.
[14] 陈韫慧,方思璇,陈佳琪,等.不同益生元对植物乳杆菌生长的影响[J].食品与发酵工业,2020,46(21):28-33. CHEN Y H,FANG S X,CHEN J Q,et al.Effects of different prebiotics on the growth of Lactobacillus plantarum[J].Food and Fermentation Industries,2020,46(21):28-33.(in Chinese)
[15] 李正中.发酵饲料对日本沼虾生长性能、抗氧化能力及肠道微生物的影响[D].上海:上海海洋大学,2023. LI Z Z.Fermented feed on growth performance,antioxidant capacity and intestinal microorganisms of Macrobrachium nipponense[D].Shanghai:Shanghai Ocean University,2023.(in Chinese)
[16] WANG Z Z,LIAO S L,WANG J,et al.Effects of fermented cottonseed meal substitution for fish meal on intestinal enzymatic activity,inflammatory and physical-barrier-related gene expression,and intestinal microflora of juvenile golden pompano (Trachinotus ovatus)[J].Fishes,2023,8(9):466.
[17] 杨树浩.生物发酵饲料对罗氏沼虾生长性能、消化酶和免疫酶活性的影响[D].佛山:佛山科学技术学院,2017. YANG S H.Effect of fermented biological feed on growth performance,digestive enzyme and immune enzyme activity of Macrobrachium rosenbergii[D].Foshan: Foshan Institute of Science and Technology,2017.(in Chinese)
[18] CABANILLAS-G MEZ M,G
MEZ M,G MEZ-CADENA J,GALAVIZ M A,et al.Use of fermented malted barley by-product as partial feed replacement and carbon source for rearing Nile Tilapia (Oreochromis niloticus) juveniles[J].Journal of the World Aquaculture Society,2024,55(3):e13062.
MEZ-CADENA J,GALAVIZ M A,et al.Use of fermented malted barley by-product as partial feed replacement and carbon source for rearing Nile Tilapia (Oreochromis niloticus) juveniles[J].Journal of the World Aquaculture Society,2024,55(3):e13062.
[19] 陈启亮,段雨池,黄超,等.发酵饲料对斑点叉尾鮰生长及生化指标的影响[J].重庆师范大学学报(自然科学版),2022,39(5):40-46. CHEN Q L,DUAN Y C,HUANG C,et al.Effects of fermented feed on growth and biochemical indexes of channel catfish(Ictalurus punctatus)[J].Journal of Chongqing Normal University (Natural Science Edition),2022,39(5):40-46.(in Chinese)
[20] 钟小群,李向飞,蔡万存,等.发酵饲料对鲤鱼幼鱼生长性能、消化酶活性、肌肉品质和免疫机能的影响[J].南京农业大学学报,2018,41(1):154-162. ZHONG X Q,LI X F,CAI W C,et al.Effects of fermented feed on growth performance,digestive enzyme activity,fillet quality and immunity of juvenile carp(Cyprinus carpio)[J].Journal of Nanjing Agricultural University,2018,41(1):154-162.(in Chinese)
[21] 魏逸峰,陈金涛,宋正星,等.发酵饲料对鳙鱼生长及体成分的影响[J].科学养鱼,2021(8):68-70. WEI Y F,CHEN J T,SONG Z X,et al.Effect of fermented feed on growth and body-composition of bighead carp[J].Scientific Fish Farming,2021(8):68-70.(in Chinese)
[22] YANG L J,ZENG X F,QIAO S Y.Advances in research on solid-state fermented feed and its utilization:the pioneer of private customization for intestinal microorganisms[J].Animal Nutrition,2021,7(4):905-916.
[23] LIU J J,LIU X P,REN J W,et al.The effects of fermentation and adsorption using lactic acid bacteria culture broth on the feed quality of rice straw[J].Journal of Integrative Agriculture,2015,14(3):503-513.
[24] 李猛,廖梅杰,王印庚,等.浒苔添加比例与微生物发酵对幼刺参生长、消化和非特异性免疫的影响[J].动物营养学报,2015,27(10):3270-3278. LI M,LIAO M J,WANG Y G,et al.Effects of Enteromorpha prolifera adding ratio and microbial fermentation on growth,digestion and non-specific immune of juvenile sea cucumbers(Apostichopus japonicus selenka)[J].Chinese Journal of Animal Nutrition,2015,27(10):3270-3278.(in Chinese)
[25] 沈城,方华,郭子好,等.发酵豆粕替代部分鱼粉对中华鳖生长性能、体成分及肠道消化酶活性的影响[J].粮食与饲料工业,2015(7):51-55. SHEN C,FANG H,GUO Z H,et al.Effects of fermented soybean meal replacement of fish meal on growth performance,body composition and digestive enzyme activities in intestine of soft-shelled turtle[J].Cereal &Feed Industry,2015(7):51-55.(in Chinese)
[26] 李凤玉,解绶启,贠彪,等.发酵玉米蛋白粉替代鱼粉对斑节对虾(Penaeus monodon)生长性能、免疫应答和肠道消化酶的影响[J].饲料工业,2023,44(18):66-72. LI F Y,XIE S Q,YUN B,et al.Effects of replacing fish meal with fermented corn gluten meal in diets on growth performance,immune response and intestinal digestive function of Penaeus monodon[J].Feed Industry,2023,44(18):66-72.(in Chinese)
[27] DAWOOD M A O,MAGOUZ F I,ESSA M,et al.Impact of yeast fermented poultry by-product meal on growth,digestive enzyme activities,intestinal morphometry and immune response traits of common carp(Cyprinus carpio)[J].Annals of Animal Science,2020,20(3):939-959.
[28] 王爱民,刘文斌,王恬.外源酶对异育银鲫内源酶活性和肠道食糜排空速度的影响[J].江苏农业学报,2006,22(1):46-50. WANG A M,LIU W B,WANG T.Effects of exogenous enzymes on activity of endogenous enzymes and intestine evacuation velocity of allogynogenetic crucian[J].Jiangsu Journal of Agricultural Sciences,2006,22(1):46-50.(in Chinese)
[29] LIU J,YAO B L,SUN J,et al.Bacillus subtilis and xylo-oligosaccharide ameliorates NaHCO3-induced intestinal barrier dysfunction and autophagy by regulating intestinal microflora and PI3K/Akt pathway of crucian carp (Carassius auratus)[J].Aquaculture Reports,2024,36:102048.
[30] 李宝山,王丽丽,王际英,等.仿刺参幼参对维生素A最适需求量[J].水产学报,2023,47(8):126-134. LI B S,WANG L L,WANG J Y,et al.Optimum dietary vitamin A requirement of the juvenile sea cucumber Apostichopus japonicus[J].Journal of Fisheries of China,2023,47(8):126-134.(in Chinese)
[31] CUI J R,TAN X F,XU Z X,et al.Evaluation of growth,immune characteristics and gut microbiota of juvenile sea cucumber Apostichopus japonicus fed with fermented feed from Corynebacterium glutamicum[J].Aquaculture International,2024,32(5):6827-6843.
[32] 杨燕云,蒋鲁杰,朱晓振,等.菊芋全粉益生元发酵饲料对仿刺参生长性能、非特异性免疫及肠道微生物的影响[J].饲料工业,2022,43(10):57-64. YANG Y Y,JIANG L J,ZHU X Z,et al.Effects of Jerusalem artichoke powder prebiotics fermented feed on the growth performance,non-specific immunity and intestinal microflora of Apostichopus japonicus[J].Feed Industry,2022,43(10):57-64.(in Chinese)
[33] 薛晨.复合菌培养物和微生物发酵饲料对肉牛生长性能、非特异性免疫和抗氧化功能的影响[D].呼和浩特:内蒙古农业大学,2021. XUE C.Effects of compound culture and microbial fermented feed on growth performance,nonspecific immune and antioxidant function of beef cattle[D].Hohhot:Inner Mongolia Agricultural University,2021.(in Chinese)
[34] ZHU J J,GAO M X,ZHANG R L,et al.Effects of soybean meal fermented by L.plantarum,B.subtilis and S.cerevisieae on growth,immune function and intestinal morphology in weaned piglets[J].Microbial Cell Factories,2017,16(1):191.
[35] JIA P,CUI K,MA T,et al.Influence of dietary supplementation with Bacillus licheniformis and Saccharomyces cerevisiae as alternatives to monensin on growth performance,antioxidant,immunity,ruminal fermentation and microbial diversity of fattening lambs[J].Scientific Reports,2018,8(1):16712.
[36] BANNISTER J V,BANNISTER W H,ROTILIO G.Aspects of the structure,function,and applications of superoxide dismutas[J].Critical Reviews in Biochemistry,1987,22(2):111-180.
[37] WANG Z M,HE Z F,EMARA A M,et al.Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J].Food Chemistry,2019,288:405-412.