传染性胰腺坏死病毒(infectious pancreatic necrosis virus,IPNV)属于双RNA病毒科(Birnaviridae)水生双RNA病毒属(Aquabirnavirus)[1]。IPNV引发的传染性胰腺坏死病(infectious pancreatic necrosis,IPN)对鲑鳟养殖业造成了严重的经济损失[2]。该病毒呈二十面体球状颗粒[3],无囊膜[4],直径范围为55~75 nm(平均直径为60 nm)[5]。IPNV基因组由两条线性双链RNA片段A和B组成[6]。A链包含两个重叠的开放阅读框(open reading frame,ORF),其中较大的ORF编码外衣壳蛋白VP2、内衣壳蛋白VP3和蛋白酶VP4[7],较小的ORF编码非结构多肽VP5[8]。而基因组B片段只有一个ORF,编码VP1蛋白[9]。VP2蛋白是病毒的外衣壳蛋白,相对分子质量约为54 000 [10],是IPNV的主要结构蛋白和免疫原性蛋白,也是病毒毒力和致病性的主要决定因素,拥有主要中和抗原表位[6]。VP2蛋白作为主要的保护性抗原,已成为IPNV免疫防治研究的主要目标蛋白[11]。
全球水生双RNA病毒可分为7个基因型,中国IPNV主要存在1型和5型[12]。调查显示,IPNV已在中国7个省份的29个鲑鳟养殖场暴发,造成了严重的经济损失[13]。因此,建立一种方便、快速、准确的IPNV检测方法,对于该病毒的临床诊断及流行病学研究有着极为重要的意义。
目前,IPNV的检测方法主要包括细胞培养分离法[14]、逆转录PCR法[15-16]、等温扩增法[9]、酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)[17-18]和间接免疫荧光法(indirect immunofluorescence assay,IFA)[2,19]等。当前中国水产病毒检测体系仍以PCR技术为主,该方法因其高灵敏度和高特异性占据主导地位[20]。值得关注的是,ELISA作为经典免疫学检测手段,在人类医学领域应用广泛[21],但在水产动物病毒性疾病检测领域仍存在明显技术空白。本研究中针对这一空白领域,通过筛选IPNV VP2蛋白的优势抗原表位,成功建立了一种基于双抗体夹心原理的抗原捕获ELISA方法,该方法可实现IPNV临床样本的快速检测,以期为水产病毒性疾病的现场快速诊断提供新型技术方案。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒及试验动物 SP2/0骨髓瘤细胞、EPC细胞、CHSE-214细胞、1型IPNV毒株5株(GenBank:KX234591、KX355401、MW662100、MW662098、MW662095)、5型IPNV毒株3株(GenBank:MW662092、MW662091、MW662108)、传染性造血器官坏死病毒(infectious hematopoietic necrosis virus,IHNV,GenBank:MT242597)、鲤春病毒血症病毒(spring viremia of carp virus,SVCV,GenBank:MT675953)均由本试验室保存,VHSV毒株从中国典型培养物保藏中心购得。6~8周龄SPF级BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂 胎牛血清、链霉素和青霉素、1640基础培养基、Pierce BCATM蛋白检测试剂盒、兔源抗β-Tubulin抗体购自Thermo公司。Quick Antibody 3W、Hybridoma Feeder培养基购自博奥龙免疫技术有限公司。Protein A纯化柱、BeyoDesaltTM G-25 Spin脱盐柱购自碧云天生物技术有限公司。弗氏不完全佐剂、HAT和HT培养基添加剂购自Sigma-Aldrich(上海)贸易有限公司。Tween-20购自宝泰克生物科技公司。TMB显色液购自湖州英创生物科技有限公司。HRP标记羊抗鼠IgM抗体、HRP偶联试剂盒购自Abcam公司。
1.2 方法
1.2.1 VP2蛋白抗原表位筛选 从NCBI网站中下载常见的IPNV 1型和5型的VP2蛋白序列,每种基因型随机选取5个毒株。利用Snapgene软件进行蛋白序列比对,选出保守性高的片段序列。借助DNAMAN软件,以及IEDB、Bepipred等网站筛选出抗原性较高的肽段。由Uniprot和PDB网站下载已构建好的IPNV的VP2蛋白结构,运用PyMOL软件对VP2蛋白进行可视化处理,筛选出位于蛋白表面的肽段。在确定肽段后,由Genescript公司分别合成裸肽及KLH偶联肽。
1.2.2 单克隆抗体的制备及纯化 将1 mg/mL的KLH偶联肽段作为抗原,与Quick Antibody 3W佐剂等体积混合,对6~8 周龄的BALB/c小鼠的后腿肌肉进行注射,每只小鼠注射100 μL,14 d后进行加强免疫,将未免疫的小鼠作为阴性对照。采集小鼠尾端血液制备血清,采用HRP标记羊抗鼠IgM抗体作为二抗进行ELISA效价检测,待效价达到1∶6 400时进行细胞融合。对杂交瘤细胞进行亚克隆筛选,当阳性率达到90%以上时,选取OD值最高的孔进行扩大培养,即为分泌单克隆抗体的杂交瘤细胞株。6~8 周龄的BALB/c小鼠腹腔注射弗氏不完全佐剂,7 d后注射扩大培养的杂交瘤细胞,7~10 d后收获小鼠腹水。利用Protein A抗体纯化柱纯化抗体,测定抗体浓度后于-80 ℃保存;使用Abcam的HRP偶联试剂盒对抗体进行HRP标记。
1.2.3 Western blotting鉴定 在六孔板中铺入EPC细胞,12 h后分别接入IHNV、SVCV、VHSV病毒悬液;在六孔板中铺入CHSE细胞,12 h后接入IPNV病毒悬液。将细胞在15 ℃下培养48 h后,收集细胞进行Western blotting检测。以纯化的VP2单克隆抗体作为一抗,HRP标记的山羊抗鼠IgM抗体作为二抗,37 ℃下孵育1 h后,利用ECL发光液在成像仪中进行显影及分析。
1.2.4 IFA鉴定 将IHNV、IPNV、SVCV、VHSV分别接入细胞,在15 ℃下培养48 h后,用无菌PBS洗涤2次。采用4%多聚甲醛室温固定细胞30 min,0.5% Triton-X 100对细胞进行打孔20 min。在5%的脱脂奶粉中37 ℃下封闭1 h,以制备的VP2单克隆抗体作为一抗,Alexa Fluor 488标记的山羊抗鼠IgM作为二抗,37 ℃下孵育1 h后,用PBS洗涤3次,加入1 μg/mL的DAPI,在37 ℃下反应5 min,PBS洗涤3次后,利用荧光显微镜观察结果。
1.2.5 抗原捕获ELISA检测方法的建立 分别将VP2-178抗体和VP2-380抗体作为捕获抗体和检测抗体,捕获抗体4倍倍比稀释(1 000~256 000),检测抗体按1∶2 000稀释,筛选出最佳的捕获抗体和检测抗体。对筛选出的捕获抗体(1、0.5、0.1、0.05、0.01 μg/孔)和检测抗体(1∶1 000、1∶2 000、1∶4 000、1∶8 000)的浓度进行优化,同时确定ELISA检测中的最佳包被时间(4 ℃过夜、4 ℃过夜+37 ℃ 1 h、37 ℃ 1 h、37 ℃ 2 h),最佳的封闭液(3%脱脂奶粉、5%脱脂奶粉、3%FBS、5%FBS、3%BSA、5%BSA),最佳的封闭时间(0.5、1.0、1.5、2.0、2.5 h),最佳抗原反应时间(0.5、1.0、1.5、2.0、2.5 h),最佳检测抗体作用时间(0.5、1.0、1.5、2.0、2.5 h)及最佳TMB显色时间(10、15、20、30 min)。
1.2.6 抗原捕获ELISA方法临界值的确定 选取前期利用国家标准检测方法确定的15份阴性和33份IPNV阳性样品进行检测,应用MedCalc-20.0.10进行交互式点图分析,确定抗原捕获ELISA方法的cut-off临界值。
1.2.7 特异性试验 采用优化后的抗原捕获ELISA方法分别对IHNV、IPNV、SVCV及VHSV进行检测,根据OD450 nm值与cut off值进行比较,对该方法的特异性进行评价。
1.2.8 广谱性试验 分别从IPNV 1型和5型毒株中选出4株进行扩大培养,通过对不同基因型的毒株进行检测,评价该方法的广谱性。
1.2.9 灵敏度试验 首先,对IPNV病毒原液按10倍比稀释,以此确定该检测方法的检测限范围;其次,采用2倍倍比稀释IPNV病毒液,展开精准检测。根据OD450 nm值与cut off值进行比较,确定该检测方法的灵敏度。
1.2.10 重复性试验 采用同一批次包被的ELISA板,针对4份病毒样品进行检测,每组均设定4个重复,计算其批内变异系数。同时,运用不同批次包被的ELISA板,对相同的4份病毒样品进行检测,每组同样设置4个重复,计算批间变异系数。评价该检测方法的重复性。
1.2.11 临床应用 利用建立的方法,对本实验室保存于-80 ℃的40份虹鳟肝、脾及头肾组织混合样本(包含感染与未感染IPNV样本)进行检测。具体操作如下:将每1 g组织加入5 mL PBS进行充分研磨,加入终浓度为1%的TritonX-100溶液,运用抗原捕获ELISA方法对组织匀浆液中的IPNV进行检测(每孔100 μL)。同时参考张文等[22]建立的实时荧光定量RT-PCR方法,采用Trizol法提取病毒RNA,经反转录合成cDNA后,按照商品化荧光PCR试剂盒推荐的反应体系和程序进行检测。依据检测数据,计算两者的符合率。
2 结果与分析
2.1 抗原表位分析
通过DNAMAN软件对VP2蛋白的抗原性、亲水性等性能进行分析,其中第178~191、197~210、17~30、32~45、399~412、380~393 aa位的肽段均具有较强的亲水性(表1)。通过IEDB网站对抗原性进行分析,17~30、165~220、370~421 aa肽段具有较强的抗原性,且满足肽段长度大于14(图1)。综合发现VP2蛋白的178~191、197~210、17~30、399~412、380~393 aa具有较强的抗原性。借助PyMOL软件对自Uniprot网站获取的VP2蛋白结构予以可视化处理,发现只有VP2蛋白的第178~191、197~210、380~393 aa全部位于蛋白质表面(图2)。由于考虑到178~191与197~210 aa距离过近,可能干扰检测结果准确性,且经抗原性对比得知178~191 aa的抗原性优于197~210 aa,综合权衡后,最终选取178~191和380~393 aa作为抗原表位用于后续试验研究(表1),分别命名为p178和p380。
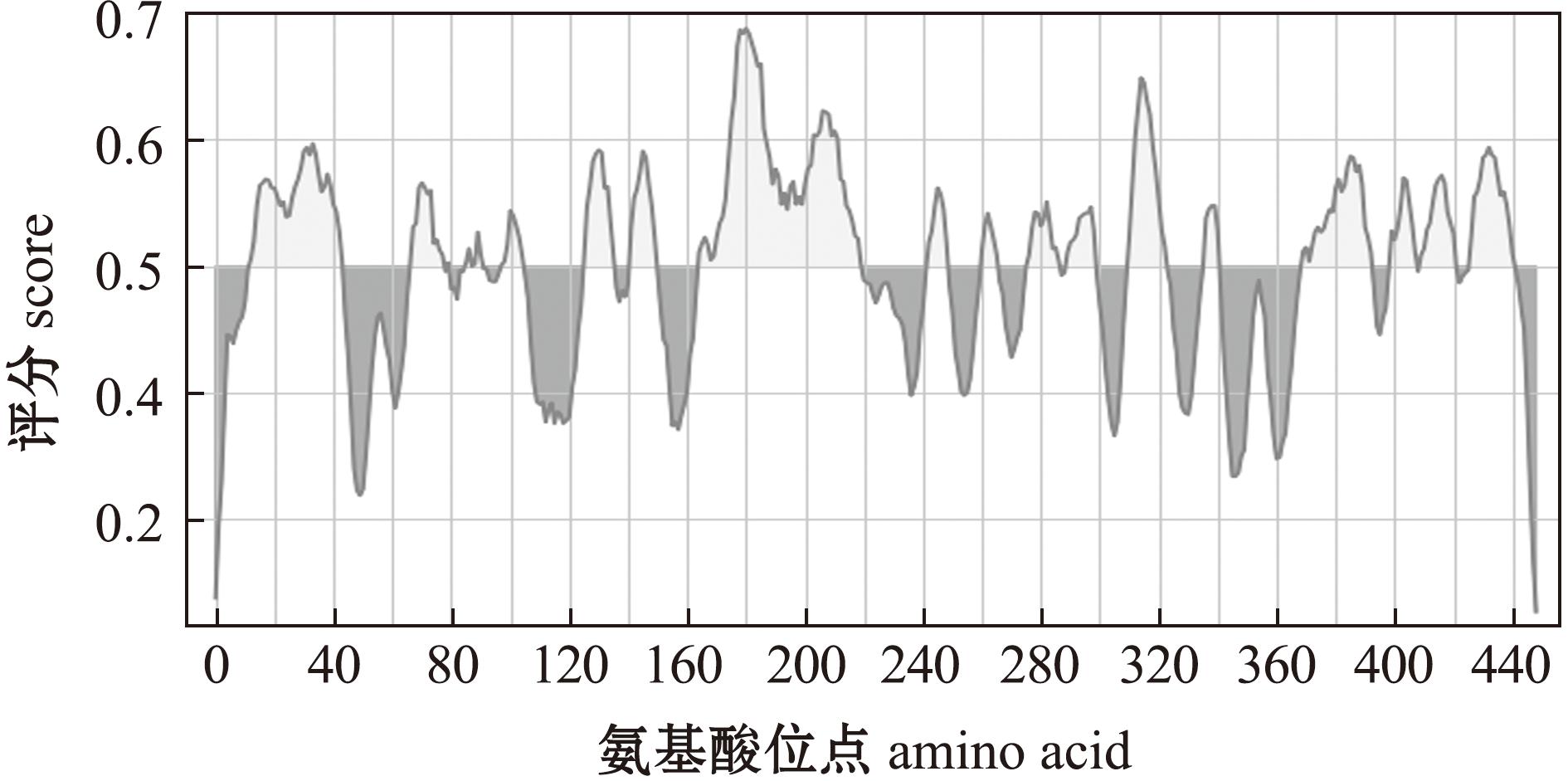
图1 IEDB网站预测IPNV VP2抗原性位点
Fig.1 Prediction of IPNV VP2 antigenicity on the IEDB website
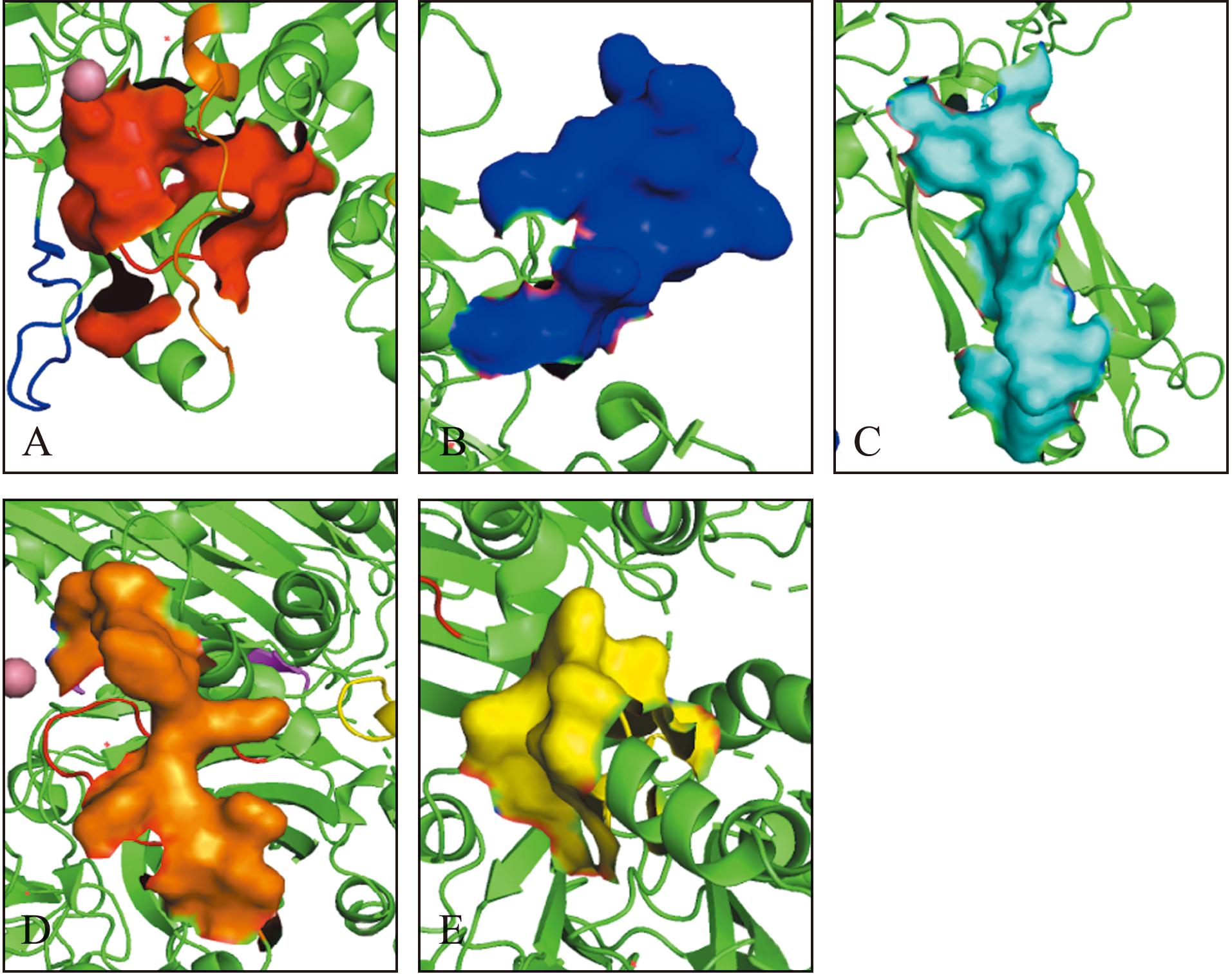
A—红色部分为VP2蛋白的17~30 aa;B—蓝色部分为VP2蛋白的178~191 aa;C—淡蓝色部分为VP2蛋白的197~210 aa;D—橙色部分为VP2蛋白的380~393 aa;E—黄色部分为VP2蛋白的399~412 aa。
A—red shows 17-30 aa of VP2 protein;B—blue shows 178-191 aa of VP2 protein;C—light blue shows 197-210 aa of VP2 protein;D—orange shows 380-393 aa of VP2 protein;E—yellow shows 399-412 aa of VP2 protein.
图2 位于蛋白表面的抗原位点图
Fig.2 Map of antigen sites located on the surface of the protein
表1 DNAMAN软件预测IPNV VP2抗原性位点
Tab.1 Prediction of IPNV VP2 antigenicity on the DNAMAN software
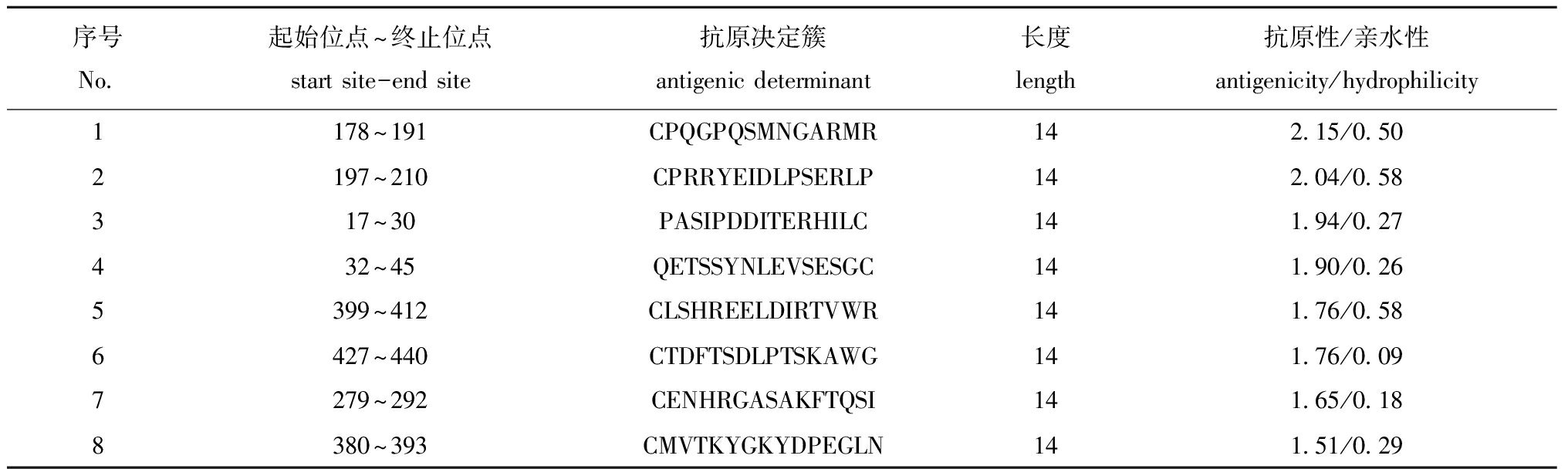
序号No.起始位点~终止位点start site-end site抗原决定簇antigenic determinant长度length抗原性/亲水性antigenicity/hydrophilicity1178~191CPQGPQSMNGARMR142.15/0.502197~210CPRRYEIDLPSERLP142.04/0.58317~30PASIPDDITERHILC141.94/0.27432~45QETSSYNLEVSESGC141.90/0.265399~412CLSHREELDIRTVWR141.76/0.586427~440CTDFTSDLPTSKAWG141.76/0.097279~292CENHRGASAKFTQSI141.65/0.188380~393CMVTKYGKYDPEGLN141.51/0.29
2.2 单克隆抗体的制备、纯化与鉴定
为了增强合成肽段的免疫原性,研究使用KLH基团对p178和p380肽段进行偶联,对小鼠进行免疫并对杂交瘤细胞进行筛选。当阳性率达到90%以上时,选取OD值最高的孔进行扩大培养,最终得到了VP2-178-2A7和VP2-380-1G12两个可以稳定分泌单克隆抗体的杂交瘤细胞株。采用Protein A纯化柱对抗体进行纯化,分别命名为VP2-178抗体和VP2-380抗体。
通过Western blotting(图3)与IFA(图4和图5)对两种单克隆抗体的特异性进行检测,结果发现,VP2-178抗体和VP2-380抗体均能与IPNV的VP2蛋白发生特异性结合反应,且与其他病毒不存在交叉反应。
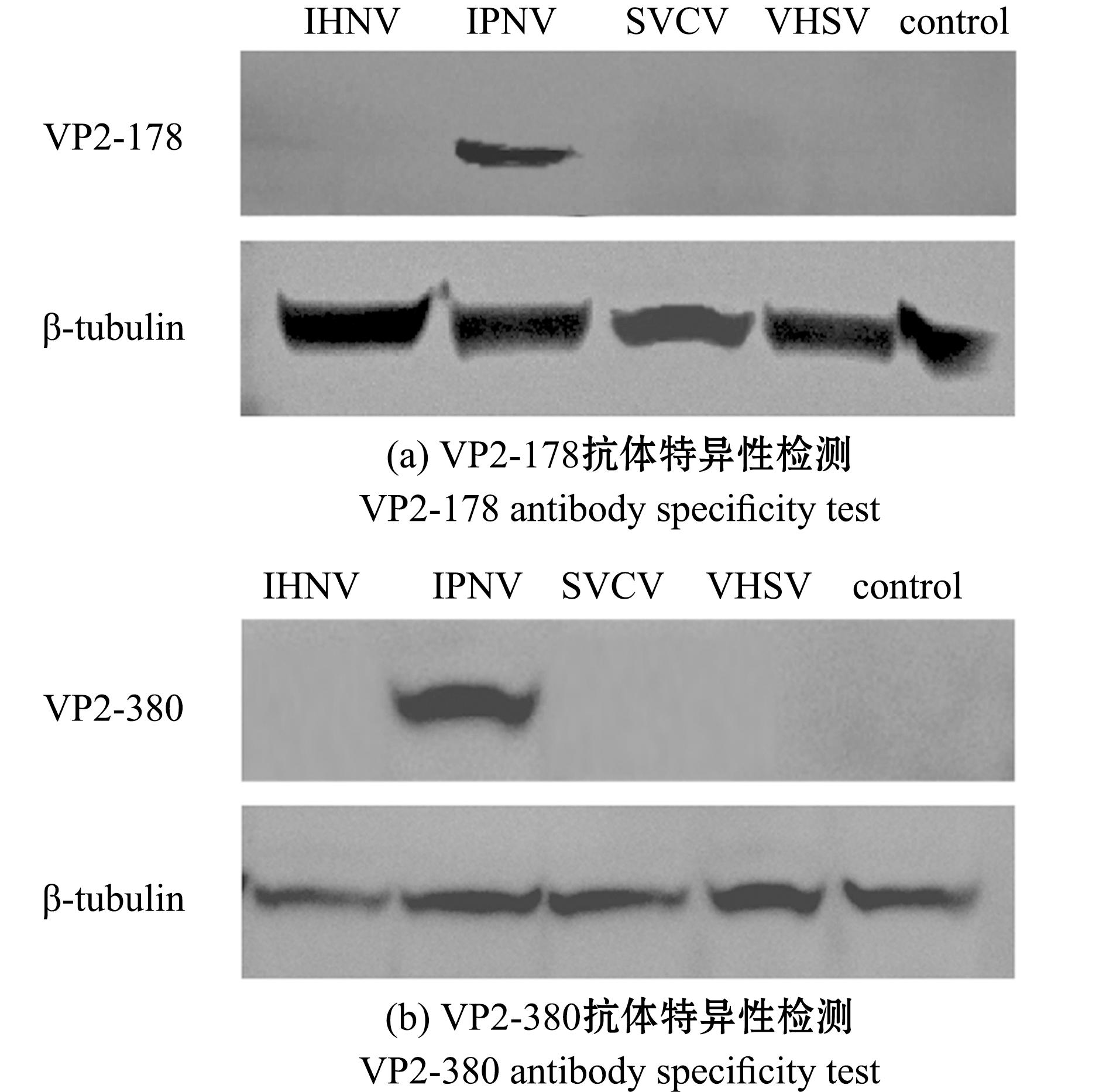
图3 Western blotting检测抗体特异性
Fig.3 Western blotting detection of antibody specificity
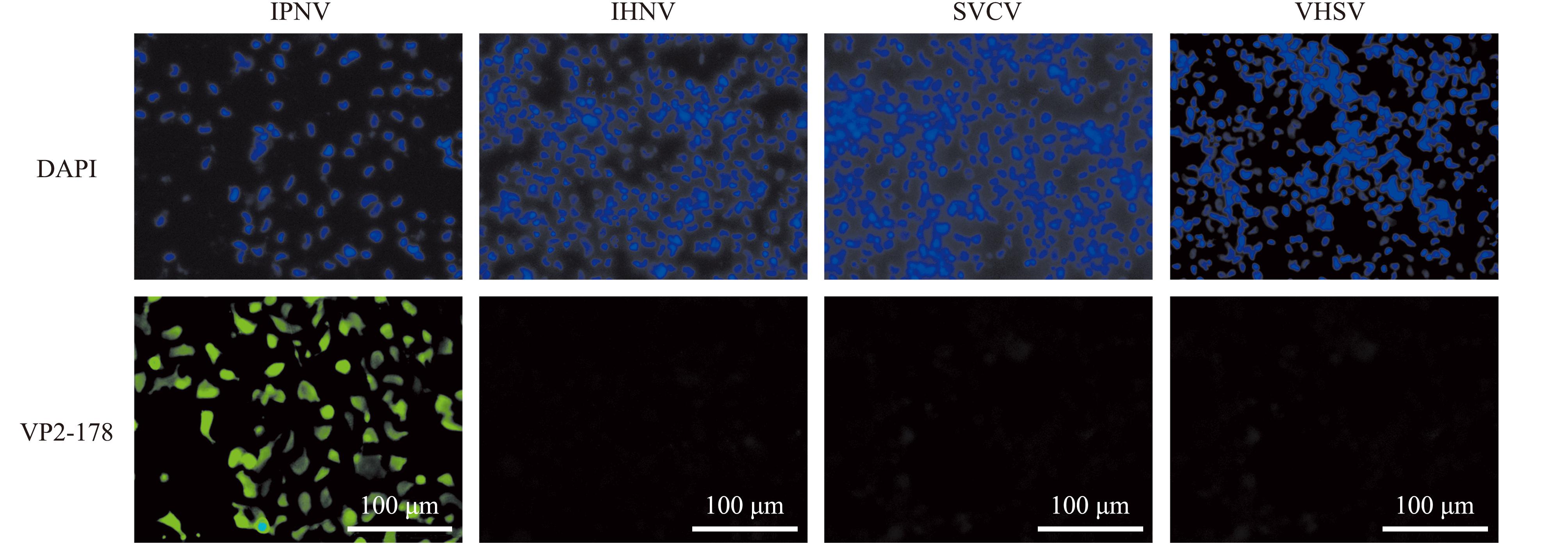
图4 IFA检测VP2-178抗体特异性
Fig.4 IFA detects the specificity of VP2-178 antibody
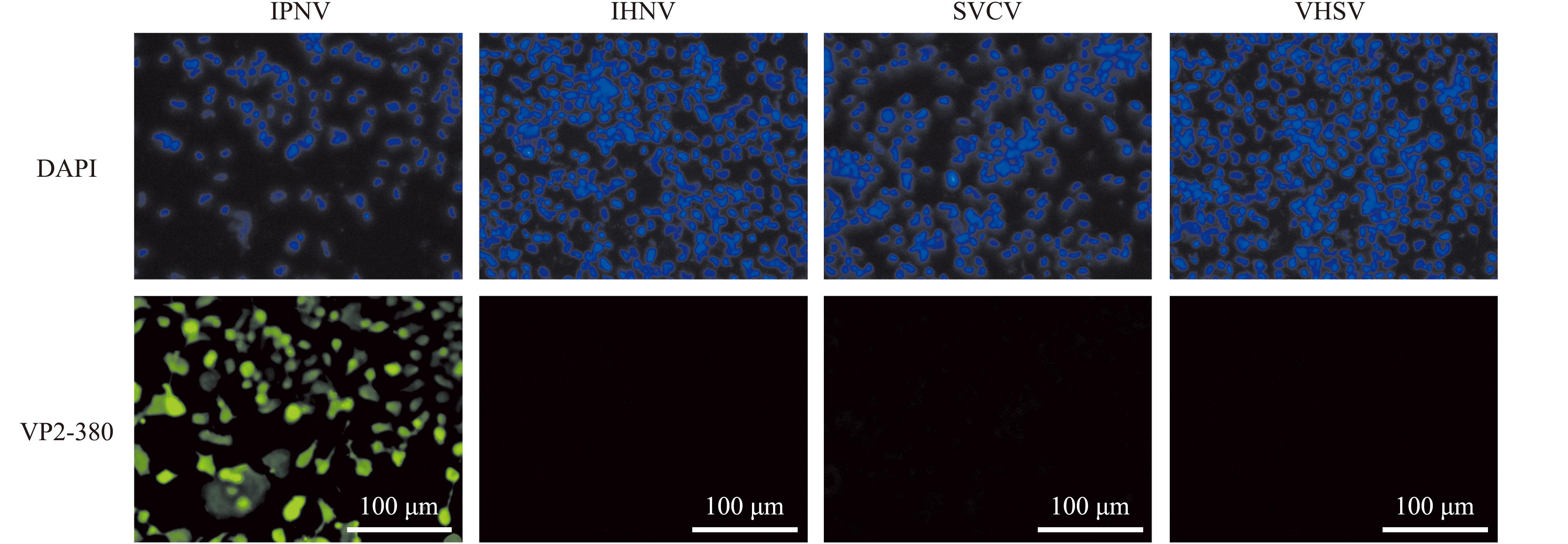
图5 IFA检测VP2-380抗体特异性
Fig.5 IFA detects the specificity of VP2-380 antibody
2.3 抗原捕获ELISA检测方法的优化
研究中分别对ELISA检测方法中的捕获抗体及其工作浓度、检测抗体及其工作浓度、捕获抗体包被时间、封闭液种类及封闭时间、抗原反应时间、检测抗体作用时间和TMB显色时间进行优化。结果发现,最佳捕获抗体为VP2-178抗体,最佳工作浓度为0.5 μg/孔,最佳检测抗体为HRP标记VP2-380抗体,最佳稀释度为1∶2 000,最佳反应条件见表2。
表2 抗原捕获ELISA最佳反应条件的优化结果
Tab.2 Optimized results for optimal reaction conditions for antigen capture ELISA
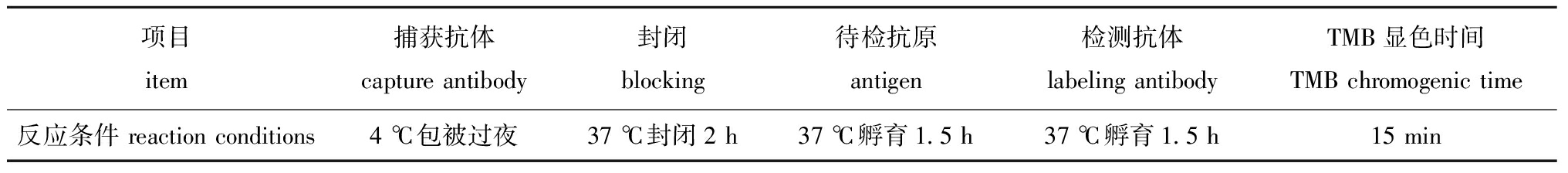
项目item捕获抗体capture antibody封闭blocking待检抗原antigen检测抗体labeling antibodyTMB显色时间TMB chromogenic time反应条件 reaction conditions4 ℃包被过夜37 ℃封闭2 h37 ℃孵育1.5 h37 ℃孵育1.5 h15 min
2.4 临界值的确定
利用建立的ELISA方法,对背景清晰的15份阴性和33份阳性IPNV组织样本进行检测,根据OD450 nm值及用国家标准方法检测的结果,利用MedCalcv20.0.10软件计算其临界值。结果表明,当敏感性为97.9%、特异性为100%时,其最优cut-off值为0.213 7,因此确定ELISA的临界值OD450 nm为0.213 7(图6),当OD450 nm大于或等于该值时被认为是阳性,当OD450 nm小于该值时被认为是阴性。
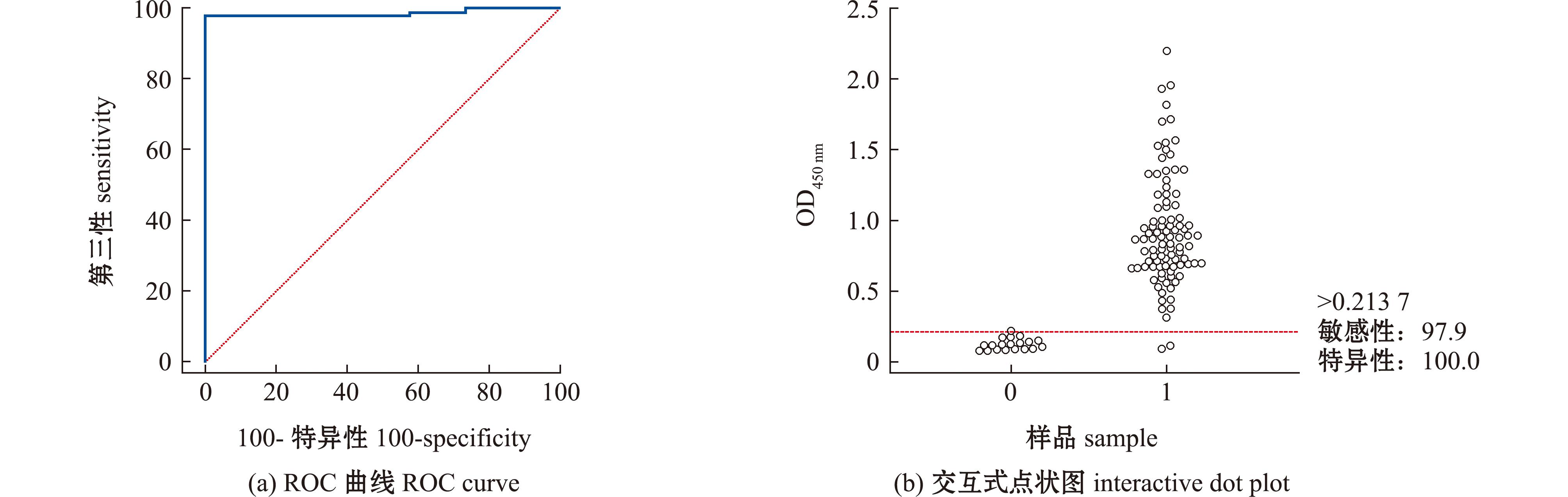
图6 抗原捕获ELISA方法阴阳性临界值的确定
Fig.6 Determination of the negative and negative cut off values of antigen capture ELISA method
2.5 抗原捕获ELISA检测方法的评估
2.5.1 特异性试验 采用建立的抗原捕获ELISA方法,分别对IHNV、IPNV、SVCV、VHSV进行检测。结果显示,除IPNV的OD450 nm值大于临界值外,其余病毒的OD450 nm值均在临界值以下,表明该方法具有良好的特异性(图7)。
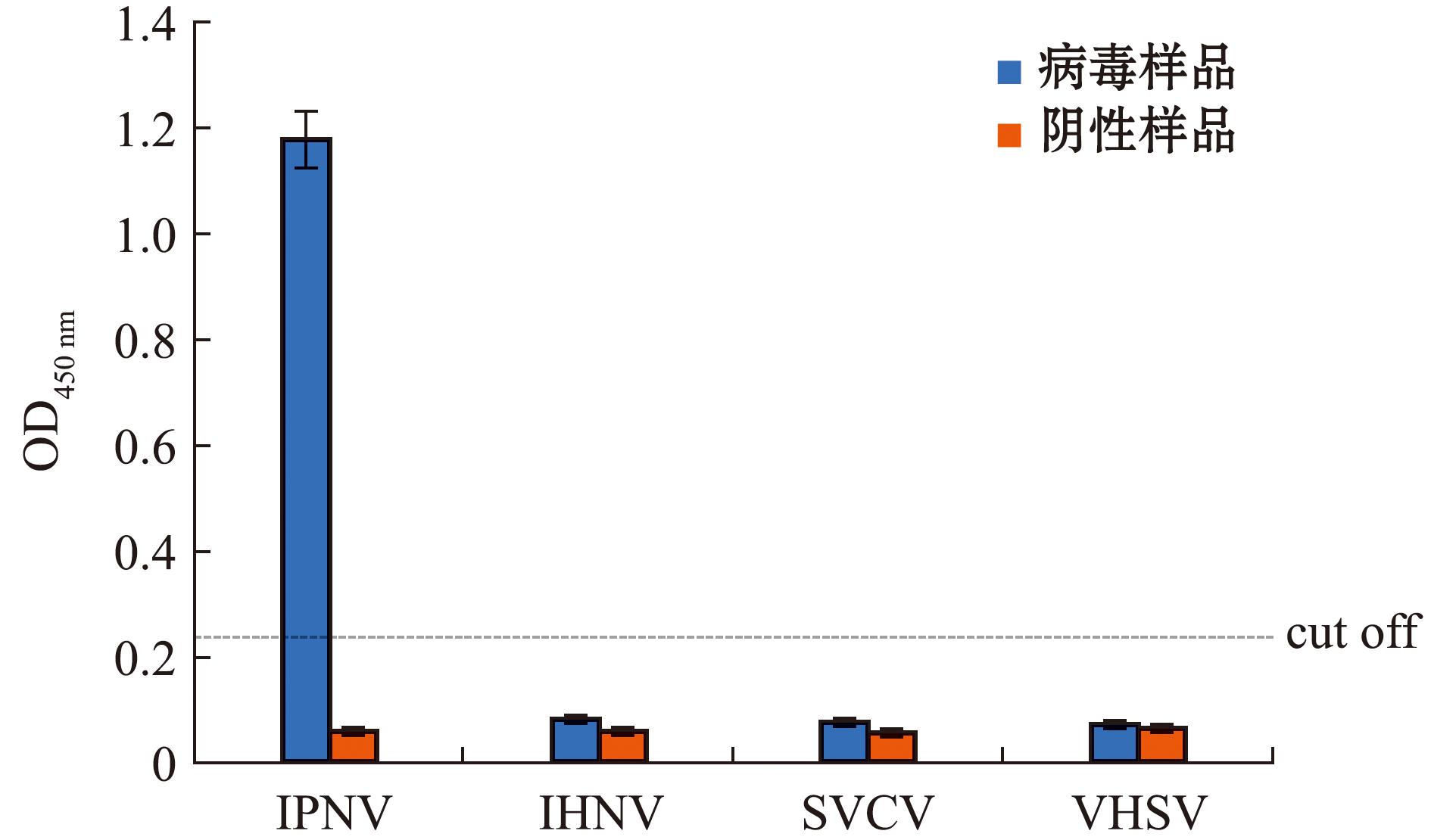
图7 抗原捕获ELISA特异性试验结果
Fig.7 Antigen capture ELISA specific test results
2.5.2 广谱性试验 用本研究建立的抗原捕获ELISA对不同基因型的IPNV毒株进行检测,结果显示,此方法能够有效检测Ⅰ型与Ⅴ型的IPNV毒株,具备针对IPNV的广谱性检测能力(图8)。
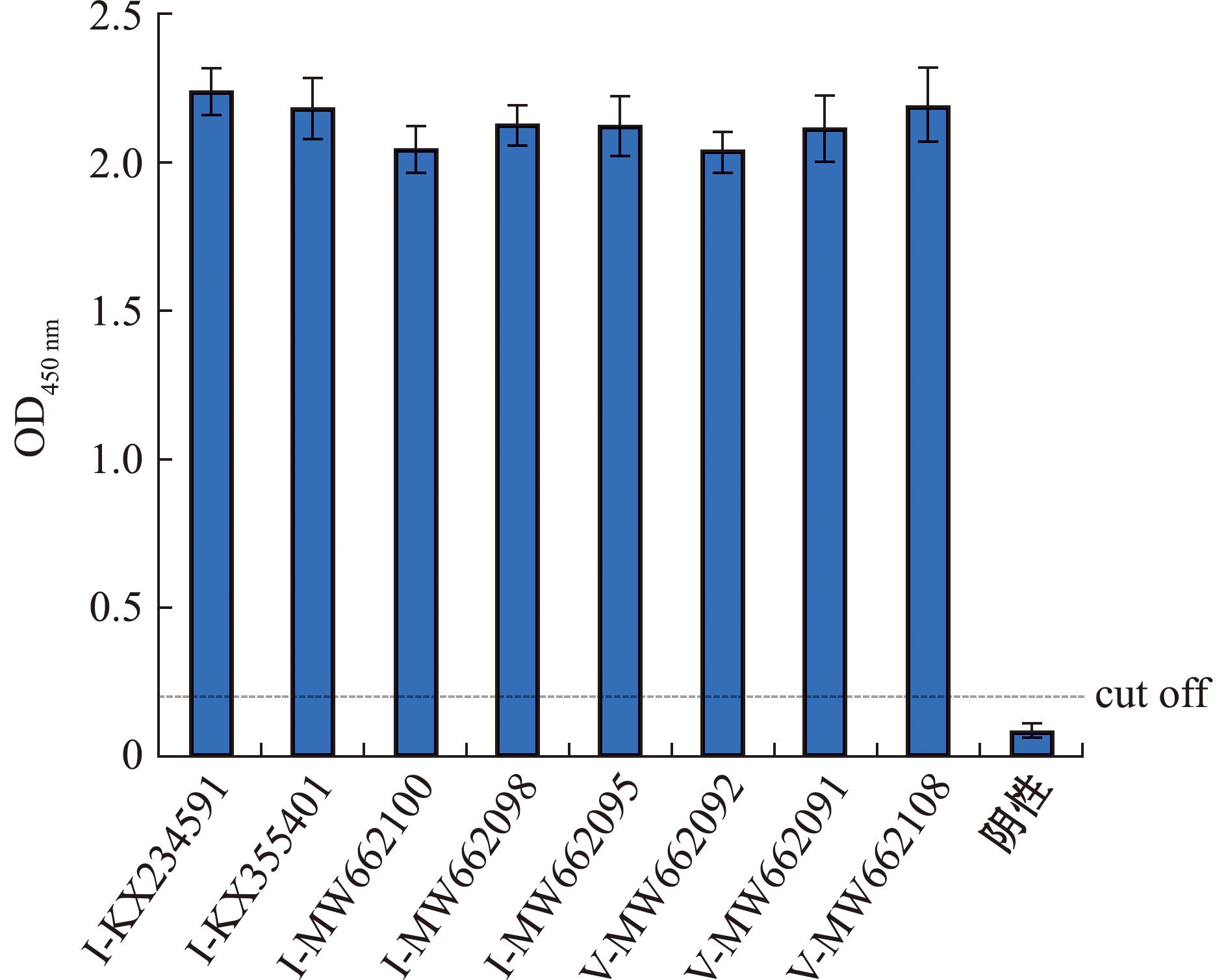
图8 抗原捕获ELISA广谱性试验结果
Fig.8 Antigen capture ELISA broad-spectrum test results
2.5.3 灵敏度试验 将IPNV病毒原液(108 TCID50/mL)进行10倍倍比稀释后,经测定其检测限处于102 TCID50附近(表3)。在此浓度范围内进一步开展2倍倍比稀释,最终确定该方法的检测限为62.5 TCID50/mL(表4)。以上结果表明,该ELISA检测方法具备较高的灵敏度。
表3 10倍稀释灵敏性试验结果
Tab.3 Results of 10-fold dilution sensitivity test
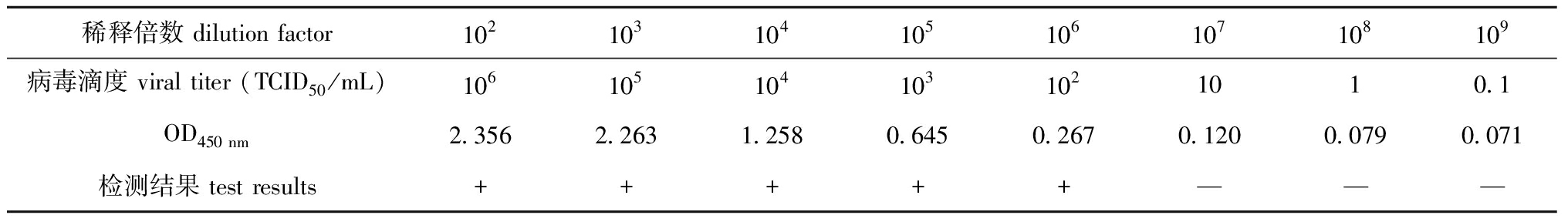
稀释倍数 dilution factor102103104105106107108109病毒滴度 viral titer (TCID50/mL)1061051041031021010.1OD450 nm2.3562.2631.2580.6450.2670.1200.0790.071检测结果 test results+++++———
注:+代表PCR阳性;—代表PCR阴性,下同。
Note:+ means positive test result;— means negative test result,et sequentia.
表4 2倍稀释灵敏性试验结果
Tab.4 Results of 2-fold dilution sensitivity test

稀释倍数 dilution factor1052×1054×1058×1051.6×1063.2×1066.4×1061.3×107病毒滴度 viral titer (TCID50/mL)10350025012562.531.2515.67.8OD450 nm0.6370.5550.4230.3210.2290.1390.0990.086检测结果 test results+++++———
2.5.4 重复性试验 用同一批次包被好的ELISA板,对4个毒株样本进行ELISA效价检测,结果显示,该批样本检测的变异系数为3.778%~5.468%。用不同批次包被好的ELISA板,对相同的样本进行ELISA效价检测,结果显示,该批样本检测的变异系数为3.995%~6.518%。两组试验的变异系数均低于10%(表5)。依据此结果可以推断,该检测方法具备良好的重复性和稳定性。
表5 抗原捕获ELISA重复性试验结果
Tab.5 Results of antigen capture ELISA repeatability test
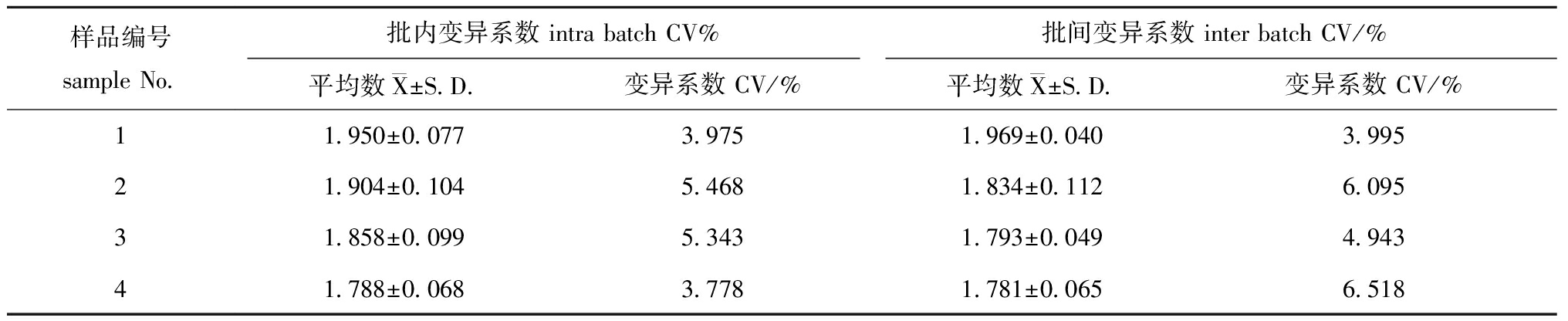
样品编号sample No.批内变异系数 intra batch CV%批间变异系数 inter batch CV/%平均数X±S.D.变异系数 CV/%平均数X±S.D.变异系数 CV/%11.950±0.0773.9751.969±0.0403.99521.904±0.1045.4681.834±0.1126.09531.858±0.0995.3431.793±0.0494.94341.788±0.0683.7781.781±0.0656.518
2.5.5 临床应用 本研究随机选取了40份样本,这些样本包含感染与未感染IPNV的虹鳟肝、脾、头肾的混合组织。将该检测结果与张文等建立的对照方法检测结果进行对比分析,结果表明,二者的结果符合率达100%(表6),这表明该检测手段在临床应用方面具有较大潜力。
表6 ELISA与对照方法检测结果比对
Tab.6 Comparison between ELISA and control method results
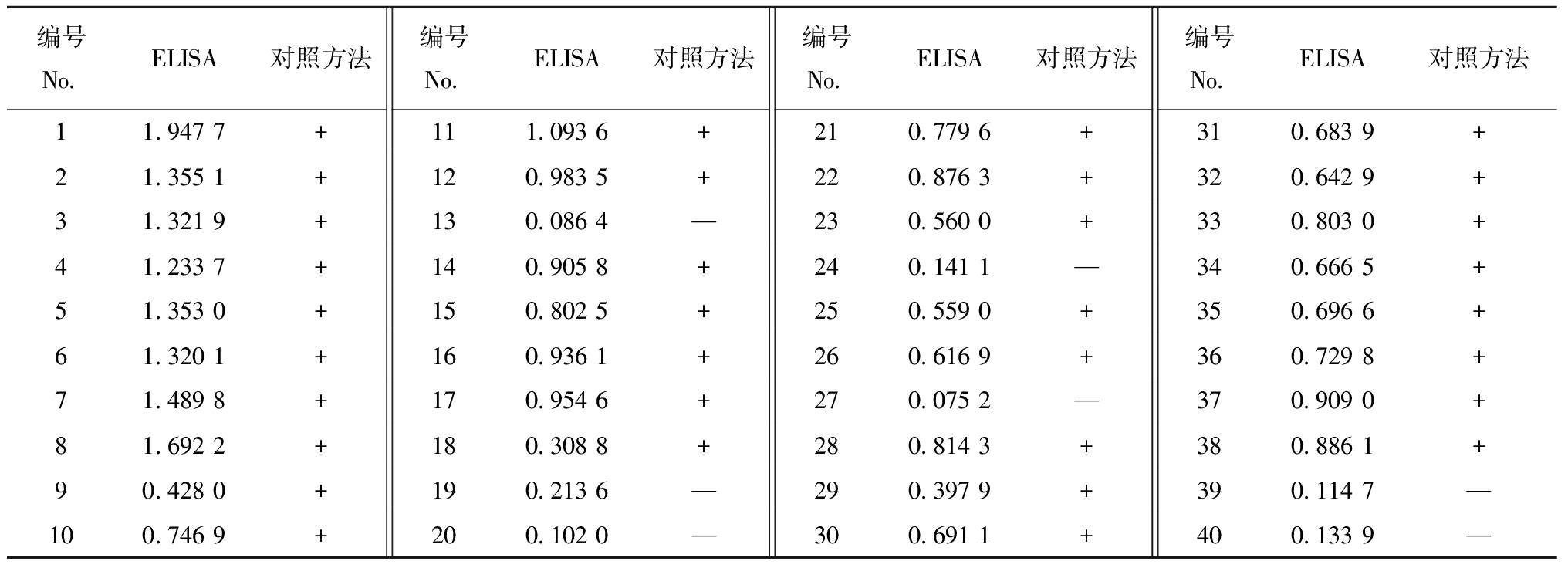
编号No.ELISA对照方法编号No.ELISA对照方法编号No.ELISA对照方法编号No.ELISA对照方法11.947 7+111.093 6+210.779 6+310.683 9+21.355 1+120.983 5+220.876 3+320.642 9+31.321 9+130.086 4—230.560 0+330.803 0+41.233 7+140.905 8+240.141 1—340.666 5+51.353 0+150.802 5+250.559 0+350.696 6+61.320 1+160.936 1+260.616 9+360.729 8+71.489 8+170.954 6+270.075 2—370.909 0+81.692 2+180.308 8+280.814 3+380.886 1+90.428 0+190.213 6—290.397 9+390.114 7—100.746 9+200.102 0—300.691 1+400.133 9—
注:+代表对照方法检测阳性;—代表对照方法检测阴性。
Note:+ means positive by control method;— means negative by control method.
3 讨论
3.1 IPNV VP2单克隆抗体的制备
IPNV是一种对鲑鳟鱼类极具传染性的急性病毒,该病毒造成的死亡率最高可达100%[23]。国外目前已有相关疫苗,如DNA疫苗[24]、重组疫苗等[25-26],但它们不足以对病毒彻底清除。抗病毒药物目前处于试验阶段,尚未投入临床使用[27],当前依旧以预防作为主要手段。因此,构建高效、便捷的检测手段势在必行。目前有许多针对IPNV的检测方法,但检测过程中需要专业的生物学仪器和专业人员操作,检测周期长、成本高,无法快速高效地对初期感染病毒的鱼群进行检测。
VP2蛋白是IPNV的重要结构蛋白,也是主要的免疫原性蛋白[6],该蛋白的抗原表位可诱导机体产生保护性免疫反应,同时其还参与病毒感染过程,是影响病毒毒力和致病性的关键因素[28]。本文通过比对多株IPNV VP2蛋白的氨基酸序列,确定了VP2的保守区域。借助多个网站对其抗原性展开深入分析,确定了部分抗原性强的肽段。鉴于蛋白质具备特定的空间结构,部分抗原表位可能会折叠到蛋白质内部。研究中进行ELISA检测及IFA检测时,均是对具备完整空间结构的蛋白质进行检测,且需筛选出位于蛋白表面的抗原肽段作为免疫原制备抗体。因此,本研究中借助PyMOL软件对自Uniprot网站获取的VP2蛋白结构予以可视化处理,进而从中筛选出位于蛋白表面的抗原位点(图 2),故本研究中最后确定了位于蛋白质表面的、抗原性强的p178和p380肽段作为抗体制备的免疫原。试验中利用p178和p380免疫小鼠,取脾细胞与SP2/0细胞融合后,获得了可分泌VP2-178和VP2-380抗体的杂交瘤细胞株。本研究中利用Western blotting和IFA方法,进一步对抗体的特异性进行了检测。结果发现,VP2-178和VP2-380抗体仅与IPNV发生特异性反应,与IHNV、SVCV、VHSV均无交叉反应,抗体特异性良好。
3.2 IgM作为检测抗体的优势
IgM不仅是适应性体液免疫反应中出现的第一种免疫球蛋白,而且非特异性的IgM还是天然免疫系统的重要组成部分,是机体抵御感染的第一道防线[29]。作为初次免疫应答的主要抗体,IgM通常以五聚体的形式存在,具有10个抗原结合位点[30],可同时与多个抗原表位结合,形成多聚物抗原复合物,能迅速识别病原体。其分子中还包括多个糖基化位点,这些糖基化结构对于抗体的稳定性和功能至关重要。与IgG抗体相比,IgM抗体抗原结合量更高,检测抗原能力更强,更加适合作为ELISA检测用的抗体。因此,本研究在筛选阳性杂交瘤细胞时,采用HRP标记羊抗鼠IgM抗体作为二抗,最后获得的VP2-178和VP2-380两株抗体均为IgM亚型。利用这两种IgM抗体建立了ELISA检测方法对IPNV病毒抗原进行检测,其病毒检测能力更强。
3.3 抗原捕获ELISA检测方法的建立及评估
研究中通过对ELISA检测方法中的捕获抗体及其工作浓度、检测抗体及其工作浓度、捕获抗体包被时间、封闭液种类及封闭时间、抗原反应时间、检测抗体作用时间和TMB显色时间等多种参数进行优化,建立了针对IPNV病毒抗原的抗原捕获ELISA检测方法。对其进行评估发现,该抗原捕获ELISA检测方法可以特异性检测IPNV,与IHNV、SVCV、VHSV等其他鱼类病毒均无交叉反应,并且广谱性强,能够检测国内流行的1型和5型IPNV毒株,病毒的最低检测滴度为62.5 TCID50/mL。张琳琳等[31]以纯化的IPNV-VP2重组蛋白多克隆抗体为包被抗体,抗IPNV VP2单克隆抗体为检测抗体建立了IPNV双抗体夹心ELISA方法,其灵敏度为103 TCID50/mL。与之相比,本方法的检测灵敏度显著提升。这可能是由于本研究采用免疫原性强的短肽进行抗体制备,其获得的抗体与抗原蛋白具有更高的亲和力;其次,本研究中的捕获抗体和检测抗体均为IgM亚型,其抗原结合量更高,检测抗原能力更强。对该检测方法批内与批间变异系数分析显示,二者均低于7%,表明该方法重复性良好。使用该抗原捕获ELISA法与RT-PCR法同时检测40份虹鳟肝、脾、头肾混合样本,结果符合率达100%。尽管抗原捕获ELISA法的灵敏度不及RT-PCR法,但操作简便快速,对试验人员及设备要求不高,成本低廉,适用于批量检测样品的初步筛查,有助于减少后续检测工作量,提升检测效率与准确性。
4 结论
1)通过各软件及网站分析,本研究成功筛选出保守性好、抗原性强、溶解性好且位于蛋白表面的抗原表位p178和p380。
2)通过免疫小鼠及细胞融合,本研究成功制备VP2-178抗体和VP2-380抗体,两株抗体具有较强的特异性。
3)本研究中建立并优化了IPNV抗原捕获ELISA方法,通过特异性试验、广谱性试验、灵敏度试验、重复性试验及临床应用,表明该ELISA方法可以用于IPNV的检测。
[1] DADAR M,PEYGHAN R,MEMARI H R,et al.Sequence analysis of infectious pancreatic necrosis virus isolated from Iranian reared rainbow trout (Oncorhynchus mykiss) in 2012[J].Virus Genes,2013,47(3):574-578.
[2] 陈桂花,贺文斌,徐黎明,等.传染性胰脏坏死病毒VP3抗血清的制备及应用[J].大连海洋大学学报,2021,36(4):573-579. CHEN G H,HE W B,XU L M,et al.Preparation and application of VP3 antiserum of infectious pancreatic necrosis virus[J].Journal of Dalian Ocean University,2021,36(4):573-579.(in Chinese)
[3] 赵景壮,贺文斌,徐黎明,等.虹鳟IPNV分离株VP2蛋白的表达及免疫原性检测[J].大连海洋大学学报,2019,34(2):179-185. ZHAO J Z,HE W B,XU L M,et al.Expression and immunogenicity analysis of VP2 protein of a Chinese infectious pancreatic necrosis virus from diseased rainbow trout Oncorhynchus mykiss[J].Journal of Dalian Ocean University,2019,34(2):179-185.(in Chinese)
[4] 江育林,徐伯亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358,394. JIANG Y L,XU B H,LI W,et al.Isolation and identification of infectious pancreatic necrosis virus (ipnv) from imported rainbow trout (Salmon gairdneri) in p.r.China[J].Acta Hydrobiologica Sinica,1989,13(4):353-358,394.(in Chinese)
[5] 赵文闻,徐黎明,陈桂花,等.传染性胰脏坏死病毒敏感细胞系比较及其在CHSE-214细胞上的增殖特性[J].水产学杂志,2022,35(1):1-8. ZHAO W W,XU L M,CHEN G H,et al.Comparison of sensitive cell lines of infectious pancreatic necrosis virus and viral proliferation characteristics in CHSE-214 cell line[J].Chinese Journal of Fisheries,2022,35(1):1-8.(in Chinese)
[6] 梁磊.IHNV-N蛋白和IPNV-VP2蛋白抗血清的制备与应用[D].杨凌:西北农林科技大学,2019. LIANG L.Preparation and application of antiserum against IHNV-N protein and IPNV-VP2 protein[D].Yangling:Northwest A &F University,2019.(in Chinese)
[7] 段凯越,赵景壮,任广明,等.基因组Ⅰ型和Ⅴ型传染性胰脏坏死病毒的分离与鉴定[J].大连海洋大学学报,2021,36(5):736-744. DUAN K Y,ZHAO J Z,REN G M,et al.Isolation and identification of genogroup Ⅰ and genogroup Ⅴ infectious pancreatic necrosis virus strains[J].Journal of Dalian Ocean University,2021,36(5):736-744.(in Chinese)
[8] DUNCAN R,MASON C L,NAGY E,et al.Sequence analysis of infectious pancreatic necrosis virus genome segment B and its encoded VP1 protein:a putative RNA-dependent RNA polymerase lacking the Gly-Asp-Asp motif[J].Virology,1991,181(2):541-552.
[9] 杨瑶.传染性胰脏坏死病毒RT-LAMP检测方法的建立及应用[D].哈尔滨:东北农业大学,2019. YANG Y.Establishment and application of RT-LAMP detection method for infectious pancreatic necrosis virus[D].Harbin:Northeast Agricultural University,2019.(in Chinese)
[10] 王健楠.传染性胰腺坏死病毒VP2抗原表位区间接免疫荧光方法的建立[D].哈尔滨:东北农业大学,2012. WANG J N.Establishment of indirect immunofluorescence method for VP2 epitope region of infectious pancreatic necrosis virus[D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[11] 赵景壮.预防IHN和IPN的二联弱毒疫苗研究[D].哈尔滨:东北林业大学,2023. ZHAO J Z.Study on bivalent attenuated vaccine for preventing IHN and IPN[D].Harbin:Northeast Forestry University,2023.(in Chinese)
[12] 欧阳少琪,赵云峰,蒋丽,等.虹鳟传染性胰脏坏死性状全基因组关联分析[J].山东农业大学学报(自然科学版),2022,53(4):618-623. OUYANG S Q,ZHAO Y F,JIANG L,et al.Genome-wide association analysis of infections pancreatic necrosis traits in Oncorhynchus mykiss[J].Journal of Shandong Agricultural University (Natural Science Edition),2022,53(4):618-623.(in Chinese)
[13] DUAN K Y,ZHAO J Z,REN G M,et al.Molecular evolution of infectious pancreatic necrosis virus in China[J].Viruses,2021,13(3):488.
[14] 曾伟伟,王庆,王英英,等.一株鳢科鱼源弹状病毒的分离及鉴定[J].水产学报,2013,37(9):1416-1424. ZENG W W,WANG Q,WANG Y Y,et al.Isolation and characterization of a rhabdovirus from snakehead fish (Ophicephalus striatus)[J].Journal of Fisheries of China,2013,37(9):1416-1424.(in Chinese)
[15] CALLEJA F,GODOY M G,C RCAMO J G,et al.Use of reverse transcription-real time polymerase chain reaction (real time RT-PCR) assays with Universal Probe Library (UPL) probes for the detection and genotyping of infectious pancreatic necrosis virus strains isolated in Chile[J].Journal of Virological Methods,2012,183(1):80-85.
RCAMO J G,et al.Use of reverse transcription-real time polymerase chain reaction (real time RT-PCR) assays with Universal Probe Library (UPL) probes for the detection and genotyping of infectious pancreatic necrosis virus strains isolated in Chile[J].Journal of Virological Methods,2012,183(1):80-85.
[16] BOWERS R M,LAPATRA S E,DHAR A K.Detection and quantitation of infectious pancreatic necrosis virus by real-time reverse transcriptase-polymerase chain reaction using lethal and non-lethal tissue sampling[J].Journal of Virological Methods,2008,147(2):226-234.
[17] 连科迅,赵丽丽,张琳琳,等.传染性胰腺坏死病毒VP2 COE蛋白单克隆抗体的制备与初步应用[J].水产学报,2013,37(8):1229-1235. LIAN K X,ZHAO L L,ZHANG L L,et al.Preparation and preliminary application of monoclonal antibodies against VP2 COE protein of infectious pancreatic necrosis virus[J].Journal of Fisheries of China,2013,37(8):1229-1235.(in Chinese)
[18] 刘立月,刘巍巍,赵丽丽,等.抗传染性胰腺坏死病毒VP3蛋白单克隆抗体的制备[J].淡水渔业,2013,43(3):56-60. LIU L Y,LIU W W,ZHAO L L,et al.Development of monoclonal antibodies against VP3 protein of infectious pancreatic necrosis virus[J].Freshwater Fisheries,2013,43(3):56-60.(in Chinese)
[19] ESPINOZA J C,KUZNAR J.Rapid simultaneous detection and quantitation of infectious pancreatic necrosis virus (IPNV)[J].Journal of Virological Methods,2002,105(1):81-85.
[20] 仇松寅,刘晓飞,景宏丽,等.鲑鳟鱼病毒性疫病现场快速检测发展现状与展望[J].水产科学,2024,43(6):1020-1026. QIU S Y,LIU X F,JING H L,et al.Development and prospect of on-site rapid detection of salmonids viral diseases:a review[J].Fisheries Science,2024,43(6):1020-1026.(in Chinese)
[21] 贺天辉.免疫学检验技术的研究进展[J].中国现代医生,2011,49(6):14-15. HE T H.Research progress of immunological test technology[J].China Modern Doctor,2011,49(6):14-15.(in Chinese)
[22] 张文,徐立蒲,吕晓楠,等.传染性胰脏坏死病毒实时荧光定量RT-PCR检测方法的建立及应用[J].中国动物检疫,2023,40(4):106-113. ZHANG W,XU L P,LÜ X N,et al.Establishment and application of a real-time fluorescence RT-PCR for infectious pancreatic necrosis virus[J].China Animal Health Inspection,2023,40(4):106-113.(in Chinese)
[23] ROBERTS R J,PEARSON M D.Infectious pancreatic necrosis in Atlantic salmon,Salmo salar L[J].Journal of Fish Diseases,2005,28(7):383-390.
[24] MIKALSEN A B,TORGERSEN J,ALESTRÖM P,et al.Protection of Atlantic salmon Salmo salar against infectious pancreatic necrosis after DNA vaccination[J].Diseases of Aquatic Organisms,2004,60(1):11-20.
[25] TAMER C,CAVUNT A,DURMAZ Y,et al.Inactivated infectious pancreatic necrosis virus (IPNV) vaccine and E.coli-expressed recombinant IPNV-VP2 subunit vaccine afford protection against IPNV challenge in rainbow trout[J].Fish &Shellfish Immunology,2021,115:205-211.
[26] CUESTA A,CHAVES-POZO E,DE LAS HERAS A I,et al.An active DNA vaccine against infectious pancreatic necrosis virus (IPNV) with a different mode of action than fish rhabdovirus DNA vaccines[J].Vaccine,2010,28(19):3291-3300.
[27] ZHAO J Z,LI L F,XU L M,et al.Traditional Chinese medicine bufalin inhibits infectious pancreatic necrosis virus genogroups I and V infection in vitro and in vivo[J].Aquaculture,2023,576:739-789.
[28] DOPAZO C P.The infectious pancreatic necrosis virus (IPNV) and its virulence determinants:what is known and what should be known[J].Pathogens,2020,9(2):94.
[29] WILSON M R,VAN RAVENSTEIN E,MILLER N W,et al.cDNA sequences and organization of IgM heavy chain genes in two holostean fish[J].Developmental &Comparative Immunology,1995,19(2):153-164.
[30] 王禹心,李雅鑫,肖俊宇.免疫球蛋白IgM和IgA的分子机制研究进展[J/OL].中国科学:生命科学,2025,55(5):932-947. WANG Y X,LI Y X,XIAO J Y.Recent advances in molecular understanding of IgM and IgA[J].Scientia Sinica(Vitae),2025,55(5):932-947.(in Chinese)
[31] 张琳琳,连科迅,张英,等.传染性胰坏死病毒双抗体夹心ELISA检测方法的建立[J].淡水渔业,2014,44(4):57-62,72. ZHANG L L,LIAN K X,ZHANG Y,et al.Development of a double antibody sandwich ELISA for detection of infectious pancreatic necrosis virus[J].Freshwater Fisheries,2014,44(4):57-62,72.(in Chinese)