云斑尖塘鳢(Oxyeleotris marmorata)和线纹尖塘鳢(O.lineolata)隶属于鲈形目(Percifomes)鰕虎鱼亚目(Gobioidei)塘鳢科(Eletridae)尖塘鳢属(Oxyeleotris),均为肉食性鱼类,因其肉质鲜美,已成为中国引进的名特优淡水养殖品种[1]。云斑尖塘鳢,俗称“泰国笋壳鱼”,原产于东南亚,1986年引入中国并繁育成功,虽然经过多年的选育,但仍然不适合投喂人工配合饲料或冰鲜鱼进行养殖,只能摄食活鱼饵料[2]。线纹尖塘鳢,俗称“澳洲笋壳鱼”,原产于澳大利亚,19世纪末引入中国并繁育成功,该鱼较云斑尖塘鳢温顺,养殖成活率高,可用冰鲜鱼作为饵料进行养殖,较易驯食人工配合饲料[3]。将上述两种鱼杂交,不论正交还是反交,其杂交后代生长速度均表现出典型的超亲杂种优势[4]。但因为线纹尖塘鳢♀×云斑尖塘鳢♂杂交后代体色呈深黑色,且其鳞片表面粗糙,养殖和运输过程中容易受伤,所以养殖推广较少;而云斑尖塘鳢♀×线纹尖塘鳢♂杂交后代因体色呈深黄褐色,有花纹而受到消费者的喜爱,且其鳞片表面光滑,不易受伤,成活率高,并且因其生长具有典型的杂种优势,且较容易转食人工配合饲料,故该种杂交尖塘鳢(Oxyeleotris marmorata♀×O.lineolata♂)养殖规模已占中国尖塘鳢养殖产量的90%以上。云斑尖塘鳢、线纹尖塘鳢及杂交尖塘鳢均为肉食性鱼类,活鱼虾是其最理想的天然饵料。目前,在中国杂交尖塘鳢主要有两种养殖模式,一种是活鱼饵料进行养殖,其成本较高;另一种就是冰鲜饵料进行养殖,在幼鱼阶段用冰鲜丰年虾(Artemia salina),成鱼阶段用冰鲜野杂鱼进行养殖,相对于活鱼饵料其养殖成本大幅度降低,是目前的主要养殖模式。然而,随着养殖规模的逐渐扩大,冰鲜鱼资源减少,价格逐渐增加,且易造成严重的环境污染,严重约束了杂交尖塘鳢养殖业的发展,故有必要开发适合杂交尖塘鳢的人工配合饲料以降低养殖成本并减少环境污染。本团队前期已经开发出了杂交尖塘鳢专用饲料,本研究中拟对开发的人工配合饲料进行养殖效果评估[5]。
生长性能作为鱼类重要的经济性状,直接影响养殖的生产效率和经济效益,而鱼类的生长性能同时受环境和遗传因素的共同作用,其中,饵料的适口性、营养和丰富度作为一种环境因素,对于遗传因素确定的经济鱼类的生长显得尤为重要[6]。鱼类的血液指标值能反映物种的属性和生理状态,是评价鱼体健康状况、营养状况及对环境的适应状况的重要指标[7]。肠道是鱼类重要的消化和吸收器官,对鱼类的生长、健康及病原体的防御至关重要[8],肠道的病变会引起机体其他器官(如肝胰脏)的损伤和功能障碍,进而影响鱼体健康[9]。衡量鱼类肠道健康的指标有肠道组织结构、肠道酶活性及肠道微生物多样性和结构特征等。肠绒毛长度、绒毛宽度及肌层厚度与鱼类肠道的生长发育和吸收能力密切相关[10]。肠道中的酶种类繁多,包括消化酶和抗氧化酶等。其中,胰蛋白酶、脂肪酶及淀粉酶为主要的消化酶类,消化酶活性的高低能够反映鱼体的消化机能水平[11],研究表明,不同饵料对鱼类肠道消化酶活性有重要影响[12]。鱼类的抗氧化系统在修复氧化应激造成的损伤方面起着重要作用,抗氧化酶能够通过清除机体过量的活性氧维持鱼类的健康生长,这是鱼类的一种保护机制[13]。此外,肠道微生物大量存在于肠道中,可将其作为宿主生命活动的重要组成部分,微生物种类及丰度会影响宿主的生长发育、免疫功能和健康水平等方面。本文以杂交尖塘鳢幼鱼为研究对象,分析比较了3种饵料对杂交尖塘鳢生长性能、生理生化、肠道组织结构、肠道酶活性和肠道微生物群落结构及多样性等方面的影响,以期为杂交尖塘鳢的健康养殖、适合人工配合饲料尖塘鳢的选育和人工饲料配方完善提供参考。
1 材料与方法
1.1 材料
试验鱼购自广州锐沣渔业发展有限公司,选择270尾同批繁殖同塘养殖的体长约5.0 cm的杂交尖塘鳢鱼苗,在中国水产科学研究院珠江水产研究所的养殖基地开展试验。
1.2 方法
1.2.1 试验鱼驯食 养殖试验进行前需对饲料组鱼苗驯食,每日喂食两次,第一天投喂冰冻丰年虾与人工配合饲料的混合物,之后每天投喂冰冻丰年虾比列逐渐减少,7 d后只投喂人工配合饲料,并完全摄食即驯食完成。
1.2.2 试验鱼养殖 试验鱼随机分为配合饲料组(S)、冰冻丰年虾组(B)、活鲮鱼(Cirrhinus molitorella)组(H),每组设置3个平行组,每个平行组各放置30尾试验鱼。养殖在100 cm×80 cm×60 cm的养殖箱中,以工厂化循环水养殖,每个养殖箱放置30尾鱼,水温控制在28 ℃±1.5 ℃,每日9:00和18:00两次饱食投喂。配合饲料为杂交尖塘鳢专用人工配合料,配方[5]为秘鲁超级红鱼粉∶秘鲁日本级鱼粉∶豆粕∶淀粉∶ 啤酒酵母∶磷酸二氢钙∶氯化胆碱∶甜菜碱A∶甜菜碱B∶多维∶多矿∶VC 为380∶100∶ 200∶260∶60∶5∶1∶1∶1∶2∶3∶2(质量比)。其他两组不用驯食,分别投喂冰冻丰年虾和活鲮鱼。
1.2.3 营养成分测定 3种饵料的营养成分委托中国广州分析测试中心进行检测,饵料营养成分见表1,因冰冻丰年虾和活鲮鱼所含水分远高于人工配合饲料,故对其进行干物质含量换算,具体换算公式为干物质数值(DM)=湿物质数值(AF)/(1-水分含量)。干物质含量比较,人工配合饲料的粗脂肪含量显著高于冰冻丰年虾和活鲮鱼(P<0.05),冰冻丰年虾中水分及粗灰分含量显著高于人工配合饲料和活鲮鱼(P<0.05),活鲮鱼中粗蛋白质含量显著高于人工配合饲料和冰冻丰年虾(P<0.05)。
表1 3种饵料的一般营养成分
Tab.1 Nutrition facts of three kinds of diets %
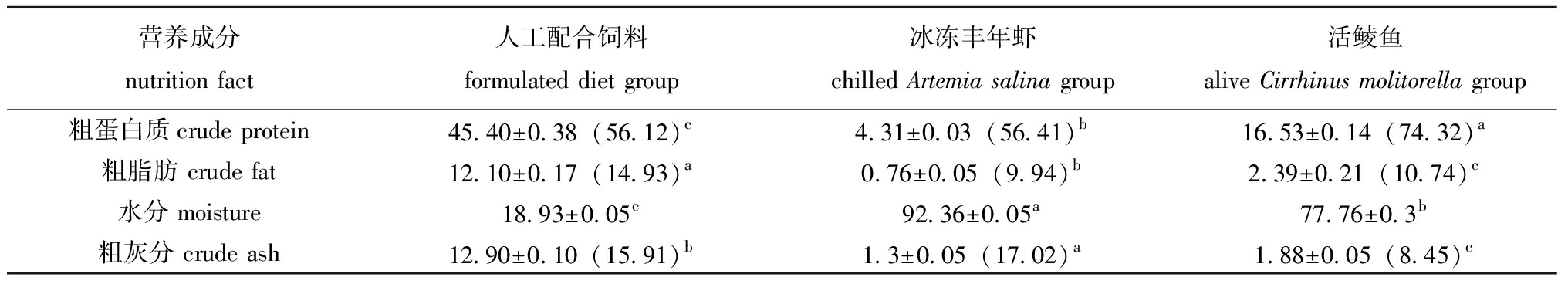
营养成分nutrition fact人工配合饲料formulated diet group冰冻丰年虾chilled Artemia salina group活鲮鱼alive Cirrhinus molitorella group粗蛋白质crude protein 45.40±0.38(56.12)c4.31±0.03(56.41)b16.53±0.14(74.32)a粗脂肪 crude fat12.10±0.17(14.93)a0.76±0.05(9.94)b2.39±0.21(10.74)c水分 moisture18.93±0.05c92.36±0.05a77.76±0.3b粗灰分 crude ash12.90±0.10(15.91)b1.3±0.05(17.02)a1.88±0.05(8.45)c
注:括号中为干物质基础。同行中标有不同字母者表示组间有显著性差异(P<0.05),下同。
Note:Numbers in brackets are dry matter basis.Different letters in the same line indicated significant difference between groups (P<0.05),et sequentia.
1.2.4 试验鱼测量 养殖试验周期为3个月,试验结束后,试验鱼停止投喂24 h后进行取样。每组随机取30尾杂交尖塘鳢(每个养殖箱取10尾),,用100 mg/L的MS-222麻醉,用游标卡尺测量每尾鱼体长(精确度为0.01 cm),分析天平测量每尾鱼的终末体质量(精确度为0.01 g),解剖后测量试验鱼内脏质量和肝脏质量(精确度为0.01 g)。然后采用下列公式计算杂交尖塘鳢的增重率(weight gain rate,WGR,%)、肥满度(condition factor,CF,g/cm3)、脏体比(viscerasomatic index,VSI,%)、肝体比(hepatosomatic index,HSI,%)和饵料系数(feed conversion ration,FCR,%)。
RWGR=(Wt-W0)/W0×100。
(1)
式中:W0为鱼的初始平均体质量(g);Wt为鱼的终末平均体质量(g)。
FCF=Wt/L3×100。
(2)
式中:Wt为鱼的终末平均体质量(g);L为终末平均体长(cm)。
IVSI=Wv/Wb×100。
(3)
式中:Wv为每尾鱼终末内脏质量(g);Wb为每尾鱼终末体质量(g)。
IHSI=Wh/Wb×100。
(4)
式中:Wh为每尾鱼终末肝脏质量(g);Wb为每尾鱼终末体质量(g)。
RFCR=F/(Wt-W0)×100。
(5)
式中:F为总投喂量(g);Wt为鱼的终末平均体质量(g);W0为鱼的初始平均体质量(g)。
1.2.5 血液生化指标的测定 从上述每组取样用的30尾试验鱼中,随机挑选6尾杂交尖塘鳢,用一次性注射器从尾部静脉采血置于离心管中,在4 ℃冰箱中静置2 h后,在4 ℃下以4 000 r/min离心10 min收集血清,使用URIT-8021A全自动生化分析仪(优利特,桂林)检测血液生化指标。
1.2.6 肠道组织形态学 每组随机选取6尾鱼取中肠肠道组织,经多聚甲醛固定24 h、梯度浓度乙醇脱水、二甲苯透明、石蜡包埋切片和苏木精-伊红(H.E.)染色后,在正置显微镜(Axio Scope A1,蔡司,德国)下观察和拍照。使用Image J软件测量记录每张切片上的肠绒毛长度(villi length)、宽度(villi width)和肌层厚度(muscle thickness),比较分析3组鱼肠道组织结构的形态差异。
1.2.7 肠道组织抗氧化功能及消化酶活测定 从上述每组取样用的30尾试验鱼中,随机挑选9尾鱼取其中肠组织置于冻存管后置入液氮速冻,随后转入-80 ℃冰箱中保存备用,用于检测其肠道抗氧化功能和消化酶活性。采用酶联免疫吸附测定法(ELISA)检测过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、淀粉酶(AMS)和胰蛋白酶(TPS),采用FRAP法检测总抗氧化能力(T-AOC),采用WST-8法检测超氧化物歧化酶(SOD)和脂肪酶(LPS)。ELISA试剂盒均购自江莱生物公司,其余试剂盒购自南京建成生物工程研究所,具体测定方法按照试剂盒说明书严格进行。
1.2.8 肠道微生物测序 从上述每组取样用的30尾试验鱼中,分别取10尾试验鱼置于冰盘进行解剖,用灭过菌的解剖剪将肠道剪下,收集肠道内容物,液氮速冻后,转移至-80 ℃超低温冰箱中保存,用于16S rDNA测定。肠道微生物的总DNA使用粪便小量DNA提取试剂盒(OMEGA,USA) 提取,采用Nanodrop 2000检测提取DNA的浓度和纯度。使用通用引物338F(5′ACTCCTACGGGAGGCAGCA 3′)和806R(5′GGACTACHVGGGTWTCTAAT 3′)对样品肠道微生物V3~V4可变区进行PCR扩增并对其产物进行纯化、定量和均一化,形成测序文库,建好的文库先进行文库质检,质检合格的16S rDNA文库采用Illumina NovaSeq测序平台进行高通量测序,测序和分析委托由上海百趣生物医学科技有限公司完成。
采用Trimmomatic v0.33软件对测序结果进行质控,过滤掉接头序列、低质量序列和短读长序列,得到高质量序列;用QIIME 2中的dada 2方法去噪,以100%相似度将序列聚类成为可操作分类单元 ASVs。去除 singletons ASVs,以处理后的数据为基础进行后续分析。
1.3 数据处理
试验数据采用Excel软件进行结果统计,相关数据用平均值±标准误(mean±S.E.)表示,采用 R 软件包对数据进行单因素方差分析(one-way ANOVA)和 t检验分析,显著性水平设为0.05。
2 结果与分析
2.1 不同饵料对杂交尖塘鳢生长性能的影响
不同组别杂交尖塘鳢的生长数据见表2。经过8 d养殖,配合饲料组、冰冻丰年虾组、活鲮鱼组的终末平均体质量分别为25.40、15.14、21.79 g,终末平均体长分别为10.92、9.81、10.39 cm。显著性检验表明,配合饲料组杂交尖塘鳢的终末平均体质量、终末平均体长、增重率和肥满度均显著高于冰冻丰年虾组(P<0.05),与活鲮鱼组无显著性差异(P>0.05),脏体比和肝体比显著高于其他两组(P<0.05),不同饵料组的饵料系数均存在显著性差异(P<0.05),其活鲮鱼组>冰冻丰年虾>配合饲料组。
表2 3种饵料对杂交尖塘鳢生长性能的影响
Tab.2 Effects of three kinds of diets on the growth performance of hybrids (O.marmorata♀×O.lineolata♂)
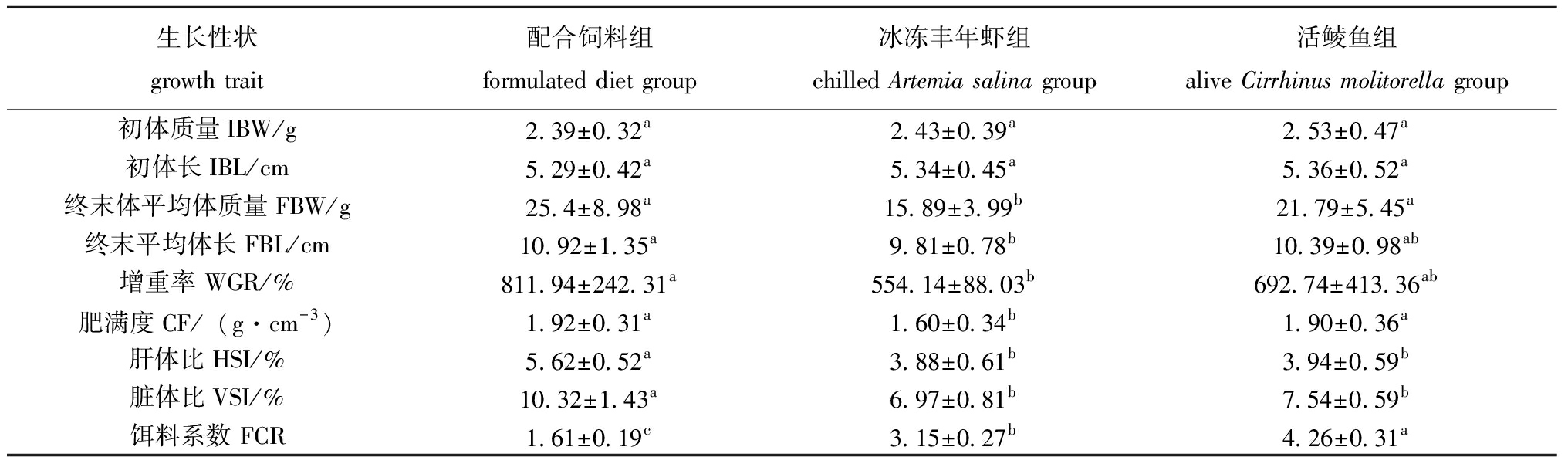
生长性状growth trait配合饲料组formulated diet group冰冻丰年虾组chilled Artemia salina group活鲮鱼组alive Cirrhinus molitorella group初体质量IBW/g2.39±0.32a2.43±0.39a2.53±0.47a初体长IBL/cm5.29±0.42a5.34±0.45a5.36±0.52a终末体平均体质量FBW/g25.4±8.98a15.89±3.99b21.79±5.45a终末平均体长FBL/cm10.92±1.35a9.81±0.78b10.39±0.98ab增重率 WGR/%811.94±242.31a554.14±88.03b692.74±413.36ab肥满度CF/(g·cm-3)1.92±0.31a1.60±0.34b1.90±0.36a肝体比HSI/%5.62±0.52a3.88±0.61b3.94±0.59b脏体比VSI/%10.32±1.43a6.97±0.81b7.54±0.59b饵料系数 FCR1.61±0.19c3.15±0.27b4.26±0.31a
2.2 摄食3种饵料杂交尖塘鳢血液生化指标差异分析
各组杂交尖塘鳢血液生化指标数据如图1所示。
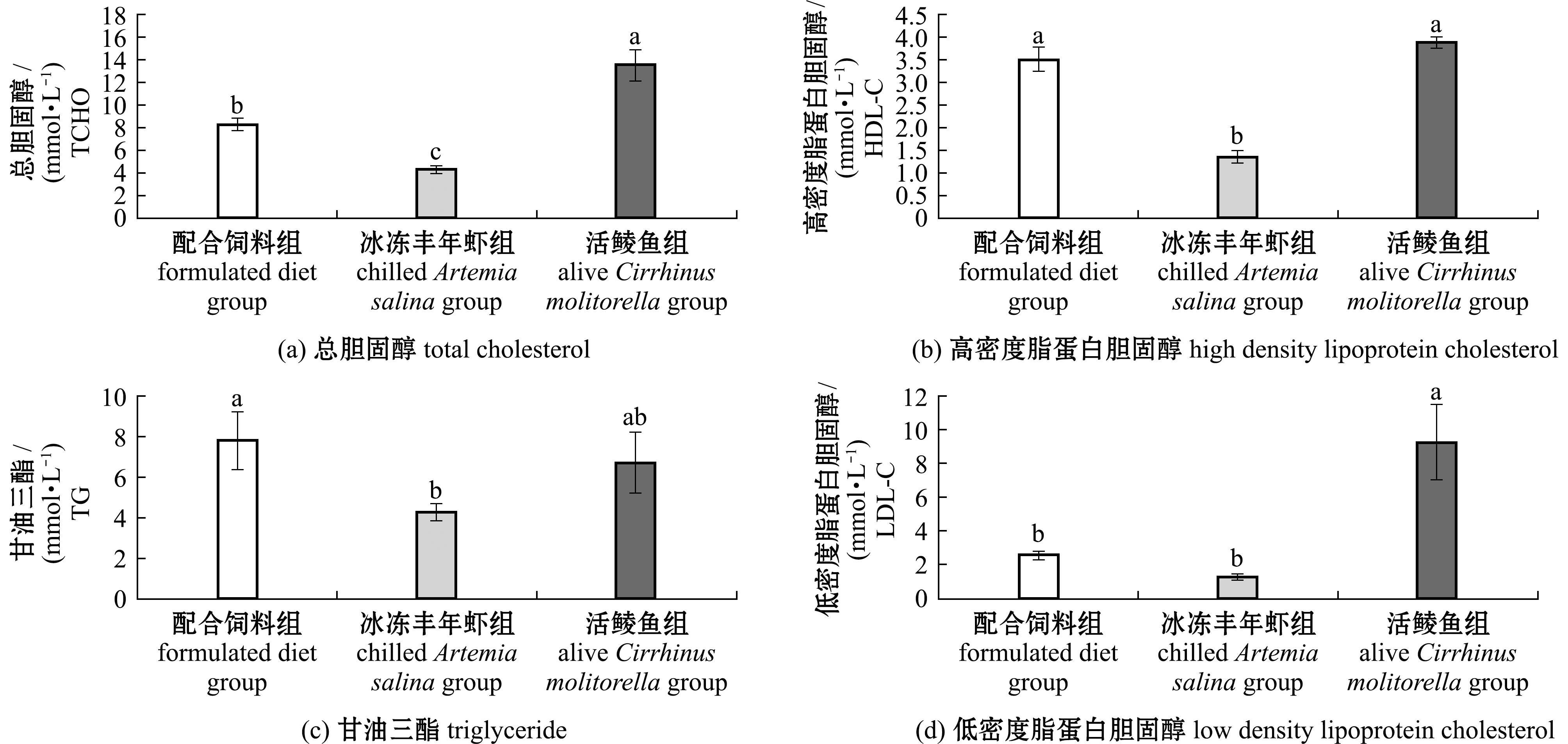
不同字母表示组间有显著性差异(P<0.05)。
Different letters represent significant difference amongthe groups(P<0.05).
图1 3种饵料组杂交尖塘鳢血液生化指标
Fig.1 Blood index of hybrids (O.marmorata♀×O.lineolata♂) in three experimental groups fed on different kinds of diets
总胆固醇(TCHO)含量活鲮鱼组>配合饲料组>冰冻丰年虾组,3组间均存在显著性差异(P<0.05)。配合饲料组鱼血液中甘油三酯(TG)和高密度脂蛋白胆固醇(HDL-C)含量显著高于冰冻丰年虾组(P<0.05),但与活鲮鱼组无显著性差异(P>0.05),而低密度脂蛋白胆固醇(LDL-C)含量显著低于活鲮鱼组(P<0.05),但与冰冻丰年虾组无显著性差异(P>0.05)。
2.3 3种饵料对杂交尖塘鳢肠道组织形态学的影响
摄食3种饵料杂交尖塘鳢的肠道组织形态结构如图2所示。肠绒毛数据统计结果如图3所示。从图3可见,活鲮鱼组杂交尖塘鳢的肠绒毛长度显著高于冰冻丰年虾组(P<0.05),但两组均与配合饲料组无显著性差异(P>0.05)。3组鱼肠绒毛宽度无显著性差异(P>0.05)。而在肌层厚度上,配合饲料组和活鲮鱼组无显著性差异(P>0.05),但均显著高于冰冻丰年虾组(P<0.05)。
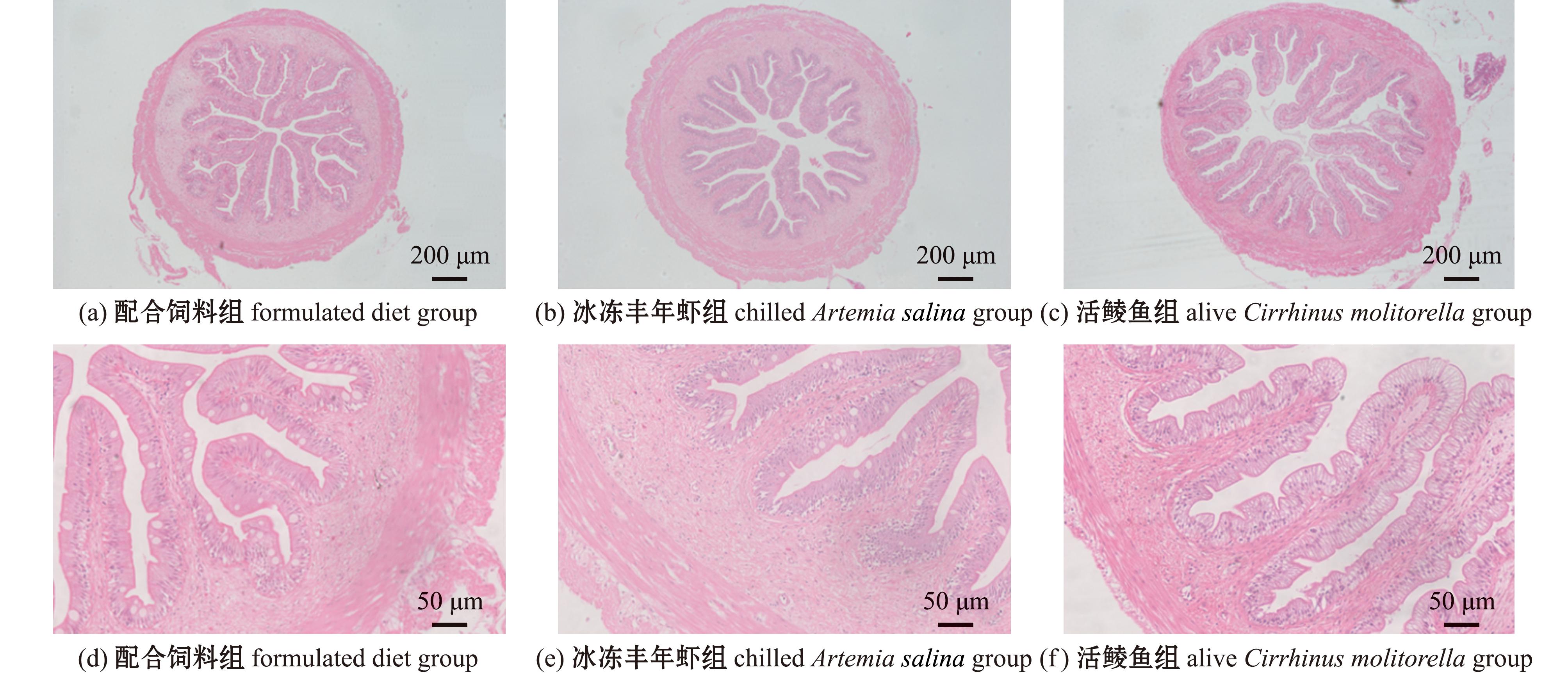
图2 3种饵料投喂杂交尖塘鳢肠道组织形态结构
Fig.2 Morphological structure of intestinal tissues of hybrids (O.marmorata♀×O.lineolata♂) fed on three kinds of diets
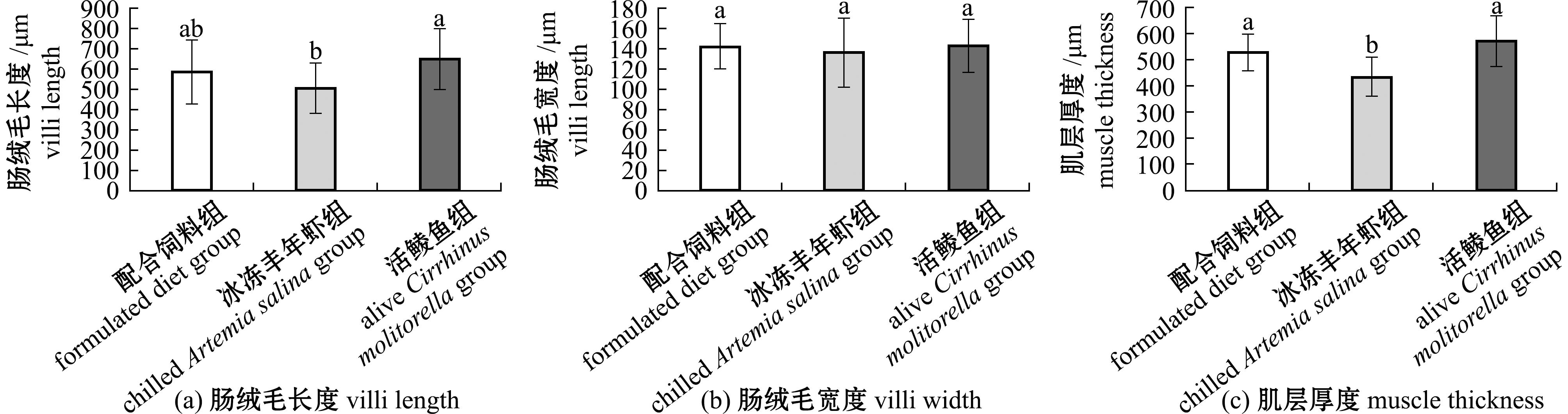
图3 不同饵料投喂杂交尖塘鳢的肠道形态指标
Fig.3 Intestinal morphology of hybrids (O.marmorata♀×O.lineolata♂) fed on different diets
2.4 3种饵料对杂交尖塘鳢肠道抗氧化功能的影响
摄食3种饵料的杂交尖塘鳢肠道抗氧化功能分析结果表明(图4),配合饲料组和冰冻丰年虾组的杂交尖塘鳢肠道中SOD活性无显著性差异(P>0.05),但冰冻丰年虾组显著高于活鲮鱼组(P<0.05);而摄食3种饵料的杂交尖塘鳢肠道中T-AOC 3组间无显著性差异(P>0.05),从大到小依次为配合饲料组>冰冻丰年虾组>活鲮鱼组;冰冻丰年虾组的杂交尖塘鳢肠道中CAT活性显著高于配合饲料组和活鲮鱼组(P<0.05)。
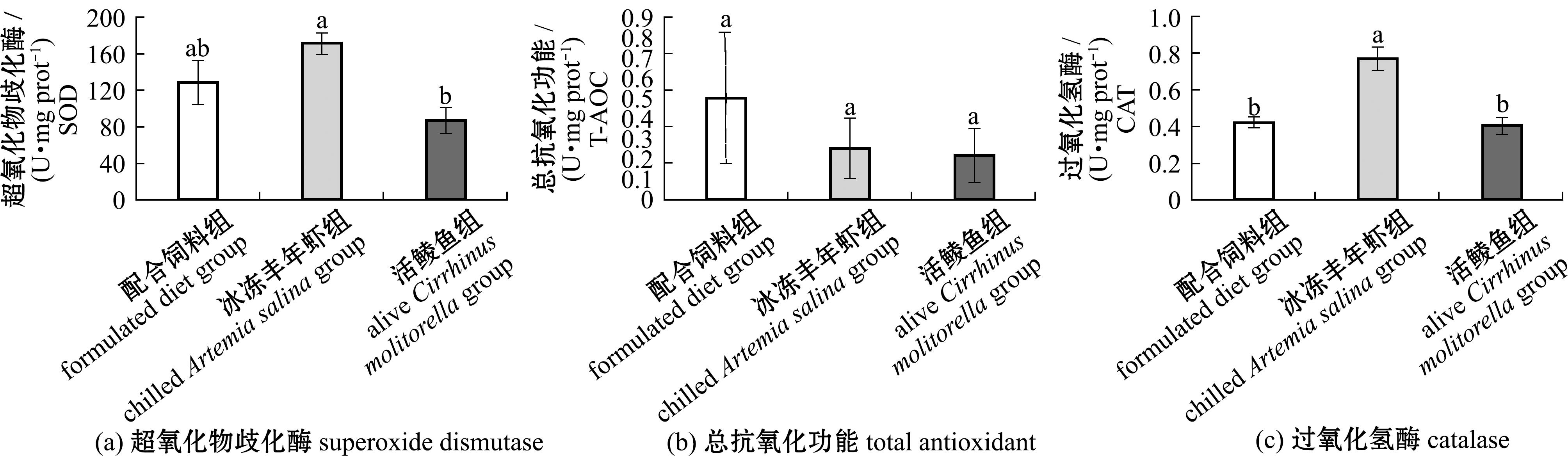
图4 摄食3种饵料杂交尖塘鳢的肠道抗氧化功能
Fig.4 Antioxidant function in the intestinal tract of hybrids (O.marmorata♀×O.lineolata♂) feeding on three different diets
2.5 3种饵料对杂交尖塘鳢肠道消化酶活性的影响
摄食3种饵料的杂交尖塘鳢肠道消化酶活性分析结果表明(图5),配合饲料组和活鲮鱼组肠道中LPS活性显著低于冰冻丰年虾组(P<0.05);配合饲料组杂交尖塘鳢肠道中AMS活性显著高于冰冻丰年虾组和活鲮鱼组(P<0.05)。3组杂交尖塘鳢肠道中TPS活性无显著性差异(P>0.05)。
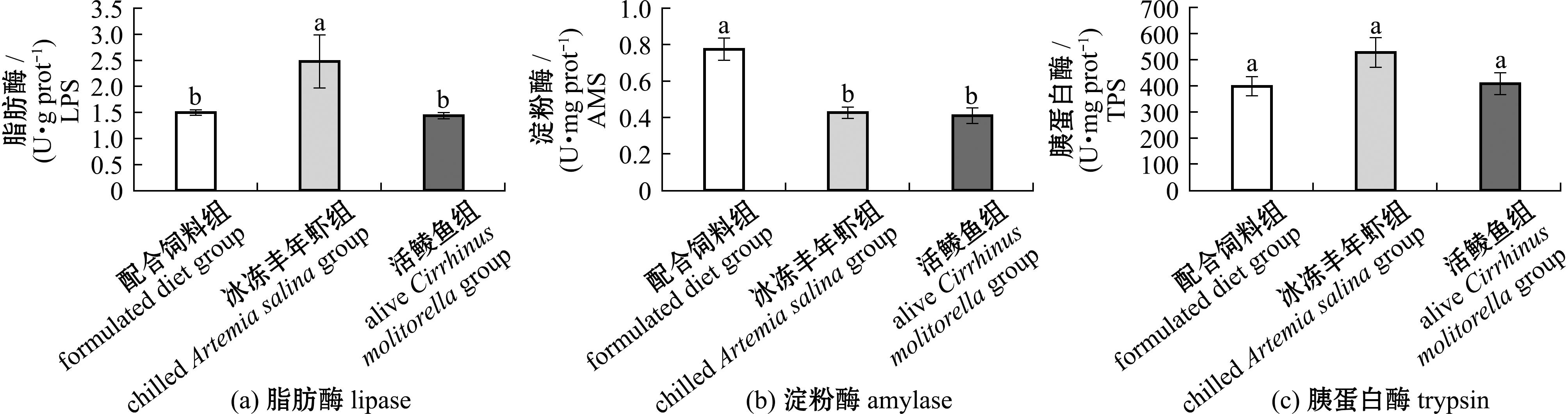
图5 不同饵料投喂杂交尖塘鳢的肠道酶活指标
Fig.5 Intestinal digestive enzyme activities in hybrids (O.marmorata♀×O.lineolata♂) fed on different diets
2.6 摄食3种饵料杂交尖塘鳢肠道微生物多样性和菌群结构分析
2.6.1 肠道微生物多样性特征分析 通过对3个饵料组共9个杂交尖塘鳢肠道样品的16S rDNA测序,共获得624 712条序列,平均每个样品有69 412条序列,计算得出各样品的alpha多样性指数(表3)。其中,配合饲料组杂交尖塘鳢肠道微生物的香农指数(Shannon)和均匀度指数(pielou-e)显著高于冰冻丰年虾组和活鲮鱼组(P<0.05),表明配合饲料组肠道微生物的多样性显著高于其他两组(P<0.05)。另外,Chao1指数和Simpson指数在3组间虽无显著性差异(P>0.05),但配合饲料组数值最高,可进一步证明其肠道微生物多样性相对较高。
表3 肠道微生物alpha多样性指数差异检验
Tab.3 Difference test of alpha diversity index of intestinal microbiota

指数 index配合饲料组 formulated diet group冰冻丰年虾组 chilled Artemia salina group活鲮鱼组 alive Cirrhinus molitorella groupChao1指数 Chao1 index619.65±221.58a413.56±17.45a441.80±30.08aShannon指数 Shannonindex5.54±0.41a3.90±0.42b3.79±0.89bSimpson指数 Simpson index0.93±0.02a0.74±0.05a0.75±0.15a均匀度指数 pielou-e index0.60±0.01a0.45±0.04b0.42±0.09b
将肠道微生物的测序结果进行主成分分析(PCoa)得到β多样性(图6),第一主成分(PCoA1)和第二主成分(PCoA2)的贡献率分别为32.28%和23.87%。不同饵料组杂交尖塘鳢肠道微生物样品聚类在不同的象限且明显分开,配合饲料组的样品聚集于第一象限,冰冻丰年虾组的样品聚集在第四象限,活鲮鱼组的样品聚集于第二象限,表明不同饵料对杂交尖塘鳢肠道菌群多样性有显著影响。
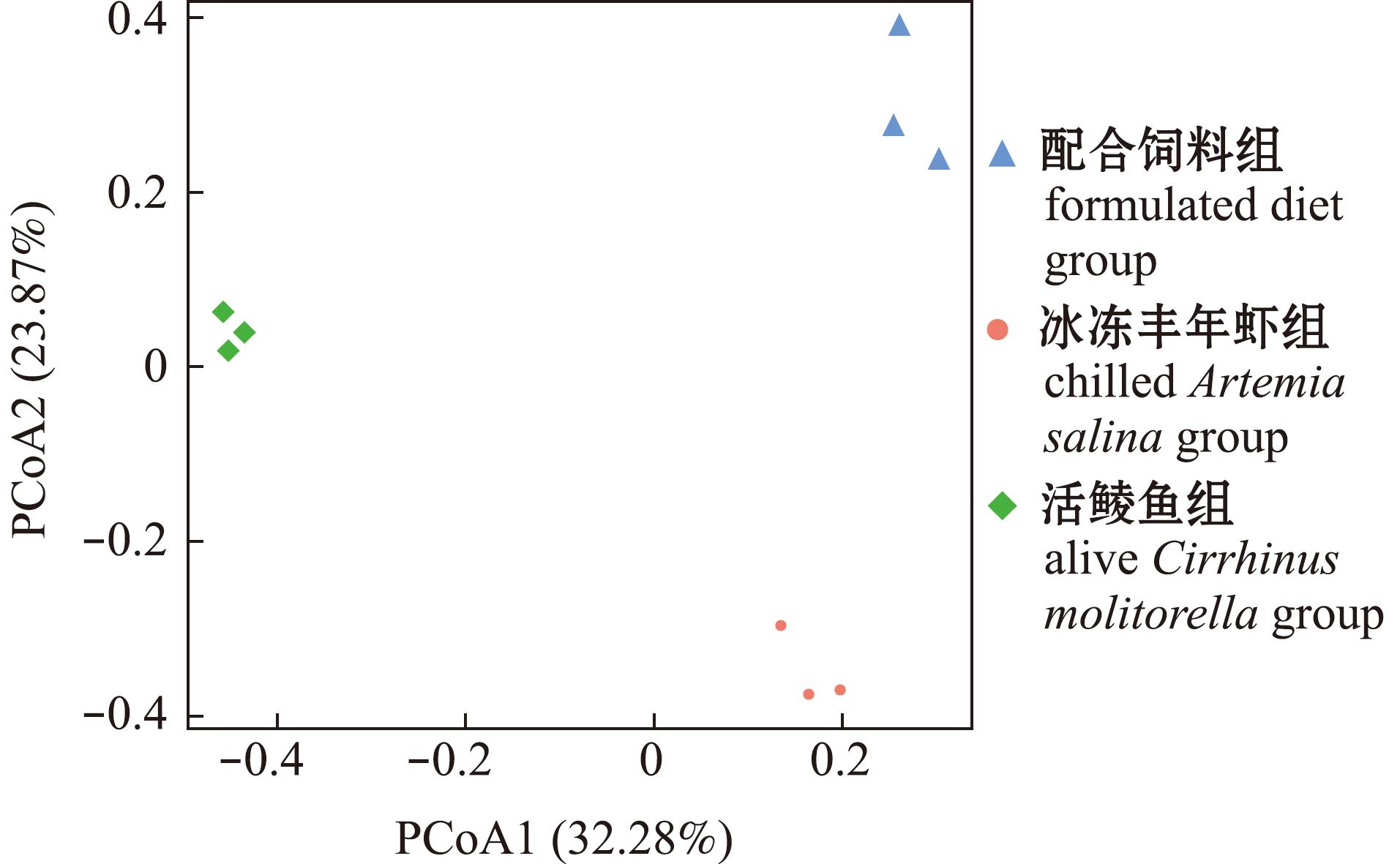
图6 PCoA分析
Fig.6 PCoA analysis
通过对测序得到的有效序列聚类后共得到6 353个ASVs,绘制韦恩图(图7),在各组别中ASV数量的从高到低依次为配合饲料组>活饵组>冰冻丰年虾组,分别为1 266、796和733个,说明配合饲料组的杂交尖塘鳢肠道微生物多样性最多,冰冻丰年虾组最低。配合饲料组、冰冻丰年虾组和活饵组独有的ASV数量分别为817、353和287个。3个饵料组的共有ASV数量为274个,占总ASV数量的9.8%。
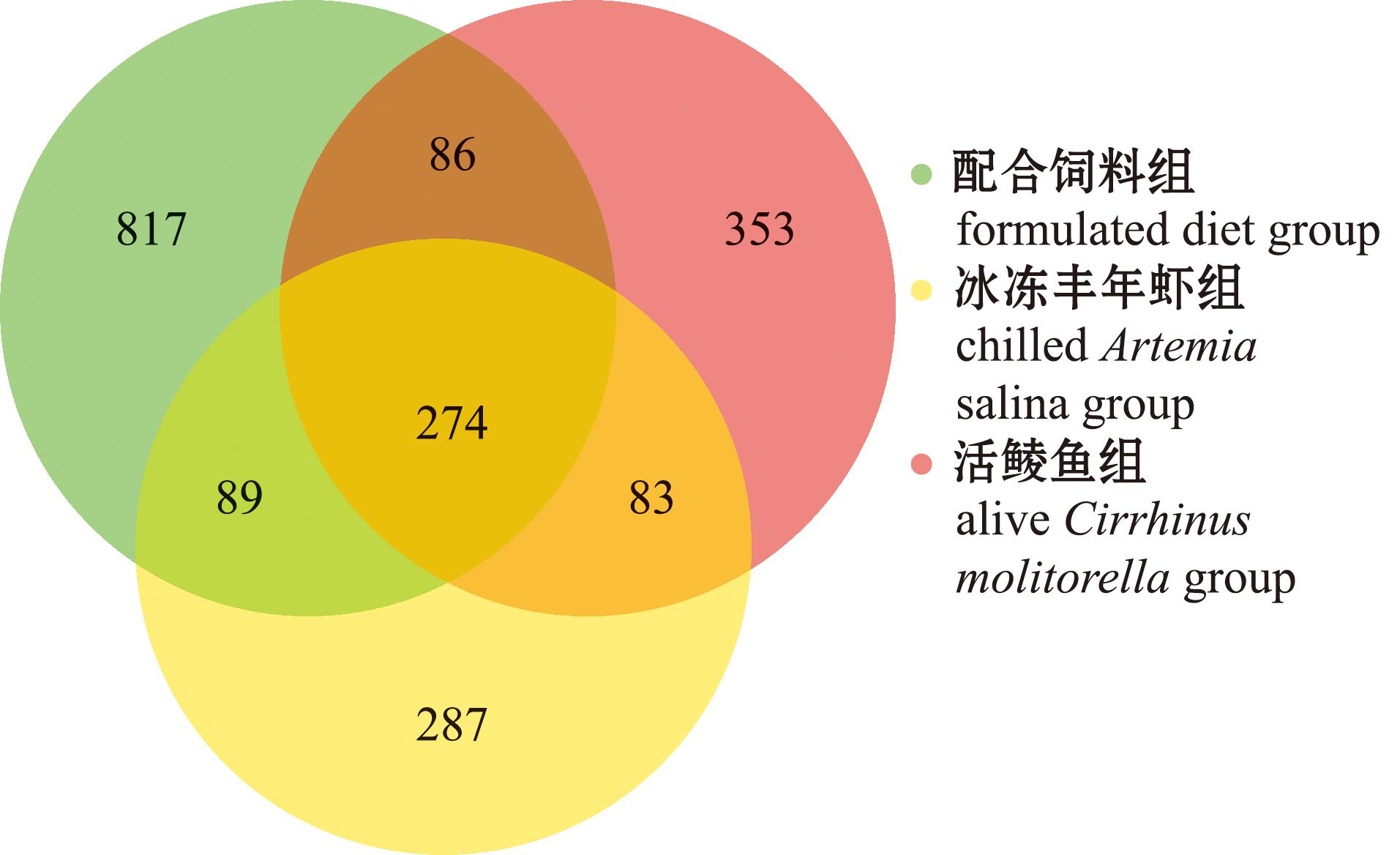
图7 ASV韦恩图
Fig.7 ASV Venn diagram
2.6.2 3种饵料对杂交尖塘鳢肠道微生物结构的影响 在门水平下,3组鱼肠道微生物结构组成如图8(a) 所示,厚壁菌门为不同饵料组的共同优势菌,其在配合饲料组、冰冻丰年虾组肠道中的相对丰度分别为39.99%和44.98%,而在活鲮鱼组中的相对丰度高达94.13%,显著高于配合饲料组和冰冻丰年虾组(P<0.05)。此外,配合饲料组杂交尖塘鳢肠道中变形菌门(Proteobacteria)的相对丰度最高(44.29%),且显著高于其他两组(P<0.05)。冰冻丰年虾组杂交尖塘鳢肠道中梭杆菌门(Fusobacteriota)的相对丰度最高(41.25%),且显著高于其他两组(P<0.05)。而活鲮鱼组中厚壁菌门为绝对优势菌。在属水平下,各组肠道微生物结构组成如图8(b) 所示,不同饵料组杂交尖塘鳢肠道的相对丰度超过2%的共同优势菌为邻单胞菌属(Plesiomonas)、狭义梭菌属1(Clostridium_sensu_stricto_1)及和罗氏菌属(Romboutsia)4个属。配合饲料组肠道中的邻单胞菌属相对丰度显著高于冰冻丰年虾组和活饵组(P<0.05);相较于配合饲料组,冰冻丰年虾组肠道中鲸杆菌相对丰度显著升高(P<0.05),而活鲮鱼组中未检测到鲸杆菌属或其相对丰度过低,活鲮鱼组肠道中的狭义梭菌属和罗氏菌属的相对丰度均显著高于配合饲料组和冰冻丰年虾组(P<0.05)。与冰冻丰年虾组和活鲮鱼组相比,配合饲料组的优势菌种类更丰富,其肠道中相对丰度达到2%的微生物有9种,而冰鲜组只有4种,活鲮鱼组有5种。试验结果表明,投喂人工配合饲料更有利于肠道平衡,有利于杂交尖塘鳢的健康生长。
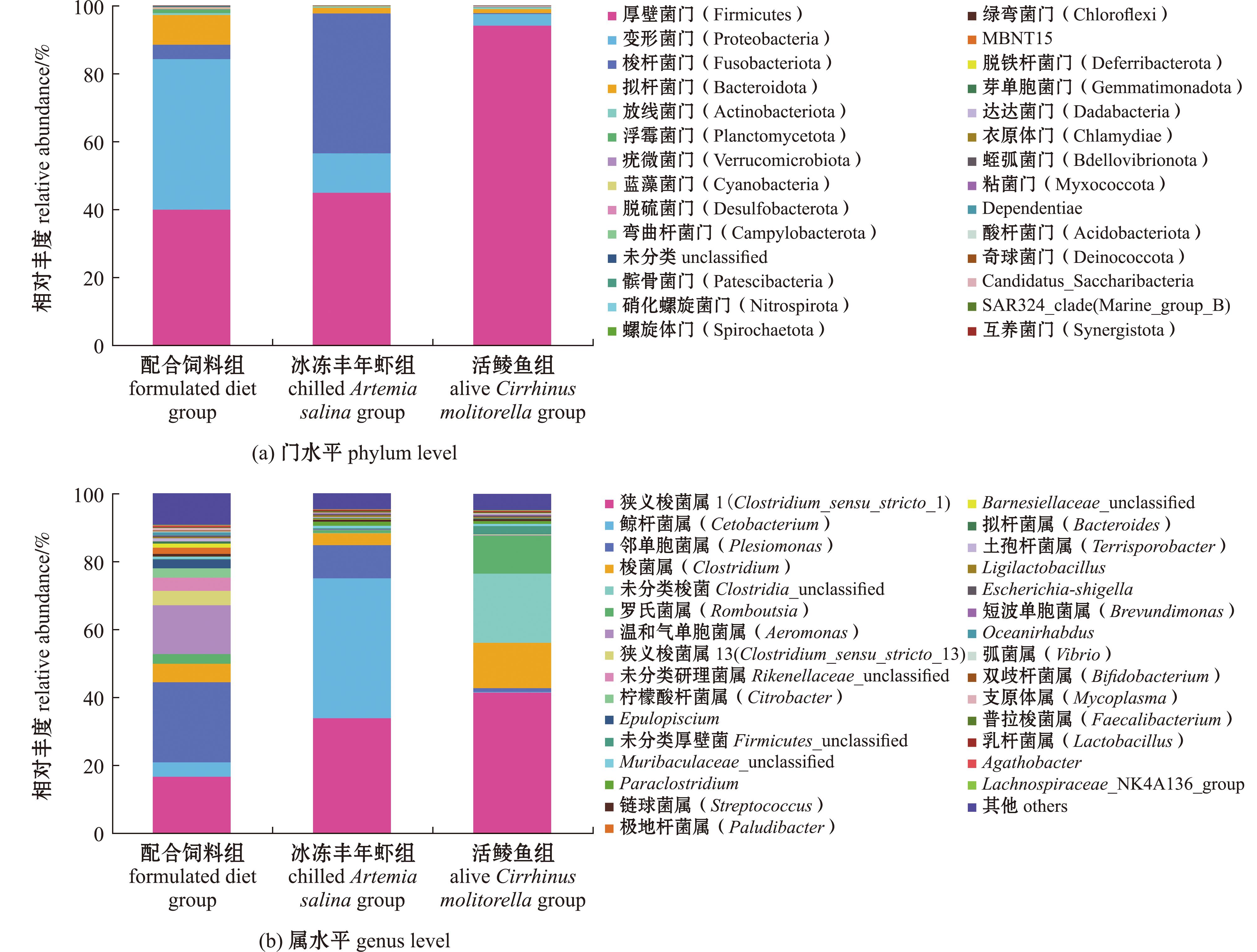
图8 摄食3种饵料杂交尖塘鳢在门和属水平的肠道菌群组成结构
Fig.8 Relative abundance of microbiota at the phylum and genus levels for hybrids(O.marmorata♀×O.lineolata♂) feeding on three different diets
3 讨论
3.1 3种饵料对杂交尖塘鳢生长的影响
生长是养殖鱼类重要的经济性状之一,养殖群体的生长速度与产量密切相关,直接影响渔民的经济效益,其受到包括温度、食物和遗传等多重因素调控[14]。杂交尖塘鳢为肉食性鱼类,与传统投喂活饵料鱼的养殖模式相比,人工配合饲料代替活饵料鱼不仅可以大幅减少肉食性鱼类养殖的成本,还可以建立标准的工厂化养殖模式[15]。在本研究中,以杂交尖塘鳢幼鱼为研究对象,在相同养殖环境中分别投喂人工配合饲料、冰冻丰年虾及活鲮鱼进行养殖,以比较分析不同饵料对其生长性能的影响。研究结果表明,配合饲料组的杂交尖塘鳢的终末平均体质量、终末平均体长和增重率均最高,与活饵组无显著性差异,但显著高于冰冻丰年虾组(P<0.05)。虽然摄食人工配合饲料组生长性能最好,但其脏体比和肝体比却显著高于其他两组(P<0.05)。而对杂交鳜(Siniperca chuatsi♀×S.scherzeri♂)和大口黑鲈(Micropterus salmoides)的研究结果与本文不同,摄食活饵鱼的杂交鳜和摄食冰鲜鱼的大口黑鲈终末体质量显著高于摄食人工饲料的鱼(P<0.05)。钟立强等[16]以配合饲料、冰鲜鱼及混合投喂养殖大口黑鲈,结果表明,配合饲料组终末体质量、终末平均体长、增重率和肥满度均显著低于冰鲜组,这可能是人工配合饲料仍然不是这两种肉食性鱼类的最佳饵料选择,摄食人工配合饲料后其生长性能仍然不如摄食天然的肉食性饵料;或者其人工配合饲料配方还不能满足这两种肉食性鱼类的营养需求。而本研究结果表明,杂交尖塘鳢比杂交鳜和大口黑鲈更容易被人工配合饲料驯化,其原因可能是不同鱼种类对饲料中脂肪的适应性不同,推测杂交尖塘鳢更能适应高脂肪水平饲料,能将饲料中的脂肪消化利用吸收,而杂交鳜和大口黑鲈可能对饲料中脂肪水平利用率较差。但杂交尖塘鳢与杂交鳜和大口黑鲈研究相似,即配合饲料组的肝体比和脏体比显著高于冰鲜组,其原因可能是本研究所用饲料脂肪含量显著高于冰冻丰年虾及活鲮鱼,杂交尖塘鳢生长较好,但却引起其肝体比及脏体比指数显著升高。与其他两组相比,配合饲料组杂交尖塘鳢饵料系数最低仅为1.61,Ma等[17]以配合饲料和饵料鱼投喂大口黑鲈,结果表明,配合饲料组的饵料系数显著低于饵料鱼组。邵俊杰等[18]以配合饲料和冰鲜鱼投喂大口黑鲈,结果显示,配合饲料组的饵料系数显著低于冰鲜鱼组。以上研究结果均与本论文相似,表明杂交尖塘鳢对人工配合饲料的利用转化率极高,而冰冻丰年虾组和活鲮鱼组的饵料系数为3.15和4.26,其原因可能是冰冻丰年虾和活鲮鱼的水分含量较高(92.36%,77.76%),杂交尖塘鳢对其利用转化率较低。研究表明,目前的杂交尖塘鳢人工配合饲料可能对其健康状况还存在一定负面影响,长期投喂脂肪含量高的饲料可能会导致鱼类脂肪肝,故后续有必要对目前的杂交尖塘鳢饲料配方进行改良完善,开发出合适比例脂肪水平且营养丰富的人工饲料,既能促进杂交尖塘鳢生长,又能降低肝体比,确保杂交尖塘鳢健康养殖。
3.2 3种饵料对杂交尖塘鳢血液生化指标的影响
血液生化指标可反映鱼体生理状况、健康状况及营养水平等,如CHO和TG水平可以用作水生生物脂质代谢状态的指标[19],HDL驱动内源性胆固醇逆向转运至肝外组织细胞,被称为“血管清道夫”[20]。其可以将血液中过量的CHO代谢,抑制血管炎症,阻碍血管内斑块形成,降低心血管疾病发生的危险[21]。本研究中,配合饲料组和活鲮鱼组血液中的TG和HDL-C水平显著高于冰冻丰年虾组,但配合饲料组和活鲮鱼组间无显著性差异,表明在干质量水平上,虽然配合饲料组所用的人工配合饲料脂肪含量最高,但配合饲料组杂交尖塘鳢能将摄食的高脂肪水平饲料进行有效消化、吸收和利用,使配合饲料组血液中TG水平仍与活鲮鱼组鱼接近,脂肪代谢未出现明显异常;另一方面,引起冰冻丰年虾组鱼生长较慢的原因有可能是冰冻丰年虾中脂肪含量最少,不能满足杂交尖塘鳢的能量和营养需求,推测只摄食脂肪水平较低的冰冻丰年虾可能会引起杂交尖塘鳢营养不足,脂肪代谢出现异常。
另外,LDL-C的作用是将胆固醇从肝脏转运至外周组织进行利用,或堆积于血管壁上,被视为“坏”胆固醇[22]。本研究中,配合饲料组和冰冻丰年虾组杂交尖塘鳢血液中LDL-C水平较活鲮鱼组杂交尖塘鳢显著下降。推测投喂人工配合饲料和冰冻丰年虾的脂肪成分中LDL-C水平较低,就此处来说可能比活鲮鱼的成分更有利于杂交尖塘鳢的健康。而血液中胆固醇含量能够在一定程度上反映机体肝脏的健康程度,当机体肝脏损伤时血液中胆固醇的含量往往会升高[23]。在本研究中,3组血液中TCHO水平均存在显著性差异,活鲮鱼组最高,其次是配合饲料组,冰冻丰年虾组最低,进一步说明了投喂人工配合饲料和冰冻丰年虾可以降低血液中TCHO水平,维护其肝脏健康。
3.3 3种饵料对杂交尖塘鳢消化酶活性的影响
肠道消化酶活性是衡量鱼类消化和吸收饲料能力的重要指标,消化酶活性反映了鱼类利用营养物质的能力,是衡量其消化功能的重要指标之一[24],主要分为蛋白酶、脂肪酶和淀粉酶等。本研究中配合饲料组和活鲮鱼组杂交尖塘鳢肠道LPS活性显著低于冰冻丰年虾组(P<0.05),而配合饲料组杂交尖塘鳢肠道中AMS活性显著高于冰冻丰年虾组和活鲮鱼组,TPS活性3组间均无显著性差异(P>0.05)。班赛男等[25]研究表明,不同饵料对翘嘴鳜消化酶活性有显著性影响,冰鲜组翘嘴鳜肠道的LPS活性显著高于配合饲料组和活饵组(P<0.05),AMS活性则是配合饲料组最高,这与本文研究结果相似。有趣的是,冰冻丰年虾本身成分中脂肪含量最低,但其LPS活性与其他两组相比却最高,其原因可能是冰冻丰年虾中缺乏营养,引起了机体的损伤,导致LPS活性增高,具体原因还需进一步研究。而AMS活性升高推测是因为活鲮鱼和冰冻丰年虾属于动物性饵料,而人工配合饲料需要加入一定量淀粉作为黏合剂,所以配合饲料组中肠道AMS活性增加,可以有效地消化分解饲料中的淀粉。赖铭勇[26]以人工配合饲料替代传统活饵料鱼投喂斑鳜,结果表明,配合饲料组斑鳜肠道TPS活性显著低于活饵组。其研究结果与本文不同,虽然人工配合饲料在粗蛋白质含量方面显著低于冰冻丰年虾和活鲮鱼,但配合饲料组肠道中TPS活性却与其他两组无显著性差异(P>0.05),其原因可能是人工配合饲料中的蛋白对于杂交尖塘鳢来说更难消化,故机体需要提高TPS活性对其消化利用吸收,而冰冻丰年虾和活鲮鱼所含蛋白更容易被消化吸收。
3.4 3种饵料对杂交尖塘鳢肠道微生物多样性的影响
肠道微生物是指寄居在动物肠道内的微生物群落,与宿主为共生关系,对于宿主的生理功能和健康状态起着至关重要的作用。有研究表明,肠道微生物多样性与宿主的生长、健康及代谢能力密切相关,肠道微生物多样性高说明肠道功能的稳定性高,宿主的抗病能力强[27]。在本研究中,3种饵料对杂交尖塘鳢肠道微生物alpha多样性有显著性影响,与活鲮鱼组和冰冻丰年虾组相比,配合饲料组的Chao1、Simpson、Shannon和pielou-e 4个指数均最高,其中Shannon和pielou-e指数则显著高于活鲮鱼组和冰冻丰年虾组,而Chao1和Simpson指数在3组间无显著性差异,均可说明配合饲料组肠道微生物多样性和丰富度最好。有研究表明,以配合饲料和饵料鱼饲喂鳜,配合饲料组肠道微生物的Chao1指数与 Simpson指数均显著高于活饵组[28]。大口黑鲈由丰年虫转食饲料后,配合饲料组的鱼肠道中Chao1指数、Simpson指数等高于丰年虫组[29],上述研究结果与本研究结果相似,作为肉食性经济鱼类,杂交尖塘鳢经过科学驯化和选育,同时开发适口的人工配合饲料,可以使其对人工配合饲料具有较好的适应性,同时提高了肠道菌群多样性,这也可能是其生长较快的原因。
3.5 3种饵料对杂交尖塘鳢肠道微生物组成的影响
鱼类肠道中存在一定数量对鱼体生长和免疫具有促进作用的优势菌群,能够维持肠道正常平衡,在一定条件下能够抵制不良环境的影响[21]。在本研究中,厚壁菌门为3组的共同优势菌,且为活鲮鱼组的绝对优势菌,而厚壁菌门相对丰度的升高表明机体对蛋白质和碳水化合物的吸收增多[30],推测厚壁菌门在杂交尖塘鳢健康生长方面具有重要影响。除厚壁菌门外,配合饲料组拟杆菌门和变形菌门的相对丰度均显著高于冰冻丰年虾组和活鲮鱼组(P<0.05),研究表明,变形菌门、拟杆菌门和厚壁菌门在鱼类生长中起着重要作用,拟杆菌门可以产生多糖水解酶,其可以有效降解膳食纤维进而产生单糖和短链脂肪酸(SCFA),是肠道内壁细胞基本代谢的能量来源之一[31],拟杆菌门丰度也被研究者认为是评价动物机体肥胖程度的重要指标[32],而变形菌门被证明可参与鱼类碳、氮、硫的代谢和循环[33],这可能是配合饲料组杂交尖塘鳢生长较快的原因之一。而在冰冻丰年虾组中,梭杆菌门的相对丰度达到41.25%,显著高于其他两组(P<0.05)。目前,对于梭杆菌门的功能研究较少,但有研究发现它可以激活宿主的炎症反应[34],提示投喂冰冻丰年虾可能会导致杂交尖塘鳢肠道炎症的产生。
4 结论
1)投喂人工配合饲料组杂交尖塘鳢的生长速度较快、饲料系数最低,还可以降低血液中低密度脂蛋白胆固醇和总胆固醇含量、提高肠道超氧化物歧化酶活性和提高肠道微生物多样性等,说明杂交尖塘鳢对人工配合饲料有较强的适应性。
2)投喂人工配合饲料组杂交尖塘鳢肝体比、脏体比显著升高,且其肠道有益菌丰度下降,故仍需对现有的杂交尖塘鳢人工配合饲料配方进行优化,解决全人工配合饲料饲养杂交尖塘鳢这一制约产业发展的关键问题。
[1] 林明辉,朱华平,苏换换,等.3个尖塘鳢引进群体繁育后代的遗传多样性分析[J].南方农业学报,2021,52(1):213-220.
LIN M H,ZHU H P,SU H H,et al.Genetic diversity analysis among offspring stocks of three imported Oxyeleotris populations by microsatellite markers[J].Journal of Southern Agriculture,2021,52(1):213-220.(in Chinese)
[2] 骆明飞,罗俊标,张建东,等.不同杂交组合尖塘鳢形态性状和生产性能的比较研究[J].河北渔业,2016(8):1-9,43.
LUO M F,LUO J B,ZHANG J D,et al.Comparative studies on morphological traits and production performance of different hybrid combinations of the Marble Goby (Oxyeleotris)[J].Hebei Fisheries,2016(8):1-9,43.(in Chinese)
[3] 李春枝,李敏,黄永强,等.云斑尖塘鳢♀×线纹尖塘鳢♂杂交育种的初步研究[J].水产养殖,2010,31(9):30-32.
LI C Z,LI M,HUANG Y Q,et al.Hybridization breeding between Oxyeleotris marmoratus(♀) and Oxyeleotris lineolatus(♂)[J].Journal of Aquaculture,2010,31(9):30-32.(in Chinese)
[4] 李敏,李春枝,黄永强,等.云斑尖塘鳢和线纹尖塘鳢自交与杂交子一代幼鱼生长性状及杂交优势分析[J].广东海洋大学学报,2012,32(1):64-67.
LI M,LI C Z,HUANG Y Q,et al.Comparative study on juvenile growth and heterosis of Oxyeleotris marmoratus,O.lineolatus and the hybridization (O.marmoratus♀ × O.lineolatus♂)[J].Journal of Guangdong Ocean University,2012,32(1):64-67.(in Chinese)
[5] 樊佳佳,马冬梅,朱华平,等.杂交尖塘鳢人工繁殖及饲料驯化技术要点[J].科学养鱼,2022(4):9-10.
FAN J J,MA D M,ZHU H P,et al.Technical points of artificial propagation and feed domestication of (O.marmorata♀×O.lineolata♂)[J].Scientific Fish Farming,2022(4):9-10.(in Chinese)
[6] 殷艳慧,蒋万胜,潘晓赋,等.水产养殖鱼类生长性状研究进展[J].中国水产科学,2020,27(4):463-484.
YIN Y H,JIANG W S,PAN XF,et al.Recent progress in growth trait of aquaculture fish[J].Journal of Fishery Sciences of China,2020,27(4):463-484.(in Chinese)
[7] 周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
ZHOU Y,GUO WC,YANG Z G,et al.Advances in the study of haemotological indices of fish[J].Journal of Shanghai Fisheries University,2001,10(2):163-165.(in Chinese)
[8] SCHUG H,YUE Y,KRESE R,et al.Time and concentration-dependent expression of immune and barrier genes in the RT gut GC fish intestinal model following immune stimulation[J].Fish &Shellfish Immunology,2019,88:308-317.
[9] 米海峰,孙瑞健,张璐,等.鱼类肠道健康研究进展[J].中国饲料,2015(15):19-22.
MI H F,SUN R J,ZHANG L,et al.Review on the intestinal health of fish[J].China Feed,2015(15):19-22.(in Chinese)
[10] 黄仁善,钟纯怡,张帝,等.不同大口黑鲈群体生长性能、肌肉营养成分、肠道形态结构及菌群组成的比较研究[J].动物营养学报,2024,36(2):1158-1172.
HUANG R S,ZHONG C Y,ZHANG D,et al.Comparative study on growth performance,muscle nutrients,intestinal morphology and structure and microflora composition of different largemouth bass (Micropterus salmoides) populations[J].Chinese Journal of Animal Nutrition,2024,36(2):1158-1172.(in Chinese)
[11] 吕云云.浒苔粉对圆斑星鲽生长、体成分、消化酶活性及血清生化指标的影响[J].饲料研究,2024,47(12):51-55.
LÜ Y Y.Effects of Enteromorpha prolifera powder on growth,body composition,digestive enzymes activity,and serum biochemical indicators of Verasper variegatus[J].Feed Research,2024,47(12):51-55.(in Chinese)
[12] 黄瑾,熊邦喜,陈洁,等.鱼类消化酶活性及其影响因素的研究进展[J].湖南农业科学,2011(5):129-131,141.
HUANG J,XIONG B X,CHEN J,et al.Research advances in digestive enzyme of fish and its influencing factors[J].Hunan Agricultural Sciences,2011(5):129-131,141.(in Chinese)
[13] AFSHARI A,SOURINEJAD I,GHARAEI A,et al.The effects of diet supplementation with inorganic and nanoparticulate iron and copper on growth performance,blood biochemical parameters,antioxidant response and immune function of snow trout Schizothorax zarudnyi (Nikolskii,1897)[J].Aquaculture,2021,539:736638.
[14] FU B D,WANG X H,FENG X,et al.Comparative transcriptomic analyses of two bighead carp (Hypophthalmichthys nobilis) groups with different growth rates[J].Comparative Biochemistry and Physiology Part D,Genomics &Proteomics,2016,20:111-117.
[15] DING W D,ZHANG X H,ZHAO X M,et al.A chromosome-level genome assembly of the mandarin fish (Siniperca chuatsi)[J].Frontiers in Genetics,2021,12:671650.
[16] 钟立强,王海骁,王明华,等.不同饵料对大口黑鲈生长性能和肠道微生物的影响[J].水生生物学报,2022,46(11):1609-1617.
ZHONG L Q,WANG H X,WANG M H,et al.Different diets on growth performance and intestinal bacterial community of largemouth bass (Micropterus salmoides)[J].Acta Hydrobiologica Sinica,2022,46(11):1609-1617.(in Chinese)
[17] MA D M,FAN J J,ZHU H P,et al.Histologic examination and transcriptome analysis uncovered liver damage in largemouth bass from formulated diets[J].Aquaculture,2020,526:735329.
[18] 邵俊杰,钟立强,朱昱璇,等.配合饲料和冰鲜鱼对大口黑鲈生长和品质的影响[J].水产科学,2023,42(1):81-88.
SHAO J J,ZHONG L Q,ZHU Y X,et al.Effects of formulated feed and chilled trash fish on growth performance and meat quality of largemouth bass Micropterus salmoides[J].Fisheries Science,2023,42(1):81-88.(in Chinese)
[19] LI X S,CUI K,FANG W,et al.High level of dietary olive oil decreased growth,increased liver lipid deposition and induced inflammation by activating the p38 MAPK and JNK pathways in large yellow croaker (Larimichthys crocea)[J].Fish &Shellfish Immunology,2019,94:157-165.
[20] 徐韬,彭祥和,林鑫,等.猪油对罗非鱼生长及餐后脂质代谢的影响[J].淡水渔业,2016,46(1):80-86.
XU T,PENG X H,LIN X,et al.Effects of different levels of lard on growth and postprandial lipid metabolism in Tilapia(Oreochromis niloticus)[J].Freshwater Fisheries,2016,46(1):80-86.(in Chinese)
[21] WANG A R,RAN C,RINGØ E,et al.Progress in fish gastrointestinal microbiota research[J].Reviews in Aquaculture,2018,10(3):626-640.
[22] ZHU T F,AI Q H,MAI K S,et al.Feed intake,growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L.) fed defatted fish meal diets with graded levels of cholesterol[J].Aquaculture,2014,428:290-296.
[23] 王俊维,丁旺,陈凯,等.饲料添加牛至精油对异育银鲫生长、消化酶活性、肠道组织结构及血液生化指标的影响[J].淡水渔业,2023,53(2):69-76.
WANG J W,DING W,CHEN K,et al.Effects of dietary oregano essential oil on growth,digestive enzyme activity,intestinal tissue structure and blood biochemical indexes in Carassius auratus gibelio[J].Freshwater Fisheries,2023,53(2):69-76.(in Chinese)
[24] DAWOOD M A O,MAGOUZ F I,MANSOUR M,et al.Evaluation of yeast fermented poultry by-product meal in Nile Tilapia (Oreochromis niloticus) feed:effects on growth performance,digestive enzymes activity,innate immunity,and antioxidant capacity[J].Frontiers in Veterinary Science,2020,6:516.
[25] 班赛男,朱传忠,杨新冬,等.摄食不同饵料对翘嘴鳜生长、体成分和消化酶活性的影响[J].淡水渔业,2020,50(1):93-100.
BAN S N,ZHU C Z,YANG X D,et al.Effect of different diet on the growth performance,body composition and digestive enzymes active of mandarin fish (Siniperca chuatisi)[J].Freshwater Fisheries,2020,50(1):93-100.(in Chinese)
[26] 赖铭勇.投喂不同饵料对斑鳜生长及消化性能的影响[J].南方农业学报,2024,55(8):2523-2534.
LAI M Y.Effects of feeding different diets on growth and digestive performance of spotted mandarin fish(Siniperca scherzeri)[J].Journal of Southern Agriculture,2024,55(8):2523-2534.(in Chinese)
[27] 刘佳玮,李小勤,游宇海,等.饲料中添加丁酸钠对斑点叉尾鮰幼鱼生长性能、血清生化和抗氧化指标以及肠道健康的影响[J].动物营养学报,2024,36(9):5895-5909.
LIU J W,LI X Q,YOU Y H,et al.Effects of dietary sodium butyrate on growth performance,serum biochemical and antioxidant indices and intestinal health of juvenilechannel catfish(Ictalurus punctatus)[J].Chinese Journal of Animal Nutrition,2024,36(9):5895-5909.(in Chinese)
[28] CHEN X,SUN C,DONG J,et al.Comparative analysis of the gut microbiota of Mandarin Fish (Siniperca chuatsi) feeding on compound diets and live baits[J].Front Genet,2022,13:797420.
[29] 马兴宇,唐忠林,陈树桥,等.转食饲料对大口黑鲈幼鱼的存活率、抗氧化酶和消化酶活性及肠道菌群的影响[J].中国水产科学,2024,31(4):403-415.
MA X Y,TANG Z L,CHEN SQ,et al.Impacts of early weaning on survival rate,antioxidant and digestive enzyme activities,and intestinal microbiota of juvenile largemouth bass(Micropterus salmoides)[J].Journal of Fishery Sciences of China,2024,31(4):403-415.(in Chinese)
[30] 金娜,邹闻书,高倩,等.枸芪多糖对育肥猪肠道菌群多样性及组成的影响[J].动物营养学报,2019,31(9):4033-4043.
JIN N,ZOU W S,GAO Q,et al.Effects of Gou-qi polysaccharides on intestinal microbial diversity and composition of growing-finishing pigs[J].Chinese Journal of Animal Nutrition,2019,31(9):4033-4043.(in Chinese)
[31] MOUNTFORT D O,CAMPBELL J,CLEMENTS K D.Hindgut fermentation in three species of marine herbivorous fish[J].Applied and Environmental Microbiology,2002,68(3):1374-1380.
[32] LEON BRADLOW H.Obesity and the gut microbiome:pathophysiological aspects[J].Hormone Molecular Biology and Clinical Investigation,2014,17(1):53-61.
[33] FJELLHEIM A J,KLINKENBERG G,SKJERMO J,et al.Selection of candidate probionts by two different screening strategies from Atlantic cod (Gadus morhua L.) larvae[J].Veterinary Microbiology,2010,144(1/2):153-159.
[34] KELLY D,YANG L Y,PEI Z H.Gut microbiota,fusobacteria,and colorectal cancer[J].Diseases,2018,6(4):109.