刺参(Apostichopus japonicus)富含多种氨基酸和微量元素,具有较高的食用与药用价值,被誉为“海产八珍”之首[1-2]。刺参的养殖区域遍布辽宁、山东、福建等沿海省份,据《2024中国渔业统计年鉴》,2023年,中国海参养殖面积达28.9万 hm2,海参产量为29.2万 t,这表明刺参养殖产业具有巨大的经济价值。然而,刺参消化能力较差,主要依靠其消化酶和肠内菌群对食物进行化学消化[3]。良好的肠道菌群结构不仅可以辅助消化,还可以提高其肠道非特异性免疫功能,增强对部分有害菌(如弧菌类)感染的抵抗力[4-5],因此,通过改变日粮配方改善刺参的肠道菌群结构已成为当下刺参养殖中的热点问题[6-9]。
海泥为海底的沉积物,是刺参养殖中的重要饲料[10]。该物质虽然可为刺参提供一定的肠道微生物,但其本身带入有害致病菌、重金属的隐患比较大[11]。因此,刺参养殖业亟须一种既可提升刺参肠道菌群丰度,又对其本身无毒无害的海泥替代物。考虑到饲料粒度会决定比表面积的大小,比表面积的大小又决定了细菌可黏附位点的多少[12],因此,某物质粒径越小,其比表面积越大,酶促反应底物在其表面的吸附作用越强,可以为各类微生物提供多尺度生态位[13]。此外,在饲粮中直接添加益生菌时,对相关菌群进行分离并定向培养的难度较大[14],因此,减小饲料或其替代物的粒径从而扩大比表面积,是提高消化率、增加菌群生态位定植的有力措施。
玻璃微珠的主要成分是二氧化硅(SiO2)和氧化铝(Al2O3),表面光洁透明呈球状,是近年来新出现的一种用途广泛、性质稳定的新型无机非金属材料[15]。然而,其比表面积大的特性往往被忽略,但这恰恰是成为良好细菌附着基的重要潜质。同时,标准化生产的玻璃微珠规格一致,物理、化学性质稳定统一。海泥则会因所采地区和深度不同造成质量良莠不齐,存在一定品控问题[16]。因此,研究玻璃微珠替代海泥具有广泛应用前景。
总之,改善刺参肠道菌群结构、营造良性肠道微生态结构是提升刺参养殖效益的重要一环。本研究综合运用石蜡切片法、行为观测法与基于Illumina平台的16S rRNA高通量测序法,探索了在日粮中添加不同当量玻璃微珠对刺参肠道结构、行为的影响,并分析了刺参的肠道菌群,以期阐明玻璃微珠对刺参肠道菌群结构与特异性菌群的影响,为刺参的健康养殖提供科学参考。
1 材料与方法
1.1 材料
试验用刺参购自大连鑫玉龙海洋生物种业科技股份有限公司,于2023年10月运至大连海洋大学农业农村部北方海水增养殖重点实验室。刺参在曝气的PE材质塑料水箱中暂养一周以适应实验室环境。暂养期间,水温为15.03 ℃±0.20 ℃,盐度为29.54±0.08,溶解氧为(8.91±0.28)mg/L,水质仪(YSI Incorporated,OH,USA)。此外,每日用商业饲料(烟台蓬安源海洋食品有限公司,主要成分为海带、扇贝、鼠尾藻、马尾藻、海青菜等)和海泥以质量比1∶4混合后投喂刺参,每两天换一次水以清理残饵粪便。
1.2 方法
1.2.1 试验设计 试验共用到3种物质:45 μm玻璃微珠、海泥和商品饲料。随机选择体表无损伤的刺参225只(3.17±0.39)g,平均分为3组。将刺参随机平均分配至9个水箱中,培养28 d。试验期间每天换水并投喂混合饲料5 g,各组饲料配方为(质量比):Q组,玻璃微珠∶商业饲料=3∶1;I组,海泥∶玻璃微珠∶商业饲料=2∶1∶1;O组,海泥∶商业饲料=3∶1。试验期间,溶氧保持在8.57~9.49 mg/L,海水温度为15.0 ℃~15.5 ℃,pH为8.05~8.31,盐度为29.48~29.59。
1.2.2 肠道形态结构分析 试验结束后对刺参进行为期2 d的饥饿处理以排空肠道,期间及时吸取粪便避免刺参二次进食。每组随机选取5只刺参(n=5)置于冰盘上,从口部剪开、解剖取肠。随后立即将肠道浸于Bouin固定液(饱和苦味酸∶甲醛∶冰醋酸=15∶5∶1)中72 h。采用石蜡切片法,并对肠道组织使用HE染色,在光学显微镜下观察并拍照,随后在Image J软件上测量肠道黏膜层至浆膜层的厚度、黏膜褶皱高度与宽度、肠道微绒毛的长度。每个肠道切片图随机选取5个视野测量并取平均值。
1.2.3 爬行行为 爬行行为与海参的觅食密切相关[17]。本试验将爬行行为分为以下4个阶段[18]:1)初始状态的刺参身体舒展;2)刺参从肛门末端开始收缩;3)收缩至身体中部,随后到口部;4)完成收缩过程并恢复到初始状态。刺参每完成上述的一个活动周期即可记录为进行了一次爬行。本试验中,研究人员每组随机挑选5只刺参,分别置于PE材质的塑料盒中,并使用数码相机(Legria HF20,Canon,Japan)进行拍摄,计算刺参在1 h内完成爬行行为的次数(n=5)。
1.2.4 摄食行为 刺参可通过口部触手的伸缩来摄取食物。Sun等[19]对摄食行为各阶段表现的描述如下:1)海参伸展触手去接触食物;2)抓取食物;3)将触手上的食物送入口中。每完整完成上述活动一次即可记为刺参进行了一次摄食。本试验中,研究人员每组随机挑选5只刺参,每只刺参分别置于一个PE材质的塑料盒中,使用数码相机(Legria HF20,Canon)进行拍摄,计算刺参在1 h内完成摄食行为的次数(n=5)。
1.2.5 肠道微生物 16S rRNA基因测序,每组随机取4头已饥饿处理过的刺参,使用消毒后手术刀对其进行解剖,具体的解剖操作见“1.2.2节”。随后将各刺参的肠道分装于无菌离心管,经液氮冷冻后使用Illumina MiSeq平台进行高通量测序,以此分析出各组刺参肠道的菌群结构(n=4)。其中,Alpha 多样性分析包括ACE指数、Chao1指数、Shannon指数和Simpson指数;Beta多样性分析使用Bray-Curtis算法进行PCoA分析比较;还使用STAMP分析以找出哪些细菌在组间有显著性差异,从而阐释差异菌群的结构特征。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用IBM SPSS Statistics 27软件对肠道形态结构各指标、爬行行为次数、摄食行为次数进行数据分析。其中,对肠道黏膜层至浆膜层的厚度、肠道微绒毛的长度、摄食行为次数、爬行行为次数采用独立样本克鲁斯卡尔-沃利斯检验;对黏膜褶皱高度、黏膜褶皱宽度进行单因素方差分析;显著性水平设为0.05。
2 结果与分析
2.1 肠道结构
3组间的肠道黏膜层至浆膜层的厚度如下:Q组为(27.83±5.58)μm,I组为(28.04±5.05)μm,O组为(26.00±8.38)μm,组间无显著性差异(P=0.432)。Q组黏膜褶皱高度为(377.48±90.06)μm,I组为(553.79±253.77)μm,O组为(413.27±180.86)μm,组间无显著性差异(P=0.324)。Q组肠道微绒毛长度为(11.59±3.46)μm,I组为(9.73±2.08)μm,O组为(10.46±2.46)μm,组间无显著性差异(P=0.566)。Q组黏膜褶皱宽度为(76.12±10.19)μm,I组为(81.52±4.47)μm,O组为(76.02±10.19)μm,组间无显著性差异(P=0.539)(图1)。
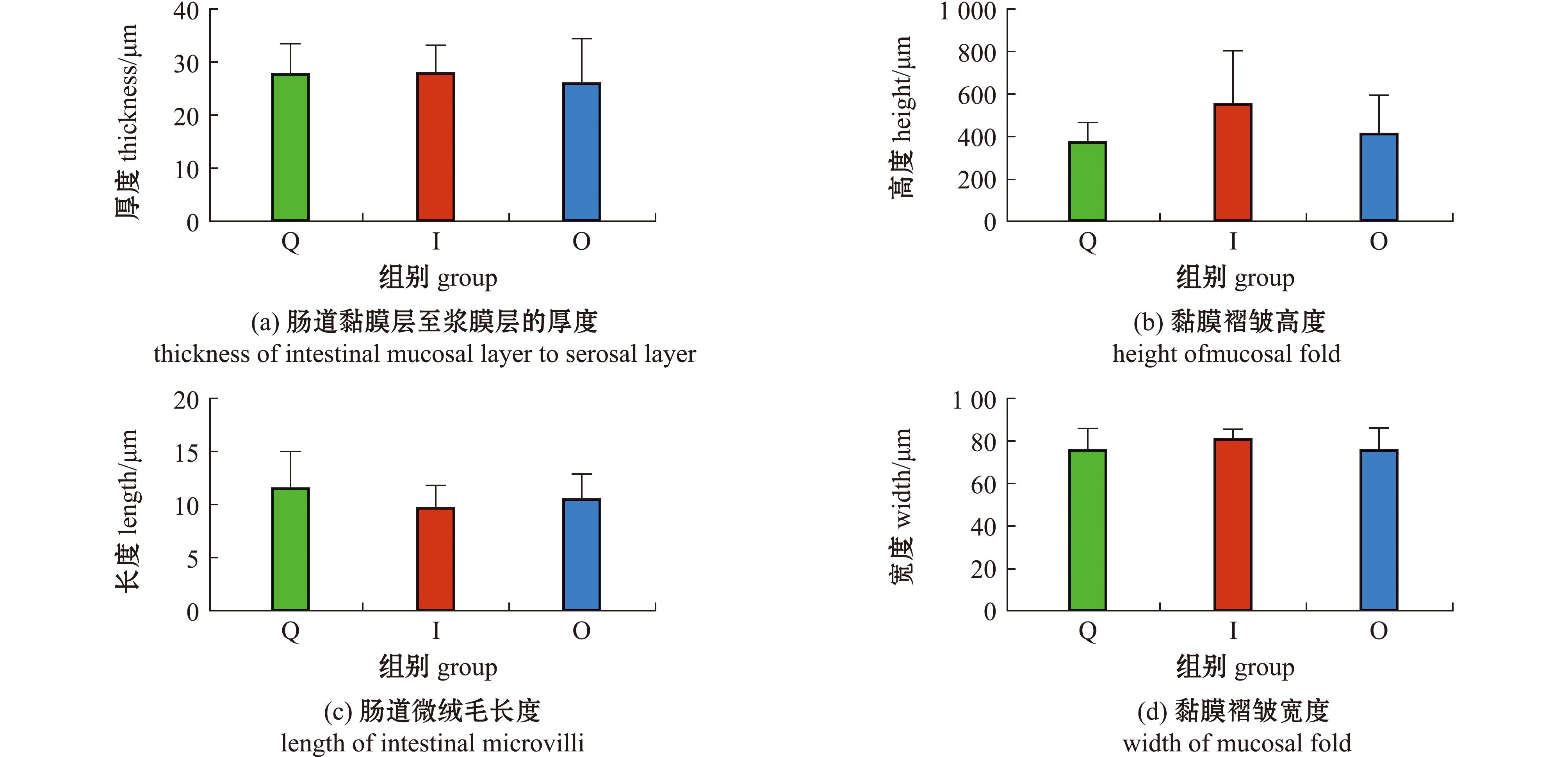
图1 日粮中添加玻璃微珠对刺参肠道形态参数的影响(n=5)
Fig.1 Effect of dietary glass microbeads on intestinal morphological parameters of Apostichopus japonicus(n=5)
2.2 运动和摄食行为
从图2可见,Q组、I组和O组刺参爬行频率分别为(16.75±23.43)、(14.13±13.12)、(4.63±2.39)次/h。经两两比较后可得,O组的爬行频率和Q组、I组相比均无显著性差异(P=0.078)(P=0.061)。Q组、I组和O组刺参摄食频率分别为(22.63±12.31)、(23.00±10.94)、(22.50±13.50)次/h(P=0.953),组间无显著性差异。

图2 日粮中添加玻璃微珠对刺参行为的影响(n=5)
Fig.2 Effect of the addition of glass microbeads to the diet on the behaviors of Apostichopus japonicus(n=5)
2.3 菌群多样性
2.3.1 Alpha多样性分析 本试验采用OTU的总数来评估样本的微生物多样性,以Chao1和ACE指数来衡量菌群丰度,以Shannon和Simpson指数表示多样性。结果表明,Q组的OTUs和Shannon指数(P=0.041)(P=0.026)显著大于O组,其他指标间无显著性差异(P>0.05)。这说明在刺参的日粮中添加大量的玻璃微珠有利于改善肠道菌群多样性(表1)。
表1 Alpha多样性分析
Tab.1 Alpha diversity analysis results
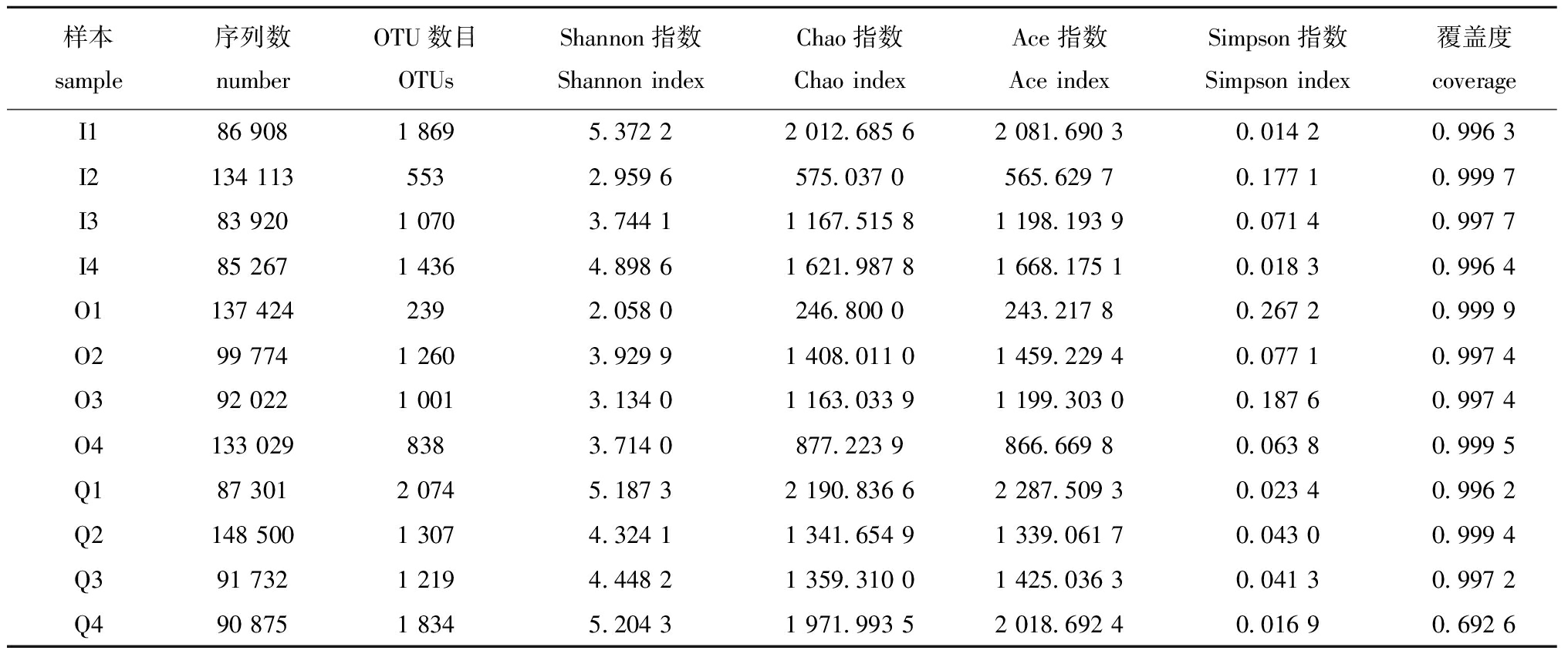
样本sample序列数numberOTU数目OTUsShannon指数Shannon indexChao指数Chao indexAce指数Ace indexSimpson指数Simpson index覆盖度coverageI186 9081 8695.372 22 012.685 62 081.690 30.014 20.996 3I2134 1135532.959 6575.037 0565.629 70.177 10.999 7I383 9201 0703.744 11 167.515 81 198.193 90.071 40.997 7I485 2671 4364.898 61 621.987 81 668.175 10.018 30.996 4O1137 4242392.058 0246.800 0243.217 80.267 20.999 9O299 7741 2603.929 91 408.011 01 459.229 40.077 10.997 4O392 0221 0013.134 01 163.033 91 199.303 00.187 60.997 4O4133 0298383.714 0877.223 9866.669 80.063 80.999 5Q187 3012 0745.187 32 190.836 62 287.509 30.023 40.996 2Q2148 5001 3074.324 11 341.654 91 339.061 70.043 00.999 4Q391 7321 2194.448 21 359.310 01 425.036 30.041 30.997 2Q490 8751 8345.204 31 971.993 52 018.692 40.016 90.692 6
2.3.2 Beta多样性分析 在门水平下,基于Bray-Curtis算法分析对所有样本进行二维坐标分析,结果如图3所示。其中,第1主坐标(PCoA1)的贡献率为61.52%,第2主坐标(PCoA2)的贡献率为19.37%,二者累计贡献率为80.89%,椭圆区域为95%置信区间。代表I组的椭圆在空间中与O组部分重合,距离Q组也较近,这说明I组与其他两组间菌群结构差异不大,菌群相似性较高。而Q组、O组形成的椭圆则距离较远,说明这两组间的整体菌群结构有显著性差异(P<0.05)。
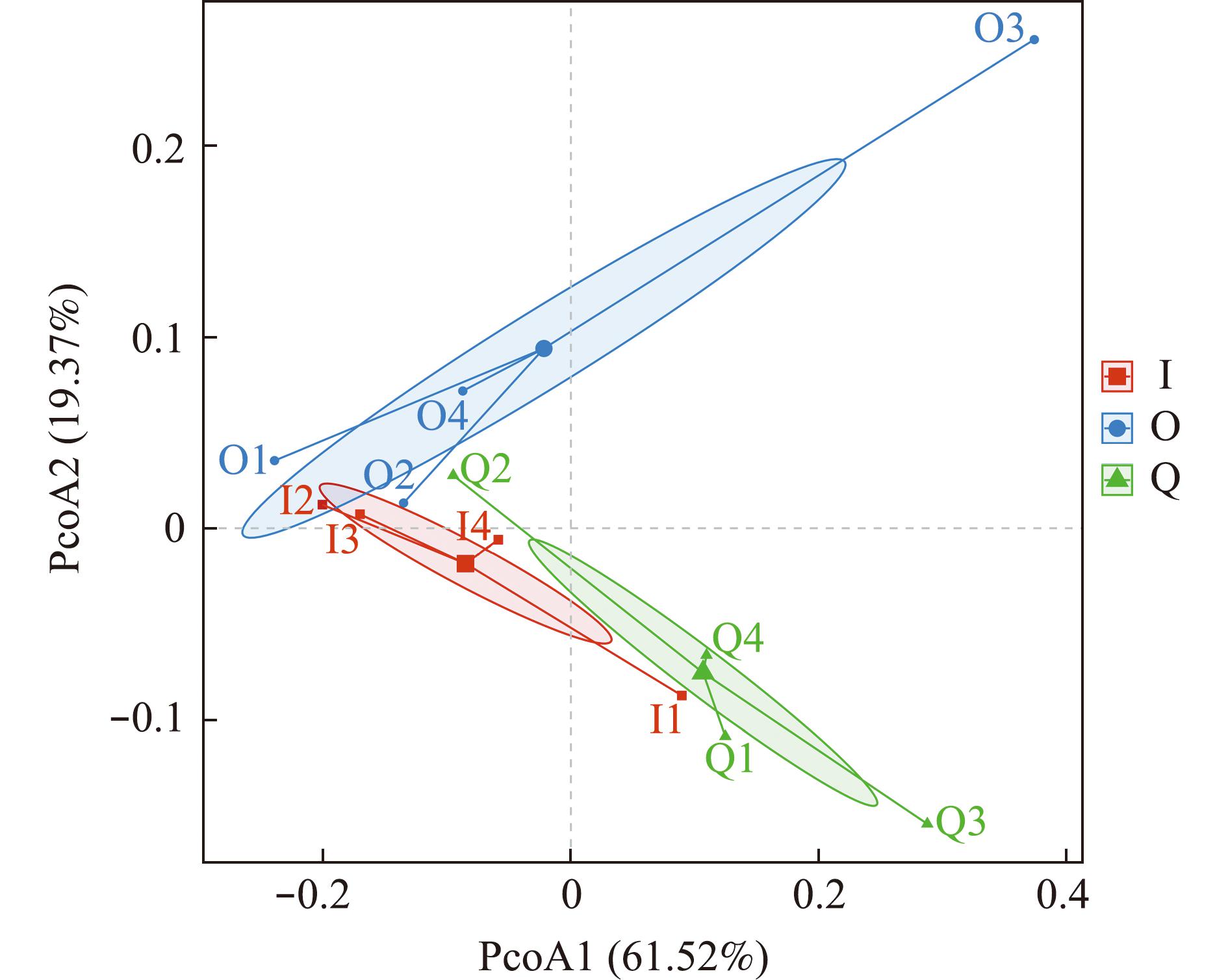
横轴和纵轴表示两个选定的主成分轴,百分比表示主成分对样本组成差异的解释度值。横轴和纵轴的刻度是相对距离,无实际意义。彩色点代表样本。中心点为每组中到每个样本距离最近的点。椭圆区域为95%置信区间。
The horizontal and vertical axes represent the two selected principal component axes and percentages represent the explanatory value of principal components for differences in sample composition.The horizontal and vertical scales are relative distances and have no practical significance.Color point represents the sample.Center point represents the closest point to each sample in each group.The elliptical region is the 95% confidence interval.
图3 在门水平下基于Bray-Curtis算法生成的PcoA星形图(n=4)
Fig.3 PcoA star plots generated at the phylum level based on the Bray-Curtis algorithm (n=4)
2.4 优势菌群结构特征
从门水平上看(图4(a)),刺参肠道内优势菌门主要为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota),二者相对丰度最高可达91.72%。其中,各组第一优势菌门均为变形菌门,在Q组、I组、O组的相对丰度占比分别为60.02%、80.86%和76.14%;次优势菌门均为拟杆菌门,在Q组、I组、O组的相对丰度占比分别为20.02%、10.86%和9.09%。此外,以上3组试验的海参肠道中还检测出厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和浮霉菌门(Planctomycetota)等细菌。
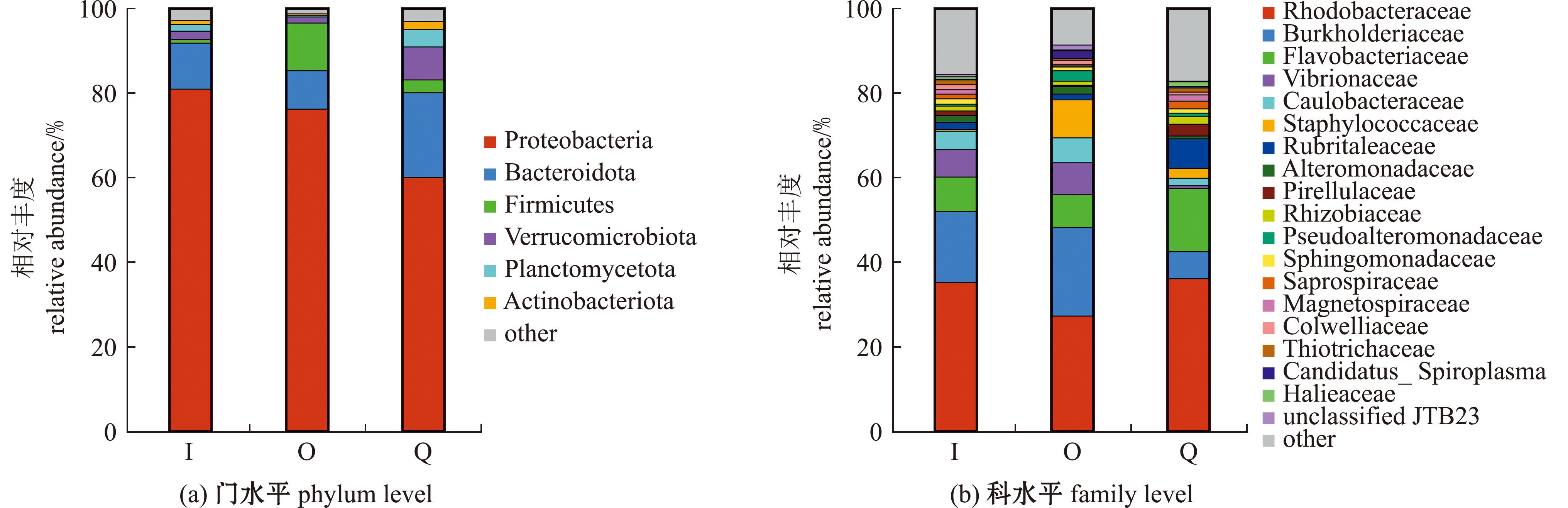
图4 各组刺参肠道样本中优势菌群在门和科水平上的相对丰度(n=4)
Fig.4 Relative abundance of the dominant bacteria in the gut of each group of Apostichopus japonicus at the phylum and family levels (n=4)
从科水平上看(图4(b)),Q组主要优势菌科以红杆菌科(Rhodobacteraceae)、黄杆菌科(Flavobacteriaceae)、鲁氏菌科(Rubritaleaceae)、伯克氏菌科(Burkholderiaceae)为代表,其相对丰度占比分别为36.17%、14.89%、6.98%、6.38%。I组主要优势菌科以红杆菌科、伯克氏菌科、黄杆菌科、弧菌科(Vibrionaceae)为代表,其相对丰度占比分别为35.30%、16.68%、8.13%、6.48%。O组主要优势菌科以红杆菌科、伯克氏菌科、葡萄球菌科(Staphylococcaceae)、黄杆菌科和弧菌科为代表,其相对丰度占比分别为27.36%、20.87%、8.96%、7.74%。
2.5 差异菌群结构特征
刺参肠道及其养殖水体差异菌群分析结果如下:在门水平,与Q、O组相比,I组各菌门均无显著性差异(P>0.05),无特异性菌门。Q组之于O组的特异性菌门有NB1-j、Hydrogenedentes、脱硫菌门(Desulfobacterota)。经数据分析,以上3个菌门的平均丰度值显著高于O组(P<0.05),是Q组的主要特异性菌门。
在科水平,相对于O组而言,PS1 clade、unclassified Rhodospirillales、unclassified EC3、unclassified NB1-j、KI89A clade、嗜氢菌科(Hydrogenedensaceae)、生丝微菌科(Hyphomicrobiaceae)、Arenicellaceae、unclassified OM190、unclassified Milano-WF1B-44是Q组刺参肠道中的特异菌,这些菌的平均丰度值显著高于O组(P<0.05)(图5)。
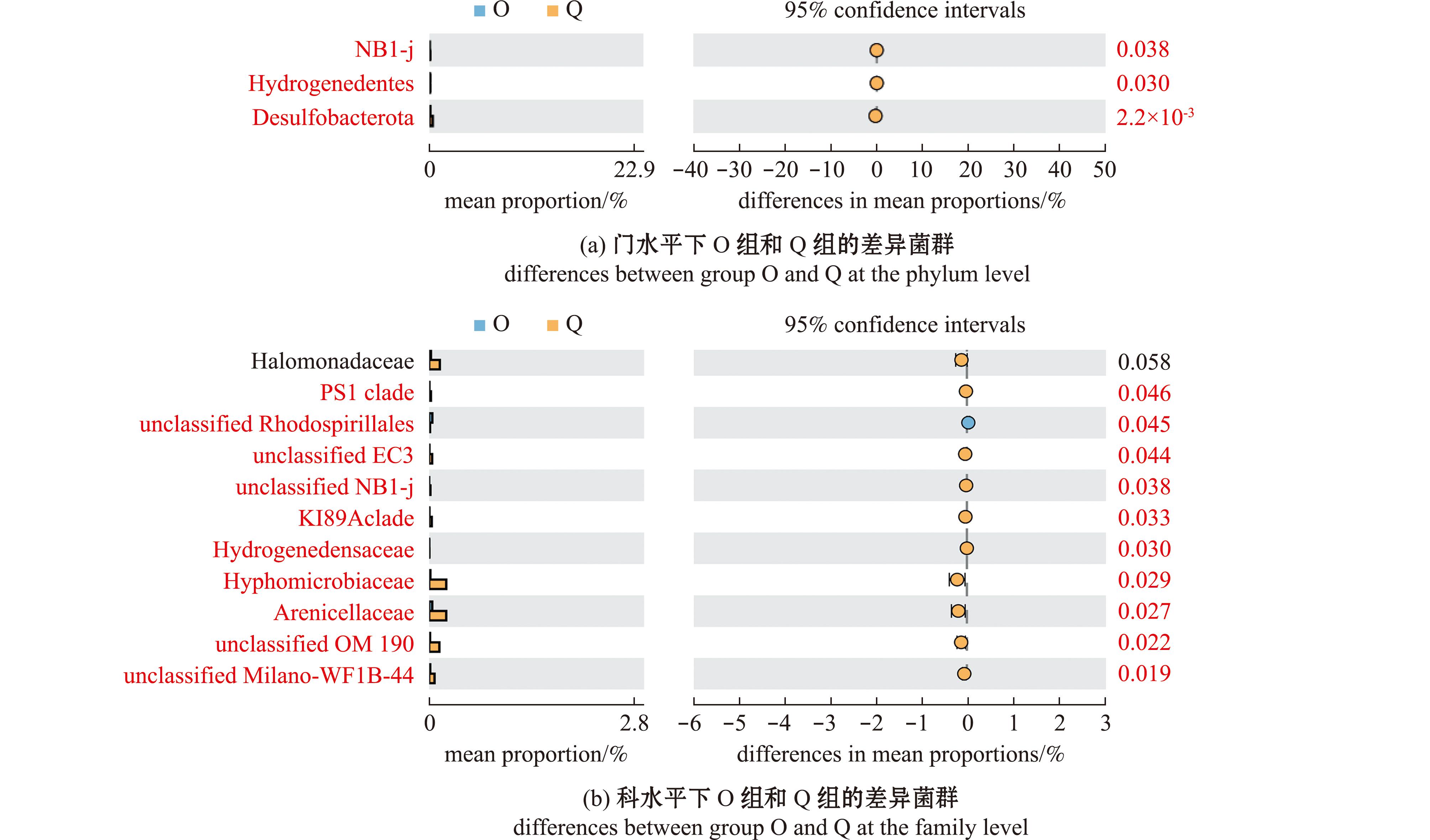
红字表示该类细菌在两试验组间有显著性差异(P<0.05)。
The red words indicate a significant difference between the two experimental groups(P<0.05).
图5 刺参肠道样本在门和科水平上的差异菌群STAMP分析(n=4)
Fig.5 STAMP analysis about the specific bacteria at the phylum and family levels of the intestinal samples of Apostichopus japonicus(n=4)
3 讨论
3.1 玻璃微珠对刺参肠道结构和行为的影响
海泥是刺参饲料中重要的原料,它不仅可稀释饲料中的营养物质[20],还有改善刺参肠道结构、促进肠道蠕动的作用[11],因此,玻璃微珠作为海泥替代物对刺参所起的效果成为本研究中需注意的要点。其他研究者也进行过海泥的替代试验:在稻壳粉试验中,刺参肠道的肌层厚度随饲料中稻壳粉比例的增加而变薄;在蒙脱石粉试验中,石粉的加入则对刺参肠道结构的各指标无显著性影响[21]。本试验的结果与稻壳粉试验不同,与蒙脱石粉试验一致。有趣的是,在禽类动物中也存在与本试验结果类似的现象,具食腐习性的秃鹫喜食柔软腐肉,其肌胃组织结构和家禽基本相似,但不太发达;而可摄食沙砾、小石子的某些家禽(如鸡)的肌胃部肌层则较厚,且肌胃黏膜表面具类角质膜[22]。考虑到稻壳粉硬度与海泥、石粉与玻璃微珠相比过于柔软,说明出现以上现象的原因可能是硬质饲料添加物在辅助刺参对食物进行研磨的同时,还在一定程度上刺激了刺参肠道组织的增生。这或许能解释为何稻壳粉的替代使刺参肌层厚度出现变薄的趋势[21],而玻璃微珠则不会对其肠道结构造成不良影响。
爬行是刺参重要的运动行为,也是防御、觅食等活动的基础,直接决定了刺参的区域分布[23];摄食行为则是生物体从外部环境获取食物以维持正常生命活动的方式[24]。以上两种行为均可在一定程度上反映刺参的摄食能力。部分有关刺参行为和肠道结构的数据证实,玻璃微珠可在大幅提高其比表面积的同时,确保对刺参的摄食、运动能力和肠道结构无负面影响,而许多精细饲料会对饲养生物的消化道结构、甚至运动和摄食能力产生负面影响[25-27]。因此,玻璃微珠作为海泥替代物与其他现有的具副作用的小粒度饲料相比优势显著,具有投入实际生产应用的潜力。
3.2 玻璃微珠对刺参肠道菌群多样性和相对丰度的影响
大量研究表明:饲料成分会影响生物体肠道菌群的组成,有些可提高肠道菌群多样性,有些则会降低菌群多样性[28-31]。生物体肠道菌群多样性可在一定程度上反映肠道稳态的情况[32],OTUs和Shannon指数均为反映微生物群落多样性的重要指标。其中,OTU数可直接反映样本中的物种丰富度,Shannon指数能用来评估微生物的多样性,数据越大则说明群落更多样、物种更丰富[33]。本研究中,Q组的OTUs和Shannon指数显著大于O组,I组各指标无显著性差异,故Q组刺参的肠道菌群多样性得到了较好的改善。这可能是因为I组日粮中的玻璃微珠添加量较少,对相关菌群的作用效果不明显。有研究表明,在畜禽废弃物资源化领域中会通过增加电极材料的比表面积,从而有效富集互营菌群[34],该结论与本试验结果相一致。据此,推测本研究中产生相关现象的原因是玻璃微珠在比表面积上的优势为在肠道定植的各菌群提供了充分的生态位点,在一定程度上改变了刺参的肠道环境,从而吸引了更多菌类在此栖息。考虑到菌群多样性指数越高,各区系间的菌群平衡越稳定、越不易被破坏[35]。因此,本试验的结果表明,当用玻璃微珠全部替代刺参日粮中的海泥时,其肠道菌群的多样性会更加丰富,与之相应的,肠道内微生物稳态平衡也会在一定程度上得到改善。
生物体的肠道内富含大量微生物,这些微生物间相互作用,共同组成了肠道菌群。在肠道菌群中,优势菌群对于动物宿主来说意义重大,其参与多个复杂的生理生化反应,包括改善消化情况、维持代谢稳态[36],以及进行免疫反应等[37]。而对于刺参这种无独立消化腺、消化器官结构极其简单的生物,在食物的分解消化上受肠道优势菌群影响调控更多[38]。本试验16S rRNA测序结果表明,玻璃微珠的添加并未影响到刺参肠道优势菌群的结构,这和刘艳霞等[39]、谭八梅等[40]对吊笼养殖和池塘养殖中刺参肠道菌群的研究结论相一致。变形菌门和拟杆菌门在刺参的肠道中分布十分广泛,有研究表明,不论在何种季节,二者都是刺参的核心菌群[41]。其中,变形菌门在生物降解中起到的作用十分重要,该门的细菌能够降解纤维素等大分子有机化合物并参与反硝化作用[42-43],可以参与生物碳、氮的代谢和循环[44],在一定程度上为宿主积攒能量,与宿主的生理状态关系密切。拟杆菌门则对辅助宿主消化起到了十分重要的作用,它既能在发酵碳水化合物的同时将大量宿主本身难以消化的植物多糖有效分解为单糖[45],使其更容易被宿主所吸收,从而合成蛋白质[44];也可参与低聚糖的发酵和降解,甚至还对水解淀粉和几丁质有所作用[46-47]。这表明,玻璃微珠在刺参日粮中的加入并不会影响肠道优势菌群的结构;相反,变形菌门与拟杆菌门仍为刺参的第一优势菌和次优势菌,相对丰度的排名依旧稳定。该试验的结果明确验证了玻璃微珠在辅助宿主消化、维护肠道微生态平衡方面展现出的正面效应,并对刺参肠内环境的稳定性做出了积极贡献。
此外,Q组伯克氏菌、葡萄球菌和弧菌科的相对丰度较O组有明显下降。伯克氏菌一般被认为是致病菌,除了能使人致病,以及对水稻及洋葱等农作物产生威胁外[48-49],还有研究发现其为引起大鲵皮肤溃疡的重要潜在病原体[50]。葡萄球菌广泛存在于空气、土地和水中,可感染多种生物[51]。现已有研究人员从感染严重腐皮病的刺参皮肤溃烂组织中成功分离得到3株葡萄球菌[52],这表明葡萄球菌对刺参养殖同样具有较大危害。弧菌是海洋中最常见的病原微生物之一,存在于不同盐度及深度的海洋中,具有高丰度和高生物载量的特点[53]。由于弧菌的性质特殊,其丰度过高时会使肠道微生态失衡,从而引发炎症反应[54]。当刺参体表受损或因外界胁迫导致免疫力低下时,弧菌还会导致烂边病与腐皮病[55],对于刺参养殖业影响重大。显而易见,在日粮中加入玻璃微珠使得上述条件致病菌的相对丰度均有所下降。这可能是因为玻璃微珠为各类细菌提供的生态位点大大增加,而在此定植的其他菌群则会与上述致病菌争夺生存空间,因此减少了致病菌的相对丰度[56]。本研究中,Q组鲁氏菌科相对丰度占比约为O组的5.25倍(图4)。鲁氏菌隶属于疣微菌门(Verrucomicrobia),有报道称该细菌出现在部分海藻上,可通过在其表面分泌抗菌代谢物防御其他有害菌[57],在维持健康微生物群方面具有关键作用。这或许是Q组刺参肠道内致病菌数量要少于O组的原因。以上结果共同表明,当向刺参日粮中添加玻璃微珠时,会使刺参部分肠道细菌的相对丰度发生改变,且玻璃微珠可在有效富集具抑菌、辅助消化功能的有益菌的同时,抑制常见致病菌的繁殖,从而在一定程度上降低细菌性疾病暴发的可能性。
3.3 玻璃微珠对刺参肠道特异性菌群的影响
肠道是刺参最大的消化吸收器官,有研究者认为,肠道特异性菌群可作为联系宿主与环境因素的中介,这在营养吸收、代谢稳态与免疫应答中具有重要意义[58]。因此,探究在日粮中添加玻璃微珠是否会使肠道特异性菌群产生变化,以及这些变化的菌群在肠道生态环境中又会发挥何种作用是十分重要的。
本研究中,在门水平下,和O组相比,Q组的特异菌为脱硫菌门。脱硫菌常见于有机污染环境,能以硫酸盐为电子受体,氧化利用多种有机物进行化能异氧,因而被认为在参与生态系统的硫循环与碳循环中起着重要作用[59]。Wang等[60]研究表明,由脱硫菌介导的硫酸盐还原作用能够降解半数以上的海洋沉积物有机质,同时会与![]() 竞争电子供体,从而抑制
竞争电子供体,从而抑制![]() 还原产生 N2O的反硝化过程,进而影响氮含量变化。这说明,在刺参日粮中添加玻璃微珠在一定程度上有助于刺参对营养物质、特别是含氮化合物的分解和吸收。
还原产生 N2O的反硝化过程,进而影响氮含量变化。这说明,在刺参日粮中添加玻璃微珠在一定程度上有助于刺参对营养物质、特别是含氮化合物的分解和吸收。
本研究中,Q组之于O组的特异性菌科有噬氢菌科和丝微菌科。其中,噬氢菌常被应用于污水处理中[61],因为其具有降解有机物和毒物的能力,特别是对水体中硝酸盐氮的去除有积极作用[62]。与之类似,生丝微菌也可进行反硝化作用,能将![]() 转化为气态最终产物[63]。这一功能不仅有助于减少水体污染、防止水体富营养化,还对保护水生生态系统、维持自然界的氮素循环具有重要意义。除反硝化作用外,该菌还与肠道健康有关,有研究表明,生丝微菌在尼罗罗非鱼肠道中相对丰度的下降,可诱发氧化应激和肠道炎症[64]。相应的,生丝微菌在肠道内大量定植,或可代表此时刺参肠道生境较为健康。当然该观点仅为推论,有待通过在刺参中的试验进一步证实。
转化为气态最终产物[63]。这一功能不仅有助于减少水体污染、防止水体富营养化,还对保护水生生态系统、维持自然界的氮素循环具有重要意义。除反硝化作用外,该菌还与肠道健康有关,有研究表明,生丝微菌在尼罗罗非鱼肠道中相对丰度的下降,可诱发氧化应激和肠道炎症[64]。相应的,生丝微菌在肠道内大量定植,或可代表此时刺参肠道生境较为健康。当然该观点仅为推论,有待通过在刺参中的试验进一步证实。
Zhou等[65]研究提出,不同的环境介质会形成不同生活条件。考虑到玻璃微珠粒度小、质地坚硬,海泥微粒粒度大、质地松软,二者物理性质有所差异,故可能会衍生出不同肠道特异性菌群。有趣的是,在刺参肠道中氧气含量正常情况下较少,一般在试验中研究者均默认肠内环境为缺氧生境,好氧菌罕见,但上述两类细菌则恰好均为好氧菌。研究人员认为:尽管玻璃微珠粒度较小,但其间仍存有一定空隙,不像质地柔软的海泥一般彼此粘连、不留空隙,所以才可留存氧气于刺参体内,从而富集该类好氧菌在刺参肠道内定植。此外,还有研究者发现,在菌藻生物膜反应器中,光照条件下噬氢菌丰度要远高于暗光条件[66]。这表明玻璃微珠光洁透明的特质可能也是导致有益菌丰度提高的重要原因。
4 结论
1)玻璃微珠作为海泥替代物,可在大幅提高比表面积的前提下确保对刺参的摄食、运动能力和肠道结构无负面影响。
2)当玻璃微珠完全替代海泥时,能够在不破坏刺参肠道微生态平衡的前提下,显著提高肠道菌群的丰度和多样性,并有效富集有益微生物。
未来研究可以进一步探讨玻璃微珠在不同养殖环境下的长期效果,以及其对刺参生长性能和抗病能力的具体影响,从而为刺参养殖业的可持续发展提供更多科学支持。
[1] 于双,姜淼,桑雪,等.大连不同产地刺参营养成分分析与评价[J].中国食品添加剂,2022,33(4):188-195.
YU S,JIANG M,SANG X,et al.Analysis and evaluation of nutrient components of sea cucumber from different places in Dalian[J].China Food Additives,2022,33(4):188-195.(in Chinese)
[2] 张月杰,卢明锋,吉爱国.刺参多糖药理作用研究进展[J].中国生化药物杂志,2012,32(1):74-77.
ZHANG Y J,LU M F,JI A G.Research progress in polysaccharide from sea cucumber and its pharmacological activities[J].Chinese Journal of Biochemical Pharmaceutics,2012,32(1):74-77.(in Chinese)
[3] 喻雨诗.海胆粪便提高刺参摄食、消化、生长和抗逆的研究[D].大连:大连海洋大学,2024.
YU Y S.Sea urchin feces improves feeding,digestion ability,growth and resistance of the sea cucumber Apostichopus japonicus[D].Dalian:Dalian Ocean University,2024.(in Chinese)
[4] LIU B N,ZHOU W M,WANG H,et al.Bacillus baekryungensis MS1 regulates the growth,non-specific immune parameters and gut microbiota of the sea cucumber Apostichopus japonicus[J].Fish &Shellfish Immunology,2020,102:133-139.
[5] 赵振军,叶博,董颖,等.仿刺参绿色饲料添加剂研究现状与思考[J].水产科学,2024,43(6):1009-1019.
ZHAO Z J,YE B,DONG Y,et al.Current status and thinking on green feed additives in aquaculture of sea cucumber Apostichopus japonicus[J].Fisheries Science,2024,43(6):1009-1019.(in Chinese)
[6] 于悦,任昕淼,付晓丹,等.刺参肠道菌群的研究进展[J].安徽农业科学,2022,50(7):19-22.
YU Y,REN X M,FU X D,et al.Research progress on intestinal microbiota for Apostichopus japonicus[J].Journal of Anhui Agricultural Sciences,2022,50(7):19-22.(in Chinese)
[7] 李璐,刘京熙,李宝山,等.发酵藻粉替代藻粉对刺参生长性能以及肠道消化酶活性、抗氧化指标和菌群多样性的影响[J].动物营养学报,2024,36(10):6620-6630.
LI L,LIU J X,LI B S,et al.Effects of replacing algal powder with fermented algal powder on growth performance,intestinal digestive enzyme activities,antioxidant indexes and microbial diversity for Apostichopus japonicus[J].Chinese Journal of Animal Nutrition,2024,36(10):6620-6630.(in Chinese)
[8] 贾文广.石莼发酵饲料的制备工艺及在刺参养殖中的应用研究[D].烟台:烟台大学,2024.
JIA W G.Optimization of fermentation conditions for sea lettuce Ulva lactuca and application effect of the fermented sea lettuce in Apostichopus japonicus culture[D].Yantai:Yantai University,2024.(in Chinese)
[9] 金珈羽.益生菌在水产养殖中的应用研究进展[J].农业灾害研究,2024,14(2):7-9.
JIN J Y.Research progress on application of probiotics in aquaculture[J].Journal of Agricultural Catastrophology,2024,14(2):7-9.(in Chinese)
[10] 魏国重,李晓月.海泥在刺参苗种培育中的应用[J].水产养殖,2011,32(5):21-22.
WEI G Z,LI X Y.Application of sea mud in the cultivation of sea cucumber Apostichopus japonicus[J].Journal of Aquaculture,2011,32(5):21-22.(in Chinese)
[11] 宫魁,王宝杰,刘梅,等.仿刺参饲用海泥资源质量评价的初步研究[J].饲料工业,2012,33(10):38-41.
GONG K,WANG B J,LIU M,et al.A preliminary study on the estimation of dietary sea mud in sea cucumber(Apostichopus japonicus)[J].Feed Industry,2012,33(10):38-41.(in Chinese)
[12] 操鹏飞,汪水平,汤佳,等.不同种类及粒度的牧草纤维体外发酵特性及三种纤维降解菌的研究[J].草业科学,2025,42(4):1051-1066.
CAO P F,WANG S P,TANG J,et al.Study on in vitro fermentation characteristics of forage fiber with different kinds and particle sizes and three fiber-degrading bacteria[J].China Industrial Economics,2025,42(4):1051-1066.(in Chinese)
[13] 李立军,仲惟,李涛.固定化微生物技术在小秦岭金矿区农田土壤修复中的应用[J].浙江农业科学,2024,65(8):1950-1956.
LI L J,ZHONG W,LI T.Application of immobilized microorganism technology on soil remediation of farmland in Xiaoqinling gold mining area[J].Journal of Zhejiang Agricultural Sciences,2024,65(8):1950-1956.(in Chinese)
[14] 刘月月,王琛,赵晓丽,等.肠道菌群的环境毒理学研究:现状与展望[J].环境科学研究,2021,34(8):1991-2000.
LIU Y Y,WANG C,ZHAO X L,et al.Environmental toxicology of gut microbiota:status and perspective[J].Research of Environmental Sciences,2021,34(8):1991-2000.(in Chinese)
[15] LIANG J Z.Toughening and reinforcing in rigid inorganic particulate filled poly(propylene):a review[J].Journal of Applied Polymer Science,2002,83(7):1547-1555.
[16] 王裕玉,胡洁,刘祥军,等.刺参营养需求与饲料研究进展[J].中国饲料,2023,35(13):79-87.
WANG Y Y,HU J,LIU X J,et al.Research progress on nutrition requirement and feed of sea cucumber[J].China Feed,2023,(13):79-87.(in Chinese)
[17] SUN J M,ZHANG L B,PAN Y,et al.Effect of water temperature on diel feeding,locomotion behaviour and digestive physiology in the sea cucumber Apostichopus japonicus[J].Journal of Experimental Biology,2018,221(Pt 9):jeb177451.
[18] TIAN R H,HU F Y,WU G,et al.An effective approach to improving fitness-related behavior and digestive ability of small sea cucumbers Apostichopus japonicus at high temperature:New insights into seed production[J].Aquaculture,2023,562:738755.
[19] SUN J M,ZHANG L B,PAN Y,et al.Feeding behavior and digestive physiology in sea cucumber Apostichopus japonicus[J].Physiology &Behavior,2015,139:336-343.
[20] SHI C,DONG S L,WANG F,et al.Effects of the sizes of mud or sand particles in feed on growth and energy budgets of young sea cucumber (Apostichopus japonicus)[J].Aquaculture,2015,440:6-11.
[21] 李泽群.饲料中海泥对刺参摄食、生长、消化及肠道的影响[D].大连:大连海洋大学,2021.
LI Z Q.Effects of dietary sea mud on feeding,growth performance,digestion ability and intestinal structure of sea cucumber Apostichopus japonicus[D].Dalian:Dalian Ocean University,2021.(in Chinese)
[22] 晁青鲜,崔富景,赫晓燕.一例秃鹫腺胃和肌胃的组织结构观察[J].野生动物学报,2018,39(2):386-389.
CHAO Q X,CUI F J,HE X Y.Histological observation of the glandular stomach and muscular stomach of black vulture (Aegypius monachus)[J].Chinese Journal of Wildlife,2018,39(2):386-389.(in Chinese)
[23] 夏苏东.刺参幼参摄食行为与蛋白质营养需要研究[D].青岛:中国科学院大学(中国科学院海洋研究所),2012.
XIA S D.Researches on feeding behavior and dietary protein requirement of sea cucumber Apostichopus japonicus (Selenka)[D].Qingdao:Chinese Academy of Sciences (Institute of Oceanology),2012.(in Chinese)
[24] 王渊源,王全阳.鱼虾的摄食行为[J].海洋渔业,1992,14(2):66-68.
WANG Y Y,WANG Q Y.Feeding behavior of fish and shrimp[J].Marine Fisheries,1992,14(2):66-68.(in Chinese)
[25] 张道亮,丁红研,王留幸,等.瘤胃酸中毒对山羊胃肠道功能、形态和菌群的影响[J].畜牧兽医学报,2024,55(10):4760-4772.
ZHANG D L,DING H Y,WANG L X,et al.Effect of rumen acidosis on gastrointestinal function,morphology,and microflora in goats[J].Acta Veterinaria et Zootechnica Sinica,2024,55(10):4760-4772.(in Chinese)
[26] 臧金刚.影响猪采食量的因素分析及调控策略[J].今日养猪业,2024(1):34-36.
ZANG J G.Analysis of factors affecting pig feed intake and its control strategy[J].Pigs Today,2024(1):34-36.(in Chinese)
[27] 杨锦浩.育肥牛科学育肥技术[J].畜禽业,2024,35(7):30-32.
YANG J H.Scientific fattening technology of fattening cattle[J].Livestock and Poultry Industry,2024,35(7):30-32.(in Chinese)
[28] 冯轶,张晨旭,杨芸芸,等.刺梨渣对鲤鱼生长性能、肠道菌群结构及抗病力的影响[J].动物营养学报,2024,36(11):7227-7235.
FENG Y,ZHANG C X,YANG Y Y,et al.Effects for Rosa roxburghii tratt residue on growth performance,intestinal microflora structure and disease resistance of common carp (Cyprinus carpio)[J].Chinese Journal of Animal Nutrition,2024,36(11):7227-7235.(in Chinese)
[29] LIN S H,CHANG H C,CHEN P J,et al.The antidepressant-like effect of ethanol extract of daylily flowers in rats[J].Journal of Traditional and Complementary Medicine,2013,3(1):53-61.
[30] 王瑞风,雷海燕,臧璞,等.大黄酸对糖尿病小鼠肠道菌群影响的初步研究[J].中国微生态学杂志,2016,28(1):21-24,46.
WANG R F,LEI H Y,ZANG P,et al.The effect of Rhein on the gut microbiota in diabetes mice[J].Chinese Journal of Microecology,2016,28(1):21-24,46.(in Chinese)
[31] DOR J,BLOTTI
J,BLOTTI RE H.The influence of diet on the gut microbiota and its consequences for health[J].Current Opinion in Biotechnology,2015,32:195-199.
RE H.The influence of diet on the gut microbiota and its consequences for health[J].Current Opinion in Biotechnology,2015,32:195-199.
[32] 黄小流,罗辉,龙书瑾,等.马齿苋多糖摄入对老龄大鼠肠道菌群结构的影响[J].营养学报,2024,46(3):276-282.
HUANG X L,LUO H,LONG S J,et al.Effect of Portulaca oleracea polysaccharide intake on intestinal flora structure of aged rats[J].China Industrial Economics,2024,46(3):276-282.(in Chinese)
[33] 龚志伟,马杰,苏趋,等.典型氧化还原环境中微塑料表面的微生物群落组成特征与构建机制[J].环境科学,2022,43(9):4697-4705.
GONG Z W,MA J,SU Q,et al.Composition characteristics and construction mechanism of microbial community on microplastic surface in typical redox environments[J].Environmental Science,2022,43(9):4697-4705.(in Chinese)
[34] 姜坤宏,许祯莹,郭真真,等.微生物电化学技术原理及其在畜禽废弃物资源化领域的应用研究进展[J].中国农业科技导报,2024,26(7):210-222.
JIANG K H,XU Z Y,GUO Z Z,et al.Principles of microbial electrochemical technology and its application in the recycling of livestock and poultry wastes[J].Journal of Agricultural Science and Technology,2024,26(7):210-222.(in Chinese)
[35] FORNO E,ONDERDONK A B,MCCRACKEN J,et al.Diversity of the gut microbiota and eczema in early life[J].Clinical and Molecular Allergy,2008,6:11.
[36] WANG A R,RAN C,RINGØ E,et al.Progress in fish gastrointestinal microbiota research[J].Reviews in Aquaculture,2018,10(3):626-640.
[37] NIE L,ZHOU Q J,QIAO Y,et al.Interplay between the gut microbiota and immune responses of ayu (Plecoglossus altivelis) during Vibrio anguillarum infection[J].Fish &Shellfish Immunology,2017,68:479-487.
[38] 葛家良.刺参浅海网箱养殖系统菌群结构特征及其与环境因子关系研究[D].上海:上海海洋大学,2023.
GE J L.Characteristics of bacterial community structure in the shallow sea cage culture system for Apostichopus japonicus and its potential correlation with environmental factors[D].Shanghai:Shanghai Ocean University,2023.(in Chinese)
[39] 刘艳霞,张靖婧,周叶青,等.北方吊笼养殖刺参肠道及其养殖环境菌群结构特征及其相关性分析[J].渔业科学进展,2023,44(6):190-202.
LIU Y X,ZHANG J J,ZHOU Y Q,et al.Characteristics and correlation analysis of bacterial community structure in the gut for Apostichopus japonicus and culture water in suspension cages from North China[J].Progress in Fishery Sciences,2023,44(6):190-202.(in Chinese)
[40] 谭八梅,王荦,裴泓霖,等.不同季节刺参养殖池塘水体菌群结构与功能特征研究[J].渔业科学进展,2021,42(3):77-88.
TAN B M,WANG L,PEI H L,et al.The seasonal structural and functional characteristics of bacterial community in Apostichopus japonicus culture pond water[J].Progress in Fishery Sciences,2021,42(3):77-88.(in Chinese)
[41] 窦妍,丁君,曲凌云,等.秋、冬季刺参养殖池塘菌群的多样性分析[J].大连海洋大学学报,2015,30(2):143-148.
DOU Y,DING J,QU L Y,et al.Flora diversity in sea cucumber Apostichopus japonicus culture ponds in autumn and winter[J].Journal of Dalian Ocean University,2015,30(2):143-148.(in Chinese)
[42] LI H,SONG W L,CHENG J,et al.Effects of harvest month on biochemical composition for Alligator weed for biohydrogen and biomethane cogeneration:identifying critical variations in microbial communities[J].International Journal of Hydrogen Energy,2020,45(7):4161-4173.
[43] GONG S H,DONDE O O,CAI Q J,et al.Improved lakeshore sediment microenvironment and enhanced denitrification efficiency by natural solid carbon sources[J].International Journal of Sediment Research,2022,37(6):823-832.
[44] 赵新宇,史宝,程汉良,等.肠道菌群对水产动物重要经济性状影响的研究进展[J].水产学杂志,2024,37(3):100-108,116.
ZHAO X Y,SHI B,CHENG H L,et al.Research progress on effect of gut microbiota on important economic traits of animals in aquaculture:a review[J].Chinese Journal of Fisheries,2024,37(3):100-108,116.(in Chinese)
[45] PEREIRA G V,ABDEL-HAMID A M,DUTTA S,et al.Degradation of complexarabinoxylans by human colonic bacteroidetes[J].Nature Communications,2021,12(1):459.
[46] GIBIINO G,LOPETUSO L R,SCALDAFERRI F,et al.Exploring Bacteroidetes:metabolic key points and immunological tricks of our gut commensals[J].Digestive and Liver Disease,2018,50(7):635-639.
[47] LI H,ZHONG Q P,WIRTH S,et al.Diversity of autochthonous bacterial communities in the intestinal mucosa of grass carp (Ctenopharyngodon idellus) (Valenciennes) determined by culture-dependent and culture-independent techniques[J].Aquaculture Research,2015,46(10):2344-2359.
[48] 方雪阳,田茜,孙羽佳,等.水稻细菌性谷枯病菌和水稻白叶枯病菌荧光RPA快速检测方法的建立[J].植物检疫,2023,37(1):49-55.
FANG X Y,TIAN Q,SUN Y J,et al.Establishment of fluorescence RPA detection methods for Burkholderia glumae and Xanthomonas oryzae pv.oryzae[J].Plant Quarantine,2023,37(1):49-55.(in Chinese)
[49] 冯洁.植物病原细菌分类最新进展[J].中国农业科学,2017,50(12):2305-2314.
FENG J.Recent advances in taxonomy of plant pathogenic bacteria[J].Scientia Agricultura Sinica,2017,50(12):2305-2314.(in Chinese)
[50] 许峻旗,谢建平,王志坚.大鲵皮肤溃疡死亡相关的微生物区系[J].水产学报,2022,46(11):2186-2195.
XU J Q,XIE J P,WANG Z J.Diversity of microflora involved in skin ulcer and death of Andrias davidianus[J].Journal of Fisheries of China,2022,46(11):2186-2195.(in Chinese)
[51] KADARIYA J,SMITH T C,THAPALIYA D.Staphylococcus aureus and staphylococcal food-borne disease:an ongoing challenge in public health[J].BioMed Research International,2014,2014(1):827965.
[52] 许潇冉,葛长字,张玉群,等.三株新型海参致病菌的分离鉴定及特性分析[J].湖北农业科学,2023,62(4):118-122,126.
XU X R,GE C Z,ZHANG Y Q,et al.Isolation,identification and characteristic analysis of three new pathogenic bacteria for Apostichopus japonicus[J].Hubei Agricultural Sciences,2023,62(4):118-122,126.(in Chinese)
[53] 陈静,祁露,郑雅露,等.致病性弧菌及其噬菌体防治研究进展[J].食品安全质量检测学报,2020,11(24):9288-9294.
CHEN J,QI L,ZHENG Y L,et al.Review on pathogenic Vibrio and its phage control[J].Journal of Food Safety &Quality,2020,11(24):9288-9294.(in Chinese)
[54] 邓益琴.水产动物弧菌病及其生物防治研究进展[J].大连海洋大学学报,2023,38(4):553-563.
DENG Y Q.Progress in research on vibriosis and biological control in animals in aquaculture:a review[J].Journal of Dalian Ocean University,2023,38(4):553-563.(in Chinese)
[55] DENG H,HE C B,ZHOU Z C,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumber Apostichopus japonicus[J].Aquaculture,2009,287(1/2):18-27.
[56] 李正中,刘波,邵鹏,等.发酵饲料在水产养殖中的研究进展[J].动物营养学报,2024,36(8):4847-4860.
LI Z Z,LIU B,SHAO P,et al.Research progress of fermented feed in aquaculture[J].Chinese Journal of Animal Nutrition,2024,36(8):4847-4860.(in Chinese)
[57] JAMES A K,ENGLISH C J,NIDZIEKO N J,et al.Giant kelp microbiome altered in the presence of epiphytes[J].Limnology and Oceanography Letters,2020,5(5):354-362.
[58] HOLMES E,LI J V,MARCHESI J R,et al.Gut microbiota composition and activity in relation to host metabolic phenotype and disease risk[J].Cell Metabolism,2012,16(5):559-564.
[59] LI J H,LIU P Y,MENGUY N,et al.Identification of sulfate-reducing magnetotactic bacteria via a group-specific 16S rDNA primer and correlative fluorescence and electron microscopy:strategy for culture-independent study[J].Environmental Microbiology,2022,24(11):5019-5038.
[60] WANG S Y,ZHU G B,ZHUANG L J,et al.Anaerobic ammonium oxidation is a major N-sink in aquifer systems around the world[J].The ISME Journal,2020,14(1):151-163.
[61] 支尧,张光生,郑凯凯,等.生物吸附/A2O组合工艺处理城市污水效能及其微生物群落结构[J].应用与环境生物学报,2017,23(5):892-899.
ZHI Y,ZHANG G S,ZHENG K K,et al.Operation performance and microbial structure in a combined biological adsorption/A2O system[J].Chinese Journal of Applied and Environmental Biology,2017,23(5):892-899.(in Chinese)
[62] 徐娜,任海伟,阎瑾,等.基于高通量测序分析明胶加工废水处理过程中的微生物菌群差异性[J].中国酿造,2024,43(7):86-92.
XU N,REN H W,YAN J,et al.Analysis of microbial community differences during wastewater treatment of gelatin production plants based on high-throughput sequencing[J].China Brewing,2024,43(7):86-92.(in Chinese)
[63] 王圣智.藻菌共生体在养殖废水处理中的微生物群落结构变化与污染物去除相关性研究[D].南昌:南昌大学,2024.
WANG S Z.Study on the correlation between the change of microbial community structure and pollutant removal in aquaculture wastewater treatment by algae-bacteria symbiosis[D].Nanchang:Nanchang University,2024.(in Chinese)
[64] LI W J,ZHANG L,WU H X,et al.Intestinal microbiota mediates gossypol-induced intestinal inflammation,oxidative stress,and apoptosis in fish[J].Journal of Agricultural and Food Chemistry,2022,70(22):6688-6697.
[65] ZHOU Y Q,ZHANG J J,WANG L,et al.Characterization of the bacterial community in the ecosystem of sea cucumber (Apostichopus japonicus) culture ponds:correlation and specificity in multiple media[J].Water,2022,14(9):1386.
[66] 高雪锋.EGSB耦合菌藻生物膜反应器处理模拟白酒酿造废水的研究[D].贵阳:贵州民族大学,2024.
GAO X F.Study on treatment of simulated liquor brewing wastewater by EGSB coupled with bacteria and algae biofilm reactor[D].Guiyang:Guizhou Minzu University,2024.(in Chinese)