六价铬[Hexavalent Chromium,Cr(Ⅵ)]在颜料、纺织生产、木材加工、镀铬和冶金行业中被广泛使用[1-2]。Cr(Ⅵ)对人类健康具有潜在危害,根据国际癌症研究机构的数据表明,Cr(Ⅵ)被归类为人类致癌物,其中,职业暴露是最常见的暴露途径,人类长时间接触Cr(Ⅵ)与肺癌和鼻窦癌发病具有相关性[3]。据报道,Cr(Ⅵ)存在于水环境中,浓度为1~2 mg/L[4],如此低环境浓度的Cr(Ⅵ)虽然对人类的潜在危害较小,但也不可避免地会危害水生生物健康及生态平衡。
铬的吸收主要发生在肠道中,Cr(Ⅵ)比Cr(Ⅲ)更容易被吸收。吸收的Cr(Ⅵ)会积聚在多个组织和器官中,导致胃肠道、肝脏和肾脏损伤[5]。含有数万亿微生物的肠道是消化和吸收的主要器官[6]。肠道微生物,也称为肠道微生物群,已被证明在免疫、肠道屏障、新陈代谢和宿主健康中发挥作用[7]。有研究表明,草鱼在51 mg/L Cr(Ⅵ)暴露72 h后,肠道细胞有明显的退行性变化特征,如绒毛肥大,严重的扁平化、融合和绒毛拥挤等[8]。相关研究中,小鼠口服0.1~180 mg/L的Cr(Ⅵ)饮用水后8 d和90 d会导致十二指肠有明显的隐窝增生,其细胞核严重拥挤和堆积[9]。研究表明,接触Cr(Ⅵ)可能会降低鸡的肠道微生物多样性并改变微生物组成,并降低产生短链脂肪酸细菌的丰度[10]。雄性小鼠吸入150 μg Cr/m3持续13周后,与对照组相比,微生物群落丰富度下降,优势菌株改变,肠道菌群可能通过增强产生短链脂肪酸的细菌来促进对肝毒性的代偿反应[11]。然而,迄今为止,关于Cr(Ⅵ)暴露对鱼类肠道微生物群影响的研究相对较少。
近年来,人们对评价膳食产品在减轻污染物毒性方面的作用日益关注[12-14]。如维生素C(抗坏血酸,VC)具有一定的抗氧化保护作用,因为它能够清除自由基和活性氧,还原过氧化物,修复过氧化物生物膜[15]。研究表明,维生素C(2 mg/L)预处理后可以缓解甲基汞在斑马鱼(Danio rerio)中引起的焦虑样效应,缓解大脑的氧化应激,对汞暴露引起的神经行为和神经化学改变起到保护作用[16]。研究表明,大鼠每日口服200或1 000 mg/kg剂量的维生素C 4周后可恢复高血压大鼠肠道菌群组成[17]。然而,关于维生素C对缓解Cr(Ⅵ)诱导的肠道微生物群影响的相关研究相对较少,维生素C是否能缓解Cr(Ⅵ)诱导的肠道微生物稳态的影响仍然未知。
在水生毒性试验中,鱼类被描述为广泛分布的脊椎动物类群,几乎所有化学物质都必须经过急性鱼类毒性试验。多年来,斑马鱼作为一种代表性的模式生物,经常被用于研究各种物质或环境因素的毒性作用和机制[18-22]。本试验中研究了Cr(Ⅵ)作为环境污染物对成年斑马鱼肠道里粪便微生物菌群稳态的影响,并评估了维生素C作为一种天然的经济实惠的抗氧化剂在预防这种毒性作用中的有效性,以期为水生生态系统受重金属污染后的修复提供一定的数据支撑。
1 材料与方法
1.1 材料
重铬酸钾(K2Cr2O7,Cr(Ⅵ),95%纯度)购自Sigma Aldrich。L(+)-抗坏血酸(Vitamin C,纯度99.7%)购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 斑马鱼饲养及试验设计 健康成年斑马鱼购自武汉国家斑马鱼资源中心。斑马鱼需经过两周驯化适应环境,饲养在27 ℃±1 ℃的水中,水中溶氧量为5.9~7.0 mg/L,pH 7.1~7.4,保持14 h∶10 h(光照∶黑暗)周期,每天喂食2次市售饲料(购自上海海圣生物科技有限公司,AP100斑马鱼专用饲料5#)。在整个试验过程中,保持饲养条件。每隔1天换1次浸泡溶液,以排出代谢废物。试验期间严格遵守动物伦理委员会的规定,并采取措施保护试验动物的福利。将540条鱼随机分为12个鱼缸中,每个鱼缸装10 L脱氯自来水(每缸45条鱼),每组放置3个平行,分别命名为Con组(即脱氯自来水作为对照组)、VC组(即维生素C处理组,浓度为2 mg/L)、Cr组(即Cr(Ⅵ)处理组,浓度为2 mg/L),Cr+VC组(即Cr(Ⅵ)与维生素C共处理组,浓度为2 mg/L)。在 60 d的暴露后,对鱼实施安乐死,并将其肠道解剖以进一步研究。在整个暴露过程中,任何治疗组均未观察到死亡。为了具有统计学意义,每个试验至少进行3 次(n=3),重复3次。
1.2.2 肠道采集 取样前需禁食24 h,采用0.03%间氨基苯甲酸乙酯甲磺酸盐(MS-222)对斑马鱼进行麻醉。麻醉后使用无菌剪刀和镊子解剖,取得的斑马鱼肠道收集肠道内容物置于无菌EP管中,保存好以便后续研究。随后立即使用液氮冷冻,置于-80 ℃下保存,用于后续提取DNA。
1.2.3 16S rRNA高通量测序和分析 收集斑马鱼的肠道内容物并置于-80 ℃下进行DNA提取。提取基因组DNA,并检测其质量。使用引物338F和806R通过PCR扩增细菌16S核糖体RNA基因的V3~V4区域。然后使用AxyPrepDNA凝胶提取试剂盒纯化PCR产物。纯化后,按照标准程序构建扩增子文库。然后在MiSeq Illumina测序平台上进行测序。
1.2.4 样品OTU、菌群多样性及群落组成分析 样品测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。
按照Mothur软件的分析流程进行序列OTU聚类。依据不同样品中的OTU分布,对OTU进行多种Alpha多样性指数分析。
基于分类学信息,在各个分类水平上进行群落结构的统计分析。在上述分析的基础上,可对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析。
1.3 数据处理
采用SPSS软件进行数据统计,采用单因素方差分析和独立样本t检验分析。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 斑马鱼肠道菌群的OTU数量
图1可以直观地展现不同组别样本中物种组成相似性及交叉情况,结果显示,Cr组(212种)中的OTU大于Con组(170种),其中,Con组中的独有OTU为35种,VC组中的独有OTU为113种,Cr组中的独有OTU为24种,Cr+VC组中的独有OTU为21种,4个组共有OTU为89种,Con组、VC组、Cr组、Cr+VC组具有特异性。
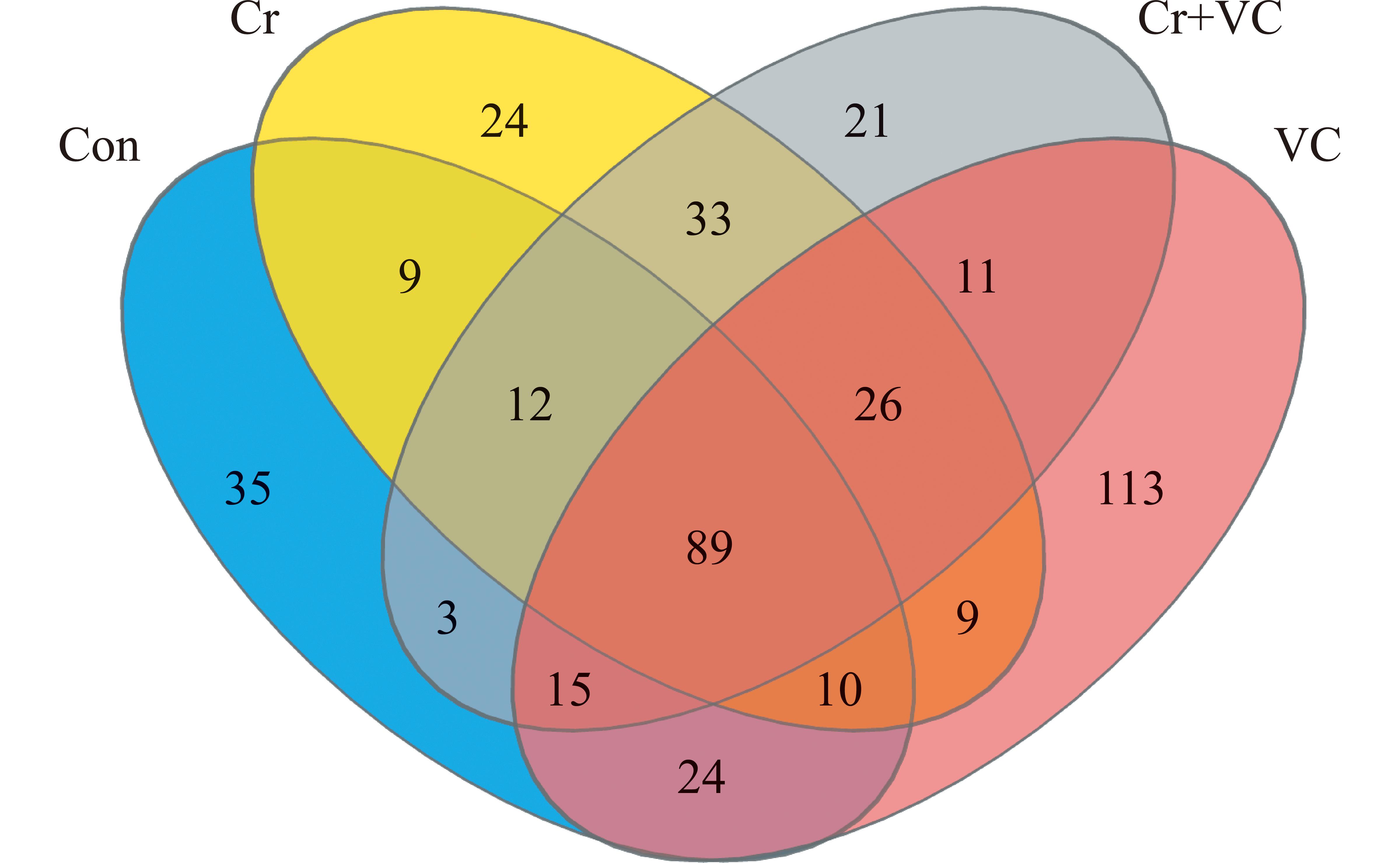
Con—对照组;VC—VC组;Cr—Cr组;Cr+VC—Cr+VC组。Con—control group;VC—VC group;Cr—Cr group;Cr+VC—Cr+VC group.
图1 不同处理斑马鱼肠道菌群OTU数量
Fig.1 Number of OTU in the intestinal flora of zebrafish from different treatments
2.2 Alpha多样性分析
表1为各组肠道菌群多样性指数,从表1可见,Chao 1指数、Shannon指数和Ace指数显示,Cr组高于对照组的肠道菌群丰富度(P<0.05),而Cr+VC组低于Cr组的丰富度。Simpson指数随着数值的增大,丰富度减少;Simpson指数显示,Cr组的肠道菌群多样性指数高于Con组的多样性,而Cr+VC组低于Cr组的丰富度。上述结果表明,在Alpha多样性方面,VC可以缓解Cr对斑马鱼肠道菌群多样性的影响。
表1 各组肠道菌群多样性指数
Tab.1 Diversity index of intestinal microbiota in each group
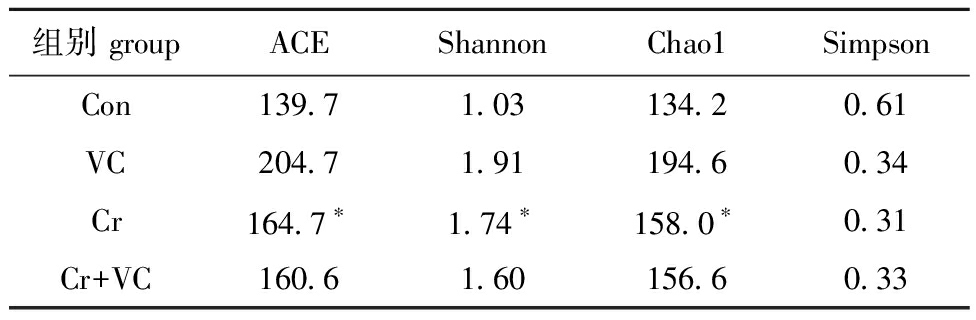
组别 groupACEShannonChao1SimpsonCon139.71.03134.20.61VC204.71.91194.60.34Cr164.7∗1.74∗158.0∗0.31Cr+VC160.61.60156.60.33
注:*表示与对照组有显著性差异(P<0.05)。
Note:*means significant difference compared with the control (P<0.05).
2.3 Beta多样性分析
PCoA分析(principal co-ordinates analysis)是用来研究样本群落组成的差异性或相似性的方法。结果显示,在OTU水平上Con组和Cr组之间的肠道菌群具有较明显的差异,Cr组和Cr+VC组间存在差异,表明各组间肠道微生物群的主要成分有显著性差异(P<0.05)(图2)。
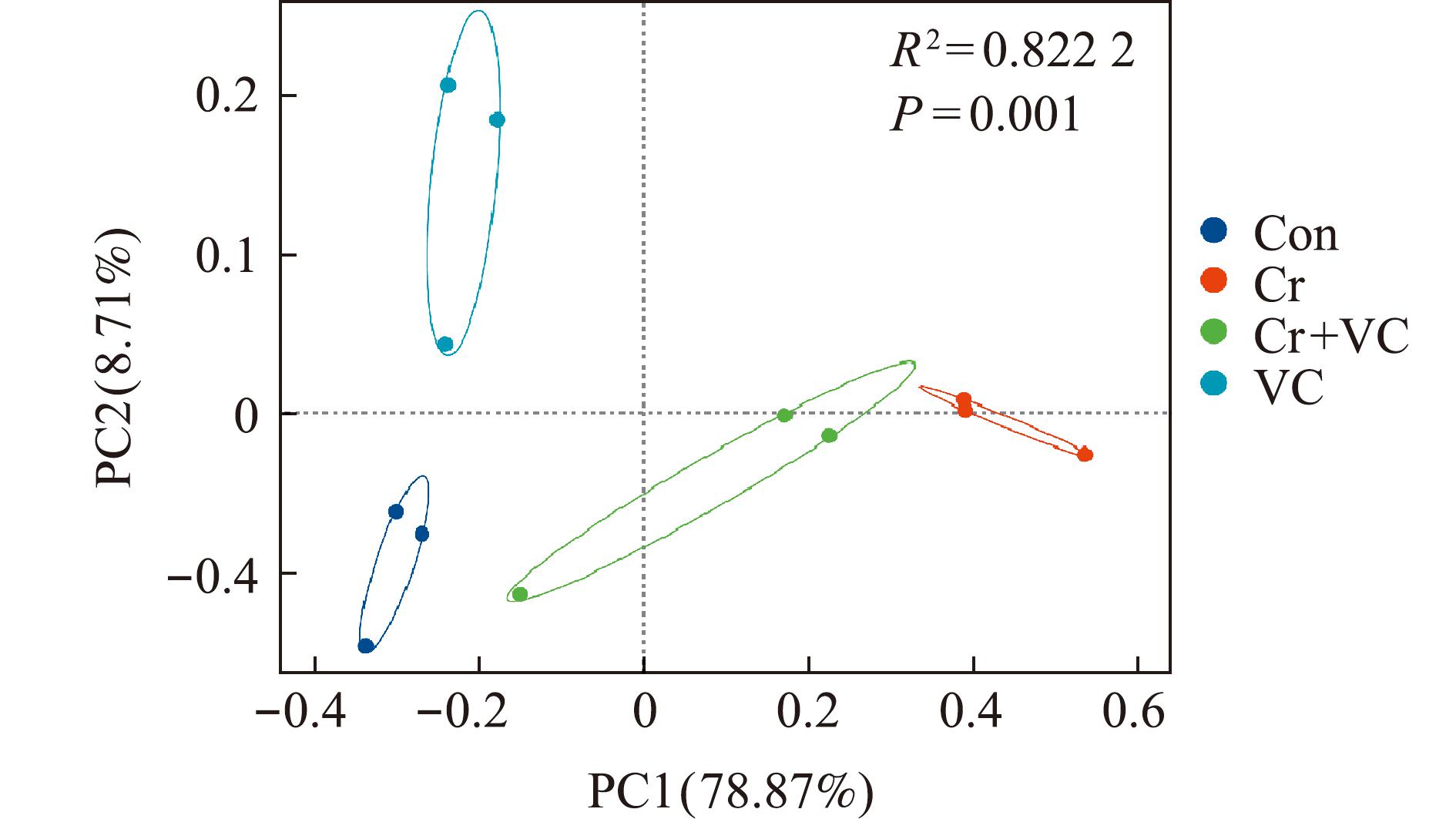
OUT水平上的PcoA分析,图中X轴和Y轴代表了两个主成分轴,百分比表示主成分对样本组成差异的解释度值,不同颜色的点代表不同分组的样本。
PcoA analysis at the OUT level,where the X and Y axes represent the two principal component axes,and the percentage indicates the value of the degree of explanation of the differences in the composition of the samples by the principal components,with the different colored dots representing the different groupings of samples.
图2 不同处理的斑马鱼PCoA分析
Fig.2 PCoA analysis of zebrafish with different treatments
2.4 肠道微生物群落组成的变化
2.4.1 门水平的物种丰度 Con组、VC组、Cr组和Cr+VC组肠道菌群的前10个门如图3所示,前10个门排序分别为梭杆菌门(Fusobacteriota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟门杆菌门(Bacteroidota)、疣微菌门(Verrucomicrobiota)、放线菌门(Actinobacteriota)、未分类菌(unclassified bacteria),蓝藻门(Cyanobacteria)、奇异球菌门(Deinococcota)、髌骨菌门(Patescibacteria)。在Con组中梭杆菌门、变形菌门和拟门杆菌门是优势菌门,在VC组、Cr组和Cr+VC组中梭杆菌门、变形菌门和厚壁菌门是优势菌门,是占比前三的菌门,占比微生物群落的96%以上。Con组的梭杆菌门占比为77.52%,VC组占比为56.52%,Cr组占比为13.14%,Cr+VC组占比为47.73%。Con组的变形菌门占比为13.91%,VC组占比为29.25%,Cr组占比为29.13%,Cr+VC组占比为24.82%。Con组的厚壁菌门占比为2.83%,VC组占比为10.55%,Cr组占比为56.49%,Cr+VC组占比为26.08%。其余门的丰度占比极低或无,其中,Con组、VC组、Cr组和Cr+VC组的相对丰度占比分别为拟门杆菌门(3.57%、1.06%、0.58%、0.86%)、疣微菌门(1.98%、0.92%、0.007%、0.01%)、放线菌门(0.093%、1.11%、0.15%、0.16%)、蓝藻门(0%、0.39%、0%、0.003%)、奇异球菌门(0.01%、0.02%、0.16%、0.02%)和髌骨菌门(0%、0.01%、0.06%、0.02%),且各组间无显著性差异(P>0.05)。
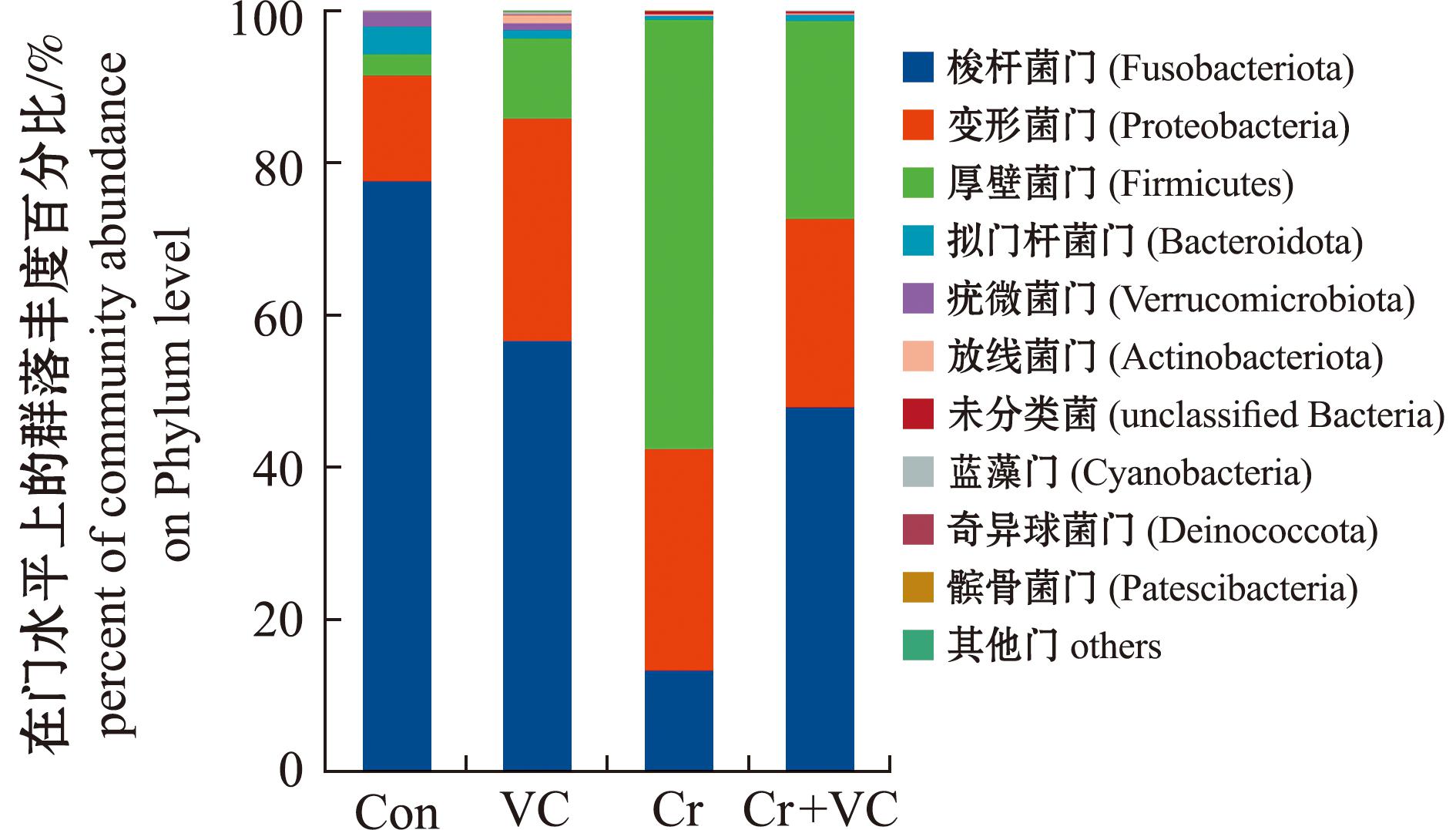
图3 在门水平上每组斑马鱼肠道的微生物群落组成
Fig.3 Microbial community composition of the zebrafish gut in each group at thephylum level
为探索VC缓解Cr(Ⅵ)暴露对斑马鱼的肠道微生物群落结构的影响,进一步对其在Con组、Cr组及Cr+VC组的物种相对丰度差异进行比较分析(图4)。在门水平上,Con组和Cr组的梭杆菌门占比存在极显著性差异(P<0.001),Cr组的处理导致梭杆菌门的相对丰度减少,而Cr+VC组处理使得梭杆菌门的相对丰度增加(图4(a))。Con组和Cr组的厚壁菌门占比存在极显著性差异(P<0.001),Cr组的处理导致厚壁菌门的相对丰度增加,而Cr+VC组处理使得梭杆菌门的相对丰度减少(图4(b)),在未分类菌、奇异球菌门中也有同样的体现(图4(g),(i))。
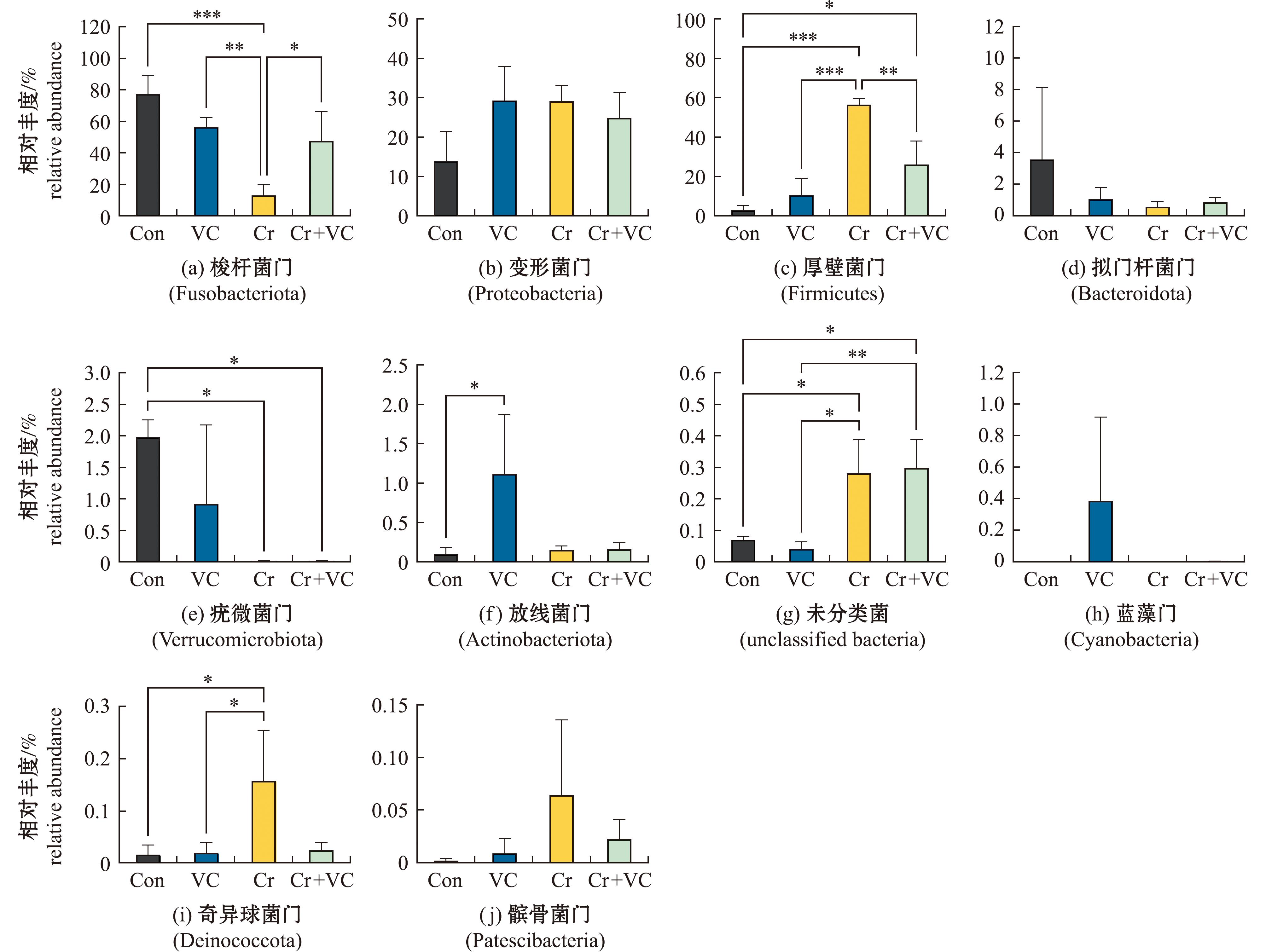
*表示P<0.05,**表示P<0.01,***表示P<0.001,说明组间存在显著性差异或极显著性差异,下同。
*means P<0.05,**means P<0.01,***means P<0.001,indicating significant differences or very significantly different between groups,et sequentia.
图4 优势菌显著性差异分析
Fig.4 Significant difference analysis of dominant bacteria
2.4.2 属水平的物种丰度 Con组、VC组、Cr组和Cr+VC组肠道菌群的前10个门如图5所示,前10个门排序分别为鲸杆菌属(Cetobacterium)、微小杆菌属(Exiguobacterium)、气单胞菌属(Aeromonas)、邻单胞菌属(Plesiomonas)、红杆菌属(Rhodobacteraceae)、ZOR0006属(ZOR0006)、葡萄球菌属(Staphylococcus)、未分类的巴恩斯氏菌科(norank Barnesiellaceae)、未分类的疣微菌科(unclassified Verrucomicrobiales)、Chitinibacter属(Chitinibacter)。其中,Con组的鲸杆菌属占比为77.52%,VC组占比为56.52%,Cr组占比为13.14%,Cr+VC组占比为47.73%。Con组的微小杆菌属占比为2.65%,VC组占比为6.96%,Cr组占比为52.03%,Cr+VC组占比为22.13%。Con组的气单胞菌属占比为7.39%,VC组占比为7.58%,Cr组占比为17.43%,Cr+VC组占比为15.93%。其余属的丰度占比中,Con组、VC组、Cr组和Cr+VC组的相对丰度分别为邻单胞菌属(3.45%、1.43%、7.08%、5.67%)、红杆菌属(1.04%、8.71%、1.14%、0.61%)、ZOR0006属(0.15%、0.27%、3.99%、3.65%)、葡萄球菌属(0.01%、3.25%、0.09%、0.06%)、未分类的巴恩斯氏菌科(2.99%、0%、0.02%、0%)、未分类的疣微菌科(1.97%、0.91%、0%、0%)和Chitinibacter属(0.11%、0.96%、0.77%、1.54%),各组间无明显差异。
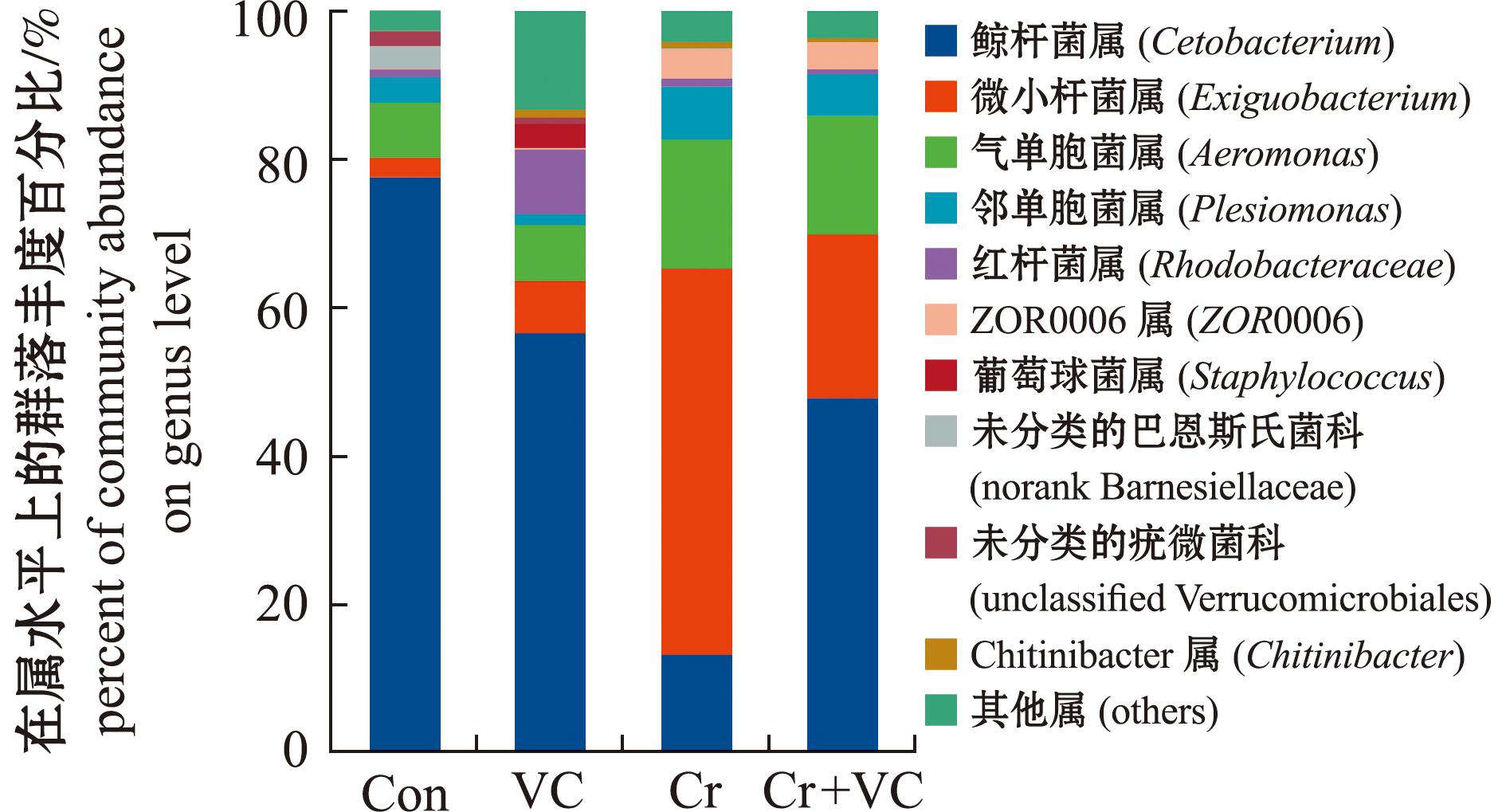
图5 属水平上每组斑马鱼肠道的微生物群落组成
Fig.5 Microbial community composition of the zebrafish gut in each group at the genus level
从图6可见,在门水平上,Con组和Cr组的鲸杆菌属占比存在极显著性差异(P<0.001),Cr组的处理导致梭杆菌门的相对丰度减少,而Cr+VC组处理使得梭杆菌门的相对丰度增加(图6(a))在未分类菌的疣微菌科中也有类似趋势的体现(图6(i))。Con组和Cr组的微小杆菌属占比存在极显著性差异(P<0.001),Cr组的处理导致梭杆菌门的相对丰度增加,而Cr+VC组处理使得梭杆菌门的相对丰度减少(图6(b))。
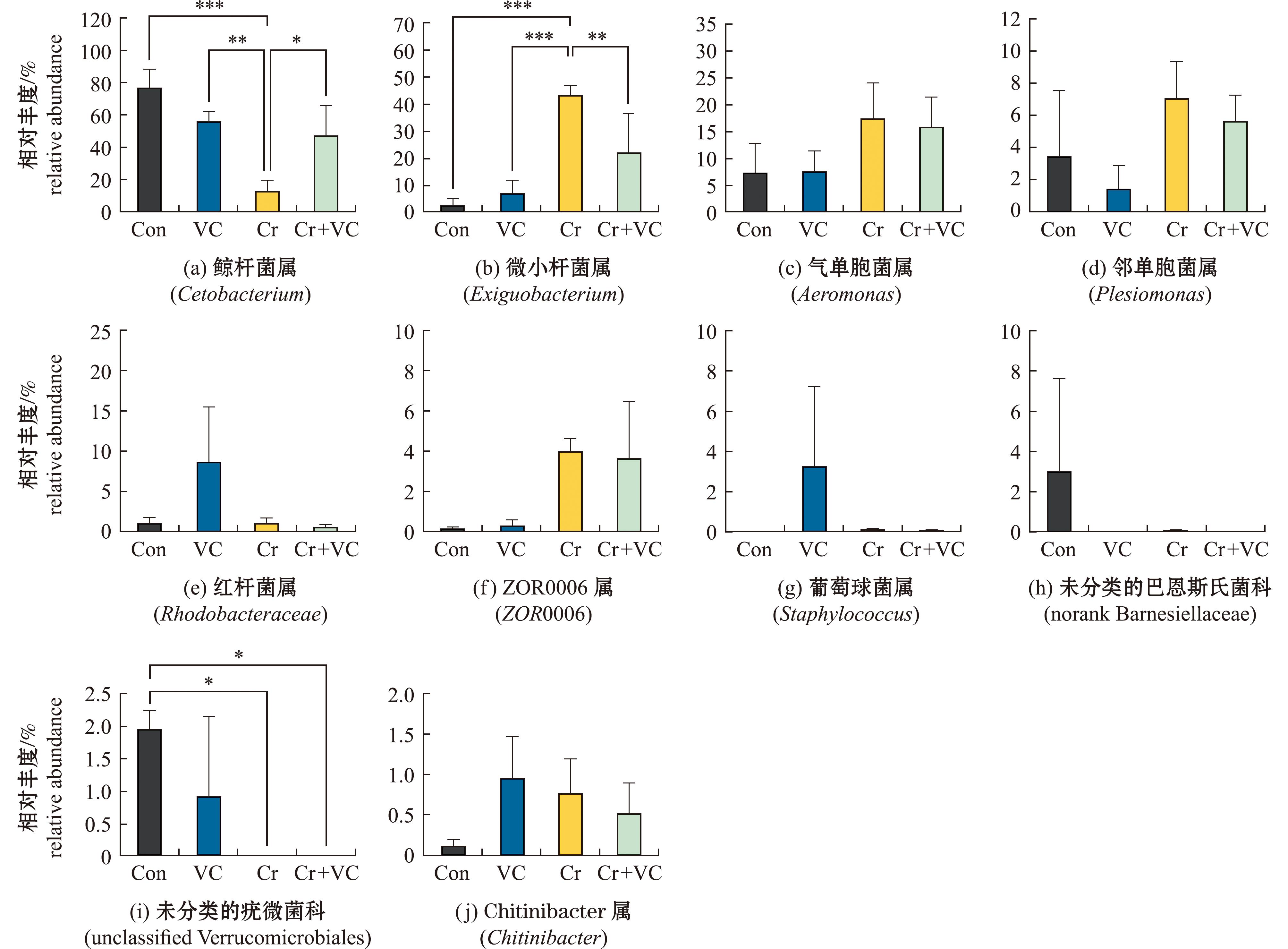
图6 优势菌显著性差异分析
Fig.6 Significant difference analysis of dominant bacteria
2.5 微生物功能预测
根据图7功能分析,24个COG中分类最丰富的前7个为“能源生产和转换”、“氨基酸运输与代谢”、“辅酶转运和代谢”、“翻译,核糖体结构和生物合成”、“复制,重组和修复”、“细胞壁/膜/被膜的生物合成”和“细胞运动”。与对照组相比,Cr组的COGs中富集的C(能源生产和转换)、E(氨基酸运输与代谢)、H(辅酶转运和代谢)、J(翻译,核糖体结构和生物合成)、L(复制、重组和修复)和M(细胞壁/膜/被膜的生物合成)的相对丰度略有降低,其中,E(氨基酸运输与代谢)功能下降最多,而Cr+VC组的相对丰度与对照组相差不大。与对照组相比,Cr组COGs中富集的N(细胞运动)相对丰度略微增加,而Cr+VC组相对丰度与对照组相差不大。
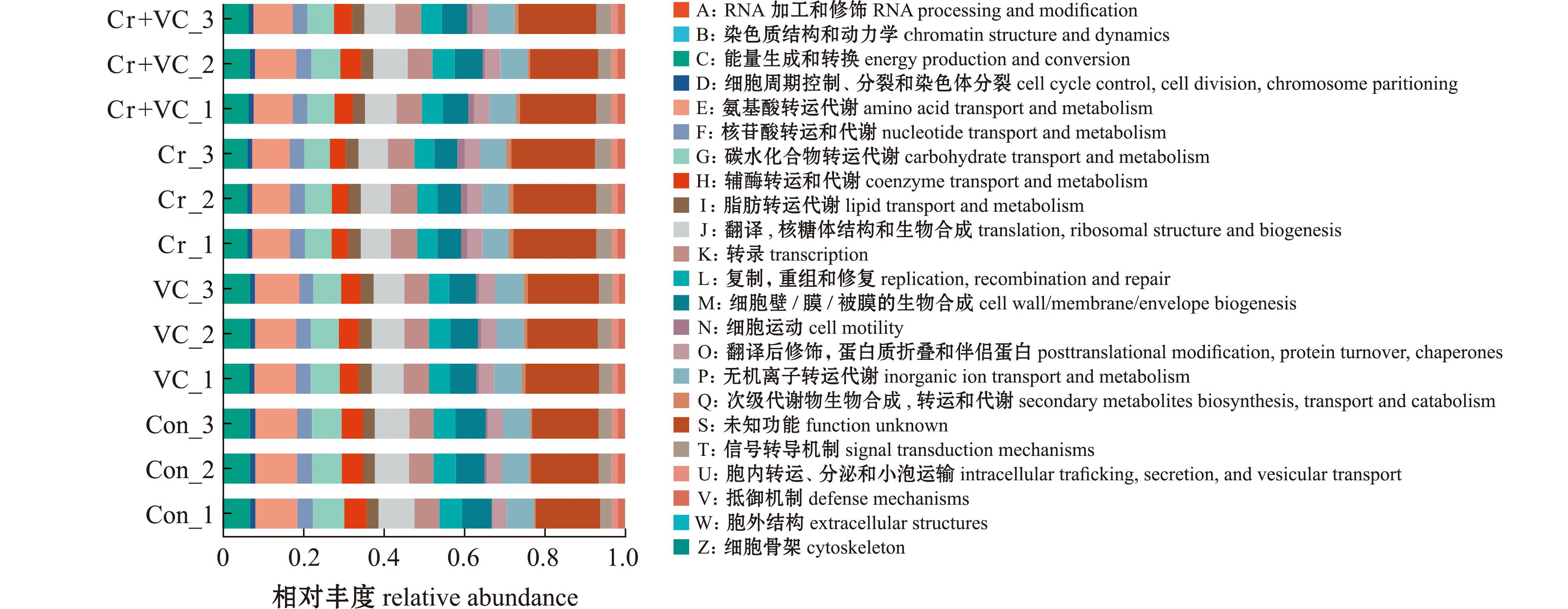
图7 COG功能分类
Fig.7 COG function classification statistics
3 讨论
3.1 维生素C缓解Cr(Ⅵ)诱导的斑马鱼肠道微生物菌群多样性的影响
近年来,动物因直接或间接接触金属污染物而引起的胃肠道、呼吸道疾病和皮肤病的暴发已在世界范围内广泛报道。因此,重金属污染对环境质量和动物健康的潜在危害越来越引起人们的关注[23]。研究表明,铬可以通过多种方式被宿主吸收,如消化系统、表皮和呼吸系统,此外,消化道摄入的铬还可以通过血液循环进入肝、肾、肠等其他器官,进一步威胁宿主的健康[24]。早期研究表明,长期接触铬会导致肉鸡生长性能显著下降并扰乱肠道微生物稳态[25]。此外,Cr(Ⅵ)暴露也被证明会引起明显的胃肠道症状[11]。众所周知,肠道在营养吸收和宿主健康中起着重要作用,而宿主健康又取决于正常的肠道微生物群结构[26-27]。虽然肠道微生物群栖息在肠道中,但它会对宿主全身造成影响,因此,维持肠道微生物稳态对宿主健康至关重要[28-29]。通过消化道摄入铬不可避免地会影响肠道菌群平衡并导致肠道损伤,但具有抗氧化特性的维生素C能否恢复肠道菌群平衡仍是未知数。因此,本研究中系统地探讨了维生素C对Cr(Ⅵ)诱导的斑马鱼肠道菌群的保护作用。
肠道菌群在环境、年龄和饮食的影响下有生理波动,这种波动不会影响肠道稳态和功能[30]。然而,重金属、抗生素和杀虫剂等强刺激会显著影响肠道微生物组成并损害肠道稳态,导致肠道微生物生态平衡失调[31]。本团队研究结果表明,随着2 mg/L的Cr(Ⅵ)的诱导,斑马鱼肠道微生物群的α多样性上升,说明Cr(Ⅵ)扰动斑马鱼的肠道微生物群稳态,然而,添加2 mg/L的维生素C后可以缓解由Cr(Ⅵ)暴露引起的肠道微生物生态失调。稳定的肠道微生物群是肠道执行各种复杂生理功能的先决条件,而肠道微生物菌群失调可能威胁肠道稳态和宿主健康[6]。此外,肠道微生物菌群失调也会影响肠道屏障功能和免疫系统,从而增加对病原体的易感性[7]。重要的是,一些病原体可能会在肠道微生物生态失调期间引起疾病,严重威胁动物的生活和健康[32]。因此,斑马鱼慢性暴露于Cr(Ⅵ)可能会引起其他并发症和肠道功能障碍。此外,本研究中还进行了Beta多样性分析,以进一步剖析维生素C缓解Cr(Ⅵ)暴露对肠道菌群主要成分的影响。本研究表明,Cr组的斑马鱼肠道菌群样本聚集集中并与对照组的种群有明显分离,表明各组间肠道微生物主要成分存在明显差异。
3.2 维生素缓解Cr(Ⅵ)诱导的斑马鱼肠道微生物群落组成的影响
Stephens等[33]的研究发现,斑马鱼胃肠道微生物组的顶级优势门为变形菌门、梭杆菌门和厚壁菌门。笔者观察到Cr(Ⅵ)暴露可能导致肠道微生物组成的显著变化,表明肠道微生物稳态被破坏,试验结果表明,Cr(Ⅵ)暴露导致肠道的鲸杆菌属(梭杆菌门)丰度显著减少,肠道微小杆菌属(厚壁菌门)丰度增加,气单胞菌属(变形菌门)下降但未表现出显著性,Cr(Ⅵ)暴露导致改变了肠道优势门的占比,在添加维生素C后可以恢复一部分斑马鱼肠道菌群鲸杆菌属、微小杆菌属和气单胞菌属的丰度。有研究表明,鲸杆菌是健康的传感器,特别是对于感染病原菌的鱼类;索氏鲸杆菌可以产生维生素B12,同时证明维生素B12可作为一种微生物间的调节剂,可以加强肠道微生物群和肠道屏障紧密连接内相互作用的能力,从而提高宿主对病原体感染的抵抗力[34]。气单胞菌属最常引起胃肠道系统感染,然而,如果治疗不当,这些过程会演变并达到感染全身的程度,从而产生败血症[35]。根据前人研究,微小杆菌属能够代谢纤维素并发酵碳水化合物以产生短链脂肪酸,这些脂肪酸是已知的抗炎介质,可以调节免疫系统[36]。斑马鱼肠道菌群的菌株占比发生改变,肠道菌群可能通过增强产生短链脂肪酸的细菌来促进对肝毒性的代偿反应[11]。Cr(Ⅵ)暴露可能会破坏肠道微生物稳态,从而进一步对宿主健康产生不利影响,但上述结果表明,维生素C可以缓解Cr(Ⅵ)诱导肠道微生物群落结构的影响。
3.3 维生素缓解Cr(Ⅵ)诱导的斑马鱼肠道微生物功能的影响
有研究显示,微生物功能预测分析表明,原发性肝癌肠道菌群失调与氨基酸代谢、复制修复、核苷酸代谢、细胞运动、细胞生长和死亡、转录等多种途径有关[37]。笔者研究中微生物功能预测分析结果显示,肠道菌群失调可能与E(氨基酸运输与代谢)、C(能源生产和转换)、H(辅酶转运和代谢)、J(翻译,核糖体结构和生物合成)、L(复制、重组和修复)、M(细胞壁/膜/被膜的生物合成)和N(细胞运动)等功能有一定的关联。维生素B12是肠道微生物合成的关键物质,直接参与E(氨基酸运输与代谢)和C(能量生产和转化),是斑马鱼肠道核心菌(索氏鲸杆菌),该菌能合成维生素B12,可以加强肠道微生物群和肠道屏障紧密连接内相互作用的能力,从而提高宿主对病原体感染的抵抗力;此外,维生素B12依赖性信号通路可调节鞭毛蛋白合成,恢复微生物的N(细胞运动)[36]。在Cr(Ⅵ)诱导下,补充维生素B12可恢复菌群中辅酶依赖的通路(如丙酸代谢和琥珀酸循环),从而改善能量供应失调[38]。维生素作为辅酶或直接抗氧化剂,可缓解Cr(Ⅵ)诱导的氧化损伤。例如,维生素C和E通过再生谷胱甘肽增强GPX4酶活性,抑制铁死亡途径[39];虾青素(维生素A衍生物)则通过稳定SLC7A11/GPX4信号轴,减少斑马鱼脑组织ROS累积和脂质过氧化[40]。这些作用与菌群中抗氧化相关功能的恢复呈正相关。结果表明,Cr(Ⅵ)暴露导致斑马鱼肠道菌群在多个功能类别上发生改变,尤其涉及E(氨基酸运输与代谢)、C(能源生产和转换)、H(辅酶转运和代谢)、J(翻译,核糖体结构和生物合成)、L(复制、重组和修复)、M(细胞壁/膜/被膜的生物合成)和N(细胞运动)等功能途径。这些功能的紊乱与Cr(Ⅵ)直接引发的氧化应激和细胞损伤密切相关。例如,Cr(Ⅵ)可显著抑制斑马鱼胚胎中细胞周期基因(如cdk4,cdk6)和抗氧化基因(如sod1,sod2)的表达,同时激活凋亡通路(Bax/Bcl2-Caspase3),进而干扰能量代谢和DNA修复等核心功能[41]。
4 结论
1)Cr(Ⅵ)暴露诱导斑马鱼肠道菌群的稳态失衡,导致斑马鱼肠道微生物群的α多样性上升,但添加2 mg/L的维生素C后可以缓解由Cr(Ⅵ)暴露引起的肠道微生物生态失调。
2)Cr(Ⅵ)暴露导致肠道中有益菌丰度显著减少,且有害菌丰度减少,但维生素C可以恢复一部分斑马鱼肠道菌群的丰度。
3)肠道菌群失调与肠道菌群的功能预测富集通路可能有一定关联,主要富集在能源生产与转换、氨基酸运输与代谢、辅酶转运与代谢、重组和修复等通路。
4)本研究中探讨了维生素C对Cr(Ⅵ)暴露斑马鱼肠道菌群的保护作用,但鉴于肠道菌群本身的复杂多样性,维生素C对肠道菌群调节及相关机制仍需要深入研究。
[1] DESMARIAS T L,COSTA M.Mechanisms of chromium-induced toxicity[J].Current Opinion in Toxicology,2019,14:1-7.
[2] KANDPAL V,KUMAR D,BISHT R.Protective effect of vitamin E on haematological parameters in chronic toxicity of hexavalent chromium in laboratory chicks[J].Journal of Drug Delivery and Therapeutics,2019,9(3):388-392.
[3] WANG Z S,YANG C F.Metal carcinogen exposure induces cancer stem cell-like property through epigenetic reprograming:a novel mechanism of metal carcinogenesis[J].Seminars in Cancer Biology,2019,57:95-104.
[4] BAKSHI A,PANIGRAHI A K.A comprehensive review on chromium induced alterations in fresh water fishes[J].Toxicology Reports,2018,5:440-447.
[5] LUO M,HUANG S C,ZHANG J L,et al.Effect of selenium nanoparticles against abnormal fatty acid metabolism induced by hexavalent chromium in chicken’s liver[J].Environmental Science and Pollution Research International,2019,26(21):21828-21834.
[6] LI A Y,LIU B X,LI F R,et al.Integrated bacterial and fungal diversity analysis reveals the gut microbial alterations in diarrheic giraffes[J].Frontiers in Microbiology,2021,12:712092.
[7] LIU J,WANG H W,LIN L,et al.Intestinal barrier damage involved in intestinal microflora changes in fluoride-induced mice[J].Chemosphere,2019,234:409-418.
[8] SHAH N,KHISROON M,SHAH S S A.Metals distribution,histopathological alterations,and health risk assessment in different tissues of fish (Ctenopharyngodon idella)[J].Biological Trace Element Research,2021,199(7):2730-2752.
[9] CHAPPELL G A,WOLF J C,THOMPSON C M.Crypt and villus transcriptomic responses in mouse small intestine following oral exposure to hexavalent chromium[J].Toxicological Sciences,2022,186(1):43-57.
[10] LI A Y,DING J X,SHEN T,et al.Environmental hexavalent chromium exposure induces gut microbial dysbiosis in chickens[J].Ecotoxicology and Environmental Safety,2021,227:112871.
[11] ZHANG Y L,LONG C M,HU G P,et al.Two-week repair alleviates hexavalent chromium-induced hepatotoxicity,hepatic metabolic and gut microbial changes:a dynamic inhalation exposure model in male mice[J].Science of the Total Environment,2023,857:159429.
[12] ZENG X Q,DU Z J,DING X M,et al.Protective effects of dietary flavonoids against pesticide-induced toxicity:a review[J].Trends in Food Science &Technology,2021,109:271-279.
[13] DALE K,RASINGER J D,THORSTENSEN K L,et al.Vitamin E reduces endosulfan-induced toxic effects on morphology and behavior in early development of zebrafish (Danio rerio)[J].Food and Chemical Toxicology,2017,101:84-93.
[14] LI S F,CAO C,SHI H D,et al.Effect of quercetin against mixture of four organophosphate pesticides induced nephrotoxicity in rats[J].Xenobiotica,2016,46(3):225-233.
[15] ![]() J,BOGUSZEWSKA K,ADAMUS-GRABICKA A,et al.Two faces of vitamin C-antioxidative and pro-oxidative agent[J].Nutrients,2020,12(5):1501.
J,BOGUSZEWSKA K,ADAMUS-GRABICKA A,et al.Two faces of vitamin C-antioxidative and pro-oxidative agent[J].Nutrients,2020,12(5):1501.
[16] PUTY B,MAXIMINO C,BRASIL A,et al.Ascorbic acid protects against anxiogenic-like effect induced by methylmercury in zebrafish:action on the serotonergic system[J].Zebrafish,2014,11(4):365-370.
[17] LI Y,SALIH IBRAHIM R M,CHI H L,et al.Altered gut microbiota is involved in the anti-hypertensive effects of vitamin C in spontaneously hypertensive rat[J].Molecular Nutrition &Food Research,2021,65(7):e2000885.
[18] JIJIE R,MIHALACHE G,BALMUS I M,et al.Zebrafish as a screening model to study the single and joint effects of antibiotics[J].Pharmaceuticals,2021,14(6):578.
[19] CAHOVA J,BLAHOVA J,PLHALOVA L,et al.Do single-component and mixtures selected organic UV filters induce embryotoxic effects in zebrafish (Danio rerio)?[J].Water,2021,13(16):2203.
[20] FARIA M,PRATS E,ROSAS RAM REZ J R,et al.Androgenic activation,impairment of the monoaminergic system and altered behavior in zebrafish larvae exposed to environmental concentrations of fenitrothion[J].Science of the Total Environment,2021,775:145671.
REZ J R,et al.Androgenic activation,impairment of the monoaminergic system and altered behavior in zebrafish larvae exposed to environmental concentrations of fenitrothion[J].Science of the Total Environment,2021,775:145671.
[21] PLHALOVA L,SEHONOVA P,BLAHOVA J,et al.Evaluation of tramadol hydrochloride toxicity to juvenile zebrafish:morphological,antioxidant and histological responses[J].Applied Sciences,2020,10(7):2349.
[22] BLAHOVA J,COCILOVO C,PLHALOVA L,et al.Embryotoxicity of atrazine and its degradation products to early life stages of zebrafish (Danio rerio)[J].Environmental Toxicology and Pharmacology,2020,77:103370.
[23] YAO Q,YANG H Y,WANG X C,et al.Effects of hexavalent chromium on intestinal histology and microbiota in Bufo gargarizans tadpoles[J].Chemosphere,2019,216:313-323.
[24] ZHANG Z C,CAO H Y,SONG N,et al.Long-term hexavalent chromium exposure facilitates colorectal cancer in mice associated with changes in gut microbiota composition[J].Food and Chemical Toxicology,2020,138:111237.
[25] LI Y X,XIA S T,JIANG X H,et al.Gut microbiota and diarrhea:an updated review[J].Frontiers in Cellular and Infection Microbiology,2021,11:625210.
[26] BRÜSSOW H.Growth promotion and gut microbiota:insights from antibiotic use[J].Environmental Microbiology,2015,17(7):2216-2227.
[27] COELHO O G L,C NDIDO F G,ALFENAS R C G.Dietary fat and gut microbiota:mechanisms involved in obesity control[J].Critical Reviews in Food Science and Nutrition,2019,59(19):3045-3053.
NDIDO F G,ALFENAS R C G.Dietary fat and gut microbiota:mechanisms involved in obesity control[J].Critical Reviews in Food Science and Nutrition,2019,59(19):3045-3053.
[28] GREENHILL C.Exercise affects gut microbiota and bone[J].Nature Reviews Endocrinology,2018,14:322.
[29] MA Z,GAO X,YANG X,et al.Low-dose florfenicol and copper combined exposure during early life induced health risks by affecting gut microbiota and metabolome in SD rats[J].Ecotoxicology and Environmental Safety,2022,245:114120.
[30] HU J,NIE Y F,CHEN J W,et al.Gradual changes of gut microbiota in weaned miniature piglets[J].Frontiers in Microbiology,2016,7:1727.
[31] KONG A N,ZHANG C,CAO Y B,et al.The fungicide thiram perturbs gut microbiota community and causes lipid metabolism disorder in chickens[J].Ecotoxicology and Environmental Safety,2020,206:111400.
[32] WANG J J,ZHU G N,SUN C,et al.TAK-242 ameliorates DSS-induced colitis by regulating the gut microbiota and the JAK2/STAT3 signaling pathway[J].Microbial Cell Factories,2020,19(1):158.
[33] STEPHENS W,BURNS A R,STAGAMAN K,et al.The composition of the zebrafish intestinal microbial community varies across development[J].The ISME Journal,2016,10(3):644-654.
[34] QI X Z,ZHANG Y,ZHANG Y L,et al.Vitamin B12 produced by Cetobacterium somerae improves host resistance against pathogen infection through strengthening the interactions within gut microbiota[J].Microbiome,2023,11(1):135.
[35] PARKER J L,SHAW J G.Aeromonas spp.clinical microbiology and disease[J].Journal of Infection,2011,62(2):109-118.
[36] SMITH P,WILLEMSEN D,POPKES M,et al.Regulation of life span by the gut microbiota in the short-lived African turquoise killifish[J].eLife,2017,6:e27014.
[37] ZHANG W Z,XU X S,CAI L P,et al.Dysbiosis of the gut microbiome in elderly patients with hepatocellular carcinoma[J].Scientific Reports,2023,13(1):7797.
[38] QI X, ZHANG Y, ZHANG Y, et al. Vitamin B12 produced by Cetobacterium somerae improves host resistance against pathogen infection through strengthening the interactions within gut microbiota[J].Microbiome, 2023,11(1):135.
[39] WANG X, LIN Z, LI T, et al. Sodium Selenite Prevents Matrine-Induced Nephrotoxicity by Suppressing Ferroptosis via the GSH-GPX4 Antioxidant System[J].Biological Trace Element Research, 2024,202(10):4674-4686.
[40] LI M Y, SHI Y C, XU W X, et al. Exploring Cr(Ⅵ)-induced blood-brain barrier injury and neurotoxicity in zebrafish and snakehead fish, and inhibiting toxic effects of astaxanthin[J].Environmental Pollution, 2024,355:124280.
[41] DANG K D, HO C N Q, VAN H D, et al. Hexavalent Chromium Inhibited Zebrafish Embryo Development by Altering Apoptosis and Antioxidant-Related Genes[J].Current Issues in Molecular Biology, 2023,45(8):6916-6926.