大口黑鲈(Micropterus salmoides),又名加州鲈或黑鲈,隶属于脊椎动物门中的鲈形目(Perciformes)太阳鱼科(Centrarchidae)黑鲈属(Micropterus)[1]。该物种以其优良的肉质和广泛的适应性而著称,在中国鱼类养殖业中占据重要地位,是一种备受欢迎的经济型养殖鱼类[2]。然而,高密度集中养殖引发的疾病给大口黑鲈产业带来了巨大挑战。许多病原微生物,包括真菌、细菌、寄生虫和病毒,都可能感染大口黑鲈[3]。尤其是诺卡氏菌病和LMBV引发的病毒病,严重阻碍了大口黑鲈养殖业的健康可持续发展。因此,研究大口黑鲈的免疫机制,有助于制定免疫策略,以预防和治疗该疾病,这些免疫策略包括对特定病原体的疫苗开发和鲈的遗传育种[4]。
在哺乳动物体内,17β-雌二醇(E2)既能激发免疫系统的活性,也能在一定程度上抑制免疫反应,从而维持免疫系统的平衡与稳定。特别值得关注的是,E2在硬骨鱼中同样展现出对免疫反应的调节作用,这使得研究者对其在鱼类免疫系统中的作用产生了浓厚的兴趣[5]。大量研究显示,雌二醇(estradiol)是硬骨鱼炎症反应的关键调节剂[6]。它通过雌激素受体介导的通路来调节硬骨鱼的免疫系统与免疫过程,从而维护骨骼的健康状态[7]。当雌激素与雌受体(estrogen receptor,ESR)结合后,形成的雌激素复合物会进入细胞核,通过雌激素反应元件(estrogen response element,ERE)介导的转录调节[7]从而影响基因的表达。这一过程在免疫系统的调节中起着至关重要的作用。当鱼体暴露于高水平的E2时,可改变其免疫系统的组成,从而诱导免疫抑制效应[8]。在金头鲷(Sparus aurata)中,E2能够改变其白细胞对传染源的反应[9]。在斜带石斑鱼(Epinephelus coioides)的研究中,E2可介导ERβ-CXCL19/CXCR4-NFκB通路诱导其产生炎症反应[10]。在橙斑石斑鱼(Epinephelus bleekeri)的研究中,E2可以通过与雌激素受体ERβ1和ERβ2结合从而诱导其产生炎症反应,然后与CXCL19的启动子结合并促进其转录。本研究团队前期研究表明,高温和LMBV的联合作用会影响大口黑鲈的多种代谢和免疫途径,从而通过调节雌激素信号通路和影响雌激素及其受体的表达来调节免疫反应。在高温特定条件下,雄鱼可能具有更强的雌激素信号通路相关免疫反应,这些反应调节免疫通路,包括抗原加工和呈递、补体系统和吞噬作用。因此,雄性鱼类可能比雌性鱼类具有更高的抗病性[11]。但雌激素信号通路影响免疫的具体机制还不清楚。
Eer2a和esr2b属于雌激素受体家族。雌激素受体是一类核受体家族,它们主要通过介导雌激素在细胞内的信号传导来参与脊椎动物的生殖、性腺发育和性别分化等过程。雌激素受体在所有脊椎动物和一些无脊椎动物中都有表达[12]。哺乳动物体内存在两种雌激素受体亚型基因,即esr1和esr2,但在硬骨鱼类中,雌激素受体的调控机制展现出更为复杂的多样性[13]。硬骨鱼已被证实拥有3种不同类型的转录因子调节的雌激素受体基因:一个单独的esr1基因,以及两个esr2亚型基因——esr2a和esr2b。值得注意的是,这种独特的第三种esr亚型(esr2a或esr2b中的任一或两者,具体依据鱼类种类而异)的出现,是硬骨鱼类在进化历程中经历的特有第三次全基因组复制直接结果[14]。这些基因在鱼类生殖系统的发育和配子发生过程中发挥着重要作用。如Yan等[15]成功构建了尼罗罗非鱼(Oreochromis nilotica)esr1、esr2a、esr2b 3种雌激素受体的敲除模型,以探究其在生殖中的作用。研究发现,esr1敲除对性别分化和生殖功能无显著性影响,提示其非必需性或存在代偿途径。敲除esr2a后可导致卵泡与精子发育异常,而esr2b的敲除可严重影响雌鱼和雄鱼的生殖导管发育。esr2a和esr2b作为雌激素受体的亚型,在鱼类性腺中的表达具有时空特异性,并可能通过调控不同靶基因的表达来影响性腺的发育和配子发生过程。虽然esr2a和esr2b属于同一家族,但它们在基因结构、表达模式和功能特性上可能存在一定差异。这些差异可能导致了它们在鱼类生殖发育过程中发挥不同作用。研究表明,核雌激素受体在虹鳟(Oncorhynchus mykiss)[16]、金头鲷[17]、鲫(Carassius auratus)[18]和斑点叉尾鮰(Ictalurus punctatus)[5]中均有表达。Zheng等[18]在鲫脾中发现了核雌激素受体的基因表达,而Massart等[16]则发现雌激素受体在虹鳟白细胞中的表达。
近年来,雌激素受体ESR与大口黑鲈的免疫相关研究鲜有报道,本研究中,通过克隆大口黑鲈雌激素受体基因esr2a、esr2b的cDNA序列,对其序列特征进行详细分析,探索其在不同组织的表达模式,以及其对诺卡氏菌(Nocardia seriolae)、LMBV和Poly I:C及外源性激素E2刺激后处理的响应,以期为深入探讨雌激素及其受体在大口黑鲈免疫机制中的功能研究提供基础数据,并为大口黑鲈产后综合征的预防与治疗提供有益参考。
1 材料与方法
1.1 材料
试验用大口黑鲈源自广东佛山新荣水产有限公司,体质量为(47.97±9.20) g,暂养期间水温控制在26 ℃±1 ℃,每日投喂1次,根据水质状况进行换水,于室内养殖室暂养1周。选取活力好、体格相近的健康大口黑鲈进行试验。
本试验采用大肠杆菌(Escherichia coli)DH5a感受态细胞(百赛生物技术有限公司,上海)作为试验克隆菌株,选用诺卡氏菌、LMBV和Poly I:C等作为免疫刺激物,诺卡氏菌、LMBV为本单位分离并保存[3]。Poly I:C购自Sigma公司(美国)。所用的PCR引物和RT-qPCR引物由生工生物工程(上海)股份有限公司合成。基因克隆及测序所用的pMD19-T载体购自百赛生物技术有限公司(上海),总RNA提取试剂盒Hipure Universal RNA Kitt与琼脂糖凝胶回收试剂盒均购自广州美基生物科技有限公司。反转录试剂盒All-in-One First-Strand Synthesis MasterMix和荧光定量PCR试剂盒Green Taq Mix购自欣凯莱生物技术有限公司,其余试剂均为国产分析纯。
1.2 方法
1.2.1 总RNA提取及cDNA合成 采用总RNA试剂盒提取大口黑鲈各组织的总RNA,以10 g/L的琼脂糖凝胶电泳检测总RNA完整性,并反转录合成cDNA,置于-20 ℃保存备用。
1.2.2 大口黑鲈雌激素受体基因esr2a、esr2b克隆 参考NCBI GenBank公布的大口黑鲈esr2a推测序列(XM_038726901)、esr2b推测序列(XM_038728481)信息设计引物esr2a-F/esr2a-R与esr2b-F/esr2b-R(表1),将esr2a与esr2b基因的开放阅读框(open reading frame,ORF)区域进行扩增,并使用10 g/L琼脂糖凝胶电泳对PCR产物进行检测。目的片段使用琼脂糖凝胶回收试剂盒进行回收,连接至pMD19-T载体上,将连接产物转化至DH5α感受态细胞中。最后,从转化后的细胞中筛选出阳性克隆,并送至生工生物工程(上海)股份有限公司进行测序。
表1 试验所用引物序列
Tab.1 Sequences of primers used in the experiments

名称name序列(5′-3′)sequence (5′-3′)用途usageesr2aF:CTTTTGGAACAGGAATGGR:CTCTTTGCTGGAGGTGCTcDNA克隆esr2bF:TTGGAGGAATAACGCGGAGGR:TGGGGGTTGGAAAGCCATTAesr2aq1F:AAGAGTGTGAGGAGGCGTTCq1R:TGATTGGTTGCTGGGCAGAT荧光定量esr2bq1F:GACCCGTTACCACTGCTTCAq1R:CTGTGGTTGTACTCGTGGCTEF-1αF:GTTGCTGCTGGTGTTGGTGAG内参基因R:GAAACGCTTCTGGCTGTAAGG
表2 试验组采集记录表
Tab.2 Experimental group collection record sheet

病原体pathogen采集组织tissues collected采集时间sampling time采集数量collection quantity注射浓度injection concentration注射剂量injection volume诺卡氏菌(N.seriolae)鳃、肾、肝、脾、肠8 h、1 d、2 d、3 d、6 d、9 d4条1.62×108 CFU/mL200 μL大口黑鲈病毒(LMBV)鳃、肾、脾、肠15 h、1 d、2 d、3 d、4 d4条1 mg/mL200 μLPoly I:C鳃、肾、脾、肠8 h、1 d、2 d、3 d、6 d、9 d3条1 mg/mL200 μL
1.2.3 生物信息学分析 使用NCBI(http://www.ncbi.nlm.gov/blast/)在线网站搜索开放阅读框,采用DNAMAN软件进行氨基酸序列的翻译和同源性比较,采用ClustalW (BioEdit) 软件进行氨基酸序列的多重比对,通过DNAMAN分析esr2a与esr2b蛋白的理化性质。使用SMART预测蛋白质的结构域和功能。
1.2.4 荧光定量PCR进行各组织表达分析 采用Primer软件设计荧光定量PCR(RT-qPCR)所需引物esr2a-q1F/esr2a-q1R与esr2b-q1F/esr2b-q1R,同时选择大口黑鲈EF-1α基因[19]作为内参基因(表1)。取6只暂养后健康的大口黑鲈,麻醉后取样,得到肝、脾、肺、肌肉、皮肤、肠、心脏、脑、鳃和肾10个组织,利用总RNA提取试剂盒提取各组织总RNA,采用反转录试剂盒合成cDNA,以该cDNA作为模板进行PCR扩增,每个cDNA样品设置3个重复。利用Applied Biosystems StepOnePlus Real-Time PCR Systems(Applied Biosystems,新加坡)对其进行荧光定量PCR分析。反应体系为20 μL,其中2×SYBR Green qPCR PreMix(欣凯莱,广州)10 μL,引物F/R各0.4 μL,cDNA模板1.2 μL,双蒸水(ddH2O)8 μL。反应条件:95 ℃下预变性30 s;95 ℃下变性10 s,58 ℃下退火10 s,72 ℃下延伸30 s,共进行40个循环;95 ℃下变性15 s,60 ℃下退火1 min,95 ℃下复性15 s(熔解曲线分析)。
1.2.5 诺卡氏菌(N.seriolae)、LMBV和Poly I:C刺激后,大口黑鲈雌激素受体基因esr2a、esr2b的表达模式 提取各组织总RNA,并反转录为cDNA进行荧光定量试验。反应体系与反应条件与“1.2.4节”中的方法相同。
1.2.6 大口黑鲈外源性激素处理 选取健康的大口黑鲈50尾,随即选取10尾大口黑鲈作为空白对照组,向剩余试验组水中添加70 μL(终浓度2 μg/L)的 E2,分别于激素处理后第7、14、21 天随机采集10尾大口黑鲈的肠、肝、脾、肾、血并提取RNA,用试剂盒筛选性别,每个时间段选择3尾雌鱼3尾雄鱼,提取各组织总RNA,并反转录为cDNA进行荧光定量试验。反应体系与反应条件与“1.2.4节”中的方法相同。
1.3 数据处理
试验数据均用平均值±标准差(mean±S.D.)表示,根据2-ΔΔCt法[20]计算不同病毒处理与激素处理后每个组织的相对表达量,每个试验独立重复3次。通过SPSS 16.0软件进行单因素方差分析(One-Way ANOVA),显著性差异设为0.05。利用Graphpad Prism 8.0软件绘图,以实现试验数据变化趋势可视化。
2 结果与分析
2.1 大口黑鲈雌激素受体esr2a,esr2b基因克隆结果与生物信息学分析
本研究中获得了esr2a基因的cDNA全长为4 845 bp,其ORF为1 674 bp,编码557个氨基酸(图1,图2)。大口黑鲈esr2a蛋白的相对分子质量为62 641.16,理论等电点为8.62,不稳定系数为63.94,脂溶系数为80.88,总平均亲水系数为-0.372,表明esr2a蛋白是一种稳定性较差、亲水性较强的酸性蛋白质。SMART软件分析显示,esr2a蛋白质结构包含一个ZnF_C4结构域(156~227)和HOLI结构域(313~483)(图3)。esr2a氨基酸序列同源性比对结果显示:其与蓝鳃太阳鱼(Lepomis macrochirus)的一致性较高(90.63%),与斑马鱼(Danio rerio)一致性较低(64.58%),与鳜(Siniperca chuatsi)、三间火箭(Chelmon rostratus)、狼鲈(Morone saxatilis)、欧洲鲈(Dicentrarchus labrax)、金鼓鱼(Scatophagus argus)、荫平鲉(Sebastes umbrosus)、狼鳗(Anarrhichthys ocellatus)、黄金鲈(Perca flavescens)的一致性分别为86.11%、84.20%、84.03%、83.68%、83.51%、82.99%、81.94%、80.38%(图4,图5,图6)。
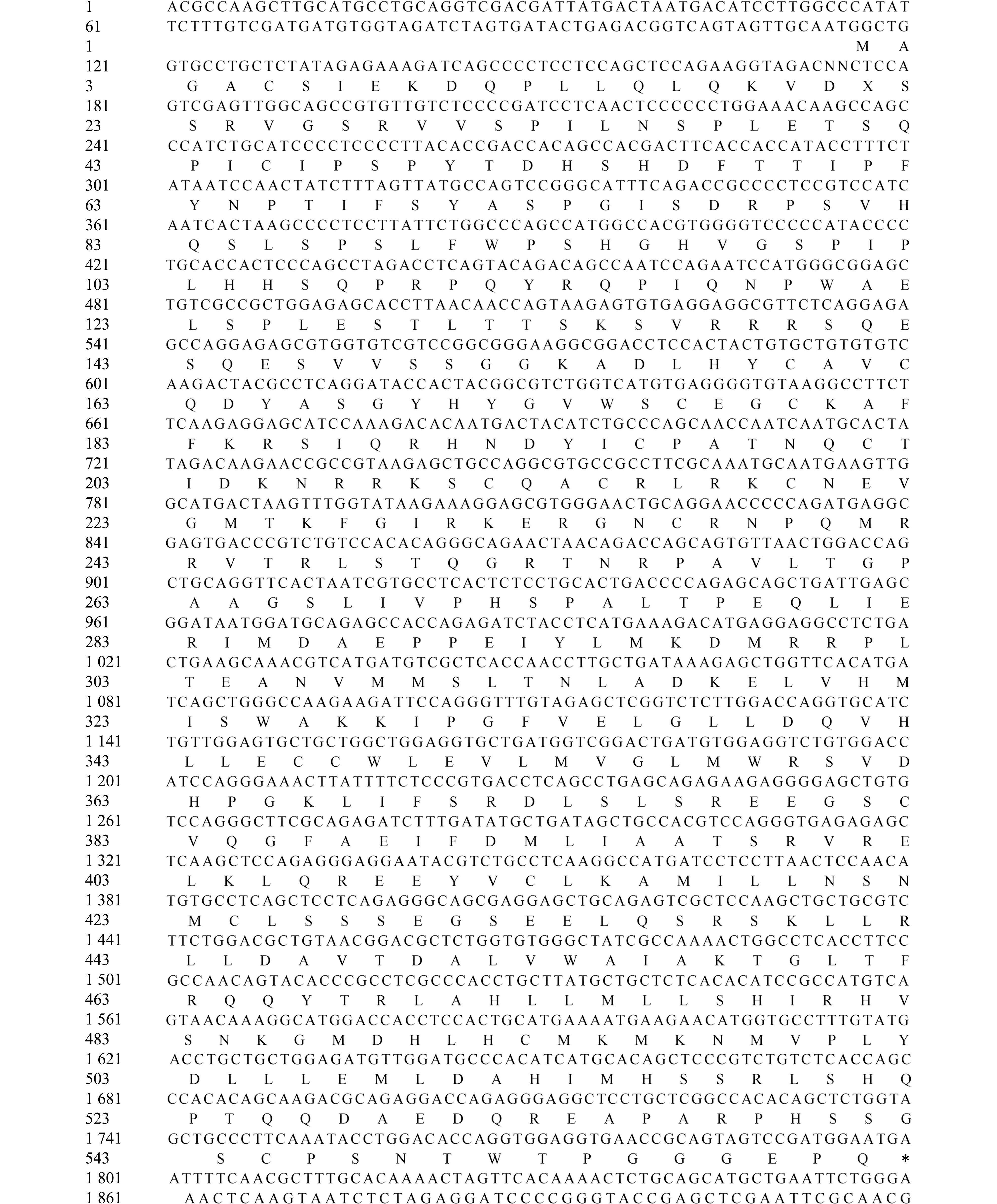
图1 大口黑鲈esr2a基因的cDNA序列
Fig.1 cDNA sequences of esr2a in largemouth bass
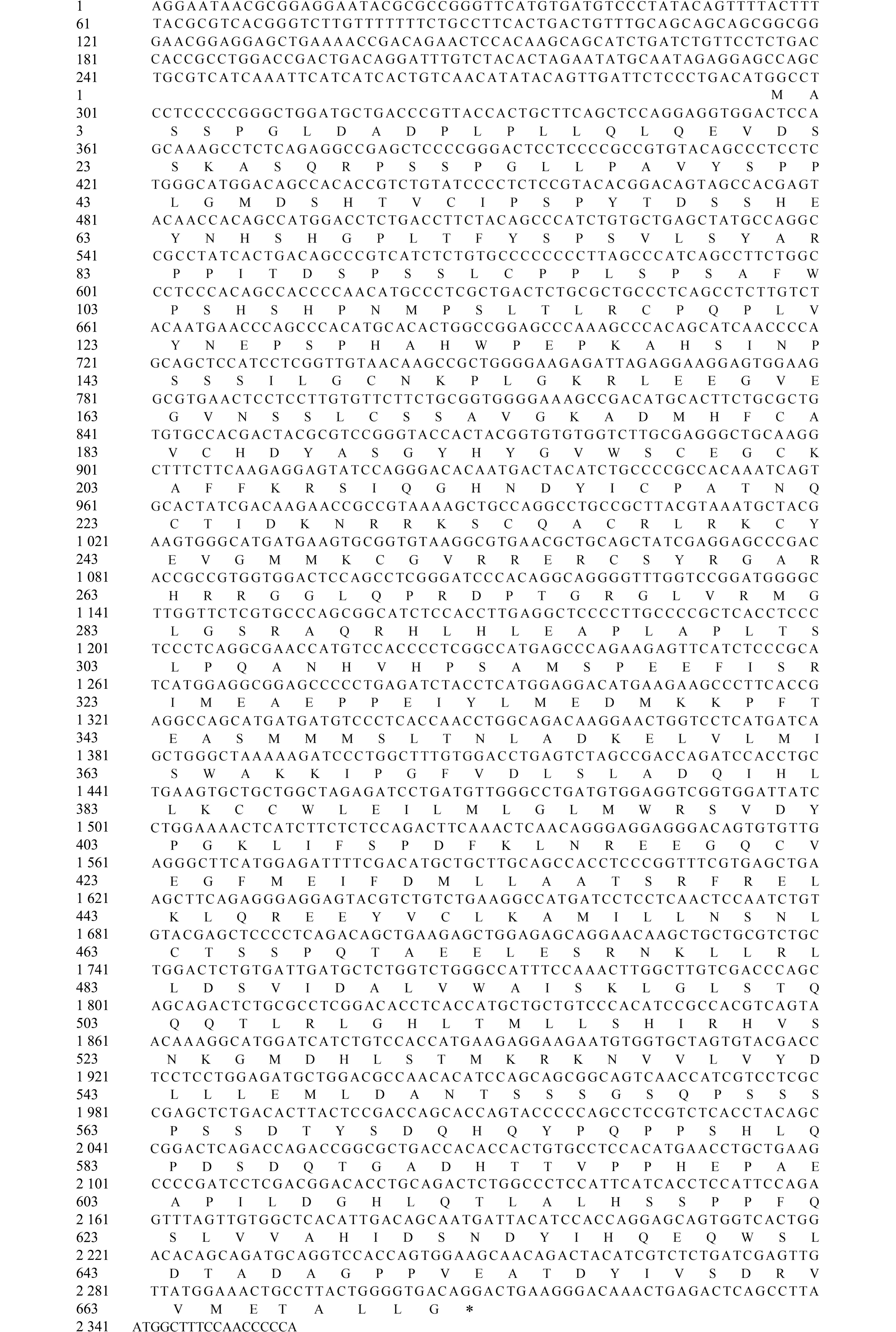
图2 大口黑鲈esr2b基因的cDNA序列
Fig.2 cDNA sequences of esr2b in largemouth bass
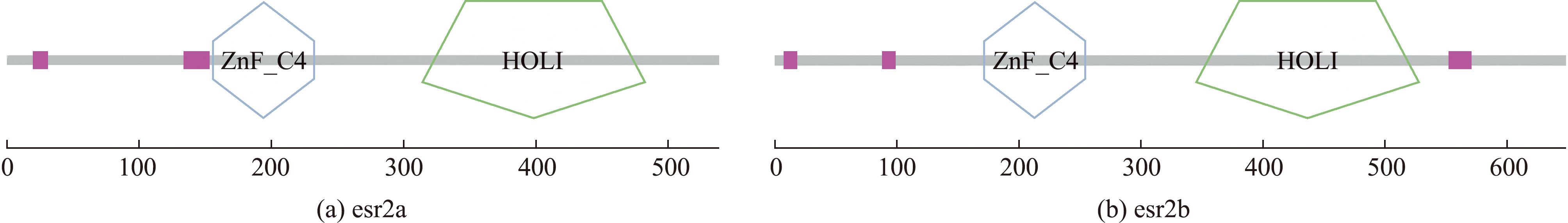
ZnF_C4 结构域(156~227 aa);HOLI 结构域(313~483 aa)。
ZnF_C4 domain (residues 156~227 aa);HOLI domain (residues 313~483 aa).
图3 大口黑鲈esr2a与esr2b蛋白的结构域预测
Fig.3 Predicted structural domains of esr2a and esr2b proteins of the largemouth bass

图4 大口黑鲈与其他物种esr2a氨基酸序列的比对
Fig.4 Amino acid sequences alignments of largemouth bass esr2a and other species

图5 大口黑鲈与其他物种esr2b氨基酸序列的比对
Fig.5 Amino acid sequences alignments of largemouth bass esr2b and other species
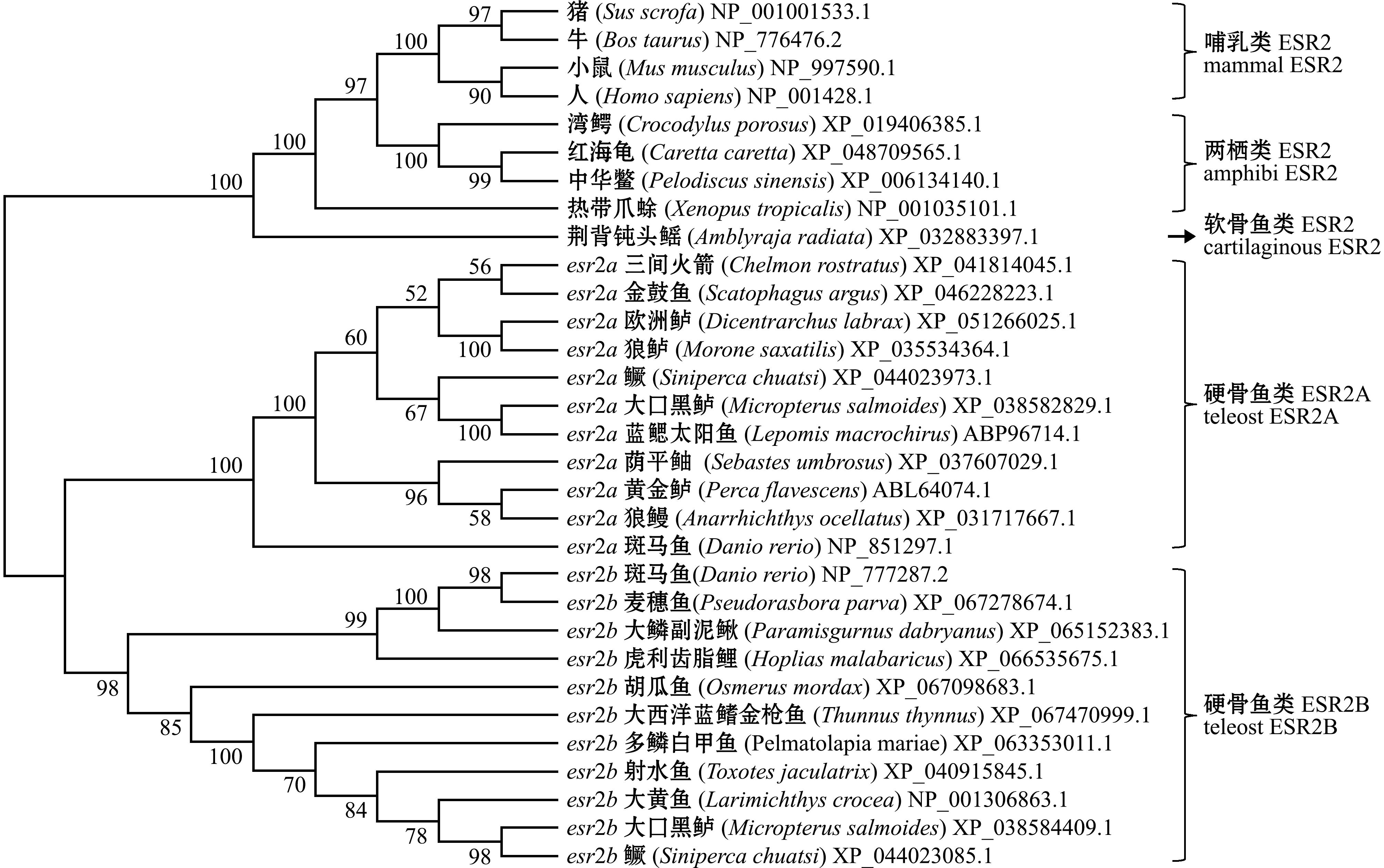
图6 依据大口黑鲈以及其他鱼类esr2a和esr2b构建的系统进化
Fig.6 Phylogenetic tree based on largemouth bass and other fish species esr2a and esr2b
esr2b基因的cDNA全长4 346 bp,其ORF为2 013 bp,编码670个氨基酸(图2)。大口黑鲈esr2b蛋白的相对分子质量为74 270.7,理论等电点为6.68,不稳定系数为63.27,脂溶系数为80.07,总平均亲水系数为-0.332,表明大口黑鲈esr2b蛋白是一种稳定性较差、亲水性较强的酸性蛋白质。SMART软件分析显示,esr2b蛋白质结构包含一个ZnF_C4结构域(156~227)和HOLI结构域(313~483)(图3)。esr2b氨基酸序列同源性比对结果显示:其与鳜的一致性较高(87.05%),与虎利齿脂鲤(Hoplias malabaricus)的一致性较低(50.36%),与大黄鱼(Larimichthys crocea)与射水鱼(Toxotes jaculatrix)的一致性均为84.75%,与多鳞白甲鱼(Pelmatolapia mariae)、大西洋蓝鳍金枪鱼(Thunnus thynnus)、胡瓜鱼(Osmerus mordax)、斑马鱼、麦穗鱼(Pseudorasbora parva)、大鳞副泥鳅(Paramisgurnus dabryanus)的一致性分别为80.58%、75.49%、61.44%、53.09%、52.23%、51.37%(图4,图5,图6)。
2.2 雌激素受体esr2a、esr2b基因在大口黑鲈正常个体中的组织分布
esr2a和esr2b在正常个体10个不同组织中的表达结果显示,esr2a和esr2b两种基因均在检测组织有表达。其中,esr2a在肾中有最高的表达量,在心脏表达量最低。esr2b在脾与肾中的表达量最高,同样在心脏中最低(P<0.05)(图7)。
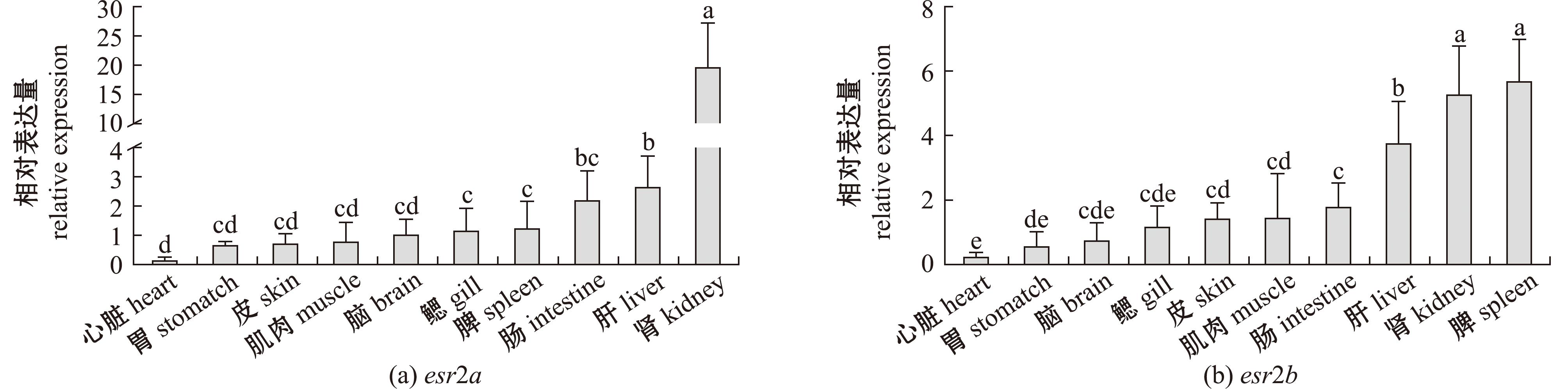
n=6,以心脏中表达量作为标准进行倍数统计;不同小写字母表示不同组织间的表达量具有显著性差异(P<0.05)。
n=6,the expression was analyzed by real-time PCR;heart expression was used as the criteria,different lowercase letters indicate significant difference among different tissues(P<0.05).
图7 esr2a和esr2b在大口黑鲈不同组织中的表达变化
Fig.7 Gene expression of esr2a and esr 2b in different tissues of largemouth bass
2.3 诺卡氏菌刺激鱼体后,大口黑鲈雌激素受体esr2a和esr2b基因的表达变化
感染诺卡氏菌后,大口黑鲈esr2a在鳃、肾、脾、肠和肝中的表达量有所改变(图7)。esr2a在鳃中表达量先下降再上升,在2 d达到谷值(P<0.05);在肾和肠中呈先上升后下降的趋势,分别于8 h与2 d达到峰值(P<0.05);在脾和肝中呈现波动态势,脾在1、2、3 d呈现平稳趋势后下降(P<0.05);肝在3、6、9 d呈平稳趋势(P<0.05)。esr2b在鳃和肝中的表达量均呈现先下降后上升的趋势(图8),分别在3、6 d达到谷值(P<0.05)。在肾中呈现波动趋势,在2 d时达到最高值(P<0.05)。脾与肠呈现先上升后下降趋势,脾在8 h时达到最高值(P<0.05);肠在2 d时达到最高值,后在3、6、9 d呈平稳趋势(P<0.05)。
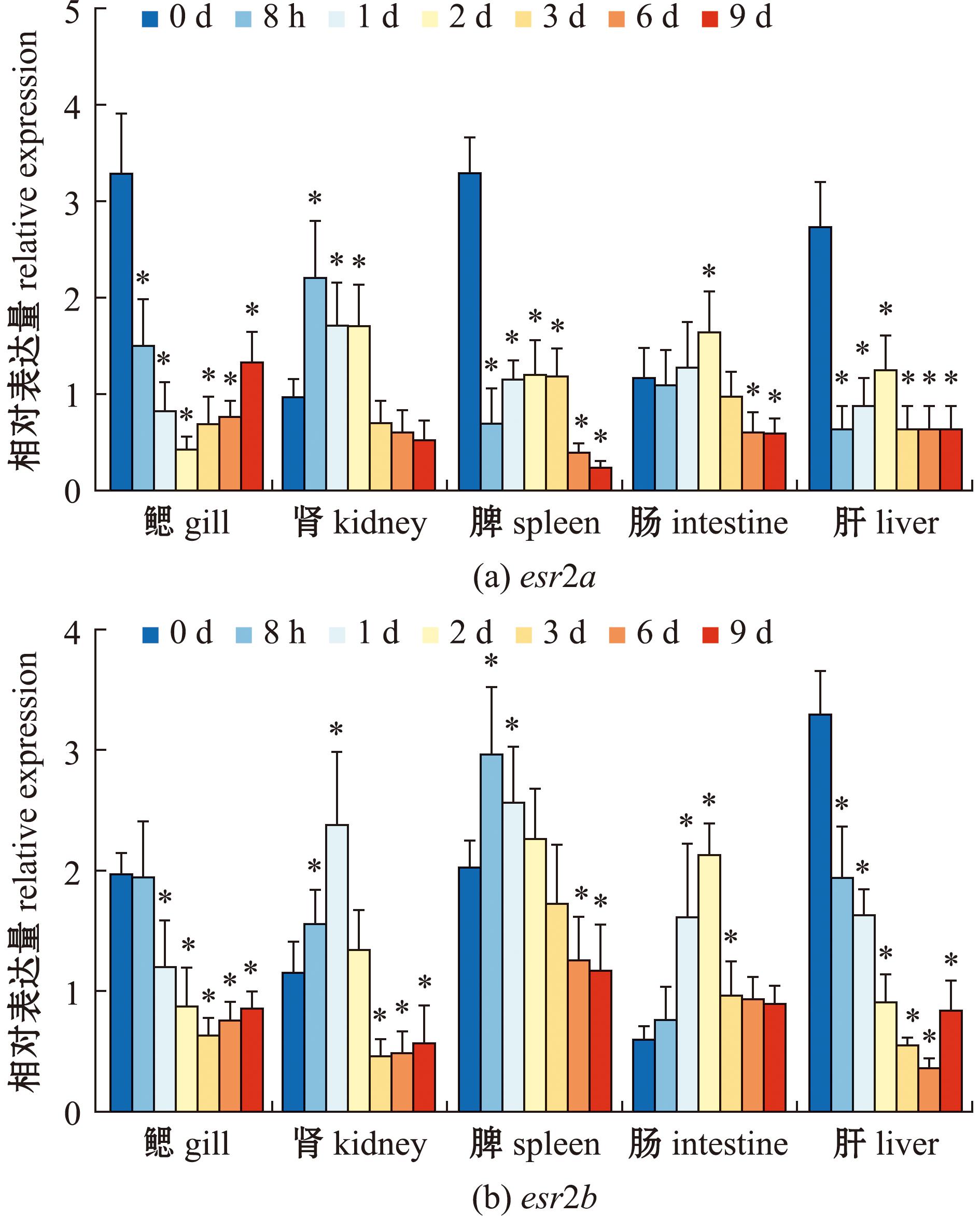
n= 4,*表示与0 h对照组比较具有显著性差异(P<0.05),下同。
n= 4,*significant difference compared to the 0 h group(P<0.05),et sequentia.
图8 感染诺卡氏菌后,esr2a和esr2b在大口黑鲈各组织中的表达变化(n=4)
Fig.8 Expression of esr2a and esr2b in response to Nocardia seriolae challenge in largemouth bass(n=4)
2.4 LMBV刺激鱼体后,大口黑鲈雌激素受体esr2a和esr2b基因的表达变化
LMBV刺激后,esr2a和esr2b表达量在各组织中有显著性变化,其中,esr2a在鳃、肾和脾中表达量呈先上升再下降趋势,均在1 d时达到峰值(图9);肠呈下降趋势,在4 d时达到最低值(P<0.05)。esr2b在鳃与肾中呈波动趋势,均在15 h时达到最高值(P<0.05);在脾与肠中呈先上升后下降趋势,分别在15 h与1 d时为最高值(P<0.05)。
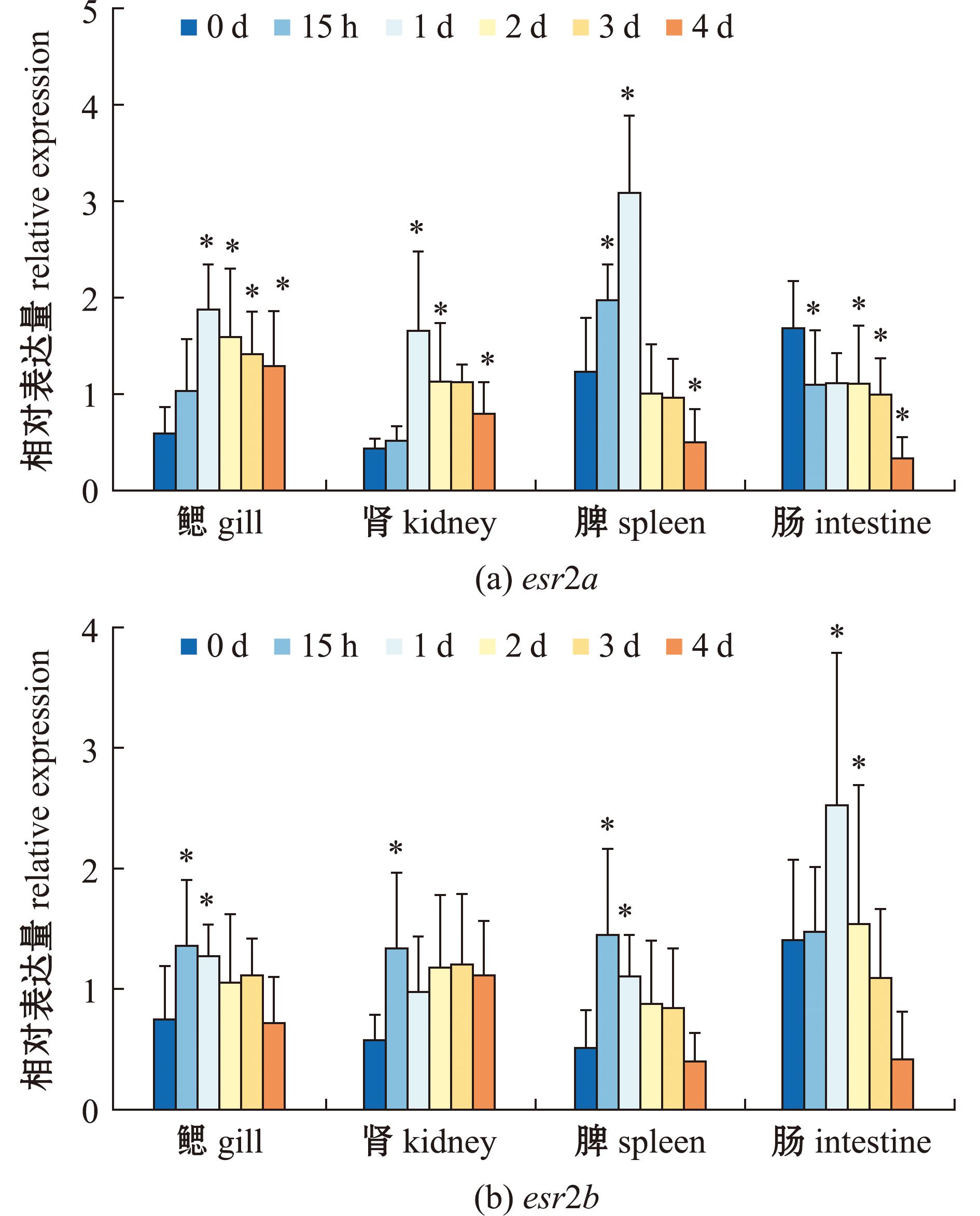
图9 感染LMBV后,esr2a和esr2b在大口黑鲈各组织中的表达变化(n=4)
Fig.9 Expression variation of esr2a and esr2b in response to LMBV challenge in largemouth bass(n=4)
2.5 Poly I:C刺激鱼体后,大口黑鲈雌激素受体esr2a和esr2b基因的表达变化
Poly I:C刺激后,esr2a表达量在各组织中有显著变化(图10)。在鳃中呈先上升再下降的趋势,1 d显著上调达到峰值(P<0.05);在肾和脾中呈先下降再上升趋势,均在刺激后3 d为最低值(P<0.05);在肠中则呈现先上升后下降趋势,刺激后8 h达到峰值(P<0.05)。Poly I:C刺激后,esr2b表达量在鳃和肠中均呈先上升再下降的变化趋势;其中,在刺激后1 d的鳃及刺激后8 h的肠中,表达量达到峰值(P<0.05)。但在肾与脾中呈现先下降后上升的波动趋势,在刺激后3 d肾与脾均达到最低值(P<0.05)。
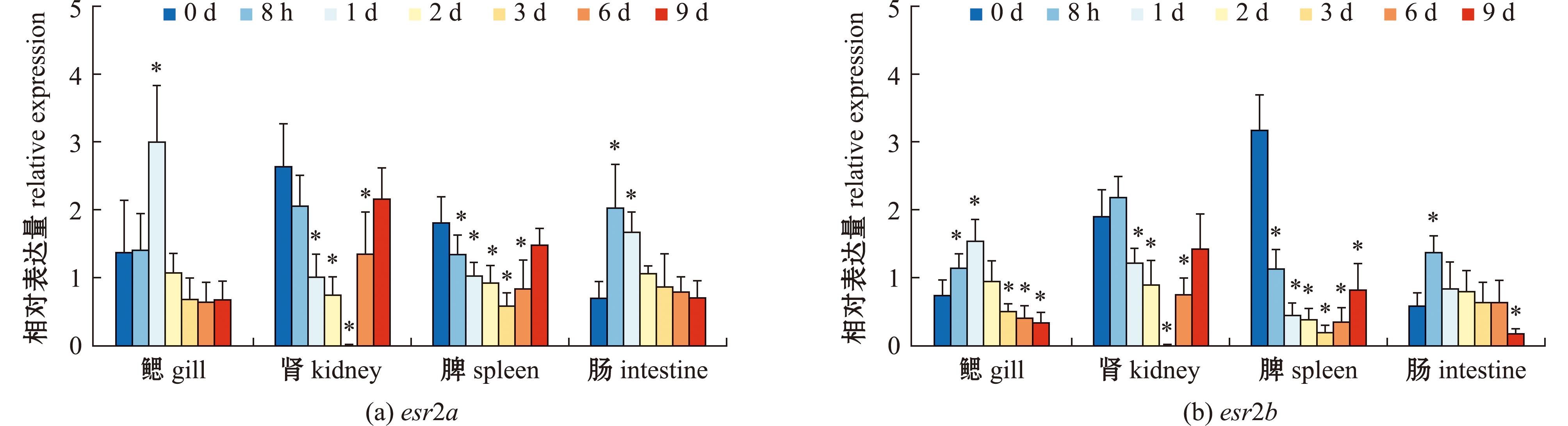
图10 Poly I:C刺激后,esr2a和esr2b在大口黑鲈各组织中的表达变化(n=3)
Fig.10 Expression of esr2a and esr2b in response after Nocardia challenge in largemouth bass(n=3)
2.6 E2刺激鱼体后,大口黑鲈雌激素受体esr2a和esr2b基因的表达变化
对雌性大口黑鲈进行E2 激素处理后,其皮肤中esr2a基因的表达量持续升高后又降低,在7 d达到峰值 (P<0.05);脾中esr2a基因的表达量显著下降,7 d的表达量较低,但是在14 d后得到部分恢复,至21 d又下降至最低值(P<0.05);肝中esr2a基因的表达量在7 d时达到最高值(P<0.05);肾中esr2a基因的表达量无明显变化。对雄性大口黑鲈进行E2 激素处理后,其皮肤中esr2a基因表达量无显著性变化;脾中esr2a基因表达量持续下降,在14 d接近为0,但是21 d后得到部分恢复(P<0.05);肝中esr2a基因的表达量呈先上升后下降趋势,在14 d时达到最高值 (P<0.05);肾中esr2a基因的表达量呈先上升后下降趋势,7 d时达到最高值(P<0.05)(图11)。
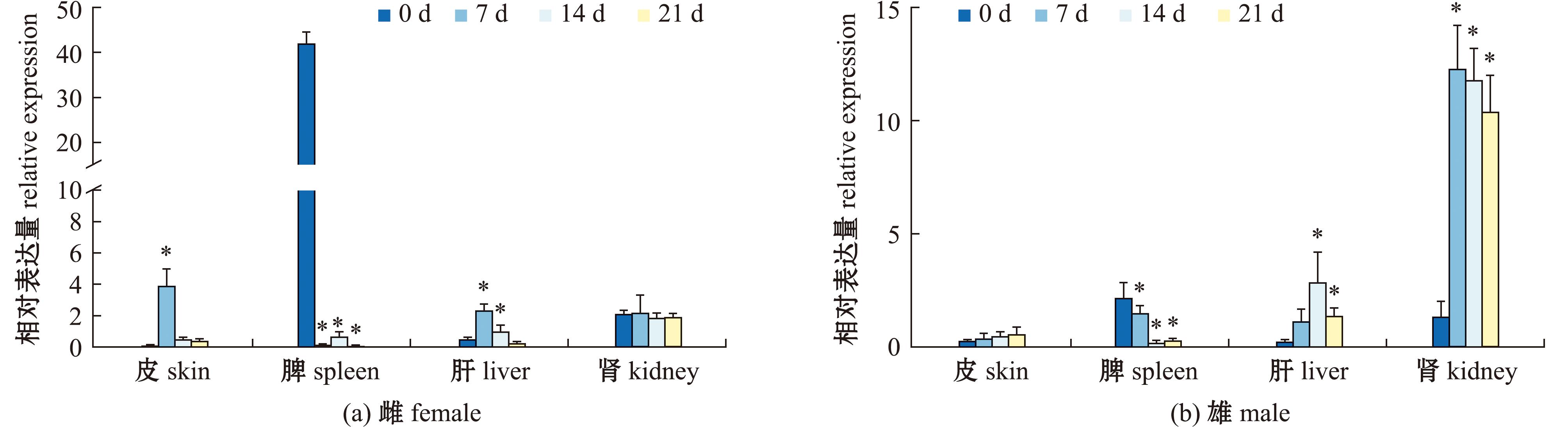
图11 大口黑鲈esr2a基因对17β-雌二醇处理后雌鱼与雄鱼的表达响应(n=3)
Fig.11 Expression response of largemouth bass esr2a gene to 17β-estradiol treatment in females and males (n=3)
对雌性大口黑鲈进行E2 激素处理后,皮肤与脾中esr2b基因的表达量均显著降低(P<0.05);肝中esr2b基因的表达量逐渐下降,但14 d时达到最高值,21 d时又呈波动趋势(P<0.05);肾中esr2b基因的表达量显著下降,14 d时接近至0,但21 d时部分上升(P<0.05)。对雄性大口黑鲈进行E2 激素处理后,皮肤与脾中esr2b基因的表达量均显著降低(P<0.05);肝中esr2b基因的表达量呈先降低后升高又下降的趋势,肝中esr2b基因表达量无明显变化;肾中esr2b基因的表达量显著降低,在21 d时达到谷值 (P<0.05)(图12)。
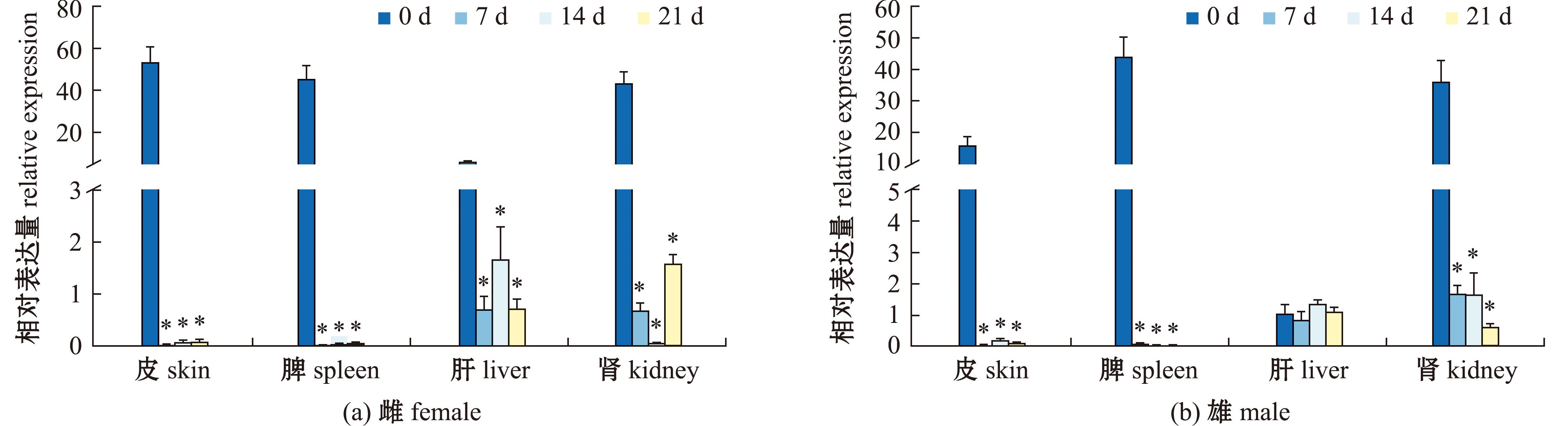
图12 大口黑鲈esr2b基因对17β-雌二醇处理后雌鱼与雄鱼的表达响应
Fig.12 Expression response of largemouth bass esr2b gene to 17β-estradiol treatment in females and males
3 讨论
3.1 大口黑鲈esr2a与esr2b序列分析
SMART软件分析显示,esr2a与esr2b蛋白质结构含有的结构域高度保守,从N端到C端依次为ZnF_C4结构域及HOLI结构域。ZnF-C4 结构域的作用是参与 DNA 结合转录因子、锌离子结合和序列特异性 DNA 结合[21]。同源性分析显示,大口黑鲈的雌激素受体基因esr2a与其他硬骨鱼类相比,在序列上展现出较高的相似性,与蓝鳃太阳鱼的esr2a基因相比,其一致性高达90.63%,表明两者在这一基因上存在紧密的亲缘关系;而与鳜的一致性也达到了86.11%,进一步证实了esr2a基因在硬骨鱼类中的广泛保守性。同样大口黑鲈的另一雌激素受体基因esr2b与其他硬骨鱼类相比,显示较高的序列相似性,与鳜相比,其esr2b基因的一致性高达87.05%,显示两者在esr2b的高度一致性;此外,与大黄鱼和射水鱼的一致性均维持在84.75%,进一步证实了esr2b基因在硬骨鱼类中的保守特征。这些结果表明,esr2a与esr2b基因在硬骨鱼类的演化进程中均高度保守,暗示了这些基因对于硬骨鱼类生长发育、繁殖等重要生理功能的维持具有不可或缺的作用。
3.2 大口黑鲈esr2a与esr2b的组织表达
本研究中Esr2a与esr2b在正常组织中的表达谱显示,esr2a与esr2b在大口黑鲈各组织中均有表达,但表达量不同。其中,esr2a在肾中的表达量最高,在心脏中的表达量最低;esr2b在脾中的表达量最高,在心脏中则最低(P<0.05)。已有报道显示,金鲫的esr2a基因主要在脑垂体及大脑中高度表达,而在性腺与肝中的表达则相对较弱[22]。雌性稻田鳝(Monopterus albus)esr2a在卵巢中表达水平较高,在嗅球、端脑、下丘脑、间脑、大脑、延髓和一些外周组织(包括心脏、肝和肠道)中表达水平较低,但在肌肉、脾、胰腺、肾、血液、眼睛和膀胱中检测不到;esr2b mRNA在端脑、下脑、延髓、垂体、卵巢、心、肝、肾、肠道和膀胱中的表达水平较高,而在嗅球、间脑、小脑、脾、胰腺和眼中的表达水平较低,但在其他组织中未检测到[23]。尼罗罗非鱼的esr1和esr2a广泛表达于各种组织,而esr2b仅在垂体、肝、肠道、肾和生殖腺中表达,且在精巢中表达最高,在卵巢中表达最低[24]。这些结果表明,esr2a与esr2b的组织表达在不同物种中有明显不同,可能是由于物种差异,也可能是不同的养殖条件、养殖环境造成。
3.3 大口黑鲈esr2a和esr2b病原及PolyI:C刺激后的表达分析
目前,有关雌激素受体与大口黑鲈免疫机制的研究尚未有报道,本研究中通过分别使用诺卡氏菌和LMBV进行攻毒,并用PolyI:C和17β-雌二醇进行处理试验,探究了esr2a和esr2b在大口黑鲈中免疫反应的响应机制。鱼的脾、肝和肾是诺卡氏菌感染的靶器官,在鱼类的免疫反应中起着重要作用[25]。刘文文等[26]发现,诺卡氏菌主要以大口黑鲈的肾、脾和肝中的巨噬细胞为靶细胞,使其产生严重病变。而Maciuszek等[27]通过组织病理学角度发现,诺卡氏菌可导致大口黑鲈肝组织和脾中产生大量肉芽肿结构,其中部区域大部分细胞已变性和坏死,同时,肾中肾小管上皮细胞也大部分已坏死且破裂,严重损害了肾、脾和肝的生理功能。在本试验中,发现大口黑鲈感染诺卡氏菌后,可在脾和肝中显著抑制esr2a基因表达,在肾中显著促进其表达,而esr2b基因在脾和肾中出现先促进后抑制的表达趋势,在肝中其受到显著抑制。这些结果表明,诺卡氏菌可显著影响大口黑鲈肾、肝和脾中esr2a和esr2b基因表达水平,表明该两个基因可能是诺卡氏菌的生物标志物,且与大口黑鲈的免疫反应密切相关。
美国海产学会(American Fisheries Society,AFS)鱼类健康部(Fish Health Section,FHS)曾提出鱼类的鳔、肾和脾为LMBV主要针对的靶器官[28]。Liu等[29]通过组织病理学检查大口黑鲈感染LMBV后的病理特征,发现其肾、脾和肠道发生大面积的充血和细胞坏死。Zhang等[30]通过RT-qPCR检测花斑连鳍(Synchiropus splendidus)全组织LMBV表达量,发现病鱼存在全身感染,在肾、脾、肠和胃中其表达量较高,推测其病毒高载体量是导致病鱼肝肿大、脾发黑和厌食的主要原因。本研究发现,大口黑鲈感染LMBV后,可在肾中显著促进esr2a基因表达,在脾中呈现先促进后抑制的表达趋势,而esr2b基因在脾和肾中均受到显著促进作用,表明esr2a与esr2b可能是大口黑鲈感染LMBV后免疫应答的正调控因子。
Poly I:C一般可作为免疫刺激剂和双链RNA病毒的疫苗,用于提高一些鱼类的免疫力[31]。日本鲭(Scomber japonicus)注射Poly I:C后可显著增加谷胱甘肽巯基转移酶(GST)的表达,表明GST可能对外源性物质敏感从而保持宿主健康[32]。金头鲷(Sparus aurata)注射Poly I:C后可导致磷脂酸磷酸水解酶(LPIN)基因上调,表明当一些外源性物质侵入人体时,鱼类具有某些代谢补偿反应机制[33]。除此之外,有研究表明,Poly I:C可在鱼类中调控肿瘤坏死因子(tumor necrosis factor,TNF)、Toll样受体2(toll like receptor 2,TLR2)、白细胞介素-8(interleukin-8,IL8)和主要组织相容性复合体Ⅱ类(major Histocompatibility complex class Ⅱ,MHCⅡ)基因下调,进而增强自然细胞杀伤能力,影响T细胞免疫并减少内因诱导的细胞凋亡[34]。在本试验中,大口黑鲈注射Poly I:C后,其肾和脾中esr2a和esr2b基因表达均受到显著抑制,表明esr2a和esr2b基因的下调可能与鱼体免疫调控有关。
3.4 E2处理后,大口黑鲈esr2a和esr2b基因表达的变化
E2对免疫细胞的发育、分化、寿命、活化和功能具有调控作用,它既能激发免疫系统的活性,也能在一定程度上抑制免疫反应,从而维持免疫系统的平衡与稳定[5,7,16]。在本试验中,通过E2处理后,发现esr2a基因表达在雌鱼脾中受到显著抑制作用,在肝中受到促进作用;在雄鱼中,esr2a基因表达在肾和肝中受到显著促进作用,且在脾中受到显著抑制作用。而esr2b基因表达在雌鱼皮、脾、肾和肝中均受到显著抑制作用,在雄鱼肝中受到显著促进作用,且在脾和肾中受到显著抑制作用。相关研究中,Ma等[35]发现,雌激素过量可导致野生型小鼠肾功能损伤。Ahmed等[36]发现,高水平的雌激素环境可导致小鼠雌激素受体受到破坏,从而诱导肝功能障碍。Anantha samy等[37]发现,雌激素受体(ESR)主要表达在小鼠脾T淋巴细胞中,含有参与雌激素代谢的酶,是产生细胞因子的主要来源。Hussen等[38]发现,高浓度雌激素可导致小鼠脾产生淀粉样变性,造成脾功能受损。Paiola等[39]发现,在鲈中,E2以剂量和时间依赖性方式在体外调节氧化还原生物学和骨髓细胞的活力。不同来源的细胞(胸腺、脾或头肾白细胞)可表现出不同的反应。关于E2处理后在不同鱼类中的数据特征通常是不统一的,Maciuszek等[27]发现,鲤通过E2处理后,在肾中esr2a和esr2b基因表达受到显著促进作用,推测其可能参与白细胞的产生,而在本试验中,研究发现外源性激素E2处理后均能在雌、雄鱼的肾、肝和脾中引起esr2a和esr2b基因的表达变化,推测其可能与大口黑鲈的免疫反应密切相关。
4 结论
1)本试验中克隆获得了大口黑鲈雌激素受体esr2a和esr2b基因的cDNA片段,全长分别为1 192、2 358 bp;它们均具有一个ZnF_C4结构域和一个HOLI结构域。
2)esr2a基因在肾中显著高表达,esr2b基因在脾与肝中显著高表达。
3)通过体内注射诺卡氏菌、LMBV、Poly I:C后,均可以引起esr2a与esr2b基因在大口黑鲈肝、肾与脾的表达变化;通过注射外源性激素E2后,在雌雄鱼肾和脾中的esr2a与esr2b基因的表达均出现显著变化;表明雌激素E2可能通过影响esr2a与esr2b基因的表达,从而影响了大口黑鲈的免疫。
[1] ROMANO N,EGNEW N,QUINTERO H,et al.The effects of water hardness on the growth,metabolic indicators and stress resistance of largemouth bass Micropterus salmoides[J].Aquaculture,2020,527:735469.
[2] 邓国成,白俊杰,李胜杰,等.大口黑鲈池塘养殖常见病害及其防治[J].广东农业科学,2011,38(18):102-103,137.
DENG G C,BAI J J,LI S J,et al.Common diseases in pond culture of largemouth bass and their control[J].Guangdong Agricultural Sciences,2011,38(18):102-103,137.(in Chinese)
[3] LIU Z G,DONG J J,KE X L,et al.Isolation,identification,and pathogenic characteristics of Nocardia seriolae in largemouth bass Micropterus salmoides[J].Diseases of Aquatic Organisms,2022,149:33-45.
[4] GUI J F.Fish biology and biotechnology is the source for sustainable aquaculture[J].Science China Life Sciences,2015,58(2):121-123.
[5] IWANOWICZ L R,STAFFORD J L,PATI O R,et al.Channel catfish (Ictalurus punctatus) leukocytes express estrogen receptor isoforms ERα and ERβ2 and are functionally modulated by estrogens[J].Fish &Shellfish Immunology,2014,40(1):109-119.
O R,et al.Channel catfish (Ictalurus punctatus) leukocytes express estrogen receptor isoforms ERα and ERβ2 and are functionally modulated by estrogens[J].Fish &Shellfish Immunology,2014,40(1):109-119.
[6] HUANG M W,WANG Q,CHEN J X,et al.The co-administration of estradiol/17α-methyltestosterone leads to male fate in the protogynous orange-spotted grouper,Epinephelus coioides[J].Biology of Reproduction,2019,100(3):745-756.
[7] MANGELSDORF D J,THUMMEL C,BEATO M,et al.The nuclear receptor superfamily:the second decade[J].Cell,1995,83(6):835-839.
[8] CASANOVA-NAKAYAMA A,WENGER M,BURKI R,et al.Endocrine disrupting compounds:can they target the immune system of fish?[J].Marine Pollution Bulletin,2011,63(5/6/7/8/9/10/11/12):412-416.
[9] LIARTE S,CHAVES-POZO E,ABELL N E,et al.Estrogen-responsive genes in macrophages of the bony fish gilthead seabream:a transcriptomic approach[J].Developmental &Comparative Immunology,2011,35(8):840-849.
N E,et al.Estrogen-responsive genes in macrophages of the bony fish gilthead seabream:a transcriptomic approach[J].Developmental &Comparative Immunology,2011,35(8):840-849.
[10] QI Z T,XU Y,DONG B,et al.Molecular characterization,structural and expression analysis of twelve CXC chemokines and eight CXC chemokine receptors in largemouth bass (Micropterus salmoides)[J].Developmental &Comparative Immunology,2023,143:104673.
[11] DONG J J,ZHANG H T,WANG Z Y,et al.High temperature exposure causes sexual dimorphism in immune responses against largemouth bass ranavirus (LMBV) in Micropterus salmoides[J].Aquaculture,2024,592:741239.
[12] HEWITT S C,KORACH K S.Estrogen receptors:new directions in the new millennium[J].Endocrine Reviews,2018,39(5):664-675.
[13] KATSU Y,KOHNO S,NARITA H,et al.Cloning and functional characterization of Chondrichthyes,cloudy catshark,Scyliorhinus torazame and whale shark,Rhincodon typus estrogen receptors[J].General and Comparative Endocrinology,2010,168(3):496-504.
[14] CHAUVIGN F,PARHI J,OLL
F,PARHI J,OLL J,et al.Dual estrogenic regulation of the nuclear progestin receptor and spermatogonial renewal during gilthead seabream (Sparus aurata) spermatogenesis[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2017,206:36-46.
J,et al.Dual estrogenic regulation of the nuclear progestin receptor and spermatogonial renewal during gilthead seabream (Sparus aurata) spermatogenesis[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2017,206:36-46.
[15] YAN L X,FENG H W,WANG F L,et al.Establishment of three estrogen receptors (esr1,esr2a,esr2b) knockout lines for functional study in Nile Tilapia[J].The Journal of Steroid Biochemistry and Molecular Biology,2019,191:105379.
[16] MASSART S,MILLA S,KESTEMONT P.Expression of gene,protein and immunohistochemical localization of the estrogen receptor isoform ERα1 in male rainbow trout lymphoid organs;indication of the role of estrogens in the regulation of immune mechanisms[J].Comparative Biochemistry and Physiology Part B,Biochemistry &Molecular Biology,2014,174:53-61.
[17] PINTO P I S,TEOD SIO R,SOCORRO S,et al.Structure,tissue distribution and estrogen regulation of splice variants of the sea bream estrogen receptor α gene[J].Gene,2012,503(1):18-24.
SIO R,SOCORRO S,et al.Structure,tissue distribution and estrogen regulation of splice variants of the sea bream estrogen receptor α gene[J].Gene,2012,503(1):18-24.
[18] ZHENG Y,WANG L H,LI M,et al.Molecular characterization of five steroid receptors from Pengze crucian carp and their expression profiles of juveniles in response to 17α-ethinylestradiol and 17α-methyltestosterone[J].General and Comparative Endocrinology,2013,191:113-122.
[19] MA D M,FAN J J,TIAN Y Y,et al.Selection of reference genes for quantitative real-time PCR normalisation in largemouth bass Micropterus salmoides fed on alternative diets[J].Journal of Fish Biology,2019,95(2):393-400.
[20] 高风英,卢迈新,黎建平,等.尼罗罗非鱼β2m基因的克隆、多态性分析及组织表达特征[J].农业生物技术学报,2016,24(10):1588-1599.
GAO F Y,LU M X,LI J P,et al.Cloning,molecular polymorphism and expression pattern of β2m gene in Nile Tilapia(Oreochromis niloticus)[J].Journal of Agricultural Biotechnology,2016,24(10):1588-1599.(in Chinese)
[21] WANG H Y,LIU B X,QIN W,et al.Inhibited expression of seven hemocyanins in hepatopancreatic necrosis syndrome (HPNS) crabs regulated by Kruppel and E75[J].Aquaculture,2022,547:737398.
[22] CHOI C Y,HABIBI H R.Molecular cloning of estrogen receptor α and expression pattern of estrogen receptor subtypes in male and female goldfish[J].Molecular and Cellular Endocrinology,2003,204(1/2):169-177.
[23] ZHENG Z Q,LIU M Q,MENG F Y,et al.Differential distribution and potential regulatory roles of estrogen receptor 2a and 2b in the pituitary of ricefield eel Monopterus albus[J].General and Comparative Endocrinology,2020,298:113554.
[24] CHENG Y Y,TAO W J,CHEN J L,et al.Genome-wide identification,evolution and expression analysis of nuclear receptor superfamily in Nile Tilapia,Oreochromis niloticus[J].Gene,2015,569(1):141-152.
[25] MAEKAWA S,YOSHIDA T,WANG P C,et al.Current knowledge of nocardiosis in teleost fish[J].Journal of Fish Diseases,2018,41(3):413-419.
[26] 刘文文,邓玉婷,朱雪晴,等.鰤诺卡氏菌对大口黑鲈头肾巨噬细胞的侵染过程[J].微生物学通报,2023,50(6):2602-2623.
LIU W W,DENG Y T,ZHU X Q,et al.Infection process of primary macrophages derived from kidney of Micropterus salmoides by Nocardia seriolae[J].Microbiology China,2023,50(6):2602-2623.(in Chinese)
[27] MACIUSZEK M,PIJANOWSKI L,PEKALA-SAFINSKA A,et al.17β-Estradiol affects the innate immune response in common carp[J].Fish Physiology and Biochemistry,2020,46(5):1775-1794.
[28] THOESEN J C.Blue book:suggested procedures for the detection and identification of certain finfish and shellfish pathogens.Version 1[M].https://www.cabidigitallibrary.org,1994.
[29] LIU X D,ZHANG Y B,ZHANG Z L,et al.Isolation,identification and the pathogenicity characterization of a Santee-Cooper ranavirus and its activation on immune responses in juvenile largemouth bass (Micropterus salmoides)[J].Fish &Shellfish Immunology,2023,135:108641.
[30] ZHANG W F,DENG H W,FU Y T,et al.Production and characterization of monoclonal antibodies against mandarinfish ranavirus and first identification of pyloric Caecum as the major target tissue[J].Journal of Fish Diseases,2023,46(3):189-199.
[31] ZHANG Y,WANG X Y,SHI H L,et al.Comparative transcriptomic analysis of the liver and spleen in marbled rockfish (Sebastiscus marmoratus) challenged with polyriboinosinic polyribocytidylic acid (poly(I:C))[J].Aquaculture,2022,554:738144.
[32] KASSIE F,ANDERSON L B,SCHERBER R,et al.Indole-3-carbinol inhibits 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone plus benzo(a) pyrene-induced lung tumorigenesis in A/J mice and modulates carcinogen-induced alterations in protein levels[J].Cancer Research,2007,67(13):6502-6511.
[33] RASHIDPOUR A,SILVA-MARRERO J I,SEGU L,et al.Metformin counteracts glucose-dependent lipogenesis and impairs transdeamination in the liver of gilthead sea bream (Sparus aurata)[J].American Journal of Physiology Regulatory,Integrative and Comparative Physiology,2019,316(3):R265-R273.
L,et al.Metformin counteracts glucose-dependent lipogenesis and impairs transdeamination in the liver of gilthead sea bream (Sparus aurata)[J].American Journal of Physiology Regulatory,Integrative and Comparative Physiology,2019,316(3):R265-R273.
[34] MATSUSHIMA K,YANG D,OPPENHEIM J J.Interleukin-8:an evolving chemokine[J].Cytokine,2022,153:155828.
[35] MA H Y,CHEN S,DU Y.Estrogen and estrogen receptors in kidney diseases[J].Renal Failure,2021,43(1):619-642.
[36] AHMED M A,HASSANEIN K M A.Effects of estrogen on hyperglycemia and liver dysfunction in diabetic male rats[J].International Journal of Physiology,Pathophysiology and Pharmacology,2012,4(3):156-166.
[37] ANANTHA SAMY T S,ZHENG R,MATSUTANI T,et al.Mechanism for normal splenic T lymphocyte functions in proestrus females after trauma:enhanced local synthesis of 17beta-estradiol[J].American Journal of Physiology Cell Physiology,2003,285(1):C139-C149.
[38] HUSSEN T J,AL-SHAELI S J J,AL-MAHNA B H R,et al.Biochemical and histological effects of long-term administration of estrogen on female mice[J].Advances in Animal and Veterinary Sciences,2024,12(8):1563-1572.
[39] PAIOLA M,MOREIRA C,DUFLOT A,et al.Oestrogen differentially modulates lymphoid and myeloid cells of the European sea bass in vitro by specifically regulating their redox biology[J].Fish &Shellfish Immunology,2019,86:713-723.