随着规模化、集约化程度的加深,投饵型海水养殖对海洋生态环境带来的压力日愈严重,而加强海水养殖尾水排放管控是防治近岸海域富营养化的重要环节[1]。王纯等[2]指出,盐生植物通过自身吸收、植物或根际微生物生化作用和耐盐调节作用等机制修复污染水体,具有成本低、安全性高、绿色环保等优点。海马齿(Sesuvium portulacastrum)属于番杏科(Aizoaceae)海马齿属(Sesuvium),是多年生肉质草本盐生植物[3],具有广盐、耐高温、适应性强、繁殖快的特点[4],作为当前研究较多的耐盐植物品种[5],海马齿显现出较高的氮、磷去除能力[6],如通过生态浮床和人工湿地[7]等模式对开放海区[4]、海水养殖池塘[8]、工厂化养殖车间[9]等鱼、虾投饵养殖造成的富营养化水体进行生物修复,可有效降低水体中氮、磷、悬浮颗粒等污染物含量。
养殖水体中的氮主要来源于水生生物氨排泄及残饵粪便等的微生物降解[10],并通过藻类光自养吸收、化学自养硝化和异养同化等方式吸收或转化为亚硝酸盐和硝酸盐(最终产物)[11]。氨氮![]() 和硝态氮
和硝态氮![]() 是植物吸收的两种主要无机氮形式[12],相较低浓度的
是植物吸收的两种主要无机氮形式[12],相较低浓度的![]() 可诱发植物代谢紊乱和中毒,
可诱发植物代谢紊乱和中毒,![]() 很少观测到植物中毒现象。不同物种甚至同一物种不同基因型对不同氮源的响应差异较大[13],因此海马齿对不同氮源的偏好及响应与海马齿修复能力休戚相关。王成强等[5]指出,海马齿对总氨氮的去除率高于碱蓬(Suaeda salsa)和江蓠(Gracilaria),对亚硝态氮
很少观测到植物中毒现象。不同物种甚至同一物种不同基因型对不同氮源的响应差异较大[13],因此海马齿对不同氮源的偏好及响应与海马齿修复能力休戚相关。王成强等[5]指出,海马齿对总氨氮的去除率高于碱蓬(Suaeda salsa)和江蓠(Gracilaria),对亚硝态氮![]() 的去除率则与江蓠相当;巫晓杰等[14]研究发现,海马齿对氮的吸收速率受浓度和不同化合态氮比例的影响,对磷的吸收速率除受浓度和不同化合态氮比例影响外,还与氮、磷比有关;窦碧霞等[6]认为,海马齿能迅速启动对
的去除率则与江蓠相当;巫晓杰等[14]研究发现,海马齿对氮的吸收速率受浓度和不同化合态氮比例的影响,对磷的吸收速率除受浓度和不同化合态氮比例影响外,还与氮、磷比有关;窦碧霞等[6]认为,海马齿能迅速启动对![]() 的吸收且效果良好,但对亚硝态氮的吸收效果需经过一定适应期才能逐渐显现;蔡真珍等[15]分析了海马齿对金刚虾养殖水体的净化效果,并进行了动力学拟合(总氮浓度<1 mg/L)。然而,大多报道采用的氮浓度较低,且为多形态氮混合供应模式,而海马齿对
的吸收且效果良好,但对亚硝态氮的吸收效果需经过一定适应期才能逐渐显现;蔡真珍等[15]分析了海马齿对金刚虾养殖水体的净化效果,并进行了动力学拟合(总氮浓度<1 mg/L)。然而,大多报道采用的氮浓度较低,且为多形态氮混合供应模式,而海马齿对![]() 或
或![]() 的吸收速率随二者的比率改变而变化[14],因此,有必要就海马齿对高浓度单一氮素的吸收响应进行研究。
的吸收速率随二者的比率改变而变化[14],因此,有必要就海马齿对高浓度单一氮素的吸收响应进行研究。
本研究中通过室内栽培试验,以硝氮组(SN)为对照组,氨氮组(SA)为试验组,配制相应形态氮的1/4 Hoagland营养液培养海马齿,分析培养液中氮磷含量的变化、海马齿的生长性状,并通过二代全长转录组测序,筛选出可能与氮代谢相关的差异基因,以期为海马齿对高浓度铵态氮和硝态氮的吸收与适应机制解析提供数据依据,以期为海马齿修复技术的推广应用提供了有益参考。
试验用海马齿来自福建省水产研究所漳州大径养殖基地,摘取5~7个茎节、长为(25.8±2.5) cm、质量为(13.74±1.93)g(n=11)的植株,仅保留上部两节叶片,采用茎段移植的方式扦插于聚苯乙烯泡沫板上(EPE,规格26.0 cm×26.0 cm×3.0 cm),每板定植10株,放入光照充足(阳光房)的室内塑料水桶(10 L,26.0 cm×19.0 cm×22.0 cm)中预培,茎段下部2~3节浸没于海水中(厦门湾天然海水,盐度28.4,pH 7.83),所有水桶用锡箔纸包裹遮光,暂养1个月使海马齿根系生长。
主要仪器设备:水质多参数测定仪Multi 3430(WTW,Germany)、双光束紫外分光光度计(TU-1810DPC,北京普析)、荧光计/MD酶标仪(Qubit4.0,Thermo)、高通量生物片段分析仪(Qsep400,Bioptic)、BCA蛋白定量试剂盒(碧云天)、高效液相色谱仪(NanoElute,Bruker)、质谱仪(times TOF Pro2,Bruker)等。
1.2.1 试验设计 前期试验发现,海马齿在海水水培(10 L)时,1 d内能将水体氮吸收殆尽,属于低氮胁迫(氮不足),且氮供给量远低于海马齿生长氮的增长量,可能存在额外的氮源;而氮充足(1/4 Hoagland营养液)时,水体氮供给量与植株氮增长量基本持平。基于硝态氮是大部分植物利用的主要氮源,参考Hoagland营养液配方[16],以厦门湾天然海水[(0.598±0.037)mg/L N:包含(0.501±0.036)mg/L ![]() 和(0.086±0.021)mg/L
和(0.086±0.021)mg/L ![]() 配制所用1/4 Hoagland营养液,将暂养后生长状态良好且长势较均匀的海马齿分为2个处理组,硝态氮组为对照组(SN),除海水本身的氮外,营养液中的氮均为
配制所用1/4 Hoagland营养液,将暂养后生长状态良好且长势较均匀的海马齿分为2个处理组,硝态氮组为对照组(SN),除海水本身的氮外,营养液中的氮均为![]() 另一组为试验组(SA),营养液中的氮均为
另一组为试验组(SA),营养液中的氮均为![]() 各处理组设置3个生物学重复(各3盆),并在同等条件下设置无植株的SA0和SN0组。试验用海马齿质量为(15.36±1.78)g,根长为(16.8±4.5)cm(n=11),试验周期为2023年2月15日—3月29日(共42 d),前2周为海马齿生长适应期,每周换水;后4周进行海马齿氮、磷吸收能力测试。
各处理组设置3个生物学重复(各3盆),并在同等条件下设置无植株的SA0和SN0组。试验用海马齿质量为(15.36±1.78)g,根长为(16.8±4.5)cm(n=11),试验周期为2023年2月15日—3月29日(共42 d),前2周为海马齿生长适应期,每周换水;后4周进行海马齿氮、磷吸收能力测试。
每周采集一次水样(100 mL),测定无机氮和活性磷酸盐含量,同时监测水体pH变化和植株总质量增长情况,并测量试验前后海马齿的株高、根长等参数(n=9)。摘取顶端向下数第二节的叶片10片/盆,装入无菌离心管投入液氮速冻,于-80 ℃冰箱中保存备用。
1.2.2 指标测定
1)水质。采用水质多参数测定仪直接测定盐度、pH;采用萘乙二胺分光光度法、锌镉还原分光光度法、次溴酸盐分光光度法和磷钼兰分光光度法分别测定水培液中亚硝酸盐氮、硝酸盐氮、氨氮和活性磷酸盐含量[17];无机氮含量为硝酸盐氮、亚硝酸盐氮和氨氮含量之和。
2)叶片转录组测序。利用Illumina高通量测序平台,对海马齿第二节叶片开展二代全长转录组测序,并对测序数据进行生物信息学分析。采用乙醇沉淀法和CTAB-PBIOZOL提取叶片样本,使用荧光定量仪和高通量生物片段分析仪对总RNA进行鉴定和定量。测序部分由武汉迈特维尔生物科技有限公司完成。
通过DIAMOND BLASTX软件对转录本进行基因组百科全书(KEGG,https://www.genome.jp/kegg)、非冗余蛋白(NR,https://ftp.ncbi.nlm.nih.gov/blast/db/FASTA/)、基因本体(GO,http://geneontology.org/)、真核生物相邻类的聚簇(KOG,http://www.ncbi.nlm.nih.gov/COG/)及蛋白质序列数据库Swiss-Prot(http://www.ebi.ac.uk/uniprot/)注释,获得注释信息后,再进行差异基因分析。
3)叶片蛋白组学分析。叶片样本在液氮中研磨成粉末后,通过超声裂解提取、丙酮沉淀、酶解除盐,再使用高效液相色谱仪和质谱仪对提取的蛋白进行基于4D-DIA定量蛋白组学分析(武汉迈特维尔生物科技有限公司)。
试验数据均以平均值±标准差(mean±S.D.)表示,采用Excel 2010、Origin 9.0、SPSS 19.0软件及迈维云平台(https://cloud.metware.cn )进行数据的分析处理和作图,根据需要采用独立样本T检验或非参数检验的两个相关样本检验(Wilcoxon检验),显著性水平设为0.05。
采用DESeq2进行转录组差异表达基因分析,筛选时输入未经过标准化reads计数数据,采用Benjamini-Hochberg方法对假设检验概率(P value)进行多重假设检验校正。差异基因的筛选条件为|log2FC|≥1,且校正后的P<0.05。差异基因富集分析基于超几何检验,以差异基因KEGG富集为例,以通路为单位进行超几何分布检验;对于GO,则基于GO条目进行。校正后P值(Q值)计算公式为
(1)
式中:N为全部基因中具有KEGG注释的基因数量;n为N中差异基因的数量;M为N中某KEGG通路的基因数量;m为M中某KEGG通路的差异基因数量。差异蛋白的筛选条件则为FC≥1.5或≤0.666 7,且校正后的P<0.05。
转录组用Illumina高通量测序平台共获得37.16 Gb的Clean bases,Q30范围为91.98%~93.06%,碱基识别的准确性较高。蛋白组通过搜库软件DIA-NN(v1.8.1)进行蛋白的定性和定量,共鉴定出肽段总数50 985个,鉴定可定量蛋白总数7 817个,大部分肽段分布在7~20个氨基酸,肽段漏切位点数为0的肽段占比82.72%。利用皮尔逊相关系数r(Pearson’s correlation coefficient)评估样品生物学重复性,SN和SA组3次生物学重复的相关系数均为1,主成分(PCA)分析结果显示,组间样本较好地聚在一起,转录组样本显著分离,蛋白组样本分离度不高。所有样本质量均满足数据分析要求(图1)。
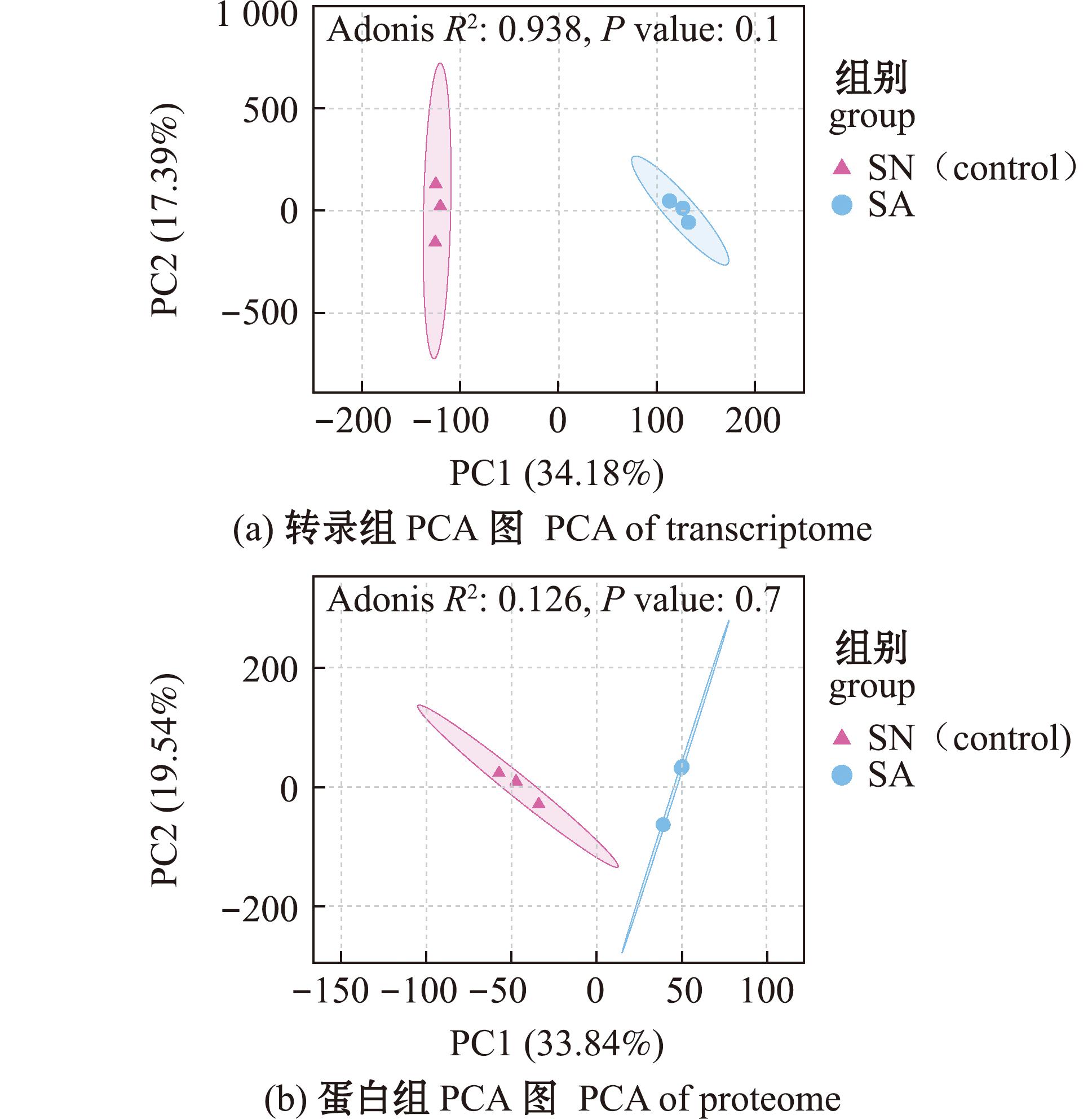
图1 海马齿叶片样本重复性检验
Fig.1 Reproducibility test of the leaf samples with Sesuvium portulacastrum
试验周期内,试验组(SA)水培液pH范围为5.08~7.23(6.27±0.76),SA0组pH范围为7.10~7.91(7.61±0.31);对照组(SN)水培液pH范围为6.34~7.23(6.74±0.26),SN0组pH范围为7.04~8.15(7.76±0.48),两个处理组水培液的pH均有下降趋势(图2),且SA组pH的降幅大于SN组,自第21 d起,SN组pH维持在6.55±0.10,SA组则持续下降至5.16±0.36,试验结束时二者差距达到1.48±0.02。
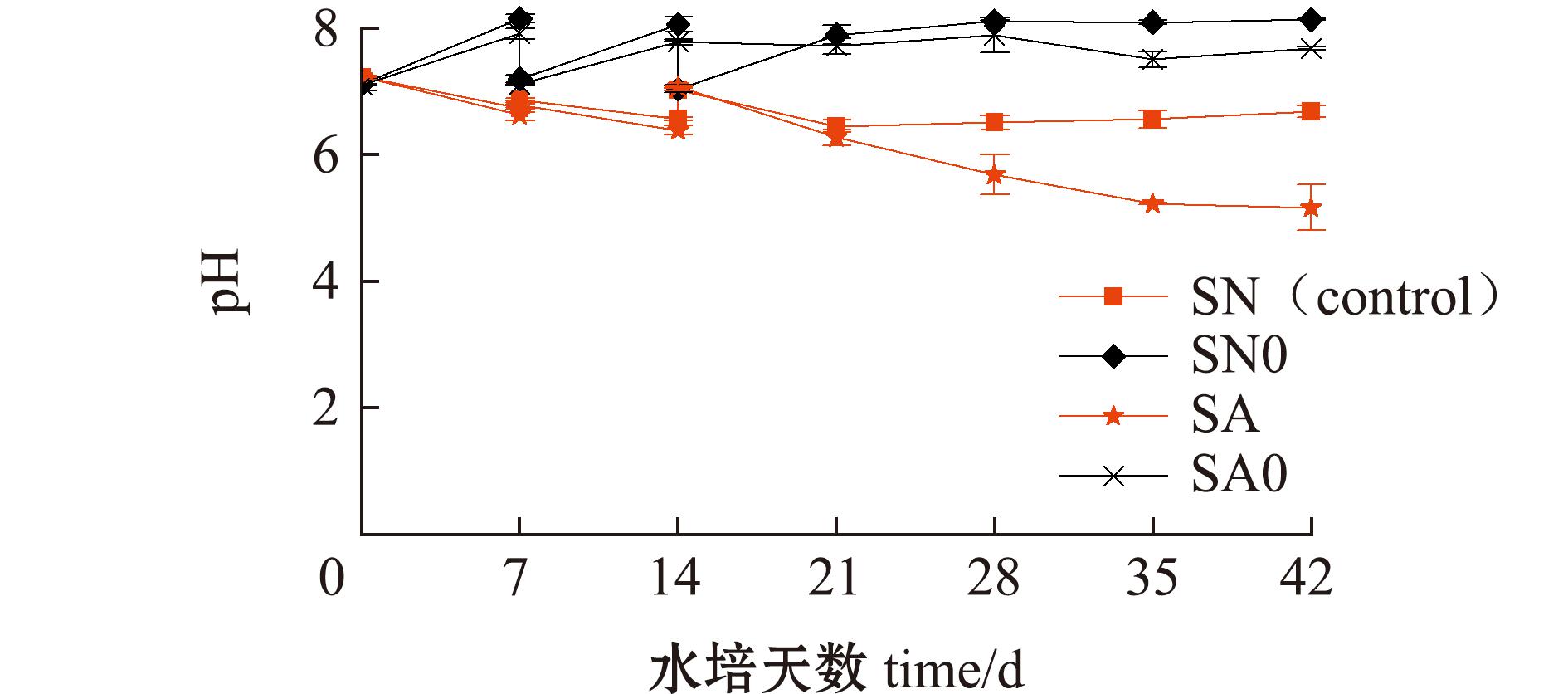
图2 水培液pH变化趋势
Fig.2 Trend of pH in hydroponic solutions
无论有无海马齿植株,水培液中无机氮的形态均未有明显变化,SA和SA0组均以氨氮为主,占比分别为97.7%~99.9%和96.0%~99.6%;而SN和SN0组则以硝酸态氮为主,占比分别为98.5%~99.6%和98.6%~99.9%。从图3可见,在最后一个换水周期内(4 s),SA组水体中DIN和DIP含量分别下降了24.4%和87.2%,SN组则分别下降了85.5%和30.4%。与SN组相比,SA组海马齿对水体中氮的吸收能力较弱且滞后,但对水体中磷的吸收情况则正好相反。
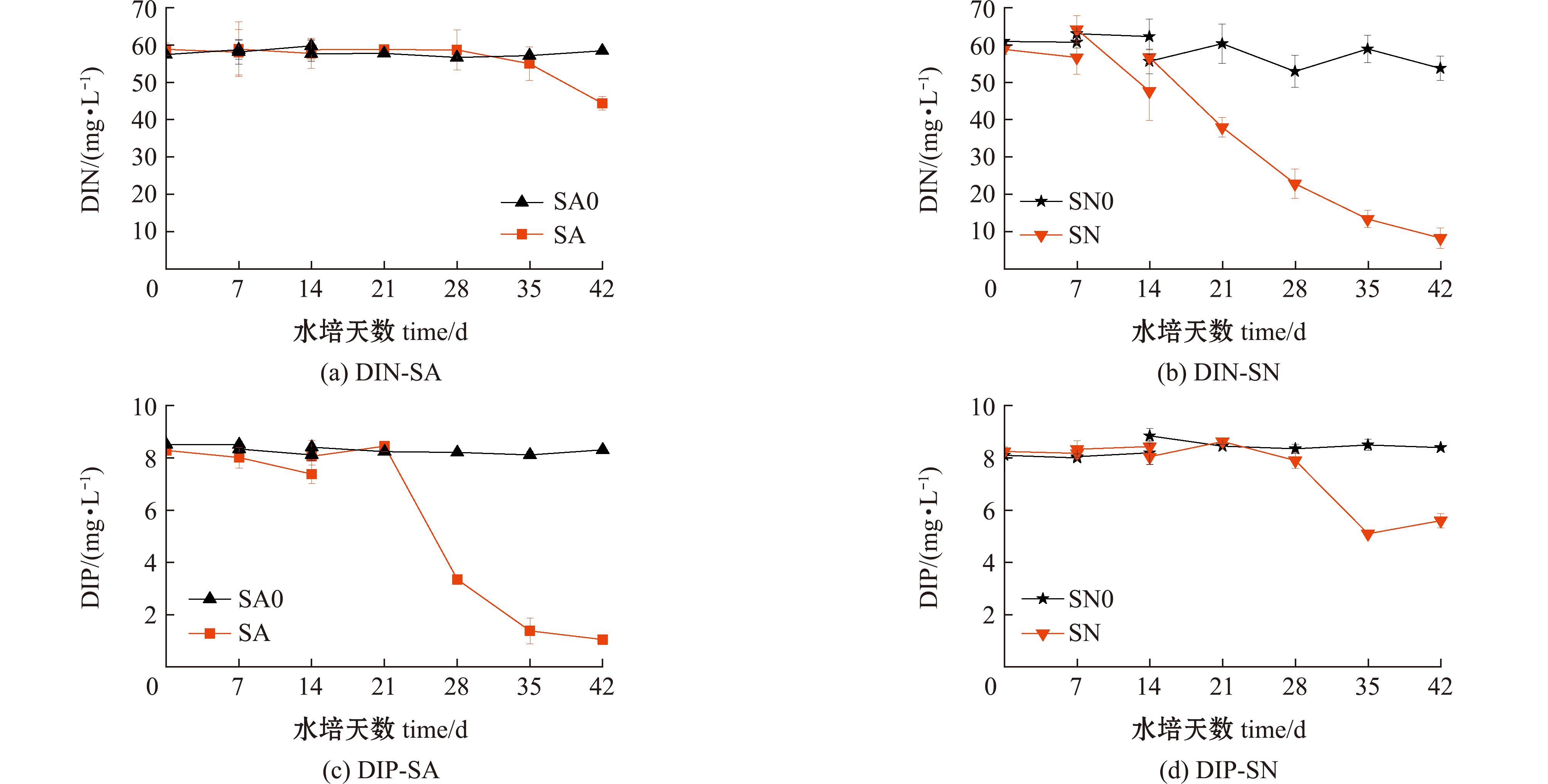
图3 水培液中DIN和DIP含量变化
Fig.3 Changes of DIN and DIP contents in hydroponic solutions
在最后一次换水周期内,以氮、磷浓度开始下降的节点为起始浓度(C0)和起始时间,以浓度对数值(lnC)与时间(t)作图,lnC~t呈线性关系,具有一级反应的特点(表1),SA组对磷的吸收速率常数(k=0.102 7 /d)是SN组(k=0.024 8 /d)的4.14倍,对氮的吸收速率常数(k=0.023 5 /d)则仅为SN组(k=0.069 7 /d)的33.7%。
表1 海马齿对氮、磷的吸收方程
Tab.1 Absorption equation of nitrogen and phosphorus by Sesuvium portulacastrum
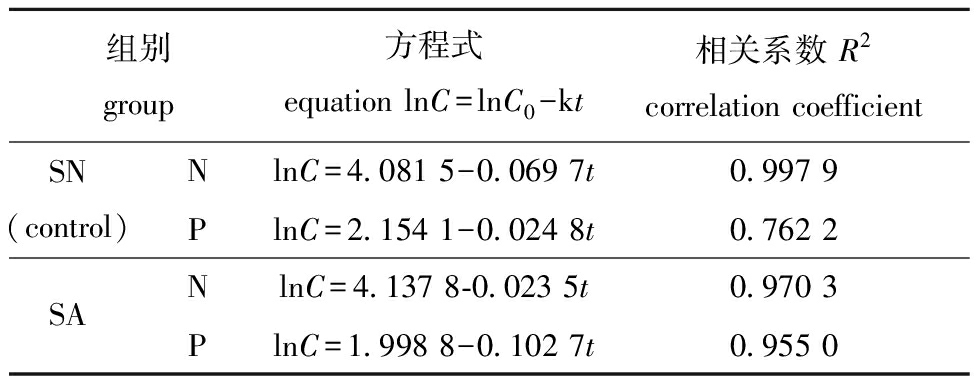
组别group方程式equation lnC=lnC0-kt相关系数 R2correlation coefficientSN(control)NlnC=4.081 5-0.069 7t0.997 9PlnC=2.154 1-0.024 8t0.762 2SANlnC=4.137 8-0.023 5t0.970 3PlnC=1.998 8-0.102 7t0.955 0
试验期间(42 d),SA组和SN组海马齿鲜质量y(g/盆)无显著性差异(P>0.05),y随时间x(d)呈线性增长:y=4.220x+145.3,R2=0.985 0(SN组);y=3.432x+144.2,R2=0.992 6(SA组)。由斜率可知,SA组海马齿鲜质量增长速度稍慢,约为SN组的81.3%。
培养42 d后,SA组海马齿根、茎、叶鲜质量略低于SN组,但除茎鲜质量(P<0.05)外,其余指标统计学上无显著性差异(图4)。从表2可见,SA组海马齿的第二节叶片、茎节周长、植株高度、根长也略低于SN组,但统计学上无显著性差异(P>0.05)。
表2 海马齿生长性状
Tab.2 Growth traits of Sesuvium portulacastrum

组别group株高/cmheight根长/cmroot length第二节茎周长/cmcircumference of second stem第二节叶片 leaves in the second stem长度 length/cm鲜质量 wet weight/gSN(control)39.7±4.4a23.6±3.6a2.10±0.02a4.69±0.15a0.38±0.02aSA37.8±3.7a22.6±4.3a1.87±0.21a4.50±0.41a0.33±0.03a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
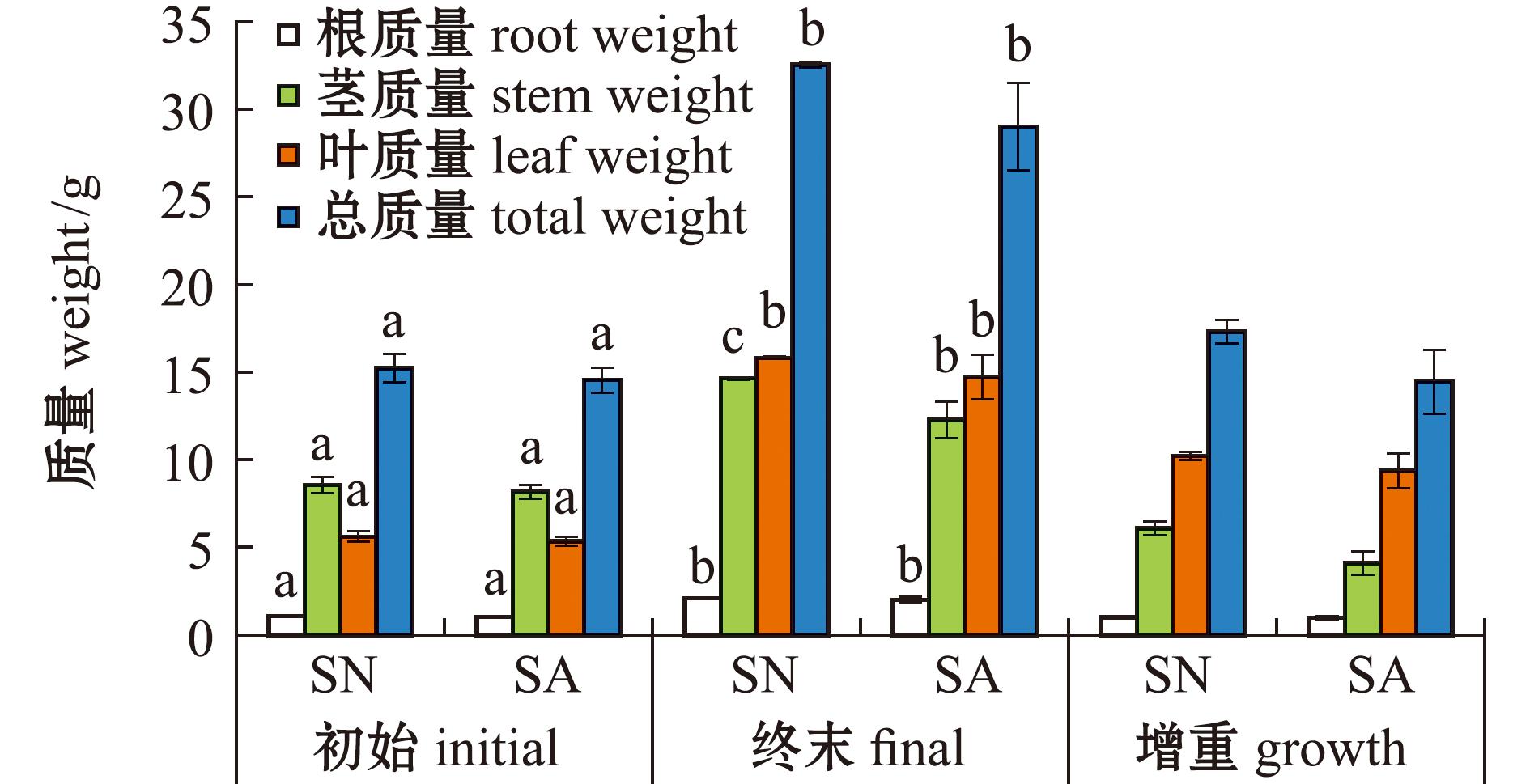
标有不同小写字母表示组间有显著性差异(P<0.05)。
The means with different letters being significantly different at the 0.05 probability level.
图4 单株海马齿质量增长情况
Fig.4 Weight increase of single Sesuvium portulacastrum
2个处理组海马齿叶片的原始数据经过滤除杂处理后,共有69 541个(66.03%)基因被成功注释,分别为NR数据库,68 415个(64.96%);Trembl数据库,68 228个(64.78%);GO数据库,59 008个(56.03%);KEGG数据库,52 043个(49.42%);Swiss-Prot数据库,49 515个(47.02%);Pfam数据库,48 619个(46.16%);以及KOG数据库,41 225个(39.14%)。其中差异表达基因1 620个,与SN组相比,SA组上调表达的基因数813个,下调表达的基因数807个。
2.3.1 KOG注释 将识别到的878个差异基因与KOG数据库25个功能组进行比对,注释结果显示,主要功能预测(general function prediction only,174个)排在首位,碳水化合物运输和代谢(carbohydrate transport and metabolism,78个)以及翻译后修饰、蛋白反转和分子伴侣(posttranslational modification,protein turnover,chaperones,77个)亦为其主要功能途径(图5)。
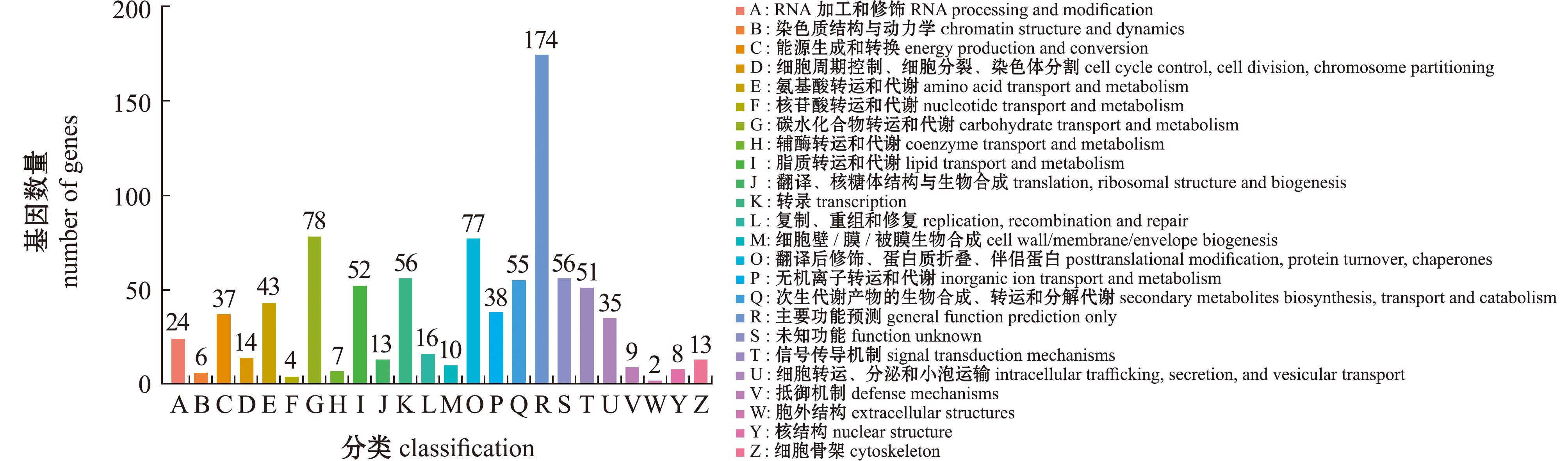
图5 差异基因KOG注释分类
Fig.5 KOG annotation of differentially expressed genes
2.3.2 氮代谢相关富集通路 使用KEGG、GO数据库对转录本进行通路注释,与SN组相比,SA组在KEGG的氮代谢通路(ko00910:nitrogen metabolism)上富集不显著,但在GO分析中,氮代谢相关通路显著富集的有:硝酸盐代谢过程(GO:0042126,nitrate metabolic process)、硝酸盐同化作用(GO:0042128,nitrate assimilation)、活性氮代谢过程(GO:2001057,reactive nitrogen species metabolic process)、氮循环代谢过程(GO:0071941,nitrogen cycle metabolic process)、对硝酸盐的反应(GO:0010167,response to nitrate)、NO生物合成(GO:0006809,nitric oxide biosynthetic process)、NO代谢过程(GO:0046209,nitric oxide metabolic process)、硝酸还原酶活性(GO:0008940,nitrate reductase activity)、氧化还原酶活性(GO:0016661,oxidoreductase activity,acting on other nitrogenous compounds as donors)、钼辅因子结合的活性(GO:0043546,molybdopterin cofactor binding)和钼离子结合(GO:0030151,molybdenum ion binding)等(图6),前7个通路隶属于GO分析中的生物过程亚类(biological process,BP),后4个通路隶属于分子功能亚类(molecular Function,MF)。
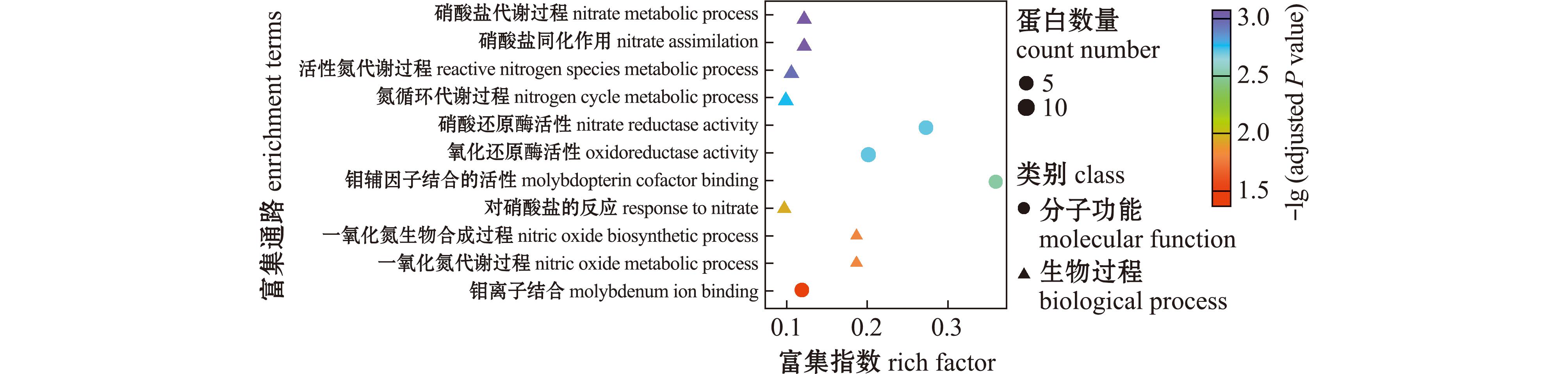
图6 转录组氮代谢相关通路富集通路气泡图
Fig.6 Bubble chart of GO enrichment pathways in nitrogen metabolism by transcriptome
2.3.3 氮代谢相关差异基因 与SN相比,SA组在11个氮代谢相关GO富集通路上共有22个差异基因,其中,上调10个,下调12个,分别编码硝酸还原酶(NR)、铁氧蛋白亚硝酸盐还原酶(NiR)、硝酸盐转运蛋白(NRT1.2、NRT1.3、NRT1.4)、谷氧还蛋白及相关蛋白(GrsS1、GrsS6)、GATA转录因子(GATA22)、铜胺氧化酶(CuAO1)、脲酶辅助蛋白G(UREG)、尿卟啉Ⅲ甲基化酶(UPM1)和硝酸盐调节基因2(NRG2)等。
KEGG氮代谢通路(ko00910)虽未显著富集,但有7个差异基因,其中,6个下调表达,1个上调表达,编码NR、NiR、铁氧还蛋白依赖性谷氨酸合成酶(Fd-GOGAT)和谷氨酰胺合成酶(GS)。还有部分编码慢阴离子通道SLAC/SLAH家族的SLAH3,编码转运蛋白NRT1/PTR家族的NPF8.3、NPF2.10,编码氨基酸转运蛋白的LHT1、Avt1H、CAT1、BAT1、AATL1和编码氨基转移酶的BCAT2、ALAAT2、AAT等。而氨转运蛋白(ATM1;2)、氨基酸转运蛋白(APP2、APP3)和水通道蛋白(TIP2-1,可能参与铵的液泡分离和解毒)的基因表达无显著性差异。
主要氮代谢相关差异基因及其编码蛋白见表3。
表3 主要氮代谢相关差异基因
Tab.3 Differentially expressed genes which related with nitrogen metabolism
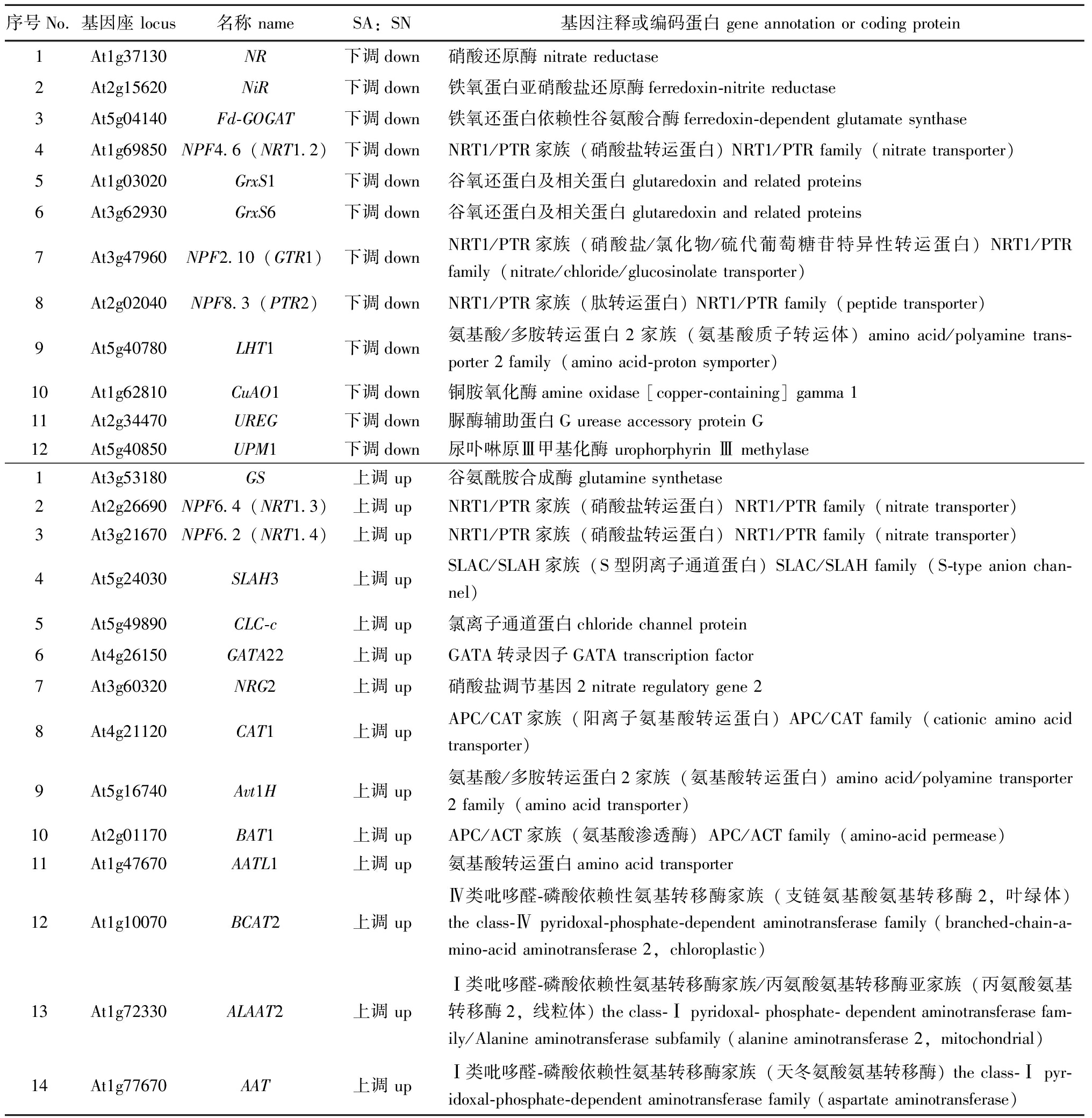
序号No.基因座 locus名称 nameSA:SN基因注释或编码蛋白 gene annotation or coding protein1At1g37130NR下调down硝酸还原酶 nitrate reductase2At2g15620NiR下调down铁氧蛋白亚硝酸盐还原酶ferredoxin-nitrite reductase3At5g04140Fd-GOGAT下调down铁氧还蛋白依赖性谷氨酸合酶ferredoxin-dependent glutamate synthase4At1g69850NPF4.6(NRT1.2)下调downNRT1/PTR家族(硝酸盐转运蛋白) NRT1/PTR family(nitrate transporter)5At1g03020GrxS1下调down谷氧还蛋白及相关蛋白 glutaredoxin and related proteins6At3g62930GrxS6下调down谷氧还蛋白及相关蛋白 glutaredoxin and related proteins7At3g47960NPF2.10(GTR1)下调downNRT1/PTR家族(硝酸盐/氯化物/硫代葡萄糖苷特异性转运蛋白) NRT1/PTR family(nitrate/chloride/glucosinolate transporter)8At2g02040NPF8.3(PTR2)下调downNRT1/PTR家族(肽转运蛋白) NRT1/PTR family(peptide transporter)9At5g40780LHT1下调down氨基酸/多胺转运蛋白2家族(氨基酸质子转运体) amino acid/polyamine trans-porter 2 family(amino acid-proton symporter)10At1g62810CuAO1下调down铜胺氧化酶amine oxidase [copper-containing] gamma 111At2g34470UREG下调down脲酶辅助蛋白G urease accessory protein G12At5g40850UPM1下调down尿卟啉原Ⅲ甲基化酶 urophorphyrin Ⅲ methylase1At3g53180GS上调 up谷氨酰胺合成酶 glutamine synthetase2At2g26690NPF6.4(NRT1.3)上调 upNRT1/PTR家族(硝酸盐转运蛋白)NRT1/PTR family(nitrate transporter)3At3g21670NPF6.2(NRT1.4)上调 upNRT1/PTR家族(硝酸盐转运蛋白)NRT1/PTR family(nitrate transporter)4At5g24030SLAH3上调 upSLAC/SLAH家族(S型阴离子通道蛋白) SLAC/SLAH family(S-type anion chan-nel)5At5g49890CLC-c上调 up氯离子通道蛋白chloride channel protein6At4g26150GATA22上调 upGATA转录因子GATA transcription factor7At3g60320NRG2上调 up硝酸盐调节基因2 nitrate regulatory gene 28At4g21120CAT1上调 upAPC/CAT家族(阳离子氨基酸转运蛋白) APC/CAT family(cationic amino acid transporter)9At5g16740Avt1H上调 up氨基酸/多胺转运蛋白2家族(氨基酸转运蛋白) amino acid/polyamine transporter 2 family(amino acid transporter)10At2g01170BAT1上调 upAPC/ACT家族(氨基酸渗透酶)APC/ACT family(amino-acid permease)11At1g47670AATL1上调 up氨基酸转运蛋白amino acid transporter12At1g10070BCAT2上调 upⅣ类吡哆醛-磷酸依赖性氨基转移酶家族(支链氨基酸氨基转移酶2,叶绿体) the class-Ⅳ pyridoxal-phosphate-dependent aminotransferase family (branched-chain-a-mino-acid aminotransferase 2,chloroplastic)13At1g72330ALAAT2上调 upⅠ类吡哆醛-磷酸依赖性氨基转移酶家族/丙氨酸氨基转移酶亚家族(丙氨酸氨基转移酶2,线粒体) the class-Ⅰ pyridoxal- phosphate- dependent aminotransferase fam-ily/Alanine aminotransferase subfamily (alanine aminotransferase 2,mitochondrial)14At1g77670AAT上调 upⅠ类吡哆醛-磷酸依赖性氨基转移酶家族(天冬氨酸氨基转移酶) the class-Ⅰ pyr-idoxal-phosphate-dependent aminotransferase family (aspartate aminotransferase)
通过定量蛋白组学分析,共鉴定到肽段总数50 985个,鉴定到蛋白总数7 817个,其中可定量蛋白数7 817个。与SN组相比,SA组共筛选差异表达蛋白112个,其中上调表达的蛋白数37个,下调表达的蛋白数74个。使用KEGG、GO数据库进行通路注释,与SN组相比,SA组在KEGG的氮代谢通路(ko00910:nitrogen metabolism)上显著富集;在GO分析中,氮代谢相关通路显著富集的有:硝酸盐同化作用(GO:0042128,nitrate assimilation)、NO生物合成(GO:0006809,nitric oxide biosynthetic process)、钼辅因子结合的活性(GO:0043546,molybdopterin cofactor binding)、钼离子结合(GO:0030151,molybdenum ion binding)、硝酸还原酶(NADH)活性[GO:0009703,nitrate reductase (NADH) activity]、硝酸还原酶(NADPH)活性[GO:0050464,nitrate reductase(NADPH) activity]和铁氧还蛋白亚硝酸还原酶活性(GO:0048307,ferredoxin-nitrite reductase activity)等,前2个通路属于生物过程亚类,后5个通路属于分子功能,且前4个通路是两个组学共同富集的通路。GO富集通路共涉及4个差异蛋白,编码硝酸还原酶NR和亚硝酸盐还原酶NiR,均下调表达,亚细胞定位预测分析时,分别定位于细胞质(cytoplasm)和叶绿体(chloroplast)(图7)。
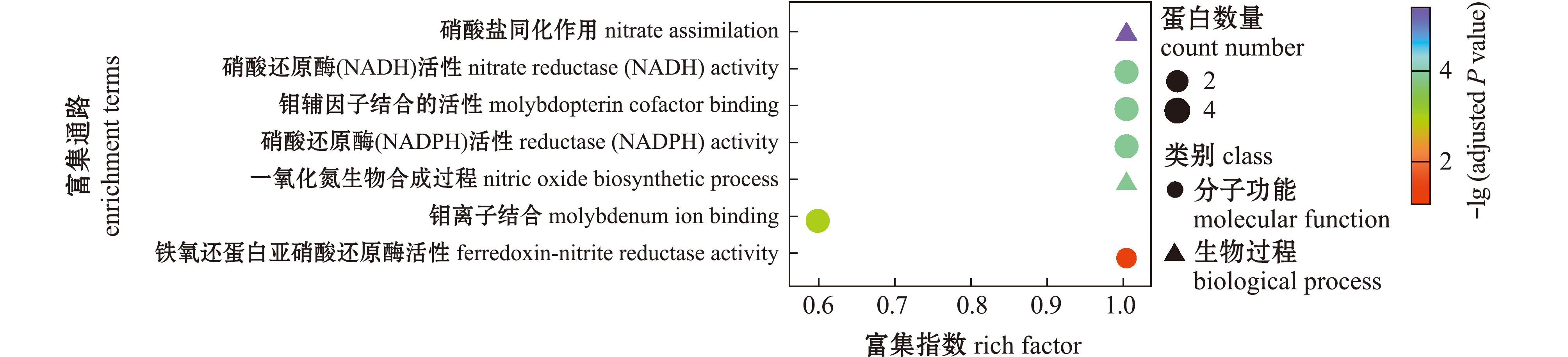
图7 蛋白组氮代谢相关通路富集通路气泡图
Fig.7 Bubble chart of GO enrichment pathways in nitrogen metabolism by proteome
两个海马齿处理组水培液pH均有不同程度的下降,且试验组(SA)下降幅度更大。植物根系对阴阳离子吸收失衡是造成根际pH改变的主要原因,根系吸收的氮以铵态氮为主时,根系分泌出质子H+,质子泵(H+-ATPase)活性提高,同时排H+能力提高,能更好地将铵同化过程产生的H+泵出细胞并排出体外[18],从而加剧了根际酸化。根系对硝态氮的吸收则是与质子驱动力相偶联的主动运输,根际pH略有升高[18],但海马齿水培液pH仍有少许下降,可能与根系分泌有机酸等酸性物质有关。
海马齿对水中氮、磷的吸收能力与氮的形态有关![]() 诱导的根际酸化增强了SA组对磷的吸收,与魏天娇等[19]的结论一致。几乎所有的磷转运蛋白都是依靠H+(质子泵作用后释放)结合磷酸根离子的形式运输磷[18,20],根际酸化提升了质子泵的活性,也提高了对磷的吸收。另一方面,磷和硝态氮的吸收都依赖质子驱动力,具有一定程度的竞争关系[18]。此消彼长,SA组对磷的吸收量高出SN组1.87倍,吸收速率常数则高出3.14倍。海马齿对
诱导的根际酸化增强了SA组对磷的吸收,与魏天娇等[19]的结论一致。几乎所有的磷转运蛋白都是依靠H+(质子泵作用后释放)结合磷酸根离子的形式运输磷[18,20],根际酸化提升了质子泵的活性,也提高了对磷的吸收。另一方面,磷和硝态氮的吸收都依赖质子驱动力,具有一定程度的竞争关系[18]。此消彼长,SA组对磷的吸收量高出SN组1.87倍,吸收速率常数则高出3.14倍。海马齿对![]() 的吸收滞后于
的吸收滞后于![]() 且吸收速率常数较小,可能与高浓度
且吸收速率常数较小,可能与高浓度![]() 作为唯一氮源时的铵胁迫和运输抑制有关[12,21]。
作为唯一氮源时的铵胁迫和运输抑制有关[12,21]。
植株铵中毒的一个重要因素就是pH失调,不耐铵植物的质子泵活性不具有耐酸适应性,根际酸化会导致质子泵活性受到抑制,并最终导致植物生长受阻[18]。SA组生长性状与SN组相比无显著性差异,叶片也未见黄化现象,说明海马齿对![]() 具有较好的耐受能力,能将其快速同化并在高浓度胁迫下保持稳定的生长性能[22]。
具有较好的耐受能力,能将其快速同化并在高浓度胁迫下保持稳定的生长性能[22]。
受转录后调控或翻译后修饰等因素影响,差异基因和差异蛋白的相关性较弱,两个组学共同富集的氮代谢相关GO通路4条,均涉及硝酸还原酶和亚硝酸盐还原酶。本研究中,与对照组(SN)相比,试验组(SA)海马齿叶片中硝酸还原酶和亚硝酸盐还原酶的基因和蛋白均下调表达,并鉴定出下调表达的硝酸盐转运蛋白家族NRT1.2/NPF4.6、NPF2.10/GTR1和NPF8.3/PTR2等氮代谢相关差异基因,说明叶片是硝态氮同化的重要部位。草本植物的根吸收![]() 后除部分在根处直接同化外,大部分直接向地上部位转运至叶肉细胞,既避免其在根系大量储存后影响根系对环境中
后除部分在根处直接同化外,大部分直接向地上部位转运至叶肉细胞,既避免其在根系大量储存后影响根系对环境中![]() 的吸收能力[23-24],又可在叶片中根据植物发育阶段、氮需求和硝态氮储存能力进行同化、储存及组织间的协调分配[25-26]。而GrxS1、GrxS6和尿卟啉原Ⅲ甲基化酶与NR和NiR同步下调表达,可能是因为谷氧还蛋白GRX是植物体内氧化还原系统的组成之一[27],而硝酸盐同化作用本质属于氧-还反应,尿卟啉原Ⅲ甲基化酶可触发NR、NiR等的生物合成。
的吸收能力[23-24],又可在叶片中根据植物发育阶段、氮需求和硝态氮储存能力进行同化、储存及组织间的协调分配[25-26]。而GrxS1、GrxS6和尿卟啉原Ⅲ甲基化酶与NR和NiR同步下调表达,可能是因为谷氧还蛋白GRX是植物体内氧化还原系统的组成之一[27],而硝酸盐同化作用本质属于氧-还反应,尿卟啉原Ⅲ甲基化酶可触发NR、NiR等的生物合成。
氨转运蛋白基因表达无显著性差异,叶片不是铵态氮同化的主要场所。氨是氧化磷酸化和光合磷酸化的解偶联剂,能抑制叶绿体和线粒体ATP形成,为避免过量![]() 导致的植物中毒,植物一经吸收必须立即通过GS/GOGAT循环同化(GOGAT是限速酶)后再向地上部分转运[28-29]。
导致的植物中毒,植物一经吸收必须立即通过GS/GOGAT循环同化(GOGAT是限速酶)后再向地上部分转运[28-29]。
硝态氮和铵态氮吸收同化的差异还导致叶片中涉及氨基酸转运和代谢等相关基因的差异。本研究中GS表达上调而Fd-GOGAT表达下调,这可能是因为![]() 同化后以谷氨酸的形式上传到叶片中,谷氨酸既是Fd-GOGAT的产物,又是GS的底物,谷氨酸的增加,使GS/GOGAT循环向谷氨酰胺合成方向偏移[30]。氨基转移酶BCAT2、ALAAT2和AAT的表达上调,说明谷氨酸通过转氨作用合成植物所需的其他氨基酸和含氮化合物[31]。氨基酸是植物体内氮长距离转运的最主要形式,氨基酸转运蛋白CAT1、Avt1H、BAT1和AATL1表达上调,可能是为了确保植物各器官间氮实现最佳分配,氨基酸进行了再分配和循环[20],如BAT1介导双向氨基酸转运,对丙氨酸、精氨酸、谷氨酸和赖氨酸具有转运活性,可能在从植物韧皮部向库组织输送氨基酸中发挥作用[32]。LHTs是定位于细胞质膜上运输赖氨酸和组氨酸的专一性蛋白,可能参与氨基酸向库器官的运输[33],LHT1在SA组表达下调,可能与SN组海马齿叶同化产生的氨基酸通过该转运蛋白向其他组织器官输送有关。
同化后以谷氨酸的形式上传到叶片中,谷氨酸既是Fd-GOGAT的产物,又是GS的底物,谷氨酸的增加,使GS/GOGAT循环向谷氨酰胺合成方向偏移[30]。氨基转移酶BCAT2、ALAAT2和AAT的表达上调,说明谷氨酸通过转氨作用合成植物所需的其他氨基酸和含氮化合物[31]。氨基酸是植物体内氮长距离转运的最主要形式,氨基酸转运蛋白CAT1、Avt1H、BAT1和AATL1表达上调,可能是为了确保植物各器官间氮实现最佳分配,氨基酸进行了再分配和循环[20],如BAT1介导双向氨基酸转运,对丙氨酸、精氨酸、谷氨酸和赖氨酸具有转运活性,可能在从植物韧皮部向库组织输送氨基酸中发挥作用[32]。LHTs是定位于细胞质膜上运输赖氨酸和组氨酸的专一性蛋白,可能参与氨基酸向库器官的运输[33],LHT1在SA组表达下调,可能与SN组海马齿叶同化产生的氨基酸通过该转运蛋白向其他组织器官输送有关。
此外,NPF6.2/NRT1.4、NPF6.4/NRT1.3、SLAH3等硝酸盐转运蛋白家族的基因表达上调,可能在铵态氮的解毒上起到一定作用:NPF6.2/NRT1.4是协调控制氮使用和K+营养的CIPK23激酶的靶点[34],而CIPK23表达上调可以负向调节氨转运蛋白AMT1;1和AMT1;2[21];SLAH3可能通过介导![]() 外流减缓
外流减缓![]() 吸收引起的根际酸化[21];NPF6.4/NRT1.3是脱落酸(ABA)的转运蛋白[35],ABA含量升高,可以阻碍
吸收引起的根际酸化[21];NPF6.4/NRT1.3是脱落酸(ABA)的转运蛋白[35],ABA含量升高,可以阻碍![]() 的吸收并提高耐受性[21]。
的吸收并提高耐受性[21]。![]() 对氯离子通道蛋白CLC-c基因的影响较小,但该基因在
对氯离子通道蛋白CLC-c基因的影响较小,但该基因在![]() 存在时表达下调[36],从而表现为SA组表达上调。
存在时表达下调[36],从而表现为SA组表达上调。
氨氮能够显著增强海马齿对磷的吸收富集,还因为磷本身参与了铵的解毒。植物通过协调不同营养供应下的吸收和代谢转化,控制转运蛋白关闭或开启,以防止营养或其产物的毒性水平积聚[37]。磷参与植物体内许多重要化合物结构的组成,如核酸、脂质、ATP、ADP、AMP和糖类,且在能量代谢(光合作用、呼吸作用和糖酵解等)中起重要作用[38]:1)谷氨酰胺合成过程需依赖ATP发挥活性[30],海马齿吸收![]() 的同时势必引起能量代谢的变化;2)磷对于氨基转移形成新的氨基酸是必需的(磷酸吡哆醛)物质;3)AMT1;1中T460位点的磷酸化可能导致
的同时势必引起能量代谢的变化;2)磷对于氨基转移形成新的氨基酸是必需的(磷酸吡哆醛)物质;3)AMT1;1中T460位点的磷酸化可能导致![]() 的摄取抑制,磷酸化程度随时间和
的摄取抑制,磷酸化程度随时间和![]() 浓度的增加而增加[37];4)磷脂酸(PA)与AMT1;1结合能调控
浓度的增加而增加[37];4)磷脂酸(PA)与AMT1;1结合能调控![]() 的吸收机制,也能抑制其转运活性[39]等(磷参与与AMT相关的
的吸收机制,也能抑制其转运活性[39]等(磷参与与AMT相关的![]() 摄取抑制,可能发生在
摄取抑制,可能发生在![]() 的同化部位)。
的同化部位)。
总体而言,海马齿对氨氮和硝态氮的吸收和同化机制不同,对硝态氮有一定的偏向性;吸收速率与氮的形态有关,吸收过程符合一级反应动力学模型,氨氮的吸收速率常数小于硝态氮[15]。氨氮和磷是海水养殖的主要污染物,海马齿对氨氮的耐受性高,且氨氮条件有助于磷的吸收,使其在海水养殖生物修复中具有较大作用。
1)受![]() 吸收同化时H+释放的影响,铵态氮导致的根际酸化大于硝态氮。
吸收同化时H+释放的影响,铵态氮导致的根际酸化大于硝态氮。
2)海马齿对硝态氮吸收具有一定偏向性,但对氨氮的耐受性较高,且SA组对磷的吸收能力大于SN组。
3)海马齿对铵态氮和硝态氮在吸收、转运与代谢上存在差异,叶片不是铵态氮同化的主要场所,却是硝态氮同化的重要部位。
致谢:对本课题组王雪玲、苏清清、黄伟杰在海马齿培养中提供的帮助,一并致谢。
[1] 张翠雅,陈锋,国显勇,等.人工湿地净化海水养殖尾水的影响因素研究进展[J].大连海洋大学学报,2023,38(5):902-912.
ZHANG C Y,CHEN F,GUO X Y,et al.Research progress on the factors influencing mariculture wastewater treatment by constructed wetland:a review[J].Journal of Dalian Ocean University,2023,38(5):902-912.(in Chinese)
[2] 王纯,袁子茜,原艺杭,等.海水养殖尾水生物处理技术研究进展与碳减排思考[J].大连海洋大学学报,2022,37(6):1055-1065.
WANG C,YUAN Z X,YUAN Y H,et al.Research progress of biological treatment technology of mariculture wastewater and thoughts on carbon reduction:a review[J].Journal of Dalian Ocean University,2022,37(6):1055-1065.(in Chinese)
[3] 唐昌林.中国植物志.第26卷[M].北京科学出版社,1996:93-158.
TANG C L.Flora of China.Vol.26[M].Beijing: Science Press,1996:93-158.(in Chinese)
[4] 杨芳,杨妙峰,郑盛华,等.东山湾海马齿生态浮床原位修复效果研究[J].渔业研究,2019,41(3):225-233.
YANG F,YANG M F,ZHENG S H,et al.Study on the in situ remediation effects of Sesuvium portulacastrum ecological floating beds in Dongshan Bay[J].Journal of Fisheries Research,2019,41(3):225-233.(in Chinese)
[5] 王成强,相智巍,黄炳山,等.3种耐盐植物对水产养殖废水净化效果[J].广东海洋大学学报,2022,42(3):25-32.
WANG C Q,XIANG Z W,HUANG B S,et al.Effects of three varieties of halophytes on the purification of aquaculture waste water[J].Journal of Guangdong Ocean University,2022,42(3):25-32.(in Chinese)
[6] 窦碧霞,黄建荣,李连春,等.海马齿对海水养殖系统中氮、磷的移除效果研究[J].水生态学杂志,2011,32(5):94-99.
DOU B X,HUANG J R,LI L C,et al.Research on effects of nutrient and phosphate removal from marine aquaculture system by Sesuvium portulacastrum[J].Journal of Hydroecology,2011,32(5):94-99.(in Chinese)
[7] 李飞翔,岳琛,张超月,等.人工湿地去除水产养殖尾水中氮磷的影响因素识别[J].生态与农村环境学报,2022,38(7):925-932.
LI F X,YUE C,ZHANG C Y,et al.Identification of influencing factors of nitrogen and phosphorus removal from aquaculture wastewater by constructed wetlands[J].Journal of Ecology and Rural Environment,2022,38(7):925-932.(in Chinese)
[8] 袁星,林彦彦,黄建荣,等.海马齿生态浮床对海水养殖池塘的修复效果[J].安徽农业科学,2016,44(14):69-75,96.
YUAN X,LIN Y Y,HUANG J R,et al.Restoration of Sesuvium portulacastrum ecological floating bed to mariculture pond[J].Journal of Anhui Agricultural Sciences,2016,44(14):69-75,96.(in Chinese)
[9] 李志凌,王晓龙,田相利,等.珍珠龙胆石斑鱼与不同海水植物工厂化原位混养的比较研究[J].海洋湖沼通报,2018,40(5):118-124.
LI Z L,WANG X L,TIAN X L,et al.A comparative study on structure optimization for industrialin situ integrated aquaculture of Epinephe lusfuscoguttatus(♀)×E.luslanceolatus(♂)with different sea water plants[J].Transactions of Oceanology and Limnology,2018,40(5):118-124.(in Chinese)
[10] DAUDA A B,AJADI A,TOLA-FABUNMI A S,et al.Waste production in aquaculture: Sources,components and managements in different culture systems[J].Aquaculture and Fisheries,2019,4(3):81-88.
[11] CHEN S J,SUN X Q,TIAN X L,et al.Influence of ammonia nitrogen management strategies on microbial communities in biofloc-based aquaculture systems[J].Science of the Total Environment,2023,903:166159.
[12] WU Y J,XU Y,LIU Z Y,et al.Different responses of the Lagerstroemia indica to varied supplies of ammonium and nitrate[J].Scientia Horticulturae,2024,329:113001.
[13] LI S,ZHANG H,WANG S L,et al.The rapeseed genotypes with contrasting NUE response discrepantly to varied provision of ammonium and nitrate by regulating photosynthesis,root morphology,nutritional status,and oxidative stress response[J].Plant Physiology and Biochemistry,2021,166:348-360.
[14] 巫晓杰,申玉春,叶宁,等.海马齿对氮、磷吸收利用速率的初步研究[J].中国农学通报,2011,27(20):92-96.
WU X J,SHEN Y C,YE N,et al.The preliminary study of Sesuvium portulacastrum on the nitrogen and phosphorus absorption rate[J].Chinese Agricultural Science Bulletin,2011,27(20):92-96.(in Chinese)
[15] 蔡真珍,郑盛华,曾健,等.海马齿生态浮床对金刚虾养殖环境的净化[J].浙江海洋大学学报(自然科学版),2023,42(3):220-227.
CAI Z Z,ZHENG S H,ZENG J,et al.The purification of the Penaeus monodon culture environment by Sesuvium portulacastrum ecological floating bed[J].Journal of Zhejiang Ocean University(Natural Science Edition),2023,42(3):220-227.(in Chinese)
[16] HOAGLAND D R,ARNON D I.The Water-culture method for growing plants without soil[J].California Agricultural Experiment Station,1950,347:1-32.
[17] 国家市场监督管理总局,中国国家标准化管理委员会.海洋监测规范 第4部分:海水分析:GB 17378.4—2007[S].北京:中国标准出版社,2008.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization Administration of the People’s Republic of China.The specification for marine monitoring:Part 4:Seawater analysis:GB 17378.4—2007[S].Beijing:Standards Press of China,2008.(in Chinese)
[18] 许飞云,张茂星,曾后清,等.水稻根系细胞膜质子泵在氮磷钾养分吸收中的作用[J].中国水稻科学,2016,30(1):106-110.
XU F Y,ZHANG M X,ZENG H Q,et al.Involvement of plasma membrane H+-ATPase in uptake of nitrogen,phosphorus and potassium by rice root[J].Chinese Journal of Rice Science,2016,30(1):106-110.(in Chinese)
[19] 魏天娇,周金泉,张明超,等.铵硝营养对高粱根系细胞膜质子泵的影响[J].植物营养与肥料学报,2015,21(5):1178-1183.
WEI T J,ZHOU J Q,ZHANG M C,et al.Effect of ![]() supply on plasma membrane H+- ATPase activity of Sorghum roots[J].Journal of Plant Nutrition and Fertilizer,2015,21(5):1178-1183.(in Chinese)
supply on plasma membrane H+- ATPase activity of Sorghum roots[J].Journal of Plant Nutrition and Fertilizer,2015,21(5):1178-1183.(in Chinese)
[20] ZENG H Q,CHEN H Y,ZHANG M X,et al.Plasma membrane H+-ATPases in mineral nutrition and crop improvement[J].Trends in Plant Science,2024,29(9):978-994.
[21] XIAO C B,FANG Y,WANG S M,et al.The alleviation of ammonium toxicity in plants[J].Journal of Integrative Plant Biology,2023,65(6):1362-1368.
[22] GAO J Q,REN P,ZHOU Q Y,et al.Comparative studies of the response of sensitive and tolerant submerged macrophytes to high ammonium concentration stress[J].Aquatic Toxicology,2019,211:57-65.
[23] XU G H,FAN X R,MILLER A J.Plant nitrogen assimilation and use efficiency [J].Annual Review of Plant Biology,2012,63(1):153-182.
[24] 安慧,上官周平.植物氮素循环过程及其根域调控机制[J].水土保持研究,2006,13(1):83-85,88.
AN H,SHANGGUAN Z P.The nitrogen cycling of plants and it’s physiological mechanism of root-zone environment[J].Research of Soil and Water Conservation,2006,13(1):83-85,88.(in Chinese)
[25] 刘海光,罗振,董合忠.植物硝态氮吸收和转运的调控研究进展[J].生物技术通报,2021,37(6):192-201.
LIU H G,LUO Z,DONG H Z.Research progress on the regulation of ![]() uptake and transport in plant[J].Biotechnology Bulletin,2021,37(6):192-201.(in Chinese)
uptake and transport in plant[J].Biotechnology Bulletin,2021,37(6):192-201.(in Chinese)
[26] 李晨阳,孔祥强,董合忠.植物吸收转运硝态氮及其信号调控研究进展[J].核农学报,2020,34(5):982-993.
LI C Y,KONG X Q,DONG H Z.Nitrate uptake,transport and signaling regulation pathways[J].Journal of Nuclear Agricultural Sciences,2020,34(5):982-993.(in Chinese)
[27] 张硕,王硕,韩胜芳,等.植物中谷氧还蛋白研究进展[J].华北农学报,2021,36(S1):202-209.
ZHANG S,WANG S,HAN S F,et al.The research progress of Glutaredoxin in plants[J].Acta Agriculturae Boreali-Sinica,2021,36(S1):202-209.(in Chinese)
[28] 徐晓鹏,傅向东,廖红.植物铵态氮同化及其调控机制的研究进展[J].植物学报,2016,51(2):152-166.
XU X P,FU X D,LIAO H.Advances in study of ammonium assimilation and its regulatory mechanism in plants[J].Chinese Bulletin of Botany,2016,51(2):152-166.(in Chinese)
[29] 陈润政,黄上志.植物生理学[M].广州:中山大学出版社,1998:125-131.
CHEN R Z,HUANG S Z.plant physiology[M].Guangzhou:Sun Yat-sen University Press,1998:125-131.(in Chinese)
[30] 莫良玉,吴良欢,陶勤南.高等植物GS/GOGAT循环研究进展[J].植物营养与肥料学报,2001,7(2):223-231.
MO L Y,WU L H,TAO Q N.Researchadvances on GS/GOGAT cycle in higher plants[J].Plant Natrition and Fertilizen Science,2001,7(2):223-231.(in Chinese)
[31] OKUMOTO S,PILOT G.Amino acid export in plants: a missing link in nitrogen cycling[J].Molecular Plant,2011,4(3):453-463.
[32] DÜNDAR E,BUSH D R.BAT1,a bidirectional amino acid transporter in Arabidopsis[J].Planta,2009,229(5):1047-1056.
[33] 刘红玲,张新婉,黄玮,等.植物氨基酸转运子研究进展[J].植物科学学报,2018,36(4):623-631.
LIU H L,ZHANG X W,HUANG W,et al.Advances in research on plant amino acid transporters[J].Plant Science Journal,2018,36(4):623-631.(in Chinese)
[34] RADDATZ N,MORALES DE LOS RIOS L,LINDAHL M,et al.Coordinated transport of nitrate,potassium, and sodium[J].Frontiers in Plant Science,2020,11:247.
[35] TONG W, IMAI A,TABATA R,et al.Polyamine resistance is increased by mutations in a nitrate transporter gene NRT1.3(AtNPF6.4) in Arabidopsis thaliana [J].Frontiers in Plant Science,2016,7:834.
[36] HARADA H,KUROMORI T,HIRAYAMA T,et al.Quantitative trait loci analysis of nitrate storage in Arabidopsis leading to an investigation of the contribution of the anion channel gene,AtCLC-c, to variation in nitrate levels[J].Journal of Experimental Botany,2004,55(405):2005-2014.
[37] LANQUAR V,LOQUE D,HORMANN F,et al.Feedback inhibition of ammonium uptake by a phospho-dependent allosteric mechanism in Arabidopsis[J].The Plant Cell,2009,21(11):3610-3622.
[38] 郑璐,包媛媛,张鑫臻,等.植物磷转运蛋白基因的研究进展[J].生态环境学报,2017,26(2):342-349.
ZHENG L,BAO Y Y,ZHANG X Z,et al.Research progress of phosphorus transporter gene in plants[J].Ecology and Environmental Sciences,2017,26(2):342-349.(in Chinese)
[39] CAO H W,LIU Q Y,LIU X,et al.Phosphatidic acid regulates ammonium uptake by interacting with AMMONIUM TRANSPORTER 1;1 in Arabidopsis[J].Plant Physiology,2023,193(3):1954-1969.