由于多溴联苯醚(polybrominated diphenyl ethers,PBDEs)被逐渐禁用,作为替代品的有机磷系阻燃(organophosphate flame retardants,OPFRs)使用量迅速上升。磷酸三(2-氯丙基)酯(TCPP)是OPFRs的典型代表之一,TCPP应用范围极为广泛,多数添加于橡胶和涂料等中[1],其高溶解性使它易进到水环境中,且是水中检出率最高的一种OPFRs[2-5]。在瑞典和德国,环境废水中TCPP浓度分别达4.4、3.0 μg/L[6]。在中国黄海海域TCPP被广泛检出,浓度为0.092~1.392 μg/L,TCPP已经成为一类新型海洋污染物[7]。
目前,有关TCPP对水生生物的毒理学研究还相对较少,且主要集中在TCPP对淡水鱼类的毒性效应上,如对淡水鱼的发育毒性、神经毒性、生殖毒性和肝脏毒性等[8-12]。研究发现,TCPP暴露会抑制斑马鱼(Danio rerio)胚胎发育,导致其胚胎发生畸形[8]。稀有鮈鲫(Gobiocypris rarus)胚胎在受到TCPP暴露后,孵化出的仔鱼会出现严重的脊柱弯曲、心包囊水肿,同时心脏的正常发育也受到干扰[1]。在神经毒性方面,TCPP暴露后会改变斑马鱼的游泳行为,降低其反应能力和灵活性[9-10]。在生殖毒性方面,TCPP具有内分泌干扰效应,导致斑马鱼性激素调控系统紊乱,繁殖能力下降[11]。除此之外,TCPP暴露还会引起斑马鱼显著的脂质代谢功能障碍,导致肝脏过度积累脂肪[12]。
目前,关于TCPP的毒性研究主要集中在淡水鱼类(如斑马鱼等)中,而海洋生物对污染物的响应可能存在显著性差异,因此有必要针对海洋鱼类展开相关研究。海水青鳉(Oryzias melastigma)是一种潜在的海洋模式鱼类,已被广泛地应用于生态毒理学研究中[13],本研究中以其作为受试生物,通过胚胎和仔鱼阶段21 d暴露后,评估了胚胎存活、孵化、心率、畸形及仔鱼生长等指标,探究了TCPP暴露对其早期发育的潜在不良影响,以期为评估TCPP对海洋鱼类的影响提供科学依据。
1 材料与方法
1.1 材料
本研究用海水青鳉由厦门大学赠送,并在本实验室培育多代。成鱼饲养在经过24 h曝气盐度为30的人工海水中(下同),水温为28 ℃±2 ℃,光照明暗循环时间为14 h∶10 h,每天投喂2次丰年虾。定期清除食物残渣和粪便,每天更换1/3体积人工海水。
1.2 方法
1.2.1 暴露试验 根据相关文献报道使用的暴露浓度[12,14],本研究用二甲亚砜作为助溶剂,将TCPP(Sigma,CAS:13674-84-5,纯度98%)加入到人工海水中,分别配制试验所需的5、15、25 mg/L暴露液,对照组海水中也加入与暴露组相同浓度的二甲亚砜(0.005%)[14],所有溶液均密封保存于避光阴凉处。将刚受精的胚胎分别置于盛有0、5、15、25 mg/L TCPP暴露液的玻璃培养皿中,每个培养皿中放置30枚胚胎,每组设置5个生物学重复,每天更新暴露液,定时观察胚胎发育情况并剔除死亡胚胎,持续暴露21 d,培养条件同成鱼。
1.2.2 胚胎心率、孵化率和存活率检测 在显微镜下观察胚胎每天的发育过程和仔鱼出膜情况,分别记录胚胎的心率、孵化率和存活率。根据相关文献报道,海水青鳉胚胎在受精后第5天开始形成心跳,在第8天时心率开始升高,在第11天时心率稳定[15],因此本研究中检测了海水青鳉胚胎第5、8、10天的心率。检测心率时,本研究在各个浓度组的每个培养皿中随机挑选8枚胚胎,在显微镜下找到胚胎心脏位置,并记录20 s内的心跳次数。
孵化率![]()
(1)
存活率![]()
(2)
1.2.3 形态发育异常观察 在显微镜下每天观察各组胚胎的发育情况,根据文献[16]报道的方法,记录其发育过程中眼睛、胸鳍和卵黄囊等异常形态,并用荧光显微镜(徕卡DM 4000B,德国)进行拍照记录。当仔鱼出膜后,收集各个浓度组中每天新出膜的仔鱼,在显微镜下进行观察并拍照记录畸形个体。
畸形率![]()
(3)
1.2.4 生长指标测量 根据文献[17]报道的方法,从各个浓度组的每个培养皿中随机选择10条仔鱼,在冰上麻醉后,将其置于显微镜下拍照,并利用Image-Pro PLUS软件测量仔鱼体长、胸鳍长、眼直径、眼轴长和巩膜直径。
1.3 数据处理
试验数据均采用平均值±标准误(mean±S.E.)表示,数据分析采用SPSS Statistics 22.0软件进行单因素方差分析(one-way ANOVA),并用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
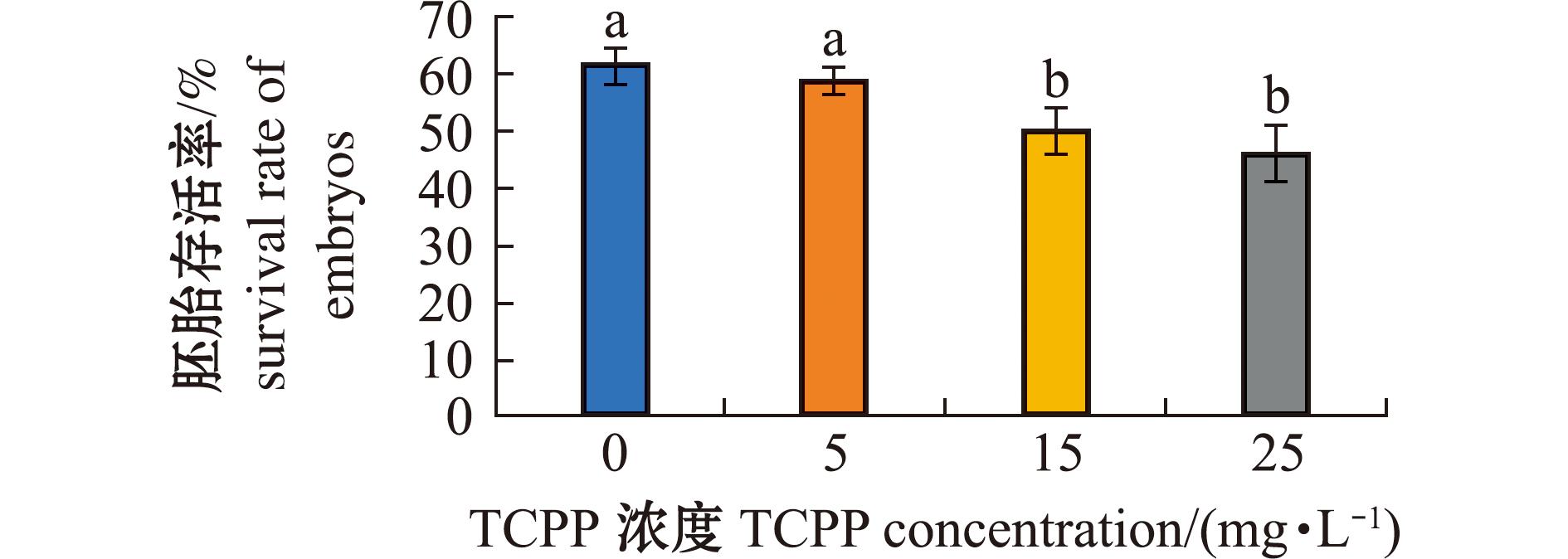
2.1 TCPP暴露对海水青鳉胚胎存活率的影响
暴露结束后统计胚胎存活率,结果如图1所示。与对照组相比,5 mg/L暴露组的胚胎存活率无显著性变化(P>0.05),15、25 mg/L暴露组的胚胎存活率均显著下降(P<0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences in the groups(P<0.05),and the means with the same letter are not significant differences(P>0.05),et sequentia.
图1 TCPP暴露对海水青鳉胚胎存活率的影响
Fig.1 Impact of TCPP exposure on the survival rate of Oryzias melastigma embryos
2.2 TCPP暴露对海水青鳉胚胎心率的影响
测定海水青鳉胚胎在第5、8、10天的心率,结果如图2所示。在第5、8、10天时,所有TCPP暴露组的胚胎心率均显著下降(P<0.05)。
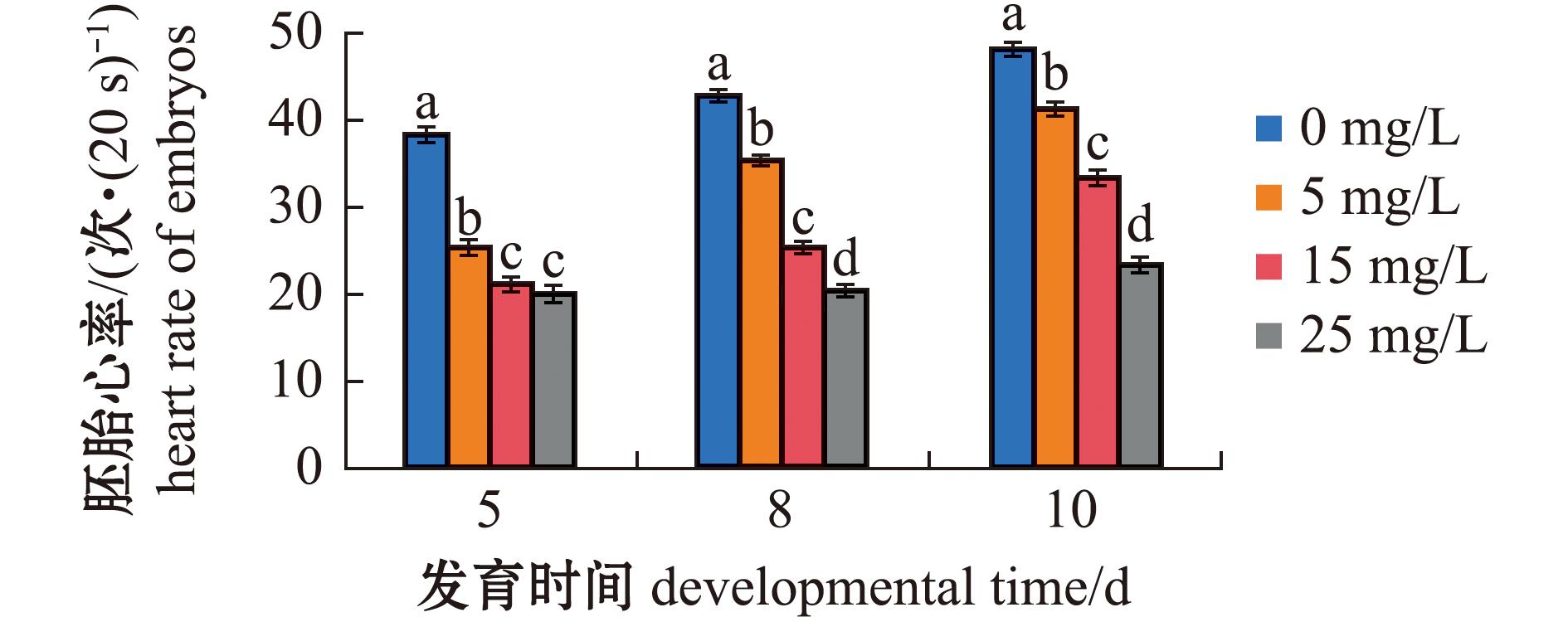
图2 TCPP暴露对海水青鳉胚胎心率的影响
Fig.2 Impact of TCPP exposure on the heart rate of Oryzias melastigma embryos
2.3 TCPP暴露对海水青鳉胚胎孵化和畸形的影响
检测海水青鳉胚胎孵化和畸形情况,如图3所示。各暴露组的孵化率均无显著性变化(P>0.05)(图3(a))。其中,5 mg/L暴露组胚胎的平均孵化时间显著缩短(P<0.05),15、25 mg/L暴露组胚胎的平均孵化时间均无显著性变化(P>0.05)(图3(b))。5 mg/L暴露组的胚胎畸形率无显著性变化(P>0.05),15、25 mg/L暴露组的胚胎畸形率均显著升高(P<0.05)(图3(c));胚胎的畸形主要表现为眼球大小不一,小眼畸形和心血管异常(图3(d))。所有TCPP暴露组的仔鱼总畸形率均无显著性变化(P>0.05)(图3(e))。
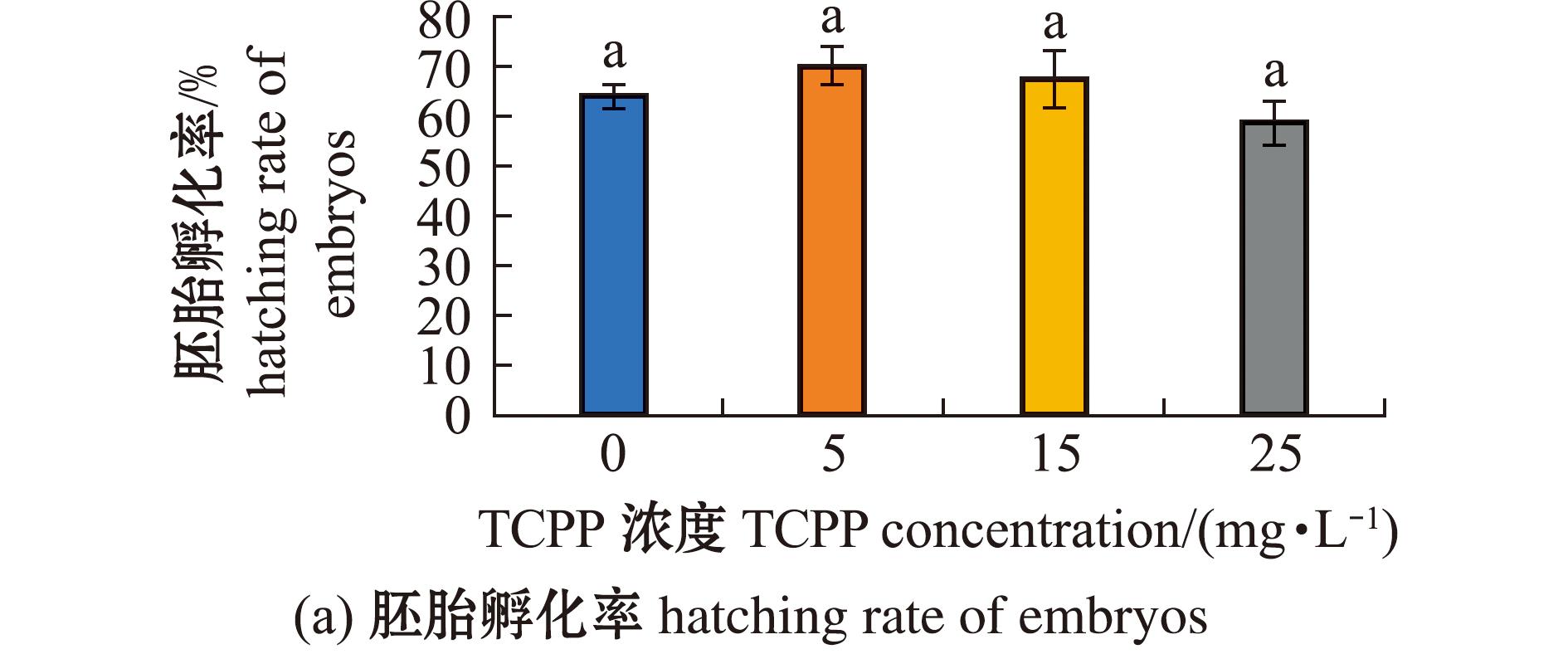
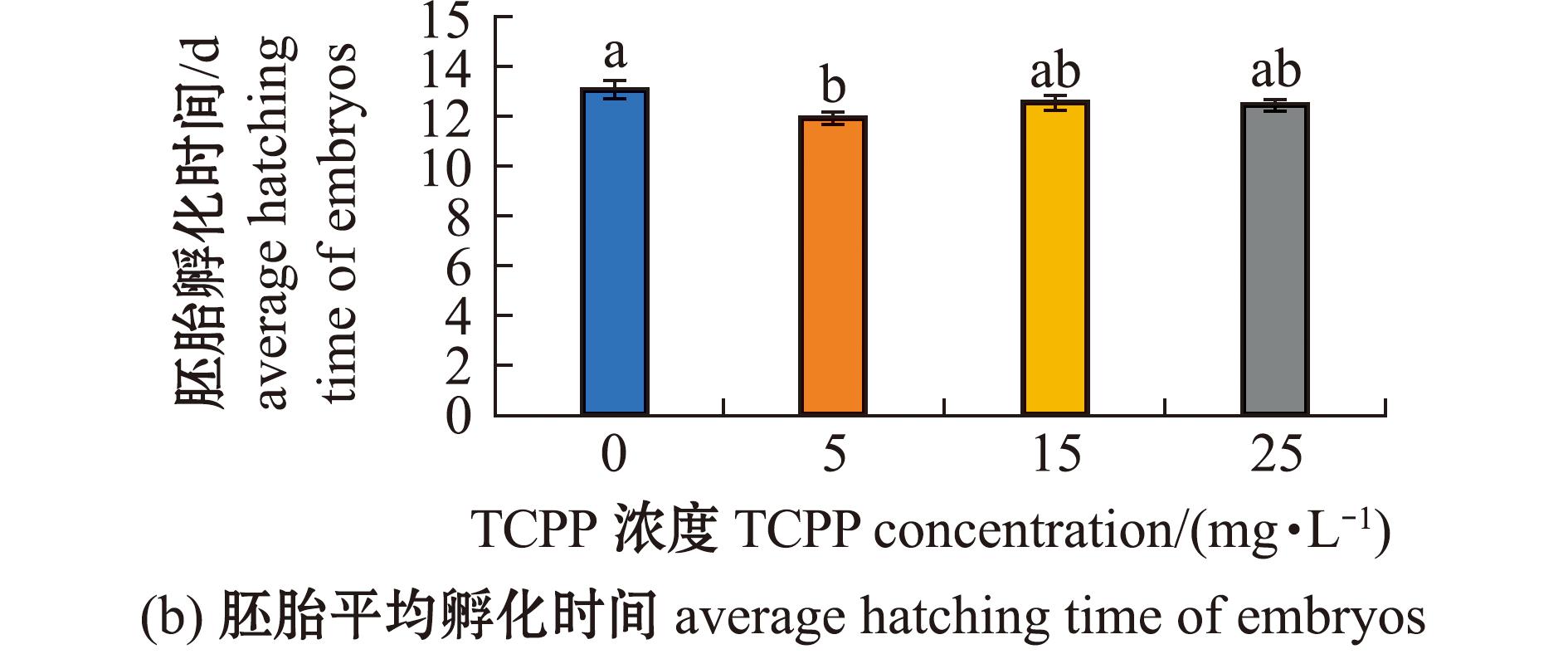
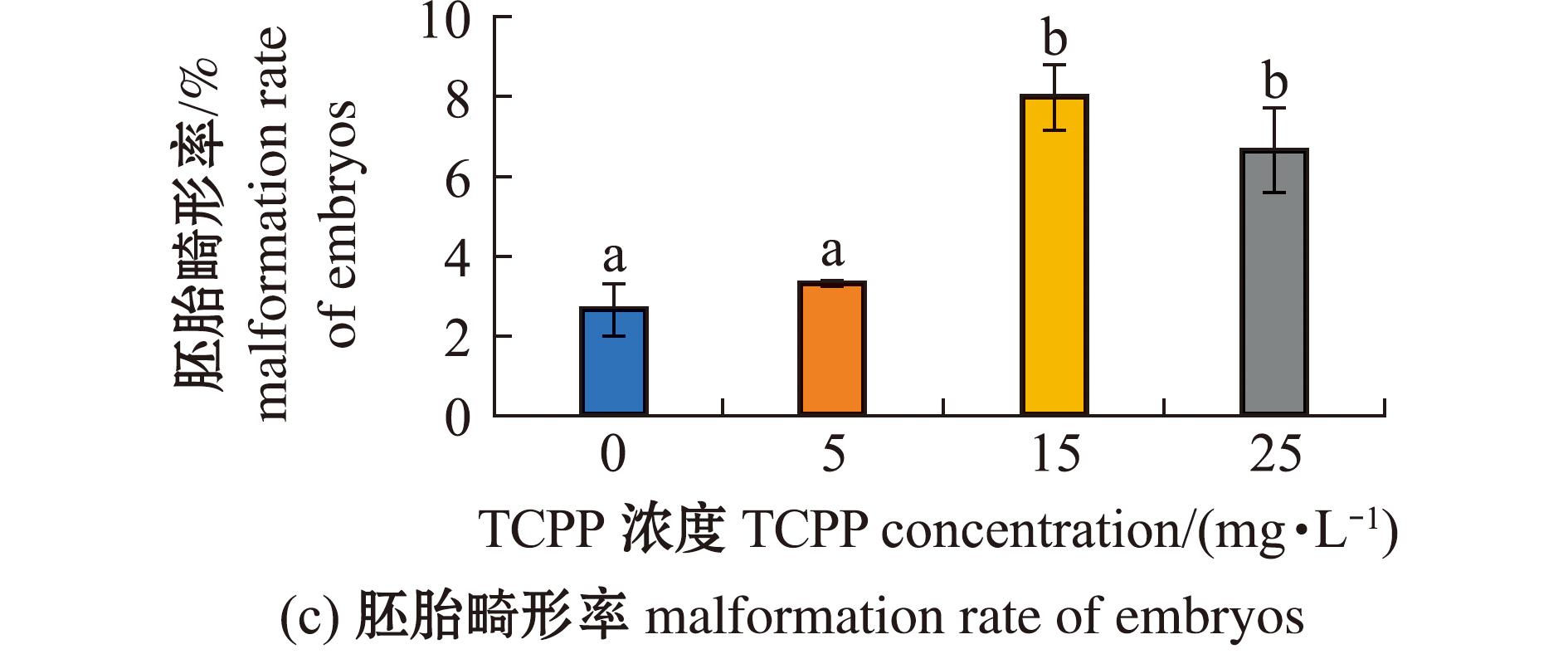
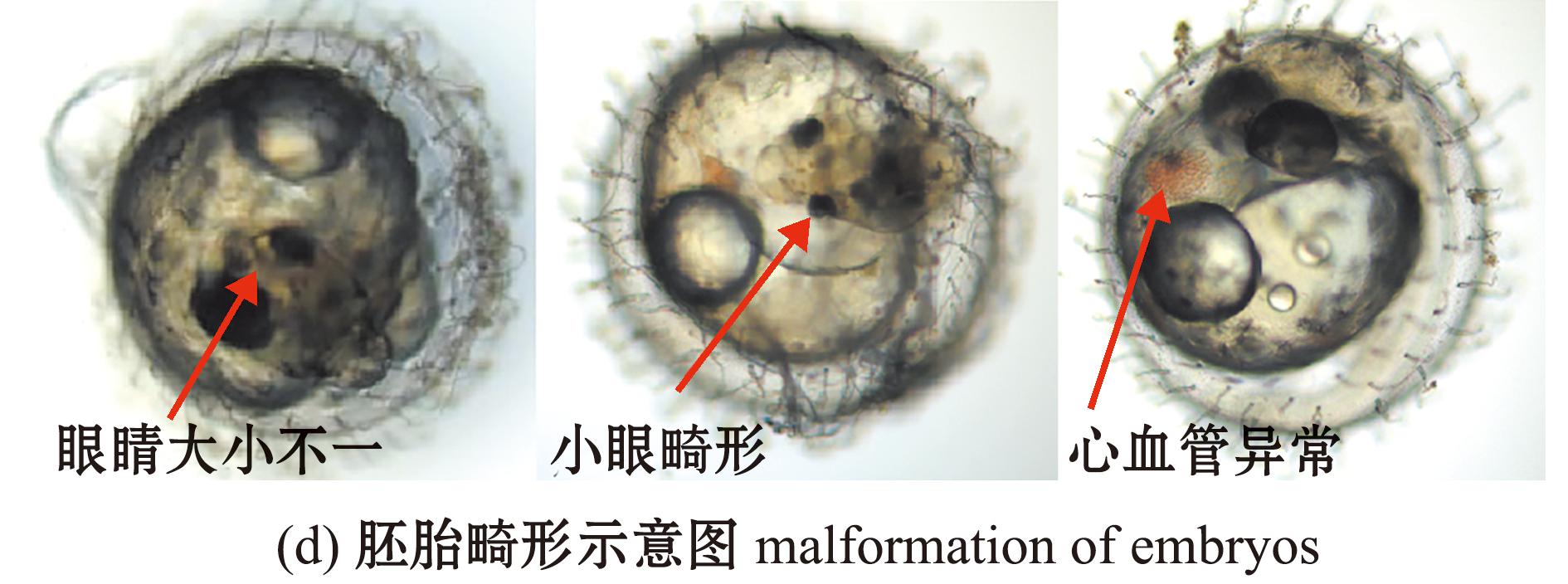
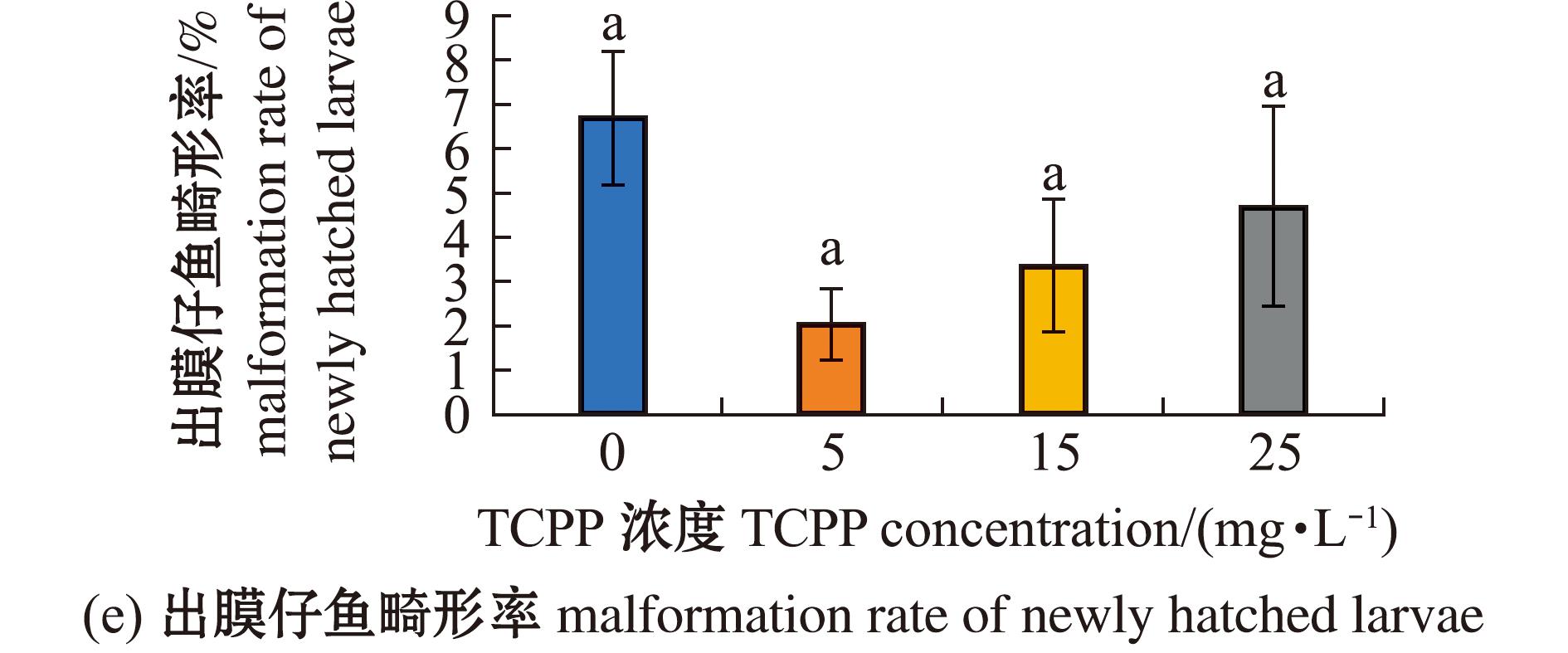
图3 TCPP暴露对海水青鳉胚胎孵化率、平均孵化时间及畸形率的影响
Fig.3 Impact of TCPP exposure on the hatching rate,average hatching time and malformation rate of Oryzias melastigma embryos
2.4 TCPP暴露对海水青鳉出膜仔鱼体长和胸鳍长度的影响
对新孵化出膜仔鱼的体长和胸鳍长度进行测量,结果如图4所示。5 mg/L暴露组的体长无显著性变化(P>0.05),15、25 mg/L暴露组的体长均显著减少(P<0.05)(图4(b))。各暴露组的胸鳍长度均无显著性变化(P>0.05)(图4(c))。
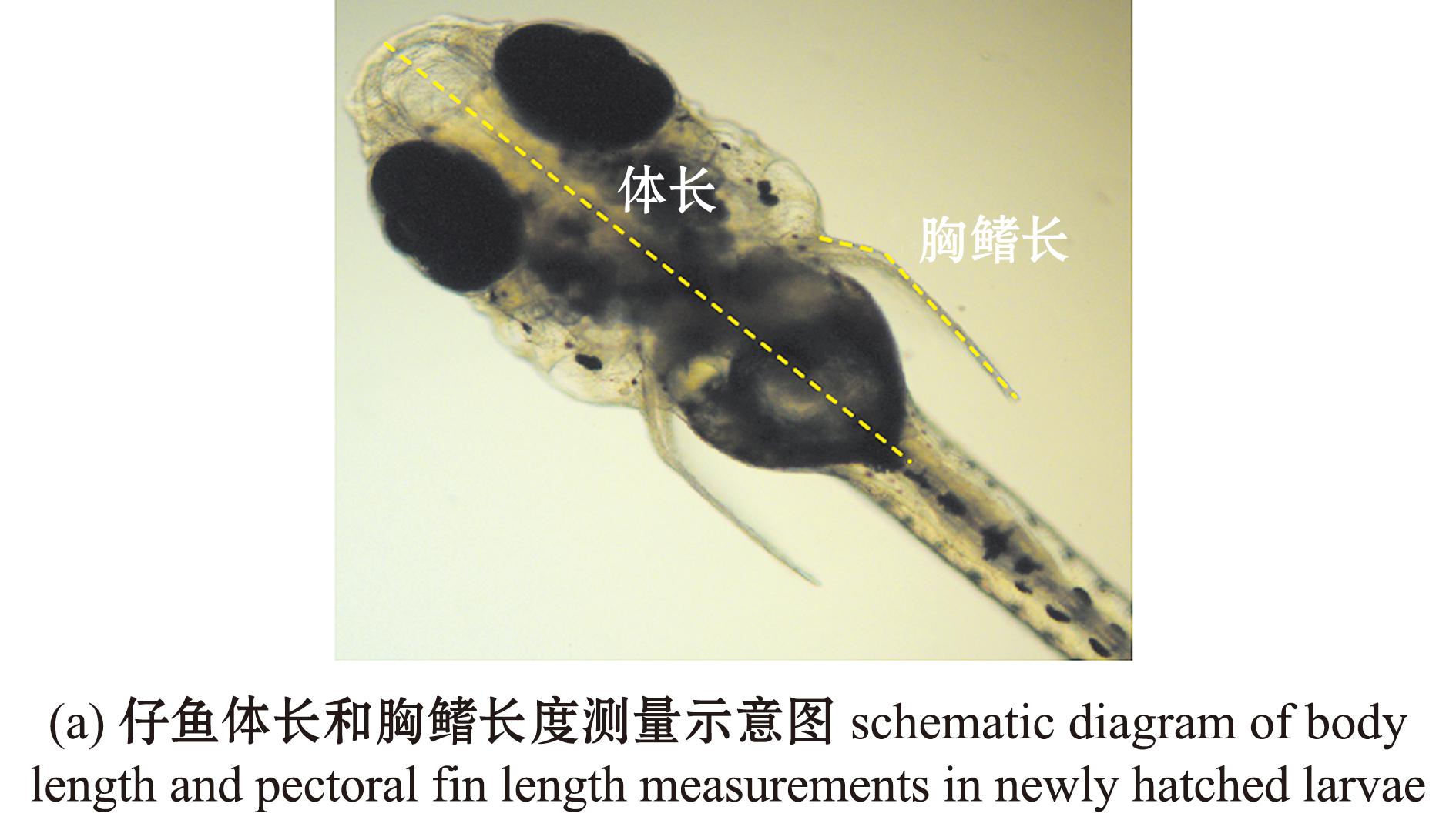
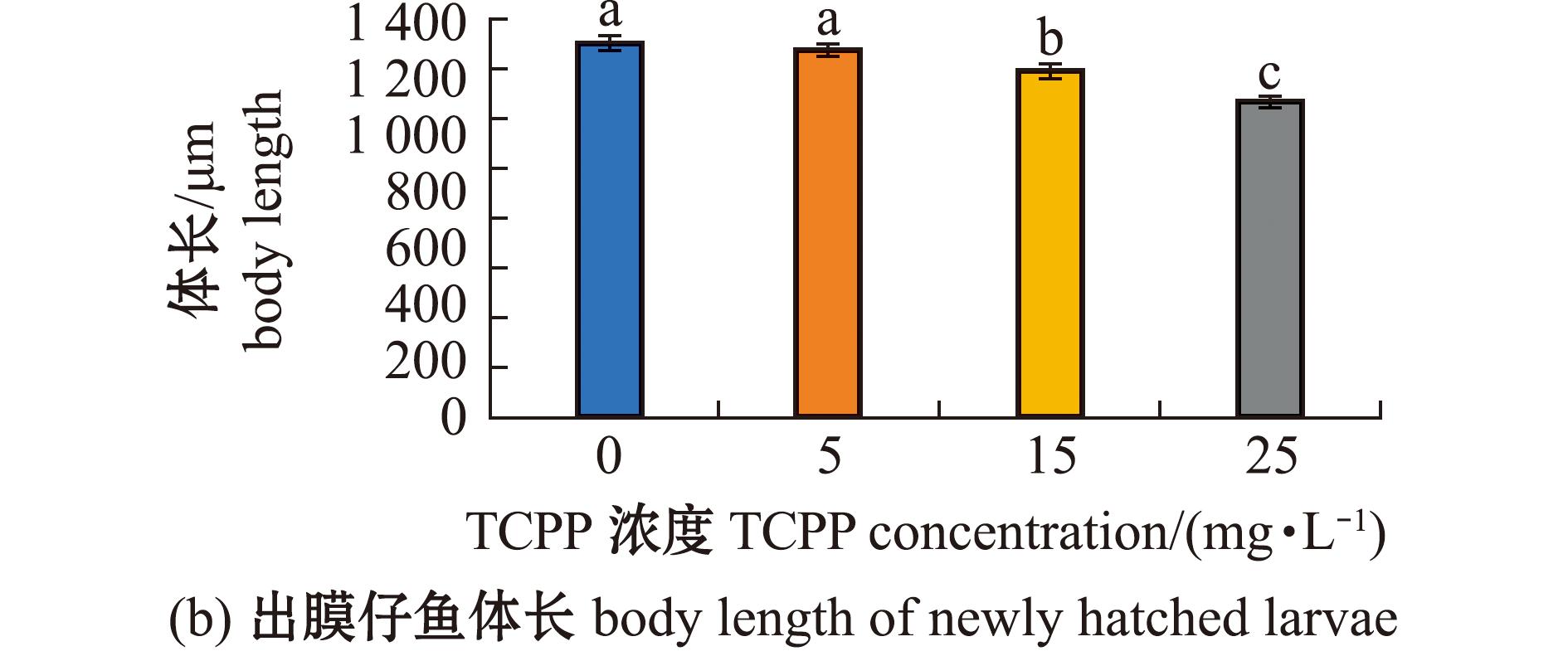
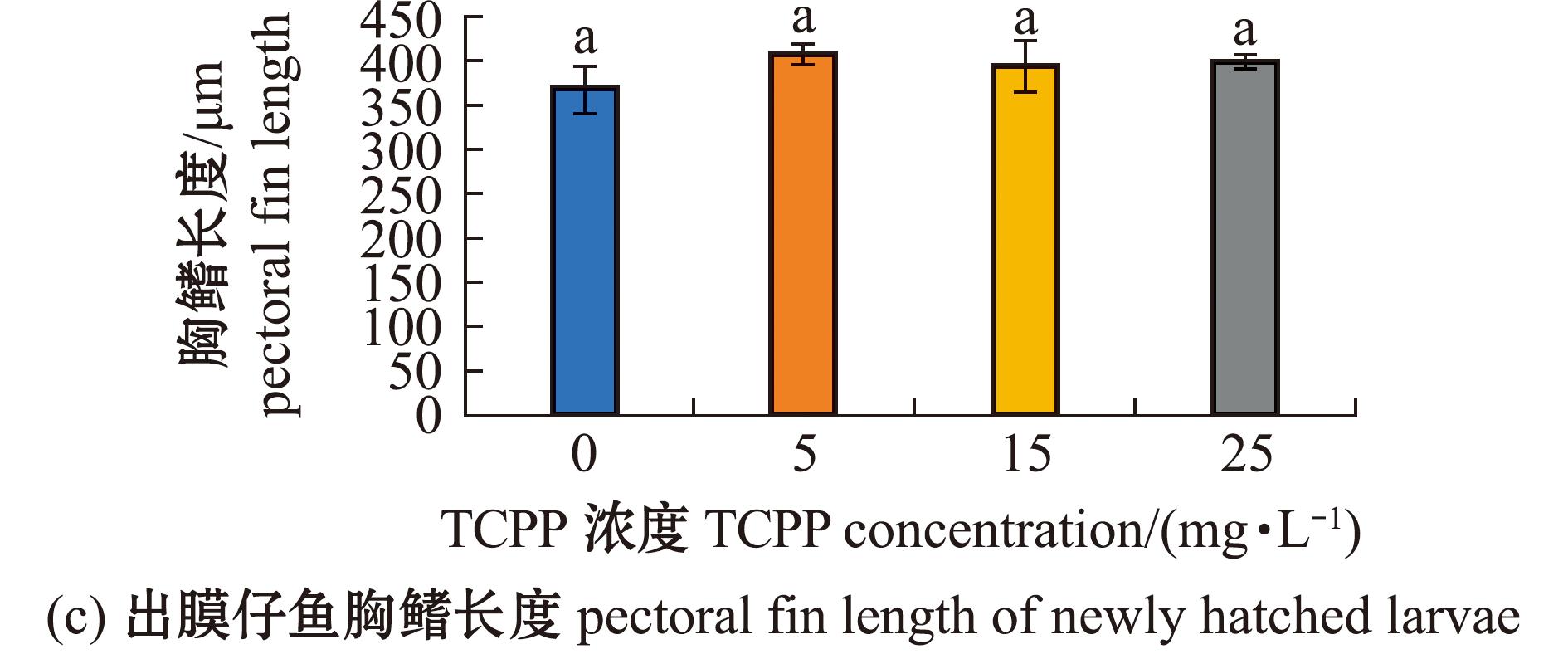
图4 TCPP暴露对海水青鳉出膜仔鱼体长、胸鳍长度的影响
Fig.4 Impact of TCPP exposure on the body length and the pectoral fin length of newly hatched Oryzias melastigma larvae
2.5 TCPP暴露对海水青鳉仔鱼眼球发育的影响
研究发现,较多胚胎出现眼球畸形,故本研究中对出膜仔鱼眼球大小进行了测量,结果如图5所示。从图5可见,5 mg/L暴露组的眼轴长(图5(b))、眼直径(图5(c))、巩膜直径(图5(d))、巩膜直径与眼直径比值(图5(e))均无显著性变化(P>0.05);15、25 mg/L暴露组的眼轴长(图5(b))、眼直径(图5(c))、巩膜直径(图5(d))均显著减少(P<0.05),巩膜直径与眼直径比值(图5(e))均显著增加(P<0.05)。

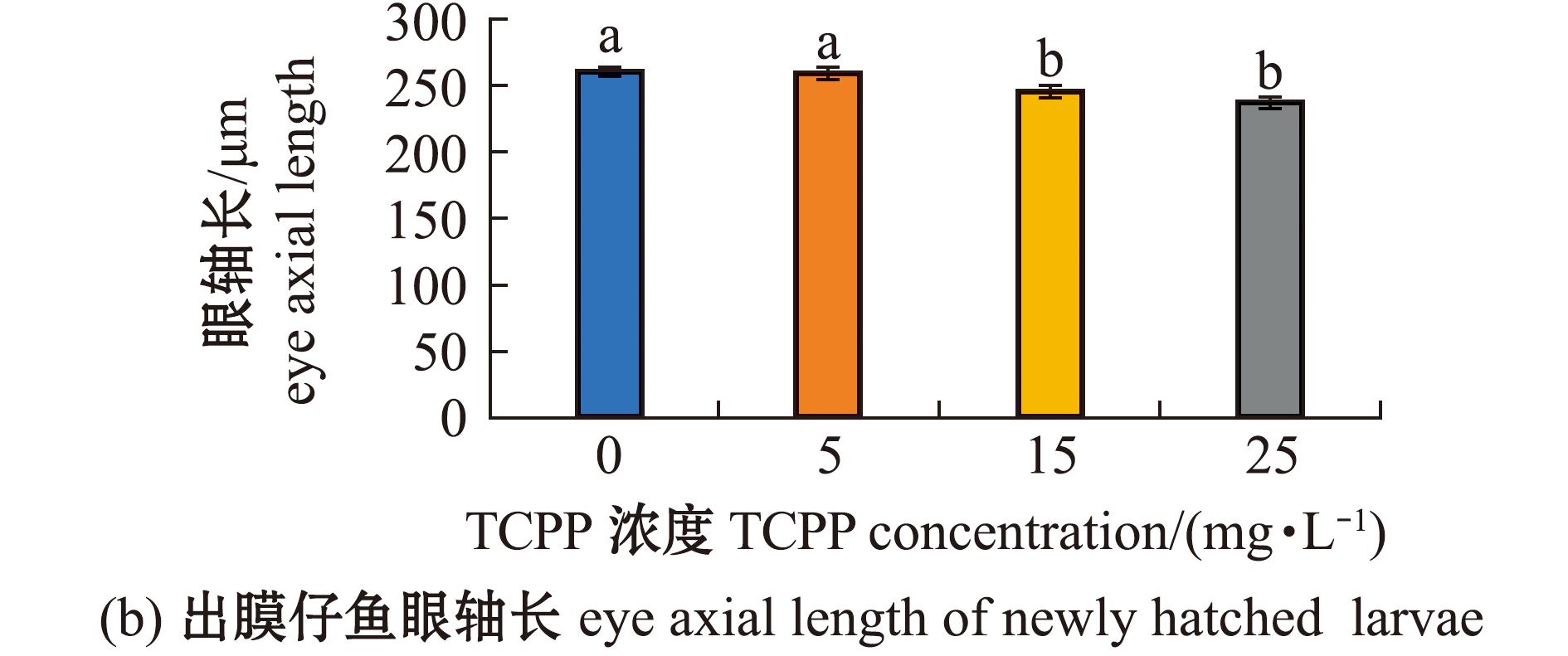
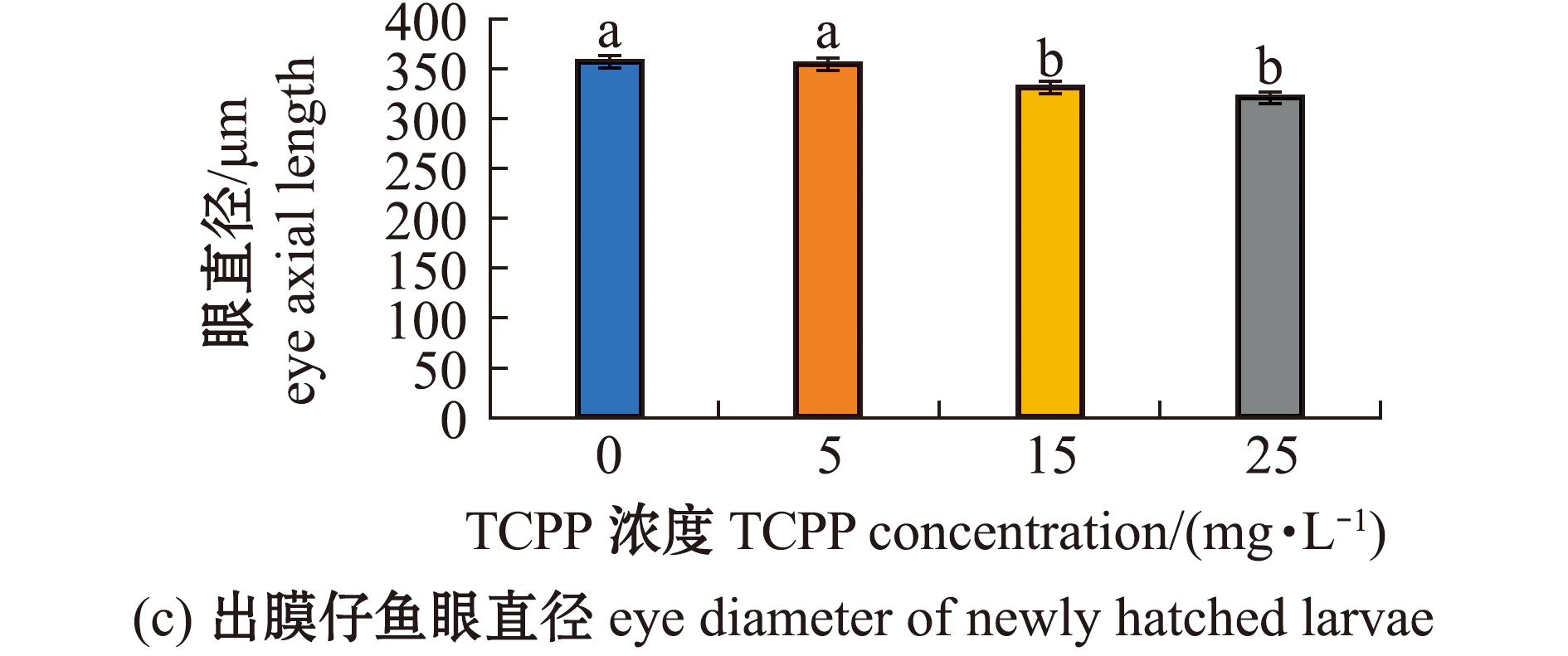
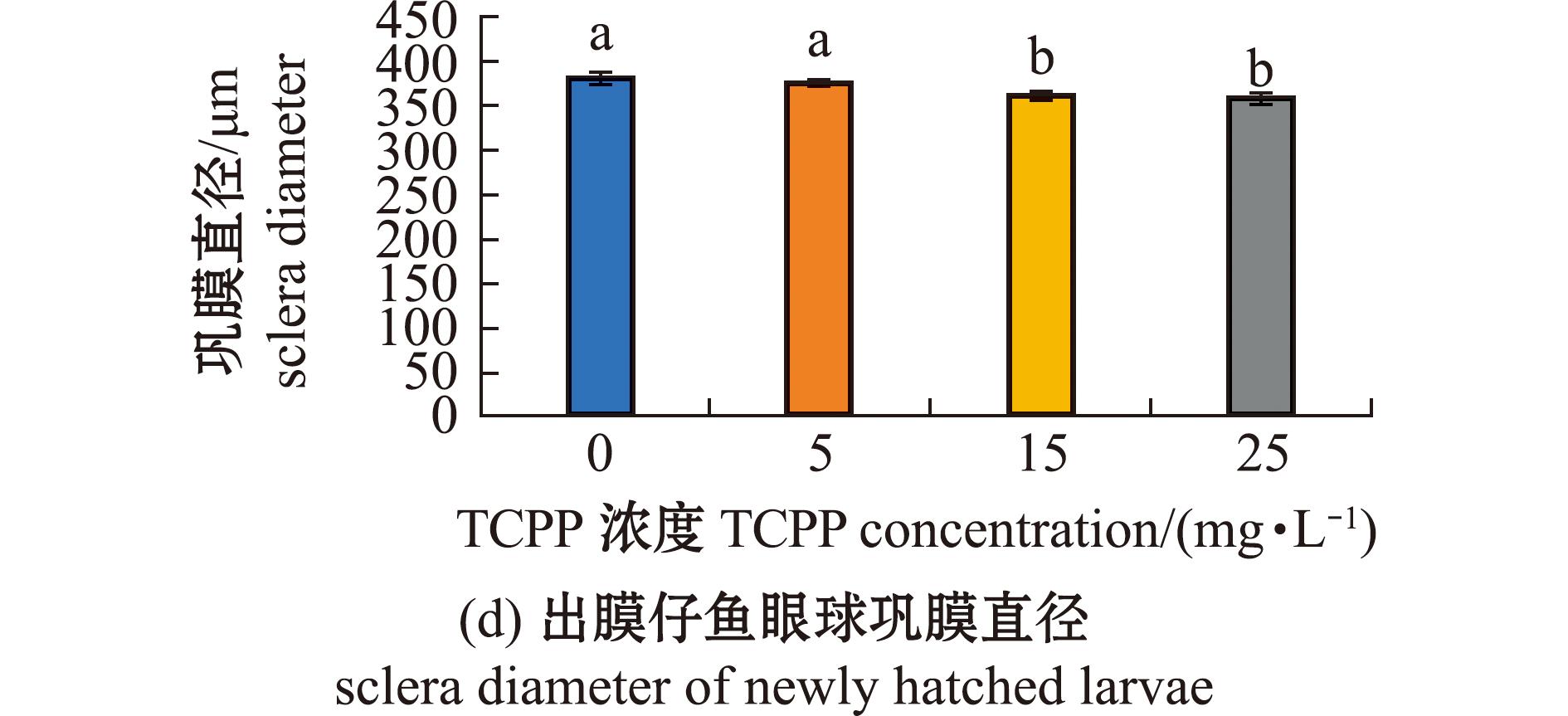
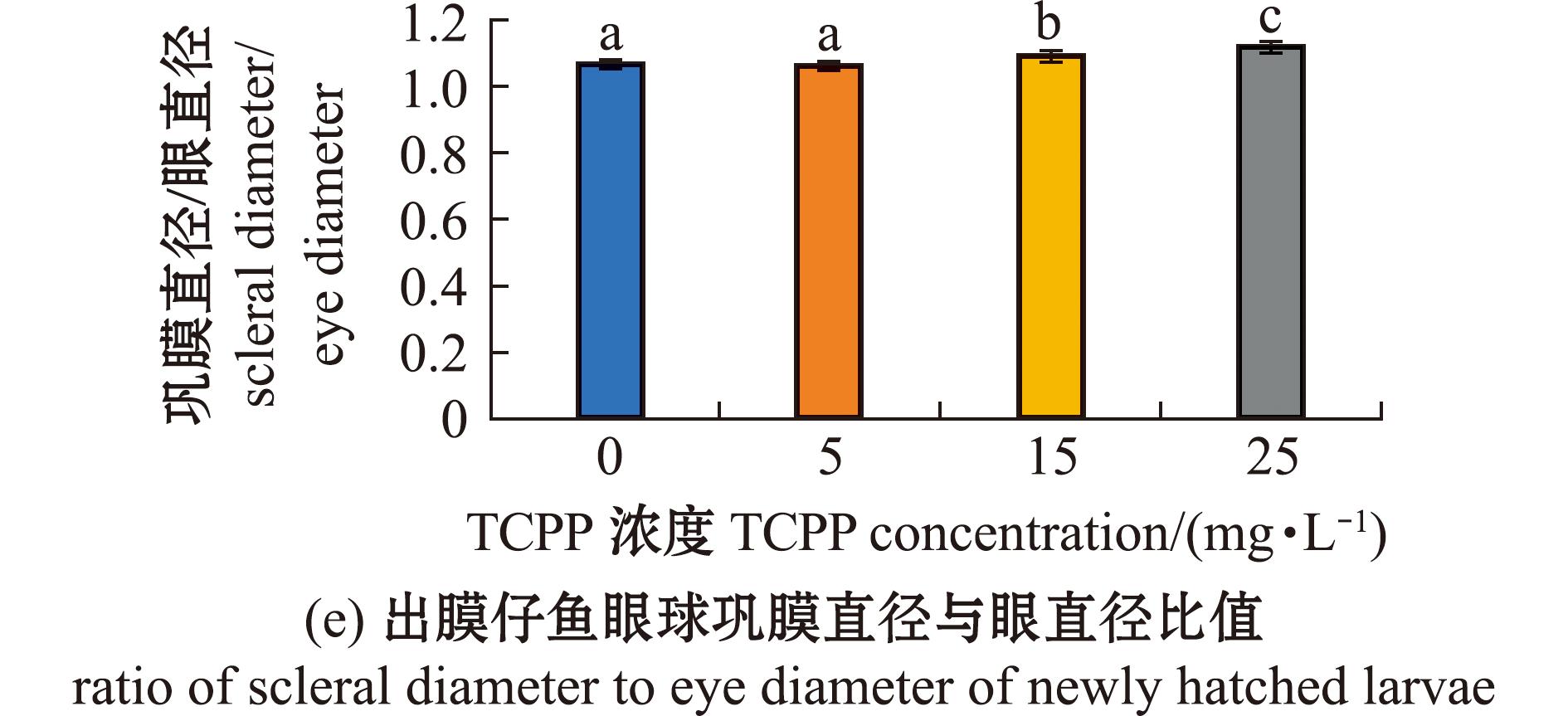
图5 TCPP暴露对海水青鳉出膜仔鱼眼球的影响
Fig.5 Impact of TCPP exposure on the eye of newly hatched Oryzias melastigma larvae
2.6 TCPP暴露对海水青鳉21 d仔鱼体长和胸鳍长度的影响
测定21 d仔鱼体长和胸鳍长度,结果如图6所示。5、15 mg/L暴露组的体长(图6(a))和胸鳍长度(图6(b))均无显著性变化(P>0.05),25 mg/L暴露组的体长(图6(a))和胸鳍长度(图6(b))均显著降低(P<0.05)。
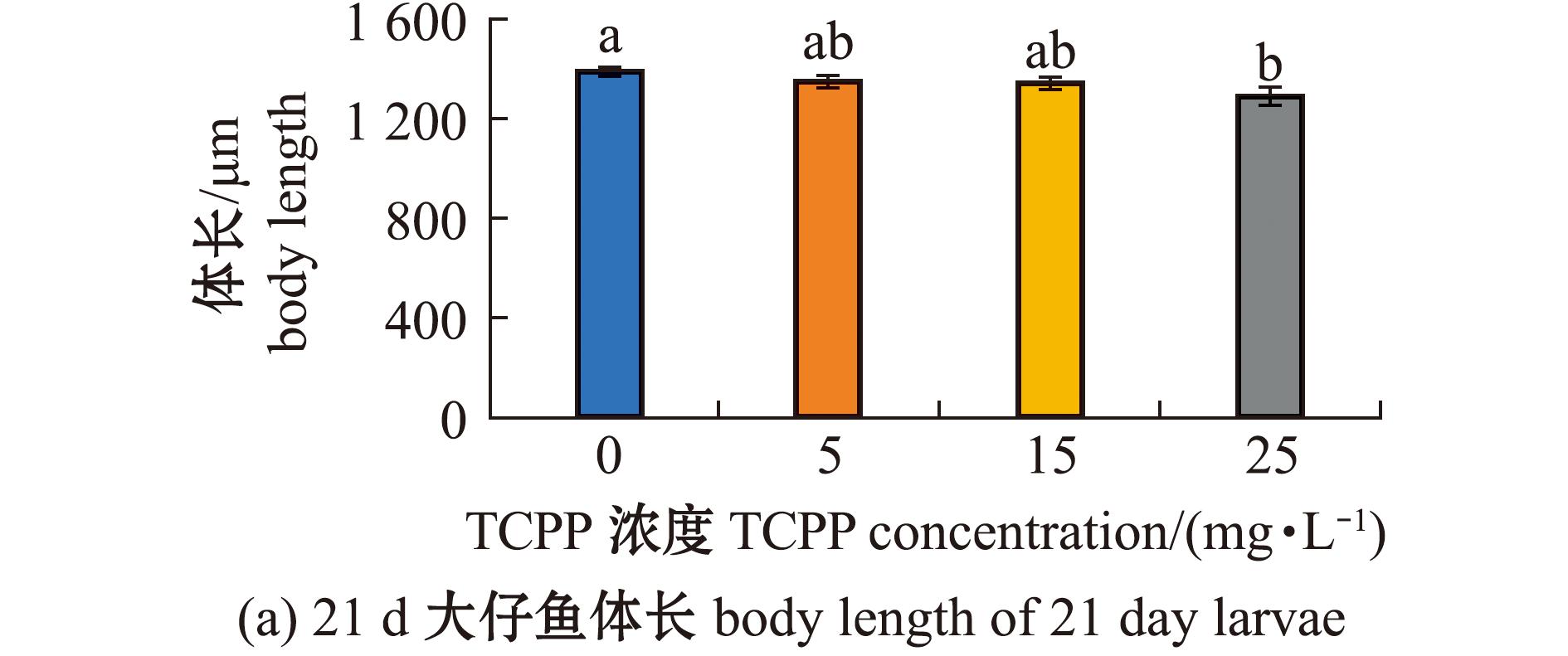
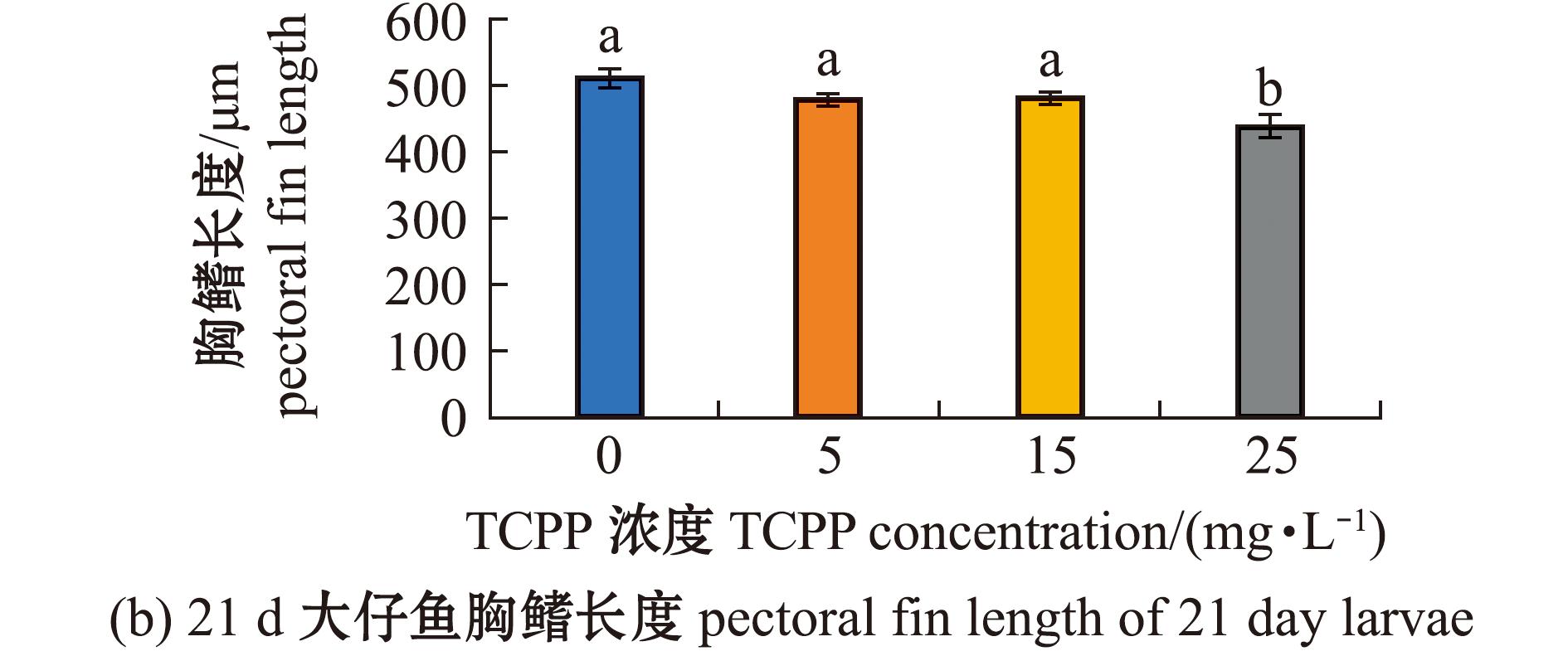
图6 TCPP暴露对海水青鳉21 d仔鱼体长和胸鳍长度的影响
Fig.6 Impact of TCPP exposure on the body length and the pectoral fin length of 21 day Oryzias melastigma larvae
3 讨论
近年来,TCPP已成为一种新型海洋污染物,对海洋生态系统健康造成潜在威胁[17]。本研究发现,TCPP暴露会抑制海水青鳉胚胎和仔鱼的生长发育,包括影响其心率、体长、胸鳍长、眼球大小等。本研究提示,海水中高浓度TCPP污染可能对海洋鱼类的生长发育造成不利影响。
3.1 TCPP暴露改变海水青鳉胚胎心率
研究表明,多种有毒化学物质(如持久性有机污染物、重金属、杀虫剂和杀菌剂)会影响鱼类胚胎发育[18-22]。心脏是鱼类最早发育和发挥功能的器官[23],而心率作为一个敏感的发育指标,已被用来代表胚胎时期的心脏功能,对胚胎存活起着至关重要的作用[22],同时异常的心率也是心血管或非心血管原因死亡的有力预测指标[24]。海水青鳉胚胎心功能受影响最大的生理参数是心率[25]。研究发现,TCPP暴露会显著抑制斑马鱼胚胎的心率[14]。本研究中,在第5、8、10天时,所有暴露组的胚胎心率均显著降低,表明TCPP暴露会对海水青鳉胚胎心率产生影响,并极有可能影响后续心脏发育,但具体的心脏毒性效应和机制还有待进一步研究。
3.2 TCPP暴露影响海水青鳉胚胎和仔鱼生长发育
鱼类生命早期对化学物质接触最为敏感。本研究结果表明,TCPP暴露对海水青鳉早期发育具有显著的毒性效应,包括胚胎存活率降低,畸形率增加,仔鱼体长、胸鳍长度降低。相关研究发现,TCPP暴露导致斑马鱼胚胎死亡率呈剂量依赖性显著增加,并出现胚胎卵黄囊水肿、头和眼畸形等发育缺陷[14],与本研究结果相似。体长和胸鳍长度测量是评估环境污染物对鱼类生态风险的重要参数,可作为衡量鱼类生长和发育的基本指标,能够反映仔鱼的整体生长状况,有助于了解污染物对鱼类发育的影响[1]。本研究结果显示,TCPP暴露会抑制仔鱼的体长。虽然TCPP暴露未改变刚出膜仔鱼的胸鳍长度,但随着暴露时间的延长,21 d仔鱼的胸鳍长度显著减少,说明TCPP暴露对仔鱼生长具有毒性作用,并提示随着暴露时间的延长可能会显现出更明显的发育抑制作用。高丹等[26]研究中也有类似发现,TCPP暴露与斑马鱼的体长呈负相关。本研究中推测,可能是污染物暴露导致的应激反应消耗了本应分配给胚胎发育的部分能量,导致仔鱼体长和胸鳍长度减少[16]。
3.3 TCPP暴露改变海水青鳉仔鱼眼球大小
在本研究中观察到许多海水青鳉胚胎出现眼睛畸形,因此进一步对出膜仔鱼眼球大小进行了测量,发现TCPP暴露会造成海水青鳉仔鱼眼睛变小,引起小眼畸形,主要表现为眼轴长、眼直径和巩膜直径均显著减少。相似研究表明,轮胎中的抗氧化剂会显著降低斑马鱼仔鱼的眼轴长、眼直径及巩膜直径,进而导致小眼畸形[27]。此外,本研究中还发现,TCPP暴露会导致仔鱼眼球巩膜直径与眼直径的比值增高[28]。已有研究证明,经过抗氧化剂暴露后的斑马鱼眼球巩膜直径与眼直径的比值显著升高,而这一比值的升高与人类高度近视的眼球表型相似[29]。上述结果表明,TCPP暴露不仅会对海水青鳉眼球发育带来不良影响,并可能与人类近视的发生有关。
4 结论
1)TCPP暴露降低了海水青鳉胚胎的存活率,增加了胚胎的畸形率,缩短了其平均孵化时间。
2)TCPP暴露会显著降低海水青鳉胚胎在第5、8、10天的心率。
3)TCPP暴露会缩短海水青鳉仔鱼的体长和胸鳍长度,并抑制其眼球发育。
上述结果表明,TCPP暴露会影响海水青鳉早期发育,具有发育毒性作用。
[1] 皮天星,蔡磊明,蒋金花,等.新型阻燃剂TCPP对斑马鱼的毒性研究[J].生态毒理学报,2016,11(2):247-256.
PI T X,CAI L M,JIANG J H,et al.Toxicity effects of a new flame retardant tris(2-chloroisopropyl) phosphate to zebrafish(Danio rerio)[J].Asian Journal of Ecotoxicology,2016,11(2):247-256.(in Chinese)
[2] BACALONI A,CUCCI F,GUARINO C,et al.Occurrence of organophosphorus flame retardant and plasticizers in three volcanic lakes of central Italy[J].Environmental Science &Technology,2008,42(6):1898-1903.
[3] FRIES E,PÜTTMANN W.Monitoring of the three organophosphate esters TBP,TCEP and TBEP in river water and ground water (Oder,Germany)[J].Journal of Environmental Monitoring,2003,5(2):346-352.
[4] MART NEZ-CARBALLO E,GONZ
NEZ-CARBALLO E,GONZ LEZ-BARREIRO C,SITKA A,et al.Determination of selected quaternary ammonium compounds by liquid chromatography with mass spectrometry.Part Ⅱ.Application to sediment and sludge samples in Austria[J].Environmental Pollution,2007,146(2):543-547.
LEZ-BARREIRO C,SITKA A,et al.Determination of selected quaternary ammonium compounds by liquid chromatography with mass spectrometry.Part Ⅱ.Application to sediment and sludge samples in Austria[J].Environmental Pollution,2007,146(2):543-547.
[5] MARKLUND A,ANDERSSON B,HAGLUND P.Screening of organophosphorus compounds and their distribution in various indoor environments[J].Chemosphere,2003,53(9):1137-1146.
[6] YAN J,FANG L,ZHAO Z J,et al.Adolescent exposure to tris(1,3-dichloro-2-propyl) phosphate (TCPP) induces reproductive toxicity in zebrafish through hypothalamic-pituitary-gonadal axis disruption[J].Science of the Total Environment,2024,953:176096.
[7] FARHAT A,CRUMP D,CHIU S,et al.In Ovo effects of two organophosphate flame retardants:TCPP and TDCPP:on pipping success,development,mRNA expression,and thyroid hormone levels in chicken embryos[J].Toxicological Sciences,2013,134(1):92-102.
[8] 夏敏.磷酸三氯丙酯暴露诱导斑马鱼神经毒性的胁迫机制[D].苏州:苏州科技大学,2021.
XIA M.Stress mechanism of trichloropropyl phosphate exposure-induced neurotoxicity in zebrafish[D].Suzhou:Suzhou University of Science and Technology,2021.(in Chinese)
[9] TAKAMIYA M,STEGMAIER J,KOBITSKI A Y,et al.Pax6 organizes the anterior eye segment by guiding two distinct neural crest waves[J].PLoS Genetics,2020,16(6):e1008774.
[10] MACPHAIL R C,BROOKS J,HUNTER D L,et al.Locomotion in larval zebrafish:Influence of time of day,lighting and ethanol[J].NeuroToxicology,2009,30(1):52-58.
[11] YAN J,ZHAO Z J,XIA M,et al.Induction of lipid metabolism dysfunction,oxidative stress and inflammation response by tris(1-chloro-2-propyl)phosphate in larval/adult zebrafish[J].Environment International,2022,160:107081.
[12] JI C L,LU Z,XU L L,et al.Global responses to tris(1-chloro-2-propyl)phosphate (TCPP) in rockfish Sebastes schlegeli using integrated proteomic and metabolomic approach[J].Science of the Total Environment,2020,724:138307.
[13] 张民,安哲,彭会.海水青鳉雌激素受体基因的克隆、组织表达特性及环境雌激素EE2对其表达的影响[J].大连海洋大学学报,2018,33(2):158-168.
ZHANG M,AN Z,PENG H.Molecular cloning,tissue distribution and 17α-ethynylestradio(EE2)exposure effect on m RNA expression of three estrogen receptor genes in marine medaka Oryzias melastigma[J].Journal of Dalian Ocean University,2018,33(2):158-168.(in Chinese)
[14] XIA M,WANG X D,XU J Q,et al.Tris (1-chloro-2-propyl) phosphate exposure to zebrafish causes neurodevelopmental toxicity and abnormal locomotor behavior[J].Science of the Total Environment,2021,758:143694.
[15] WANG C S,LEI W,JIANG C C,et al.Exposure to tris(1,3-dichloro-2-propyl) phosphate affects the embryonic cardiac development of Oryzias melastigma[J].Heliyon,2024,10(3):e25554.
[16] LIU K K,SONG J J,CHI W D,et al.Developmental toxicity in marine medaka (Oryzias melastigma) embryos and larvae exposed to nickel[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2021,248:109082.
[17] HUANG Q S,FANG C,CHEN Y J,et al.Embryonic exposure to low concentration of bisphenol A affects the development of Oryzias melastigma larvae[J].Environmental Science and Pollution Research International,2011,19(7):2506-2514.
[18] 顾杰,吴江,王宏烨,等.有机磷酸酯对斑马鱼的早期神经毒性作用研究[J].生态毒理学报,2019,14(5):152-158.
GU J,WU J,WANG H Y,et al.Neurotoxicity of organophosphate esters on the early life stages of zebrafish[J].Asian Journal of Ecotoxicology,2019,14(5):152-158.(in Chinese)
[19] LEE J S,MORITA Y,KAWAI Y K,et al.Developmental circulatory failure caused by metabolites of organophosphorus flame retardants in zebrafish,Danio rerio[J].Chemosphere,2020,246:125738.
[20] INCARDONA J P,COLLIER T K,SCHOLZ N L.Defects in cardiac function precede morphological abnormalities in fish embryos exposed to polycyclic aromatic hydrocarbons[J].Toxicology and Applied Pharmacology,2004,196(2):191-205.
[21] LIN C C,HUI M N Y,CHENG S H.Toxicity and cardiac effects of carbaryl in early developing zebrafish (Danio rerio) embryos[J].Toxicology and Applied Pharmacology,2007,222(2):159-168.
[22] SAMREEN,ZHANG X N,WANG J,et al.Environmental relevant herbicide prometryn induces developmental toxicity in the early life stages of marine medaka (Oryzias melastigma) and its potential mechanism[J].Aquatic Toxicology,2022,243:106079.
[23] WANG R F,ZHU L M,ZHANG J,et al.Developmental toxicity of copper in marine medaka (Oryzias melastigma) embryos and larvae[J].Chemosphere,2020,247:125923.
[24] ZHANG Z D,YAN Q.Comparative toxicity of different crude oils on the cardiac function of marine medaka (Oryzias melastigma) embryo[J].International Journal Bioautomation,2014,18(4):389.
[25] PALATINI P,JULIUS S.Heart rate and the cardiovascular risk[J].Journal of Hypertension,1997,15(1):3-17.
[26] 高丹,同帜,张圣虎,等.4种典型有机磷阻燃剂对斑马鱼胚胎毒性及风险评价[J].生态与农村环境学报,2017,33(9):836-844.
GAO D,TONG Z,ZHANG S H,et al.Toxicity of four typical organic phosphorus flame retardants to zebrafish embryo and risk assessment[J].Journal of Ecology and Rural Environment,2017,33(9):836-844.(in Chinese)
[27] ZHANG S Y,GAN X F,SHEN B G,et al.6PPD and its metabolite 6PPDQ induce different developmental toxicities and phenotypes in embryonic zebrafish[J].Journal of Hazardous Materials,2023,455:131601.
[28] SUMMERS RADA J A,SHELTON S,NORTON T T.The sclera and myopia[J].Experimental Eye Research,2006,82(2):185-200.
[29] LIN M Y,LIN I T,WU Y C,et al.Stepwise candidate drug screening for myopia control by using zebrafish,mouse,and Golden Syrian Hamster myopia models[J].EBio Medicine,2021,65:103263.