尼罗罗非鱼(Oreochromis niloticus)是属于丽鱼科(Cichlidae)的淡水鱼类[1],根据联合国粮食与农业组织(FAO)记录,罗非鱼已成为世界范围内养殖数量最多的经济鱼类品种。然而,链球菌感染已成为目前罗非鱼养殖行业不可忽视的问题[2],脑是无乳链球菌感染罗非鱼的重要靶器官,无乳链球菌(Streptococcus agalactiae,GBS)感染后通过血脑屏障(blood-brain barrier,BBB)引发脑膜炎破坏脑-神经系统[3]。血脑屏障是介于血液和脑组织间的动态界面,主要由内皮细胞、星形胶质细胞、周细胞和神经元等组成,周细胞与内皮细胞结合形成紧密连接,紧密连接是一种复杂的细胞系统,是血脑屏障的结构和基础[4],具有调节作用,对物质通过有选择性阻碍,超过98%的小分子和几乎100%的大分子,包括蛋白、多肽和基因药物,无法通过外周给药方式直接递送入脑[5]。
在多种脑源性疾病的治疗过程中,中草药均发挥了良好的疗效,其疗效的取得与中草药有效成分透过血脑屏障或改善血脑屏障的形态结构和功能有关,因而,研究中草药对血脑屏障通透性的干预作用也逐渐成为目前的热点之一。近年研究表明,一些脂溶性高的药物(如石菖蒲、冰片和麝香等)可以直接通过简单扩散透过脂质膜的血脑屏障[6],通过GC-MS研究,发现石菖蒲挥发油中的甲基异丁香酚、β-细辛醚、α-细辛醚等成分可透过血脑屏障进入脑组织[6];部分中草药的有效成分七叶皂苷钠[7]、白果内酯[8]、麝香酮[9]等可以通过调节紧密连接蛋白表达水平、位置分布,引起胞间连接松散,影响血脑屏障的通透性,从而治疗脑部疾病。
苏木(Caesalpinia sappan L.)作为中国传统的天然中草药,具有抗肿瘤、抗炎、免疫抑制、神经系统保护作用等药理活性。其富含的巴西苏木素(Brazilin)[10]具有广泛的生物活性,对金黄色葡萄球菌[11]、耐碳青霉烯类鲍曼不动杆菌[12]有良好的抑菌效果,但对链球菌的抑菌效果及血脑屏障的通透性影响尚未见报道。
本课题组前期已建立了罗非鱼内皮细胞系和星形胶质细胞系,且通过Trans-well构建了内皮细胞-星形胶质细胞共培养的罗非鱼血脑屏障模型,可以在24 h内形成紧密连接的结构,并表现出明显的屏障特性,可作为研究材料用于体外模拟巴西苏木素影响罗非鱼血脑屏障的研究。
本研究中选取了36种中草药,并从中筛选出对罗非鱼鱼源无乳链球菌抑菌效果良好的中草药,探究了其有效抑菌成分对尼罗罗非鱼体外血脑屏障模型通透性的影响及其对治疗尼罗罗非鱼细菌性脑膜炎的可用性,以期为探索治疗罗非鱼脑部疾病的药物提供重要依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 无乳链球菌ZQ0910株分离自广东肇庆罗非鱼产区的患病罗非鱼脑部,由广东省水产经济动物病原生物学及流行病学重点实验室鉴定并保存。
1.1.2 药剂与试剂 36种中草药原药均购自北京同仁堂佛山连锁药店有限责任公司,巴西苏木素标准品购自Solarbio公司。
试验所用CCK8试剂盒购自Biomiky生物科技有限公司,TransZol Up Plus RNA Kit试剂盒、逆转录试剂盒、实时荧光定量试剂盒均购自北京全式金生物技术有限公司,乙腈购自西格玛奥德里奇(上海)贸易有限公司。
1.2 方法
1.2.1 中草药水提物的制备[13] 取36味中草药分别称取30 g,用600 mL蒸馏水浸泡2 h,煮至沸腾后保持100 ℃继续煎煮1 h,过滤,收集药液,共煎煮两次,合并滤液,蒸发浓缩至30 mL,得到药液质量浓度为1 g/mL的中药水提物,使用离心机(赛默飞世尔科技公司)在10 000 r/min条件下离心15 min,取上清液用孔径0.22 μm的滤膜过滤除菌,于4 ℃条件下保存备用。
1.2.2 被测菌种活化及悬液的制备 在无菌环境下,按体积比1∶50将-20 ℃保存的菌种接种到BHI液体培养基,37 ℃下震荡培养6~8 h,调整菌液浓度为1×108 CFU/mL,用BHI液体培养基稀释100倍制成菌悬液备用[14]。
1.2.3 中草药抑菌活性的测定 采用琼脂扩散法,吸取100 μL上述制备的菌悬液均匀涂布于BHI固体培养基,取无菌滤纸(直径为6 mm),吸取中草药水提物,吹干后,贴于培养基表面,每种样品设置3组平行,以无菌滤纸(直径为6 mm)为空白对照,置于37 ℃恒温箱培养16~18 h后,用游标卡尺测量抑菌圈直径,筛选出抑菌效果良好的中草药用于后续试验[14]。
1.2.4 最低抑菌浓度(MIC)测定 采用二倍稀释法测定中草药的最小抑菌浓度,取200 μL中草药水提物(1 g/mL)装入1.8 mL BHI液体培养基的EP管中,然后采用二倍稀释法,依次得到含有浓度分别为0.1、0.05、0.025、0.012 5、0.006 25、0.003 123、0.001 56 g/mL的中草药液体培养基,分别将50 μL稀释后的菌悬液分别加至上述不同浓度的中草药溶液中,每个浓度设置3组平行,于37 ℃培养箱中培养24 h后进行观察,每个平行组中透明澄清的生长小孔对应的浓度即为最小抑菌浓度。
1.2.5 制备尼罗罗非鱼体外血脑屏障模型 提前1晚将基质胶置于冰上在4 ℃冰箱融化,使用预冷的枪头按1∶8比例用预冷的无血清L-15培养基稀释基质胶,取稀释好的基质胶50 μL添加到Trans-well聚酯纤维膜上,置于37 ℃下4 h,基质胶凝固后膜变白色。接种细胞前用完全培养基润洗一下铺有基质胶的聚酯纤维膜,Trans-well小室按1×104cells/mL的量接种星形胶质细胞,下池按1×104cells/mL的量接种内皮细胞,接种细胞后24 h换液[15]。
1.2.6 CCK8法确定TVEC[16]和TA02[16]细胞的安全给药浓度 根据CCK8试剂盒说明书进行试验,分别加入浓度为18.75、37.5、75、150 μmol/L的巴西苏木素药物。
1.2.7 细胞给药 将TVEC-01与TA-02细胞共培养模型随机分为10组置于细胞培养板,设置试验组为空白组,以及20、40、80 μmol/L巴西苏木素组。将共培养模型取出,弃去旧的培养基,用PBS清洗细胞两次,加入以不含血清的L15培养基为溶剂配置的给药工作液,每组设置3个复孔。4 h后将细胞培养板取出,弃去给药液,PBS清洗两次,每孔加入200 μL TRNzol试剂,用移液枪多次吹打直至细胞完全裂解,转移裂解后的液体至EP管中置于-80 ℃冰箱中保存。
1.2.8 紧密连接蛋白表达水平分析 以TransZol Up Plus RNA Kit操作说明书为依据提取RNA,根据TransGen Biotech相关说明书将组织的Total RNA反转录变成目的产物cDNA。
选取加药后的细胞cDNA作为模板,以β-actin-F/R作为内参,通过实时荧光定量PCR仪器(ABI7500,Bio-Rad,CA,USA)进行qPCR反应,检测3个紧密连接蛋白的表达水平变化。设置反应体系(95 ℃下预变性4 min,95 ℃下变性20 s,56 ℃下退火20 s,72 ℃下延伸20 s,共进行40个循环,95 ℃下终延伸15 s)。设定脑的表达量为1,采用 2-ΔΔCt法计算相对表达量[17]。
1.2.9 质谱条件 电喷雾离子源(ESI),正离子方式检测,扫描方式选择多反应检测(MRM)。流动相A:乙腈-B:0.2%甲酸,检测时间:15 min,梯度洗脱(0~3 min,A:35→10,B:65→90;6~6.5 min,A:10→35,B:90→65),流速200 μL/min,进样体积5 μL。
1.2.10 对照品溶液配制 标准储备液:使用电子天平(上海浦春计量仪有限公司)采用减量称重法准确称取巴西苏木素0.010 g,置于10 mL容量瓶中,并用60%乙腈溶液定容到10 mL(质量浓度1.0 mg/mL),用60%乙腈稀释100倍成质量浓度为10 μg/mL的标准储备液,4 ℃下冰箱储存备用。
标准工作液(现配现用):用60%乙腈溶液将巴西苏木素标准储备液稀释成浓度为500、250、125、62.5、31.25、15.63、7.81 ng/mL的标准工作液[18]。
考虑到巴西苏木素极易氧化的特性[14],另按此方法配制一份巴西苏木素置于室温下放置完全氧化后的标准储备液和标准工作液,以完全氧化后的巴西苏木素作为巴西苏木素透过血脑屏障后的检测对象。
1.2.11 样品的采集与前处理 取样:选择复制成功的BBB模型,分为4组,巴西苏木素浓度为900、450、225 ng/mL组和空白组,每组设置3个平行,于供给池加入相应药液,接收池为HBSS,与加药后的15、30、60、90、120、180、240 min于接收池取样200 μL,同时补入等体积空白HBSS。
供试品制备:吸取300 μL于1.5 mL离心管中,以8 000 r/min离心10 min,弃去上清,氮气吹干,再加入300 μL乙腈复溶,充分涡旋2 min,重复两次,过0.22 μL针头滤膜,进行LC-MS分析。
1.2.12 标准曲线绘制 结合巴西苏木素极易氧化的特质,以巴西苏木素的氧化产物氧化巴西苏木素为检测目标绘制标准曲线。分别配制含彻底氧化后的巴西苏木素浓度分别为500、250、125、62.5、31.25、15.63、7.81 ng/mL的60%乙腈溶液,用0.22 μL滤膜过滤,使用高分离快速液相色谱-三重串接四极杆质谱仪(安捷伦科技有限公司)进行LC-MS分析,记录峰面积,以不同浓度的氧化巴西苏木素溶液峰面积为纵坐标,配制的氧化巴西苏木素浓度为横坐标,得到氧化巴西苏木素标准曲线回归方程。
1.3 数据处理
试验数据采用平均数±标准差(mean±S.D.)表示,采用SPSS软件进行统计学分析,采用Prismchs软件绘制图表和趋势图。
2 结果与分析
2.1 36种中草药水提物对无乳链球菌的体外抑菌活性和最低抑菌浓度
从表1可见,黄柏、五倍子、十大功劳、黄连、苏木和紫苏等23味中草药对无乳链球菌有一定的抑菌作用,其中,黄柏、五倍子、十大功劳、黄连和苏木这5种中草药水提物对无乳链球菌的抑菌圈达到20 mm以上,有较强的体外抑菌活性,五倍子、黄连和苏木的MIC≤6.25 mg/mL,表明对无乳链球菌的抑菌、杀菌效果最显著。
表1 36种中草药水提物对无乳链球菌MIC和抑菌圈直径
Tab.1 MIC and Diameter of inhibition zone of aqueous extracts of 36 Chinese herbals to Streptococcus agalactiae
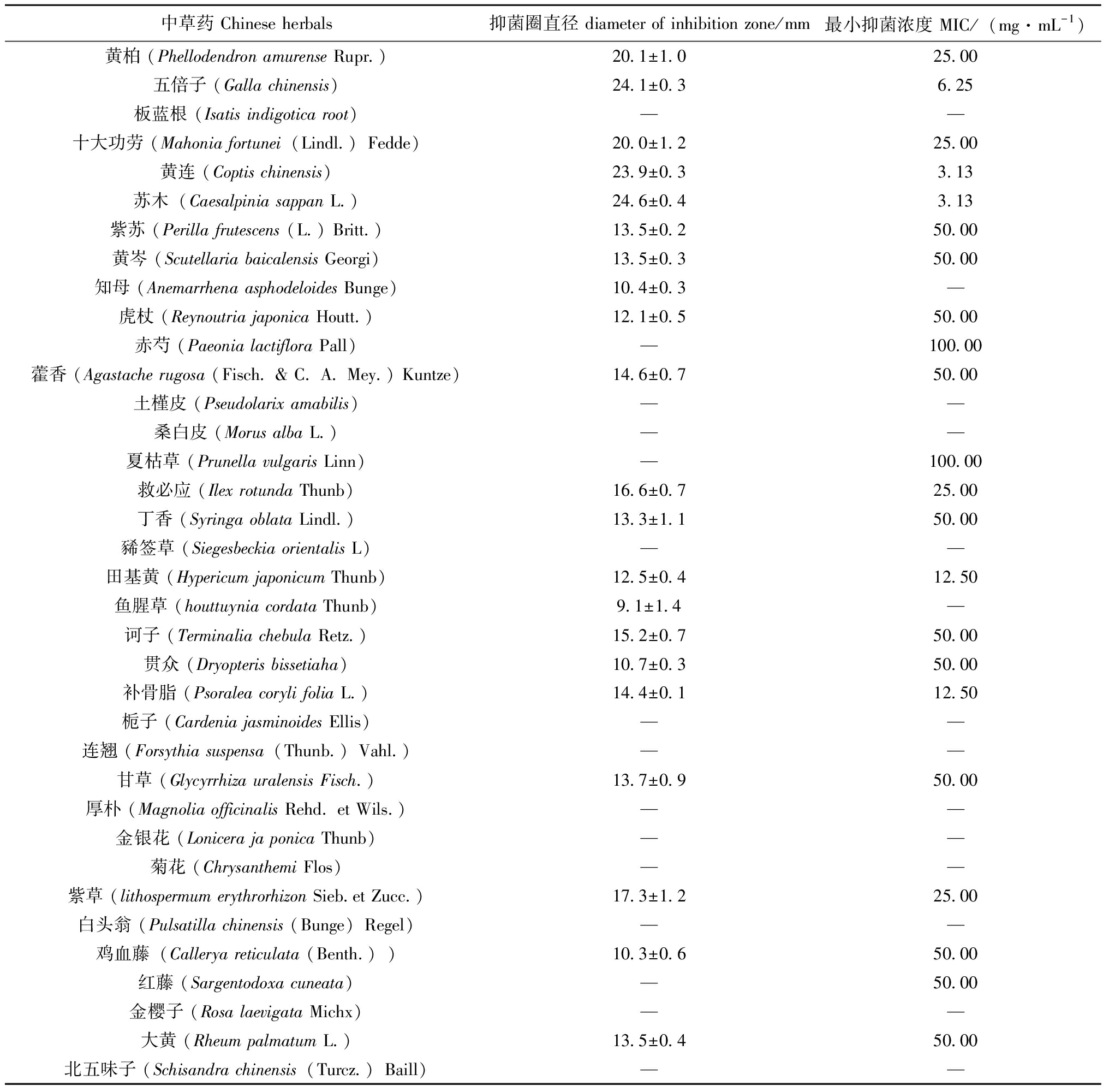
中草药 Chinese herbals抑菌圈直径 diameter of inhibition zone/mm最小抑菌浓度 MIC/(mg·mL-1)黄柏 (Phellodendron amurense Rupr.)20.1±1.025.00五倍子 (Galla chinensis)24.1±0.36.25板蓝根 (Isatis indigotica root)——十大功劳 (Mahonia fortunei(Lindl.)Fedde)20.0±1.225.00黄连 (Coptis chinensis)23.9±0.33.13苏木(Caesalpinia sappan L.)24.6±0.43.13紫苏 (Perilla frutescens (L.) Britt.)13.5±0.250.00黄岑 (Scutellaria baicalensis Georgi)13.5±0.350.00知母 (Anemarrhena asphodeloides Bunge)10.4±0.3—虎杖 (Reynoutria japonica Houtt.)12.1±0.550.00赤芍 (Paeonia lactiflora Pall)—100.00藿香 (Agastache rugosa (Fisch. & C. A. Mey.) Kuntze)14.6±0.750.00土槿皮 (Pseudolarix amabilis)——桑白皮 (Morus alba L.)——夏枯草 (Prunella vulgaris Linn)—100.00救必应 (Ilex rotunda Thunb)16.6±0.725.00丁香 (Syringa oblata Lindl.)13.3±1.150.00豨签草 (Siegesbeckia orientalis L)——田基黄 (Hypericum japonicum Thunb)12.5±0.412.50鱼腥草 (houttuynia cordata Thunb)9.1±1.4—诃子 (Terminalia chebula Retz.)15.2±0.750.00贯众 (Dryopteris bissetiaha)10.7±0.350.00补骨脂 (Psoralea coryli folia L.)14.4±0.112.50栀子 (Cardenia jasminoides Ellis)——连翘 (Forsythia suspensa(Thunb.)Vahl.)——甘草 (Glycyrrhiza uralensis Fisch.)13.7±0.950.00厚朴 (Magnolia officinalis Rehd. et Wils.)——金银花 (Lonicera ja ponica Thunb)——菊花 (Chrysanthemi Flos)——紫草 (lithospermum erythrorhizon Sieb.et Zucc.)17.3±1.225.00白头翁 (Pulsatilla chinensis (Bunge)Regel)——鸡血藤(Callerya reticulata (Benth.))10.3±0.650.00红藤 (Sargentodoxa cuneata)—50.00金樱子 (Rosa laevigata Michx)——大黄 (Rheum palmatum L.)13.5±0.450.00北五味子 (Schisandra chinensis(Turcz.)Baill)——
注:抑菌圈直径包括药敏纸片孔径6 mm;—表示无抑菌作用。
Note:The diameter of the inhibition zone includes the aperture of the drug-sensitive paper disc (6 mm);— indicates no bacteriostatic effect.
2.2 细胞安全给药浓度的确定
从图1可见,在0~150 μmol/L浓度范围内,巴西苏木素对共培养的TVEC-01、TA-02细胞生长无明显抑制作用,因此后续试验可在此浓度范围内进行。
2.3 巴西苏木素对紧密连接蛋白mRNA表达水平的影响变化
罗非鱼脑内皮细胞(TVEC-01)和罗非鱼星形胶质细胞(TA-02)共培养模型分别经过空白培养基、不同浓度的巴西苏木素处理后,细胞间紧密连接蛋白的mRNA表达变化如图2所示。从图2可见,与空白对照组相比,浓度分别为20、40、80 μmol/L的巴西苏木素均能显著降低JAM-B、ZO-1、Claudin-5(P<0.05)的mRNA表达水平。
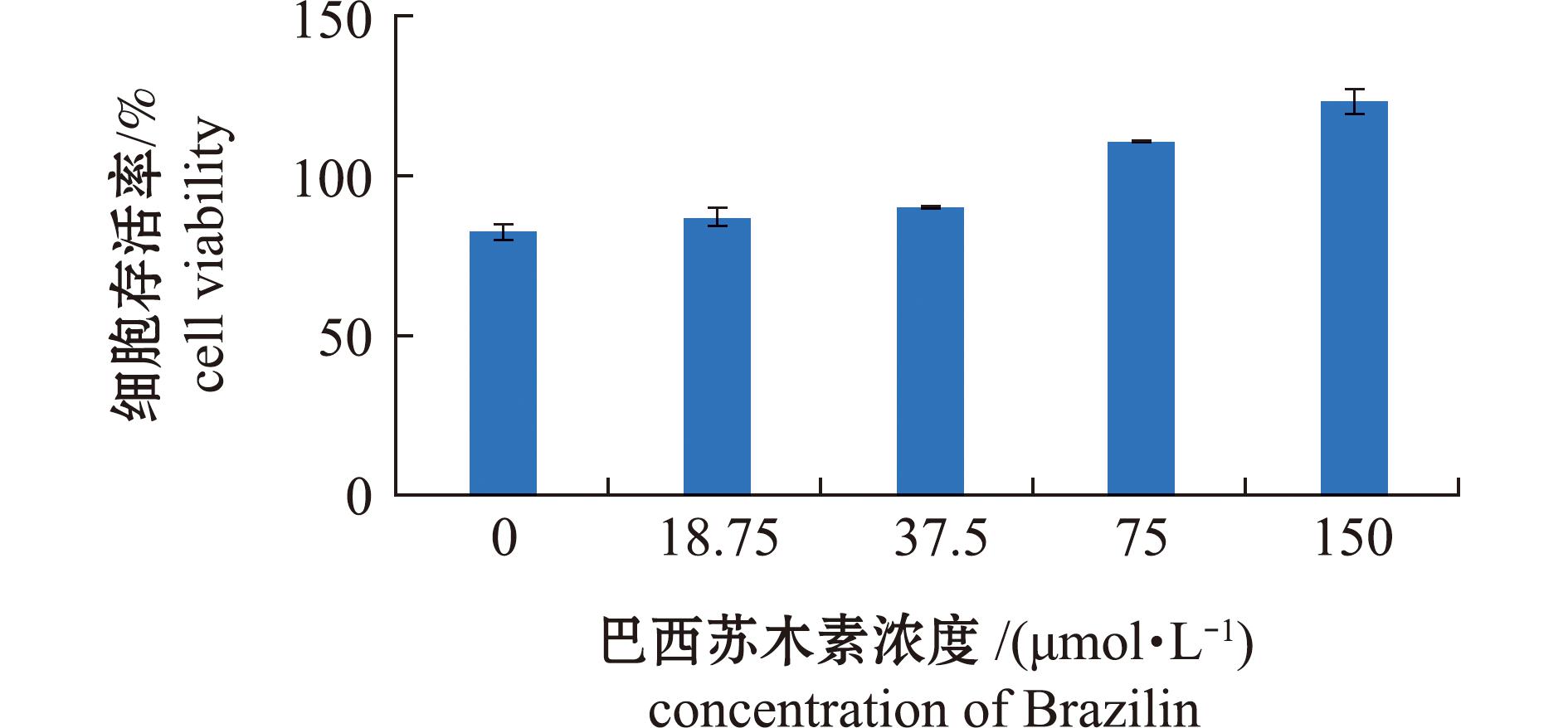
图1 不同浓度的巴西苏木素对血脑屏障体外模型的CCK8试验
Fig.1 CCK8 results of the blood-brain barrier in vitro model with different concentrations of Brazilin
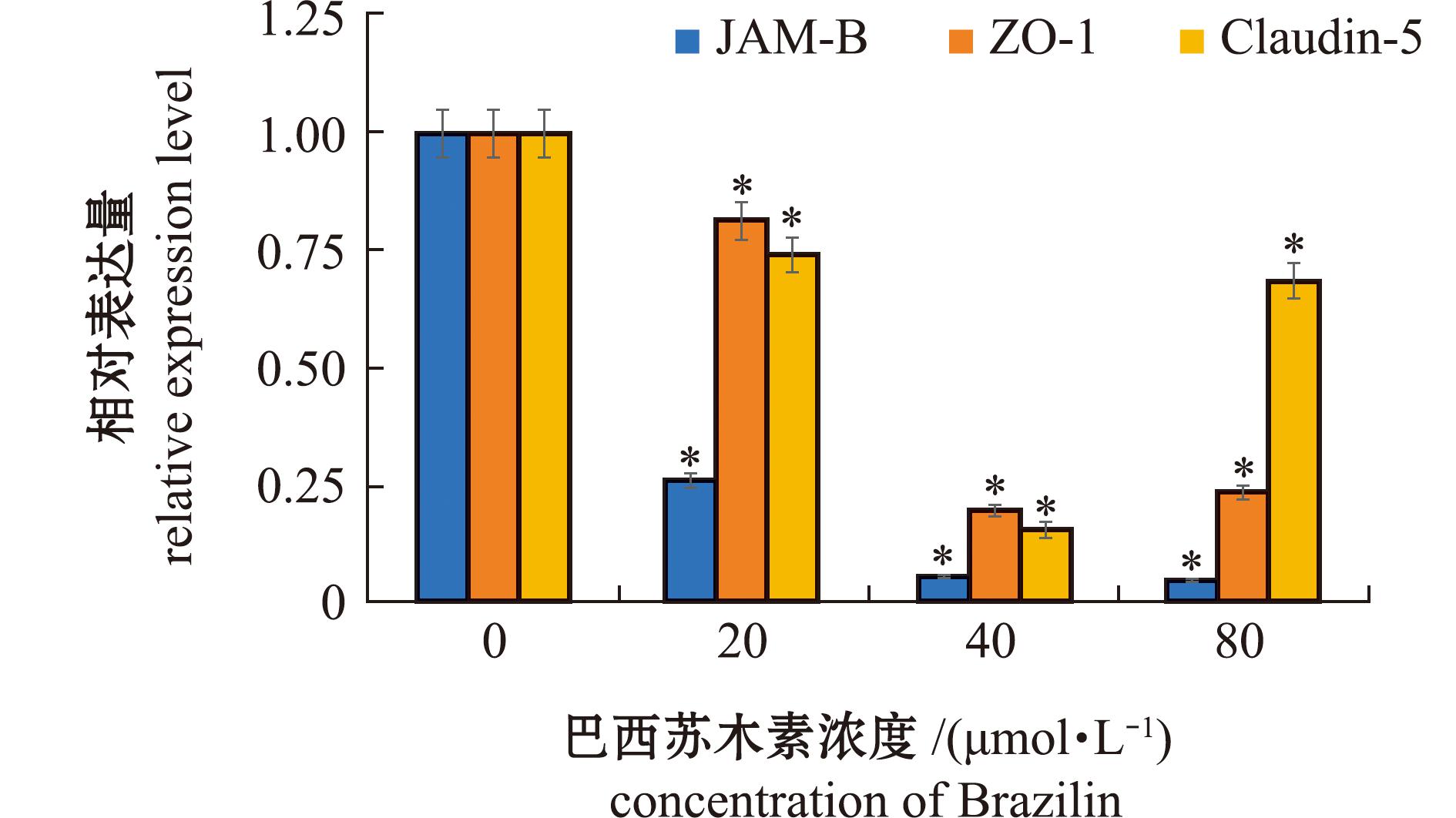
*表示与对照组有显著性差异(P<0.05)。
*means significant difference compared with the control (P<0.05).
图2 巴西苏木素对体外BBB模型中紧密连接蛋白mRNA表达水平的影响
Fig.2 Effects of Brazilin on the expression level of tight junction protein mRNA in a vitro BBB model
2.4 色谱条件优化
试验中以乙腈为流动相,加入0.2%甲酸可以提高目标物在正离子电喷物ESI中的离子化效率,使目标物得到较好的分离,并获得峰形尖锐、对称性好的色谱峰,增大离子峰的强度,在1 min内巴西苏木素和完全氧化后的巴西苏木素得到较好的分离(图3)。
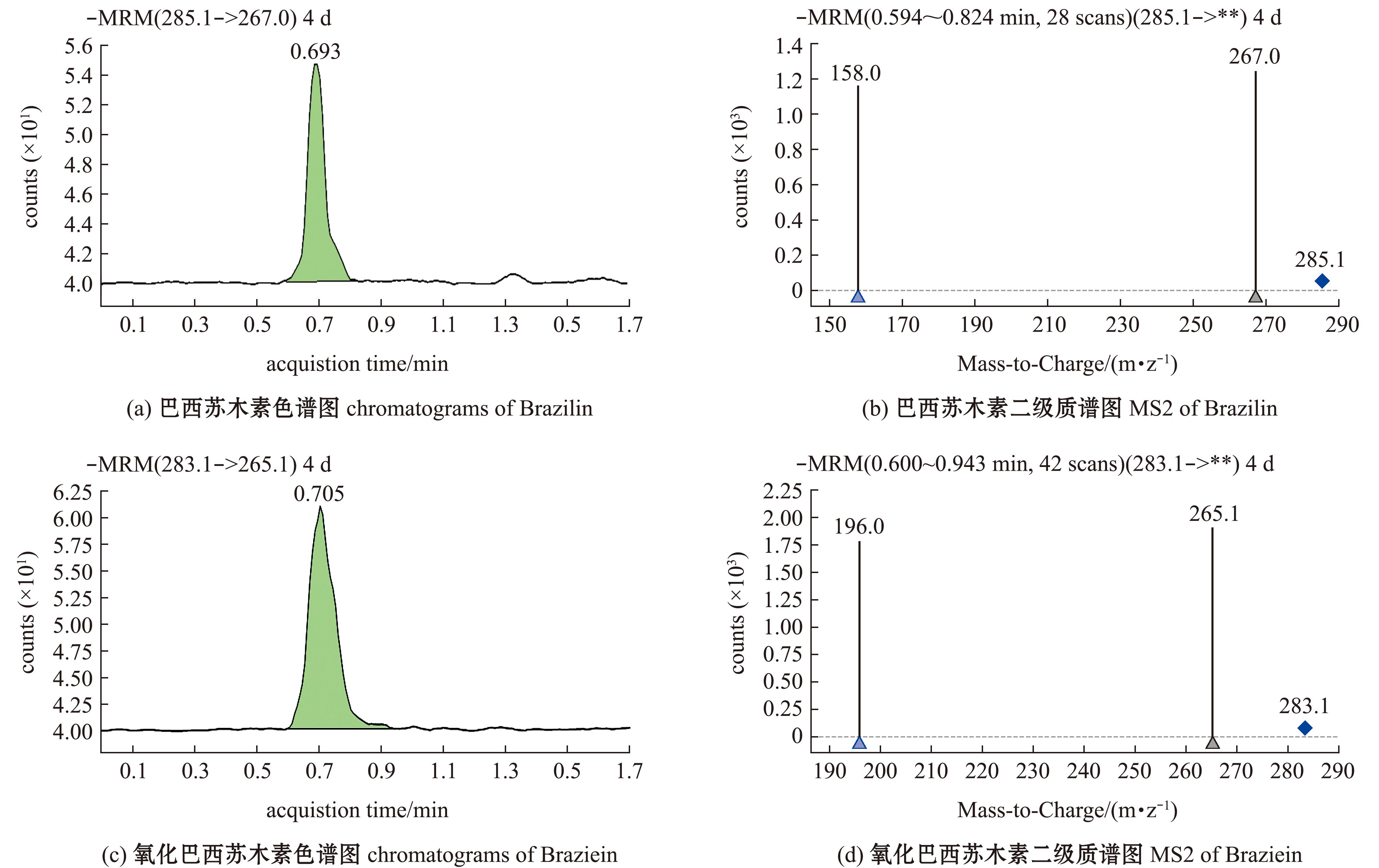
图3 两种药物标准液的色谱图和二级质谱图
Fig.3 Chromatograms and MS2 of two medications
将1 000 ng/mL的巴西苏木素和完全氧化后的巴西苏木素标准溶液分别在正离子模式下进行一级质谱全扫描,分别得到准分离分子。发现巴西苏木素标准液全扫描响应值最高峰值(m/z=285.1)与巴西苏木素分子量(巴西苏木素分子量扣一个负离子)286.3相似,故确定巴西苏木素的分子分离峰为285,然后以m/z为巴西苏木素的母离子,向其施加碰撞能形成子离子,进行二级质谱全扫描,选择丰度最强的子离子m/z=267.0作为其监测离子。完全氧化后的巴西苏木素标准液全扫描响应值最高峰值(m/z=283.1),以m/z=283.1作为母离子,向其施加碰撞能,进行二级质谱全扫描,主要产生m/z=196.0、265.1等子离子,根据文献[15],判断其为氧化巴西苏木素(Brazilein),选择丰度最强的子离子m/z=196.0作为其监测离子。
2.5 标准曲线和线性范围考察
从图4可见,以配制的7.81、15.63、31.25、62.5、125、250、500 ng/mL氧化巴西苏木素标准液峰面积为纵坐标y,浓度为横坐标x,得到氧化巴西苏木素标准曲线回归方程为y=1.495 385x+5.088 402,R2=0.999,表明氧化巴西苏木素浓度在7.81~500 ng/mL范围内线性关系良好。
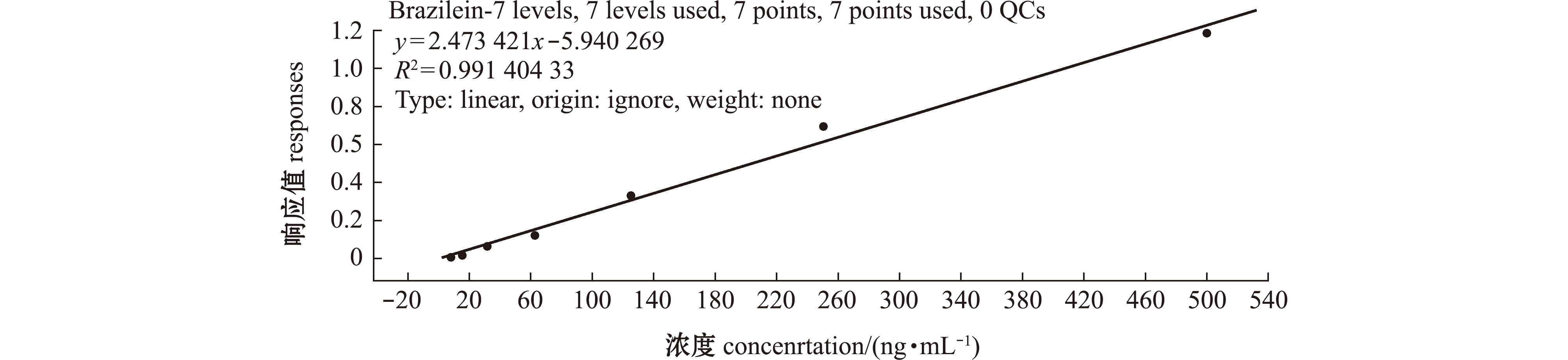
图4 氧化巴西苏木素标准曲线
Fig.4 Standard curve of Braziein
试验过程中,分别配制含氧化巴西苏木素浓度(ng/mL)为500、250、125、62.5、31.25、15.63、7.81的60%乙腈溶液,使用0.22 μL滤膜过滤,然后进行LC-MS分析,记录峰面积,以不同浓度的氧化巴西苏木素溶液峰面积为纵坐标,配制的氧化巴西苏木素浓度为横坐标,得到其标准曲线回归方程。
2.6 高效液相色谱串联质谱法分析巴西苏木素调节体外血脑屏障模型透过率
按“1.2.10节”条件进行测试,巴西苏木素调节体外血脑屏障模型透过率结果见表2~表4。
血脑屏障透过率=![]() ×100%。
×100%。
(1)
表2 125 ng/mL组巴西苏木素BBB透过率
Tab.2 BBB transmittance of hematoxylin in Brazilin
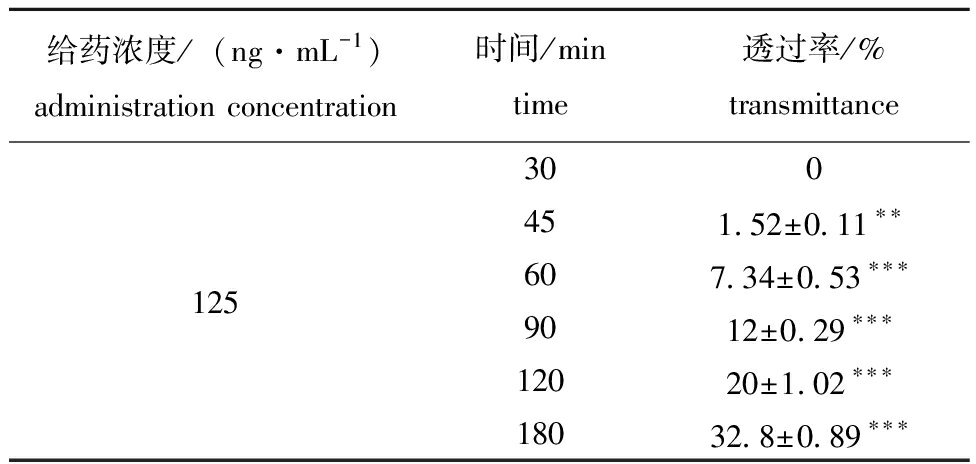
给药浓度/(ng·mL-1)administration concentration时间/mintime透过率/%transmittance300451.52±0.11∗∗125607.34±0.53∗∗∗9012±0.29∗∗∗12020±1.02∗∗∗18032.8±0.89∗∗∗
注:本日氧化巴西苏木素标准曲线y=1.495 385x+5.088 402,R2=0.999;*表示显著相关(P<0.05),**表示极显著相关(P<0.01),***表示极其显著相关(P<0.001),下同。
Note:The standard curve of oxidized brazilin for today y=1.495 385x+5.088 402,R2=0.999,* means significant correlations(P<0.05);**means very significant correlations(P<0.01),and***indicates an extremely significant correlation (P <0.001),et sequentia.
表3 250 ng/mL组巴西苏木素BBB透过率
Tab.3 BBB transmittance of hematoxylin in Brazilin
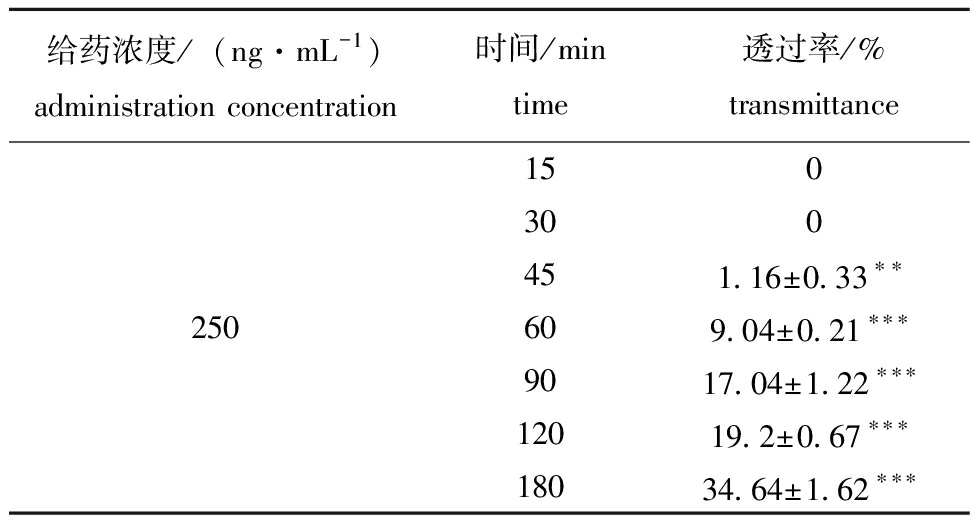
给药浓度/(ng·mL-1)administration concentration时间/mintime透过率/%transmittance150300451.16±0.33∗∗250609.04±0.21∗∗∗9017.04±1.22∗∗∗12019.2±0.67∗∗∗18034.64±1.62∗∗∗
表4 500 ng/mL组巴西苏木素BBB透过率
Tab.4 BBB transmittance of hematoxylin in Brazilin
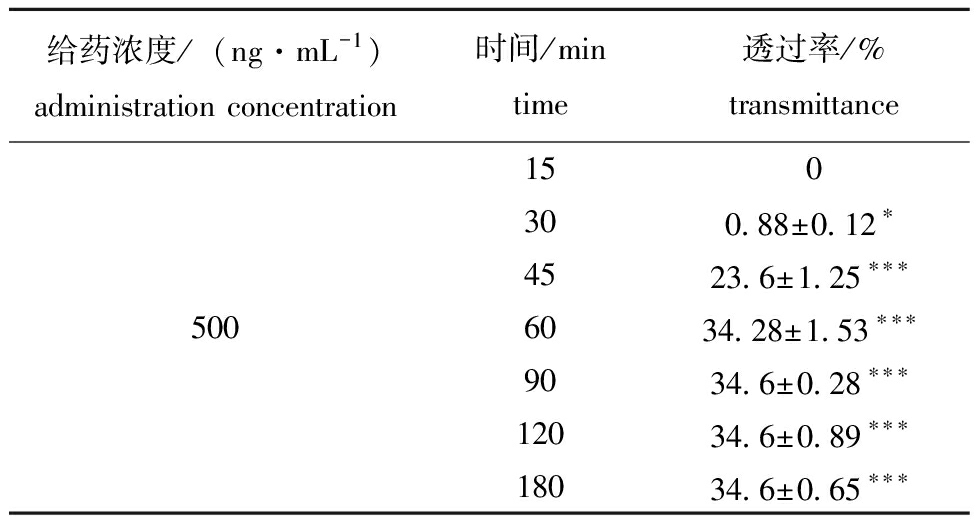
给药浓度/(ng·mL-1)administration concentration时间/mintime透过率/%transmittance150300.88±0.12∗4523.6±1.25∗∗∗5006034.28±1.53∗∗∗9034.6±0.28∗∗∗12034.6±0.89∗∗∗18034.6±0.65∗∗∗
在Trans-well小室种加入巴西苏木素的前30 min巴西苏木素的透过率较低,仅500 ng/mL组巴西苏木素有0.88%的透过率,加入巴西苏木素的第45 min,与空白组对比均有显著性差异(P<0.01),自加入巴西苏木素的60 min起,每一时间段的巴西苏木素透过率与空白组对比均有极显著性差异(P<0.001)。
3 讨论
3.1 中草药的抑菌作用及在水产养殖病害防控中的应用
尼罗罗非鱼是一种生长速度快、食谱广、环境适应力好及抗病力强的经济鱼类,但随着养殖环境的恶化,无乳链球菌感染已经成为目前罗非鱼养殖的一个主要问题[19],造成的经济损失逐渐增大[20],据统计,2019年仅给亚洲国家就造成高达5亿美元的经济损失,其引发的脑膜炎传染性强、死亡率高且治疗困难。
药理学研究表明,中草药在抑制鱼源病原微生物上具有独特的功效,在水产养殖业病害防控方面,中草药因毒性低、不良反应少、不易产生抗药性等特点,已成为替代抗生素类药物的首选[21]。本研究中选取了36种中草药,分别对其抗罗非鱼鱼源无乳链球菌的抗菌活性进行了筛选分析,结果发现,无乳链球菌对中草药苏木、五倍子、黄连的水提液极度敏感,其中,五倍子抑菌圈直径为(24.1±0.3)mm,MIC为6.25 mg/mL;黄连抑菌圈直径为(23.9±0.3)mm,MIC为3.13 mg/mL;苏木抑菌圈直径为(24.6±0.4)mm,MIC为3.13 mg/mL。部分中草药水提液的抑菌效果与文献报道存在偏差,可能与中草药的熬煮时间、根茎部位、药物放置时间及试验方法不同。柴胡、薄荷等药物具有一定的芳香挥发成分,这些药的煎煮时间适宜控制在20 min以内,以减少有效成分挥发,对于厚朴、鸡血藤等质地坚硬的药材要延长煎煮时间,避免出现药物有效成分析出不理想的情况[22];《中华人民共和国药典》记载了中药不同入药部位的功效,如甘草的根茎有清热解毒的作用,茎叶则有抗菌、抗病毒的功效;瞿政飞[23]研究发现,中药煎煮容器、煎煮方式、煎煮次数的不同均会对中药的药物疗效造成影响。
不同中草药对不同病原菌抑菌、杀菌效果和机制不尽相同[24]。五倍子的抗菌成分主要是鞣质,其抑菌作用主要通过抑制细菌代谢所需的酶类而产生;黄连属于广谱类抗菌中草药[25],主要成分小檗碱对细菌有抑制作用;苏木的主要抗菌成分为巴西苏木素[26],可通过抑制变性链球菌生物膜的形成而达到抑菌效果。本试验筛选出的具有良好抑菌作用的中草药有效成分和作用机制仍需进一步深入研究。
3.2 巴西苏木素对血脑屏障的通透性影响
血脑屏障这种结构特殊的生理性屏障通过选择性转运系统严格控制从血液到大脑的大小分子的转运,维持一个稳定的、功能最优的神经系统环境,但BBB的这种低通透性也是药物渗透进入中枢神经系统(CNS)的主要限制因素,因此,通过血脑屏障是药物在中枢神经系统中发挥作用的前提条件。紧密连接是血脑屏障的一个显著特性[27],紧密连接主要由跨越细胞间隙的蛋白质复合物(occludin和claudin)、连接黏附分子(junction adhesion molecules,JAMs)和闭合小环蛋白(zona occludins,Zos)组成,对血脑屏障的完整性至关重要[28]。研究发现,一些中草药能迅速通过血脑屏障或促进其他药物通透,张志刚等[29]研究证实,中草药冰片、石菖蒲能够抑制Claudin-5蛋白表达,使内皮细胞紧密连接的缝隙变宽,增加血脑屏障的通透性,刘运锋[30]研究证实了中草药白芍的活性成分芍药苷、芍药内酯苷等能透过血脑屏障。本研究中,在巴西苏木素的刺激下,JAM-B、ZO-1、Claudin-5的mRNA水平的表达均显著降低(P<0.05),可以推断巴西苏木素对血脑屏障模型的通透性造成了一定影响。
3.3 巴西苏木素对罗非鱼人工血脑屏障模型透过率测定
中草药对血脑屏障的通透性影响具有独特的双重性,一方面,中草药自身一些有效成分能透过血脑屏障,发挥其治疗作用;另一方面,在血脑屏障受到损伤时,中草药能降低其通透性,尽可能地维持、稳定及修复其损伤。罗玉敏等[31]研究发现,黄芪中的黄芪甲苷可以透过血脑屏障并降低血脑屏障的通透性,起到保护脑组织的作用;郭瑞友等[32]研究证实,海风藤提取物可以显著减轻并抵御局灶性脑缺血后血脑屏障的破坏;本研究进行的CCK8试验发现能迅速通过血脑屏障、促进其他药物通透,以及在血脑屏障受到破坏时降低血脑屏障的通透性,保护血脑屏障。本研究中发现,在0~150 μmol/L浓度范围内,巴西苏木素对共培养的TVEC-01、TA-02细胞生长有促进作用,但其对血脑屏障的保护作用还需进一步研究。
本研究预试验将苏木有效抑菌成分巴西苏木素加入尼罗罗非鱼人工血脑屏障模型上池,在给药的45 min后均于下池检测出氧化巴西苏木素对应质谱峰,后续试验建立了氧化巴西苏木素的LC-MS质谱条件,测出了巴西苏木素对体外血脑屏障模型的透过率,但巴西苏木素透过血脑屏障的具体机制还需进一步研究。
4 结论
1)中草药苏木对于无乳链球菌的抑菌效果较好,其中,MIC为3.3 mg/mL,抑菌圈直径为(24.6±0.4)mm。可以进一步通过菌体蛋白表达、生物被膜形成和毒力相关基因转录的测定探究苏木对无乳链球菌的抑菌机制,为无乳链球菌病的防控提供基础数据。
2)巴西苏木素可降低紧密连接蛋白JAM-B、ZO-1、Claudin-5的mRNA表达水平,说明巴西苏木素可以通过降低紧密连接蛋白JAM-B、ZO-1、Claudin-5的mRNA表达从而降低BBB通透性。本试验研究主要集中在巴西苏木素透过罗非鱼血脑屏障体外模型方面,后续可以进行动物体内药动学试验,测定血液、脑组织中苏木各种成分的含量,为开发治疗脑部疾病的药物提供理论依据。
3)本试验建立的LC-MS方法对透过罗非鱼血脑屏障体外模型的巴西苏木素进行定量测定,分别检测了125、250、500 ng/mL 3个浓度的巴西苏木素加入Transwell上室后在不同时间点对罗非鱼血脑屏障体外模型的透过率,结果表明,在加入巴西苏木素的第45 min起,Transwell小室的巴西苏木素与空白组对比均有显著性差异(P<0.01)。
[1] 陈惠萍,梁桉婕,吕冉晖,等.罗非鱼优势耐冰温假单胞菌的分离鉴定及耐冰温基因[J].广东海洋大学学报,2024,44(4):96-104.
CHEN H P,LIANG A J,LÜ R H,et al.Isolation and identification of dominant Pseudomonas spp.from Tilapia under super-chilled storage and ice-tolerant genes of Pseudomonas strains[J].Journal of Guangdong Ocean University,2024,44(4):96-104.(in Chinese)
[2] SPELLERBERG B,POHL B,HAASE G,et al.Identification of genetic determinants for the hemolytic activity of Streptococcus agalactiae by ISS1 transposition[J].Journal of Bacteriology,1999,181(10):3212-3219.
[3] 张祥.miR-155调控SOCS1/6参与尼罗罗非鱼细菌性脑膜炎炎症反应的机制研究及应用[D].湛江:广东海洋大学,2023.
ZHANG X.Study on the mechanism of miR-155 regulating SOCS1/6 in the inflammatory reaction of bacterial meningitis in Nile Tilapia and its application[D].Zhanjiang:Guangdong Ocean University,2023.(in Chinese)
[4] HASHIMOTO Y,CAMPBELL M.Tight junction modulation at the blood-brain barrier:current and future perspectives[J].Biochimica et Biophysica Acta Biomembranes,2020,1862(9):183298.
[5] 张琪.基于血和脑同步微透析研究冰片对神经保护作用的山奈酚透过血脑屏障的促进作用[D].合肥:安徽医科大学,2014.
ZHANG Q.Based on synchronous microdialysis of blood and brain,the protective effect of borneol on nerve was studied[D].Hefei:Anhui Medical University,2014.(in Chinese)
[6] 刘家欣,王丹,刘森,等.α-细辛醚和β-细辛醚在心脑血管病中的作用及机制研究进展[J].现代生物医学进展,2019,19(9):1797-1800.
LIU J X,WANG D,LIU S,et al.Research progress of the effects and mechanisms of alpha-asarone and beta-asarone in cardio-cerebrovascular diseases[J].Progress in Modern Biomedicine,2019,19(9):1797-1800.(in Chinese)
[7] 蔡维平,陈燕芬,汤李超,等.七叶皂苷钠对细菌性脑膜炎大鼠RhoA/ROCK通路及血脑屏障通透性的影响[J].中国微生态学杂志,2022,34(6):644-650.
CAI W P,CHEN Y F,TANG L C,et al.Effects of sodium aescinate on RhoA/ROCK pathway and blood brain barrier permeability in rats with bacterial meningitis[J].Chinese Journal of Microecology,2022,34(6):644-650.(in Chinese)
[8] 梁文意.白果内酯调节血脑屏障通透性的作用及其机制研究[D].广州:广东药科大学,2020.
LIANG W Y.Effect of bilobalide on regulating blood-brain barrier permeability and its mechanism[D].Guangzhou:Guangdong Pharmaceutical University,2020.(in Chinese)
[9] 高旅,吴丽萍,史正刚,等.中药调控血脑屏障通透性的作用研究进展[J].中国实验方剂学杂志,2019,25(20):200-207.
GAO L,WU L P,SHI Z G,et al.Research progress on effect of traditional Chinese medicine on blood-brain barrier permeability[J].Chinese Journal of Experimental Traditional Medical Formulae,2019,25(20):200-207.(in Chinese)
[10] 邓成杰,刘爽,徐晓云,等.苏木化学成分及药理作用的研究进展[J].中国现代中药,2020,22(5):810-826.
DENG C J,LIU S,XU X Y,et al.Research progress on chemical constituents and pharmacological effects of sappan lignum[J].Modern Chinese Medicine,2020,22(5):810-826.(in Chinese)
[11] 晏嘉,徐子善,陈旋,等.巴西苏木素对金黄色葡萄球菌生物膜形成的抑制作用及其机制[J].中华医院感染学杂志,2023,33(8):1121-1126.
YAN J,XU Z S,CHEN X,et al.Inhibitory effect and mechanism of Brazilian hematoxylin on formation of Staphylococcus aureus biofilm[J].Chinese Journal of Nosocomiology,2023,33(8):1121-1126.(in Chinese)
[12] 徐令清,杜良琴,袁润奇,等.苏木及其活性成分对耐碳青霉烯类鲍曼不动杆菌的体外抑制作用研究[J].重庆医学,2023,52(5):662-666,671.
XU L Q,DU L Q,YUAN R Q,et al.Inhibitory effect of hematoxylon and its active components on carbapenem-resistant Acinetobacter baumannii in vitro[J].Chongqing Medicine,2023,52(5):662-666,671.(in Chinese)
[13] YANG S W.Comparative study on the antibacterial activity of 32 kinds of Chinese herbal medicine[J].Journal of Anhui Agricultural Sciences,2011,39(3):1361-1362.
[14] 李焯新,蔡小辉,黄瑜,等.中草药与抗生素联用对罗非鱼源无乳链球菌的体外抑菌作用[J].广东海洋大学学报,2016,36(4):45-49.
LI Z X,CAI X H,HUANG Y,et al.Antibacterial effect in vitro on Streptococcus agalactiae isolated from Tilapia with combination of Chinese herbs and antibiotics[J].Journal of Guangdong Ocean University,2016,36(4):45-49.(in Chinese)
[15] CHEN Y H,LI Y,LUO J L,et al.A novel study of brain microvascular endothelial cells induced by astrocyte conditioned medium for constructing blood brain barrier model in vitro:a promising tool for meningitis of teleost[J].Fish &Shellfish Immunology,2024,146:109401.
[16] LI Y,HUANG Y,CAI J,et al.Establishment of an astrocyte-like cell line from the brain of Tilapia (Oreochromis niloticus) for virus pathogenesis and a vitro model of the blood-brain barrier[J].Journal of Fish Diseases,2022,45(10):1451-1462.
[17] 李一,吴雪莹,钟勇,等.尼罗罗非鱼钙结合蛋白S100P基因的克隆及功能分析[J].大连海洋大学学报,2024,39(4):613-621.
LI Y,WU X Y,ZHONG Y,et al.Cloning and functional gene analysis of calcium-binding protein S100P in Nile Tilapia (Oreochromis niloticus)[J].Journal of Dalian Ocean University,2024,39(4):613-621.(in Chinese)
[18] 汤菊芬,蔡佳,廖建萌,等.HPLC-MS/MS法同时测定水产品中的诺氟沙星、盐酸小檗碱、盐酸氯苯胍残留[J].中国兽药杂志,2014,48(8):55-60.
TANG J F,CAI J,LIAO J M,et al.Determination of norfloxacin,berberine hydrochloride and robenidine hydrochloride residues in aquatic products by high performance liquid chromatography-mass spectrometry(HPLC-MS/MS)[J].Chinese Journal of Veterinary Drug,2014,48(8):55-60.(in Chinese)
[19] 陈杨慧,张素莹,黄永雄,等.尼罗罗非鱼claudin-5基因克隆及其在无乳链球菌胁迫下的表达分析[J].广东农业科学,2024,51(7):25-34.
CHEN Y H,ZHANG S Y,HUANG Y X,et al.Cloning of claudin-5 gene from Oreochromis niloticus and analysis of its expression under Streptococcus agalactiae[J].Guangdong Agricultural Sciences,2024,51(7):25-34.(in Chinese)
[20] 黎源.尼罗罗非鱼CD2/CD244与CD48协同信号分子功能研究[D].湛江:广东海洋大学,2022.
LI Y.Study on the function of CD2/CD244 and CD48 synergistic signal molecules in Nile Tilapia[D].Zhanjiang:Guangdong Ocean University,2022.(in Chinese)
[21] 徐晓津,李秀华,马一帆,等.49味中药及其复方与抗生素对溶藻弧菌的体外抑菌作用[J].广东海洋大学学报,2019,39(6):30-38.
XU X J,LI X H,MA Y F,et al.In vitro bacteriostasis of 49 kinds of Chinese herbs,antibiotics and their compound prescriptions against Vibrio alginolyticus[J].Journal of Guangdong Ocean University,2019,39(6):30-38.(in Chinese)
[22] 王妍.基于代谢组学的植物挥发物的分析方法研究与应用[D].杭州:浙江工业大学,2009.
WANG Y.Research and application of analytical methods of plant volatiles based on metabonomics[D].Hangzhou:Zhejiang University of Technology,2009.(in Chinese)
[23] 瞿政飞.中药煎煮方法对汤剂疗效的影响探究[J].科技视界, 2021, (16): 139-140.
ZHAI Z F. Exploration on the influence of decoction methods of traditional chinese medicine on the efficacy of decoctions[J].Science &Technology Vision,2021,(16):139-140.(in Chinese)
[24] YAN T Z.Antibacterial effect of twelve Chinese herbal medicine[J].Journal of Zhejiang Ocean University (Natural Science Edition),2012,31(2):147-152.
[25] 陈燕晴,韦英益,梁万文,等.三黄连散对罗非鱼无乳链球菌的体外抑菌效果观察[J].广西畜牧兽医,2019,35(5):205-208,220.
CHEN Y Q, WEI Y Y, LIANG W W, et al.Observation on the in vitro bacteriostatic effect of Sanhuanglian powder against streptococcus agalactiae in Tilapia[J].Guangxi Journal of Animal Husbandry &Veterinary Medicine,2019,35(5):205-208,220.(in Chinese)
[26] YANG X H,REN L S,ZHANG S W,et al.Antitumor effects of purified protosappanin B extracted from lignum sappan[J].Integrative Cancer Therapies,2016,15(1):87-95.
[27] GARC A-SALVADOR A,DOM
A-SALVADOR A,DOM NGUEZ-MONEDERO A,G
NGUEZ-MONEDERO A,G MEZ-FERN
MEZ-FERN NDEZ P,et al.Evaluation of the influence of astrocytes on in vitro blood-brain barrier models[J].Alternatives to Laboratory Animals,2020,48(4):184-200.
NDEZ P,et al.Evaluation of the influence of astrocytes on in vitro blood-brain barrier models[J].Alternatives to Laboratory Animals,2020,48(4):184-200.
[28] 钱天洋, 袁莉, 吴晓宏.中药透过血脑屏障方式研究进展[J].交通医学, 2022, 36(03): 236-239.
QIAN T Y, YUAN L, WU X H.Research progress on the ways of traditional Chinese medicine passing through the blood-brain barrier[J].Medical Journal of Communications,2022, 36(3):236-239.(in Chinese)
[29] 张志刚,范小璇,连露露,等.芳香开窍药对血脑屏障通透性调控作用的研究进展[J].环球中医药,2022,15(8):1510-1516.
ZHANG Z G,FAN X X,LIAN L L,et al.The research progress about the effect of Aromatic on the regulation of blood brain barrier permeability[J].Global Traditional Chinese Medicine,2022,15(8):1510-1516.(in Chinese)
[30] 刘运锋.白芍活性成分调控P-gp介导生物碱类成分跨血脑屏障转运机制研究[D].南昌:江西中医药大学,2021.
LIU Y F.Mechanism of active components of Paeonia lactiflora regulating P-gp-mediated transport of alkaloids across blood-brain barrier[D].Nanchang:Jiangxi University of Traditional Chinese Medicine,2021.(in Chinese)
[31] 罗玉敏,秦震.黄芪甲苷对大鼠局灶脑缺血血脑屏障破坏的影响[J].中国临床神经科学,2000,8(4):280-281.
LUO Y M,QIN Z.Effect of astragaloside Ⅳ on blood-brain barrier damage in rats with focal cerebral ischemia[J].Chinese Journal of Clinical Neurosciences,2000,8(4):280-281.(in Chinese)
[32] 郭瑞友,张苏明,方思羽,等.海风藤提取物对老龄大鼠缺血性脑损伤保护作用研究[J].华中医学杂志,2000,(4):177-178,182,F003.
GUO R Y,ZHANG S M,FANG S Y.Study on the protective effect of Piper kadsura Ohwi on the focal cerebral ischemia in aged rats[J].Central China Medical Journal,2000,(4):177-178,182,F003. (in Chinese)