罗氏沼虾(Macrobrachium rosenbergii),隶属于节肢动物门软甲纲十足目长臂虾科沼虾属。因其个体大、肉质鲜嫩、营养价值丰富,广受消费者喜爱[1],养殖区域主要集中于长三角和珠三角一带。近年来,随着养殖规模逐渐扩大,在高密度养殖及近亲繁殖的影响下,罗氏沼虾出现生长缓慢,个体小,抗病力差等问题,其产业发展受到一定影响[2]。本实验室对江苏、浙江和上海三个地区对生长正常和缓慢两种状态的罗氏沼虾进行了转录组水平和酶活性情况分析,发现ATP合酶活性均存在显著性差异,生长正常的虾体内的ATP合酶活性高于生长缓慢的虾,推测ATP合酶可能通过能量代谢途径对罗氏沼虾的生长产生影响。
氧化磷酸化(oxidative phosphorylation)对于需氧生物而言,是最主要的供能方式[3],ATP合酶是氧化磷酸化的末端终止酶,也是氧化磷酸化中直接生成ATP的关键一步。ATP合酶的功能研究表明,首先ATP合酶主要功能是参与能量代谢,为生物体生长发育提供能量,张博等[4]克隆棉铃虫ATP合酶d亚基开放阅读框(ORF),并在6龄幼虫中敲低其表达量,结果导致幼虫发育迟缓、体质量下降。Zhao等[5]发现,三疣梭子蟹的肝胰腺中ATP含量越高,三疣梭子蟹生长越快。然而,ATP合酶在罗氏沼虾中的生长作用还尚未明确。在免疫方面,成君军[6]在南美白对虾中发现,ATP合酶的β亚基与白斑病毒的免疫有关;霍利杰[7]发现,在日本囊对虾中的ATP合酶亚基E和G会促进白斑病毒的复制。ATP合酶结构的研究表明,ATP合酶是由F1亲水头部和F0疏水尾部组成的蛋白复合物,F1和F0由d、F6和OSCP组成的外周柄连接[8]。
寡霉素敏感相关蛋白(OSCP)亚基在20世纪70年代被首次发现,此后科学家对其结构、定位和功能展开了一系列深入研究。范海鸣等[9]研究表明,OSCP亚基位于ATP合酶的外周柄,其羧基端位于ATP合酶F1部分的表面,向下延伸10 nm左右到达F0部分[10],且OSCP亚基能将α和β亚基固定在特殊的复合物中,使β亚基能正常参与催化,说明OSCP亚基在维持ATP合酶结构完整性上具有重要作用,OSCP是ATP合酶能正常运转的重要蛋白。张凯亮[11]研究证实,通过增加线粒体内OSCP蛋白水平,能够有效提高线粒体的呼吸功能,提高ATP合酶的合成效率,说明OSCP亚基对ATP合成起到正调控的作用。目前,关于罗氏沼虾OSCP亚基的基因序列还不了解,OSCP亚基对罗氏沼虾ATP合酶的作用尚不清楚。
本研究中,通过克隆获得罗氏沼虾ATP合酶OSCP亚基基因cDNA全长,并利用siRNA成功抑制OSCP亚基基因在心脏中的表达,探究了在OSCP亚基基因表达下调后对罗氏沼虾ATP合酶各个亚基基因表达的影响,以期为后续研究罗氏沼虾ATP合酶活性及ATP合成对罗氏沼虾生长的影响提供科学参考。
1 材料与方法
1.1 材料
试验用小规格虾为(5.5±0.6)cm,300尾,性腺发育成熟的成虾规格为(20.30±3.54)cm,40尾,雌、雄各20尾,分别暂养一周后进行试验,暂养期间,水温为24 ℃±1 ℃,盐度为0.8,每天投喂3次明辉牌人工饲料,每隔两天换水2/3。小规格虾由上海申漕特种水产开发公司提供,成虾购自上海市浦东新区古棕路菜市场。
1.2 方法
1.2.1 组织选取 随机从40尾成虾中挑选性腺发育成熟的雄、雌虾各3尾,在冰上解剖取肌肉、肝胰腺、心脏、鳃、肠、脑、精巢、卵巢、眼睛和胃组织,置于RNAsafe稳定液(上海翊圣生物科技有限公司),待组织完全浸湿后置于-80 ℃冰箱中保存。
1.2.2 总RNA提取及cDNA合成 采用Trizol 法提取罗氏沼虾肌肉、肝胰腺、心脏、鳃、肠、脑、精巢、卵巢、眼睛和胃组织的总RNA,置于-80 ℃冰箱中保存。按照Fastking cDNA第一链合成试剂盒(去基因组)(天根生化科技(北京)有限公司)和SMARter RACE 5′/3′kit[宝日医生物技术(北京)有限公司]试剂盒说明书合成cDNA,置于-20 ℃冰箱中保存备用。
1.2.3 ATP合酶OSCP亚基基因全长克隆 根据罗氏沼虾转录组数据库中OSCP亚基预测序列,经NCBI对比在保守区域设计引物(1F、1R),根据获得的核心片段序列设计5′UTR和3′UTR特异性引物(表1),以合成的cDNA为模板,PCR扩增体系为Mix 10 μL(上海翊圣生物科技有限公司),ddH2O 7.6 μL,上、下游引物和cDNA模板各0.8 μL,共20 μL。PCR反应程序为94 ℃下预变性5 min,共进行1个循环,94 ℃下变性30 s,57 ℃下退火30 s,72 ℃下延伸30 s,第二至第四步共进行32个循环,72 ℃下终延伸10 min,共进行1个循环。以1%的TAE凝胶电泳PCR产物,在凝胶成像仪下切割目的条带,按照胶回收试剂盒[天根生化科技(北京)有限公司]回收目标条带,将回收产物在冰上与pMDTM-19-Vector[宝日医生物技术(北京)有限公司]连接,转化到大肠杆菌,挑取阳性单菌落培养菌液送生工生物工程(上海)公司测序。
表1 引物序列
Tab.1 Primer sequence

引物 primer序列 sequence (5′-3′)用途 application1FGGCTACCAGGCAACTGGTTC核心片段扩增1RTAGAGACGATCATTCCGCCA5R1GCAAGAGCACCGAAAAGGTT5′RACE5R2GAACTGATTCAACGGCCTGC3F1TGCTCTTGCGGAGAATGGAC3′RACE3F2GCAGGCCGTTGAATCAGTTCUPM(short)CTAATACGACTCACTATAGGGC3′5′RACE通用引物UPM(long)CTAATACGACTCACTATAGGGCA-AGCAGTGGTATCAACGCAGAGTYZFAAGCAGTGGTATCAACGCAGA全长验证YZRACCGTAATTCGCTGGTTACATCOSCP-qpcrFAAGCAGGCCGTTGAATCAGTOSCP-qpcrRGCTTTCAGAGAGGCCTCCAAα-qpcrFCGTTGCCTACCGTCAGATGTα-qpcrRTGAGGGAACCACCACCATTGβ-qpcrFACCCGCGAAGGAAATGACTTβ-qpcrRTATTCGGCAACGGTCAGTCC荧光定量γ-qpcrFATCTGCCATATCTGCCGGTGγ-qpcrRGCTCCCTCTTTCATGGCGTAb-qpcrFAGTCCGTCTGGGTTTCGTTCb-qpcrRTGGGCCGAACTTCTTGACAGd-qpcrFAAGATCCCATACCCAGCCGAd-qpcrRCGATCATTGCTCGCCTTGAC18sFTGTTACGGGTGACGGA内参18sRAATTACGCAGACTCGGAAGA
1.2.4 ATP合酶OSCP亚基基因序列分析 NCBI-ORF Finder 预测开放阅读框,ExPASy ProtParam预测基因蛋白理化性质,TMHMM预测跨膜区,signalP 5.0分析信号肽,NCBI-Conserved Domain预测重要结构域,采用SWISS-MODEL构建蛋白三级结构,采用DNAMAN进行氨基酸多重序列对比,利用MEGA构建系统发育树。
1.2.5 OSCP亚基各组织的表达分析 对罗氏沼虾肌肉、肝胰腺、心脏、鳃、肠、脑、精巢、卵巢、眼睛和胃中的 OSCP亚基基因表达量进行测定,荧光定量反应体系20 μL:SYBR Green Master Mix 10 μL(上海翊圣生物科技有限公司),ddH2O 8.2 μL,上、下游引物各0.4 μL,cDNA模板1 μL。荧光定量反应程序:95 ℃下预变性2 min,共进行1个循环;95 ℃下变性30 s,57 ℃下延伸30 s,共进行40个循环,60 ℃下绘制溶解曲线。以18 s为内参基因,共进行3个重复。
1.2.6 有效siRNA筛选 由生工生物工程(上海)公司根据OSCP亚基碱基序列设计3条siRNA引物及1条无意义的NgsiRNA(NC)(表2),随机挑取体质健康、规格相近(5.5 cm±0.6 cm)的罗氏沼虾100尾,平均分到5个蓝箱子(51 cm×38 cm×29 cm)内,每个箱子放置20尾虾,试验共分5组,分别注射OSCP1、OSCP2、OSCP3的组设为3个试验组,分别注射NgsiRNA、 DEPC的组设为2个对照组。3个试验组均按照1 μg/g剂量注射,两个对照组分别注射与试验组同体积的 NgsiRNA、 DEPC,注射部位为围心腔,注射后每间隔24 h从各组随机选取3尾虾采集心脏组织,置于RNAsafe稳定液中,于-80 ℃冰箱中保存。
表2 siRNA序列
Tab.2 siRNA sequences

siRNA序列名称siRNA name序列(5′-3′)sequence(5′-3′)所处序列位置position in sequenceOSCP1S:CGACAAAGAUUUCAAAGAATT190 bpAS:UUCUUUGAAAUCUUUGUCGTTOSCP2S:CCUCCAAGAUCAAGAAGUATT615 bpAS:UACUUCUUGAUCUUGGAGGTTOSCP3S:CGAAGUCAUUUGUGAAGUATT430 bpAS:UACUUCACAAAUGACUUCGTTNgsiRNAS:UUCUCCGAACGUGUCACGUTTAS:ACGUGACACGUUCGGAGAATT
注:S为正向序列,AS为反向序列。
Note:S is the forward sequence,and AS is the reverse sequence.
1.2.7 siRNA注射剂量筛选 随机挑取体质健康、规格相近(5.5 cm±0.6 cm) 的罗氏沼虾120尾,平均分到6个蓝箱子(51 cm×38 cm×29 cm)内,每个箱子放置20尾虾,每个箱子为1组,共6组,分别注射 0.8、1.2、2.0、3.0 μg/g 4个剂量组设为4个试验组,注射与试验组同体积的NC和DEPC的组设为2个对照组,注射部位为围心腔,注射后每间隔24 h从各组随机选取3尾采样,采取心脏组织置于RNAsafe稳定液中,待组织完全浸湿后置于-80 ℃冰箱中保存,用于荧光定量检测。
1.2.8 siRNA干扰后ATP合酶其他亚基基因表达量的测定 本实验室已克隆获得ATP合酶 α、β、γ、δ、b和d亚基cDNA序列,利用NCBI Primer-BLAST在线工具在其编码区设计引物(表1),测定以上亚基在siRNA干扰后的心脏组织中的相对表达量。
1.3 数据处理
采用 2-ΔΔCt 方法计算基因的相对表达量。采用SPSS 17.0软件对OSCP亚基基因组织表达量分析及siRNA干扰基因表达变化进行单因素方差分析(one-way ANOVA),显著性差异设为0.05,采用Graphpad Prism软件制图。
2 结果与分析
2.1 OSCP亚基克隆与序列分析
OSCP亚基分395、265、507 bp 3段克隆,利用DNAMAN在片段相同处进行拼接,对拼接得到的全长设计引物验证序列准确性(图1)。最终获得OSCP亚基cDNA全长922 bp,包括5′非编码区78 bp,3′非编码区214 bp,开放阅读框630 bp,共编码209个氨基酸,蛋白相对分子质量为22 380,分子式为 C1 007H1 673N261O295S7,在32~200 aa有特殊的保守区域为OSCP,无多肽性和跨膜结构域,等电点为9.46,表现为疏水性。使用SWISS-MODEL工具对OSCP亚基进行三级结构建模,结果如图2所示,同源模板与序列的一致性为49.26%,GMQE为0.67± 0.06,QMEAN为0.66,说明OSCP亚基蛋白与构建的模板可信度较高。
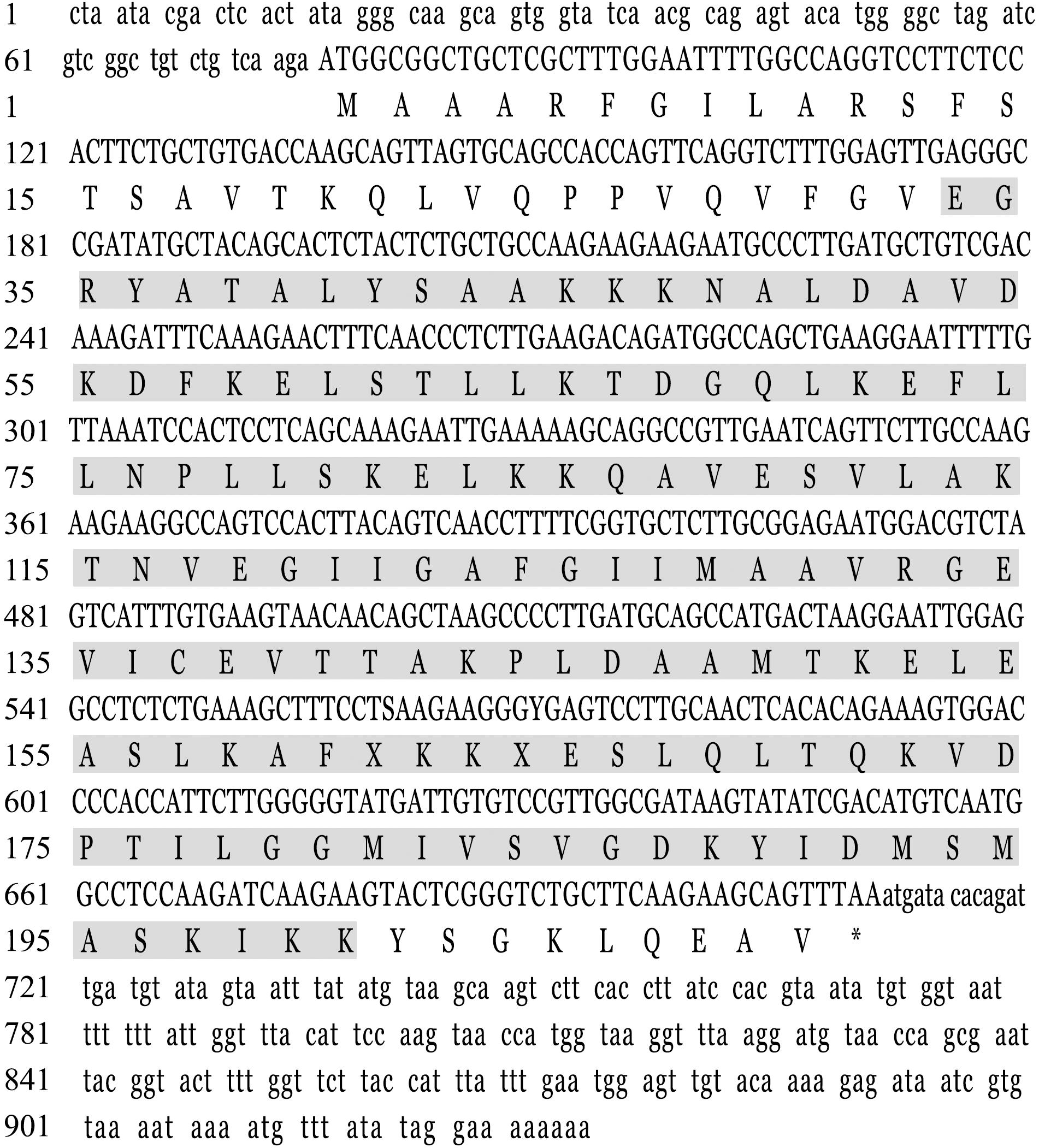
ATG—起始密码子;*表示终止密码子;阴影为OSCP结构域。
ATP—start codon;*means stop codon;shadowd means OSCP domain.
图1 罗氏沼虾ATP合酶OSCP亚基碱基序列及预测的氨基酸序列
Fig.1 Sequence of bases and predicted amino acid sequence of the ATP synthase OSCP subunit of Macrobrachium rosenbergii
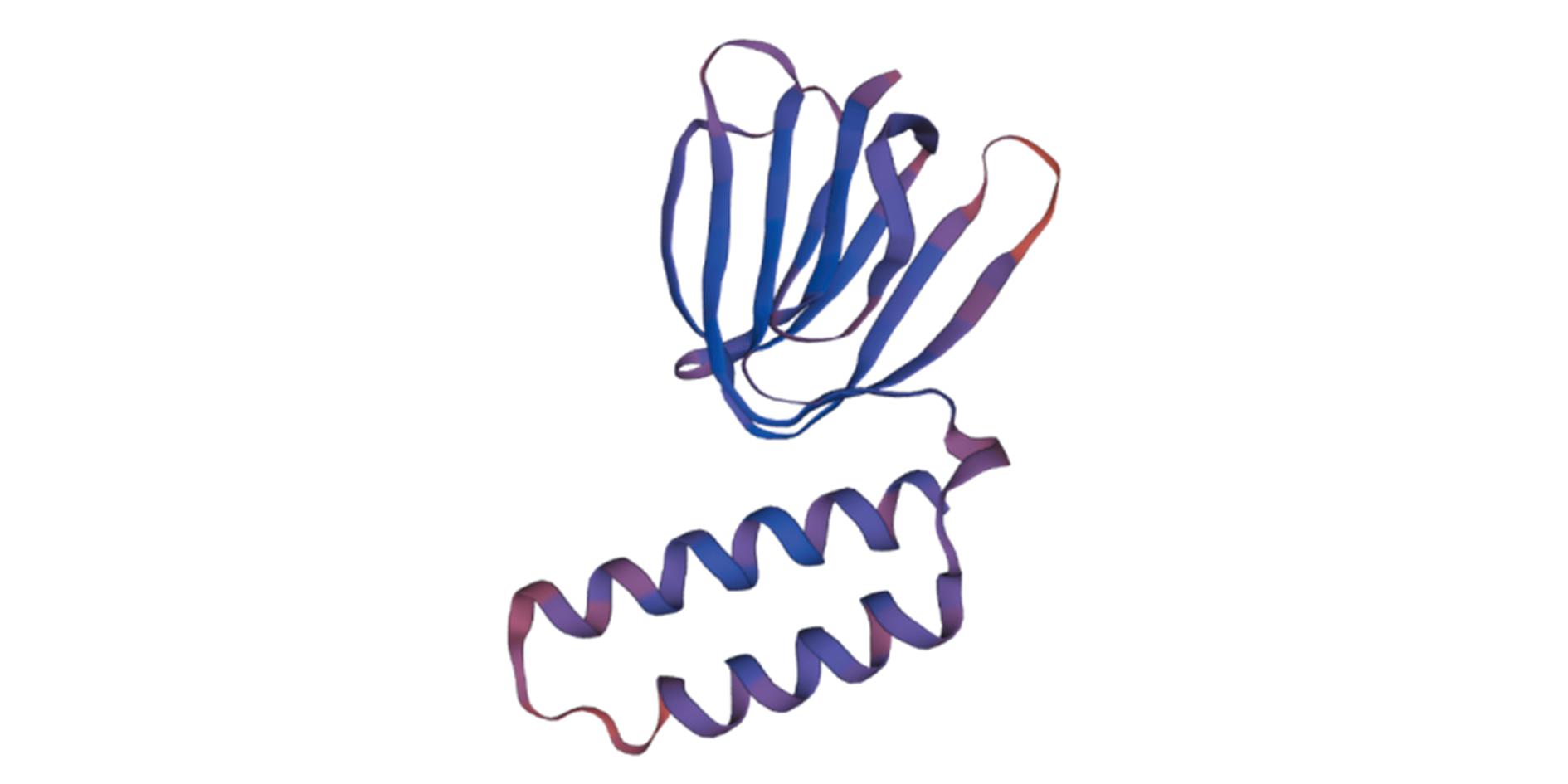
图2 罗氏沼虾ATP合酶OSCP蛋白三级结构
Fig.2 Tertiary structure of ATP synthase OSCP protein in Macrobrachium rosenbergii
2.2 OSCP亚基预测氨基酸同源性和系统发育树分析
从图3可见,罗氏沼虾OSCP亚基编码氨基酸与虾类同源性最高,其中,与美国龙虾(H.americanus)和斑节对虾(P.monodon XP_037775209.1)的一致性较高,分别为80.38%和80.25%,与凡纳滨对虾(L.vannamei ROT80184.1)的一致性次之,为78.47%。其他甲壳类一致性较低,与灰眼雪蟹(C.opilio KAG0711678.1)为63.43%,大型溞为52.38%。与哺乳类动物一致性最低,其中,与人(Human NP_001688.1)、大鼠(Rattus XP_032756302.1)、牛(B.taurus NP_776669.1)、果蝠(R.aegyptiacus KAF6473274.1)分别为47.66%、50%、42.7%、47.66%。

图3 罗氏沼虾与其他物种ATP合酶OSCP亚基氨基酸序列比对
Fig.3 Amino acid sequence comparison of Macrobrachium rosenbergii ATP synthase OSCP subiunt and other species
在一致性对比和进化关系分析方面,采用Mega对OSCP亚基氨基酸序列进行进化关系分析,采用NJ法(neighbor joining)构建系统发育树,结果如图4所示,罗氏沼虾OSCP亚基与美国龙虾、斑节对虾距离最近,与牛、果蝠距离最远,一致性分析与多重比较结果一致。
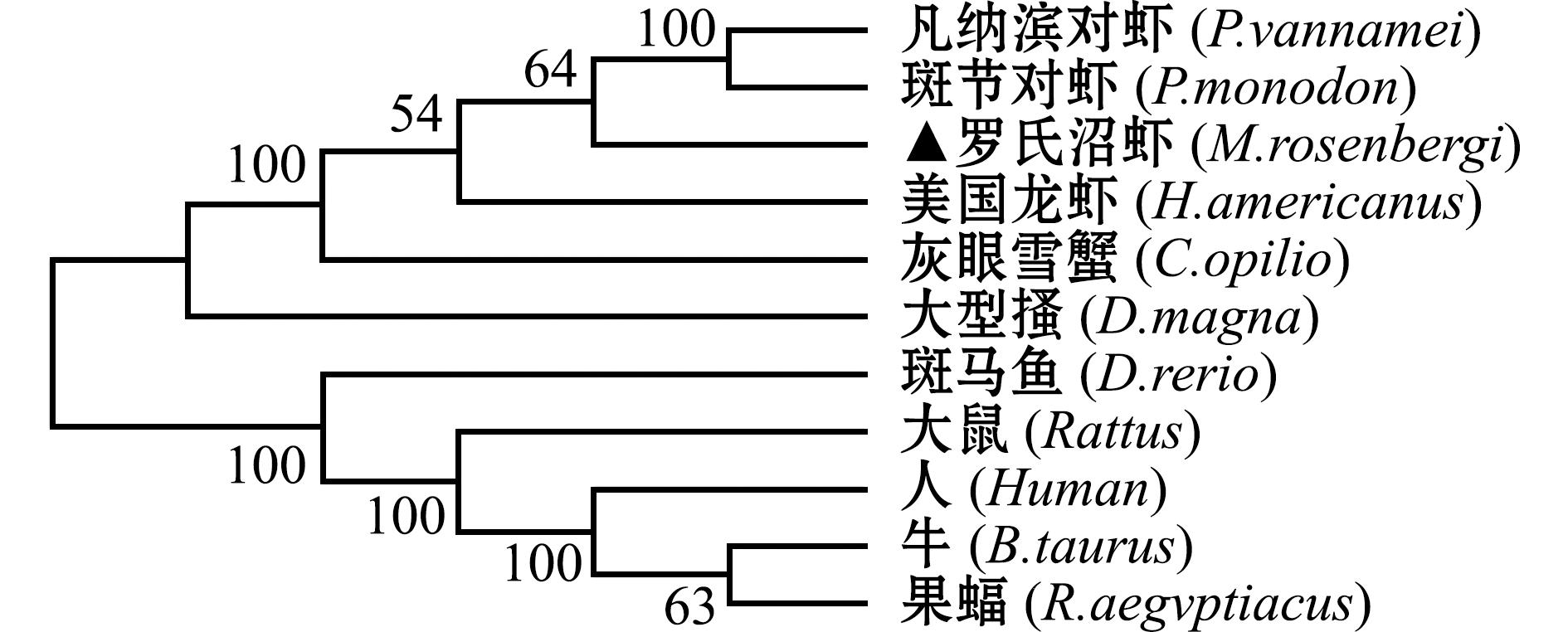
图4 罗氏沼虾与其他物种的ATP合酶OSCP亚基氨基酸的系统发育树
Fig.4 Amino acid phylogenetic tree of Macrobrachium rosenbergii ATP synthase OSCP subiunt and other species
2.3 OSCP亚基组织表达分析
利用荧光定量PCR检测OSCP 亚基在不同组织中的表达差异,结果如图5所示。从图5可见,OSCP亚基在10个组织(眼、鳃、肌肉、肠、精巢、胃、心脏、卵巢、脑和肝胰腺)中均有表达,其中,在心脏组织中表达最高,且显著高于其他组织(P<0.05),肝胰腺组织表达显著高于眼柄、肠、精巢和胃(P<0.05)。
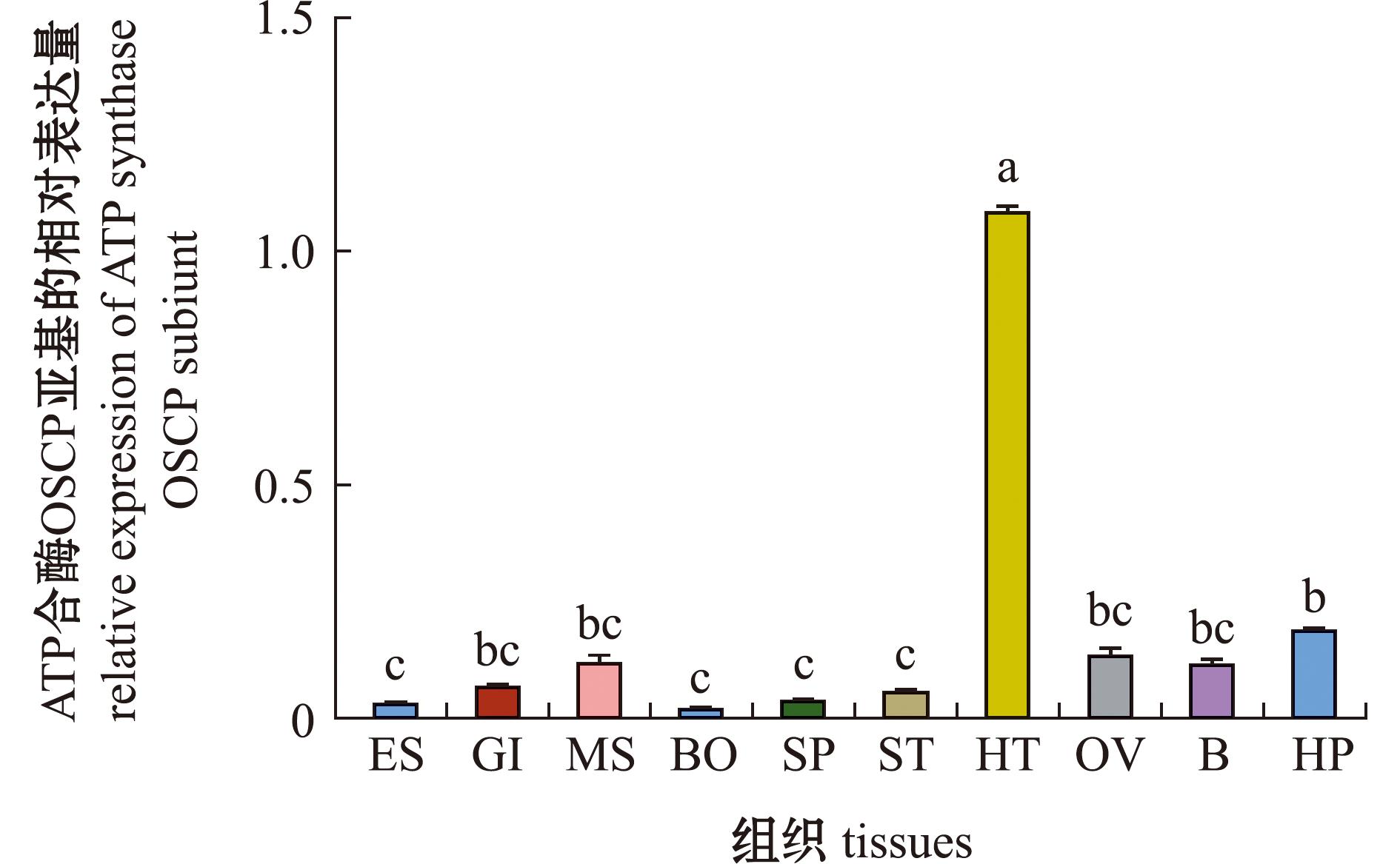
ES—眼;GI—鳃;MS—肌肉;BO—肠;SP—精巢;ST—胃;HT—心;OV—卵巢;B—脑;HP—肝胰腺;不同小写字母表示各处理组间有显著性差异(P<0.05),下同。
ES—eyes;GI—gill;MS—muscle;BO—bowel;SP—spermary;ST—stomach;HT—heart;OV—ovarium;B—brain;HP—hepatopancreas;different lowercase letters indicated that there was significant difference among treatment groups(P<0.05),et sequentia.
图5 罗氏沼虾ATP合酶OSCP亚基组织表达分布
Fig.5 Distribution of tissue expression of ATP synthase OSCP subiunt in Macrobrachium rosenbergii
2.4 3条不同siRNA的干扰效果
在注射OSCP1和OSCP3后,试验组心脏组织靶基因的表达量与对照组相比无显著性差异(P>0.05),而注射OSCP2后,试验组心脏组织靶基因的表达量显著低于DEPC组和NC组,(P<0.05)最低时为DEPC组的45.48%,说明siRNA OSCP2对ATP合酶OSCP亚基有显著干扰作用。(图6)
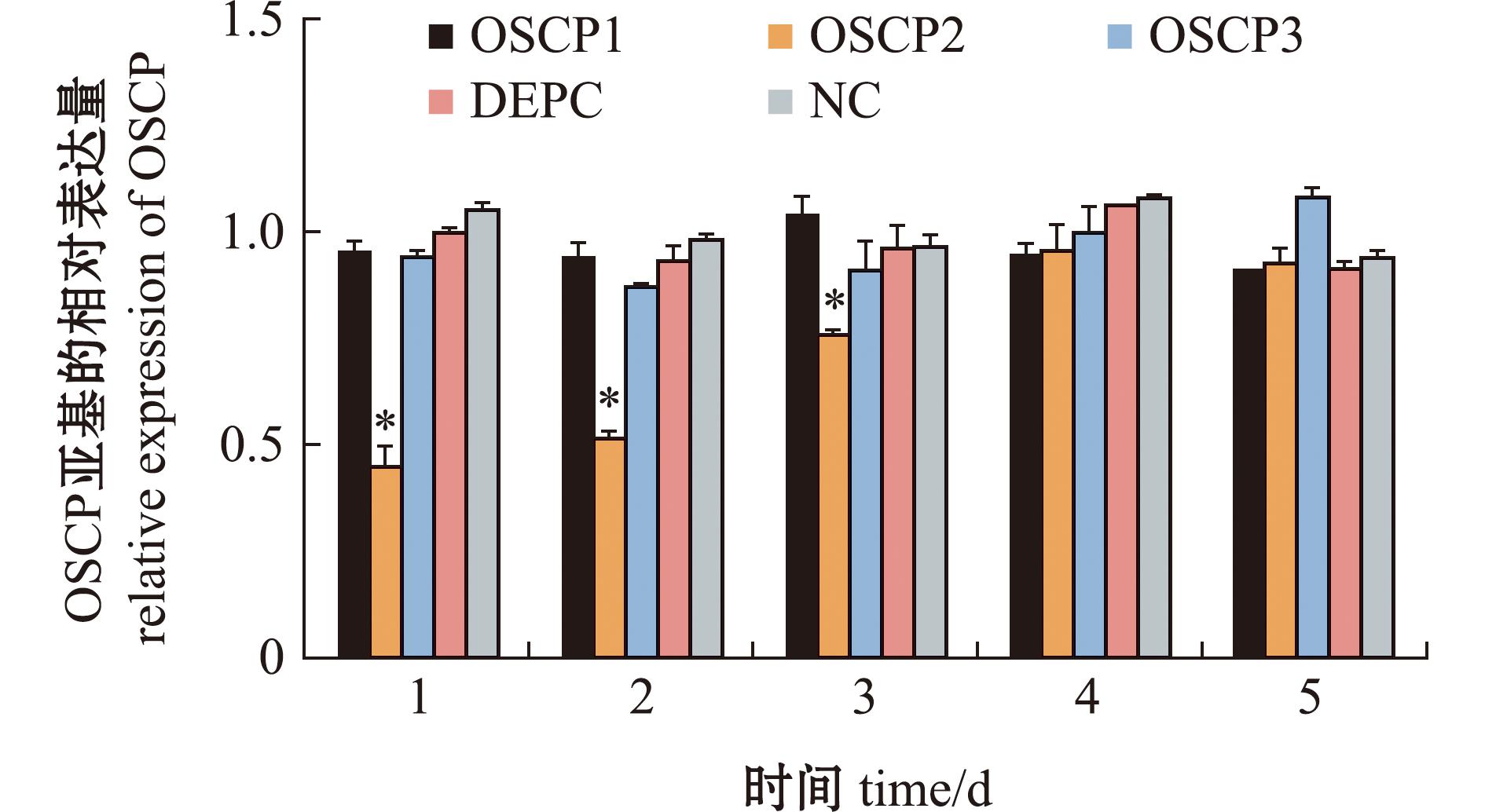
NC和DEPC为对照组;*表示该处理在同一时间显著低于对照组(P<0.05),下同。
NC and DEPC were controls;* means on the column indicated that the treatment was significantly lower than control at the same time(P<0.05),et sequentia.
图6 罗氏沼虾心脏中ATP合酶OSCP亚基在3条不同siRNA干扰后的相对表达变化情况
Fig.6 Relative expression change of ATP synthase OSCP subunit in the heart of Macrobrachium rosenbergii after three different siRNAs’ interference
2.5 不同剂量siRNA对OSCP亚基表达干扰情况
选用OSCP2为注射的siRNA,4个剂量组中0.8、1.2、2.0 μg/g组对罗氏沼虾心脏靶基因的表达有显著的抑制作用(P<0.05),在干扰后的第1天,0.8、1.2、2.0 μg/g组靶基因的表达量均显著低于对照组,到第3天只有1.2 μg/g组靶基因的表达量仍显著低于对照组,在注射后第4天试验组与对照组靶基因的表达量均无显著性差异(P>0.05)。综上可知,剂量为1.2 μg/g的OSCP2 siRNA对OSCP亚基的基因表达干扰效果最好,有效干扰期为3 d(图7)。
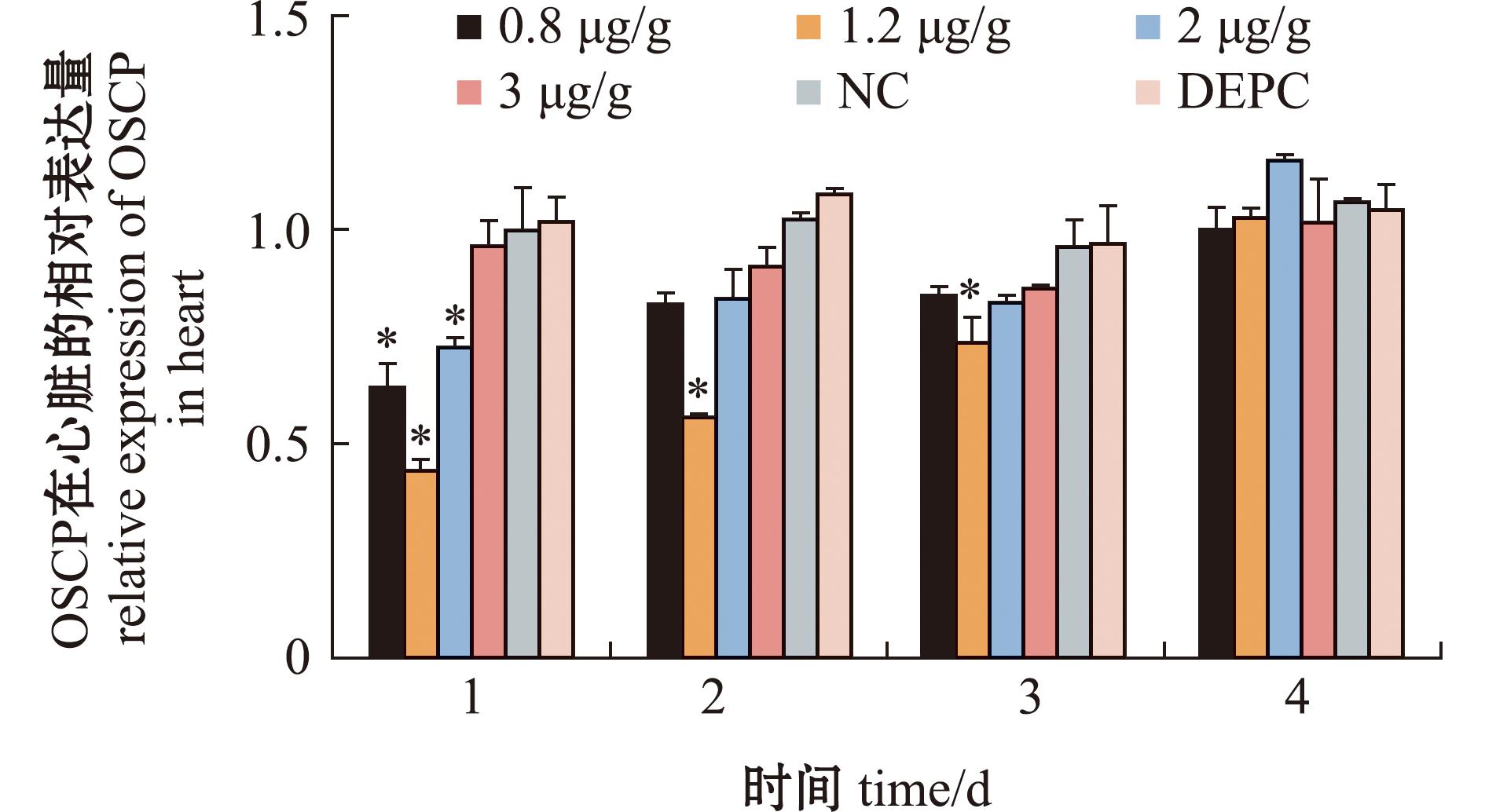
图7 罗氏沼虾心脏中中ATP合酶OSCP亚基在siRNA干扰后的表达变化情况
Fig.7 Relative expression change of ATP synthase OSCP subunit in the heart of Macrobrachium rosenbergii after siRNA interference
2.6 siRNA干扰后在心脏中ATP合酶 α、β、γ、δ、b和d亚基基因表达量的变化
从图8(a)~(f)可以看出,OSCP亚基基因表达量下降后,试验组心脏组织中ATP合酶α、β、γ、δ、b和d亚基表达量显著低于对照组,且均在干扰后的第1天表达量为最低,到了第4天除γ和d亚基外,其余亚基表达量与对照组无显著性差异(P>0.05)。综上所述,当OSCP亚基受siRNA干扰表达被抑制后,试验组心脏组织中ATP合酶F1、F0和外周柄亚基的表达量同样出现下降,且d亚基的表达下降幅度最大。
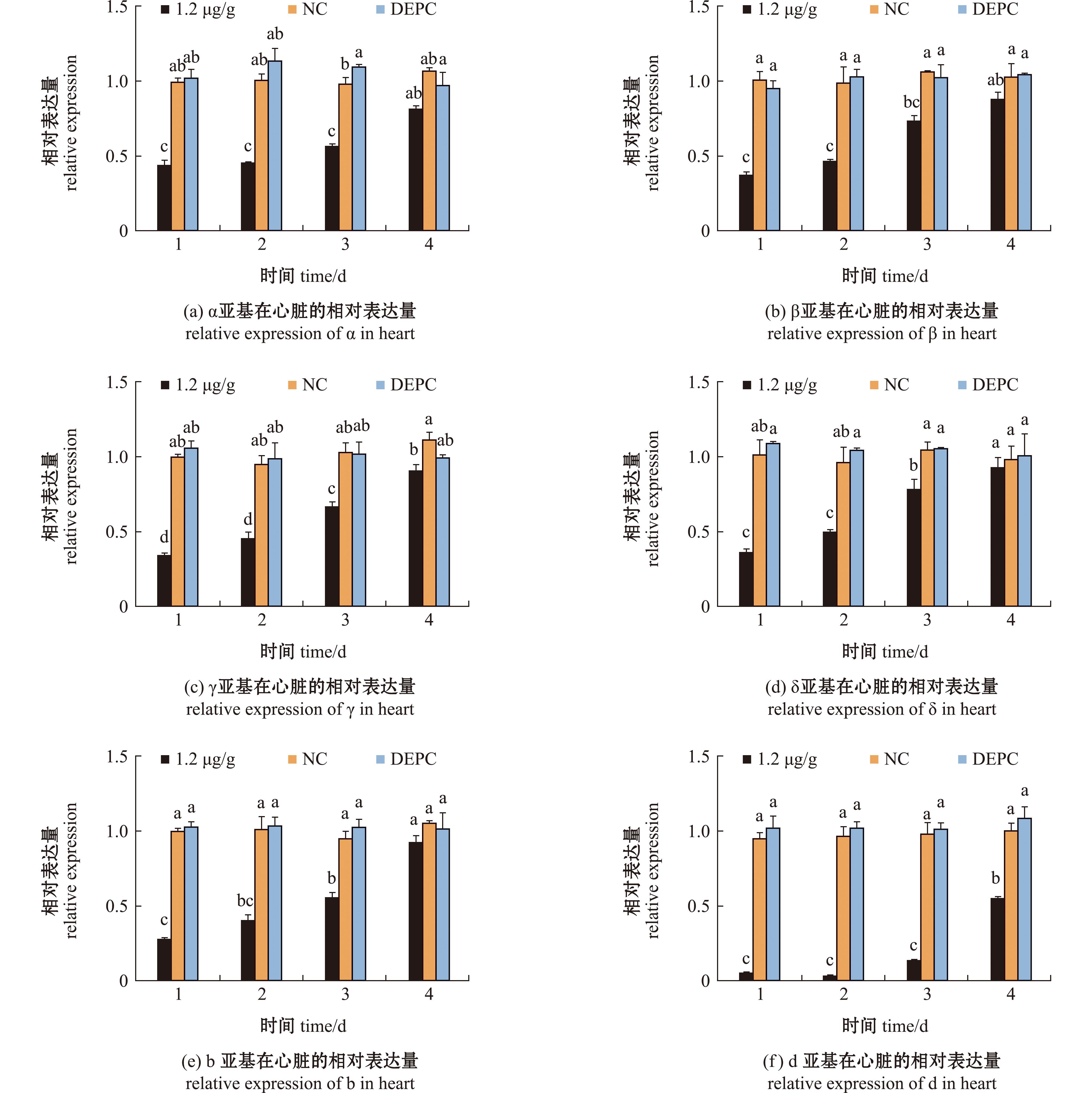
图8 siRNA干扰后心脏中ATP合酶α、β、γ、δ、b和d亚基的基因表达量变化
Fig.8 Relative expression change of ATP synthase α、β、γ、δ、b and d in heart of Macrobrachium rosenbergii after siRNA interference
3 讨论
3.1 OSCP亚基基因序列信息及基因表达分析
本研究中通过RACE首次克隆获得OSCP亚基基因cDNA序列全长,编码一个202个氨基酸的蛋白,氨基酸多序列对比发现与美国龙虾和斑节对虾相似度高达80%以上,由基于OSCP亚基氨基酸序列相似性构建的系统发育进化树可知,与斑节对虾、凡纳滨对虾和中国明对虾等虾类相似度最高并树为一支,进化距离关系符合物种之间的进化次序。组织定量PCR结果显示,OSCP亚基在心脏表达最高,其次为肝胰腺,其他组织较少,这符合王竹青等[12]对ATP合酶 β亚基在三疣梭子蟹各组织表达情况的报道。杂交鲟“鲟龙1号”的atp1β1基因经荧光定量PCR测定,其在心脏、鳃、肝脏组织中高表达,并且心脏表达水平最高[13]。ATP合酶是机体生产ATP的关键酶,线粒体是能量工厂,是生产ATP的主要场所,心脏中存在大量的线粒体,与之对应ATP合酶含量较高,有研究表明,在心肌肥厚的小鼠模型中,OSCP的蛋白表达显著下调,线粒体功能存在障碍[14],ATP合酶由许多亚基组成,亚基通常由基因表达量调控,这表明心脏和肝胰腺是罗氏沼虾的主要供能场所。
3.2 siRNA及注射剂量的筛选
在对甲壳类动物微量注射siRNA的试验中,肌肉[15]、心脏[16]和围心腔等均可成为注射部位,江丰伟等[17]在对青虾肌肉、眼柄基部、心脏和围心腔4个部位进行微量注射时,发现围心腔死亡率最低,且贾垂攀等[18]和袁伟等[19]发现,对罗氏沼虾siRNA干扰时同样注射围心腔,对虾损伤较小。综合考虑,本试验注射部位选为围心腔。以1 μg/g 剂量通过围心腔将3条 siRNA注射至罗氏沼虾体内,通过荧光定量检测对比确定 OSCP2 对OSCP 亚基有有效的干扰作用,能抑制基因表达,并且干扰有效时间为3 d。这与Ge等[20]的结果相似,Ge等对小龙虾胰岛素样雄激素腺基因(IAG)设计了3条siRNA,最终只有一条siRNA有显著的抑制效果。出现这种情况可能有以下几个原因:第一,在引物设计中,GC含量过高或过低,倾向于3′端的内部稳定性,siRNA与目标基因错配;第二,设计的siRNA与目标基因靶点结合能力低,造成脱靶;第三,设计的注射剂量未在有效范围内,以及siRNA在操作中降解。田宏刚等[21]认为,存在于昆虫血淋巴或肠道内的核酸酶可以降解dsRNA或siRNA,推测罗氏沼虾体内也存在此种核酸酶且对siRNA有降解作用,这还需要进一步验证。
Tan等[22]在对罗氏沼虾胰岛素受体基因(MrIR)沉默时,设计siRNA注射剂量分别为0.1、0.5、1.5、3.0 μg/g 4个组,发现0.5 μg/g对MrIR基因的沉默效果最佳。贾垂攀等[18]在对罗氏沼虾细胞色素C氧化酶亚基2的siRNA注射剂量筛选时发现,2.0 μg/g剂量的抑制效果优于0.8、1.5、3.0 μg/g。说明siRNA注射剂量对靶基因的抑制作用并非呈正相关,而是在一定范围内随着剂量增加抑制时间延长。本文设计了4个剂量组,分别为0.8、1.2、2.0、3.0 μg/g,结果显示,0.8、1.2、2.0 μg/g 3个剂量组均能抑制罗氏沼虾心脏中靶基因的表达,但抑制效果各不相同,相比之下,1.2 μg/g组在心脏中对靶基因的抑制效果均为最好,试验组心脏靶基因表达量为对照组的43.88%,且在干扰后的第3天只有1.2 μg/g组心脏中靶基因的表达量仍显著低于对照组。
3.3 干扰OSCP亚基对ATP合酶其余亚基表达量的影响
随着OSCP亚基的基因表达量下调,ATP合酶 α、β、γ、δ、b和d亚基在心脏中的基因表达量也随之显著下降,且在干扰后的第1天表达量达到最低,在siRNA干扰后的前3天,1.2 μg/g组靶基因表达水平均显著低于对照组。由于OSCP与C环结合[23]能够调节F0内的质子电导,OSCP亚基通过与C环的相互作用,协调电子传导和质子流,质子通过亚基a进入C环,C环上的羧酸根基团与质子结合,被中和的羧酸根基团向疏水的磷脂双分子层一侧移动,带动C环旋转,OSCP亚基的灵活性确保了这一过程的顺利进行。在结构上,OSCP亚基位于F1顶部,向下延伸到达F0部分,连接着ATP合酶F1和F0两部分,与中心柄一起确保能量转换,并能将α和β亚基固定在特殊的复合物中,因此当OSCP亚基基因表达被抑制后,线粒体膜电位被瓦解,氧化磷酸化能力减弱,活性氧(reactive oxygen specie,ROS)水平上升,导致线粒体功能丧失,OSCP亚基基因表达下调之后,蛋白表达下降,ATP合酶组装不完整,无法发挥功能,并且组装缺失导致结构不稳定,其他亚基随之降解,其他亚基的基因表达量也下调,在对牛ATP合酶的茎部亚基与F的组装中发现,亚基b、F6和d需要通过OSCP亚基来与F相互作用,这3个亚基在OSCP缺失的情况下无法与F组装[22]。而本研究中也发现,当OSCP亚基表达下调后,d亚基表达量下降幅度最大,推测OSCP和d亚基均位于ATP合酶外周柄,因此受到的影响较大。
4 结论
1)OSCP亚基基因表达在心脏中最高,表明罗氏沼虾心脏是能量生产的主要器官。
2)OSCP亚基基因表达下降,ATP合酶其他亚基的基因表达也受到影响,表明OSCP亚基在维持ATP合酶结构完整性和稳定性方面具有至关重要的作用。
[1] 周劲松.不同地理种群罗氏沼虾杂交效应及遗传多样性分析[D].南京:南京农业大学,2006.
ZHOU J S.Analysis of hybridization effect and genetic diversity of Macrobrachium rosenbergii in different geographical populations[D].Nanjing:Nanjing Agricultural University,2006.(in Chinese)
[2] 姜建萍,袁翔,邱庆庆,等.罗氏沼虾性别相关基因研究进展及其单性化养殖现状[J].南方农业学报,2019,50(9):2111-2118.
JIANG J P,YUAN X,QIU Q Q,et al.Research progress of sex-related genes and research status of monosex culture in Macrobrachium rosenbergii:a review[J].Journal of Southern Agriculture,2019,50(9):2111-2118.(in Chinese)
[3] ST PIERRE J,BRAND M D,BOUTILIER R G.Mitochondria as ATP consumers:cellular treason in anoxia[J].Proceedings of the National Academy of Sciences of the United States of America,2009,97(15):8670-8674.
[4] 张博,耿梓宸,常彦鹏,等.ATP合酶亚基d参与海藻糖代谢调控棉铃虫幼虫变态的分子机理[J].昆虫学报,2023,66(3):267-276.
ZHANG B,GENG Z C,CHANG Y P,et al.Molecular mechanism of the ATP synthase subunit d in trehalose metabolism regulating the larval metamorphosis of Helicoverpa armigera (Lepidoptera:Noctuidae)[J].Acta Entomologica Sinica,2023,66(3):267-276.(in Chinese)
[5] ZHAO M M,LUO J X,ZHOU Q C,et al.Influence of dietary phosphorus on growth performance,phosphorus accumulation in tissue and energy metabolism of juvenile swimming crab (Portunus trituberculatus)[J].Aquaculture Reports,2021,20:100654.
[6] 成君军.对虾白斑综合症病毒的一种结合蛋白BP53的表达与功能研究[D].青岛:中国海洋大学,2008.
CHENG J J.Expression and function of a binding protein BP53 of shrimp white spot syndrome virus[D].Qingdao:Ocean University of China,2008.(in Chinese)
[7] 霍利杰.日本囊对虾ATP合酶及其抑制因子在病毒免疫反应中的功能研究[D].济南:山东大学,2019.
HUO L J.Study on the function of Penaeus japonicus ATP synthase and its inhibitor in viral immune response[D].Jinan:Shandong University,2019.(in Chinese)
[8] YANG J H,SARROU I,MARTIN-GARCIA J M,et al.Purification and biochemical characterization of the ATP synthase from Heliobacterium modesticaldum[J].Protein Expression and Purification,2015,114:1-8.
[9] 范海鸣,刘艳霞.线粒体ATP合酶中寡霉素敏感相关蛋白的研究进展[J].中国药学杂志,2008,43(9):641-643.
FAN H M,LIU Y X.Research progress of oligomycin-sensitive related proteins in mitochondrial ATP synthase[J].Chinese Pharmaceutical Journal,2008,43(9):641-643.(in Chinese)
[10] CARBAJO R J,KELLAS F A,YANG J C,et al.How the N-terminal domain of the OSCP subunit of bovine F1Fo-ATP synthase interacts with the N-terminal region of an alpha subunit[J].Journal of Molecular Biology,2007,368(2):310-318.
[11] 张凯亮.线粒体能量代谢相关蛋白调节胰岛β细胞功能的作用及机制研究[D].武汉:华中科技大学,2021.
ZHANG K L.Study on the role and mechanism of mitochondrial energy metabolism-related proteins in regulating the function of islet β cells[D].Wuhan:Huazhong University of Science and Technology,2021.(in Chinese)
[12] 王竹青,任宪云,高保全,等.三疣梭子蟹F型ATP酶β亚基(F-ATPaseβ)基因的克隆、组织表达及在家系近交中的变化[J].渔业科学进展,2018,39(1):97-106.
WANG Z Q,REN X Y,GAO B Q,et al.cDNA cloning and expression analysis of F-ATPaseβ subunit gene in Portunus trituberculatus and its variation in family inbreeding[J].Progress in Fishery Sciences,2018,39(1):97-106.(in Chinese)
[13] 杨合霖,刘霞飞,张颖,等. 杂交鲟“鲟龙 1 号”(Huso dauricus ♀ × Acipenser schrenckii (♂))atp1α1与atp1β1基因的克隆、序列分析及碱胁迫下鳃的表达特征[J]. 水产学杂志,2023,36(5):17-26.
YANG H L, LIU X F, ZHANG Y,et al.Cloning, sequence analysisand expression regulation characteristics in gill of atplαl and atp1β1 genes of hybrid sturgeon (Huso dauricus ♀ x Acipenser schrenckii♂)under alkali stress[J]. Chinese Journal of Fisheries,2023,36(5):17-26. (in Chinese)
[14] GUO Y Y, ZHANG K L,GAO X,et al.Sustained oligomycin sensitivity conferring protein expression in cardio myocytes protects against cardiac hypertrophy induced by pressure overload via impmving mitochondrial function[J].Hum GeneTher,2020,31(2l/22):1178-1189.
[15] ROBALINO J,BARTLETT T,SHEPARD E,et al.Double-stranded RNA induces sequence-specific antiviral silencing in addition to nonspecific immunity in a marine shrimp:convergence of RNA interference and innate immunity in the invertebrate antiviral response?[J].Journal of Virology,2005,79(21):13561-13571.
[16] ZHANG Y P,JIANG S F,XIONG Y W,et al.Molecular cloning and expression analysis of extra sex combs gene during development in Macrobrachium nipponense[J].Turkish Journal of Fisheries &Aquatic Sciences,2013,13(2): 331-340.
[17] 江丰伟,傅洪拓,乔慧,等.青虾transformer-2基因RNA干扰规律的研究[J].中国农学通报,2014,30(32):32-37.
JIANG F W,FU H T,QIAO H,et al.The RNA interference regularity of transformer-2 gene of oriental river prawn Macrobrachium nipponense[J].Chinese Agricultural Science Bulletin,2014,30(32):32-37.(in Chinese)
[18] 贾垂攀,戴习林,尹丹慧,等.干扰COX2基因对罗氏沼虾生长及能量代谢酶活性和基因表达的影响[J].南方农业学报,2021,52(12):3274-3285.
JIA C P,DAI X L,YIN D H,et al.Effects of interference with COX2 gene on growth and energy metabolism enzyme activity and gene expression of Macrobrachium rosenbergii[J].Journal of Southern Agriculture,2021,52(12):3274-3285.(in Chinese)
[19] 袁伟,戴习林,戈潘缘元,等.RNA干扰不同类型TLR基因对罗氏沼虾免疫相关基因表达的影响[J].上海海洋大学学报,2021,30(4):590-600.
YUAN W,DAI X L,GE P Y Y,et al.Effects of RNA interferences with different Toll-like receptors on the expression of immune-related genes in Macrobrachium rosenbergii[J].Journal of Shanghai Ocean University,2021,30(4):590-600.(in Chinese)
[20] GE H L,TAN K,SHI L L,et al.Comparison of effects of dsRNA and siRNA RNA interference on insulin-like androgenic gland gene (IAG) in red swamp crayfish Procambarus clarkii[J].Gene,2020,752:144783.
[21] 田宏刚,刘同先,张文庆.RNAi技术在中国昆虫学研究中的发展、应用与展望[J].应用昆虫学报,2019,56(4):605-616.
TIAN H G,LIU T X,ZHANG W Q.Progress in RNAi technology,and prospects for its application,in entomological research in China[J].Chinese Journal of Applied Entomology,2019,56(4):605-616.(in Chinese)
[22] TAN K,LI Y H,ZHOU M,et al.siRNA knockdown of MrIR induces sex reversal in Macrobrachium rosenbergii[J].Aquaculture,2020,523:735172.
[23] SYMERSKY J,OSOWSKI D,ERIC WALTERS D,et al.Oligomycin frames a common drug-binding site in the ATP synthase[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(35):13961-13965.
[24] STRAFFON A F L,PRESCOTT M,NAGLEY P,et al.The assembly of yeast mitochondrial ATP synthase:subunit depletion in vivo suggests ordered assembly of the stalk subunits b,OSCP and d[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,1998,1371(2):157-162.