三疣梭子蟹(Portunus trituberculatus,以下简称“梭子蟹”),因其卓越的营养价值和鲜美口感在中国水产养殖领域占据举足轻重的经济地位。梭子蟹成熟雌体卵巢所展现的橙红色泽,不仅是评估梭子蟹品质的关键指标,更是决定消费者接受度和市场价值的重要因素[1]。研究表明,这些色泽与其组织中类胡萝卜素构成及含量紧密相关,因此通过向饲料中补充类胡萝卜素可以在一定程度上提升梭子蟹的养殖效益[2]。梭子蟹在养殖过程中常常面临多重环境压力,如水体中氨和亚硝酸盐浓度上升、pH值极端波动及低氧环境,特别是在夏季高温期间环境胁迫尤为严重[3]。这些不利条件不仅影响梭子蟹的免疫系统,还可能对其正常生理过程、生存和生长造成负面影响,进而损害养殖的经济效益[4-5]。为此,增强梭子蟹的抗氧化能力已成为减缓其受环境胁迫影响的关键策略[6]。
β-胡萝卜素作为一种高效的着色剂和添加剂,不仅天然存在于浮游生物、水果和蔬菜中,还能单独或与其他类胡萝卜素结合使用,从而显著改善摄食对象体表及组织色泽[7-8]。除色素沉着特性外,β-胡萝卜素对甲壳动物的抗氧化性能、免疫性能、抗逆性能和抗病性能等方面也有一定的提升效果[9]。鉴于甲壳动物无法自身合成β-胡萝卜素,在饲料中添加β-胡萝卜素成为满足其自身需求的重要途径[2]。尽管前期研究已探讨了虾青素对梭子蟹生长和色泽方面的积极效果,但关于β-胡萝卜素对梭子蟹生长和抗氧化能力的具体作用效果尚缺乏深入研究[10],因此,本研究中聚焦于添加β-胡萝卜素对梭子蟹养殖性能、抗氧化能力和非特异性免疫的影响,以期为β-胡萝卜素对甲壳动物的生理作用提供新见解,并推动梭子蟹功能性饲料的研发进程。
1 材料与方法
1.1 材料
本试验通过在基础饲料中添加不同含量的人工合成β-胡萝卜素,使得饲料中β-胡萝卜素的含量分别达到约1.30、49.15、102.13、203.53 mg/kg,并分别标记为β-0、β-50、β-100和β-200。饲料中β-胡萝卜素含量的梯度设定参考前期学者的研究结果[11-12],饲料的制备流程参照张鑫等[13]方法。为了最大程度地减少类胡萝卜素在储存过程中的损失,将所有试验饲料存放于黑色塑料袋中,并置于-20 ℃冰箱中进行冷藏。试验饲料的详细配方、营养构成及类胡萝卜素含量见表1和表2。
表1 试验饲料配方(干物质)
Tab.1 Formulations of the experimental diets(dry matter) %
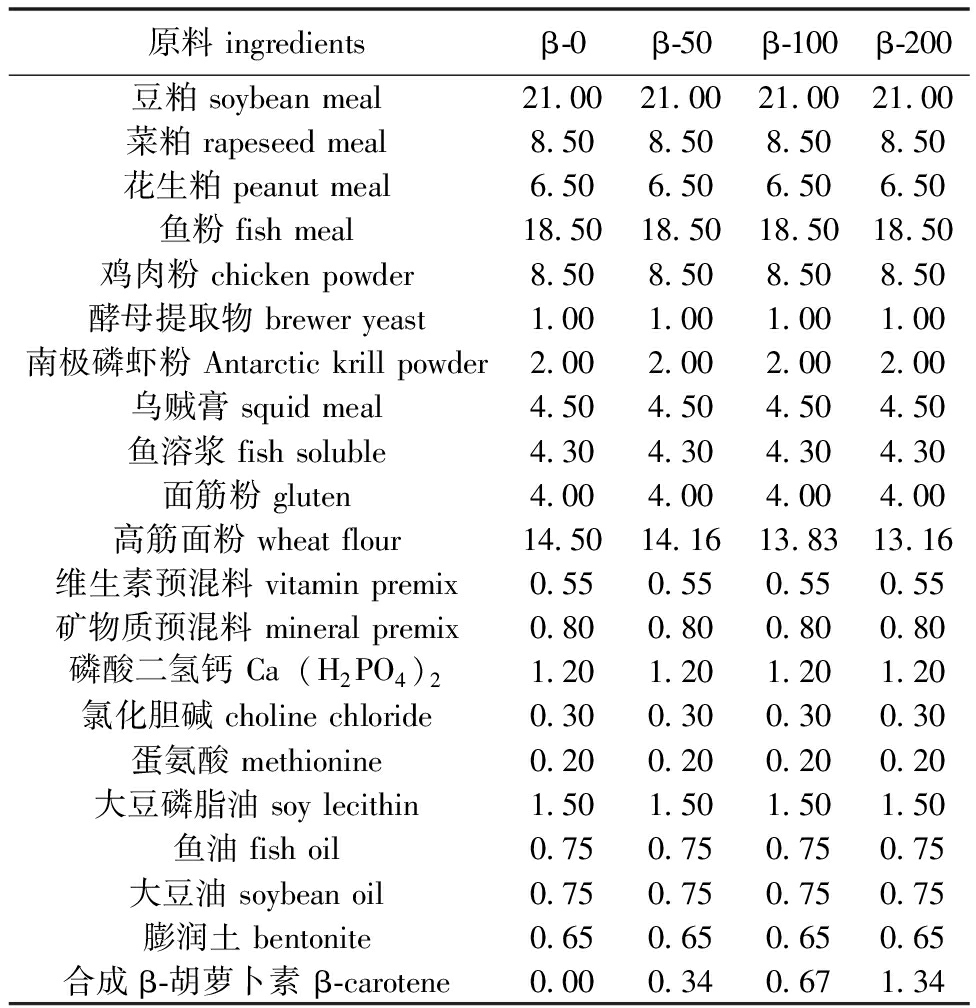
原料ingredientsβ-0β-50β-100β-200豆粕soybeanmeal21.0021.0021.0021.00菜粕rapeseedmeal8.508.508.508.50花生粕peanutmeal6.506.506.506.50鱼粉fishmeal18.5018.5018.5018.50鸡肉粉chickenpowder8.508.508.508.50酵母提取物breweryeast1.001.001.001.00南极磷虾粉Antarctickrillpowder2.002.002.002.00乌贼膏squidmeal4.504.504.504.50鱼溶浆fishsoluble4.304.304.304.30面筋粉gluten4.004.004.004.00高筋面粉wheatflour14.5014.1613.8313.16维生素预混料vitaminpremix0.550.550.550.55矿物质预混料mineralpremix0.800.800.800.80磷酸二氢钙Ca(H2PO4)21.201.201.201.20氯化胆碱cholinechloride0.300.300.300.30蛋氨酸methionine0.200.200.200.20大豆磷脂油soylecithin1.501.501.501.50鱼油fishoil0.750.750.750.75大豆油soybeanoil0.750.750.750.75膨润土bentonite0.650.650.650.65合成β-胡萝卜素β-carotene0.000.340.671.34
表2 试验饲料的营养组成及类胡萝卜素组成
Tab.2 Proximate composition and major carotenoid content of the experimental diets
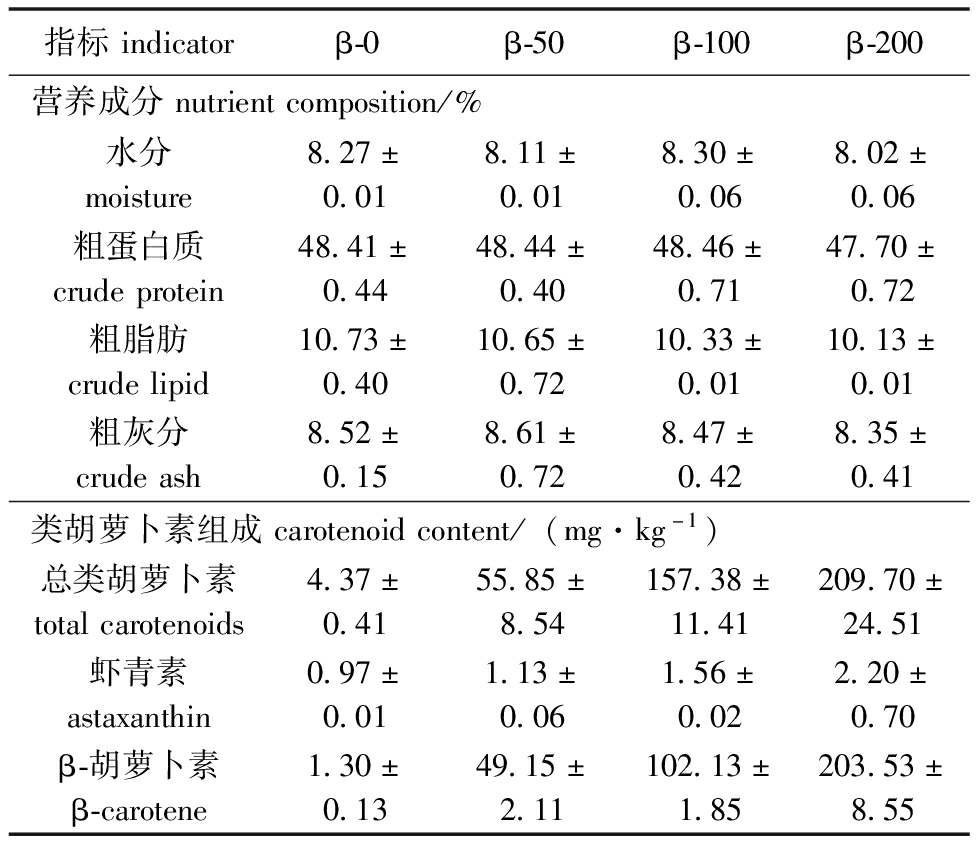
指标indicatorβ-0β-50β-100β-200营养成分nutrientcomposition/%水分moisture8.27±0.018.11±0.018.30±0.068.02±0.06粗蛋白质crudeprotein48.41±0.4448.44±0.4048.46±0.7147.70±0.72粗脂肪crudelipid10.73±0.4010.65±0.7210.33±0.0110.13±0.01粗灰分crudeash8.52±0.158.61±0.728.47±0.428.35±0.41类胡萝卜素组成carotenoidcontent/(mg·kg-1)总类胡萝卜素totalcarotenoids4.37±0.4155.85±8.54157.38±11.41209.70±24.51虾青素astaxanthin0.97±0.011.13±0.061.56±0.022.20±0.70β-胡萝卜素β-carotene1.30±0.1349.15±2.11102.13±1.85203.53±8.55
1.2 方法
1.2.1 试验设计及养殖试验 2023年9—11月在浙江省海洋水产研究所西轩基地开展养殖试验,设备为12个直径为160 cm、高度为120 cm的聚乙烯(PE)循环水水槽。9月中旬从养殖池塘中精心挑选活力充沛、四肢健全、完成生殖蜕壳的梭子蟹雌体300只,初始体质量为(160.32±12.24)g,室内条件暂养5 d后分配至12个水槽中,每个饲料组设置3个平行水槽,每个水槽中均放置12只雌蟹。水槽底部铺设10 cm厚的细沙作为庇护物,细沙覆盖率维持在50%左右。为避免试验蟹在养殖过程中打斗和残食,将瓦片和PVC管铺设在水槽底部作为梭子蟹的隐蔽场所。使用消毒沉淀后的海水作为试验用水,试验期间保持每个水槽的水位在50 cm左右,水体溶解氧浓度始终保持在5 mg/L以上,水体盐度保持在25左右。每日换水1次,换水量为总水体1/3。试验期间模拟自然环境的昼夜光照模式,保持12 h光照和12 h黑暗的比例。在养殖过程中严格按照梭子蟹体质量的3%进行饲料投喂,并使用虹吸法每天清理水槽中的排泄物和残饵。定期测定水体的pH值、氨氮和亚硝酸盐等指标,确保这些指标在试验期间始终维持在理想的范围内,即pH值为7.5~8.2,氨氮为0.2~0.4 mg/L,亚硝酸盐为0.05~0.15 mg/L。整个养殖试验持续60 d,最终在2023年11月底结束养殖试验。
1.2.2 生长数据和样本采集 试验进行到第30天时,所有试验蟹禁食24 h。从各个水槽中随机挑选出3只雌蟹,使用电子天平(精度0.01 g,JY202,上海浦春)精确称量试验蟹体质量,并基于这些数据计算各组试验蟹增重率(WGR)。使用解剖方式取出试验蟹卵巢和肝胰腺并称重,据此计算各试验蟹性腺指数(GSI)和肝胰腺指数(HSI)。在养殖试验的第60天,再次从各水槽中随机选取3只梭子蟹进行称量。使用1 mL注射器从每只梭子蟹的第三步足基部采集2 mL血淋巴,随后保存于2 mL离心管并置于-80 ℃冰箱中,并将解剖获得的头胸甲、卵巢和肝胰腺等组织存储于-40 ℃冰箱中,用于后续生化分析。养殖试验结束后,对各水槽中存活梭子蟹进行详细的计数和称重,使用下列公式计算试验蟹的WGR(%)、GSI(%)、HSI(%)及成活率(SR,%)。
RWGR=(WF-WI)/WI×100%,
(1)
IGSI=WG/WB×100%,
(2)
IHSI=WH/WB×100%,
(3)
RSR=NF/NI×100%。
(4)
式中:WI为初始平均体质量;WF为最终平均体质量;WG为性腺质量;WH为肝胰腺质量;WB为体质量;NI为梭子蟹初始数量;NF为梭子蟹最终数量。
1.2.3 免疫及抗氧化性能 利用IKA微型匀浆器(型号T10B,德国IKA公司)对血淋巴样品进行匀浆处理,匀浆后的样品在恒定4 ℃条件下以10 000 r/min离心20 min,上清液置于-40 ℃冰箱中。肝胰腺组织的处理方面,从每只梭子蟹精准取出约0.1 g肝胰腺组织,按1∶5(w/v)比例向其中加入生理盐水。利用IKA匀浆器在2 mL的离心管中对混合液进行充分匀浆处理,匀浆后混合物在4 ℃低温条件下再次以10 000 r/min离心10 min,分离得到的上清液保存于-40 ℃低温环境中。利用分光光度计以及试剂盒(南京建成生物工程研究所)对血淋巴和肝胰腺中的超氧化物歧化酶(SOD,No.A084-3-1)、总抗氧化能力(T-AOC,No.A015-2-1)、过氧化物酶(POD,No.A084-3-1)、丙二醛(MDA,No.A003-1-1)、碱性磷酸酶(AKP,No.A059-1-1)、酸性磷酸酶(ACP,No.A060-1)和溶菌酶(LZM,No.A050-1-1)等多项生化指标进行测定。
1.2.4 色泽及类胡萝卜素组成 试验饲料中的水分、粗蛋白质和灰分的测定均严格遵循AOAC[14]的既定程序。总脂肪测定采用氯仿-甲醇(体积比为2∶1)的混合溶剂进行提取[15]。试验蟹头胸甲、卵巢和肝胰腺冷冻干燥后,使用丙酮提取样品中总类胡萝卜素,利用紫外-可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司)在470 nm处对提取液进行定量分析[16]。5种类胡萝卜素(虾青素、叶黄素、玉米黄质、角黄素和β-胡萝卜素)的鉴定和定量参照Long等[17]的方法。利用色差仪(CR400,日本柯尼卡美能达公司)对试验蟹的头胸甲、卵巢和肝胰腺进行色度值测定,主要包含L*(亮度值)、a*(红度值)和b*(黄度值)3个指标[18],组织色泽的测定同样遵循Long等[17]的方法。
1.3 数据处理
采用SPSS 27.0软件对试验数据进行统计分析,试验数据均以平均值±标准差(mean±S.D.)表示。采用Levene法进行方差齐性检验,当不满足齐性方差时进行反正弦或平方根处理。采用ANOVA法对试验结果进行方差分析,采用Duncan’s法进行多重比较,显著性水平设为0.05。在整个统计分析过程中始终将每个水槽视为一个独立的重复单位,以确保分析结果的独立性和可靠性。在GraphPad Prism 8软件上绘制相关图表。
2 结果与方法
2.1 生长性能及性腺发育
饲料中添加β-胡萝卜素对梭子蟹雌体生长和性腺发育的影响见表3。在养殖试验期间,各组试验蟹在不同时间点的平均体质量和增重率均未表现出显著性差异(P>0.05)。性腺发育方面,性腺指数(GSI)从30 d的2.95%~3.07%增加至60 d的4.74%~4.79%,肝胰腺指数(HSI)也从30 d的4.42%~4.85%显著提升至60 d的6.21%~6.39%,但组间同样无显著性差异(P>0.05)。各试验组梭子蟹成活率均维持在约75%的水平,未因饲料中β-胡萝卜素的添加而表现出显著性差异(P>0.05)。
表3 添加β-胡萝卜素对梭子蟹雌体生长和性腺发育的影响
Tab.3 Effects of β-carotene supplements on growth and gonad development of female Portunus trituberculatus
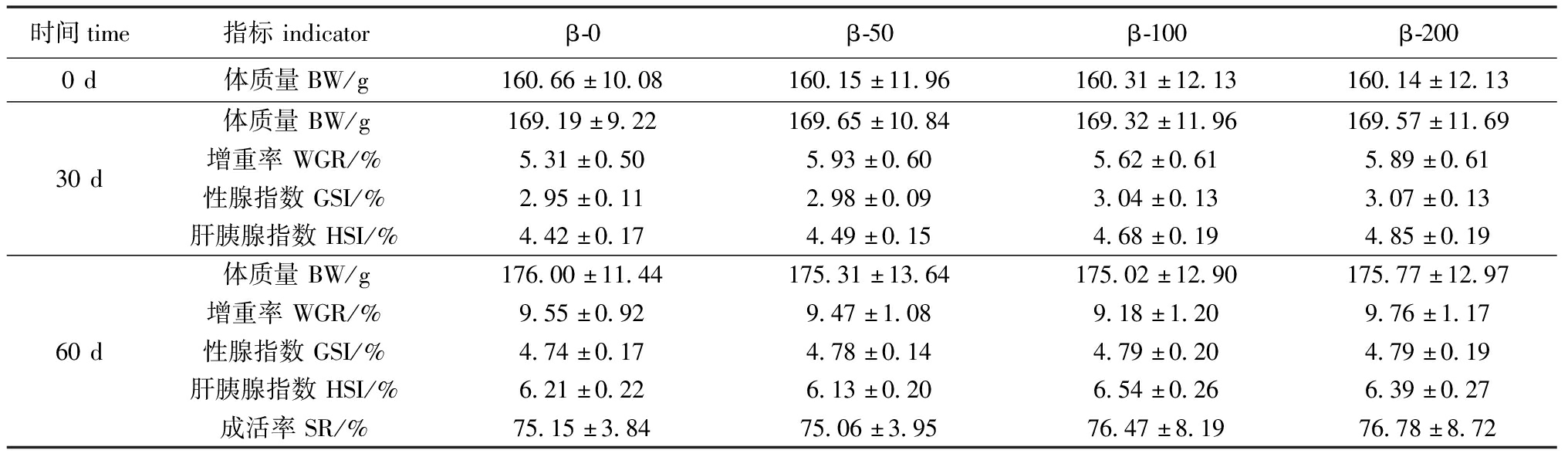
时间time指标indicatorβ-0β-50β-100β-2000d体质量BW/g160.66±10.08160.15±11.96160.31±12.13160.14±12.13体质量BW/g169.19±9.22169.65±10.84169.32±11.96169.57±11.6930d增重率WGR/%5.31±0.505.93±0.605.62±0.615.89±0.61性腺指数GSI/%2.95±0.112.98±0.093.04±0.133.07±0.13肝胰腺指数HSI/%4.42±0.174.49±0.154.68±0.194.85±0.19体质量BW/g176.00±11.44175.31±13.64175.02±12.90175.77±12.97增重率WGR/%9.55±0.929.47±1.089.18±1.209.76±1.1760d性腺指数GSI/%4.74±0.174.78±0.144.79±0.204.79±0.19肝胰腺指数HSI/%6.21±0.226.13±0.206.54±0.266.39±0.27成活率SR/%75.15±3.8475.06±3.9576.47±8.1976.78±8.72
2.2 免疫及抗氧化性能
饲料中添加β-胡萝卜素对梭子蟹雌体肝胰腺和血淋巴中抗氧化指标的影响见表4。随着饲料中β-胡萝卜素添加量的增加,前三个饲料组的肝胰腺和血淋巴总抗氧化能力水平呈现显著上升趋势(P<0.05)。然而当β-胡萝卜素添加量从100 mg/kg增加到200 mg/kg时,总抗氧化能力水平却出现了降低的趋势。血淋巴的丙二醛含量随着β-胡萝卜素添加量的增加表现出了相反的趋势,当添加量从0 mg/kg增加至100 mg/kg时,丙二醛含量显著降低(P<0.05),当β-胡萝卜素添加量进一步增加至200 mg/kg时,丙二醛含量却出现了明显增加。饲料中添加β-胡萝卜素显著降低血淋巴中超氧化物歧化酶活性(P<0.05),血淋巴的过氧化物酶水平随饲料中β-胡萝卜素添加量的增加而增长,并在β-胡萝卜素添加量为200 mg/kg时差异显著(P<0.05)。
表4 添加β-胡萝卜素对雌性梭子蟹肝胰腺和血淋巴中抗氧化指标的影响
Tab.4 Effects of β-carotene supplement on antioxidant indicators in hepatopancreas and hemolymph of female Portunus trituberculatus
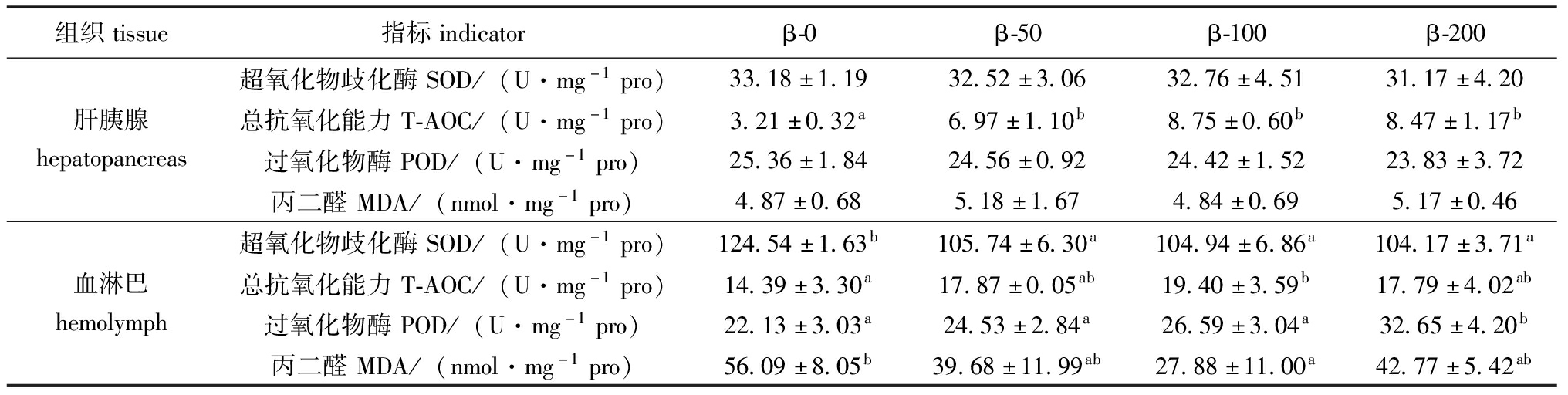
组织tissue指标indicatorβ-0β-50β-100β-200超氧化物歧化酶SOD/(U·mg-1pro)33.18±1.1932.52±3.0632.76±4.5131.17±4.20肝胰腺hepatopancreas总抗氧化能力T-AOC/(U·mg-1pro)3.21±0.32a6.97±1.10b8.75±0.60b8.47±1.17b过氧化物酶POD/(U·mg-1pro)25.36±1.8424.56±0.9224.42±1.5223.83±3.72丙二醛MDA/(nmol·mg-1pro)4.87±0.685.18±1.674.84±0.695.17±0.46超氧化物歧化酶SOD/(U·mg-1pro)124.54±1.63b105.74±6.30a104.94±6.86a104.17±3.71a血淋巴hemolymph总抗氧化能力T-AOC/(U·mg-1pro)14.39±3.30a17.87±0.05ab19.40±3.59b17.79±4.02ab过氧化物酶POD/(U·mg-1pro)22.13±3.03a24.53±2.84a26.59±3.04a32.65±4.20b丙二醛MDA/(nmol·mg-1pro)56.09±8.05b39.68±11.99ab27.88±11.00a42.77±5.42ab
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same line are not significant differences,et sequentia.
饲料中添加β-胡萝卜素对梭子蟹雌体肝胰腺和血淋巴中非特异性免疫指标的影响见表5。当饲料中β-胡萝卜素添加量从0 mg/kg逐步增加至100 mg/kg时,肝胰腺中碱性磷酸酶活性及血淋巴中酸性磷酸酶活性均表现出显著上升的趋势(P<0.05),然而当β-胡萝卜素添加量进一步增加至200 mg/kg时,这两种酶的活性均显著降低(P<0.05)。饲料中添加β-胡萝卜素对梭子蟹血淋巴中溶菌酶活性产生了显著的抑制作用。β-胡萝卜素的添加对肝胰腺中的酸性磷酸酶和溶菌酶水平,以及血淋巴中的碱性磷酸酶水平,均未表现出显著性影响(P>0.05)。
表5 添加β-胡萝卜素对梭子蟹雌体肝胰腺和血淋巴中非特异免疫指标的影响
Tab.5 Effects of β-carotene on non-specific immune indices of hepatopancreas and hemolymph of female Portunus trituberculatus
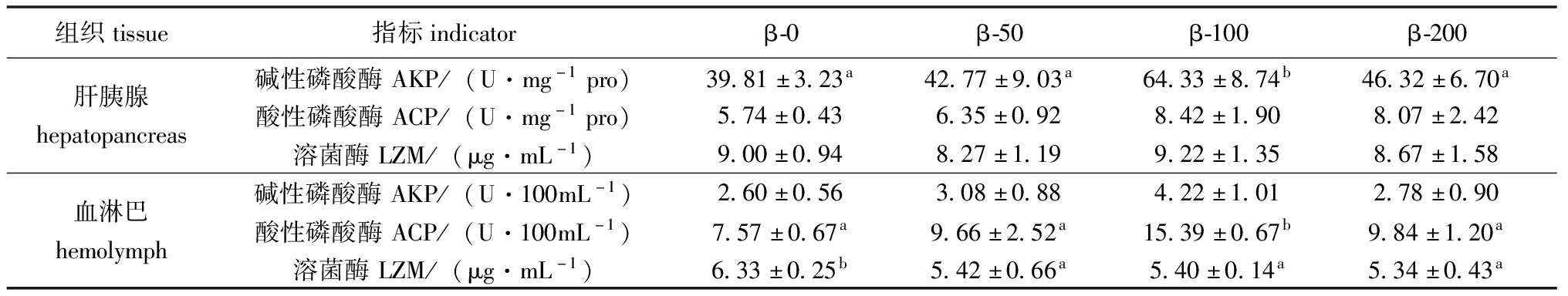
组织tissue指标indicatorβ-0β-50β-100β-200碱性磷酸酶AKP/(U·mg-1pro)39.81±3.23a42.77±9.03a64.33±8.74b46.32±6.70a肝胰腺hepatopancreas酸性磷酸酶ACP/(U·mg-1pro)5.74±0.436.35±0.928.42±1.908.07±2.42溶菌酶LZM/(μg·mL-1)9.00±0.948.27±1.199.22±1.358.67±1.58碱性磷酸酶AKP/(U·100mL-1)2.60±0.563.08±0.884.22±1.012.78±0.90血淋巴hemolymph酸性磷酸酶ACP/(U·100mL-1)7.57±0.67a9.66±2.52a15.39±0.67b9.84±1.20a溶菌酶LZM/(μg·mL-1)6.33±0.25b5.42±0.66a5.40±0.14a5.34±0.43a
2.3 色泽及类胡萝卜素组成
饲料中添加β-胡萝卜素对梭子蟹雌体组织色泽的影响如图1所示。随着饲料中β-胡萝卜素添加量从0 mg/kg逐渐提升至200 mg/kg,试验蟹卵巢的红度值(a*)和黄度值(b*)均呈现出显著增加趋势(P<0.05)。亮度值(L*)虽随β-胡萝卜素添加量的增加而降低,但未达到显著水平(P>0.05)。对于肝胰腺,当β-胡萝卜素添加量从0 mg/kg增加至100 mg/kg时,a*和b*值均显著上升(P<0.05),然而当β-胡萝卜素添加量进一步增至200 mg/kg时,这两个指标趋于稳定。头胸甲方面,尽管a*和b*值也随β-胡萝卜素添加量的增加而上升,但各组间并未有显著性差异(P>0.05)。
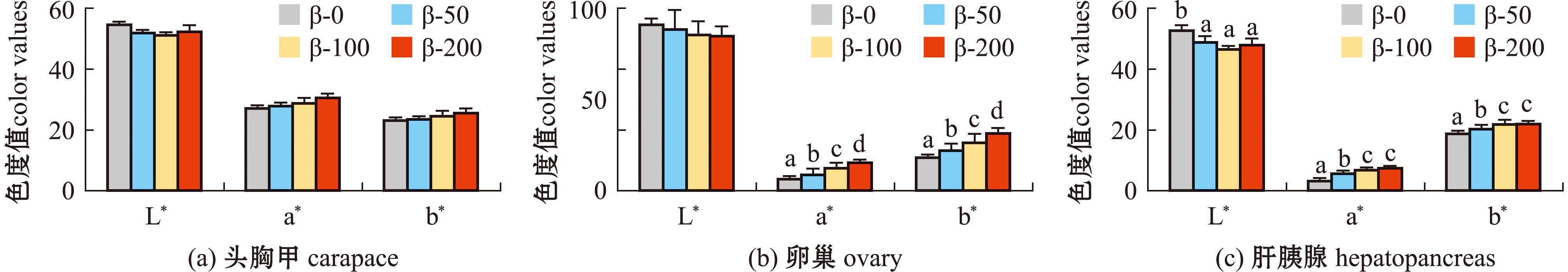
图1 饲料中添加β-胡萝卜素对梭子蟹雌体头胸甲、卵巢和肝胰腺色泽的影响
Fig.1 Effects of β-carotene supplement on color parameters of carapace,ovary and hepatopancreas of female Portunus trituberculatus
饲料中添加β-胡萝卜素对梭子蟹雌体各组织类胡萝卜素组成的影响见表6。随着饲料中β-胡萝卜素添加量从0 mg/kg递增至100 mg/kg,头胸甲和肝胰腺中的总类胡萝卜素和β-胡萝卜素含量均显著上升(P>0.05),当添加量进一步从100 mg/kg增加至200 mg/kg时,这种增加趋势明显减缓。此外,各β-胡萝卜素添加组头胸甲和肝胰腺中虾青素含量显著较高(P<0.05),而β-100和β-200饲料组较β-0和β-10饲料组肝胰腺中玉米黄素含量也显著较高(P<0.05)。卵巢中的总类胡萝卜素和β-胡萝卜素含量随着饲料中β-胡萝卜素添加量的增加而持续显著增长(P<0.05),卵巢中虾青素含量在前3个饲料组中显著上升(P<0.05),但在β-200组则保持相对稳定。
表6 添加β-胡萝卜素对雌体梭子蟹头胸甲、卵巢和肝胰腺类胡萝卜素组成的影响(干物质)
Tab.6 Effects of βcarotene supplement on carotenoid contents in carapace,ovaries and hepatopancreas of female Portunus trituberculatus (dry matter) mg/kg
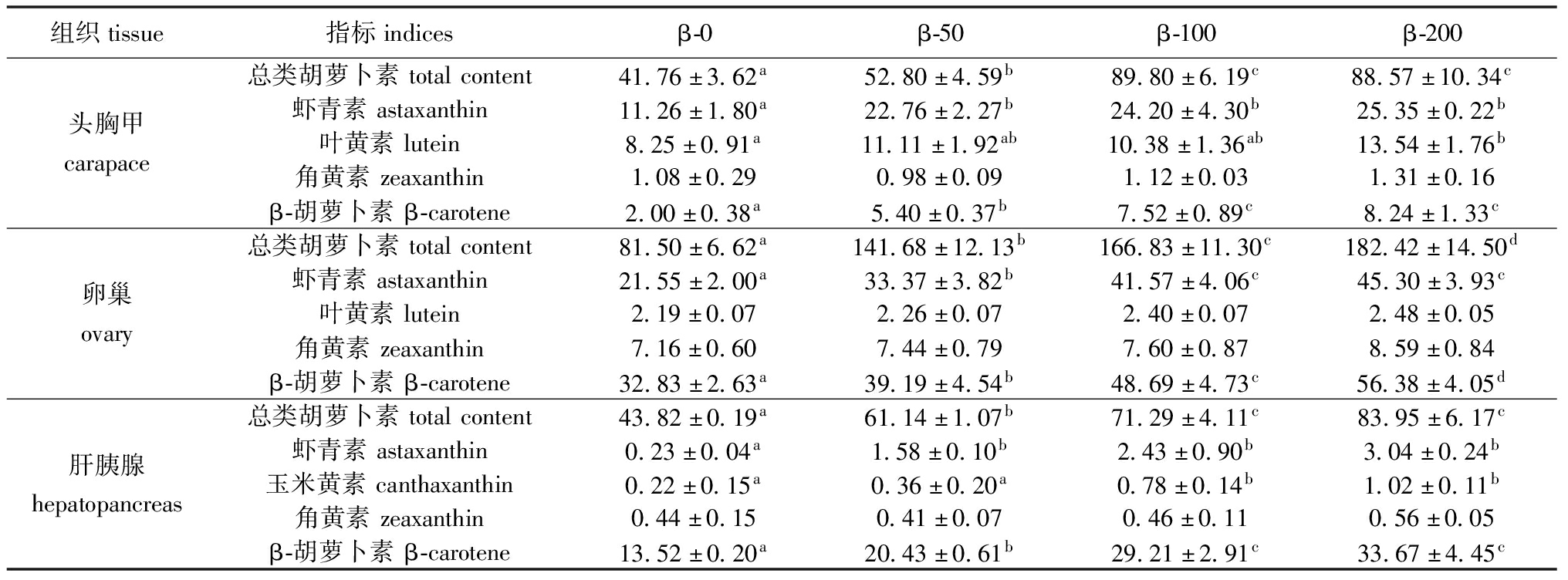
组织tissue指标indicesβ-0β-50β-100β-200总类胡萝卜素totalcontent41.76±3.62a52.80±4.59b89.80±6.19c88.57±10.34c虾青素astaxanthin11.26±1.80a22.76±2.27b24.20±4.30b25.35±0.22b头胸甲carapace叶黄素lutein8.25±0.91a11.11±1.92ab10.38±1.36ab13.54±1.76b角黄素zeaxanthin1.08±0.290.98±0.091.12±0.031.31±0.16β-胡萝卜素β-carotene2.00±0.38a5.40±0.37b7.52±0.89c8.24±1.33c总类胡萝卜素totalcontent81.50±6.62a141.68±12.13b166.83±11.30c182.42±14.50d虾青素astaxanthin21.55±2.00a33.37±3.82b41.57±4.06c45.30±3.93c卵巢ovary叶黄素lutein2.19±0.072.26±0.072.40±0.072.48±0.05角黄素zeaxanthin7.16±0.607.44±0.797.60±0.878.59±0.84β-胡萝卜素β-carotene32.83±2.63a39.19±4.54b48.69±4.73c56.38±4.05d总类胡萝卜素totalcontent43.82±0.19a61.14±1.07b71.29±4.11c83.95±6.17c虾青素astaxanthin0.23±0.04a1.58±0.10b2.43±0.90b3.04±0.24b肝胰腺hepatopancreas玉米黄素canthaxanthin0.22±0.15a0.36±0.20a0.78±0.14b1.02±0.11b角黄素zeaxanthin0.44±0.150.41±0.070.46±0.110.56±0.05β-胡萝卜素β-carotene13.52±0.20a20.43±0.61b29.21±2.91c33.67±4.45c
3 讨论
3.1 生长性能及性腺发育分析
饲料中添加β-胡萝卜素对甲壳动物生长性能的影响已有相关研究。Boonyaratpalin等[19]和Harpaz等[20]的研究表明,饲料中添加β-胡萝卜素对斑节对虾(Penaeus monodon)和红螯螯虾(Cherax quadricarinatus)等甲壳动物的生长性能改善效果有限。然而Supamattaya等[12]和Niu等[21]在后续的研究中揭示了饲料中添加藻源天然β-胡萝卜素可以显著提升斑节对虾的养殖性能。与之类似,Yamada等[22]和Chien等[23]的研究也发现饲料中添加β-胡萝卜素能有效提升日本对虾(Penaeus japonicus)的养殖性能。这些不一致的研究结果可能与多种因素有关,包括不同的养殖条件(如水温、盐度、pH值和养殖密度)、养殖阶段、物种对β-胡萝卜素的具体需求量及β-胡萝卜素的来源[2]。此外,水生动物种类的差异也可能导致类胡萝卜素代谢途径存在差异,进而影响了β-胡萝卜素对生长性能的提升效果[24]。性腺和肝胰腺是成熟梭子蟹的关键食用部位,本研究中并未因饲料中β-胡萝卜素的添加而显著改变其性腺指数(GSI)和肝胰腺指数(HSI),这一观察结果与前期中华绒螯蟹(Eriocheir sinensis)[25]和梭子蟹[26]的研究报道相吻合。
3.2 免疫及抗氧化性能分析
多种抗氧化酶在维护生物体复杂的免疫系统中扮演着关键角色,它们构成了抵御自由基的首道酶防御屏障。总抗氧化能力是衡量机体抗氧化系统整体功能状态的重要指标[27],而丙二醛则是脂质过氧化反应的常见终产物,其含量能准确反映脂质过氧化的程度[28]。本研究中发现,随着β-胡萝卜素添加量的递增,肝胰腺和血淋巴中的总抗氧化能力水平呈现出“低-高-低”的波动趋势,其中β-100组总抗氧化能力水平达到峰值。然而,血淋巴中的丙二醛含量却随着β-胡萝卜素添加量的增加(0~100 mg/kg)而逐渐降低,但当β-胡萝卜素添加量为200 mg/kg时,丙二醛水平却上升异常。这些结果表明,适量添加β-胡萝卜素(约100 mg/kg)有助于维持梭子蟹体内活性氧(ROS)与机体抗氧化活性的平衡状态,然而过量添加β-胡萝卜素可能削弱机体的抗氧化能力,并可能带来潜在的毒性风险[29]。根据Stahl等[30]的研究,类胡萝卜素的抗氧化作用主要基于其熄灭单线态氧和捕捉过氧基自由基的能力,能有效预防脂质过氧化。类胡萝卜素与过氧基自由基的相互作用可能通过形成不稳定的β-胡萝卜素自由基加合物进行,该加合物因其高度的共振稳定性而具有较低的反应性[31]。在β-200饲料组中,抗氧化能力的降低可能是由于高量类胡萝卜素分解产物在抗氧化过程中产生的氧化攻击,进而损害了线粒体功能[32],这一假设尚需进一步验证。
鉴于甲壳动物缺乏适应性免疫系统,它们依赖于体液和细胞固有的免疫反应来抵御外来微生物的侵袭[33]。碱性磷酸酶和酸性磷酸酶作为甲壳动物体液免疫中的关键磷酸酶,其活性直接反映了甲壳动物的免疫状态[34]。本研究中β-100饲料组显著提高了肝胰腺碱性磷酸酶活性和血淋巴酸性磷酸酶活性,这表明β-胡萝卜素对梭子蟹的免疫健康具有积极效应。这种免疫力的提升与前期在其他甲壳动物物种的研究结果相吻合,如斑节对虾[8]和南美白对虾(Litopenaeus vannamei)[9]。溶菌酶是水产动物体内一种重要的非特异性防御因子,广泛存在于体内多种组织和体液中,其能够水解革兰氏阳性细菌的细胞壁黏性多肽中的乙酰氨基多糖,并使之裂解被释放出来,形成一个水解酶体系,破坏和消除侵入体内的异物,从而担负起机体防御的功能[10]。王军辉等[35]研究表明,在饵料中添加虾青素可以显著改善锦鲤(Cyprinus carpio L.)溶菌酶活性等体液指标,而本试验研究结果显示,各β-胡萝卜素添加组血清中溶菌酶活性未明显增加,这可能是由于不同种类的类胡萝卜素对溶菌酶活性的影响差别较大所造成。
3.3 色泽及类胡萝卜素组成分析
甲壳动物对类胡萝卜素具有较强的依赖性,它们具备将大量此类物质高效存储或转化为虾青素并沉积在头胸甲、卵巢和肝胰腺等特定组织中的能力[36]。在本研究中,当梭子蟹摄食含有50~200 mg/kg β-胡萝卜素的饲料后,其组织中虾青素浓度显著增长,这直接印证了它们将β-胡萝卜素转化为虾青素的强大代谢机制。值得注意的是,随着β-胡萝卜素添加量从0 mg/kg增加至100 mg/kg,头胸甲和肝胰腺中的类胡萝卜素浓度显著上升,但进一步增加β-胡萝卜素添加量后,其浓度趋于稳定。这一趋势可能表明,一旦组织中类胡萝卜素沉积量达到阈值或达到饱和状态,额外的类胡萝卜素将难以被利用或可能被分解,因此组织中的类胡萝卜素总量不再增加[22]。然而,与头胸甲和肝胰腺中类胡萝卜素浓度的稳定状态形成鲜明对比的是,卵巢中的类胡萝卜素含量在β-200饲料组中仍呈现出持续增长的趋势。这种类胡萝卜素沉积效率的差异可能与甲壳动物肝胰腺的功能相关,这些功能包括营养物质的消化、吸收、储存及解毒等。这一发现为进一步理解甲壳动物对类胡萝卜素的利用机制提供了新的视角。
为提升经济甲壳动物的体表及组织色泽,β-胡萝卜素常作为一种重要的着色剂添加至配合饲料中,进而提升它们的整体品质和市场价值。据Boonyaratpalin等[19]的研究报道,相较于50 mg/kg的虾青素,175 mg/kg的β-胡萝卜素在促进斑节对虾色素沉积方面展现出了更高的效率。此外,Supamattaya等[12]的研究也观察到,当饲料中β-胡萝卜素的含量达到200~300 mg/kg时,斑节对虾的头胸甲色泽提升显著。这些研究结果与本研究中发现相互印证,即在饲料中添加50~100 mg/kg的β-胡萝卜素能有效促进成熟梭子蟹头胸甲和肝胰腺的色素沉积。尤为重要的是,随着饲料中β-胡萝卜素添加量的增加,卵巢和肝胰腺的红度值(a*)及虾青素含量也同步上升,这表明增强的红度不仅仅源于β-胡萝卜素的直接作用,更有一部分是由于β-胡萝卜素在体内转化为虾青素所产生的间接作用。
4 结论
1)向饲料中添加50~200 mg/kg β-胡萝卜素对梭子蟹雌体的生长性能和性腺发育影响较小。
2)饲料中添加适量β-胡萝卜素(50~100 mg/kg)可以显著提高梭子蟹免疫及抗氧化性能,但过量的β-胡萝卜素(200 mg/kg)对机体免疫及抗氧化性能有不利影响。
3)饲料中添加β-胡萝卜素极大地促进了蟹壳、卵巢及肝胰腺中虾青素与β-胡萝卜素的累积,同时卵巢和肝胰腺的红度值(a*)与黄度值(b*)均得到了显著提升。
4)综合考虑梭子蟹成熟雌体生长性能、抗氧化性能、非特异性免疫及色泽优化等多方面需求,建议梭子蟹育肥饲料中β-胡萝卜素最适添加量为100 mg/kg左右。
[1] DALY B,SWINGLE J S,ECKERT G.Dietary astaxanthin supplementation for hatchery-cultured red king crab,Paralithodes camtschaticus,juveniles[J].Aquaculture Nutrition,2013,19:312-320.
[2] WADE N M,GABAUDAN J,GLENCROSS B D.A review of carotenoid utilisation and function in crustacean aquaculture[J].Reviews in Aquaculture,2017,9(2):141-156.
[3] 吴丹华,郑萍萍,张玉玉,等.温度胁迫对三疣梭子蟹血清中非特异性免疫因子的影响[J].大连海洋大学学报,2010,25(4):370-375.WU D H,ZHENG P P,ZHANG Y Y,et al.Effect of temperature stress on serum non-specific immune factors in swimming crab Portunus trituberculatus[J].Journal of Dalian Ocean University,2010,25(4):370-375.(in Chinese)
[4] 隋延鸣,高保全,刘萍,等.三疣梭子蟹“黄选1号” 盐度耐受性及适宜生长盐度分析[J].大连海洋大学学报,2012,27(5):398-401.SUI Y M,GAO B Q,LIU P,et al.The tolerance to and optimal salinity for growth in swimming crab Portunus trituberculatus “Huangxuan No.1”[J].Journal of Dalian Ocean University,2012,27(5):398-401.(in Chinese)
[5] 韩晓琳,王好锋,高保全,等.低盐度对不同三疣梭子蟹群体幼蟹发育的影响[J].大连海洋大学学报,2014,29(1):31-34.HAN X L,WANG H F,GAO B Q,et al.Effects of low salinity on development of juveniles in different groups of swimming crab Portunus trituberculatus[J].Journal of Dalian Ocean University,2014,29(1):31-34.(in Chinese)
[6] WEI J J,ZHANG F,TIAN W J,et al.Effects of dietary folic acid on growth,antioxidant capacity,non-specific immune response and disease resistance of juvenile Chinese mitten crab Eriocheir sinensis(Milne-Edwards,1853)[J].Aquaculture Nutrition,2016,22(3):567-574.
[7] 伍先绍,贺稚非,龚霄.杜氏盐藻及其在功能食品中的应用[J].中国食品添加剂,2008(2):127-130.WU X S,HE Z F,GONG X.Dunaliella salina and its application in foods[J].China Food Additives,2008(2):127-130.(in Chinese)
[8] MADHUMATHI M,RENGASAMY R.Antioxidant status of Penaeus monodon fed with Dunaliella salina supplemented diet and resistance against WSSV[J].International Journal of Engineering Science and Technology,2011,3:7249-7259.
[9] MEDINA F LIX D,L
LIX D,L PEZ EL
PEZ EL AS J A,CAMPA C
AS J A,CAMPA C RDOVA
RDOVA  I,et al.Survival of Litopenaeus vannamei shrimp fed on diets supplemented with Dunaliella sp.is improved after challenges by Vibrio parahaemolyticus[J].Journal of Invertebrate Pathology,2017,148:118-123.
I,et al.Survival of Litopenaeus vannamei shrimp fed on diets supplemented with Dunaliella sp.is improved after challenges by Vibrio parahaemolyticus[J].Journal of Invertebrate Pathology,2017,148:118-123.
[10] HAN T,LI X Y,WANG J T,et al.Effects of dietary astaxanthin (AX) supplementation on pigmentation,antioxidant capacity and nutritional value of swimming crab,Portunus trituberculatus[J].Aquaculture,2018,490:169-177.
[11] ZHANG R Y,ZHANG L,JIANG X D,et al.Effects of dietary β-carotene on color and flavor quality of ovaries in adult female Chinese mitten crab (Eriocheir sinensis)[J].eFood,2024,5(4):e169.
[12] SUPAMATTAYA K,KIRIRATNIKOM S,BOONYARATPALIN M,et al.Effect of a Dunaliella extract on growth performance,health condition,immune response and disease resistance in black tiger shrimp (Penaeus monodon)[J].Aquaculture,2005,248(1/2/3/4):207-216.
[13] 张鑫,韩蓓,胡俊涛,等.豆粕替代鱼粉对乌鳢生长性能、蛋白质利用及肠道组织形态的影响[J].动物营养学报,2020,32(6):2799-2807.ZHANG X,HAN B,HU J C,et al.Effects of replacement of fish meal by soybean meal on growth performance,protein utilization and intestinal tissue morphology of Channa argus[J].Chinese Journal of Animal Nutrition,2020,32(6):2799-2807.(in Chinese)
[14] AOA C.Official methods of analysis[C]//Gait Hersburg,Maryland,USA:Association of Official Analytical Chemists,2000.
[15] FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J].The Journal of Biological Chemistry,1957,226(1):497-509.
[16] JOHNSTON I A,ALDERSON R,SANDHAM C,et al.Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.)[J].Aquaculture,2000,189(3/4):335-349.
[17] LONG X W,WU X G,ZHAO L,et al.Effects of dietary supplementation with Haematococcus pluvialis cell powder on coloration,ovarian development and antioxidation capacity of adult female Chinese mitten crab,Eriocheir sinensis[J].Aquaculture,2017,473:545-553.
[18] LE N K,MERY D,PEDRESCHI F,et al.Color measurement in Lab units from RGB digital images[J].Food Research International,2006,39(10):1084-1091.
N K,MERY D,PEDRESCHI F,et al.Color measurement in Lab units from RGB digital images[J].Food Research International,2006,39(10):1084-1091.
[19] BOONYARATPALIN M,THONGROD S,SUPAMATTAYA K,et al.Effects of β-carotene source,Dunaliella salina,and astaxanthin on pigmentation,growth,survival and health of Penaeus monodon[J].Aquaculture Research,2001,32:182-190.
[20] HARPAZ S,RISE M S,ARAD S M,et al.The effect of three carotenoid sources on growth and pigmentation of juvenile freshwater crayfish Cherax quadricarinatus[J].Aquaculture Nutrition,1998,4(3):201-208.
[21] NIU J,WEN H,LI C H,et al.Comparison effect of dietary astaxanthin and β-carotene in the presence and absence of cholesterol supplementation on growth performance,antioxidant capacity and gene expression of Penaeus monodon under normoxia and hypoxia condition[J].Aquaculture,2014,422:8-17.
[22] YAMADA S,TANAKA Y,SAMESHIMA M,et al.Pigmentation of prawn (Penaeus japonicus) with carotenoids I.Effect of dietary astaxanthin,β-carotene and canthaxanthin on pigmentation[J].Aquaculture,1990,87(3/4):323-330.
[23] CHIEN Y H,JENG S C.Pigmentation of kuruma prawn,Penaeus japonicus Bate,by various pigment sources and levels and feeding regimes[J].Aquaculture,1992,102(4):333-346.
[24] ZHANG J,LIU Y J,TIAN L X,et al.Effects of dietary astaxanthin on growth,antioxidant capacity and gene expression in Pacific white shrimp Litopenaeus vannamei[J].Aquaculture Nutrition,2013,19(6):917-927.
[25] 麻楠,龙晓文,赵磊,等.饲料中添加合成虾青素对中华绒螯蟹成体雌蟹性腺发育、色泽和抗氧化能力的影响[J].水生生物学报,2017,41(4):755-765.MA N,LONG X W,ZHAO L,et al.Effects of dietary supplementation of synthetic astaxanthin on ovarian development,coloration and antioxidant capacity of adult female Chinese mitten crab,Eriocheir sinensis[J].Acta Hydrobiologica Sinica,2017,41(4):755-765.(in Chinese)
[26] 吴仁福,龙晓文,侯文杰,等.饲料中添加雨生红球藻粉对三疣梭子蟹雌体卵巢发育、色泽、抗氧化能力和生化组成的影响[J].水生生物学报,2018,42(4):698-708.WU R F,LONG X W,HOU W J,et al.Effects of dietary supplementation with haematococcus pluvialis powder on ovarian development,coloration,antioxidant capacity and biochemical composition of adult female swimming crab,portunus trituberculatus[J].Acta Hydrobiologica Sinica,2018,42(4):698-708.(in Chinese)
[27] 崔惟东,冷向军,李小勤,等.虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J].水产学报,2009,33(6):987-995.CUI W D,LENG X J,LI X Q,et al.Effects of astaxanthin and canthaxanthin on pigmentation of muscle and total antioxidant capacity of liver in rainbow trout (Oncorhynchus mykiss)[J].Journal of Fisheries of China,2009,33(6):987-995.(in Chinese)
[28] DEVASENA T,LALITHA S,PADMA K.Lipid peroxidation,osmotic fragility and antioxidant status in children with acute post-streptococcal glomerulonephritis[J].Clinica Chimica Acta,2001,308(1/2):155-161.
[29] HALLIWELL B.Role of free radicals in the neurodegenerative diseases:therapeutic implications for antioxidant treatment[J].Drugs &Aging,2001,18(9):685-716.
[30] STAHL W,SIES H.Antioxidant activity of carotenoids[J].Molecular Aspects of Medicine,2003,24(6):345-351.
[31] RICE-EVANS C A,SAMPSON J,BRAMLEY P M,et al.Why do we expect carotenoids to be antioxidants in vivo?[J].Free Radical Research,1997,26(4):381-398.
[32] SIEMS W,WISWEDEL I,SALERNO C,et al.β-Carotene breakdown products may impair mitochondrial functions-potential side effects of high-dose β-carotene supplementation[J].The Journal of Nutritional Biochemistry,2005,16(7):385-397.
[33] CHEN F Y,WANG K J.Characterization of the innate immunity in the mud crab Scylla paramamosain[J].Fish &Shellfish Immunology,2019,93:436-448.
[34] XUE Q,RENAULT T.Enzymatic activities in European flat oyster,Ostrea edulis,and Pacific oyster,Crassostrea gigas,hemolymph[J].Journal of Invertebrate Pathology,2000,76(3):155-163.
[35] 王军辉,熊建利,张东洋,等.饲料中添加虾青素对锦鲤生长、体色、抗氧化能力和免疫力的影响[J].动物营养学报,2019,31(9):4144-4151.WANG J H,XIONG J L,ZHANG D Y,et al.Effects of sstaxanthin supplementation on growth,body color,antioxidant capability and immunity of Kio Carp(Cyprinus carpio L.)[J].Chinese Journal of Animal Nutrition,2019,31(9):4144-4151.(in Chinese)
[36] BABIN A,MOREAU J,MORET Y.Storage of carotenoids in crustaceans as an adaptation to modulate immunopathology and optimize immunological and life-history strategies[J].BioEssays:News and Reviews in Molecular,Cellular and Developmental Biology,2019,41(11):e1800254.