金鱼(Carassius auratus)属鲤形目鲤科鲫属,因体色艳丽、适应性强,现成为水族市场最受欢迎的观赏鱼之一[1]。随着观赏鱼交易的不断发展,运输胁迫引起的鱼类应激反应及减缓应激措施引起研究者的关注。运输时长是影响鱼类应激反应的重要因素之一,斑点叉尾鮰(Ictalurus punctatus)幼鱼经过12 h的模拟运输后血糖和皮质醇含量显著升高,鳃、皮肤和肠道结构受到损伤[2]。大口黑鲈(Micropterus salmoides)幼鱼在运输6 h后,肝细胞中出现空泡,运输12 h后空泡化更严重,且随着运输时间的延长,其肝脏和肠道中的SOD活性与对照组相比显著降低[3]。
芦荟(Aloe vera)属百合科植物,含有丰富的生物活性物质,如芦荟多糖和芦荟苷等,具有维持血糖稳定、抗菌和清除自由基等作用[4-6]。用芦荟多糖对斑马鱼(Danio rerio)进行药浴可以促进其断尾再生并起到抗炎的作用[7]。在运输头石脂鲤(Brycon cephalus)的水中添加芦荟粉可以提高其白细胞呼吸活性,增强其免疫力[8]。Vanderzwalmen 等[9]研究表明,芦荟可降低孔雀鱼(Poecilia reticulata)在运输中的啃咬行为。
目前,有关芦荟在鱼类中的应用研究多侧重于食用鱼,且多集中于饲料中添加芦荟成分研究,对于在水中添加芦荟提取物能否通过影响鱼类行为和各项生理指标来达到减缓观赏鱼运输应激效果的研究较为缺乏。本研究中对不同运输胁迫时间后金鱼的死亡率和行为进行分析,确定对金鱼造成明显应激的运输时间,并通过在运输水体中添加芦荟提取物后金鱼行为和生理指标的变化趋势揭示其对运输胁迫下金鱼抗应激能力的影响,以期为提高观赏鱼运输福利、优化运输方案提供有益参考。
1 材料与方法
1.1 材料
1.1.1 试验金鱼 试验鱼为购自北京某渔场体况健康的金鱼(草种),体长为(6.04±0.76)cm,体质量为(2.15±0.62)g。试验正式开始前将金鱼暂养1 d,水温控制在22 ℃±1 ℃。养殖用水为提前充分曝气的自来水,缸内配置空气泵持续供氧,并采用小型过滤装置保证暂养期间水体的溶解氧含量大于6 mg/L、氨氮含量小于0.2 mg/L。暂养期间每日9:30和17:30分别投喂专用观赏鱼颗粒饲料,采取自然光照,不额外添加照明装置,明暗时间比为12∶12,试验开始前24 h禁食。
1.1.2 主要仪器 高速冷冻离心机(型号为Biofuge Stratos)购自美国ThermoFisher Scientific公司;酶标仪(型号为HT)购自美国Gene Company Limitied公司;紫外分光光度计(型号为2100 pro)购自美国Biochrom公司。
1.2 方法
1.2.1 模拟运输胁迫时间对金鱼行为的影响 设置5个处理组,分别为运输2、4、6、12、24 h,记作T2、T4、T6、T12、T24组。每个处理组设置4次重复,每个重复放置5尾金鱼。以10尾/盒的密度将其转移至塑料密封盒中,盒中水和氧气的比例约为1∶3,水为提前充分曝气且溶氧量和氨氮含量均符合标准的水。将塑料密封盒置于摇床上以50 r/min的速度进行模拟运输。运输完成后,将金鱼迅速转入玻璃缸内饲养96 h,除暂养的前24 h禁食外,每日9:30和17:30分别投喂专用观赏鱼颗粒饲料1次,每24 h更换1次新水并记录死亡率,在运输完成1 h后进行录像用于行为分析,试验设计见图1。
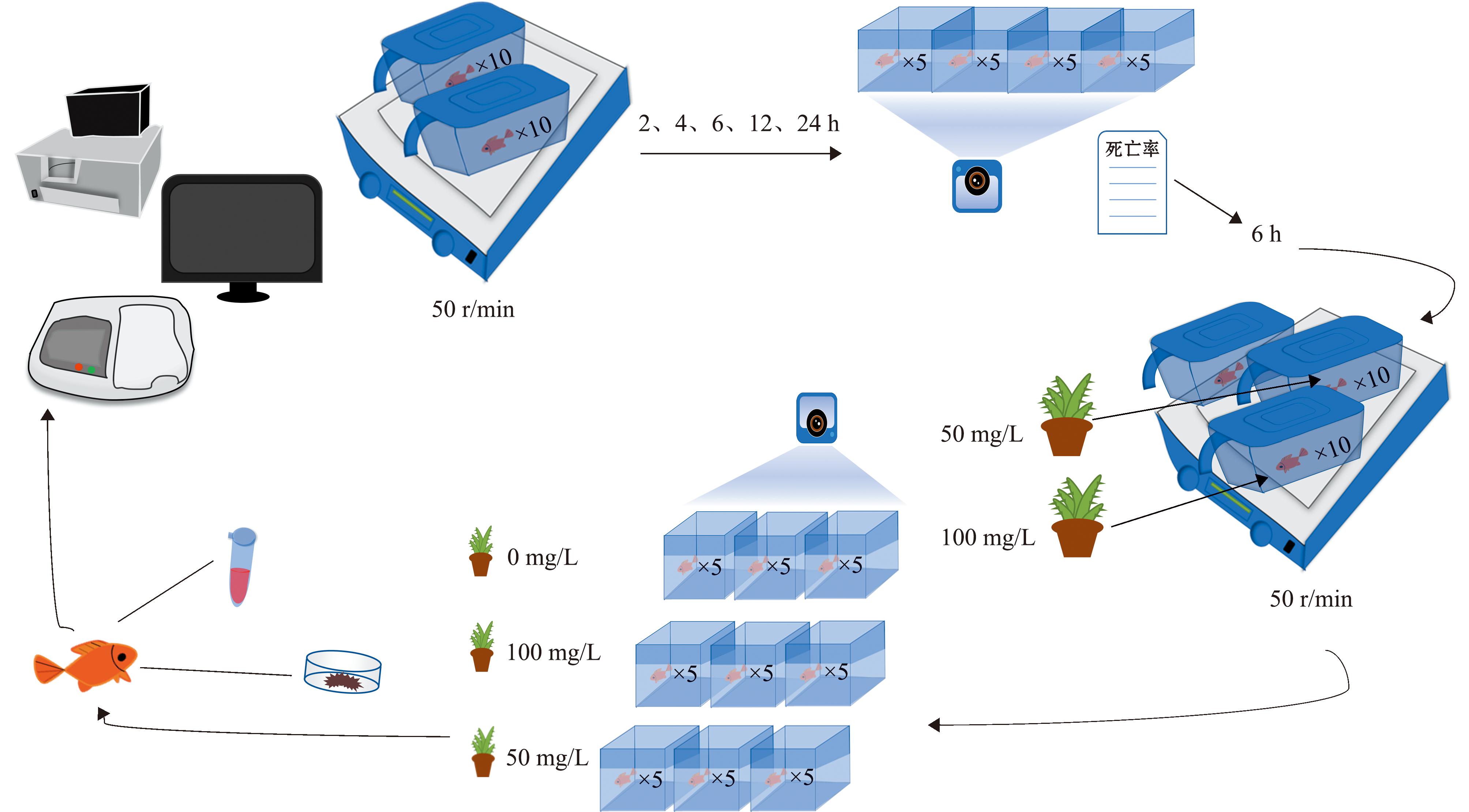
图1 试验设计
Fig.1 Experimental design
1.2.2 最大非致死浓度(MNLC)的计算 试验用芦荟提取物购自陕西米先尔生物科技有限公司。分别选择50、100、150、200、250、300 mg/L的芦荟提取物添加浓度,每个浓度组设置3组重复,每个重复放置5尾鱼。试验期间观察鱼的发病和死亡情况,及时捞出死亡个体,并记录48 h死亡率,通过曲线拟合算出药物的最大非致死浓度(maximum non-lethal concentration,MNLC)。
1.2.3 水中添加芦荟提取物对运输胁迫下金鱼行为和生理指标的影响 根据最大非致死浓度(MNLC)的计算结果,试验设置3个处理组,分别为对照组、添加50 mg/L芦荟提取物组和100 mg/L芦荟提取物组,记作C、T50、T100。每个处理组设置3次重复,每个重复放置5尾金鱼。运输6 h后,将每个密封盒中的金鱼随机挑选5尾进行血液和组织采样,剩余的5尾金鱼迅速转入玻璃缸内饲养24 h以观察行为和死亡率,24 h饲养结束后进行血液和组织取样。
1.2.4 行为观察 对需要进行行为观察和分析的金鱼,每日录像30 min并随机在每段视频中选取5 min,根据行为谱进行行为的分类记录。行为谱设定参考Vanderzwalmen等[10-11]和Jones等[12]的行为研究,具体金鱼行为谱见表1。
表1 金鱼行为谱
Tab.1 Behavior spectrum of golden fish
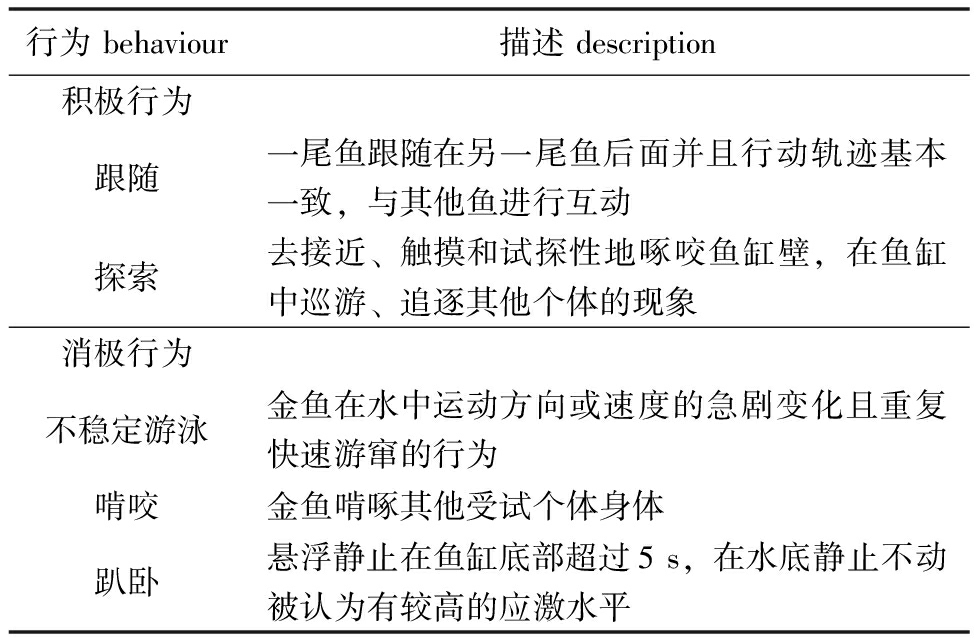
行为behaviour描述description积极行为跟随一尾鱼跟随在另一尾鱼后面并且行动轨迹基本一致,与其他鱼进行互动探索去接近、触摸和试探性地啄咬鱼缸壁,在鱼缸中巡游、追逐其他个体的现象消极行为不稳定游泳金鱼在水中运动方向或速度的急剧变化且重复快速游窜的行为啃咬金鱼啃啄其他受试个体身体趴卧悬浮静止在鱼缸底部超过5s,在水底静止不动被认为有较高的应激水平
1.2.5 血糖(GLU)的测定 各处理组的金鱼麻醉后在尾静脉处进行等量采血,4 ℃下以1 200 r/min离心15 min,收集上清液。采用南京建成生物工程研究所的葡萄糖含量测定试剂盒进行测定。
1.2.6 皮质醇(COR)的测定 各处理组的金鱼麻醉后在尾静脉处进行等量采血,4 ℃下以1 200 r/min离心15 min,收集上清液。采用江苏酶免实业有限公司的皮质醇含量测定试剂盒进行测定。
1.2.7 乳酸(LD)的测定 用眼科剪剪下麻醉后金鱼的背部肌肉,用0.65%的生理盐水冲洗干净。以1 g组织∶9 mL生理盐水的比例在冰上匀质得到10%质量分数的匀浆液,后在4 ℃下以4 000 r/min离心10 min,收集上清液。采用南京建成生物工程研究所的乳酸含量测定试剂盒进行测定。
1.2.8 超氧化物歧化酶(SOD)的测定 用眼科剪剪下麻醉后金鱼的鳃,用解剖针分离出肝组织,用0.65%的生理盐水冲洗干净。以1 g组织∶9 mL生理盐水的比例在冰上匀质得到10%质量分数的匀浆液,后在4 ℃下以4 000 r/min离心10 min,收集上清液。采用南京建成生物工程研究所的SOD含量测定试剂盒进行测定。
1.2.9 丙二醛(MDA)的测定 用眼科剪剪下麻醉后金鱼的鳃,用解剖针分离出肝组织,用0.65%的生理盐水冲洗干净。以1 g组织∶9 mL生理盐水的比例在冰上匀质得到10%质量分数的匀浆液,后在4 ℃下以4 000 r/min离心10 min,收集上清液。采用南京建成生物工程研究所的丙二醛含量测定试剂盒进行测定。
1.2.10 溶菌酶(lysozyme)的测定 体表黏液的收集和保存采用Subramanian等[13]的方法。采用南京建成生物工程研究所的溶菌酶含量测定试剂盒进行测定。
1.3 数据处理
试验数据的预处理均采用 Excel 2021软件,所采用的统计工具为 SPSS 23.0 软件,通过单因素方差分析和LSD(Least Significant Difference)多重比较分析不同胁迫时间及不同药物添加浓度对金鱼死亡率、行为特征及各项生理指标的影响,采用独立样本t检验方法分析运输0 h和24 h时金鱼各项生理指标的变化。试验结果以平均值±标准误(mean±S.E.)表示,显著性差异设为0.05。
2 结果与分析
2.1 运输胁迫时间对金鱼死亡率和行为的影响
从表2可见,模拟运输完成24 h时,各处理组均保持0%的死亡率;运输完成48 h时,除T2和T4组外各组死亡率均升高但未呈现显著性变化。运输完成72 h时,T2和T4组死亡率仍然保持0%,其他各处理组死亡率持续升高,T12和T24组死亡率显著高于T2组和T4组(P<0.05);运输完成96 h时,T2和T4组死亡率仍然保持0%,其他各处理组死亡率继续升高,T12和T24组的死亡率显著高于T2、T4和T6组(P<0.05)、T6组死亡率显著高于T2和T4组(P<0.05)。
表2 模拟运输胁迫时间对金鱼死亡率的影响
Tab.2 Effect of simulated transportation stress time on the death rate of goldfish %
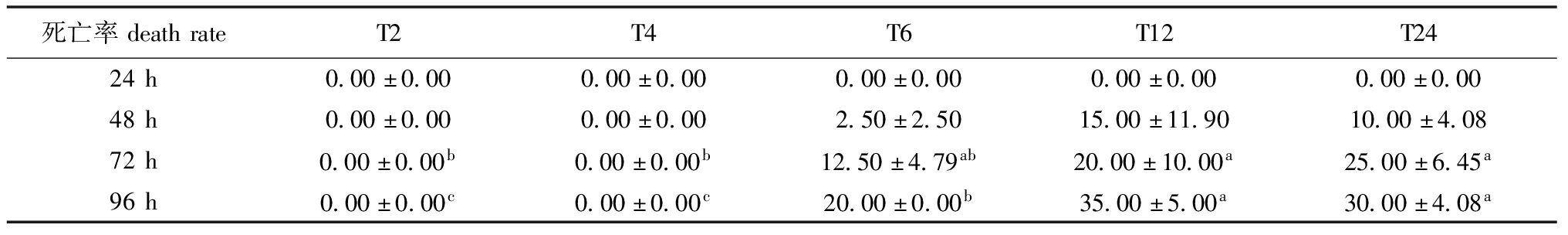
死亡率deathrateT2T4T6T12T2424h0.00±0.000.00±0.000.00±0.000.00±0.000.00±0.0048h0.00±0.000.00±0.002.50±2.5015.00±11.9010.00±4.0872h0.00±0.00b0.00±0.00b12.50±4.79ab20.00±10.00a25.00±6.45a96h0.00±0.00c0.00±0.00c20.00±0.00b35.00±5.00a30.00±4.08a
注:同行标有不同字母表示同一时间下不同组间有显著性差异(P<0.05)。
Note:Values with superscript letters in the same line indicate significant difference among different groups at the same time(P<0.05).
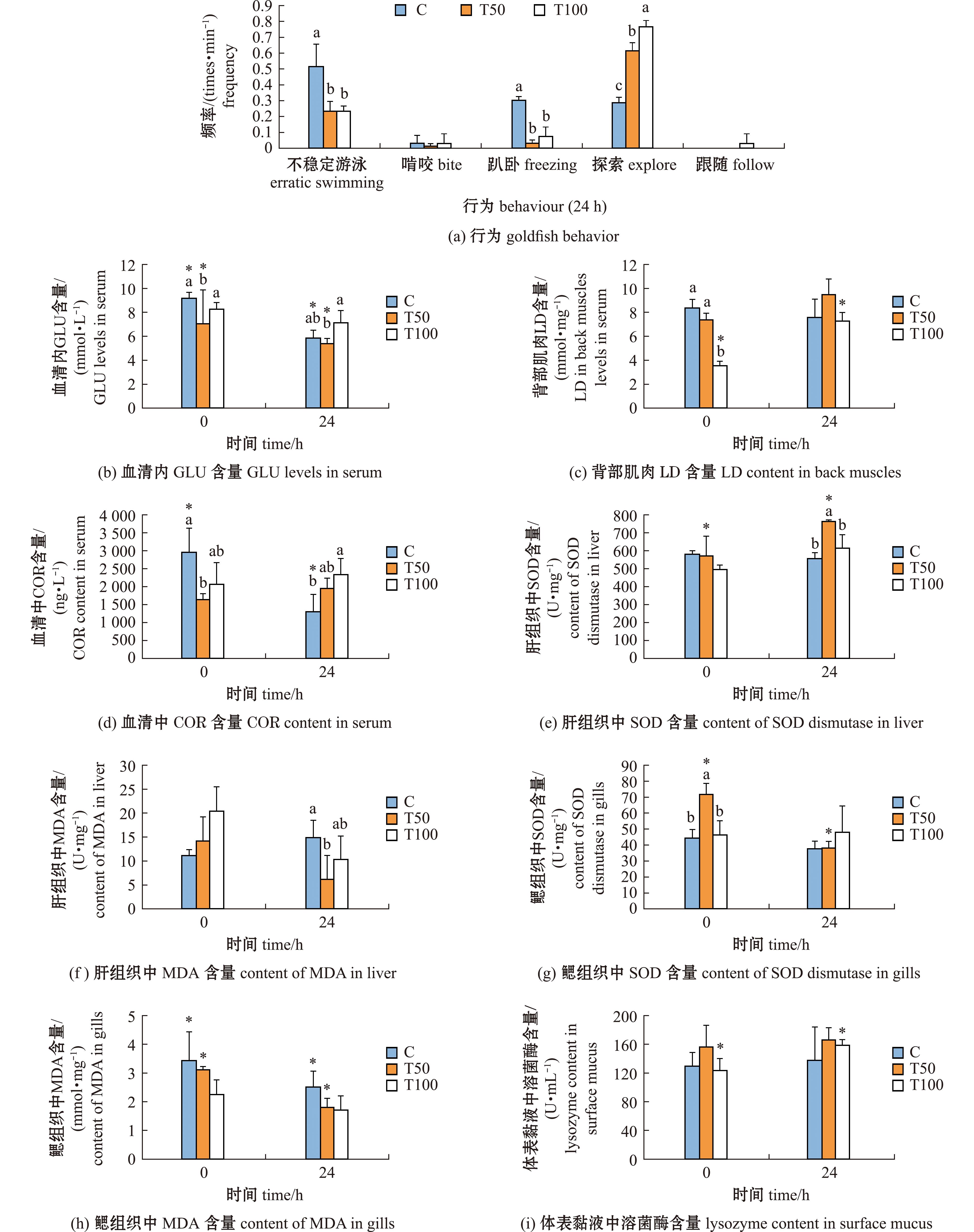
不同运输胁迫时间对金鱼的行为影响如图2所示。根据单因素方差分析,发现运输胁迫时间对金鱼不稳定游泳、趴卧和跟随行为有显著性影响(P<0.05)。根据LSD多重比较结果显示,T12组不稳定游泳行为显著高于T2、T4、T6组(P<0.05);T24组不稳定游泳行为显著高于T2、T4、T6、T12组(P<0.05)。T6和T12组的趴卧行为高于其余试验组,且各组间无显著性差异(P<0.05)。T6和T12组的趴卧行为显著高于T2组(P<0.05)。跟随行为T4组显著高于T2、T6、T12和T24组(P<0.05)。综合比较行为分析结果可以得出,T2组在行为表现上优于其他各组,T6和T12组在趴卧次数明显增多,T12和T24组不稳定游泳次数增多,说明金鱼处于紧张应激状态中,运输6 h以上会使金鱼出现明显应激表现。
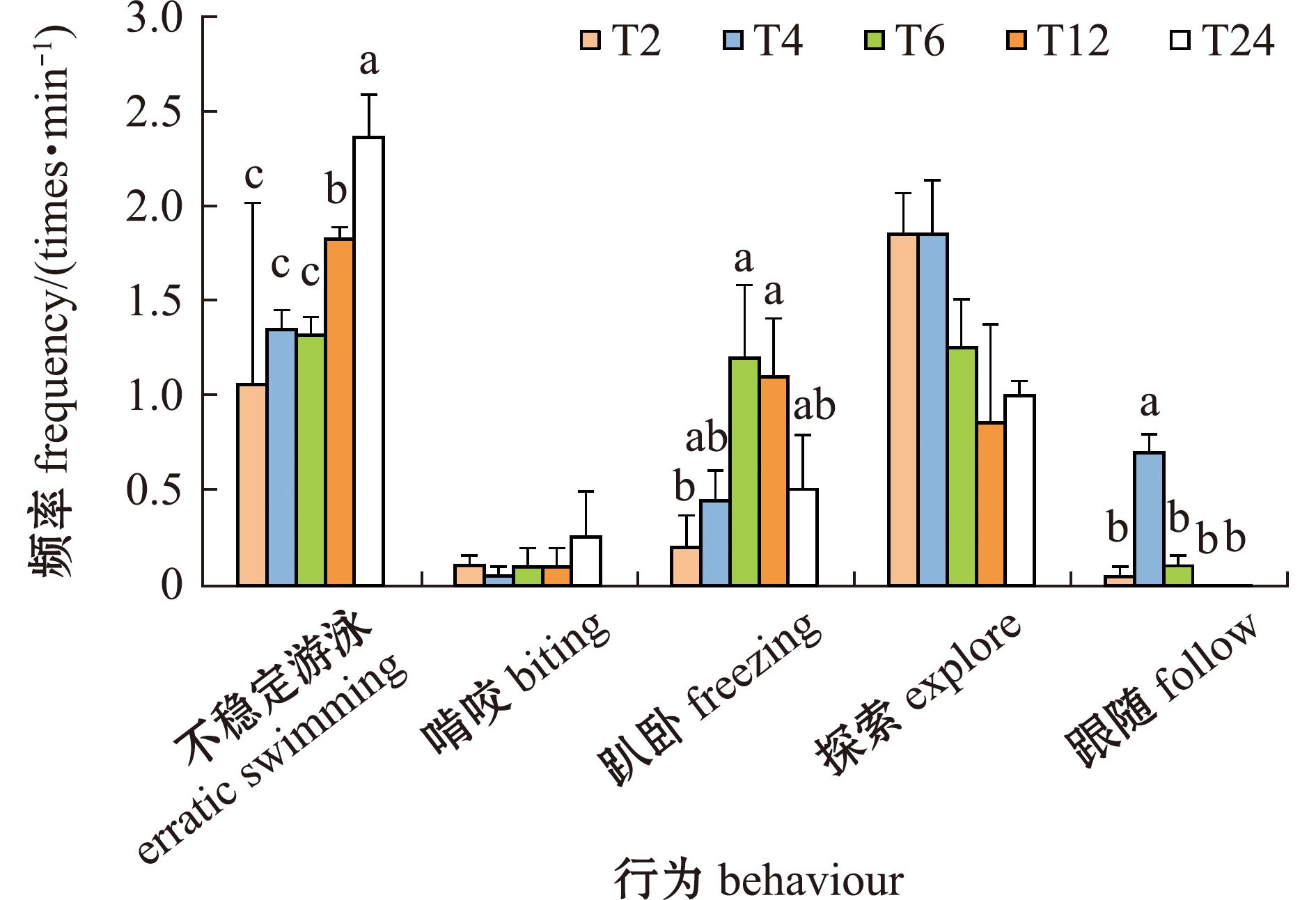
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters within the same column are significant differences in different group at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
图2 不同模拟运输胁迫时间对金鱼行为的影响
Fig.2 Effect of different simulated transportation stress times on behavior of goldfish
2.2 水中添加不同浓度的芦荟提取物对金鱼运输胁迫的影响
2.2.1 水中添加芦荟提取物对金鱼的最大非致死浓度(MNLC) 水中添加不同浓度芦荟提取物48 h后金鱼死亡率见表3,通过origin 2024软件未能拟合出符合标准的曲线,故选择100 mg/L作为芦荟提取物的MNLC。
表3 不同浓度芦荟提取物下金鱼的死亡率
Tab.3 Death rate of goldfish with different aloe vera concentrations
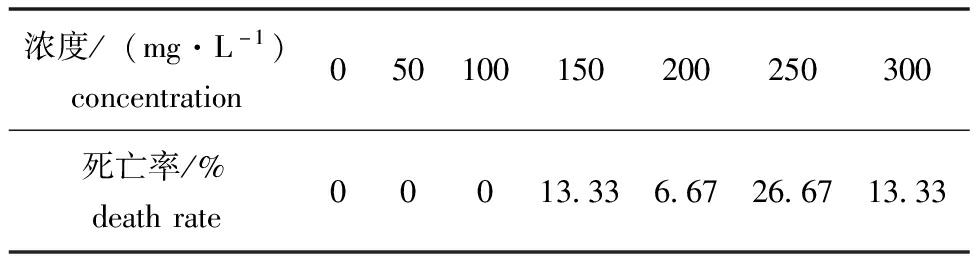
浓度/(mg·L-1)concentration050100150200250300死亡率/%deathrate00013.336.6726.6713.33
2.2.2 水中添加不同浓度芦荟提取物对金鱼行为的影响 不同浓度芦荟提取物对运输后金鱼的行为影响如图3(a)所示。运输完成0 h各组间金鱼均表现为趴卧行为,数据不具有统计意义。模拟运输完成24 h,T50和T100组金鱼与对照组相比不稳定游泳、趴卧次数显著降低(P<0.05),探索次数显著升高(P<0.05),同时,T100组金鱼的探索次数显著高于T50组(P<0.05)。
图中标有不同字母表示同一时间下不同组间有显著性差异(P<0.05),相同或无字母表示无显著性差异(P>0.05);*表示同一处理组内不同时间下有显著性差异(P<0.05)。
Different letters indicate significant differences between different groups at the same time (P<0.05),the same or no letters indicate no significant differences (P>0.05);* means significant differences within the same treatment group at different times (P<0.05).
图3 不同浓度芦荟提取物对金鱼行为和应激指标的影响
Fig.3 Effects of aloe vera with different concentrations on behavior and stress indicators in goldfish
2.2.3 水中添加不同浓度芦荟提取物对金鱼代谢的影响 不同浓度芦荟提取物对运输后金鱼血清中血糖含量影响如图3(b)所示。运输完成0 h,T50组金鱼的血糖含量与对照组相比显著降低(P<0.05),T100组与对照组相比无显著性差异。运输完成24 h,T50和T100组金鱼的血糖含量与对照组相比均无显著性差异,但T50组金鱼的血糖含量显著低于T100组(P<0.05)。与运输完成0 h相比,对照组和T50组的金鱼运输完成24 h血清中血糖含量显著降低(P<0.05)。
不同浓度芦荟提取物对运输后金鱼背部肌肉中乳酸含量影响如图3(c)所示。运输完成0 h,T100组的金鱼背部肌肉中乳酸含量与对照组相比显著降低(P<0.05),同时也显著低于T50组(P<0.05)。运输完成24 h,各处理组间乳酸含量无显著性差异,T100组的乳酸含量仍最低。与运输完成0 h相比,T100组金鱼运输完成24 h背部肌肉乳酸含量显著升高(P<0.05)。
不同浓度芦荟提取物对运输后金鱼血清中皮质醇含量影响如图3(d)所示。运输完成0 h,T50组的金鱼血清中皮质醇含量显著低于对照组。运输完成24 h,T100组金鱼血清中皮质醇含量显著高于对照组(P<0.05)。与运输完成0 h后相比,对照组金鱼运输完成24 h的血清皮质醇含量显著降低(P<0.05)。
2.2.4 水中添加不同浓度芦荟提取物对金鱼抗氧化能力的影响 不同浓度芦荟提取物对运输后金鱼肝组织中SOD含量影响如图3(e)所示。运输完成0 h,各组间金鱼肝组织中SOD含量无显著性差异。运输完成24 h,T50组的金鱼肝组织中的SOD含量与对照组和T100组相比显著升高(P<0.05)。与运输完成0 h相比,T50组金鱼运输完成24 h肝组织中SOD含量显著升高(P<0.05)。
不同浓度芦荟提取物对运输后金鱼肝组织中MDA含量影响如图3(f)所示。运输完成0 h,各组间金鱼肝组织中MDA的含量无显著性差异(P>0.05)。运输完成24 h,T50组的金鱼肝组织中的MDA含量与对照组相比显著降低(P<0.05)。各组间金鱼运输完成24 h的肝组织MDA含量与运输完成0 h无显著性差异(P>0.05)。
不同浓度芦荟提取物对运输后金鱼鳃组织中SOD含量影响如图3(g)所示。运输完成0 h,T50组的金鱼鳃组织中SOD含量与对照组和T100组相比显著升高(P<0.05)。运输完成24 h,各组间金鱼鳃组织中的SOD含量无显著性差异。与运输完成0 h相比,T50组金鱼运输完成24 h鳃组织中SOD含量显著降低(P<0.05)。
不同浓度芦荟提取物对运输后金鱼鳃组织中MDA含量影响如图3(h)所示。运输完成0 h以及运输完成24 h的各组金鱼鳃组织中MDA含量均与对照组相比无显著性差异(P>0.05),但可以发现,T50和T100组与对照组相比呈现下降的趋势。与运输完成0 h相比,对照组和T50组金鱼运输完成24 h的鳃组织中MDA含量显著降低(P<0.05)。
2.2.5 水中添加不同浓度芦荟提取物对金鱼体表黏液中溶菌酶的影响 不同浓度芦荟提取物对金鱼体表黏液中溶菌酶含量影响如图3(i)所示。运输完成0 h以及运输完成24 h各组间金鱼黏液中溶菌酶的含量均与对照组相比无显著性差异(P>0.05),但可以发现,T50和T100组呈上升的趋势。与运输完成0 h相比,T100组金鱼运输完成24 h体表黏液中溶菌酶含量显著升高(P<0.05)。
3 讨论
3.1 模拟不同运输胁迫时间对金鱼的影响
鱼类的运输通常在有限且密闭的空间内完成,随着运输时间的延长,水中溶氧量的减少,氨氮含量的增高,外界温度变化及个体碰撞带来的体表损伤等因素都会对鱼体造成运输胁迫并引起应激反应。王锦绣等[14]研究表明,大口黑鲈幼鱼运输0~12 h时不会对其存活率产生显著影响,但运输时间达20 h时,大口黑鲈幼鱼成活率显著下降。王文雯等[15]研究表明,运输12 h的高体鰤(Seriola dumerili)幼鱼成活率由100%下降至93.33%。将黑尾近红鲌(Ancherythroculter nigrocauda)以20 g/L密度运输10 h后存活率显著下降[16]。本研究的结果显示,随着运输时间延长至6 h,金鱼开始出现死亡的现象,运输时间延长至12 h以上,金鱼的死亡率在运输完成72 h和96 h后显著上升,与上述研究结果相似。
鱼类行为是一种评估福利的指标,是鱼类对压力和环境变化的反应[17]。在应激状态下鱼类会表现出更多的消极行为和更少的积极行为。观赏鱼的活体运输是引起其行为改变、福利不良的重要因素。不稳定游泳是一种常见的消极行为,是鱼类压力升高、痛苦或致病状态的指标,如鱼突然快速游动或急转弯[10];啃咬行为的发生可能会对机体造成伤害,严重时甚至导致死亡[18];趴卧不动是一种与恐惧和压力相关的行为表现,被认为是不良福利的标志[19];探索和跟随行为的出现被视为一种积极状态,是福利良好的标志[20]。
Vanderzwalmen等[11]研究发现,运输后的观赏鱼在恢复期间不稳定游泳、啃咬和趴卧行为的发生率显著升高。高密度处理组的大口黑鲈在运输后比低密度处理组的个体表现出更多的趴卧、不稳定游泳和攻击行为[21]。鱼类受到的运输胁迫程度越高,消极行为的出现频率就越高。本试验结果显示,随着运输时间的延长,金鱼的积极行为出现频率降低,消极行为出现频率升高,与上述结果一致。但在杂斑剑尾鱼(Xiphophorus variatus)的运输中,历经长途运输的鱼在到达目的地后表现出的不稳定游泳行为少于短途运输的鱼[10],与本研究结果不一致,这可能与鱼的个体大小、品种及运输密度等有关。
3.2 芦荟提取物对缓解金鱼运输应激的影响
3.2.1 芦荟提取物对金鱼行为的影响 本研究中发现,在试验水中添加了芦荟提取物后,金鱼不稳定游泳、啃咬和趴卧行为的出现频率均低于对照组,探索行为出现频率高于对照组。与此类似,Vanderzwalmen等[9]研究表明,水中添加含有芦荟提取物的水质调节剂可以降低孔雀鱼在运输中的啃咬行为。在鲤饲料中添加一定量的芦荟提取物可以视为有益健康的饲料添加剂,可提高水产动物的福利[22]。然而,何秋霞等[23]研究发现,在水中添加芦荟大黄素对斑马鱼仔鱼的运动行为无明显影响。结果不同的原因可能与鱼的个体大小、品种、生存环境和药品成分等原因有关。
3.2.2 芦荟提取物对金鱼代谢的影响 鱼类在面对外界刺激带来的应激时需要更多能量,机体的糖异生增强,糖原分解导致糖原含量下降[24],蛋白质周转速度加快,鱼类新陈代谢发生变化,葡萄糖的利用率降低,血糖浓度迅速升高用以抵御外界刺激。淡水鱼在应激期间会发生过度换气[25],因此对能量的需求更高,需要更多的葡萄糖供给以应对压力。芦荟的生物活性成分能够支持脂类和碳水化合物的代谢,维持正常的血糖[6]。本研究结果显示,水中添加50 mg/L的芦荟提取物可以显著降低运输后金鱼血清中血糖含量。但Zanuzzo等[8]研究结果显示,在转运头石脂鲤的水中添加芦荟不影响血糖水平,可能与鱼个体大小、芦荟添加量和运输环境温度的不同有关。
鱼类在装袋、新环境及运输的刺激下代谢增强,导致水中溶氧量降低、氨氮含量升高,机体通过增加无氧呼吸强度来弥补有氧呼吸产生的能量不足,从而导致肌肉内乳酸含量增高[26]。另外,有研究表明,水中添加芦荟提取物能降低水中的总氨氮水平且净化水质,从而降低由于水质变差对鱼类造成的胁迫[27]。本研究中发现,100 mg/L组金鱼在运输完成0 h时背部肌肉中乳酸含量显著降低,可能是芦荟提取物通过维持机体代谢的稳定和保持水质的良好来达到减少乳酸堆积的结果。运输完成24 h时100 mg/L组金鱼肌肉中乳酸含量显著升高,可能是由于探索行为的显著增加导致其代谢提高、乳酸含量上升。
皮质醇水平的高低是衡量动物机体是否正在经历应激反应和应激反应是否强烈的指标,通常在应激的状态下动物机体需要皮质醇来维持正常生理机能。对鱼饲喂含有芦荟提取物的日粮降低了感染嗜水气单胞菌后鱼的皮质醇水平[28]。本试验中,水中添加芦荟提取物后金鱼的皮质醇在运输完成0 h时均低于对照组,与上述试验结果一致。运输完成24 h时对照组的金鱼皮质醇显著低于处理组,可能是由于应激已经达到峰值,激活了皮质醇的负反馈调节机制,抑制了皮质醇的释放[29]。运输完成24 h时试验组皮质醇的升高可能与进入新环境有关。
3.2.3 芦荟提取物对金鱼抗氧化能力的影响 应激会使机体产生过量的ROS,从而破坏抗氧化系统并降低抗氧化酶的活力。SOD是动物体内一种重要的抗氧化酶,大量存在于肝等动物组织中,能抑制和阻断自由基,减少自由基代谢产物MDA的产生。由于鳃是直接与外部环境接触的器官之一,芦荟提取物首先作用于鳃,因此选取鳃和肝两种组织对其SOD及MDA的含量进行测定。Zanuzzo等[8]研究发现,将0.5、1.0 mg/L的芦荟粉添加到细鳞肥脂鲤(Piaractus mesopotamicus)的血液中,减少了氧自由基产生量。在西伯利亚鲟(Acipenser baerii)的饲料中添加0.25%、0.50%的芦荟粉,血浆SOD活力显著提高;添加量为0.125%和0.25%时,血浆中MDA含量显著降低[30]。饲喂罗非鱼添加了芦荟提取物与蜂胶的混合物的日粮,可以提高其脾脏中谷胱甘肽还原酶(GR)和过氧化氢酶(CAT)的活性[31]。本研究结果显示,在水中添加50 mg/L芦荟提取物可以提高金鱼的抗氧化能力,与上述试验结果一致。本研究中50、100 mg/L组金鱼肝组织中SOD含量在运输后24 h才显著上升,可能是由于药物不是直接接触并作用于肝,故具有延迟性。
3.2.4 芦荟提取物对金鱼非特异性免疫的影响 鱼类的黏液是鱼体的第一道免疫防线,黏液内含有多种免疫因子,如溶菌酶、酸性磷酸酶、白蛋白和其他组分,其中溶菌酶是反映鱼体非特异性免疫最具代表性的因子,能水解致病菌黏多糖的碱性酶,存在于血清、黏液和多种组织中,参与机体的免疫反应[32]。鱼类在应激状态下,代谢变差并影响免疫功能的发挥,因此溶菌酶的活力也会随之下降,不足以抵御外界刺激和细菌等带来的伤害。同时,运输胁迫导致的氧化应激也会降低非特异性免疫能力[33],因此测量鱼类黏液中溶菌酶含量的变化可以评估芦荟提取物的免疫增强作用。Zanuzzo等[8]研究发现,向运输头石脂鲤的水中分别加入0.02、0.20、2.00 mg/L的芦荟粉,运输2 h后机体白细胞呼吸活性呈剂量依赖式升高,增强了生物体抵抗病原侵害的能力,有效预防了疾病的发生。对西伯利亚鲟饲喂添加芦荟粉的日粮后,其红细胞、血红蛋白、MCV、白细胞、溶菌酶和ACH50的含量显著高于对照组[34]。饲喂感染嗜水气单胞菌的鱼芦荟添加量为0.5%、1.0%的日粮6 h后,其白细胞呼吸活性和血清溶菌酶水平增加[28]。向野鲮(Labeo rohita)腹腔注射芦荟提取物均可以提高其免疫参数活性[35-36]。
本试验结果显示,添加芦荟提取物后金鱼体表黏液内的溶菌酶含量呈上升趋势,但未呈现显著性差异,与上述试验结果相似。运输完成24 h时,100 mg/L组金鱼黏液中溶菌酶含量显著高于运输完成0 h时,可能是金鱼脱离了胁迫环境,免疫力迅速提高的原因[37]。
4 结论
1)金鱼运输6 h以上会出现死亡,且随着运输时间的延长消极行为的出现频率升高。
2)在水中添加芦荟提取物能够减少运输后金鱼消极行为的出现。
3)在水中添加芦荟提取物能够有效降低运输引起的金鱼血糖、皮质醇和乳酸升高,增加抗氧化酶的活性,缓解金鱼所受到的运输胁迫并提高其抗应激能力。
4)芦荟提取物的添加浓度为50 mg/L时效果最佳。
[1] 王双双.饲料脂肪水平对草金鱼和蛋白水平对泰狮生长、形态特征及健康的影响[D].天津:天津农学院,2020.WANG S S.Effects of dietary lipid levels on Carassius auratus red var and protein levels on Oranda(Carassius auratus)growth,morphology and health[D].Tianjin:Tianjin Agricultural University,2020.(in Chinese)
[2] 李豪华.斑点叉尾鮰运输应激缓解技术研究[D].兰州:兰州理工大学,2023.LI H H.Research on stress relieving techniques of Channel Catfish fry (Ictalurus punctatus) in transport[D].Lanzhou:Lanzhou University of Technology,2023.(in Chinese)
[3] WANG Q C,YE W,TAO Y F,et al.Transport stress induces oxidative stress and immune response in juvenile largemouth bass (Micropterus salmoides):analysis of oxidative and immunological parameters and the gut microbiome[J].Antioxidants,2023,12(1):157.
[4] 田兵,华跃进,马小琼,等.芦荟抗菌作用与蒽醌化合物的关系[J].中国中药杂志,2003,28(11):1034-1037.TIAN B,HUA Y J,MA X Q,et al.Relationship between antibacterial activity of Aloe and its anthaquinone compounds[J].China Journal of Chinese Materia Medica,2003,28(11):1034-1037.(in Chinese)
[5] 周颖,葛朝晖,张海娟.芦荟主要生物学功能及其在动物生产中的应用[J].饲料研究,2023,46(2):153-156.ZHOU Y,GE Z H,ZHANG H J.Main biological function of Aloe barbadensis and its application in animal production[J].Feed Research,2023,46(2):153-156.(in Chinese)
[6] 王媛媛.芦荟苷与芍药苷对镉诱导小鼠肝肾损伤的保护作用[D].重庆:西南大学,2023.WANG Y Y.Protective effect of Aloin and Paeoniflorin on cadmium-induced liver and kidney injury in mice[D].Chongqing:Southwest University,2023.(in Chinese)
[7] 张浩,罗秉俊,王艳,等.库拉索芦荟大分子凝胶的修复功效研究[J].广东化工,2019,46(11):96-98.ZHANG H,LUO B J,WANG Y,et al.Study on repair effects of Aloe vera macromolecule gel[J].Guangdong Chemical Industry,2019,46(11):96-98.(in Chinese)
[8] ZANUZZO F S,BILLER-TAKAHASHI J D,URBINATI E C.Effect of Aloe vera extract on the improvement of the respiratory activity of leukocytes of matrinxã during the transport stress[J].Revista Brasileira de Zootecnia,2012,41(10):2299-2302.
[9] VANDERZWALMEN M,EDMONDS E,CAREY P,et al.Effect of a water conditioner on ornamental fish behaviour during commercial transport[J].Aquaculture,2020,514:734486.
[10] VANDERZWALMEN M,CAREY P,SNELLGROVE D,et al.Benefits of enrichment on the behaviour of ornamental fishes during commercial transport[J].Aquaculture,2020,526:735360.
[11] VANDERZWALMEN M,MCNEILL J,DELIEUVIN D,et al.Monitoring water quality changes and ornamental fish behaviour during commercial transport[J].Aquaculture,2021,531:735860.
[12] JONES M,ALEXANDER M E,LIGHTBODY S,et al.Influence of social enrichment on transport stress in fish:a behavioural approach[J].Applied Animal Behaviour Science,2023,262:105920.
[13] SUBRAMANIAN S,MACKINNON S L,ROSS N W.A comparative study on innate immune parameters in the epidermal mucus of various fish species[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,148(3):256-263.
[14] 王锦绣,王炬光,李伟,等.运输密度和时间对大口黑鲈幼鱼生理生化和肝肠结构的影响[J].广东海洋大学学报,2023,43(4):93-102.WANG J X,WANG J G,LI W,et al.Effects of transportation density and duration on the physiological and biochemical indicators,liver and intestine structure of juvenile largemouth bass(Micropterus salmoides)[J].Journal of Guangdong Ocean University,2023,43(4):93-102.(in Chinese)
[15] 王文雯,杨静茹,付正祎,等.运输时间对高体鰤幼鱼应激、代谢、抗氧化和免疫的影响[J].中国渔业质量与标准,2023,13(2):25-36.WANG W W,YANG J R,FU Z Y,et al.Effects of transport time on stress,metabolism,antioxidation and immunity of Seriola dumerili juveniles[J].Chinese Fishery Quality and Standards,2023,13(2):25-36.(in Chinese)
[16] 李佩,陈见,余登航,等.运输密度和时间对黑尾近红鲌皮质醇、乳酸、糖元含量的影响[J].水生生物学报,2020,44(2):415-422.LI P,CHEN J,YU D H,et al.Effects of transportation density and time on Cortisol,lactate and glycogen of Ancherythroculter nigrocauda[J].Acta Hydrobiologica Sinica,2020,44(2):415-422.(in Chinese)
[17] MARTINS C IM,GALHARDO L,NOBLE C,et al.Behavioural indicators of welfare in farmed fish[J].Fish Physiology and Biochemistry,2012,38(1):17-41.
[18] KALUEFF A V,GEBHARDT M,STEWART A M,et al.Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond[J].Zebrafish,2013,10(1):70-86.
[19] BRAITHWAITE V A,SALVANES A G V.Environmental variability in the early rearing environment generates behaviourally flexible cod:implications for rehabilitating wild populations[J].Proceedings Biological Sciences,2005,272(1568):1107-1113.
[20] GRAHAM C,VON KEYSERLINGK M A G,FRANKS B.Zebrafish welfare:Natural history,social motivation and behaviour[J].Applied Animal Behaviour Science,2018,200:13-22.
[21] YANG Y F,NARAYAN E,PLANELLAS S R,et al.Effects of stocking density during simulated transport on physiology and behavior of largemouth bass (Micropterus salmoides)[J].Journal of the World Aquaculture Society,2024,55(2):e13054.
[10] VANDERZWALMEN M,CAREY P,SNELLGROVE D,et al.Benefits of enrichment on the behaviour of ornamental fishes during commercial transport[J].Aquaculture,2020,526:735360.
[22] KUEBUTORNYE F K A,ROY K,FOLORUNSO E A,et al.Plant-based feed additives in Cyprinus carpio aquaculture[J].Reviews in Aquaculture,2024,16(1):309-336.
[23] 何秋霞,董贞兰,楚杰,等.芦荟大黄素对斑马鱼胚胎发育及运动行为学的毒性研究[J].山东科学,2015,28(3):23-28.HE Q X,DONG Z L,CHU J,et al.Toxicity of Aloe-emodine to embryos growth and behavior of zebrafish[J].Shandong Science,2015,28(3):23-28.(in Chinese)
[24] 衣鸿莉,刘俊荣,王选飞,等.养殖大菱鲆死前应激状态对肌肉代谢与品质的影响[J].大连海洋大学学报,2020,35(4):570-576.YI H L,LIU J R,WANG X F,et al.Effects of pre-slaughter stress on muscular metabolism and quality of farmed turbot Scophthalmus maximus[J].Journal of Dalian Ocean University,2020,35(4):570-576.(in Chinese)
[25] BARTON BBARTON,HAUKENES,PARSONS G B,et al.Plasma Cortisol and chloride stress responses in juvenile walleyes during capture,transport,and stocking procedures[J].North American Journal of Aquaculture,2003,65(3):210-219.
[26] 杨涵,张童昊,YONGSAWADIGUL JIRAWAT,等.鱼袋保活中团头鲂存活率和肌肉品质的变化[J].水产学报,2024,48(7):82-95.YANG H,ZHANG T H,JIRAWAT Y,et al.Changes in survival rate and muscle quality of Megalobrama amblycephala in fish bags during the process of keeping-alive[J].Journal of Fisheries of China,2024,48(7):82-95.(in Chinese)
[27] KATE G U,KRISHNANI K K,KUMAR N,et al.Abiotic and biotic stress alleviating effects of the medicinal and aromatic plant-derived product on striped catfish Pangasianodon hypophthalmus[J].Fish &Shellfish Immunology,2023,135:108625.
[28] DE ASSIS R W S,URBINATI E C.Physiological activity of Aloe vera in pacu (Piaractus mesopotamicus) inoculated with Aeromonas hydrophila[J].Fish Physiology and Biochemistry,2020,46(4):1421-1430.
[29] GONZ LEZ G
LEZ G MEZ M P,MAR
MEZ M P,MAR N ARRIBAS S L,VARGAS-CHACOFF L.Stress response of Salmo salar (Linnaeus 1758) facing low abundance infestation of Caligus rogercresseyi (Boxshall &Bravo 2000),an object in the tank,and handling[J].Journal of Fish Diseases,2016,39(7):853-865.
N ARRIBAS S L,VARGAS-CHACOFF L.Stress response of Salmo salar (Linnaeus 1758) facing low abundance infestation of Caligus rogercresseyi (Boxshall &Bravo 2000),an object in the tank,and handling[J].Journal of Fish Diseases,2016,39(7):853-865.
[30] WANG C A,XU Q Y,XU H,et al.Effects of aloe powder on the growth performance and plasma indices of sturgeon(Acipenser baerii Brandt)[J].Journal of Shanghai Ocean University,2011.00187.
[31] DOTTA G,DE ANDRADE J I A,GARCIA P,et al.Antioxidant enzymes,hematology and histology of spleen in Nile Tilapia fed supplemented diet with natural extracts challenged with Aeromonas hydrophila[J].Fish &Shellfish Immunology,2018,79:175-180.
[32] 李梦娇,王倩,张婷,等.氨氮胁迫对团头鲂生长、抗氧化和免疫的影响[J].水产科学,2024,43(4):640-647.LI M J,WANG Q,ZHANG T,et al.Growth,antioxidant capability,and immunity of Blunt Snout Bream Megalobrama amblycephala juveniles under chronic ammonia nitrogen stress[J].China Industrial Economics,2024,43(4):640-647.(in Chinese)
[33] KUMAR P,PRASAD Y,PATRA A K,et al.Ascorbic acid,garlic extract and taurine alleviate cadmium-induced oxidative stress in freshwater catfish (Clarias batrachus)[J].Science of the Total Environment,2009,407(18):5024-5030.
[34] MOGHADDAM S B,HAGHIGHI M,ROHANI M,et al.The effects of different levels of Aloe vera extract on some of the hematological and non-specific immune parameters in Siberian sturgeon (Acipenser baerii)[J].Iranian Journal of Fisheries Sciences,2017,16:1234-1247.
[28] DE ASSIS R W S,URBINATI E C.Physiological activity of Aloe vera in pacu (Piaractus mesopotamicus) inoculated with Aeromonas hydrophila[J].Fish Physiology and Biochemistry,2020,46(4):1421-1430.
[35] SRIVASTAVA A,KUMARI U,MITTAL S,et al.Immunoprotective role of aloin and disease resistance in Labeo rohita,infected with bacterial fish pathogen,Aeromonas hydrophila[J].Environmental Science and Pollution Research International,2023,30(11):30062-30072.
[36] SRIVASTAVA A,NIGAM A K,MITTAL S,et al.Role of aloin in the modulation of certain immune parameters in skin mucus of an Indian major carp,Labeo rohita[J].Fish &Shellfish Immunology,2018,73:252-261.
[37] 陈军平,武慧慧,沈方方,等.急性温度胁迫对乌苏里拟鲿稚鱼抗氧化和非特异免疫功能的影响[J].水产科学,2024,43(4):580-589.CHEN J P,WU H H,SHEN F F,et al.Effects of acute temperature stress on antioxidant enzyme activities and non-specific immune function in juvenile bullhead fish Pseudobagrus ussuriensis[J].Fisheries Science,2024,43(4):580-589.(in Chinese)