三角帆蚌(Hyriopsis cumingii)是一种重要的淡水经济贝类,也是中国培养淡水珍珠的首选贝类[1],其在水体生态系统中扮演着重要的调节角色,并在市场上占据重要地位。然而,在大规模养殖过程中,三角帆蚌易受到细菌等病原体侵染,导致贝类活力下降甚至死亡,造成巨大经济损失[2]。因此,探究贝类健康状况检测方法以提高养殖效率尤为重要。此外,贝类的活动特征微小,传统的贝类健康指标主要包括生理指标(生长率和食物清除率)、酶活性、功能基因表达[3]等,这些方法需进行活体取样,并依赖昂贵的精密仪器,检测过程繁琐。因此,实现双壳贝类的实时健康监测具有一定的挑战性,检测效果不佳可能导致病害问题延迟发现,而开发实时、高效的非侵入性监测方法有利于实现双壳贝类的健康养殖。
心率已被证明是反映身体整体生理状况的可靠且准确的指标[4]。在双壳贝类的研究中,心脏活动存在昼夜节律,能反映动物的新陈代谢强度。心跳波形可反映心脏兴奋的产生、恢复和传导的过程[5],其变化与生物自身因素(如年龄、规格和昼夜变化)和外界环境因素(如水体理化因子和藻类丰富度)紧密相关[6]。贝类心脏跳动的频率和振幅与机体血液循环量直接相关,心脏跳动强,血液循环量大,代谢活跃[7],尽管心率具有非侵入性的优势,但是心率指标的监测一直存在操作繁琐、成本高等问题,所以亟须研究新的贝类健康指征。开闭壳行为是双壳贝类独特而重要的一种活动方式,其由韧带和闭壳肌共同控制,与呼吸、排泄、摄食和斧足伸展等活动密切相关[8],当受到生理或环境因子胁迫时,贝类会通过调节闭壳频率应对环境应激[9],同时贝类自身的呼吸代谢、存活、生长及贝类的酶活和免疫能力都会受到影响[2,10],开闭壳行为对贝类日常活动和躲避敌害等具有重要意义,反映贝类健康活力、环境耐受与抗逆性能,同时也能反映环境条件的变化[11],目前鲜有评估双壳贝类与相关生命行为的研究。
本研究中以三角帆蚌为研究对象,利用水下非侵入性24 h实时监测双壳贝类开闭壳行为的超敏设备和心率监测仪,分析了三角帆蚌开闭壳频率和心率的昼夜特征及摄食和免疫响应特点,探究了贝类开闭壳频率与三角帆蚌的健康状况指征的相关性,以期为双壳贝类养殖场提供实时、无损伤的生理健康评估手段。
1 材料与方法
1.1 材料
1.1.1 三角帆蚌与暂养 试验用三角帆蚌取自浙江武义淡水珍珠科技小院,随机选取健康、规格相近的一龄三角帆蚌,壳长为(66.90±2.88)mm,壳宽为(15.57±1.17) mm,体质量为(25.50±3.32) g。清洗干净贝壳表面的附着物,置于塑料箱中暂养1周,以适应试验环境。暂养用水为曝气7 d的自来水,溶氧量>5 mg/L,氨氮含量<0.020 mg/L,亚硝酸盐氮含量<0.005 mg/L,实验室内装有空调,用恒温棒维持水温为26 ℃。
1.1.2 投饵试验 试验设置3个平行组,每组养殖30只蚌,每天分别于9:00、21:00投喂小球藻,试验水体每日换水量为30%,并及时清理残饵及粪便。于每日8:00—12:00和20:00—24:00监测三角帆蚌开闭壳频率和心率,连续监测3 d。
1.1.3 感染试验 试验设置3个平行组,每组养殖30只蚌,每只三角帆蚌人工注射浓度为3.0×107 CFU/mL的嗜水气单胞菌(Aeromonas hydrophila)0.5 mL,养殖管理方法同投饵试验,病菌感染前安装好开闭壳频率和心率监测装置并开始监测,3 h后开始批量注射病菌并继续监测,总监测时长为18 h(为保证数据监测稳定,取前3 h平均值为感染0 h数据)。
1.1.4 开闭壳频率免疫相关酶活试验 监测正常养殖条件下同一养殖群体三角帆蚌的开闭壳频率,取开闭壳频率数据的前、中和后5%三角帆蚌为开闭壳高、中、低频率组。本批次三角帆蚌筛选出的开闭壳高、中、低频率组数据分别为(15.33±1.37)、(9.40±0.64)、(3.73±1.79)次/h,每组均取6只蚌,提取血清并剖取闭壳肌、肝胰腺部位的组织样本,液氮速冻并保存于-80 ℃超低温冰箱中。
1.2 方法
1.2.1 开闭壳频率测定 通过将铝镍钴合金磁体(1 cm2圆形)粘在三角帆蚌的水平朝上面,壳的另一面使用玻璃胶和垫圈固定在定制钢板底座上,并调整角度,使磁体与上方感应探头平行并保持适当距离(感应探头穿过钢板上方的定制孔径,并用螺母调节高度进行固定)。电控单元通过检测到的电势差信号,测定其开闭壳频率。
1.2.2 心率测定 使用多通道生理信号记录仪(Powerlab 8/30,AD Instruments,Germany)测定,贝壳表面的水分擦干后将红外感应探头一端用蓝丁胶(Blu-Tack,Bostik Ltd,UK)黏附在贝类心脏位置的壳表面,另一端接入信号放大器,内置软件获取心跳的有关参数并计算出每分钟心率(bpm)[12]。
1.2.3 免疫相关酶活性测定 超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和过氧化氢酶(CAT)活性采用南京建成生物工程研究所有限公司研发的试剂盒进行测定。准确称取0.1 g肝胰腺、闭壳肌组织及1.0 mL血清上清液,按质量体积比1∶10加入提取液,进行冰浴匀浆,4 ℃条件下以8 000 g离心10 min,收集上清液置于冰上,然后按试剂盒说明书进行测定,使用酶标仪检测读数。
1.3 数据处理与绘图
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 27.0软件进行单因素方差分析,采用Duncan法比较组间差异显著性,显著性水平设为0.05。采用GraphPad Prism 9软件绘制图形。
2 结果与分析
2.1 三角帆蚌开闭壳频率及心率的昼夜变化和摄食响应
三角帆蚌的开闭壳频率和心率(表1)个体间差异明显,夜间开闭壳频率和心率高于白天,但无显著性差异(P>0.05);昼夜投饵后1 h的开闭壳频率和心率均显著高于投饵前(P<0.05),昼夜开闭壳频率分别提高至投饵前水平的132%和129%,昼夜心率分别提高至投饵前水平的114%和113%,表明滤食行为提高了三角帆蚌开闭壳频率和心率水平;投饵后2 h的开闭壳频率和心率逐渐回落,较投饵前无显著性差异。
表1 昼夜投饵对三角帆蚌开闭壳频率及心率的影响
Tab.1 Effect of feeding at day or night on the shell open-close frequency and heart rate of Hyriopsis cumingii
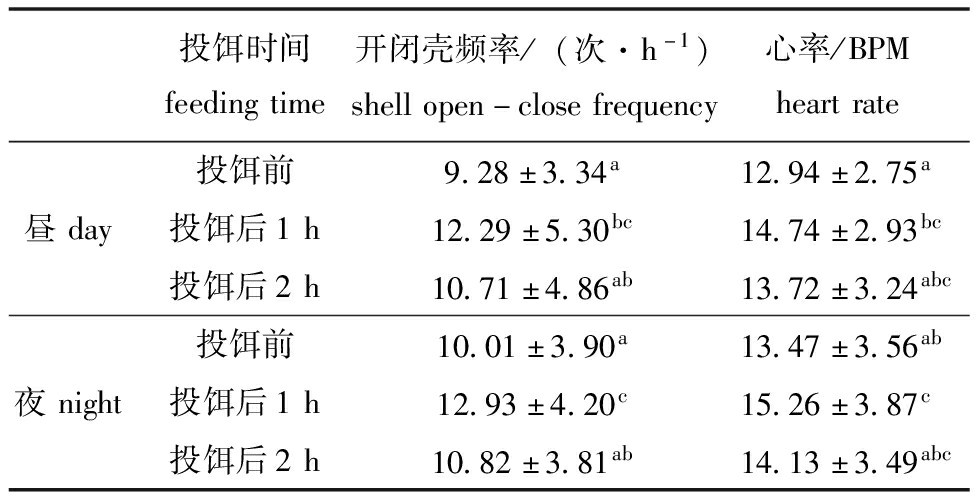
投饵时间feedingtime开闭壳频率/(次·h-1)shellopen-closefrequency心率/BPMheartrate投饵前9.28±3.34a12.94±2.75a昼day投饵后1h12.29±5.30bc14.74±2.93bc投饵后2h10.71±4.86ab13.72±3.24abc投饵前10.01±3.90a13.47±3.56ab夜night投饵后1h12.93±4.20c15.26±3.87c投饵后2h10.82±3.81ab14.13±3.49abc
注:同列中标有不同字母者表示组间有显著性差异(P<0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level.
投饵前后三角帆蚌心跳波形变化特征如图1所示,三角帆蚌夜间心跳振幅高于白天,白天心跳振幅高电压处于(1.60 ± 0.12) v(图1(a)),而夜间心跳振幅高电压处于(1.67 ± 0.16) v(图1(b));投饵后,昼夜三角帆蚌心跳振幅均明显提高,白天心跳振幅高电压升至(1.65 ± 0.13) v(P>0.05)(图1(c)),夜间心跳振幅高电压升至(1.80 ± 0.19) v(P<0.05)(图1(d))。
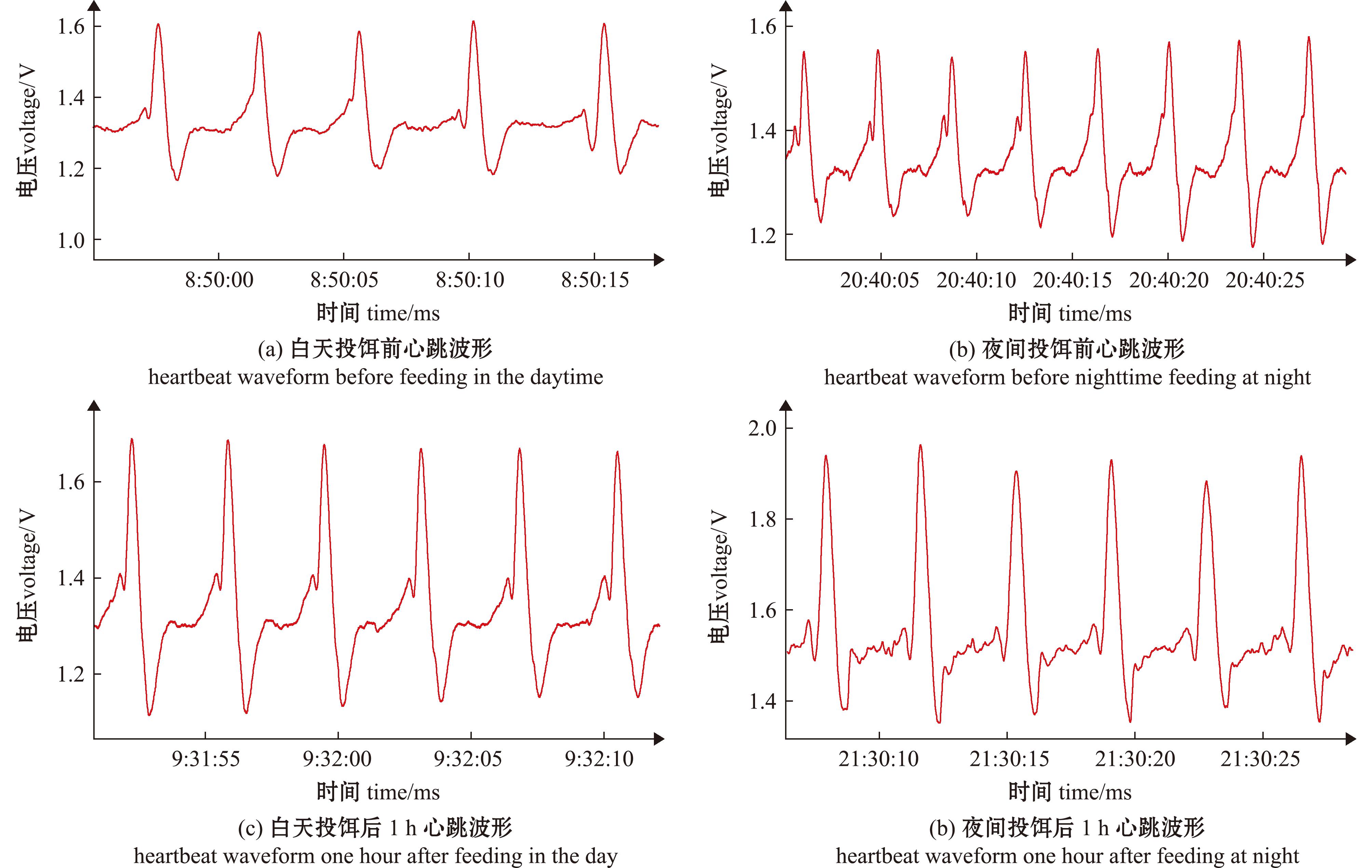
图1 昼夜投饵前后三角帆蚌心跳波形
Fig.1 Heartbeat waveform of Hyriopsis cumingii before and after day and night feeding
2.2 三角帆蚌开闭壳频率及心率对细菌感染的响应
三角帆蚌感染嗜水气单胞菌后的开闭壳频率和心率变化如图2所示,在感染嗜水气单胞菌后3 h,三角帆蚌开闭壳频率显著上升达到最高值18.75次/h,为初始频率的1.52倍(P<0.05),然后呈逐渐下降趋势,7 h后,开闭壳频率显著低于三角帆蚌正常水平,至15 h已低至正常开闭壳频率的31.29%。感染嗜水气单胞菌后,三角帆蚌心率持续上升,在3~7 h时,三角帆蚌心率显著高于正常水平,且在5 h达到峰值14.65 bpm,为初始心率的1.25倍(P<0.05),随后频率缓慢降低,12 h后恢复至正常水平。表明开闭壳频率能对细菌感染做出响应,且开闭壳频率响应较心率更为强烈。
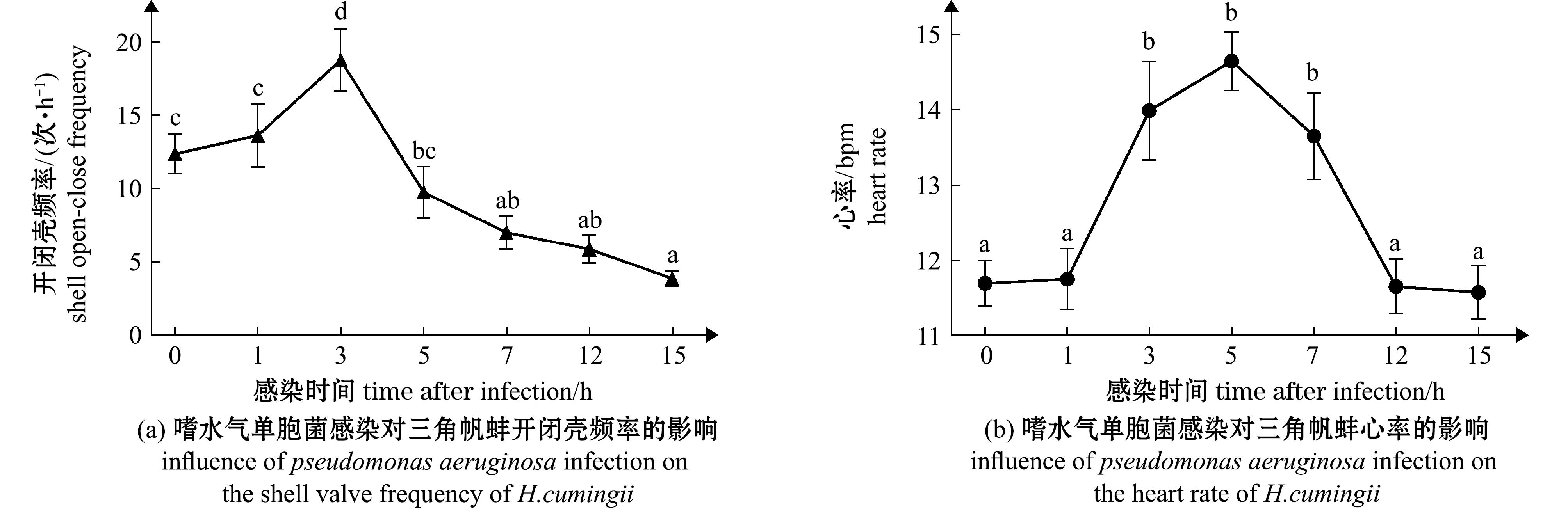
标注不同字母表示不同感染时间下的指标数值与未感染时相比有显著性差异(P<0.05)。
Different letters denote a significant differencebetween the values of the indicators at different times of infection and non-infection(P<0.05).
图2 嗜水气单胞菌感染对三角帆蚌开闭壳频率和心率的影响
Fig.2 Effect of Pseudomonas aeruginosa infection on the shell frequency and heart rate of H.cumingii
2.3 不同开闭壳频率三角帆蚌免疫相关酶活性差异
正常养殖条件下同一养殖群体中,将三角帆蚌按自然存在的开闭壳频率差异分为高、中、低开闭壳频率组后,测定不同开闭壳频率组三角帆蚌肝胰腺、闭壳肌和血清的免疫相关酶活性(图3),发现4种免疫相关酶活性均在肝胰腺组织中的表达最高。肝胰腺中SOD活性高频率组显著低于低频率组(P<0.05),肝胰腺、闭壳肌中AKP活性高频率组显著高于低频率组(P<0.05),血清SOD活性中高、中频率组显著高于低频率组(P<0.05)(图3(a)、(c)),肝胰腺ACP、CAT活性中,高频率组>低频率组>中频率组,且高频率组显著高于其他两组(P<0.05),闭壳肌组织中ACP活性,高频率组显著高于中频率组(P<0.05)(图3(b)、(d))。
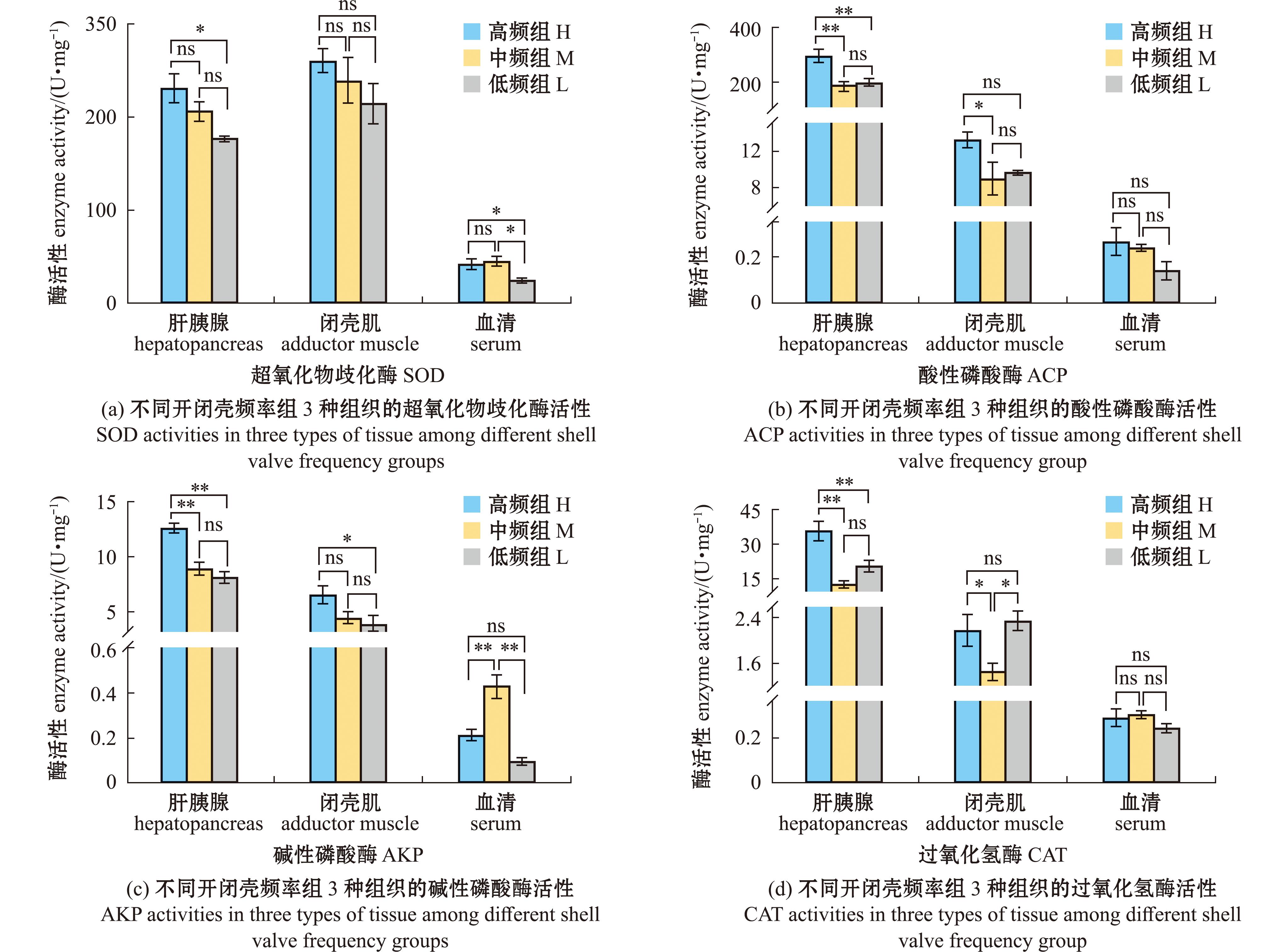
*表示在各组织中不同开闭壳频率组三角帆蚌酶活有差异性显著(P<0.05);**表示有极显著性差异(P<0.01)。
*means a significant difference among different shell open-close frequency groups in different tissues(P<0.05);**means a very significant difference (P<0.01).
图3 不同开闭壳频率组三角帆蚌3种组织的4种免疫相关酶活性(n=6)
Fig.3 Four kinds of immune-related enzyme activities in three types of tissue among the different shell valve open-close frequency groups (n=6)
3 讨论
3.1 贝类生物节律与环境响应
生物节律对贝类的生存和适应具有重要意义,影响其摄食、消化等重要生理和行为活动[13],大多数生物体都有一个被称为昼夜节律生物钟的分子计时器[14]。研究表明,贝类的摄食、消化、呼吸、排泄、心率和开闭壳行为等生理指标存在节律性[15-18],如三角帆蚌摄食率、耗氧率和排氨率等夜间均高于白天[19-20];菲律宾蛤仔的摄食率有显著的昼夜差异,夜间的摄食率明显高于白天[21];长牡蛎的呼吸和排泄在1个日周期内会产生显著的变化;扇贝的心率昼夜节律与开闭壳运动相似[22]。本研究中,三角帆蚌心率昼夜变化也被证明存在昼夜节律。开闭壳是一种能量适应行为,主要取决于肌肉的松弛和收缩,与静止阶段相比,能量成本更高,开闭壳变化可能与能量代谢有关,Thompson等[16]在1972年首次证明双壳贝类的开闭壳行为是一种生物钟控制的活动,在动物个体中具有明显的节律。研究结果表明,贝类存在生理代谢的节律,但是环境因子变化会对贝类节律产生影响[18]。本研究中发现,三角帆蚌在昼夜摄食后开闭壳频率和心率都高于摄食前,摄食行为增加了三角帆蚌开闭壳频率、心率负荷和需氧量,且会出现心率加速并伴随能量转换,表明摄食等行为会对贝类的生理指标节律产生影响[20,23-24],进一步研究表明,摄食率与心率、开闭壳行为相关,可通过开闭壳频率和心率指标变化监测三角帆蚌摄食状态。Markich等[23]在双壳贝类开闭壳行为与铀金属暴露的研究中,发现了开闭壳频率与壳长和年龄显著相关,Rajagopal等[25]研究发现,贻贝的开闭壳频率与氯浓度密切相关。嗜水气单胞菌广泛分布于自然界的各种水体中,是多种水生动物的致病菌,可引起软体动物、鱼类和两栖类等多种动物的全身性败血症或局部感染,常致动物大量死亡[26]。已有研究发现,嗜水气单胞菌是三角帆蚌的重要致病菌,本研究中发现,三角帆蚌感染嗜水气单胞菌初期,开闭壳频率和心率均出现上升现象,可能是由于双壳贝类心脏无内皮细胞,直接浸没在血淋巴中,因此心脏活动会很快受到细菌感染的影响,并被快速检测到[27];而开闭壳行为对有毒物质的潜在反应包括瓣膜打开和关闭的快速循环等[28]。两个指标的下降趋势则说明随着感染时间的延长,机体的心率受到抑制,可能减缓了血液循环和营养物质的输送,导致行为能力下降及开闭壳频率降低等现象。试验结果表明,三角帆蚌同其他贝类一样具有明显的节律性,且存在环境响应机制,这可能与贝类的闭壳效应有关[29],开闭壳行为也是一个能够反映机体生理状况的指标,且对细菌感染响应与心率指标变化呈现相同的趋势,甚至响应更为强烈。
3.2 开闭壳行为作为三角帆蚌健康指征的可行性
贝类的健康评估对于水产种质资源保护、苗种培育及绿色健康养殖业发展具有重要意义[14]。本研究中发现,三角帆蚌心率和开闭壳均存在明显的环境响应,但心率测定仍然面临测量过程繁琐、设备成本较高等问题。在养殖生产中,双壳闭合有力也已成为亲贝挑选的一项重要指标[30],然而,目前对开闭壳频率研究较少,通常认为,正常情况下,滤水、呼吸等活动会引起贝壳保持长时间小幅度张开的状态,只有受到应激及摄食等行为时,才会出现明显的开闭壳行为[31],本研究中确定了双壳贝类开闭壳频率的水下24 h超敏检测方法,可便捷地测定三角帆蚌开闭壳频率,研究发现,在未受刺激的条件下,三角帆蚌存在小幅度、低频率的开闭壳行为,投饵后1 h的开闭壳频率和心率均显著高于投饵前,感染嗜水气单胞菌后,三角帆蚌开闭壳频率与心率均产生明显的生理响应,但开闭壳频率较心率更为敏感,故开闭壳频率能够反映机体对外界环境的响应。
贝类的免疫系统为非特异性免疫,易受到环境和外源生物等因素的影响[32]。肝胰腺、血细胞及闭壳肌的免疫相关酶活性可以反映机体健康状况[33]。研究表明,水产动物中抗逆性群体抗氧化酶和免疫相关酶活性普遍高于普通群体[33-35]。SOD和CAT是生物体重要的抗氧化防御性功能酶,主要预防过氧化物(ROS)对机体的损害,是测定机体抗逆性的重要指标[36]。蒋文枰等[34]在研究翘嘴鲌新品种抗逆性中发现,氨氮抗逆性能更强的翘嘴鲌“全雌1号”在氨氮胁迫下抗氧化酶活性高于普通翘嘴鲌。本试验中,高开闭壳频率组中肝胰腺及血清SOD和CAT活性均显著高于低频率组,表明高开闭壳频率组拥有更好的抗氧化能力。AKP、ACP是两种重要的机体功能调节酶,磷酸酶活力是衡量免疫功能和机体状态的指标,反映了机体对外源微生物侵染的防御能力[37],王海宁等[33]对中华绒螯蟹选育群体的研究发现,种质较优的选育群体AKP、ACP水平显著高于对照组的未选育群体,选育群体拥有更好的机体免疫力及抗病性能。本试验中,高开闭壳频率组肝胰腺AKP和ACP活性均显著高于中、低频率组,由此反映出开闭壳频率与上述免疫相关酶的活性存在一定关联。
本研究对开壳频率这一计数指标作为三角帆蚌新的健康指征和评价方法进行了有益尝试,建议开闭壳频率可作为评估三角帆蚌健康状况的潜在指标,该研究是在试验条件下人工可控养殖场景中进行的,在生产中应用存在局限性。贝类养殖生产环境多变,开闭壳频率作为一种综合性指标,可能受到多种因素影响,开闭壳频率变化反映了多种环境变化响应,因此,开闭壳频率变化作为健康指标的产业应用,仍需在开闭壳频率长时间的变化动态和多环境因子不同强度下的变化模式等方面开展更深入研究。
4 结论
1)本研究中发明了三角帆蚌开闭壳频率检测设备和方法,发现在投饵和细菌感染过程中三角帆蚌开闭壳行为与心率变化呈相同响应趋势,且其响应幅度较心率更为强烈,表明开闭壳行为能够作为反映机体生理变化的重要指标。
2)本研究中发现正常养殖条件下同群体三角帆蚌存在开闭壳频率差异,可分为高、中、低开闭壳频率3组,高开闭壳频率组的4种免疫相关酶活性较高,可作为评估三角帆蚌健康状况的潜在指标,但研究仍存在局限性,尚待更深入研究。
[1] LIU H B,YANG J,GAN J L.Trace element accumulation in bivalve mussels Anodonta woodiana from Taihu Lake,China[J].Archives of Environmental Contamination and Toxicology,2010,59(4):593-601.
[2] AGUIRRE-VELARDE A,PECQUERIE L,JEAN F,et al.Predicting the energy budget of the scallop Argopecten purpuratus in an oxygen-limiting environment[J].Journal of Sea Research,2019,143:254-261.
[3] XING Q,LI Y P,GUO H B,et al.Cardiac performance:a thermal tolerance indicator in scallops[J].Marine Biology,2016,163(12):244.
[4] 胡志成,姚焰.心率变异性的历史沿革与研究进展[J].实用心电学,2023,32(5):355-359.HU Z C,YAO Y.History and research progress of heart rate variability[J].Journal of Practical Electrocardiology,2023,32(5):355-359.(in Chinese)
[5] 常向阳.虾夷扇贝保活过程中生命特征指标与品质变化规律及预测模型建立[D].湛江:广东海洋大学,2023.CHANG X Y.Changes in quality and vital characteristics of Patinopecten yessoenisis during the preservation process and prediction[D].Zhanjiang:Guangdong Ocean University,2023.(in Chinese)
[6] BAKHMET I,SAZHIN A,MAXIMOVICH N,et al.In situ long-term monitoring of cardiac activity of two bivalve species from the White Sea,the blue mussel Mytilus edulis and horse mussel Modiolus modiolus[J].Journal of the Marine Biological Association of the United Kingdom,2018,99:833-840.
[7] DEPLEDGE M H,ANDERSEN B B.A computer-aided physiological monitoring system for continuous,long-term recording of cardiac activity in selected invertebrates[J].Comparative Biochemistry and Physiology Part A:Physiology,1990,96(4):473-477.
[8] NAGAI K,HONJO T,GO J,et al.Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor[J].Aquaculture,2006,255(1/2/3/4):395-401.
[9] BROKORDT K,P REZ H,CAMPOS F.Environmental hypoxia reduces the escape response capacity of juvenile and adult Scallops Argopecten purpuratus[J].Journal of Shellfish Research,2013,32(2):369-376.
REZ H,CAMPOS F.Environmental hypoxia reduces the escape response capacity of juvenile and adult Scallops Argopecten purpuratus[J].Journal of Shellfish Research,2013,32(2):369-376.
[10] AGUIRRE-VELARDE A,JEAN F,THOUZEAU G,et al.Effects of progressive hypoxia on oxygen uptake in juveniles of the Peruvian scallop,Argopecten purpuratus (Lamarck,1819)[J].Aquaculture,2016,451:385-389.
[11] HARTMANN J T,BEGGEL S,AUERSWALD K,et al.Establishing mussel behavior as a biomarker in ecotoxicology[J].Aquatic Toxicology,2016,170:279-288.
[12] 林思恒,吴富村,张国范.高温胁迫下皱纹盘鲍不同养殖群体心率变化比较[J].海洋科学,2016,40(11):84-90.LIN S H,WU F C,ZHANG G F.Comparison of heart rate changes in different cultured populations of Haliotis discus Hannai under high temperature stress[J].Marine Sciences,2016,40(11):84-90.(in Chinese)
[13] 杨晓新,林小涛,计新丽,等.温度、盐度和光照条件对翡翠贻贝滤水率的影响[J].海洋科学,2000,24(6):36-39.YANG X X,LIN X T,JI X L,et al.The effects of light intensity,temperature,and salinity on the filtration rate of Perna viridis[J].Marine Sciences,2000,24(6):36-39.(in Chinese)
[14] AKIYAMAM,MORIYA T,SHIBATA S.Physiological,pharmacological and molecular aspects of mammalian biological clocks[J].Nihon Yakurigaku Zasshi Folia Pharmacologica Japonica,1998,112(4):243-250.
[15] PURCHON R D.Digestion in filter feeding bivalves-a new concept[J].Journal of Molluscan Studies,1971:39(4):253-262.
[16] THOMPSON I L.Biological rhythms of shell growth and valve movement in bivalves[D].The University of Chicago,1972.
[17] AGUIRRE-VELARDE A,JEAN F,THOUZEAU G,et al.Feeding behaviour and growth of the Peruvian scallop (Argopecten purpuratus) under daily cyclic hypoxia conditions[J].Journal of Sea Research,2018,131:85-94.
[18] 任黎华,张继红,方建光,等.长牡蛎呼吸、排泄及钙化的日节律研究[J].渔业科学进展,2013,34(1):75-81.REN L H,ZHANG J H,FANG J G,et al.The diurnal rhythm of respiration,excretion and calcification in oyster Crassostrea gigas[J].Progress in Fishery Sciences,2013,34(1):75-81.(in Chinese)
[19] 郑侠飞,王岩.池塘养殖三角帆蚌的耗氧率[J].浙江大学学报(农业与生命科学版),2013,39(4):460-466.ZHENG X F,WANG Y.Oxygen consumption rate of freshwater pearl mussel (Hyriopsis cumingii) reared in ponds[J].Journal of Zhejiang University (Agriculture and Life Sciences),2013,39(4):460-466.(in Chinese)
[20] 孙明龙,白志毅,傅百成,等.三角帆蚌耗氧率和排氨率的昼夜变化及不同饵料浓度下的摄食节律[J].水产学杂志,2020,33(6):56-60.SUN M L,BAI Z Y,FU B C,et al.Diurnal variation in oxygen consumption and ammonia excretion and feeding rhythm of freshwater mussel Hyriopsis cumingii under different Alga concentrations[J].Chinese Journal of Fisheries,2020,33(6):56-60.(in Chinese)
[21] 杜美荣,方建光,毛玉泽,等.栉孔扇贝面盘幼虫和稚贝的滤水率昼夜节律[J].渔业科学进展,2012,33(5):73-77.DU M R,FANG J G,MAO Y Z,et al.Diurnal rhythm of filtration rate of Zhikong scallop Chlamys farreri veliger and spat[J].Progress in Fishery Sciences,2012,33(5):73-77.(in Chinese)
[22] XING Q,ZHANG L L,LI Y Q,et al.Development of novel cardiac indices and assessment of factors affecting cardiac activity in a bivalve mollusc Chlamys farreri[J].Frontiers in Physiology,2019,10:293.
[23] MARKICH S J.Influence of body size and gender on valve movement responses of a freshwater bivalve to uranium[J].Environmental Toxicology,2003,18(2):126-136.
[24] 陈修报,王安琪,郑浩然,等.背角无齿蚌幼蚌心率对镉暴露胁迫的响应及预警评估[J].渔业科学进展,2021,42(1):186-192.CHEN X B,WANG A Q,ZHENG H R,et al.Response of heart rates to cadmium-exposed stress and early warning capacity in Anodonta woodiana juveniles[J].Progress in Fishery Sciences,2021,42(1):186-192.(in Chinese)
[25] RAJAGOPAL S,VAN DER VELDE G,JENNER H A.Shell valve movement response of dark false mussel,Mytilopsis leucophaeta,to chlorination[J].Water Research,1997,31(12):3187-3190.
[26] 文祝友,刘晓燕,金燮理,等.三角帆蚌嗜水气单胞菌病的病理研究[J].湖南农业大学学报,2001,(1):56-59.WEN Z Y,LIU X Y,JIN X L,et al.Study on Pathology of Hyriopsis cumingii Lea Disease Caused by Aeromonas hydrophila[J].Journal of Hunan Agricultural University,2001,(1):56-59.(in Chinese)
[27] NICHOLSON S.Cardiac and lysosomal responses to periodic copper in the mussel Perna viridis (Bivalvia:Mytilidae)[J].Marine Pollution Bulletin,1999,38(12):1157-1162.
[28] BASTI L,NAGAI K,SHIMASAKI Y,et al.Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum[J].Aquaculture,2009,291(1/2):41-47.
[29] 朱龙,周尚颉,马雨阳,等.双酚A致文蛤鳃组织氧化损伤[J].生态毒理学报,2024,19(1):223-231.ZHU L,ZHOU S J,MA Y Y,et al.Oxidative damage of bisphenol a to Meretrix petechialis gill tissues[J].Asian Journal of Ecotoxicology,2024,19(1):223-231.(in Chinese)
[30] 牛志凯,刘宝锁,张东玲,等.合浦珠母贝3个地理群体杂交后代生长性状和闭壳肌拉力的比较分析[J].南方水产科学,2015,11(1):26-32.NIU Z K,LIU B S,ZHANG D L,et al.Comparative analysis of growth traits and shell-closing strength among hybrid populations from three geographical groups of pearl oyster (Pinctada fucata)[J].South China Fisheries Science,2015,11(1):26-32.(in Chinese)
[31] 刘洪波,陈修报,杨健.自然光照下三种淡水贝类张闭壳的活动特征[J].水产学杂志,2018,31(4):27-31.LIU H B,CHEN X B,YANG J.Valve movement behavior of three freshwater mussels Corbicula fluminea,Hyriopsis cumingii and Anodonta woodiana under natural light[J].Chinese Journal of Fisheries,2018,31(4):27-31.(in Chinese)
[32] COATES C J,SÖDERH LL K.The stress-immunity axis in shellfish[J].Journal of Invertebrate Pathology,2021,186:107492.
LL K.The stress-immunity axis in shellfish[J].Journal of Invertebrate Pathology,2021,186:107492.
[33] 王海宁,姜晓东,吴旭干,等.中华绒螯蟹二龄早熟和晚熟品系选育第四代在扣蟹阶段养殖性能和免疫性能的评价[J].水产学报,2020,44(5):816-826.WANG H N,JIANG X D,WU X G,et al.Evaluation of culture and immunity performance of the second-year-old early-maturing and late-maturing strains of the fourth selective generation during the juvenile culture of Chinese mitten crab (Eriocheir sinensis)[J].Journal of Fisheries of China,2020,44(5):816-826.(in Chinese)
[34] 蒋文枰,程顺,刘士力,等.翘嘴鲌及翘嘴鲌“全雌1号”氨氮胁迫下的生理应答反应及耐受性分析[J].四川农业大学学报,2024,42(1):134-139.JIANG W P,CHENG S,LIU S L,et al.Analysis of physiological responses and tolerance in Culter alburnus and Culter alburnus var.‘All-Female 1’ subjected to ammonia nitrogen stress[J].Journal of Sichuan Agricultural University,2024,42(1):134-139.(in Chinese)
[35] 姜晓东,吴旭干,何杰,等.中华绒螯蟹2龄早熟、晚熟选育群体和非选育群体蟹种免疫性能的比较[J].海洋渔业,2017,39(2):181-189.JIANG X D,WU X G,HE J,et al.Comparison of immune performance of juvenile crabseeds among the second instar early-maturing,late-maturing and non-selective populations of Chinese mitten crab Eriocheir sinensis[J].Marine Fisheries,2017,39(2):181-189.(in Chinese)
[36] 许瀚之,张华,熊盼盼,等.马氏珠母贝异速生长个体对免疫刺激的差异响应[J].热带海洋学报,2022,41(5):180-188.XU H Z,ZHANG H,XIONG P P,et al.Differential responses of allometric individuals to immune stimuli in Pinctada fucata martensii[J].Journal of Tropical Oceanography,2022,41(5):180-188.(in Chinese)
[37] 卢彤岩,郭德文,赵吉伟,等.哲罗鱼不同组织SOD、CAT、ACP和AKP活力的比较研究[J].水产学杂志,2010,23(4):10-13.LU T Y,GUO D W,ZHAO J W,et al.Activity comparison of SOD,CAT,ACP and AKP in the tissues of Hucho taimen[J].Chinese Journal of Fisheries,2010,23(4):10-13.(in Chinese)