厚壳贻贝(Mytilus coruscus)是中国东海沿海地区常见的双壳贝类,也是重要的海水养殖经济贝类[1]。按生活方式可将厚壳贻贝生命周期分为浮游生活阶段和底栖附着阶段,幼虫变态过程是衔接这两个阶段的关键环节。幼虫变态率的高低直接影响着厚壳贻贝苗种的产量和质量,也是决定厚壳贻贝养殖经济效益与发展前景的关键因素[2]。
本团队前期研究证明,细菌形成的生物被膜具有诱导厚壳贻贝幼虫完成变态的能力,然而环境因子的变化会显著影响生物被膜的形成,从而影响其对贻贝幼虫变态的诱导能力[3-6]。如随着盐度和温度升高,海洋希瓦氏菌株(Shewanella loihica)生物被膜成膜能力增强,细菌密度和生物被膜形成量显著升高,诱导贻贝幼虫变态能力显著上升[3];深海菌株枝芽苞菌(Virgibacillus)生物被膜胞外多糖(exopolysaccharides,EPS)含量随温度升高而增多,生物被膜诱导贻贝变态能力与胞外多糖含量变化一致[4]。近年来,气候变化愈发明显,全球海表面温度(SST)在 2011—2020 年间平均温度上升了0.88 ℃(0.68 ℃~1.01 ℃)[5-6],东海作为中国重要的厚壳贻贝养殖区域,海表面年平均温度近60年来升高了1.45 ℃(1.13 ℃~1.77 ℃),且海水年平均温度变化幅度、夏季平均最高温和冬季平均最低温等均显著升高[7-8]。然而,目前海水温度升高对细菌生物被膜形成的影响及生物被膜诱导厚壳贻贝幼虫变态的影响尚不清楚。
假交替单胞菌属(Pseudoalteromonas)在东海海域中广泛分布,本研究中选取分离自东海自然生物被膜且对厚壳贻贝幼虫变态有着稳定诱导能力的海假交替单胞菌(Pseudoalteromonas marina)作为研究对象[9-10],且实验室已获得该菌株全基因组。
本研究旨在探究海洋暖化对海假交替单胞菌形成生物被膜及诱导厚壳贻贝幼虫变态能力的影响。在中国东海海域常年冬季海水表层水温为14 ℃、春秋水温为18 ℃、最高水温27 ℃的基础上[11-12],根据海洋暖化发展趋势预测2100年全球海表面温度上升4 ℃[13-14],本研究中设置18 ℃、22 ℃、31 ℃ 3个试验组,分别对应东海冬季、春秋季、夏季在2100年的预测水温。通过检测海假交替单胞菌随海水温度升高后其生物被膜特性、厚壳贻贝幼虫变态能力及生物被膜中可调控厚壳贻贝幼虫变态的信号分子环二鸟苷酸 (cyclic dimeric guanosine monophosphate,c-di-GMP)的变化情况,探究了温度、生物被膜特性和厚壳贻贝幼虫变态之间的相互关系,试验结果可为解析海洋暖化对细菌生物被膜的形成及其调控海洋无脊椎动物幼虫变态的影响提供数据支持。
1 材料与方法
1.1 材料
试验用厚壳贻贝幼虫来自福建漳浦育苗场,壳长为(280.3±0.5) μm,壳高为(240.5±0.5) μm。养殖贻贝幼虫的自然海水需经过0.45 μm滤膜过滤,盐度为30,每日投喂试验室养殖的新鲜湛江等鞭金藻(Lsochrysis zhanjiangensis),每隔两日更换海水。在18 ℃、黑暗环境下暂养48 h后开始试验。试验所用细菌采用分离自东海自然生物被膜上的海假交替单胞菌。
1.2 方法
1.2.1 细菌生物被膜制备 依据杨金龙等[9]的方法,细菌首先通过平板划线在25 ℃下培养12 h,选择单一菌落接种于液体培养基。随后,在200 r/min的摇床中避光培养16 h,离心去除培养液,用高压灭菌过滤海水(autoclaved filtered seawater,AFSW)重悬菌体,形成细菌悬浮液。菌液稀释后,取1 mL通过0.22 μm滤膜过滤,再采用0.1%吖啶橙溶液染色5 min,利用显微镜观察并计算细菌密度(CFU/mL)。每个生物被膜样本重复测定3次,每次随机选择10个视野。根据初始密度5×108 CFU/mL,以30 mL培养皿体系(直径64 mm×19 mm)中计算加入相应体积的菌液,再加入AFSW。将含有灭菌玻片的培养皿在黑暗条件分别置于14 ℃、18 ℃、22 ℃、27 ℃、31 ℃下培养48 h形成生物被膜,每个密度设置12个平行。
1.2.2 厚壳贻贝幼虫变态 试验开始前需将幼虫暂养48 h以上。按照“1.2.1节”的方法制备生物被膜,设置初始浓度为5×108 CFU/mL。在生物被膜形成48 h后,将其转到新的培养皿中,向每个培养皿添加20 mL的AFSW,并向每个培养皿中加入20只活力旺盛的幼虫,在18 ℃避光环境中培养。每隔12 h观察记录幼虫的变态情况,直至96 h,记录并计算96 h幼虫变态率及相关行为学信息[15]。试验同时设置对照组,以AFSW作为空白对照组,以10-4 mol/L肾上腺素(epinephrine,EPI)刺激作为阳性对照组,每个组别设置9个重复,以确保结果的准确性和可靠性。
1.2.3 生物被膜细菌密度的计数 参考杨金龙等[9]的方法,对生物被膜细菌密度进行记录,在生物被膜形成48 h后,取出成膜玻片,用5%的甲醛水溶液将其固定24 h,将生物被膜用0.1%吖啶橙溶液避光染色5 min。完成染色后,将玻片避光干燥,在玻片中央滴加镜油,放置盖玻片后再滴加镜油,在1 000×放大倍数下用Olympus BX51显微镜(Olympus Corporation,日本)观察并计算细菌密度(CFU/mL)。为确保试验准确性,每个玻片重复测定3次,每次随机选择10个视野。
1.2.4 生物被膜形成能力检测 参考李芬等[16]方法取6孔板,每孔加入初始密度为5×108 CFU/mL的菌液20 mL,不同温度下培养48 h,弃培养基,每组设置6个重复,加PBS洗涤干燥,干燥完成后各孔加入1%结晶紫2 mL,再用PBS冲洗干燥,干燥后加入无水乙醇溶解30 min,测定各孔的OD600 nm数值。
1.2.5 共聚焦激光扫描显微镜图像分析 生物被膜进行染色,在Peng等[17]和Gonz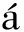 lez等[18]的方法基础上,将制备48 h后的生物被膜进行染色处理,用0.9%的生理盐水轻微清洗,提前配备共聚焦工作液,ConA-TMR用于α-多糖染色,Calcofluor white用于β-多糖染色;将配置好的共聚焦染液添加到细菌生物被膜上避光染色30 min,完成染色后用0.9%的生理盐水洗去多余的染料,并进行避光干燥;观察分析染色后的生物被膜,将染色的生物被膜用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)通过LAS X版本仪器(Leica,德国)进行拍摄。通过Image J软件计算,将原始照片转换尺寸,用生物量(μm3)代替阈值。每个生物被膜每种染料进行3个生物学重复,每次重复随机选择3个视野。
lez等[18]的方法基础上,将制备48 h后的生物被膜进行染色处理,用0.9%的生理盐水轻微清洗,提前配备共聚焦工作液,ConA-TMR用于α-多糖染色,Calcofluor white用于β-多糖染色;将配置好的共聚焦染液添加到细菌生物被膜上避光染色30 min,完成染色后用0.9%的生理盐水洗去多余的染料,并进行避光干燥;观察分析染色后的生物被膜,将染色的生物被膜用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)通过LAS X版本仪器(Leica,德国)进行拍摄。通过Image J软件计算,将原始照片转换尺寸,用生物量(μm3)代替阈值。每个生物被膜每种染料进行3个生物学重复,每次重复随机选择3个视野。
1.2.6 生物被膜脂多糖(lipopolysaccharide,LPS)测定 生物被膜成膜48 h后刮膜得到细菌生物被膜悬浮液,室温8 000 r/min离心3 min,依次加入提取液试剂A、B、C提取出脂多糖样品。设置空白组和待测样品组进行脂多糖含量测定[19],加样封板,37 ℃温浴,弃去再加满,静置30 s弃去,重复5次,再加入显色液A50和B50轻摇匀,37 ℃黑暗条件下反应,后加入终止液反应,450 nm波长下空白孔调零,对每个孔测量其OD值,代入脂多糖标准回归方程可得样品脂多糖含量。
1.2.7 生物被膜可拉酸(Colanic acid,CA)测定 生物被膜可拉酸染色参考Zeng等[20]的方法,通过测量岩藻糖定量可拉酸。用灭菌玻片从结晶皿底部收集细胞至15 mL离心管中,每个温度设9组样品。每个样品(1.5 mL)煮沸10 min,以13 000 r/min离心5 min。收集上清液(1 mL),加入45 mL的H2SO4溶液,v(H2SO4)∶v(H2O) = 6∶1,并将混合物在100 ℃下加热20 min。取混合物(200 μL)放入酶标仪(Flah,中国)中,在OD396 nm和OD427 nm下测定。然后向混合物(3.5 mL)中加入新鲜半胱氨酸(3% m/v,100 μL),并在黑暗中培养1 h后在OD396 nm和OD427nm 下再次测量。岩藻糖浓度通过加入半胱氨酸盐酸盐前后的OD396 nm差异计算。使用L-岩藻糖校准曲线确定可拉酸浓度。
1.2.8 生物被膜纤维素测定 根据Zeng等[20]描述对生物被膜中纤维素定量,制备生物被膜,设置初始浓度为5×108 CFU/mL。成膜后,采用无菌玻璃片刮取生物被膜,用1 mL AFSW稀释于无酶Tube管中(菌悬液)。测试并稀释菌悬液至OD600 nm值为1.5。然后加入Calcofluor(卡尔科弗卢尔染剂)使其浓度为15 μg/mL,迅速将其置于水浴锅内30 ℃下孵育2 h,13 000 r/min下离心20 min后,取上清液测定350 nm处吸光度。根据Calcofluor标准曲线计算纤维素浓度,每个温度组设置9个重复。
1.2.9 生物被膜c-di-GMP的含量测定 制备细菌初始浓度为5×108 CFU/mL的生物被膜,48 h后刮取生物被膜,低温下以12 000 r/min离心 5 min,弃去上清液,在冰上风干沉淀物后,往里面加入c-di-GMP提取液100 μL,吹打混匀,在冰上孵育15 min,继续以16 000 r/min离心5 min,吸取少量上清液于色谱瓶,同时适当稀释c-di-GMP 作为标曲,采用液质联用质谱仪(Waters,美国)精确检测c-di-GMP浓度[21]。
1.3 数据处理
本研究中采用GraphPad Prism 8(GraphPad Software Inc,美国)软件进行绘图;采用JMPTM(SAS Institute Co,中国)对数据进行显著性差异检测;显著性差异设为0.05,通过OriginPro(Version 2021)软件进行Pearson相关性分析。
2 结果与分析
2.1 不同海水温度下海假交替单胞菌生物被膜形成能力的变化
温度升高对生物被膜细菌密度的影响如图1所示。在相同初始密度5×108 cells/cm2下形成生物被膜,随着海水温度的升高,生物被膜细菌密度呈先升高后降低趋势,当温度达22 ℃时,细菌密度达最高值为5.5×107 cells/cm2;当温度达31 ℃时,细菌密度达到最低值为2.5×107 cells/cm2。与海水温度14 ℃生物被膜细菌密度相比,温度为18 ℃下细菌密度无显著性差异(P>0.05),22 ℃下细菌密度增加28.8%(P<0.05);与22 ℃时生物被膜细菌密度相比,31 ℃时细菌密度显著下降50.1%(P<0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异 (P>0.05),下同。
The means with different letters are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 不同温度下海假交替单胞菌生物被膜细菌密度变化
Fig.1 Changes in bacterial density in the biofilm of Pseudoalteromonas marina at different temperatures
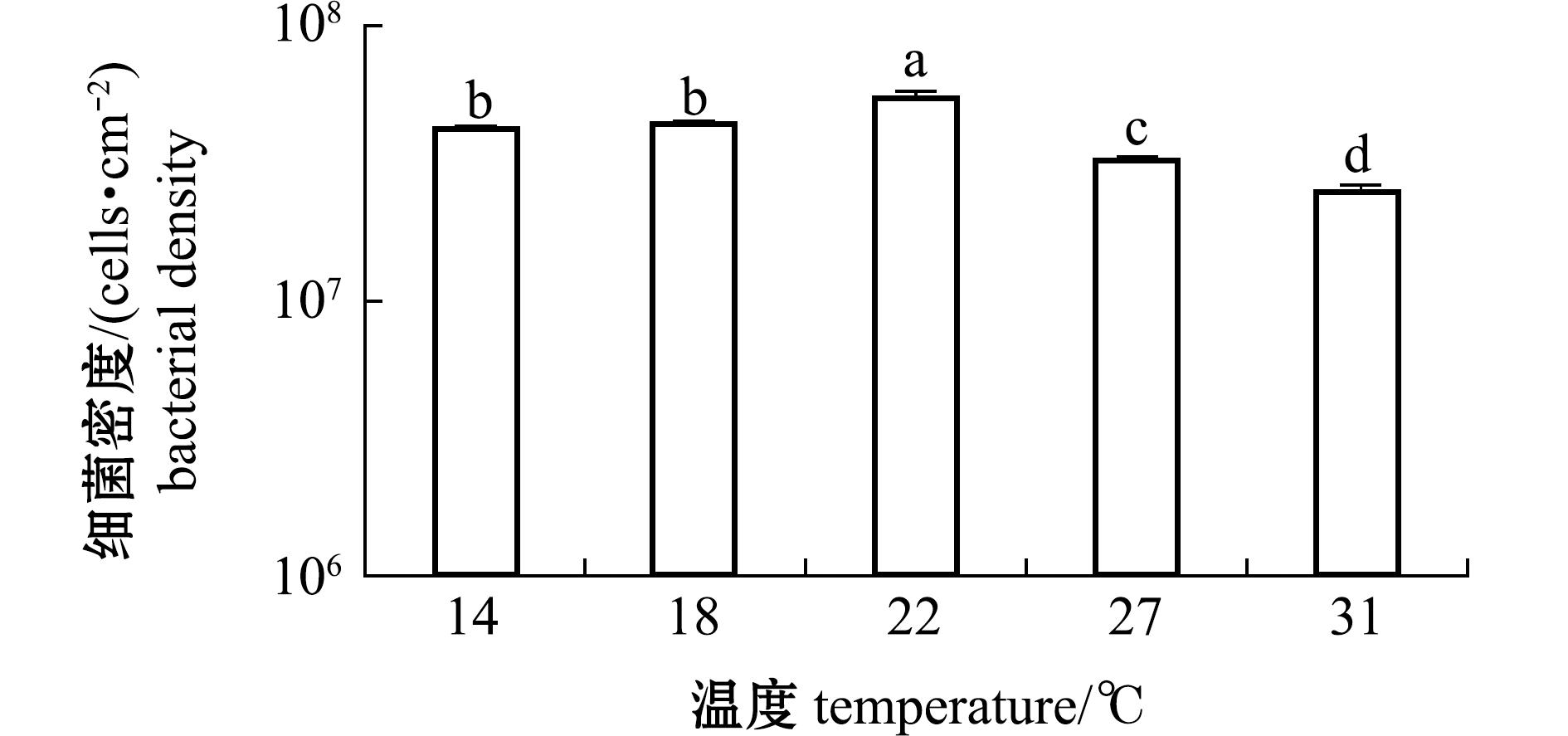
从图2可见,随着海水温度的升高,细菌生物被膜形成能力和膜厚先升高后下降,与细菌密度呈正相关。膜厚在22 ℃时达到最高值(P<0.05)。与海水温度为14 ℃时形成生物被膜膜厚相比,18 ℃和22 ℃时生物被膜膜厚分别增加19.6%和34.8%;与22 ℃相比,27 ℃和31 ℃时生物被膜膜厚分别下降26.3%和64.8%(P<0.05)。
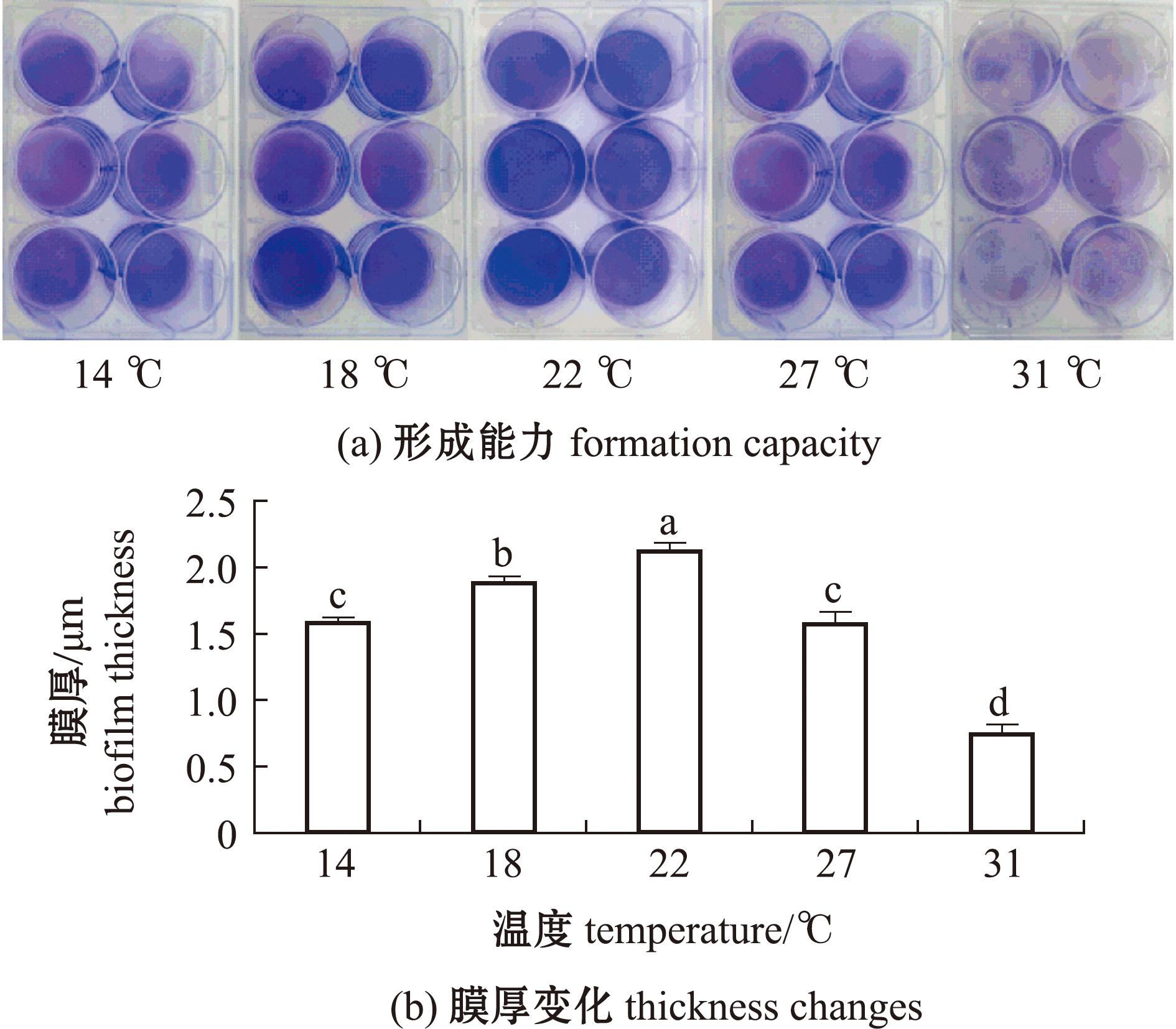
图2 不同温度下海假交替单胞菌生物被膜形成能力和膜厚度变化
Fig.2 Biofilm formation capacity and thickness changes of Pseudoalteromonas marina at diferent temperatures
2.2 不同海水温度下生物被膜诱导厚壳贻贝幼虫变态能力的变化
从图3(a)可见,与空白玻片作为对照组相比,5个温度下形成生物被膜均具有诱导活性(P<0.05),随着温度上升,生物被膜的诱导活性先上升后下降,当海水温度为22 ℃时幼虫变态率最高,为36.0%(P<0.05)。与海水温度14 ℃生物被膜诱导活性比,22 ℃时细菌诱导活性增加50.6%(P<0.05);与22 ℃时生物被膜诱导活性相比,31 ℃时诱导活性下降56.7%(P<0.05)。从图3(b)可见,幼虫死亡率随海水温度升高呈先减少后上升趋势,22 ℃时变态率最高且死亡率较低,高于22 ℃时幼虫仍存在游泳行为,变态率随温度升高呈现下降趋势。
blank为空白组,为过滤灭菌海水;EPI为阳性对照组,为10-4 mol/L肾上腺素刺激。
The blank group was AFSW,and the EPI was 10-4 mol/L adrenaline stimulated as positive control group.
图3 不同温度下海假交替单胞菌生物被膜影响幼虫变态变化
Fig.3 Biofilm of Pseudoalteromonas marina affects the larval metamorphosis at different temperature
2.3 不同海水温度下海假交替单胞菌生物被膜胞外多糖的分布及含量变化
对不同温度下形成的生物被膜胞外多糖进行共聚焦定性分析,通过CLSM计算生物量,从图4可见,生物被膜中α-多糖含量随海水温度升高先增加后下降 (图4 (a) )。在22 ℃时生物被膜中α-多糖生物量达到最高值5 545.5 μm3,相比14 ℃上升46.4%;31 ℃时生物量最低为2 194.6 μm3,相比22 ℃时下降 60.4% (P<0.05)(图4(b))。生物被膜中β-多糖(图4(b))生物量随海水温度升高逐渐增加,31 ℃时达最高值18 949.9 μm3,相比14 ℃时上升168.8%(P<0.05)。
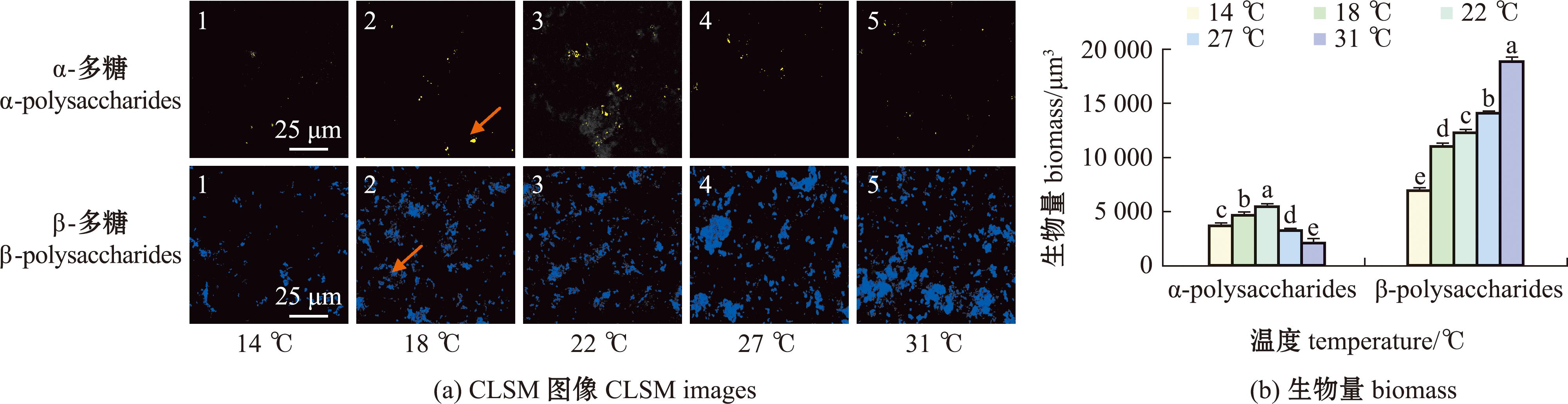
图4 不同温度下海假交替单胞菌生物被膜胞外α-多糖、β-多糖的变化
Fig.4 Changes in extracellular α-polysaccharides and β-polysaccharides of Pseudoalteromonas marina at different temperatures
2.4 不同海水温度下生物被膜脂多糖、可拉酸、纤维素含量的变化
随着海水温度升高,细菌生物被膜胞外多糖发生变化。为了探究何种多糖发生变化,后续对细菌生物被膜脂多糖、可拉酸和纤维素等进行测定。从图5可见,生物被膜脂多糖定量表明,随着海水温度升高,脂多糖含量先升高后下降(P<0.05),海水温度为14 ℃、31 ℃时含量最低且无显著性差异(P>0.05),在18 ℃、22 ℃时最高且无显著性差异(P>0.05);海水温度为22 ℃时,脂多糖含量为18.8 mg/L,与海水温度14 ℃相比增加34.6%(P<0.05);海水温度31 ℃时脂多糖含量为14.0 mg/L,与22 ℃相比下降26.7%(P<0.05)。
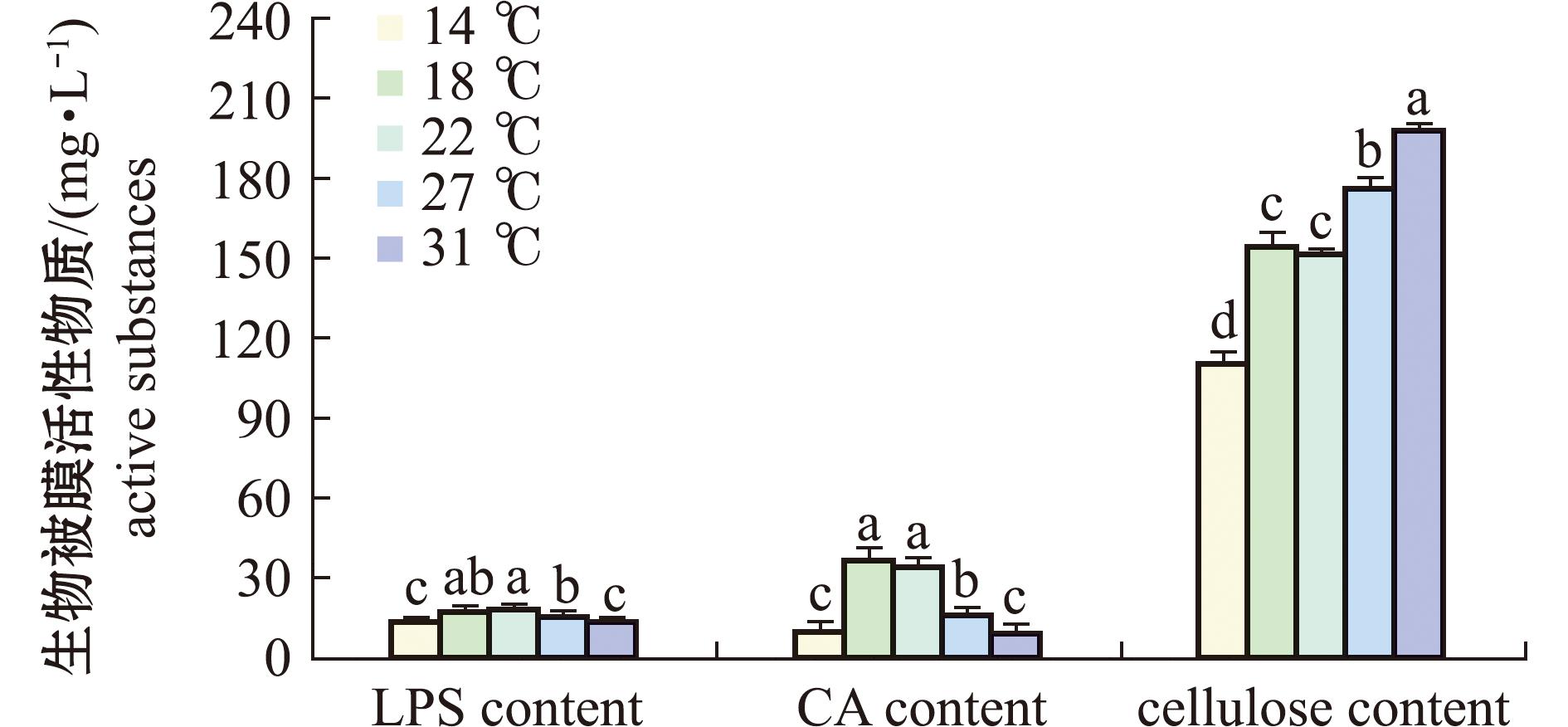
图5 不同温度下海假交替单胞菌生物被膜活性物质含量变化
Fig.5 Changes in the content of active substances in the biofilm of Pseudoalteromonas marina at different temperatures
海水温度升高对细菌形成生物被膜可拉酸含量有一定影响(图5),可拉酸含量随海水温度升高呈先上升后下降的趋势,在海水温度为14 ℃、31 ℃时,生物被膜可拉酸含量最低,最低值为9.9 mg/L,在18 ℃、22 ℃时最高且无显著性差异(P>0.05),最高值为37.1 mg/L(P>0.05)。与海水温度14 ℃时相比,22 ℃时可拉酸含量上升225.5%;与海水温度22 ℃时相比,31 ℃时可拉酸含量下降71.3%(P<0.05)。
海水温度升高对细菌形成生物被膜胞外纤维素含量有一定影响(图5)。随着海水温度的上升,生物被膜胞外纤维素含量持续上升(P<0.05)。在海水温度为14 ℃时含量最低,为110.4 mg/L,当温度达到31 ℃时,纤维素含量达到最高值198.3 mg/L;与海水温度为14 ℃时相比,31 ℃时纤维素含量增加79.4%(P<0.05)。
2.5 不同海水温度下生物被膜c-di-GMP含量的变化
用液质联用质谱仪(Waters,美国)检测c-di-GMP浓度,发现其含量随海水温度的升高(图6)显著先上升后下降(P<0.05),海水温度为14 ℃、31 ℃时含量最低且无显著性差异(P>0.05),最低值为49.2 ng/mL,海水温度22 ℃时c-di-GMP含量最高为112.7 ng/mL,与14 ℃时相比增加128.6%(P<0.05);与海水温度为22 ℃时相比,海水温度为31 ℃时c-di-GMP含量下降47.3%(P<0.05)。
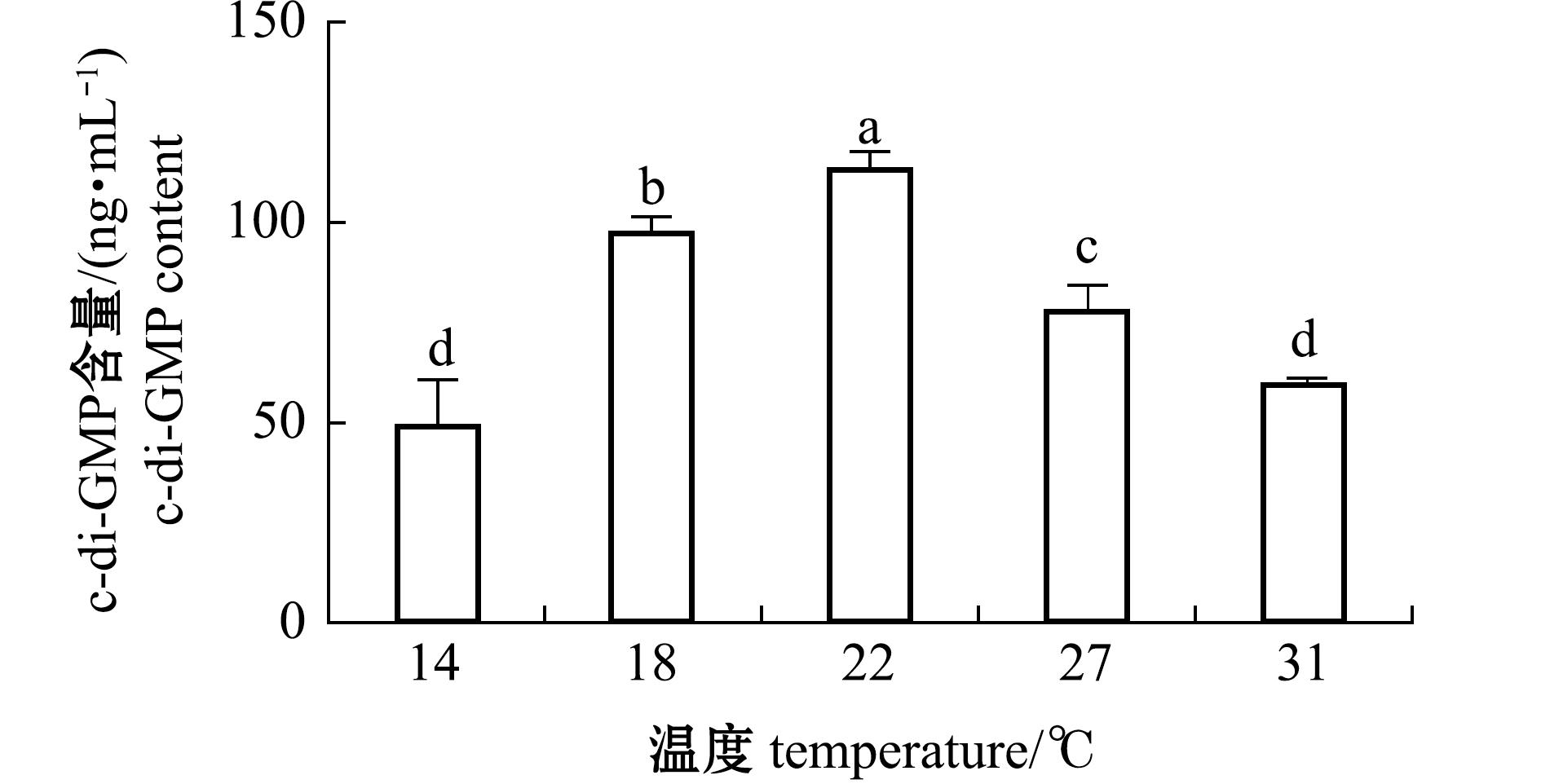
图6 不同温度下海假交替单胞菌生物被膜c-di-GMP含量变化
Fig.6 Changes in c-di-GMP content in the biofilm of Pseudoalteromonas marina at different temperatures
2.6 厚壳贻贝幼虫变态与生物被膜生物学特性的相关性分析
根据以上不同结果进行多因素相关性分析,以探究随海水温度升高海假交替单胞菌生物被膜诱导厚壳贻贝幼虫变态能力与生物被膜其他因素间的相关性。结果表明(图7),厚壳贻贝幼虫变态与信号分子c-di-GMP水平相关性系数为0.84,具有显著正相关性(P<0.05)。同时厚壳贻贝幼虫变态与胞外α-多糖、脂多糖、可拉酸含量的相关系数分别为0.88、0.86、0.85,呈显著正相关性(P<0.05),与胞外β多糖、纤维素无相关性。此外,信号分子c-di-GMP水平与胞外α-多糖、脂多糖、可拉酸含量相关性系数分别为0.81、0.90、0.87,呈显著正相关性(P<0.05);胞外β-多糖与纤维素含量相关系数为0.90,呈显著正相关(P<0.05)。
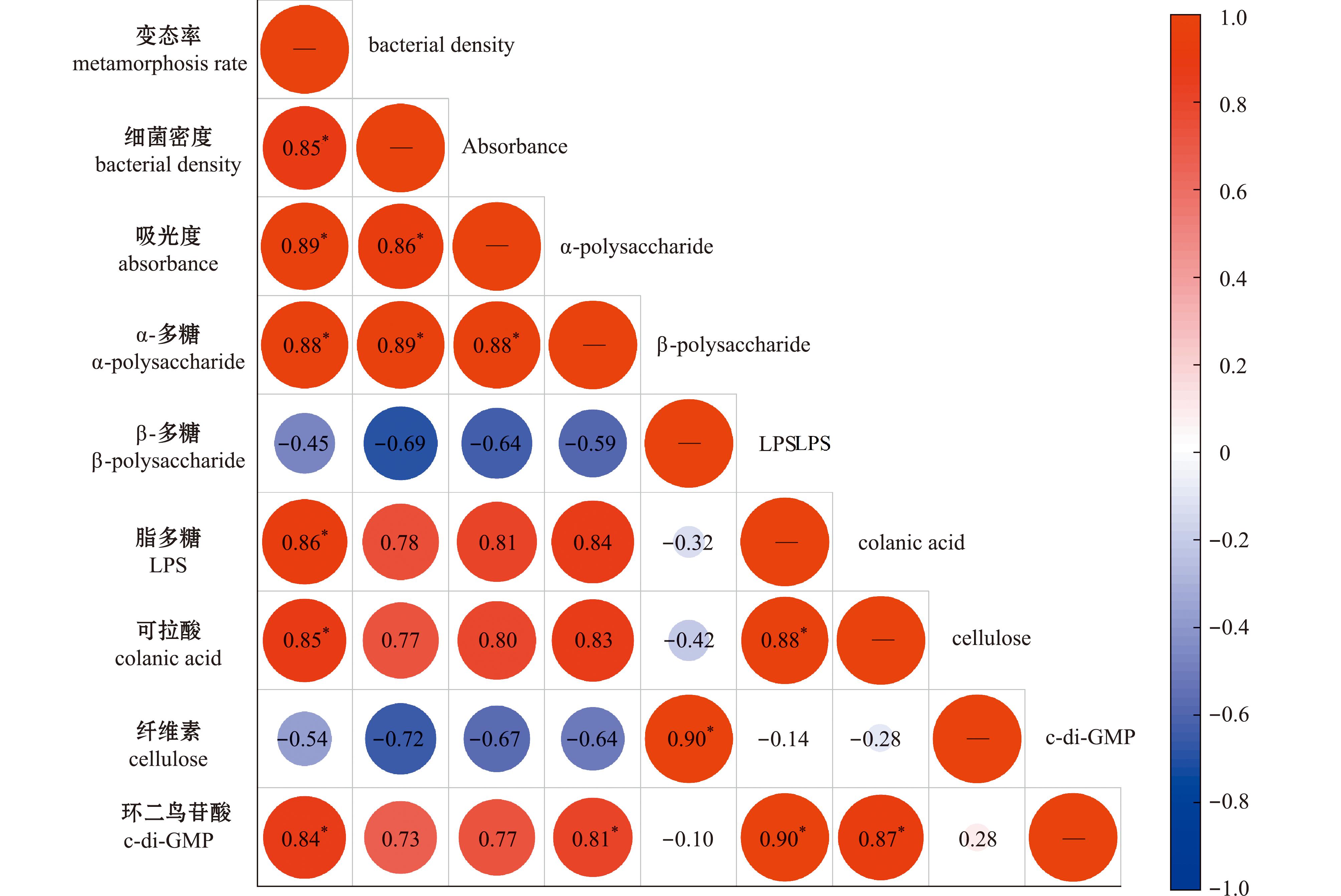
*表示与对应组有显著性差异(P<0.05),红色为正相关系数,蓝色为负相关系数。
*means significant difference compared with the control group (P<0.05),red is the positive correlation coefficient,and blue is the negative correlation coefficient.
图7 厚壳贻贝幼虫变态与生物被膜生物学特性的相关性分析
Fig.7 Correlation analysis between larval metamorphosis of Mytilus coruscus and biological characteristics of biofilm
3 讨论
厚壳贻贝的变态过程受细菌生物被膜调控,随着海水暖化问题日益严重,海洋细菌形成生物被膜的能力及其对厚壳贻贝幼虫变态诱导能力会受到一定影响[3-4,15]。尽管升温对海洋细菌造成影响较大,但目前关于温度升高对海洋细菌生物被膜及厚壳贻贝幼虫变态影响的研究报道较少。
3.1 海洋暖化对细菌生物被膜的影响
生物被膜是细菌在自然界中的主要存在形式,其构成主要是由10%细菌及其90%胞外产物组成[22]。已有研究表明,温度变化能够显著影响生物被膜的生物学特性改变。如随着温度的升高,单增李斯特菌(Listeria monocytogenes)的生物被膜形成能力呈先上升后下降的趋势[23]。高伟等[3]研究发现,一定范围内随着温度升高,近海来源的光伏希瓦氏菌(Shewanella loihica)生物被膜的细菌密度和膜厚显著增强。本研究表明,随着海水温度的升高,海假交替单胞菌生物被膜的细菌密度先上升后下降,在22 ℃时达到最大值;生物被膜形成量也呈现相似的趋势。
胞外产物是形成成熟生物被膜的关键条件,胞外多糖是胞外产物中最主要的成分,在维持生物被膜结构、保持细胞生存所需的营养物质及促进细胞与细胞间的相互作用等方面发挥作用[24-26]。研究表明,25 ℃恒温培养副溶血性弧菌(Vibrio parahaemolyticus)生物被膜胞外α-多糖显著高于4 ℃、15 ℃、37 ℃下培养,此时生物被膜黏附性增强[27]。本研究发现,随着温度升高,细菌生物被膜的胞外α-多糖含量在22 ℃时达到最大值,与生物被膜细菌密度和生物被膜形成量呈正相关。由此推测,细菌胞外α-多糖增强了细菌与基质表面的黏附作用,增强了生物被膜的稳定性,利于生物被膜的形成。此外,本研究中发现,细菌胞外β-多糖含量随海水温度的升高逐渐升高,与生物被膜的细菌密度及生物被膜形成量无显著相关性,其原因可能是细菌胞外β-多糖具有热稳定性,可以与胞外其他物质形成网络结构保护细菌[28],同时胞外β-多糖具有抑制生物被膜形成及分解已形成生物被膜的功能[29]。
3.2 生物被膜对厚壳贻贝幼虫变态的影响
细菌生物被膜对厚壳贻贝幼虫变态的诱导活性主要与生物被膜胞外产物及其调控信号分子有关[3-4]。本团队前期研究发现,细菌中常见的第二信使c-di-GMP调控多种胞外多糖的产生,参与厚壳贻贝幼虫的变态发育过程[30]。其中,脂多糖[19,31]、可拉酸[32]可以直接诱导厚壳贻贝幼虫变态。研究表明,构建海假交替单胞菌c-di-GMP突变菌ΔcdgB,突变菌的c-di-GMP含量增加17.5%,其生物被膜脂多糖含量增多43.3%;回补基因ΔcdgB使脂多糖含量恢复至野生菌水平,这表明脂多糖含量受cdgB基因的调控[31]。构建海假交替单胞菌细菌多糖合成基因突变菌Δ01912,突变菌可拉酸含量增加,同时c-di-GMP含量增高,01912可能是通过c-di-GMP水平来调节可拉酸的产生,厚壳贻贝变态率升高[17]。本研究中,生物被膜的c-di-GMP水平、胞外脂多糖及可拉酸的含量均随温度的升高呈现先升高后下降趋势,并与生物被膜诱导能力显著正相关(P<0.05)。脂多糖由O-抗原、核心多糖和类脂A组成,与Toll样受体(Toll-like receptors,TLR)结合参与生物体的多种生理活动[33],厚壳贻贝幼体发育过程中,TLR作为重要受体,可能参与或调控厚壳贻贝幼虫的变态发育[34]。同时可拉酸和脂多糖在组成上具有相似之处[35],两者都含有半乳糖和葡萄糖。有研究表明,大肠杆菌中可拉酸的合成与脂多糖存在关联,脂多糖特殊的结构可能会通过激活细菌双组分调节系统(regulator of capsule synthesis,Rcs)来影响可拉酸的分泌[18]。由此推测,生物被膜脂多糖促进了可拉酸的分泌;且随着温度升高,脂多糖和可拉酸含量变化是导致生物被膜诱导幼虫变态能力随温度显著变化的原因之一。
纤维素主要由葡萄糖组成,是典型的细菌胞外β-多糖[35]。生物被膜中纤维素含量过高[37]或降低[30]均会降低生物被膜对厚壳贻贝幼虫的诱导能力。研究表明,敲除海假交替单胞菌纤维素合成基因bcsQ,突变菌ΔbcsQ生物被膜的纤维素含量降低50.2%,c-di-GMP下降78.0%,可拉酸下降63.2%;bcsQ基因的缺失通过减少c-di-GMP的产生,导致c-di-GMP调控可拉酸含量下降[30]。此外,有研究表明,当纤维素含量累计一定量时,主要通过降低胞外α-多糖分泌,间接调控厚壳贻贝幼虫附着变态[36]。本研究中,温度升高使纤维素含量变化,由此推测,温度升高影响c-di-GMP的含量,促进纤维素生成,从而导致生物被膜诱导能力降低。
综上所述,海水温度变化影响了细菌生物被膜的生物学特性且可诱导厚壳贻贝幼虫变态的能力,c-di-GMP在其中发挥着至关重要的作用,作为细菌重要的第二信使,其可以调控细菌生物被膜的形成及胞外多糖的生物量,c-di-GMP水平的高低影响细菌脂多糖、可拉酸和纤维素等的分泌。本研究中表明,海水温度的升高导致生物被膜活性物质脂多糖和可拉酸的生物量先升高后下降,与生物被膜诱导能力呈显著正相关;而细菌生物被膜纤维素的生物量随海水温度升高而逐渐升高,纤维素含量过低或者过高均对生物被膜诱导能力存在抑制作用。本研究首次论证了随着海水温度升高,生物被膜诱导活性与胞外多糖、c-di-GMP等多种因素之间的相关性。本研究结果对于海洋暖化影响细菌生物被膜生物学特性提供了试验支持。
4 结论
1)海洋暖化影响了细菌生物被膜诱导厚壳贻贝幼虫变态的能力。
2)随着海水温度的升高,细菌生物被膜中具有诱导作用的活性物质脂多糖、可拉酸含量先升高后下降,存在抑制作用的纤维素逐渐升高,导致生物被膜诱导厚壳贻贝幼虫变态的能力呈先升高后下降趋势。
3)c-di-GMP含量随海水温度升高呈先增加后下降的趋势,海水温度的升高通过影响细菌c-di-GMP的水平,从而调控细菌被膜胞外多糖的分泌,最终影响厚壳贻贝的幼虫变态。
[1] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.CHANG Y Q.Shellfish enrichment[M].Beijing:China Agriculture Press,2007.(in Chinese)
[2] 李太武.海洋生物学[M].北京:海洋出版社,2013.LI T W.Marine biology[M].Beijing:Ocean Press,2013.(in Chinese)
[3] 高伟,郭行磐,徐嘉康,等.微生物被膜形成因子及其对厚壳贻贝附着的影响[J].大连海洋大学学报,2017,32(4):405-409.GAO W,GUO X P,XU J K,et al.Effects of environmental factors on formation of bacterial biofilms and settlement of plantigrades of mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2017,32(4):405-409.(in Chinese)
[4] 梁箫,杨丽婷,彭莉华,等.不同温度下形成的深海菌膜对厚壳贻贝幼虫变态的影响[J].水产学报,2020,44(10):1728-1741.LIANG X,YANG L T,PENG L H,et al.Effects of biofilms of deep-sea bacteria at varying temperatures on larval metamorphosis of Mytilus coruscus[J].Journal of Fisheries of China,2020,44(10):1728-1741.(in Chinese)
[5] CHENG L J,ABRAHAM J,TRENBERTH K E,et al.Another year of record heat for the oceans[J].Advances in Atmospheric Sciences,2023,40(6):963-974.
[6] 蔡榕硕,谭红建.中国近海变暖和海洋热浪演变特征及气候成因研究进展[J].大气科学,2024,48(1):121-146.CAI R S,TAN H J.Progress on the evolutionary characteristics and climatic causes for warming and marine heatwaves in the coastal China Seas[J].Chinese Journal of Atmospheric Sciences,2024,48(1):121-146.(in Chinese)
[7] 王平,毛克彪,孟飞,等.中国东海海表温度时空演化分析[J].国土资源遥感,2020,32(4):227-235.WANG P,MAO K B,MENG F,et al.Spatiotemporal evolution of sea surface temperature in the East China Sea[J].Remote Sensing for Land &Resources,2020,32(4):227-235.(in Chinese)
[8] 张翠翠,魏皓,宋贵生,等.基于IPCC-CMIP5的中国东部近海表层水温未来预估分析[J].海洋与湖沼,2020,51(6):1288-1300.ZHANG C C,WEI H,SONG G S,et al.Ipcc-cmip5 based projection and analysis of future sea surface temperature changes in coastal seas east of China[J].Oceanologia et Limnologia Sinica,2020,51(6):1288-1300.(in Chinese)
[9] 杨金龙,郭行磐,陈芋如,等.中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响[J].水产学报,2015,39(3):421-428.YANG J L,GUO X P,CHEN Y R,et al.Effects of bacterial biofilms formed on middle wettability surfaces on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2015,39(3):421-428.(in Chinese)
[10] YANG J L,GUO X P,DING D W.Draft genome sequence of Shewanella sp.ECSMB14101,isolated from the East China Sea[J].Genome Announcements,2015,3(1):e01388-14.
[11] ZHOU B T,XU Y.CMIP5 analysis of the interannual variability of the Pacific SST and its association with the Asian-Pacific oscillation[J].Atmospheric and Oceanic Science Letters,2017,10(2):138-145.
[12] 化成君,伍玉梅,张衡,等.2014年东黄海海表温度季节变化分析[J].渔业信息与战略,2016,31(3):193-205.HUA C J,WU Y M,ZHANG H,et al.Analysis on the seasonal variability of sea surface temperature in the East the Yellow Sea in 2014[J].Fishery Information &Strategy,2016,31(3):193-205.(in Chinese)
[13] MASSON-DELMOTTE V.Climate change 2021:the physical science basis:Working Group I contribution to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change[M].
[14] NELSON MP.The science of climate change:a love story[J].BioScience,2022,72(9):812-813.
[15] LIANG X,CHEN Y-R,GAO W,et al.Effects on larval metamorphosis in the mussel Mytilus coruscus of compounds that act on downstream effectors of G-protein-coupled receptors[J].Journal of the Marine Biological Association of the United Kingdom,2018,98(2):333-339.
[16] 李芬,范玉堂,王丽娟,等.牛乳源大肠杆菌生物被膜形成及抗生素的作用[J].西北农业学报,2020,29(7):983-989.LI F,FAN Y T,WANG L J,et al.Biofilm formation and antibiotics resistance of Escherichia coli isolated from milk[J].Acta Agriculturae Boreali-occidentalis Sinica,2020,29(7):983-989.(in Chinese)
[17] PENG L H,LIANG X,CHANG RH,et al.A bacterial polysaccharide biosynthesis-related gene inversely regulates larval settlement and metamorphosis of Mytilus coruscus[J].Biofouling,2020,36(7):753-765.
[18] GONZ LEZ-MACHADO C,CAPITA R,RIESCO-PEL
LEZ-MACHADO C,CAPITA R,RIESCO-PEL EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella Agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella Agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
[19] 吴静娴,李嘉政,胡晓梦,等.脂多糖对细菌生物被膜形成及厚壳贻贝幼虫变态的影响[J].水产学报,2022,46(11):2134-2142.WU J X,LI J Z,HU X M,et al.Effects of lipopolysaccharide on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2022,46(11):2134-2142.(in Chinese)
[20] ZENG Z S,GUO X P,LI B Y,et al.Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities[J].Applied Microbiology and Biotechnology,2015,99(23):10127-10139.
[21] TRAN C,HADFIELD M G.Larvae of Pocillopora damicornis (Anthozoa) settle and metamorphose in response to surface-biofilm bacteria[J].Marine Ecology Progress Series,2011,433:85-96.
[22] VAN HOUDT R,MICHIELS C W.Biofilm formation and the food industry,a focus on the bacterial outer surface[J].Journal of Applied Microbiology,2010,109(4):1117-1131.
[23] OCHIAI Y,YAMADA F,MOCHIZUKIM,et al.Biofilm formation under different temperature conditions by a single genotype of persistent Listeria monocytogenes strains[J].Journal of Food Protection,2014,77(1):133-140.
[24] HALL-STOODLEY L,WILLIAM COSTERTON J,STOODLEY P.Bacterial biofilms:from the natural environment to infectious diseases[J].Nature Reviews Microbiology,2004,2(2):95-108.
[25] LANDINI P,ANTONIANI D,GRANT BURGESS J,et al.Molecular mechanisms of compounds affecting bacterial biofilm formation and dispersal[J].Applied Microbiology and Biotechnology,2010,86(3):813-823.
[26] BEULE A,HOSEMANN W.Bakterielle biofilme[J].Laryngo-Rhino-Otologie,2007,86(12):886-898.
[27] 赵爱静,付娇娇,宋雪迎,等.致病性与非致病性副溶血性弧菌在不同温度和接触材料表面生物被膜形成情况分析[J].食品与生物技术学报,2018,37(1):7-14.ZHAO A J,FU J J,SONG X Y,et al.Analysis of biofilm formation by pathogenic and No-pathogenic Vibrio parahaemolyticus at various temperatures and contact surfaces[J].Journal of Food Science and Biotechnology,2018,37(1):7-14.(in Chinese)
[28] IGUCHI M,YAMANAKA S,BUDHIONO A.Bacterial cellulose:a masterpiece of nature’s arts[J].Journal of Materials Science,2000,35(2):261-270.
[29] 王丹,檀茜倩,裴建博,等.虾酱源芽孢杆菌的抑菌及其胞外多糖的抗生物被膜功能[C]//中国食品科学技术学会.中国食品科学技术学会第十八届年会摘要集,2022,(22):016.WANG D,TAN Q Q,PEI J B,et al.Antibacterial function of Bacillus shrimp paste and antibiofilm function of exopolysaccharides[C]//Chinese Society of Food Science and Technology.Summary of the 18th annual meeting of Chinese Society of Food Science and Technology,2022,(22):016.(in Chinese)
[30] 程峥.细菌纤维素的合成及其高值化应用研究[D].广州:华南理工大学,2019.CHENG Z.Synthesis of bacterial cellulose and its high-valued application[D].Guangzhou:South China University of Technology,2019.(in Chinese)
[31] HU X M,PENG L H,WU J X,et al.Bacterial c-di-GMP signaling gene affects mussel larval metamorphosis through outer membrane vesicles and lipopolysaccharides[J].NPJ Biofilms and Microbiomes,2024,10(1):38.
[32] 解静仪,王小雨,李局,等.海洋细菌生物被膜可拉酸含量影响厚壳贻贝稚贝附着[J].海洋学报,2023,45(8):96-107.XIE J Y,WANG X Y,LI J,et al.Effect of the content of colanic acid in marine bacterial biofilms on the settlement of Mytilus coruscus plantigrades[J].Haiyang Xuebao,2023,45(8):96-107.(in Chinese)
[33] BAO W Y,SATUITO C G,YANG J L,et al.Larval settlement and metamorphosis of the mussel Mytilus galloprovincialis in response to biofilms[J].Marine Biology,2007,150(4):565-574.
[34] 陈缘,易扬,杨海波,等.TLR4介导自噬流在脂多糖诱导肾小管上皮细胞炎症反应中的作用研究[J].广西医科大学学报,2020,37(5):811-816.CHEN Y,YI Y,YANG H B,et al.The role of TLR4-mediated autophagic flux in lipopolysaccharide-induced inflammatory response in tubular epithelial cells[J].Journal of Guangxi Medical University,2020,37(5):811-816.(in Chinese)
[35] GRANT W D,SUTHERLAND I W,WILKINSON J F.Exopolysaccharide colanic acid and its occurrence in the Enterobacteriaceae[J].Journal of Bacteriology,1969,100(3):1187-1193.
[36] 邵安琪,李嘉政,张俊波,等.纤维素对海假交替单胞菌生物被膜生物学特性及厚壳贻贝幼虫附着变态的影响[J].水产学报,2023,47(8):118-125.SHAO A Q,LI J Z,ZHANG J B,et al.Effect of cellulose on Pseudoalteromonas marina biofilm biological characteristics and larval settlement and metamorphosis of Mytilus coruscus[J].Journal of Fisheries of China,2023,47(8):118-125.(in Chinese)