海参隶属棘皮动物门海参纲,是原始后口动物,处于从无脊椎动物向脊椎动物进化的特殊地位。海参具有复杂的水管系统,其是一个由体腔产生的管道网络,管腔内充满体腔液和体腔细胞,包括石管、环状水管、辐水管和波里氏囊等结构,其中,波里氏囊是一个突出的膨大结构,也被称为海参水管系统的附属物[1]。过去普遍认为,海参波里氏囊的功能主要是调节水管系统内的压力,从而控制体腔液流进、流出管足,支配管足的活动。然而,随着更多技术在相关研究中应用,对海参波里氏囊的功能认知正在逐步更新。近年来研究证实,海参波里氏囊具有造血功能,在海参体腔细胞生成中起着关键性作用;波里氏囊对异物刺激还可表现出明显的炎症反应以清除异物,有研究者甚至推测其在功能上类似于脊椎动物免疫器官——淋巴结[2-6]。
海参位列世界八大珍品之一,其中刺参(Apostichopus japonicus)是中国消费的主要海参品种,也是海参纲的主要经济养殖品种。《2024年中国渔业统计年鉴》显示,2023 年中国刺参养殖面积为28.9万hm2,养殖产量为29.20万t,苗种产量为646亿头,已成为中国海水养殖业的重要支柱产业[7]。然而,随着养殖规模和密度的扩大,刺参病害问题也日益凸显,其中刺参“腐皮综合征”影响较大,每年给该行业造成的经济损失高达 30~40亿元,逐渐成为刺参产业健康发展的瓶颈[8]。刺参“腐皮综合征”是当前对刺参养殖产业危害最为严重的疾病,又称化皮病、烂皮病等。该病于2003年2月在山东荣成首次发生,自2004年开始在全国范围内大规模暴发,波及中国从北方到南方的主要刺参产区。随着国家发布针对养殖端减抗和限抗的规定,抗生素的使用被严格控制,通过提高刺参自身免疫力达到防病治病的要求将是保证刺参养殖业健康发展的有效方法,因此,对刺参免疫防御系统的研究迫在眉睫。
本文利用刺参“腐皮综合征”病原菌——灿烂弧菌(Vibrio splendidus)对刺参进行体腔注射,研究了波里氏囊的形态结构变化,以及波里氏囊壁和囊腔内细胞的增殖比列变化,以进一步了解刺参波里氏囊对灿烂弧菌侵染的应答响应。研究结果可为解析刺参的免疫系统及防御机制提供更多资料,并为刺参疾病免疫防控技术研究提供更多靶点,对保障刺参健康养殖及产业可持续发展具有重要意义。
1 材料与方法
1.1 材料
试验用刺参购于大连市某刺参养殖场,体质量为50 g左右,暂养于实验室充气海水槽中,水温为16 ℃,盐度为30,暂养7 d后进行试验。刺参“腐皮综合征”病原菌——灿烂弧菌,由宁波大学李成华研究员馈赠。Cell-LightTM Apollo® 567 EdU检测试剂盒购自广州锐博生物技术有限公司。
1.2 方法
1.2.1 灿烂弧菌的人工感染 用过滤灭菌海水配制TSA培养基,从-80 ℃冰箱中取出保存的灿烂弧菌,划线接种后,挑取单菌落,使用TSB液体培养基扩大培养,4 ℃下以1 000 g离心5 min后,收集细菌沉淀,用过滤灭菌海水重悬,调整浓度至1×108 CFU/mL。试验组每头刺参体腔注射100 μL灿烂弧菌悬液,对照组注射等量无菌海水。
1.2.2 刺参波里氏囊的形态观察 灿烂弧菌体腔注射前和注射后2、6、12、24、48、72、96、120 h解剖刺参,用医用缝合线对波里氏囊顶端进行结扎后,用无菌剪刀剪下波里氏囊,观察拍照。
1.2.3 刺参波里氏囊壁的组织切片 灿烂弧菌体腔注射前和注射后2、6、12、24、48、72、96、120 h解剖刺参,剪下波里氏囊,去除囊腔内液体,囊壁组织置于4%多聚甲醛中固定。将固定好的波里氏囊样品置入包埋的样品筐中进行脱水,依次经由低浓度乙醇(70%)到无水乙醇,再到二甲苯:无水乙醇0.5 h,二甲苯15 min,二甲苯和石蜡(等体积配制)0.5 h,然后用纯石蜡60 ℃浸没处理。冷却后成固体蜡块,用刀片切成5 μm薄片,滴加蛋白甘油后,黏附在载玻片上烘干过夜进行HE染色。显微镜下观察结构、拍照和记录。
1.2.4 刺参波里氏囊壁中细胞增殖检测 试验组注射灿烂弧菌、对照组注射等量无菌海水,同时对每头刺参体腔注射200 μL EdU标记溶液(1 mg/mL)。注射后2、6、12、24、48、72 h解剖刺参,剪下波里氏囊,进行OCT包埋、冰冻切片,按照Cell-LightTM Apollo® 567 EdU检测试剂盒说明书进行细胞增殖检测。具体程序如下:冰冻切片上滴加4%多聚甲醛室温孵育15 min,PBS洗涤2次,每次5 min;滴加50 μL 2 mg/mL的甘氨酸溶液室温孵育10 min,PBS洗涤2次,每次5 min;滴加50 μL 0.5% Triton X-100 室温孵育10 min,PBS洗涤1次,每次5 min;滴加50 μL 1×Apollo® 567染色反应液室温孵育30 min,PBS洗涤3次,每次5 min;滴加含DAPI的抗衰减封片剂封片,荧光显微镜下观察拍照。随机选取不同视野,使用Image J软件进行计数及统计分析EdU阳性率。
1.2.5 刺参波里氏囊腔内细胞增殖检测 试验组注射灿烂弧菌、对照组注射等量无菌海水,同时对每头刺参体腔注射200 μL EdU标记溶液(1 mg/mL)。注射后4、6、12 h解剖刺参,用预先含有适量抗凝剂(MAS)的 1 mL 无菌注射器插入波里氏囊内以1∶1抽取囊腔内体腔液,混合均匀后4 ℃下以800 g离心10 min,收集囊腔内细胞,PBS重悬备用。在干净载玻片上滴两滴囊腔内细胞悬液,每滴 20 μL,放入湿盒中室温孵育20 min,吸去多余上清液,滴加4%多聚甲醛室温孵育15 min,-20 ℃保存备用。利用Cell-LightTM Apollo® 567 EdU检测试剂盒进行细胞增殖检测,具体操作程序同“1.2.4节”。
2 结果与分析
2.1 灿烂弧菌侵染后刺参波里氏囊的形态变化
刺参波里氏囊在正常状态下呈透明、短椭球形,灿烂弧菌侵染后波里氏囊形态发生明显变化,2~12 h时波里氏囊逐渐拉长;24 h时波里氏囊肉眼可见发生凹陷,长度变短;随后逐渐开始收缩,至120 h时已恢复至灿烂弧菌侵染前形态(图1)。
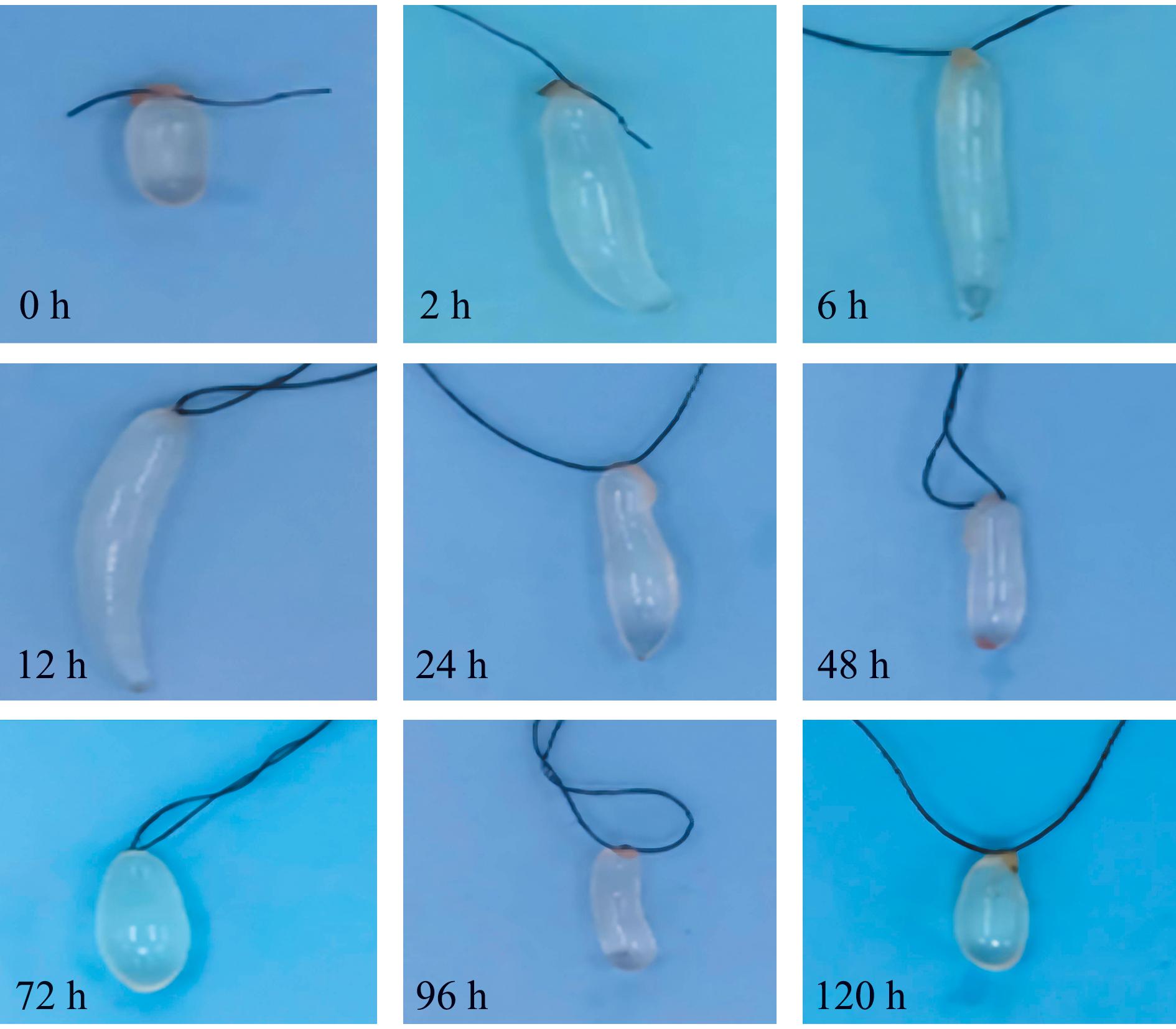
图1 灿烂弧菌浸染后刺参波里氏囊的形态变化
Fig.1 Morphological changes of polian vesicle in Apostichopus japonicus after Vibrio splendidus infection
2.2 灿烂弧菌侵染后刺参波里氏囊壁的组织结构变化
刺参波里氏囊壁石蜡切片结果显示,囊壁组织由外向内依次由体腔上皮层、结缔组织层、肌肉纤维层和纤毛上皮层组成。正常状态下体腔上皮层表面凹凸不平、表面分布一层深染细胞;结缔组织层在囊壁中占比较大,组织中零星分布着一些深染细胞;肌肉纤维层被厚厚的结缔组织包裹,在石蜡切片中被染成深粉色;最内侧是薄薄的纤毛上皮层,其上附着大量深染细胞。
灿烂弧菌侵染后2 h,囊壁组织体腔上皮层边缘变平,结缔组织层和纤毛上皮层中深染细胞数量变少;6~12 h时,体腔上皮层边缘表面凹凸不平,结缔组织层和纤毛上皮层中深染细胞数量明显增加;24 h时结缔组织层和纤毛上皮层中深染细胞数量又迅速减少;48~72 h时,结缔组织层和纤毛上皮层中深染细胞数量再次增加;96 h时囊壁组织结构恢复至侵染前状态;120 h时囊壁组织结构和侵染后2 h时状态基本一致(图2)。

CC—体腔;VC—囊腔;CoE—体腔上皮层;CT—结缔组织层;M—肌肉层;CiE—纤毛上皮层。黑色箭头所指为深染细胞。
CC—coelomic cavity;VC—vesicle cavity;CoE—coelomic epithelium layer;CT—connective tissue layer;M—muscular layer;CiE—ciliated epithelium layer.Black arrow indicated dark-stained cells.
图2 灿烂弧菌侵染后刺参波里氏囊壁的微观组织结构变化
Fig.2 Microstructural changes of polian vesicle in Apostichopus japonicus after Vibrio splendidus infection
2.3 灿烂弧菌侵染后刺参波里氏囊壁中细胞增殖变化
利用OCT包埋、冰冻切片和EdU细胞增殖检测,分析灿烂弧菌侵染后刺参波里氏囊壁中细胞增殖变化,结果显示:与无菌海水注射组相比,灿烂弧菌注射后各时间点波里氏囊壁组织中均可见明显的红色EdU阳性信号,尤其是刺激后6、12 h时囊壁中EdU阳性信号明显增多,表明灿烂弧菌侵染能够刺激波里氏囊壁中细胞增殖(图3)。

红色代表EdU染色的增殖细胞,蓝色代表DAPI染色的细胞核,下同。
Red indicates EdU-stained proliferating cells,blue indicates DAPI-stained nuclei,et sequentia.
图3 灿烂弧菌侵染后刺参波里氏囊壁中细胞增殖检测
Fig.3 Distribution of cells with EdU signal from cyst wall of polian vesicle in Apostichopus japonicus after Vibrio splendidus infection
2.4 灿烂弧菌侵染后刺参波里氏囊腔内细胞增殖比例变化
利用细胞滴片和EdU增殖检测,分析灿烂弧菌侵染后刺参波里氏囊腔内细胞增殖比例变化,结果显示,试验组和对照组波里氏囊腔内细胞中均有明显的红色阳性信号,与无菌海水注射组相比,灿烂弧菌注射组囊腔内细胞阳性信号明显增多(图4)。通过Image J软件分析,灿烂弧菌注射组囊腔内细胞EdU阳性率在4、6、12 h时分别为10.39%、11.20%、11.61%,无菌海水注射组分别为7.22%、6.24%、6.61%(图5)。灿烂弧菌组与无菌海水组同期相比,囊腔内细胞EdU阳性率分别增加了3.17%、4.96%、5.00%(P<0.05)。
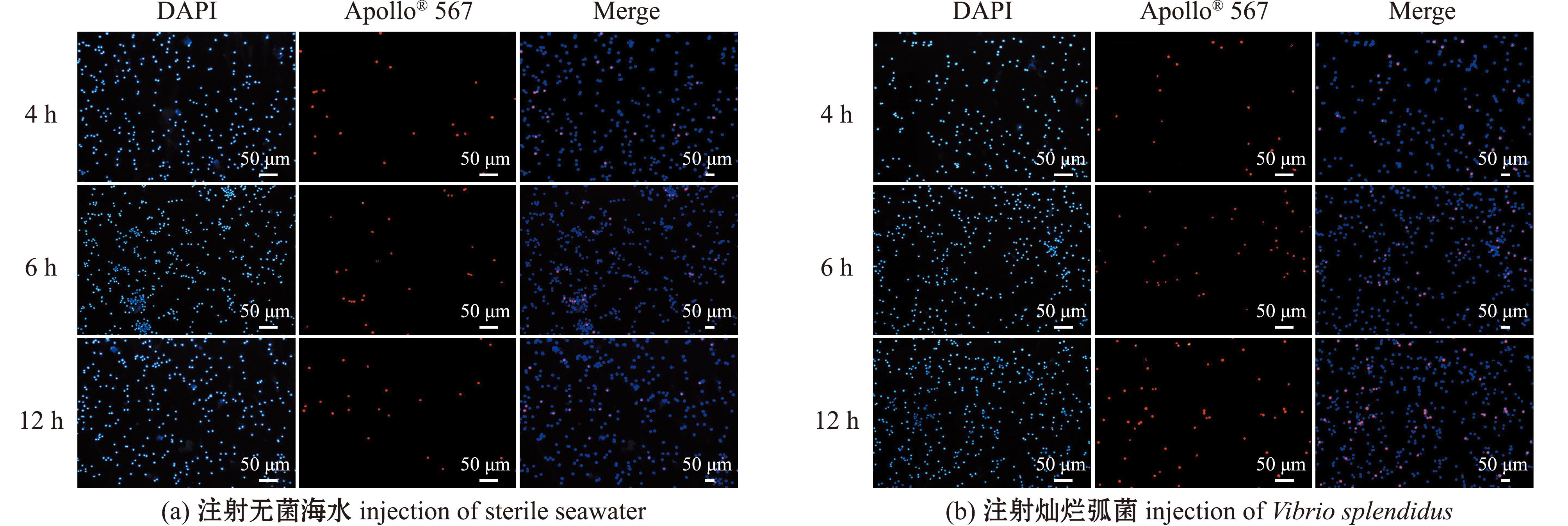
图4 灿烂弧菌侵染后刺参波里氏囊腔内细胞增殖检测
Fig.4 Distribution of cells with EdU signal from the cavity of polian vesicle in Apostichopus japonicus after Vibrio splendidus infection
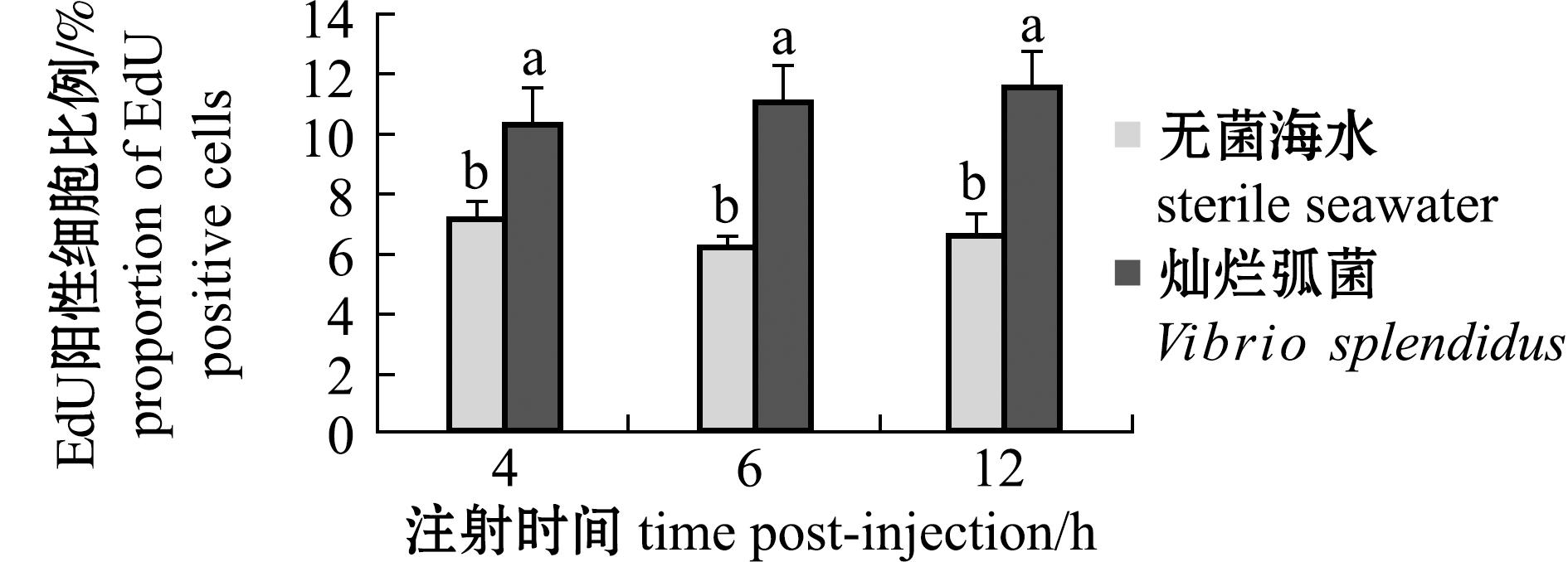
图5 灿烂弧菌侵染后刺参波里氏囊腔内EdU阳性细胞比例变化
Fig.5 The proportion of EdU positive cells from the cavity of polian vesicle in Apostichopus japonicus after Vibrio splendidus infection
3 讨论
目前,已经鉴定的刺参“腐皮综合征”病原主要有以灿烂弧菌为典型代表的弧菌(Vibrio sp.),以及假交替单胞菌属细菌(Pseudoalteromonas nigrifaciens)和嗜水气单胞菌(Aeromonas hydrophlia)等[8-11]。作为无脊椎动物的刺参只存在先天性免疫,缺乏脊椎动物中的获得性免疫。刺参体腔中充满了体腔液,其中悬浮着不同种类的体腔细胞,同时还随着水管系统的延伸遍布于刺参的体壁、管足,广泛参与机体的营养输送、代谢及免疫等多种机能[1]。大量研究表明,具开放循环系统的刺参体腔细胞是其主要的免疫反应效应器。面对病原的入侵,体腔细胞一方面发挥吞噬包裹、细胞杀伤、趋化修复等作用,另一方面还能合成和分泌多种免疫因子,如凝集素、穿孔素、溶酶体酶、血清蛋白及抑制蛋白等,对机体损伤或感染产生免疫应答[8,12]。近年研究发现,刺参水管系统与体腔间并非无限畅通,小分子和生物大分子等可溶性物质可流通于体腔和水管系统之间,但外源颗粒物和细菌则不能通过体腔进入水管系统和波里氏囊[13]。刺参波里氏囊腔内体腔细胞的类型和体腔内体腔细胞一致,但细胞的数量和亚型比例两者间存在明显差异;囊腔内细胞总数约为1.13×107 cells/mL,体腔内细胞总数为2.14×107 cells/mL,囊腔内以球形细胞为主(占比约57%),体腔内以淋巴细胞为主(占比约63%)[14]。研究发现,刺参波里氏囊在刺参免疫系统中发挥着重要作用。Li等[2]利用兔抗人造血转录因子GATA1抗体免疫组化定位、细胞EdU增殖检测和体腔细胞单抗示踪等技术,发现刺参波里氏囊具有生成体腔细胞的能力,是刺参的“造血组织”之一。Wang等[15]研究发现,灿烂弧菌通过体腔注射刺参后,波里氏囊内体腔细胞密度呈先下降后上升再下降又上升的波动趋势,笔者认为波里氏囊腔内体腔细胞在灿烂弧菌刺激时可向体腔内迁移,并参与病原的清除。
3.1 灿烂弧菌侵染后刺参波里氏囊的形态结构变化
前期研究表明,灿烂弧菌经体腔注射后并不能入侵至刺参波里氏囊内[13],本研究发现,灿烂弧菌注射前,刺参波里氏囊表观形态相对较小,在刺激后2~12 h波里氏囊逐渐变大且伸长。灿烂弧菌侵染后2 h时,波里氏囊壁结缔组织层和纤毛上皮层中深染细胞数量明显减少,而在6、12 h时,深染细胞数量又出现大量增加,之后在24~72 h深染细胞数量再次出现减少和增加,直至96 h时细胞数量才恢复至细菌侵染前状态。这表明灿烂弧菌虽然不能入侵至波里氏囊内,但波里氏囊对灿烂弧菌刺激也表现出了应答响应,尤其是深染细胞数量呈现明显波动趋势。根据D’Ancona等[5]的报道,波里氏囊壁中深染细胞为体腔细胞,利用绵羊红细胞对海参进行体腔注射后囊壁中体腔细胞(深染细胞)数量明显增多,与本文的研究结果一致。
3.2 灿烂弧菌侵染后刺参波里氏囊壁中细胞增殖变化
研究表明,波里氏囊是刺参的“造血组织”之一,具有生成体腔细胞的能力。本文利用EdU增殖检测技术分析了灿烂弧菌侵染后刺参波里氏囊壁中细胞增殖变化,结果发现,灿烂弧菌注射后各时间点,波里氏囊壁中均可见明显的红色EdU阳性信号,尤其是刺激后6、12 h时囊壁中EdU阳性信号明显增多,这与HE染色中深染细胞数量变化规律相一致,表明灿烂弧菌侵染能够刺激波里氏囊壁中细胞增殖。但是,注射无菌海水组刺参波里氏囊壁中EdU阳性信号相对较少,这与Li等[2]研究结果不一致,这可能与刺参个体差异有关,无刺激源存在时囊壁中细胞增殖能力相对较弱。
3.3 灿烂弧菌侵染后刺参波里氏囊腔内细胞增殖比例变化
本研究中分析了灿烂弧菌侵染后刺参波里氏囊腔内细胞增殖比例变化,发现灿烂弧菌注射组囊腔内细胞有明显的阳性信号,细胞EdU阳性率在4、6、12 h时分别为10.39%、11.20%、11.61%,无菌海水注射组分别为7.22%、6.24%、6.61%,结果说明,灿烂弧菌侵染能够刺激波里氏囊腔内细胞增殖,此结果正好验证了Wang等[15]前期关于灿烂弧菌侵染后刺参波里氏囊腔和体腔内体腔细胞的数量变化规律报道,由此笔者推测,灿烂弧菌侵染后波里氏囊腔内细胞的快速增殖是为了补充体腔内体腔细胞应答灿烂弧菌侵染而造成的细胞消耗。但关于刺参波里氏囊腔内细胞增殖的来源目前还不明确,是囊壁内细胞增殖后迁移到囊腔,还是囊腔内细胞自我增殖,还需要进一步深入研究。
4 结论
1)研究发现,灿烂弧菌虽不能入侵至波里氏囊内,但波里氏囊对灿烂弧菌侵染表现出了积极的应答响应,波里氏囊壁和囊腔内体腔细胞的增殖能力均明显增强。
2)灿烂弧菌侵染后6~12 h,刺参波里氏囊壁和囊腔内细胞增殖最为活跃。
[1] YANG H S,MERCIER J F H A A.The sea cucumber Apostichopus japonicus:history,biology and aquaculture[M].London,UK:Academic Press,2015.
[2] LI Q,REN Y,LUAN L L,et al.Localization and characterization of hematopoietic tissues in adult sea cucumber,Apostichopus japonicus[J].Fish &Shellfish Immunology,2019,84:1-7.
[3] SMITH A C.Immunopathology in an invertebrate,the sea cucumber,Holothuria cinerascens[J].Developmental &Comparative Immunology,1980,4:417-431.
[4] SMITH A C.A proposed phylogenetic relationship between sea cucumber Polian vesicles and the vertebrate lymphoreticular system[J].Journal of Invertebrate Pathology,1978,31(3):353-357.
[5] D’ANCONA G,RIZZUTO L,CANICATT C.Engagement of Polian vesicles during Holothuria polii response to erythrocyte injection[J].Journal of Invertebrate Pathology,1989,54(3):300-305.
C.Engagement of Polian vesicles during Holothuria polii response to erythrocyte injection[J].Journal of Invertebrate Pathology,1989,54(3):300-305.
[6] REN Y,XU Y P,WANG Z H,et al.Molecular cloning,biological description,and functional analysis of Ajfos transcription factor in pathogen-induced Apostichopus japonicus[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2024,276:109814.
[7] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2024中国渔业统计年鉴[M].北京:中国农业出版社,2024.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2024 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2024.(in Chinese)
[8] 李成华.刺参腐皮综合征发生的分子调控机制研究进展[J].大连海洋大学学报,2021,36(3):355-373.LI C H.Research progress on molecular regulation mechanism of skin ulcer syndrome in sea cucumber Apostichopus japonicus:a review[J].Journal of Dalian Ocean University,2021,36(3):355-373.(in Chinese)
[9] 张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.ZHANG C Y,WANG Y G,RONG X J.Isolation and identification of causative pathogen for skin ulcerative syndrome in Apostichopus japonicus[J].Journal of Fisheries of China,2006,30(1):118-123.(in Chinese)
[10] 葛辉,何丽斌,林琪,等.福建海区网箱养殖刺参“腐皮综合症” 病原分析与鉴定[J].福建水产,2012,34(2):105-110.GE H,HE L B,LIN Q,et al.Analysis and identification of causative pathogen for skin ulcerative syndrome in Fujian sea cage cultured Apostichopus japonicus[J].Journal of Fujian Fisheries,2012,34(2):105-110.(in Chinese)
[11] 杨嘉龙,周丽,绳秀珍,等.养殖刺参溃疡病病原菌RH2的鉴定及其生物学特性分析[J].水产学报,2007,31(4):504-511.YANG J L,ZHOU L,SHENG X Z,et al.Identification and biological characteristics of pathogen RH2 associated with skin ulceration of cultured Apostichopus japonicus[J].Journal of Fisheries of China,2007,31(4):504-511.(in Chinese)
[12] LI Q,LI Y,LI H,et al.Production,characterization and application of monoclonal antibody to spherulocytes:a subpopulation of coelomocytes of Apostichopus japonicus[J].Fish &Shellfish Immunology,2010,29(5):832-838.
[13] 范栩源,王振辉,任媛,等.仿刺参水管系统与体腔间物质交换问题探究[J].水产科学,2023,42(4):705-711.FAN X Y,WANG Z H,REN Y,et al.Substance exchange between water-vascular system and coelom in sea cucumber Apostichopus japonicus[J].Fisheries Science,2023,42(4):705-711.(in Chinese)
[14] LI Q,QI R R,WANG Y N,et al.Comparison of cells free in coelomic and water-vascular system of sea cucumber,Apostichopus japonicus[J].Fish &Shellfish Immunology,2013,35(5):1654-1657.
[15] WANG Z H,FAN X Y,LI Z,et al.Comparative analysis for immune response of coelomic fluid from coelom and polian vesicle in Apostichopus japonicus to Vibrio splendidus infection[J].Fish and Shellfish Immunology Reports,2023,4:100074.