青海湖裸鲤(Gymnocypris przewalskii)隶属鲤科(Cyprinidaes)裂腹鱼亚科(Schizothoracinae)裸鲤属(Gymnocypris),主要分布在中国最大的咸水湖—青海湖中。由于青海湖水文环境中较高的盐碱度,生活在此的青海湖裸鲤相较于其他鱼种展现出了显著的盐碱适应和耐受能力。有研究表明,青海湖裸鲤在高盐碱的环境胁迫下,通过糖代谢适应环境胁迫[1]。同时,较高的盐碱度也导致青海湖裸鲤免疫系统发生了相应的调整。目前,对于青海湖裸鲤如何通过自身调控适应青海湖高盐碱水环境的机制尚不清楚。
分布于黄河水系中的花斑裸鲤(Gymnocypris eckloni)与青海湖裸鲤同属于裂腹鱼亚科裸鲤属。赵凯等[2]探讨了青海湖裸鲤和花斑裸鲤的起源关系,青海湖裸鲤和花斑裸鲤产生地理隔离的原因是青藏高原“共和运动”导致中间山脉隆起,青海湖与古黄河分离,黄河开始向上游袭夺[3-4]。青海湖裸鲤起源于黄河花斑裸鲤两个主要支系中的一个[3],与花斑裸鲤为近缘种[5]。经过漫长的进化过程,青海湖裸鲤和花斑裸鲤形成了适应青藏高原极端环境(包括低温、低氧、高海拔和强紫外线辐射)的生存能力和独特形态特征[6-7],形成了一种理想状态下的适应进化研究模型。在淡水水域环境中生存的花斑裸鲤可作为在高盐碱条件下生存的青海湖裸鲤的参照标准[8]。
转录组测序技术(RNA-Seq)具有高通量检测、耗费时间较短、成本低廉和定量法范围广等特点[9]。赵永丽[10]取经过常氧和低氧胁迫处理的花斑裸鲤的肝胰脏、肌肉等混合组织进行转录组测序、组装和基因功能注释,通过对低氧适应相关基因的差异筛选和通路富集,得出花斑裸鲤在应对低氧环境胁迫时,通过加强糖酵解途径功能和糖异生作用,增强HIF-1信号通路功能,强化抗氧化防御系统,促进受损细胞的凋亡及抑制细胞的生长,以提高机体应对低氧耐受性和存活率。余家麒[11]通过转录组学技术比较分析了常氧和低氧胁迫下青海湖裸鲤肝、鳃和脑组织中的差异表达基因,发现在低氧胁迫下青海湖裸鲤差异表达基因主要显著富集在与能量相关途径,并筛选到与能量代谢相关的低氧关键基因,如PPARα、CPT1、ACO等。张海琛等[12]通过转录组学技术比较分析了位于青海湖河口水域和泉吉河中的青海湖裸鲤的鳃、肾脏组织中的差异表达基因,筛选得到与免疫、代谢和渗透相关基因,发现其主要在青海湖裸鲤耐盐碱过程中发挥作用,主要包括钠/钾转运ATP酶、钙/钙调蛋白依赖性蛋白激酶、一氧化氮合酶和细胞色素P450等。
为了深入探究青海湖裸鲤如何通过自身调控适应高盐碱环境,本研究中在同一时期采集规格相近的青海湖裸鲤和花斑裸鲤的肝脏、肾脏和鳃组织进行RNA-Seq转录组测序,对青海湖裸鲤和花斑裸鲤同组织间的差异表达基因(differentially expressed genes,DEGs)进行筛选,并挖掘青海湖裸鲤耐盐碱关键基因,对青海湖裸鲤适应高盐碱水环境调控机制进行研究,以期为进一步挖掘和开发利用裸鲤属功能基因提供基础数据。
1 材料与方法
1.1 材料
本试验样品采于2023年7月,分别采集3尾2~3龄的花斑裸鲤(110 g±5 g)和青海湖裸鲤(90 g±5 g)。
青海湖裸鲤样品采集于青海湖与哈尔盖河口 (100°25′12″ E,37°07′12″ N)pH为9.58,盐度为13;花斑裸鲤样品采集于黄河源头鄂陵湖支流水域(97°42′00″ E,34°55′12″ N),pH为7.9,盐度为0.3。
将青海湖裸鲤和花斑裸鲤用MS-222(100 mg/L)麻醉后,分别采集青海湖裸鲤鳃(Gymnocypris przewalskii gill,GPRG)、肾脏(Gymnocypris przewalskii kidney,GPRK)、肝脏(Gymnocypris przewalskii liver,GPRL)组织和花斑裸鲤鳃(Gymnocypris eckloni gill,GECG)、肾脏(Gymnocypris eckloni kiendy,GECK)、肝脏(Gymnocypris eckloni liver,GECL)组织,样品迅速浸泡在液氮中,之后经液氮速冻后运至实验室-80 ℃超低温冰箱中保存备用。
1.2 方法
1.2.1 样本RNA提取及反转录 各组织总RNA的提取参照TaKaRa MiniBEST Universal RNA Extraction Kit(Code No.9767,TaKaRa)说明书。RNA样品的浓度、纯度和完整性的检测使用分光光度计(Nanodrop ND-2000,Thermo Fisher Scientific,USA)和Agilent2100。RNA样品用于后续文库构建要求:OD260 nm/OD280 nm=1.8~2.0,且RIN值>7。
1.2.2 文库构建 cDNA文库构建参照NEBNext® UltraTM RNA Library Prep Kit (NEB,USA)试剂说明书。初步定量:使用Qubit 2.0 Fluorometer,将文库稀释至1.5 ng/μL。qRT-PCR:采用Agilent 2100 bioanalyzer(Agilent Technologies,CA,USA)对文库的insert size进行检测。insert size符合预期结果时,对文库有效浓度进行准确定量,转录组文库的质量要求是有效浓度高于 2 nmol/L。双末端测序:使用Illumina HiSeq 2500平台,测序读长为PE150,并通过Agilent 2100生物分析仪进行评估。质量合格的文库通过Illumina HiSeq 2500(Illumina,美国)平台进行测序,以获取原始数据。
1.3 数据处理
原始数据进行过滤:采用FastQC v0.11.5和Trimmomatic v0.36软件获得高质量的序列数据(clean data)。样本的转录序列的组装:采用Trinity软件对每个样本的转录序列进行组装,获得各样本Unigene序列信息。筛选DEGs:采用DESeq2软件(1.20.0),以|log2 (fold change)|≥1,padj<0.05为标准。GO和KEGG功能注释:采用R软件(3.8.1)对DEGs进行GO和KEGG功能注释分析,以P<0.05作为DEGs在GO条目或KEGG通路中显著富集的标准。
2 结果与分析
2.1 检测数据及其质量
本研究中分别对青海湖裸鲤和花斑裸鲤的3个组织(鳃、肾脏和肝脏)进行转录组测序。结果表明,18个cDNA文库经Illumina测序后共获得149.57 Gb clean data,各样品clean data均达到6.50 Gb及以上,Q30碱基百分比在83.89%及以上。
表1 测序数据统计
Tab.1 Sequencing data statistics
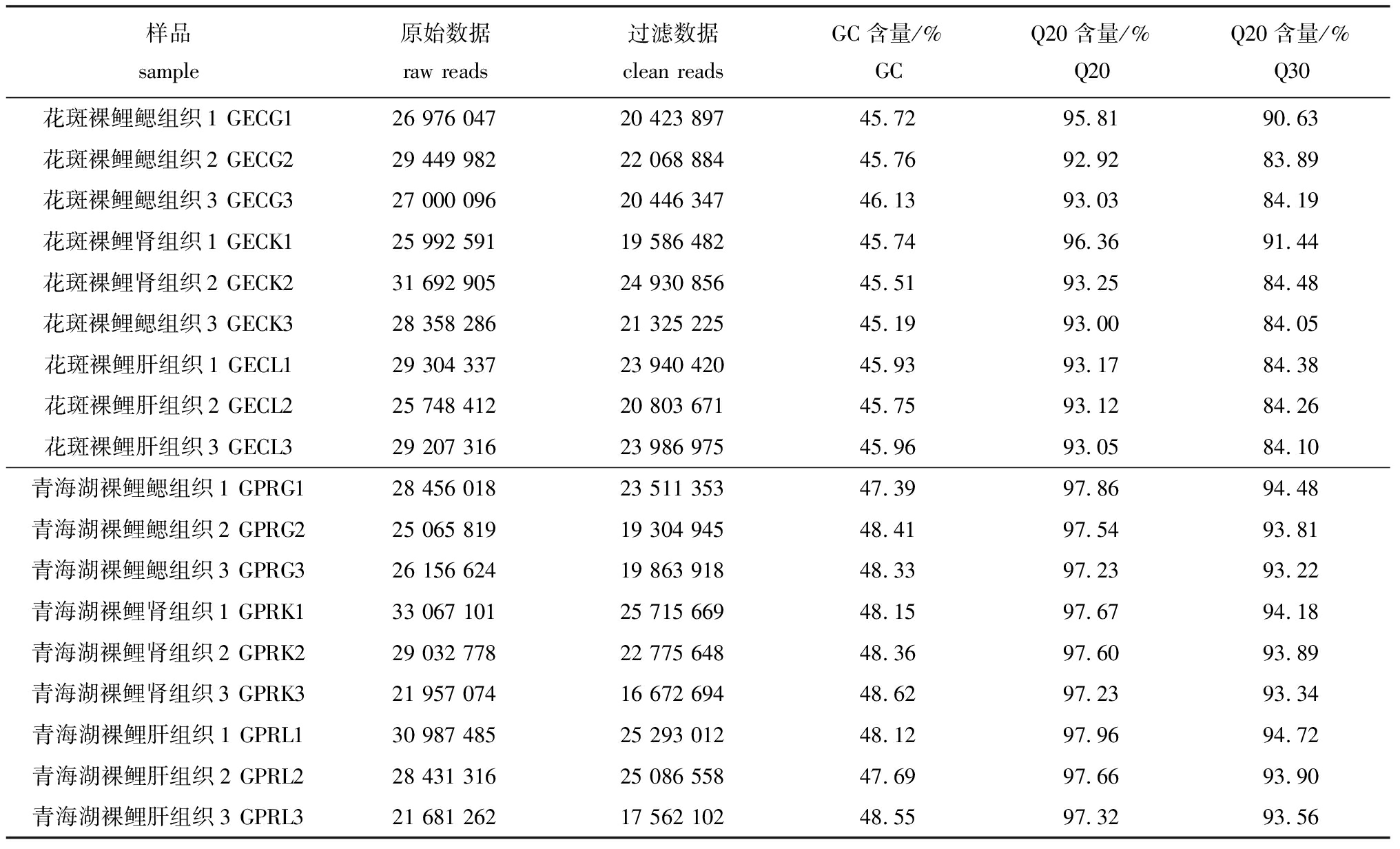
样品sample原始数据rawreads过滤数据cleanreadsGC含量/%GCQ20含量/%Q20Q20含量/%Q30花斑裸鲤鳃组织1GECG1269760472042389745.7295.8190.63花斑裸鲤鳃组织2GECG2294499822206888445.7692.9283.89花斑裸鲤鳃组织3GECG3270000962044634746.1393.0384.19花斑裸鲤肾组织1GECK1259925911958648245.7496.3691.44花斑裸鲤肾组织2GECK2316929052493085645.5193.2584.48花斑裸鲤鳃组织3GECK3283582862132522545.1993.0084.05花斑裸鲤肝组织1GECL1293043372394042045.9393.1784.38花斑裸鲤肝组织2GECL2257484122080367145.7593.1284.26花斑裸鲤肝组织3GECL3292073162398697545.9693.0584.10青海湖裸鲤鳃组织1GPRG1284560182351135347.3997.8694.48青海湖裸鲤鳃组织2GPRG2250658191930494548.4197.5493.81青海湖裸鲤鳃组织3GPRG3261566241986391848.3397.2393.22青海湖裸鲤肾组织1GPRK1330671012571566948.1597.6794.18青海湖裸鲤肾组织2GPRK2290327782277564848.3697.6093.89青海湖裸鲤肾组织3GPRK3219570741667269448.6297.2393.34青海湖裸鲤肝组织1GPRL1309874852529301248.1297.9694.72青海湖裸鲤肝组织2GPRL2284313162508655847.6997.6693.90青海湖裸鲤肝组织3GPRL3216812621756210248.5597.3293.56
注:GC(%):G、C两种碱基在clean data总碱基中的占比;Q20(%):clean data质量值≥20的碱基的占比;Q30(%):clean data质量值≥30的碱基的占比。
Note:GC(%):the percentage of G and C bases in the total bases of clean data;Q20(%):the percentage of bases with clean data quality values≥20;Q30(%):the percentage of bases with clean data quality values≥30.
2.2 差异表达基因分析
分别对青海湖裸鲤和花斑裸鲤不同组织差异表达基因进行筛选,在GECG-vs-GPRG、GECK-vs-GPRK和GECL-vs-GPRL组中,分别筛出9 807个DEGs(5 447个DEGs表达上调,4 360个DEGs表达下调)、6 550个DEGs(3 730个DEGs表达上调,2 820个DEGs表达下调)和5 651个DEGs(2 870个DEGs表达上调,2 781个DEGs表达下调)(图1)。
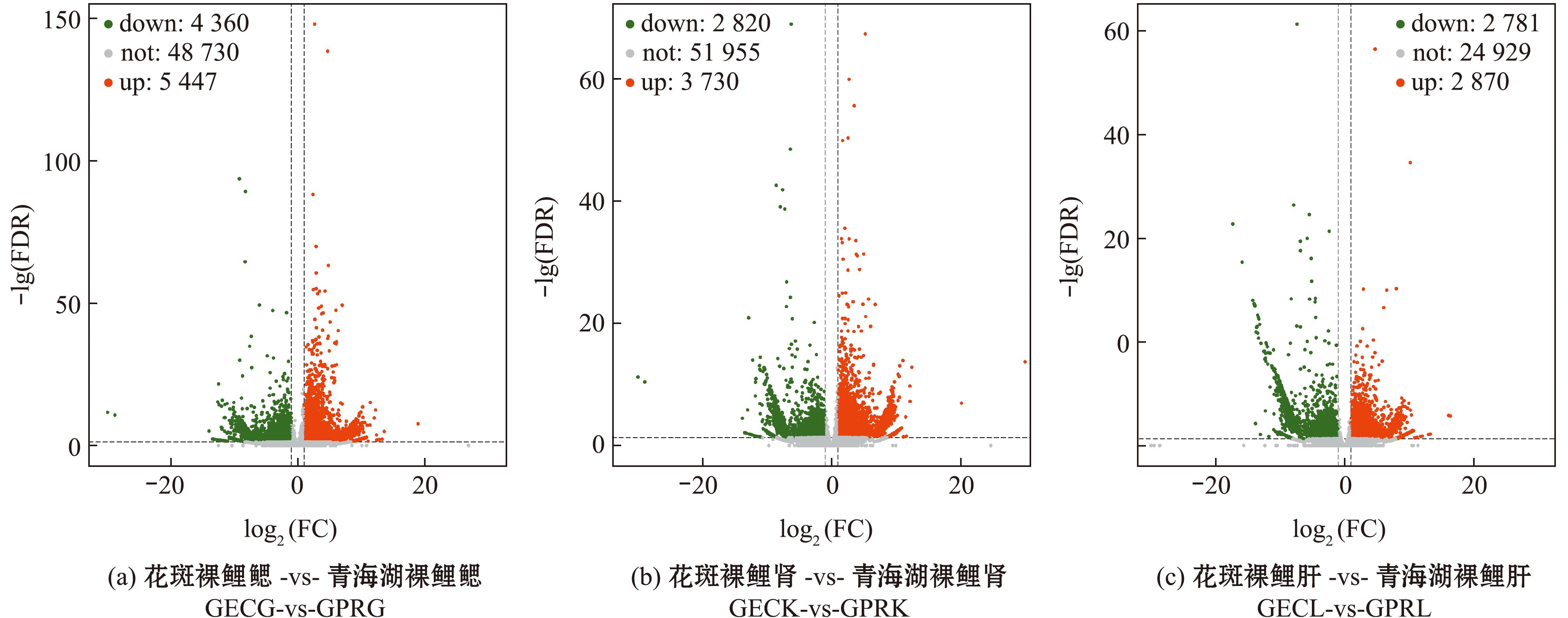
横坐标绝对值大小,表达量在两样品间的表达量倍数;纵坐标值大小,差异表达的显著性及筛选得到的DEGs的可靠性;绿色点,DEGs表达上调;红色点,DEGs表达上调;灰色点,非差异表达DEGs。
Absolute value size of horizontal coordinate,expression multiplicity of expression between twosamples;Vertical coordinate value size,significance of differential expression and reliability of DEGs obtained by screening;Green dots,up-regulation of DEGs;red dots,up-regulation of DEGs;gray dots,non-differential expression of DEGs.
图1 差异表达火山图
Fig.1 Differential expression volcanoes
对青海湖裸鲤和花斑裸鲤各组织中筛选出的DEGs做进一步的分析,结果显示,GECG-vs-GPRG、GECK-vs-GPRK、GECL-vs-GPRL 3个比较组中有712个共表达的DEGs,GECG-vs-GPRG、GECK-vs-GPRK和GECL-vs-GPRL组分别有4 857、2 661和2 682个特异表达的DEGs(图2(d))。
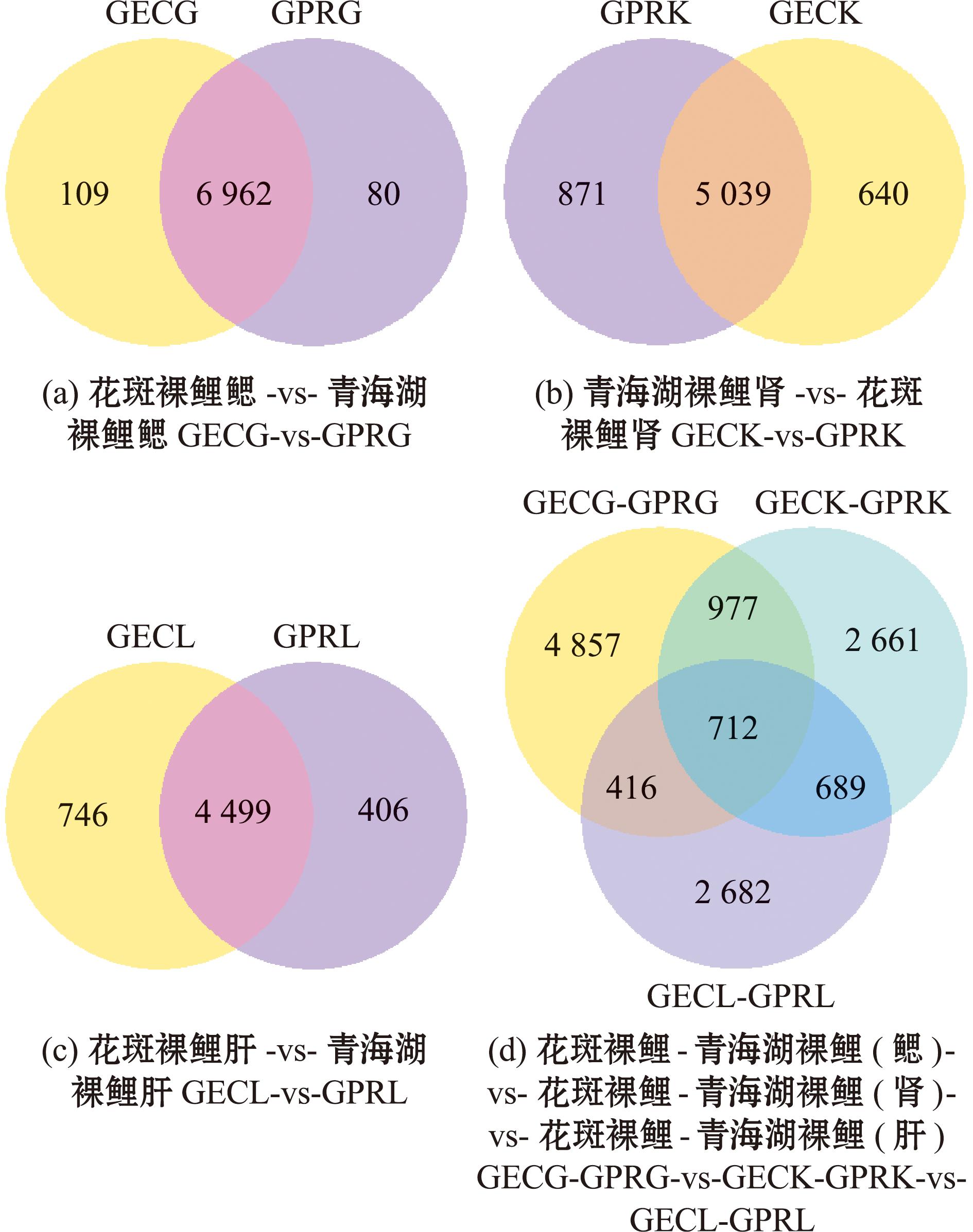
图2 各比较组差异表达韦恩图
Fig.2 Wayne diagram of differential expression for each comparison group
2.3 差异基因功能注释
将青海湖裸鲤与花斑裸鲤各组织的差异表达基因进行GO功能富集分析和KEGG代谢途径富集分析。
GO富集分析结果显示,GECG-vs-GPRG、GECK-vs-GPRK、GECL-vs-GPRL及各组织共表达组中差异表达基因均在细胞(cell)、细胞组分(cell part)、结合(binding)、催化作用(catalytic activity)、细胞过程(cellular process)和代谢过程(metabolic process)等条目注释的DEGs最多(图3)。
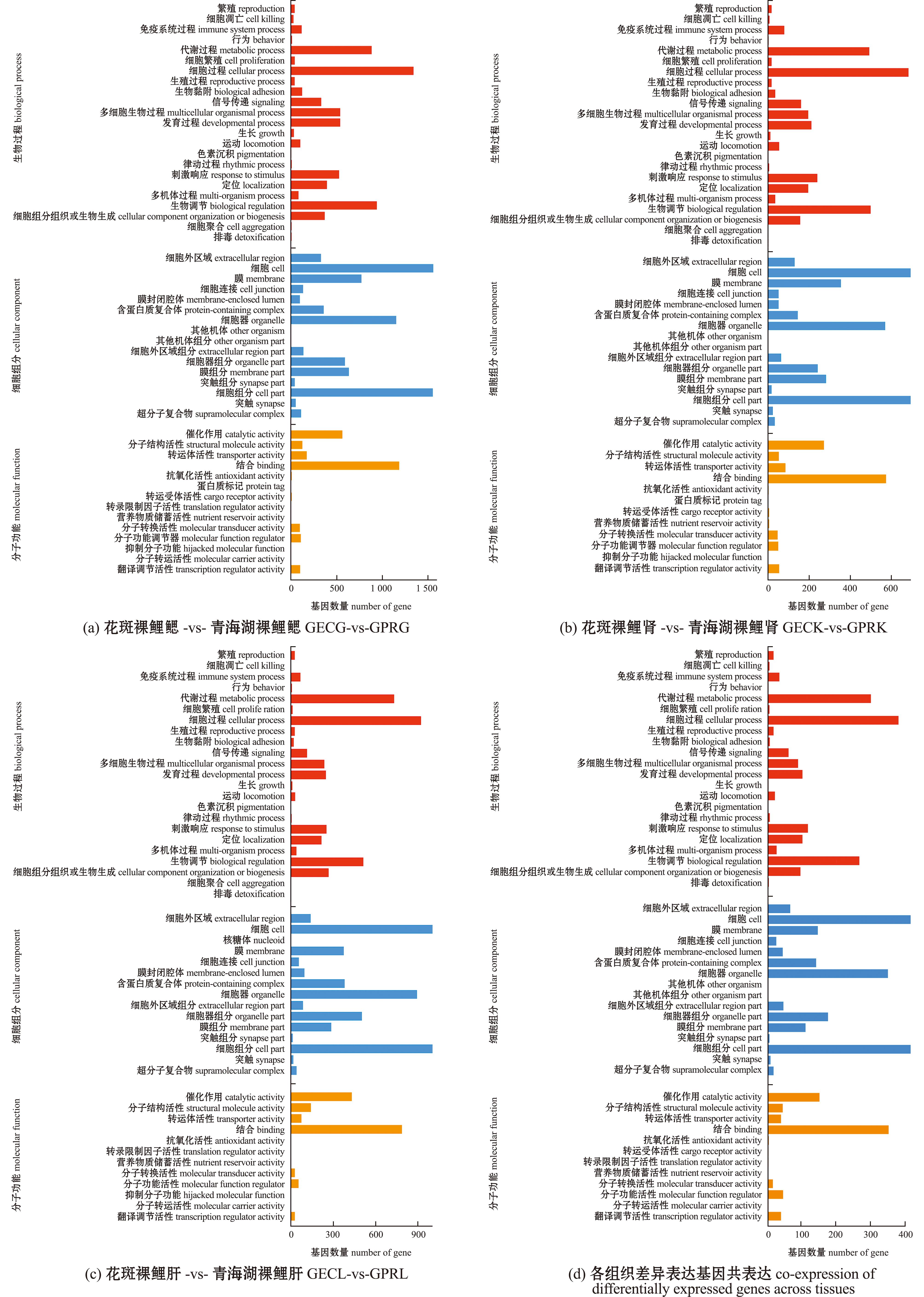
图3 不同比较组的差异表达基因GO富集条目
Fig.3 Bar plots of GO enrichment of DEGs in different comparison groups
在GECG-vs-GPRG组,DEGs在生物过程中的 “其他生物的溶血”(hemolysis in other organism)和“组织再生”(tissue regeneration)中显著富集(P<0.05)(图4(a));在细胞组分中的“细胞外区域”(extracellular region)中显著富集(P<0.05)(图4(b));在分子功能过程中的“丝氨酸类内肽酶活性”(serine-type endopeptidase activity)中显著富集(P<0.05)(图4(c))。
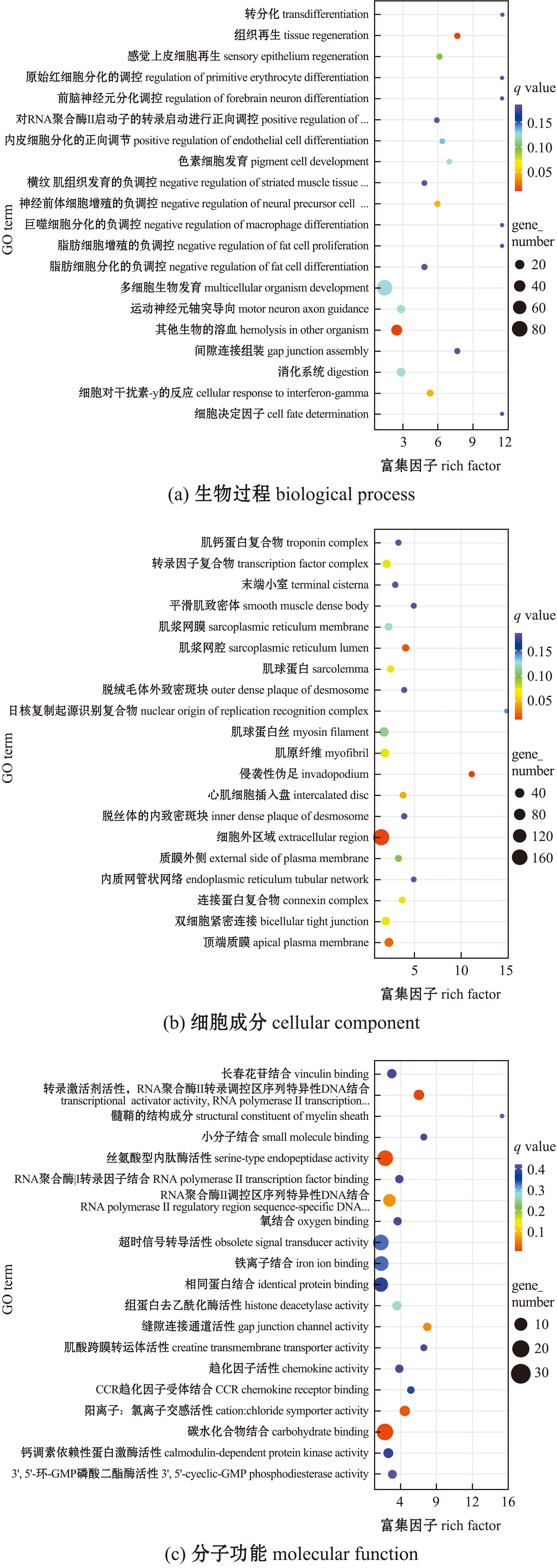
图4 GECG-vs-GPRG差异表达基因GO富集
Fig.4 GO enrichment of differentially expressed genes in the GECG-vs-GPRG
在GECK-vs-GPRK组,DEGs在生物过程中的“神经嵴细胞的分化”(neural crest cell differentiation)中显著富集(P<0.05)(图5(a));在“细胞组分过程中的胶原蛋白修饰剂”(collagen trimer)和“基底层质膜”(basolateral plasma membrane)中显著富集(P<0.05)(图5(b));在分子功能过程中的“阴离子跨膜转运体活性”(anion transmembrane transporter activity)中显著富集(P<0.05)(图5(c))。
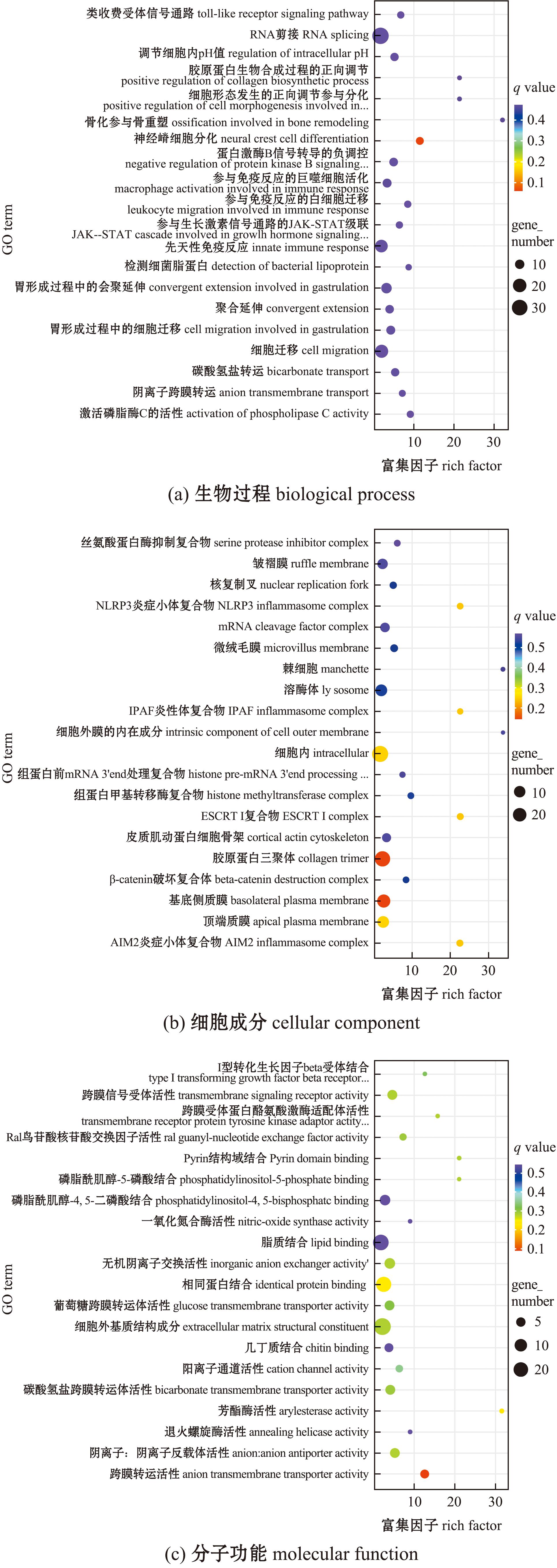
图5 GECK-vs-GPRK差异表达基因GO富集
Fig.5 GO enrichment of differentially expressed genes in the GECK-vs-GPRK
在GECL-vs-GPRL组,DEGs在生物过程中的“翻译”(translation)中显著富集(P<0.05)(图6(a));在细胞组分过程中的“核糖体”(ribosome)、“核仁”(nucleolus)和“细胞质大核糖体亚基”(cytosolic large ribosomal subunit)中显著富集(P<0.05)(图6(b));在分子功能过程中的“核糖体的结构成分”(structural constituent of ribosome)和“RNA结合”(RNA binding)中显著富集(P<0.05)(图6(c))。
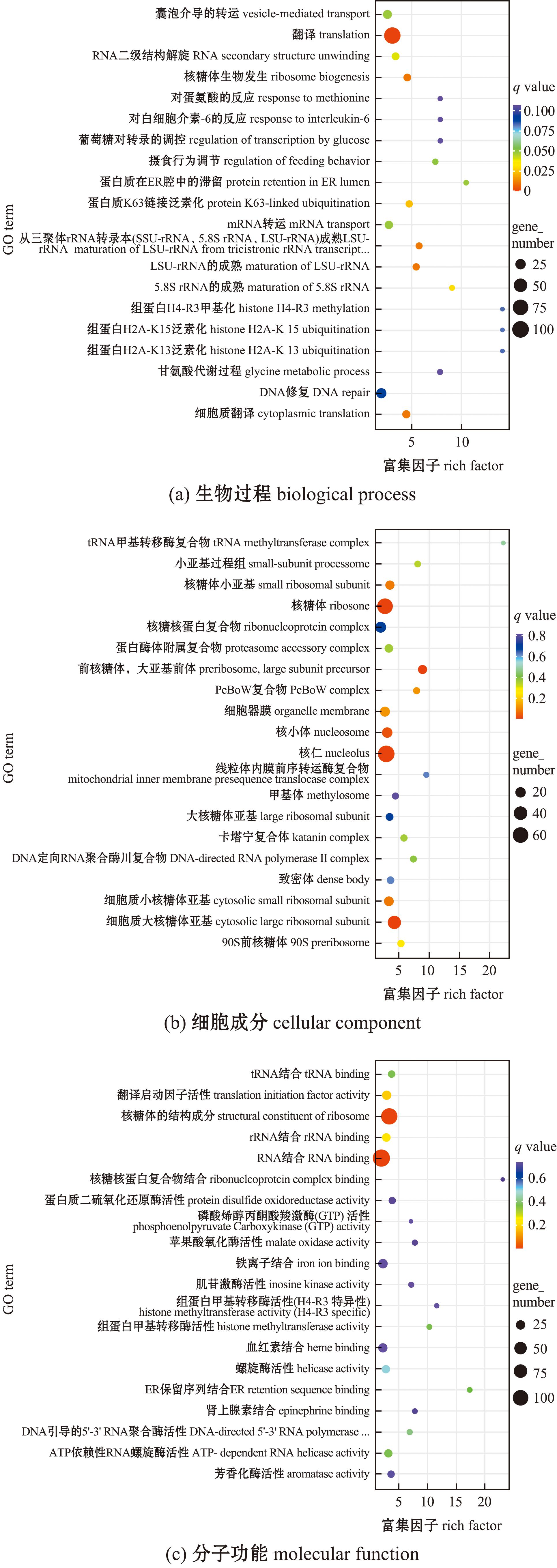
图6 GECL-vs-GPRL差异表达基因GO富集
Fig.6 GO enrichment of differentially expressed genes in the GECL-vs-GPRL
各组织共表达的DEGs,在生物过程中的“核小体的组装”(nucleosome assembly)、“对细菌的防御响应”(defense response to bacterium)和“补体激活,替代途径”(complement activation,alternative pathway)中显著富集(P<0.05)(图7(a));在细胞组分过程中的“核小体”(nuclear nucleosome)、“核细胞周期蛋白依赖性蛋白激酶全酶复合体”(nuclear cyclin-dependent protein kinase holoenzyme complex)和“细胞周期蛋白/CDK 正转录延伸因子复合体”(cyclin/CDK positive transcription elongation factor complex)中显著富集(P<0.05)(图7b);在分子功能过程中的“核糖体的结构成分”(structural constituent of ribosome)、“内肽酶抑制剂活性”(endopeptidase inhibitor activity)和“补体结合”(complement binding)中显著富集(P<0.05)(图7(c))。
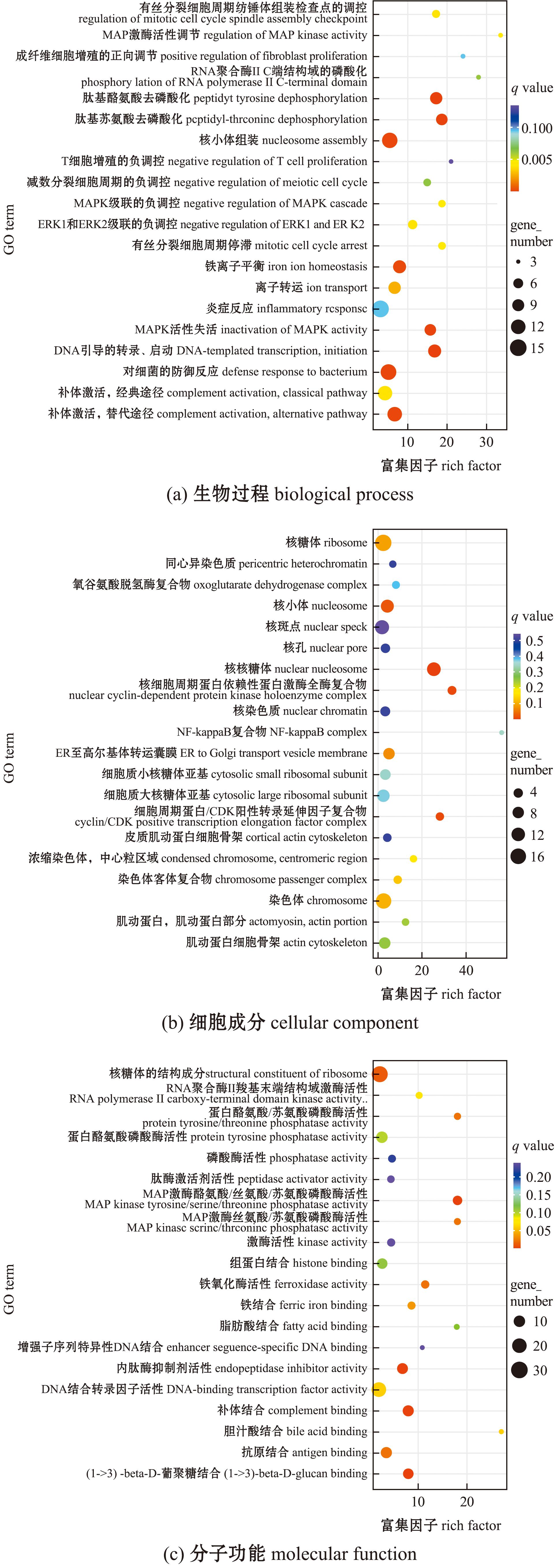
图7 各组织差异表达基因共表达GO富集
Fig.7 Co-expression of differentially expressed genes across tissues GO enrichment
根据KEGG通路富集分析,在GECG-vs-GPRG组中,DEGs在“细胞因子-细胞因子受体相互作用”(cytokine-cytokine receptor interaction)和“DNA复制”(DNA replication)等通路显著富集(P<0.05)(图8(a))。在GECK-vs-GPRK组中,DEGs在“氧化磷酸化作用”(oxidative phosphorylation)和“单疱疹病毒 1感染”(herpes simplex virus 1 infection)等通路显著富集(P<0.05)(图8(b))。在GECL-vs-GPRL组中,DEGs在“核糖体”(ribosome)、“RNA运输”(RNA transport)和“真核生物的核糖体生成”(ribosome biogenesis in eukaryotes)等通路显著富集(P<0.05)(图8(c))。

图8 差异表达基因KEGG富集
Fig.8 KEGG enrichment of differentially expressed genes
各组织共表达的DEGs在“核糖体”(ribosome)、“细胞凋亡”(apoptosis)、“铁死亡”(ferroptosis)、“脂肪细胞因子信号通路”(adipocytokine signaling pathway)、“新霉素、卡那霉素和庆大霉素的生物合成”(neomycin,kanamycin and gentamicin biosynthesis)、“糖酵解/糖异生”(glycolysis/gluconeogenesis)和“脂肪酸的生物合成”(fatty acid biosynthesis)等通路显著富集(P<0.05)(图8(d))。
其中,在青海湖裸鲤和花斑裸鲤各组织中表达差异的通路铁死亡、细胞凋亡和糖酵解/糖异生中分别筛选出21、22、12个DEGs,注释到“铁死亡”(tfa、tfR1a)、“细胞凋亡”(atf4b)和“糖异生/糖酵解”(hk2)等通路差异表达基因可能是与青海湖裸鲤耐盐碱有关的关键基因。
3 讨论
青海湖裸鲤生存于高盐碱的咸水湖中,环境较为恶劣,生长相对缓慢,不同于其他鲤科鱼类的是青海湖裸鲤还有生殖洄游的习性,可在淡水和盐碱水环境生活,其耐盐碱的特性相较于其他鲤科鱼类也较为特有[13-14]。在鱼类耐盐碱研究方面,多数鱼类较为耐盐,能够耐高碱的鱼类并不多见[15],青海湖裸鲤是耐碱鱼类的典型代表[16-17]。青海湖裸鲤作为青海湖的土著鱼类,挖掘其耐盐碱关键基因,并对其适应高盐碱水环境调控机制进行深入研究,可为进一步挖掘和开发利用裸鲤属功能基因提供有益参考。
3.1 铁死亡在青海湖裸鲤适应高盐碱环境中的作用机制分析
铁死亡是一种非凋亡的细胞死亡形式,由细胞膜上致命的脂质过氧化物异常积累引起[18-19],其发生机制是细胞膜上高表达的不饱和脂肪酸发生脂质过氧化(二价铁离子/酯氧合酶催化)导致细胞死亡[20]。铁蛋白、转铁蛋白及转铁蛋白受体是铁死亡过程中发挥重要作用的蛋白。研究表明,脊椎动物机体中的铁转运主要靠转铁蛋白来实现,它是机体内重要的β-球蛋白[21]。转铁蛋白作为体液中不可缺少的一种蛋白成分,具有广泛的生理蛋白功能,主要参与呼吸、细胞增殖、免疫调节、铁的转运和代谢、铁离子平衡及能量平衡,且具有较强的抗菌和抑菌功能[22]。铁的储存代谢及熏蒸主要通过铁蛋白来实现,机体内的铁主要通过铁蛋白贮存,并且可以通过铁的摄入储存来防止机体细胞中游离的Fe3+水平过高而产生毒性作用。肝脏是机体最大的铁储存器官,但肝脏内铁的过度积累也可能会导致肝细胞损伤。研究表明,许多肝脏相关疾病都与铁蛋白水平的异常变化密切相关,如病毒性肝炎、脂肪肝、肝纤维化、肝硬化及肝癌等[23-24]。研究发现,肝脏中的铁过量沉积时,会刺激肝细胞内的Feton反应,主要通过产生氧自由基、活性氧和羟基自由基等有害物质,造成对机体肝细胞的伤害[25]。转铁蛋白受体(transferrin receptor,tfr)是二聚体,它由两个相同的亚基通过两条二硫键相互连接而形成,是一种Ⅱ型的跨膜糖蛋白[26-27]。tfr是细胞铁稳态的关键调节器,主要通过与转铁蛋白(transferrin,tf)的相互作用来实现铁的吸收。研究表明,tfr与贫血、神经退行性疾病及癌症等的发生有关[28-29]。
本研究中,tfa、tfr1a主要在青海湖裸鲤和花斑裸鲤的肝脏组织中表达,且在花斑裸鲤肝脏组织中的表达量显著高于青海湖裸鲤。淡水水域中的花斑裸鲤作为高盐碱环境中生存的青海湖裸鲤的对照,其肝脏对于铁死亡过程的调控能力大于受环境胁迫影响的青海湖裸鲤,其中与铁死亡相关的tfa、tfR1a表达量较高。
3.2 细胞凋亡在青海湖裸鲤适应高盐碱环境中的作用机制分析
细胞凋亡是指在特定的生理或病理情况下,机体为了维持内环境的稳态,通过基因调控、启动内源性核酸内切酶等途径,细胞出现程序性死亡的过程,一般对动物的个体发育产生影响[30]。在细胞凋亡过程中,转录激活子4(activatingtranscriptionfactor 4,atf4)作为胁迫反应响应的基因发挥着重要作用,主要作用于应激信号诱导的反应,如介导缺氧、氨基酸缺失、氧化应激和内质网应激等信号通路[31]。atf4在细胞核中参与一系列基因的转录调控,如氨基酸的合成、蛋白质的正确折叠和降解、氧化还原状态的维持、自噬过程及细胞凋亡等[32]。当机体面临应激情况时,atf4的表达水平会增加,与细胞转录因子相互作用,通过调节下游的靶基因,启动细胞的应答机制[33]。
由于青海湖的高盐碱环境,青海湖裸鲤需通过机体的一系列自身调节来适应环境胁迫,atf4作为一种普遍的胁迫反应响应基因,其表达量在青海湖裸鲤组织内均高于花斑裸鲤。本研究结果表明,青海湖裸鲤在应对环境胁迫时,细胞凋亡相关通路中的差异表达基因atf4b,可能在青海湖裸鲤适应高盐碱环境过程中发挥重要作用。
3.3 糖酵解在青海湖裸鲤适应高盐碱环境中的作用机制分析
糖酵解通过葡萄糖代谢来实现为细胞供能的过程。通常在氧气条件充足的情况下,在细胞质中葡萄糖转化为丙酮酸,丙酮酸转运至线粒体,在线粒体中发生氧化磷酸化反应,生成大量ATP为细胞供能。在缺氧条件下,发生厌氧糖酵解,将丙酮酸转化为乳酸,产生少量ATP。但也存在特殊情况,Wang等[34]发现,肿瘤细胞可以在氧气充足的状态下,不通过氧化磷酸化,而是利用AEG与减少的线粒体氧化磷酸化结合来产生能量,也就是有氧糖酵解,其特点是快速生成ATP[35-37]。催化有氧糖酵解代谢途径第一步的限速酶是己糖激酶 2 (hk2)[38],hk2主要通过抑制细胞色素C的释放来抑制细胞凋亡的发生,从而促进糖酵解过程发生[39]。
青海湖裸鲤受环境胁迫,自身需要产生更多的ATP来为细胞供能,hk2作为糖酵解过程中重要的限速酶,其高表达可抑制细胞凋亡的发生,促进糖酵解产生ATP,在青海湖裸鲤中有高表达量。
4 结论
1)通过对青海湖裸鲤和花斑裸鲤鳃、肾脏和肝脏组织进行转录组比较分析,各组织分别筛出9 807、6 550、5 651个DEGs。
2)共有53 330个DEGs在3个组织中共表达,其中107个DEGs显著富集到细胞凋亡(apoptosis)、铁死亡(ferroptosis)和糖酵解/糖异生(glycolysis/gluconeogenesis)(P<0.05)等信号通路。
3)tfa、tfr1a、atf4b、hk2等基因可能与青海湖裸鲤适应高盐碱水环境密切相关。
[1] 高子韩,卫唯,岳苗,等.慢性碱胁迫下青海湖裸鲤的糖代谢相关应答[J].大连海洋大学学报,2025,40(1):65-75.GAO Z H,WEI W,YUE M,et al.Glucose metabolism-related responses in Gymnocy prisprzewalskii from Qinghai Lake under chronic alkalinity stress[J].Journal of Dalian Ocean University,2025,40(1):65-75.(in Chinese)
[2] 赵凯,段子渊,杨公社,等.青海湖裸鲤的起源和花斑裸鲤的种群演化[J].自然科学进展,2007,17(3):320-328.ZHAO K,DUAN Z Y,YANG G S,et al.Origin of Gymnocypris przewalskii and population evolution of Gymnocypris eckloni[J].Progress in natural sciences,2007,17(3):320-328.(in Chinese)
[3] 李吉均,方小敏,马海洲,等.晚新生代黄河上游地貌演化与青藏高原隆起[J].中国科学(D辑(地球科学)),1996(4):316-322.LI J J,FANG X M,MA H Z,et al.Late Cenozoic geomorphologic evolution of the upper Yellow River and uplift of the Tibetan Plateau[J].Science in China (Series D (Earth Sciences)),1996(4):316-322.(in Chinese)
[4] 李吉均,方小敏,潘保田,等.新生代晚期青藏高原强烈隆起及其对周边环境的影响[J].第四纪研究,2001,21(5):381-391.LI J J,FANG X M,PAN B T,et al.Late cenozoic intensive uplift of Qinghai-Xizang plateau and its impacts on environments in surrounding area[J].Quaternary Sciences,2001,21(5):381-391.(in Chinese)
[5] 孟玉琼,张伦祥,许国倩,等.青海湖裸鲤和花斑裸鲤消化酶活力对比[J].河北渔业,2018(1):1-4.MENG Y Q,ZHANG L X,XU G Q,et al.Comparative on digestive enzymes activities of Gymnocypris przewalskii and Gymnocypris eckloni[J].Hebei Fisheries,2018(1):1-4.(in Chinese)
[6] 赵凯,李俊兵,杨公社,等.青海湖及其相邻水系特有裸鲤属鱼类的分子系统发育[J].科学通报,2005,50(13):1348-1355.ZHAO K,LI J B,YANG G S,et al.Molecular phylogeny of gymnosperms endemic to Qinghai Lake and its adjacent water systems[J].Chinese Science Bulletin,2005,50(13):1348-1355.(in Chinese)
[7] 田菲,赵凯.青海湖裸鲤高原极端环境适应的基因组基础[C]//第八届中国西部动物学学术研讨会.贵阳,2019:98.TIAN F,ZHAO K.Genomic basis of adaptation to environmental extremes in Gymnocypris przewalskii plateau[C]//The Eighth Western China Zoological Symposium,Guiyang:2019:98.(in Chinese)
[8] 张海琛,许保可,阿琳林,等.青海湖裸鲤与花斑裸鲤MHCⅡ基因克隆、组织表达及多态性[J].水产学报,2024,48(11):3-19.ZHANG HC,XU B K,A L L,et al.Screening and analysis of the osmotic,immune,metabolic related genes of Gymnocypris przewalskii and Gymnocypris eckloniin saline-alkali tolerance[J].Journal of Fisheries of China,2024,48(11):3-19.(in Chinese)
[9] 马宏林.基于斑马鱼模型的芪龙胶囊促进血管生成的机理研究[D].济南:齐鲁工业大学,2024.MA H L.Study on the Mechanism of qilong capsule promoting angiogenesis based on zebrafish model[D].Jinan:Qilu University of Technology,2024.(in Chinese)
[10] 赵永丽.花斑裸鲤低氧胁迫转录组学及其主要差异基因表达调控研究[D].西宁:青海大学,2018.ZHAO Y L.Transcriptomics of Gymncypris eckloni under hypoxia and the expression regulation of major differentially Genes[D].Xining:Qinghai University,2018.(in Chinese)
[11] 余家麒.青海湖裸鲤低氧胁迫的转录组学分析[D].西宁:青海大学,2023.YU J Q.Transcriptomic analysis of hypoxic stress in Gymnocypris przewalskii[D].Xining:Qinghai University,2023.(in Chinese)
[12] 张海琛,马清花,许保可,等.青海湖裸鲤盐碱耐受过程中的渗透、免疫、代谢相关基因筛选和分析[J].水产学报,2023,47(12):17-36.ZHANG H C,MA Q H,XU B K,et al.Screening and analysis of the osmotic,immune,metabolic related genes of Gymnocypris przewalskii in saline-alkali tolerance[J].Journal of Fisheries of China,2023,47(12):17-36.(in Chinese)
[13] 付生云,周卫国,张涛,等.青海湖裸鲤洄游排卵、受精高峰期的繁殖特征[J].畜牧兽医科技信息,2019(11):33-34.FU S Y,ZHOU W G,ZHANG T,et al.Reproductive characteristics of Gymnocypris przewalskii during its migratory oviposition and peak fertilization periods[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,2019(11):33-34.(in Chinese)
[14] WEI F L,LIANG J,TIAN W G,et al.Transcriptomic and proteomic analyses provide insights into the adaptive responses to the combined impact of salinity and alkalinity in Gymnocypris przewalskii[J].Bioresources and Bioprocessing,2022,9(1):104.
[15] 卫唯,高子韩,岳苗,等.青海湖裸鲤SMIT1和SMIT2基因克隆及其对碱度环境的应答[J].中国畜牧兽医,2024,51(6):2285-2299.WEI W,GAO Z H,YUE M,et al.Cloning of the SMIT1 and SMIT2 genes in Gymnocypris przewalskii and its response to alkaline environment[J].China Animal Husbandry &Veterinary Medicine,2024,51(6):2285-2299.(in Chinese)
[16] 常玉梅,梁利群.耐盐碱鱼类的生理和分子机制研究进展[J].水产学报,2021,45(5):798-812.CHANG Y M,LIANG L Q.Advances of research of physiological and molecular mechanisms related to alkali-saline adaptation for fish species inhabiting alkali-saline water[J].Journal of Fisheries of China,2021,45(5):798-812.(in Chinese)
[17] 王卓,么宗利,林听听,等.碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP和AKP酶活性的影响[J].中国水产科学,2013,20(6):1212-1218.WANG Z,YAO Z L,LIN T T,et al.Effects of carbonate alkalinity stress on SOD,ACP,and AKP activities in the liver and kidney of juvenile Gymnocypris przewalskii[J].Journal of Fishery Sciences of China,2013,20(6):1212-1218.(in Chinese)
[18] DIXON S J,LEMBERG K M,LAMPRECHT M R,et al.Ferroptosis:an iron-dependent form of nonapoptotic cell death[J].Cell,2012,149(5):1060-1072.
[19] STOCKWELL B R,JIANG X J,GU W.Emerging mechanisms and disease relevance of ferroptosis[J].Trends in Cell Biology,2020,30(6):478-490.
[20] 陈默冉,周雪冰,陈丹,等.铁死亡在肿瘤中的研究进展[J].生命科学,2022,34(9):1108-1115.CHEN M R,ZHOU X B,CHEN D,et al.Research progress of ferroptosis in tumors[J].Chinese Bulletin of Life Sciences,2022,34(9):1108-1115.(in Chinese)
[21] 赵建辉,韩柱,侯小康.转铁蛋白的研究进展[J].河北化工,2010,33(9):34-36.ZHAO J H,HAN Z,HOU X K.Study progress of transferrin[J].Hebei Chemical Engineering and Industry,2010,33(9):34-36.(in Chinese)
[22] 李春燕,孙传政,宋鑫.肿瘤细胞死亡的一种新形式:铁死亡[J].中国生物化学与分子生物学报,2019,35(11):1208-1214.LI C Y,SUN C Z,SONG X.A new form of tumor cell death:ferroptosis[J].Chinese Journal of Biochemistry and Molecular Biology,2019,35(11):1208-1214.(in Chinese)
[23] 李坤,沈天白,李莹.慢性乙型肝炎和乙型肝炎肝硬化患者血清铁蛋白的变化[J].实用肝脏病杂志,2015,18(6):620-623.LI K,SHEN T B,LI Y.The change of serum ferritin in patients with hepatitis B and hepatitis B-induced liver cirrhosis[J].Journal of Practical Hepatology,2015,18(6):620-623.(in Chinese)
[24] 程丹,邵志林,吴亮,等.慢性肝病及肝癌患者血清铁蛋白的检测意义[J].肝脏,2017,22(4):339-341.CHENG D,SHAO Z L,WU L,et al.Significance of detection of serum ferritin in patients with chronic liver disease and liver cancer[J].Chinese Hepatology,2017,22(4):339-341.(in Chinese)
[25] 黄越前.血清铁蛋白对非酒精性脂肪肝患者早期肝纤维化的诊断价值[J].检验医学与临床,2015,12(10):1383-1385.HUANG Y Q.Clinical value of serum ferritin in diagnosis for hepatic fibrosis in patients with nonalcoholic fatty liver disease[J].Laboratory Medicine and Clinic,2015,12(10):1383-1385.(in Chinese)
[26] LOUTRADIS D,DRAKAKIS P,VOMVOLAKI E,et al.Different ovarian stimulation protocols for women with diminished ovarian reserve[J].Journal of Assisted Reproduction and Genetics,2007,24(12):597-611.
[27] PARENTI R,SALVATORELLI L,MAGRO G.Anaplastic thyroid carcinoma:current treatments and potential new therapeutic options with emphasis on TfR1/CD71[J].International Journal of Endocrinology,2014,2014(1):685396.
[28] CALLENSC,MOURA I C,LEPELLETIER Y,et al.Recent advances in adult T-cell leukemia therapy:focus on a new anti-transferrin receptor monoclonal antibody[J].Leukemia,2008,22(1):42-48.
[29] RICHARDSON D R,KALINOWSKI D S,LAU S,et al.Cancer cell iron metabolism and the development of potent iron chelators as anti-tumour agents[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2009,1790(7):702-717.
[30] 杨佐娟,何建平.哺乳动物卵子发生过程中细胞凋亡的研究进展[J].陕西师范大学学报(自然科学版),2006,34(S1):141-144.YANG Z J,HE J P.Research progress of apoptosis during oogenesis in mammals[J].Journal of Shaanxi Normal University (Natural Science Edition),2006,34(S1):141-144.(in Chinese)
[31] 王慧,刘勤江.ATF4基因与肿瘤[J].中国医药导报,2018,15(18):36-39.WANG H,LIU Q J.ATF4 gene and tumor[J].China Medical Herald,2018,15(18):36-39.(in Chinese)
[32] SINGLETON D C,HARRIS A L.Targeting the ATF4 pathway in cancer therapy[J].Expert Opinion on Therapeutic Targets,2012,16(12):1189-1202.
[33] 余金玉,韩静,张营,等.花旗松素调控内质网应激PERK-ATF4通路减轻高血压大鼠心肌肥厚的机制研究[J].中国比较医学杂志,2023,33(9):54-62.YU J Y,HAN J,ZHANG Y,et al.Mechanism of taxifolin regulating endoplasmic reticulum stress via the PERK-ATF4 pathway to reduce myocardial hypertrophy in hypertensive rats[J].Chinese Journal of Comparative Medicine,2023,33(9):54-62.(in Chinese)
[34] WANG Y H,PATTI G J.The Warburg effect:a signature of mitochondrial overload[J].Trends in Cell Biology,2023,33(12):1014-1020.
[35] 余功,陈江涛,胡桥,等.清燥救肺汤对荷Lewis小鼠肺癌细胞糖酵解关键限速酶HK2,PFK2,PKM2的影响[J].中国实验方剂学杂志,2020,26(4):54-58.YU G,CHEN J T,HU Q,et al.Effect of Qingzao Jiufei Tang on rate-limiting enzymes HK2,PFK2 and PKM2 in glycolytic pathway in lewis lung cancer-bearing mice cells[J].Chinese Journal of Experimental Traditional Medical Formulae,2020,26(4):54-58.(in Chinese)
[36] YING Z H,LI H M,YU W Y,et al.Iridin prevented against lipopolysaccharide-induced inflammatory responses of macrophages via inactivation of PKM2-mediated glycolytic pathways[J].Journal of Inflammation Research,2021,14:341-354.
[37] ZHANG Q,LUO P,XIA F,et al.Capsaicin ameliorates inflammation in a TRPV1-independent mechanism by inhibiting PKM2-LDHA-mediated Warburg effect in sepsis[J].Cell Chemical Biology,2022,29(8):1248-1259.e6.
[38] WANG Q Q,GUO X C,LI L,et al.N6-methyladenosine METTL3 promotes cervical cancer tumorigenesis and Warburg effect through YTHDF1/HK2 modification[J].Cell Death &Disease,2020,11:911.
[39] DEWAAL D,NOGUEIRA V,TERRY A R,et al.Author correction:Hexokinase-2 depletion inhibits glycolysis and induces oxidative phosphorylation in hepatocellular carcinoma and sensitizes to metformin[J].Nature Communications,2018,9:2539.