黑鲷(Acanthopagrus schlegelii)为鲷科(Sparidae)棘鲷属(Acanthopagrus)鱼类,在中国南北沿海均见分布,在黄海、渤海沿岸产量较大,其肉质鲜美、营养丰富,且抗逆性较强,是中国沿海重要的增养殖对象[1]。随着黑鲷养殖规模的拓展,培育优良新品种成为推进其产业发展的关键。杂交育种通过将不同遗传背景的个体进行组合,可以有效地提升选育目标的遗传多样性,且获得杂种优势,增强育种效果[2]。真鲷(Pagrus major)为鲷科真鲷属种类,生长速度快,且外观色泽鲜艳,为中国南方近海养殖鱼类主要品种[3]。近年来,利用真鲷与黑鲷两种鱼类各自特性的杂交育种研究已有许多报道,围绕两种杂交子代与亲本的养殖性状表现、基因表达及线粒体基因组等研究均已取得诸多效果[4-7]。
相较于杂交培育,鱼类自体受精的研究报道较少,仅在虹鳟(Oncorhynchus mykiss)[8]、革胡子鲇(Clarias lazera)[9]和黄河鲶(Silurus lanzhouensis)[10]等物种上取得了一些试验结果。自体受精不仅可以加快不良基因的淘汰,提高基因纯化速度,还可以加快群体分化,提高育种效率[11];而且,相较于采用精子灭活进行的雌核发育等育种手段[12],自体受精更具独特的育种研究价值。本团队利用黑鲷雄性先熟型的雌雄同体特性及精子低温保存技术,成功构建了多个黑鲷自体受精家系,并取得良好的养殖效果,首次在黑鲷自体受精繁育及养殖上取得突破。
为探究黑鲷的自体受精子代或杂交子代的遗传特征,并为鲷科性逆转鱼类遗传育种的提供科学参考,研究此类新种质的遗传信息变化情况具有重要意义。染色体作为生物遗传物质信息的主要载体,是生物进化的档案库[13]。对鱼类染色体核型进行分析,是鱼类遗传育种等研究的重要参考,也是揭示物种遗传信息的重要手段[14]。已有研究分别报道了黑鲷和真鲷的染色体组成等情况[15],但关于黑鲷♀×真鲷♂的杂交子代及黑鲷自体受精子代染色体组成研究尚未见报道。据此,本研究中通过优化体内注射法,对黑鲷自体受精与杂交的子代进行了染色体核型分析,以期为相关黑鲷育种及遗传变化研究提供科学依据。
1 材料与方法
1.1 材料
试验鱼均为江苏省海水增养殖技术及种苗中心繁育、养殖。杂交子代(PA,黑鲷♀×真鲷♂)和黑鲷自体受精子代(AS)鱼各3尾,共计6尾试验鱼,均为体质量50~60 g的一龄鱼。
1.2 方法
1.2.1 染色体标本的制备 染色体标本制备参照林义浩[16]PHA液体内注射法并对浓度和处理条件进行了优化。
预处理:试验鱼按5 μg/g的剂量胸鳍基部注射植物血球凝集素PHA(0.9%生理盐水配制),暂养24 h后,再次胸鳍基部注射2 μg/g剂量的秋水仙素(0.9%生理盐水配制),暂养1.5~2 h后,将试验鱼剪开鳃动脉部放血3~5 min,使用的试验用品均提前消毒。
制备头肾细胞悬液:解剖并采集试验鱼头肾组织,用0.9%生理盐水冲洗2~3 次。置于盛有少量生理盐水的培养皿中,用镊子反复撕扯头肾组织2~3 min,经过 57 μm纱绢过滤至20 mL离心管中。将制备好的细胞悬液置于离心机中,以1 000 r/min离心8 min,弃上清液,重复2~3 次;低渗:加入8 mL浓度为0.075 mol/L的KCl溶液,低渗处理30 min,随后以1 000 r/min离心8 min,弃上清液。固定:在低渗保留的细胞悬液中,加入8 mL现配的冷的卡诺氏固定液,固定30 min后,以1 000 r/min离心8 min,弃上清液,此过程重复3次。制片:采用冷滴片法制作切片,采用10% Giemsa染液进行染色,染色时间为30 min,超纯水缓慢冲洗,自然干燥后镜检并拍摄。
1.2.2 染色体核型分析 采用尼康Ni-E显微镜,100 X油镜下观察染色体制片,选择分散均匀、长度适中、形态明确的分离相并拍照。采用MATO软件对染色体进行计数和测量[17]。染色体的数量根据众数原则计算。确认着丝点的位置,测量和计算每条染色体的相对长度和臂比,并根据Levan等[18]的标准进行配对。根据臂比将染色体分为4组:m类型染色体(中部着丝粒染色体,metacentric chromosomes),臂比为1.0~1.7;sm类型染色体(亚中部着丝粒染色体,submetacentric chromosomes),臂比为1.71~3.00;st类型染色体(亚端部着丝粒染色体,subtelocentric chromosomes),臂比为3.01~7.00;t类型染色体(端部着丝粒染色体,telocentric chromosomes),臂比>7.00;m和sm染色体的臂数为2,t和st染色体的臂数为1。相对染色体长度=(1条染色体的长度×2/所有染色体的总长度)×100。
2 结果与分析
2.1 黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代的染色体数目
观察记录两个种类的染色体分裂相情况,分别筛选分散良好、形态清晰的染色体中期分裂相各100 个,并统计染色体数目,结果见表1。其中,PA中期分裂相染色体中,染色体数目48 条的分裂相最多,占比为63.0%。根据众数原则,判断PA的染色体数目为2n=48。AS染色体数目为48 条的分裂相最多,占比为40.0%。判断AS的染色体数目为2n=48。
表1 黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代的染色体数目统计
Tab.1 Chromosome number statistics of F1 hybrids of Acanthopagrus schlegelii ♀×Pagrus major ♂ and F1 offspring of Acanthopagrus schlegelii self-fertilization
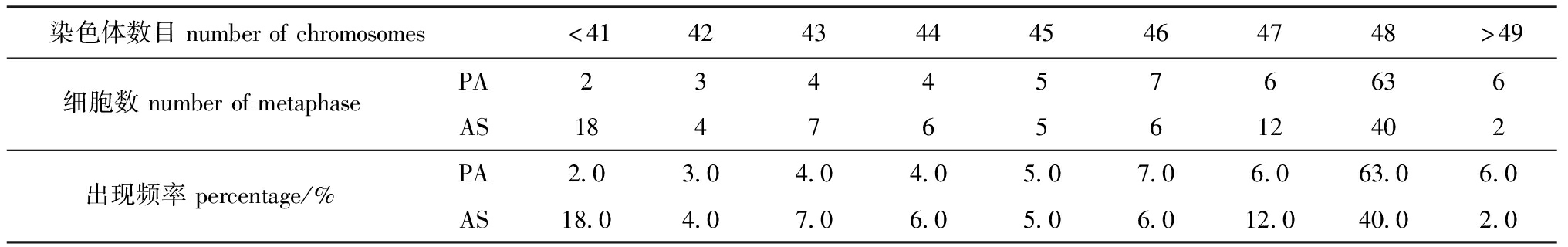
染色体数目numberofchromosomes<4142434445464748>49细胞数numberofmetaphasePA2344576636AS184765612402出现频率percentage/%PA2.03.04.04.05.07.06.063.06.0AS18.04.07.06.05.06.012.040.02.0
2.2 黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代的染色体核型分析
分别挑选杂交和自体受精子代中各5个分散均匀、形态清楚的中期分裂相,进行显微摄像镜检,并统计染色体相对长度、臂比、染色体类型,结果见表2。根据测量统计和Levan的分类标准,PS的24对染色体分为3组,包括4对亚中部着丝粒染色体,1对亚端部着丝粒染色体,19对端部着丝粒染色体。染色体组的核型公式为2n=8sm+2st+38t,NF=56(图1)。24对染色体中相对长度最大为5.67±0.37,最小为2.55±0.10。AS的24对染色体分为4组:2对中部着丝粒染色体,2对亚中部着丝粒染色体,1对亚端部着丝粒染色体,19对端部着丝粒染色体。染色体组的核型公式为2n=4m+4sm+2st+38t,NF=56(图2)。24对染色体中,相对长度最大为5.59±0.07,最小为2.82±0.15。
表2 黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代的核型指数
Tab.2 Karyotype index of F1 hybrids of Acanthopagrus schlegelii ♀×Pagrus major ♂ and F1 offspring of Acanthopagrus schlegelii self-fertilization
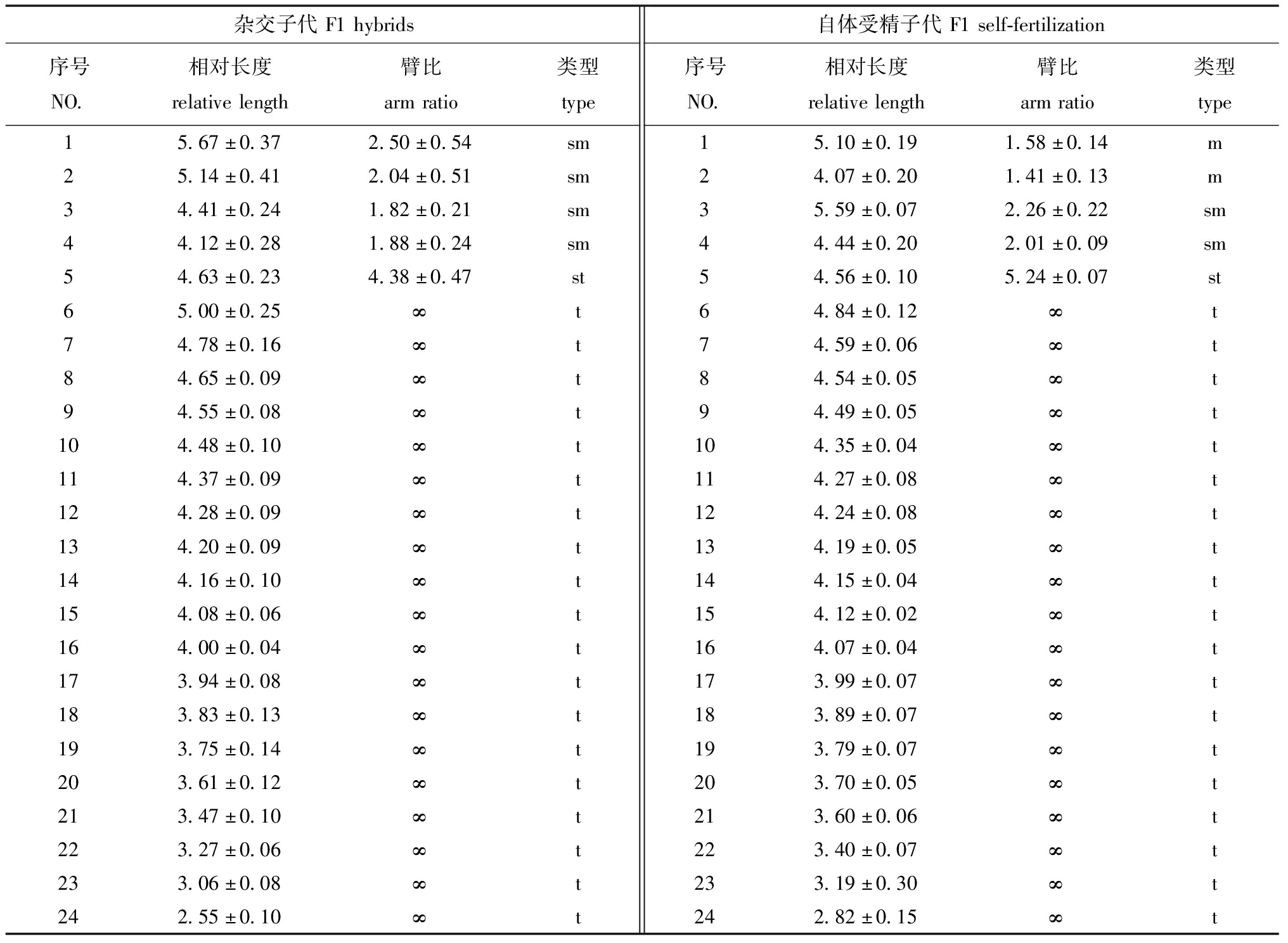
杂交子代F1hybrids序号NO.相对长度relativelength臂比armratio类型type15.67±0.372.50±0.54sm25.14±0.412.04±0.51sm34.41±0.241.82±0.21sm44.12±0.281.88±0.24sm54.63±0.234.38±0.47st65.00±0.25∞t74.78±0.16∞t84.65±0.09∞t94.55±0.08∞t104.48±0.10∞t114.37±0.09∞t124.28±0.09∞t134.20±0.09∞t144.16±0.10∞t154.08±0.06∞t164.00±0.04∞t173.94±0.08∞t183.83±0.13∞t193.75±0.14∞t203.61±0.12∞t213.47±0.10∞t223.27±0.06∞t233.06±0.08∞t242.55±0.10∞t自体受精子代F1self-fertilization序号NO.相对长度relativelength臂比armratio类型type15.10±0.191.58±0.14m24.07±0.201.41±0.13m35.59±0.072.26±0.22sm44.44±0.202.01±0.09sm54.56±0.105.24±0.07st64.84±0.12∞t74.59±0.06∞t84.54±0.05∞t94.49±0.05∞t104.35±0.04∞t114.27±0.08∞t124.24±0.08∞t134.19±0.05∞t144.15±0.04∞t154.12±0.02∞t164.07±0.04∞t173.99±0.07∞t183.89±0.07∞t193.79±0.07∞t203.70±0.05∞t213.60±0.06∞t223.40±0.07∞t233.19±0.30∞t242.82±0.15∞t
注:∞表示臂比>7.0。
Note:∞ means that the arm ratio is greater than 7.0.
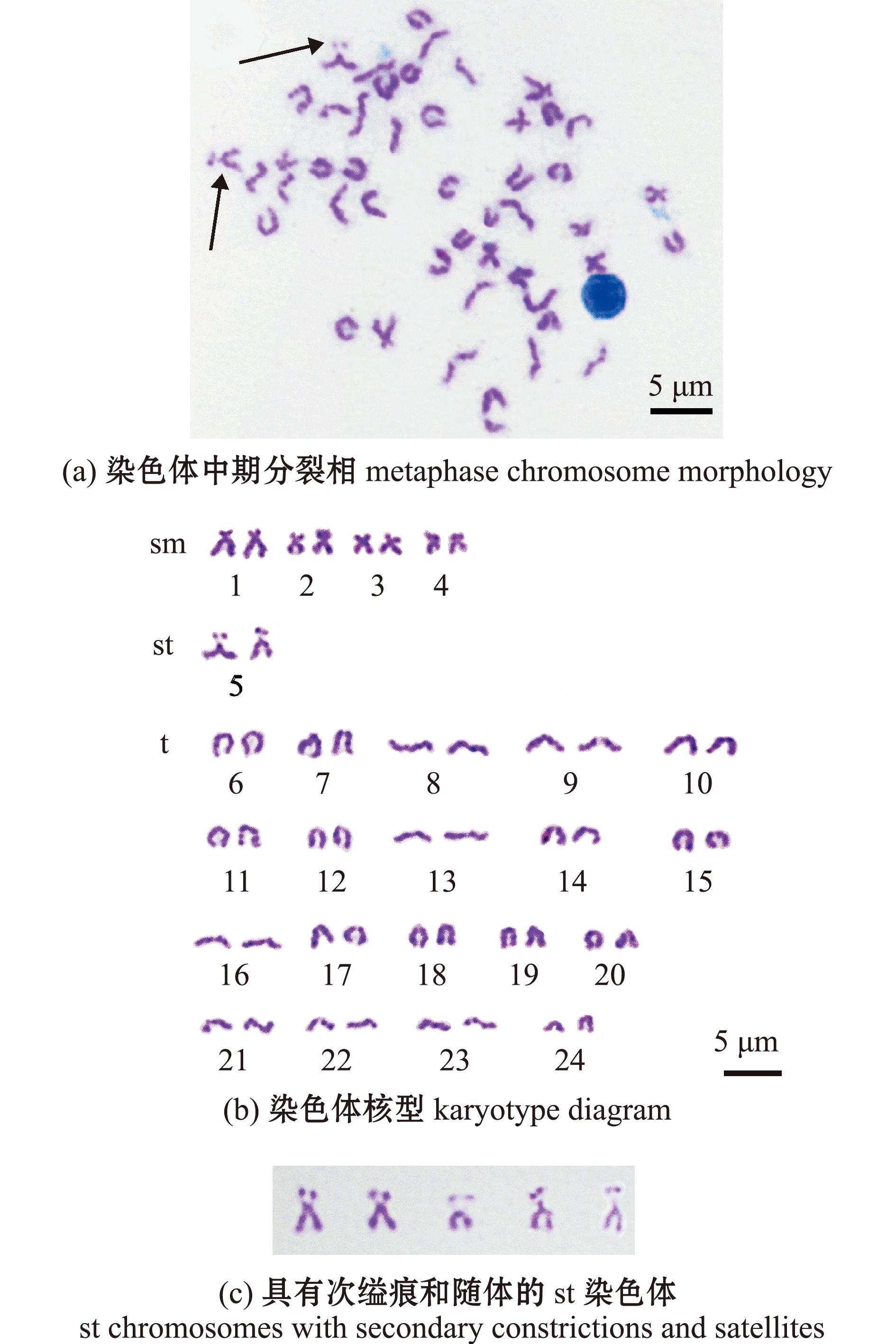
图1 黑鲷♀×真鲷♂杂交子代染色体中期分裂相、核型及具有次缢痕和随体的st染色体
Fig.1 Metaphase chromosome morphology,karyotype diagram of F1 Hybrids of Acanthopagrus schlegelii ♀×Pagrus major ♂ and st chromosomes with secondary constrictions and satellites
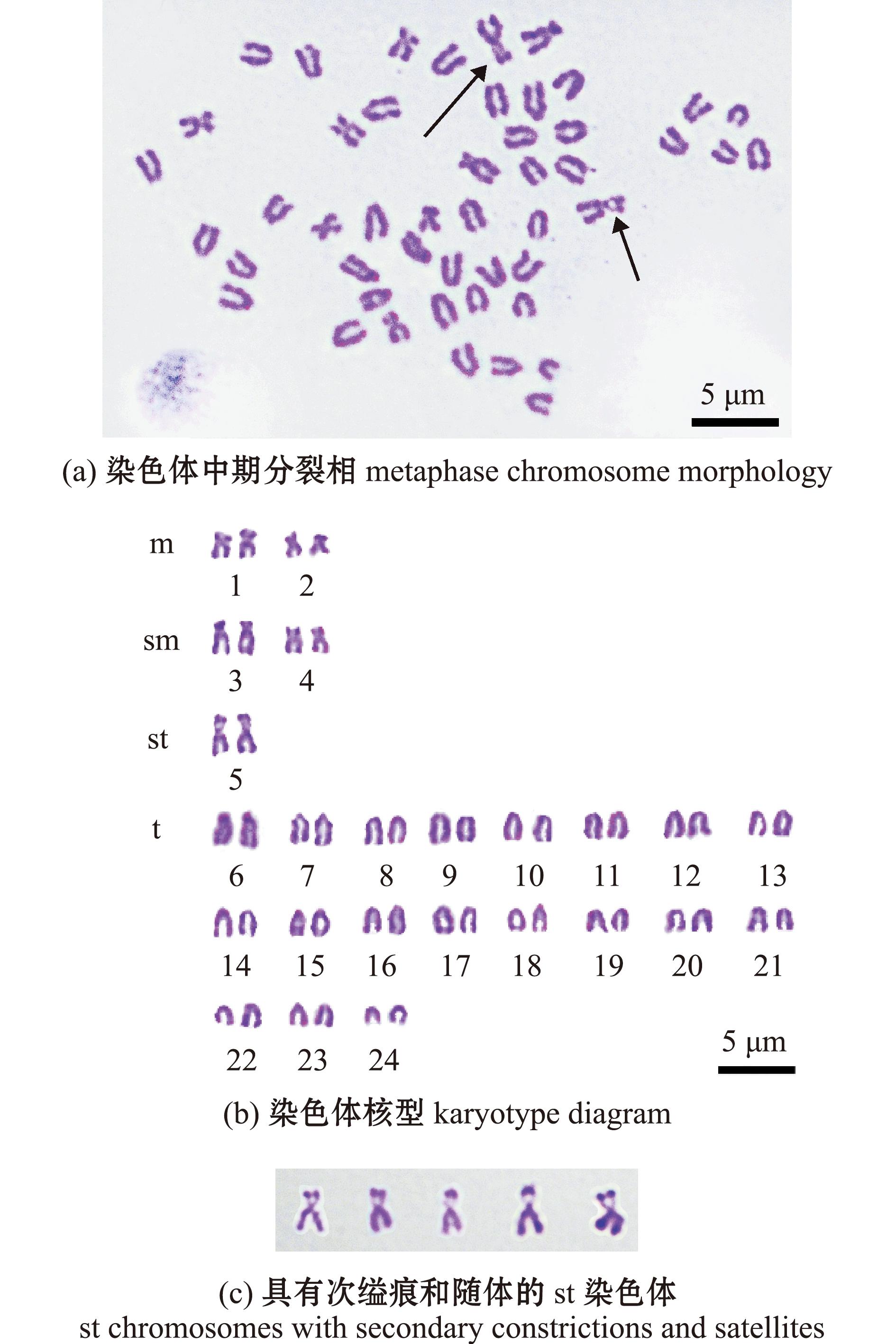
图2 黑鲷自体受精子代染色体中期分裂相、核型及具有次缢痕和随体的st染色体
Fig.2 Metaphase chromosome morphology,karyotype diagram of F1 offspring of Acanthopagrus schlegelii self-fertilization and st chromosomes with secondary constrictions of and satellites
对染色体组特殊标志性特征结构进行检查发现,杂交和自体受精的st染色体均具有次缢痕和随体的特殊结构(如图1和图2中箭头所示)。
3 讨论
3.1 黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代染色体制备方法优化分析
染色体制备的关键在于获取大量处于有丝分裂的细胞及让细胞停留在分裂中期。本研究中在依据林义浩[16]制备染色体方法的基础上,进行参数的优化,且尝试不同的浓度和处理条件。PHA作为一种非特异性刺激物,能够促使淋巴细胞进入有丝分裂周期,但其作用效果与浓度及处理时间密切相关[19]。研究表明,PHA浓度过低或处理时间过短时,淋巴细胞未能充分激活,导致进入有丝分裂的细胞数量不足;而浓度过高或作用时间过长时,反而会对细胞产生抑制作用,导致细胞增殖停滞,甚至出现毒性反应,如细胞死亡或形态畸变[20]。秋水仙素在染色体制备中的作用是通过抑制纺锤体形成,使得正在分裂的细胞在中期停滞,从而使染色体清晰可见。秋水仙素浓度和处理时间的优化是染色体制备的另一个关键因素,研究表明,秋水仙素的浓度过高或处理时间过长,虽然能够增加分裂细胞的数量,但会导致染色体在显微镜下过于浓缩,形态模糊,影响后续的染色体核型分析[21]。本研究在优化PHA、秋水仙素浓度和作用时间时,经过多次尝试,将PHA浓度降低至5 μg/g,秋水仙素浓度降低为2 μg/g。同时,PHA作用时间由1.5 h延长至24 h,制出染色体分裂相明显清楚,得到了较好的效果。秋水仙素作用时间由3 h缩短为2 h,预试验发现,PHA作用24 h后,注射秋水仙素2 h时鱼体活力快速下降,超出2 h后个体出现死亡率增大现象。
3.2 黑鲷自体受精子代染色体核型分析
自体受精作为一种特殊的生殖手段,受精卵由同一生物个体提供的卵子和精子结合形成[22]。自体受精一般发生于植物中,在海洋鱼类中尚鲜有报道。黑鲷具天然的性逆转习性,为雄性先熟型的雌雄同体,在2 龄期前全部表现为雄性功能,3 龄鱼开始部分性逆转为雌性[23]。自体受精个体的获取,采用在2 龄时取个体精液超低温保存,待到该个体在3 龄性逆转为雌性后,通过人工授精的方式即可得到自体受精卵进行培育[24]。遗传物质来源于同一个体,只携带来自单一亲本的染色体,而不是通常的一半来自父本,一半来自母本,因此,不会导致染色体核型发生改变[25]。本试验得到的AS染色体数目及染色体核型,均与林勉等[26]、喻子牛等[15]研究中得到的黑鲷的染色体数目及核型完全一致。然而,自体受精子代染色体数目众数48仅占40.0%,明显低于林勉等[26]的77.0%和喻子牛等[15]的63.4%。这种结果差异是否与自体受精的生殖方式或染色体制作方法所取的分裂相时期等有关,有待进一步分析[19,27]。
随体是一种位于染色体末端的小型、球状或椭圆形的染色质结构,它通过一系列细小的纤维与染色体的主体相连,这种带有随体的染色体被称作随体染色体[28]。随体与染色体主体间的连接点被称为次缢痕,并且在这一连接区域形成了核仁组织区域(NOR)[29]。本研究中的杂交子代和自体受精子代的st染色体均具有明显随体结构,这一结果与亲本黑鲷和真鲷一致。在核型演化及物种间亲缘关系研究中,NORs的数目和分布是一项重要依据[30]。
3.3 黑鲷♀×真鲷♂远缘杂交诱发雌核发育分析
有关不同种属鱼类间的杂交育种研究曾有大量报道。通常情况下,鱼类杂交育种中的正反交结果基本相同[31]。如在长鳍鲤和锦鲤的两种杂交子代(长鳍鲤♀×锦鲤♂,锦鲤♀×长鳍鲤♂)的染色体核型分析中,正、反交子代的染色体核型均为2n=22m+26sm+52st(NF=148),其核型介于双亲之间[32]。然而,在以真鲷为母本的杂交中(黑鲷♂×真鲷♀),其子代的核型为2n=30m+8sm+2st+8t(NF=86),其与父母本均不同[26];这与本试验中以黑鲷为母本所得的杂交子代染色体核型2n=8sm+2st+38t(NF=56)差异较大;杂交子代核型与黑鲷母本的更为贴近。以上两种杂交中,尽管双亲均为同一属,但其子代的染色体核型却呈现出介于双亲本之间或与某一亲本基本一致的情况,这表明杂交子代并非由父母亲本配子组成的杂合体。
根据Liu等[33]的研究,紫外线灭活的团头鲂精子可激活橙黄色锦鲤的卵子,得到人工雌核发育的橙黄色锦鲤,经染色体鉴定雌核发育子代染色体和亲本染色体一致。这一现象也在孙远东等[34]、刘静等[35]、牛文涛等[36]的研究中得到了验证,均表明雌核发育子代的染色体核型与母本基本一致。王晓清等[37]用大黄鱼和鮸进行属间杂交,通过分子标记分析表明,杂交子代与母本大黄鱼间具有极高的遗传同质性,属异精雌核发育个体。杨娜等[38]对吉富罗非鱼×翘嘴鳜的科间杂交子代进行染色体分析,结果显示,杂交子代的染色体数目与其母本相同,核型与其母本相似,二者与父本明显不同。在雌核发育过程中,父本精子仅起到激活卵子的作用,未贡献遗传物质,因此,子代的染色体结构和类型应当完全来源于母本。在本试验中,杂交子代的染色体核型(2n=8sm+2st+38t)与黑鲷母本的核型(2n=4m+4sm+2st+38t)非常接近,这表明后代的染色体特征几乎完美复制了母本的染色体类型和结构。研究表明,与父本真鲷的明显差异,支持了杂交子代仅继承了母本基因组的假设。母本黑鲷有4 条m型染色体(2n=4m+4sm+2st+38t),而在杂交子代的染色体核型中m型染色体转变成sm型染色体,这可能是由染色体复制或分配中的偶然性或小规模重排造成的。通过微卫星位点和COI序列的遗传分析,杂交子代的遗传多样性与黑鲷群体极为相似,进一步支持了杂交子代的遗传信息主要来源于母本黑鲷[39]。所有这些证据共同验证了杂交子代可能是由雌核发育形成的后代。
4 结论
1)黑鲷自体受精子代核型与母本一致。
2)黑鲷♀×真鲷♂杂交子代的染色体核型与母本高度相似,与父本差异较大,推测其可能是远缘杂交诱发的雌核发育后代。
3)通过优化试验条件,采用浓度为5 μg/g的PHA及2 μg/g的秋水仙素,可以得到较为理想的黑鲷♀×真鲷♂杂交子代和黑鲷自体受精子代个体的染色体中期分裂相。
[1] 李雪娇.低盐环境下黑鲷的生理响应及对脂肪营养需求的研究[D].宁波:宁波大学,2022.LI X J.Study on physiological response of Sparus macrocephalus in low salt environment and its demand for fat nutrition[D].Ningbo:Ningbo University,2022.(in Chinese)
[2] HOCHHOLDINGER F,YU P.Molecular concepts to explain heterosis in crops[J].Trends in Plant Science,2025,30(1):95-104.
[3] 翁忠钗.真鲷池塘育苗技术[J].中国水产,2011(3):38-39.WENG Z C.Seedling raising techniques of red snapper in pond[J].China Fisheries,2011(3):38-39.(in Chinese)
[4] ZHU F,ZHANG Z Y,CHEN S Y,et al.The complete mitochondrial genome of the hybrid of Pagrus major (♀)×Acanthopagrus schlegelii (♂)[J].Mitochondrial DNA Part A,DNA Mapping,Sequencing,and Analysis,2016,27(4):2980-2981.
[5] DU X R,ZHAO Y,LI J B,et al.Expression patterns of TGF-β1,TβR-I,TβR-Ⅱ,and Smad2 reveal insights into heterosis for growth of hybrid offspring between Acanthopagrus schlegelii and Pagrus major[J].Genes,2024,15(7):945.
[6] ZHOU T J,JIA C F,MENG Q,et al.Transcriptome-based analysis of the liver response mechanism of black porgy (Acanthopagrus schlegelii) to stocking density[J].Fishes,2023,8(7):356.
[7] ZHOU T J,MENG Q,SUN R J,et al.Structure and gene expression changes of the gill and liver in juvenile black porgy (Acanthopagrus schlegelii) under different salinities[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2024,50:101228.
[8] CHEVASSUS B,DEVAUX A,CHOURROUT D,et al.Production of YY rainbow trout males by self-fertilization of induced hermaphrodites[J].Journal of Heredity,1988,79(2):89-92.
[9] 刘少军,王跃群,姚占州,等.人工诱导雌雄同体革胡子鲇自体受精后代的胚胎发育研究[J].中国水产科学,1997,4(2):7-12.LIU S J,WANG Y Q,YAO Z Z,et al.Studies on the embryonic development of offspring produced by self-fertilizing of induced hermaphrodites of the teleost Clarias lazera[J].Journal of Fishery Sciences of China,1997,4(2):7-12.(in Chinese)
[10] WANG T,LI Z,YU Z X,et al.Production of YY males through self-fertilization of an occasional hermaphrodite in Lanzhou catfish (Silurus lanzhouensis)[J].Aquaculture,2021,539:736622.
[11] 马大勇,胡红浪,孔杰.近交及其对水产养殖的影响[J].水产学报,2005,29(6):849-856.MA D Y,HU H L,KONG J.Inbreeding and its impact on aquaculture[J].Journal of Fisheries of China,2005,29(6):849-856.(in Chinese)
[12] 曲木,张宝龙,赵子续,等.雌核发育在水产养殖业的应用[J].农业开发与装备,2019(11):60-61,59.QU M,ZHANG B L,ZHAO Z X,et al.Application of gynogenesis in aquaculture[J].Agricultural Development &Equipments,2019(11):60-61,59.(in Chinese)
[13] 姚世鸿.染色体进化与生物进化关系研究的历史与现状[J].贵州师范大学学报(自然科学版),1993,11(4):75-83.YAO S H.The history and present situation of the research on the relationship between chromosomal evolution and biological evolution[J].Journal of Guizhou Normal Univeristy (Natural Science Edition),1993,11(4):75-83.(in Chinese)
[14] 尤锋,吴志昊.我国海水鱼类染色体操作研究与应用进展[J].海洋科学,2020,44(8):69-84.YOU F,WU Z H.Progress in the study and application of chromosome manipulation in marine fishes from China[J].Marine Sciences,2020,44(8):69-84.(in Chinese)
[15] 喻子牛,孔晓瑜,谢宗墉,等.真鲷Pagrosomus major和黑鲷Sparus macrocephalus的核型及Ag—NOR带研究[J].青岛海洋大学学报,1993,23(3):107-115.YU Z N,KONG X Y,XIE Z Y,et al.Studies on the karyotypes and Ag-nor banding of pagrosomus major and Sparus macrocephalus[J].Journal of Ocean University of Qingdao,1993,23(3):107-115.(in Chinese)
[16] 林义浩.快速获得大量鱼类肾细胞中期分裂相的PHA体内注射法[J].水产学报,1982,6(3):201-208.LIN Y H.A PHA injection methodin vivo for the rapid obtainment of large numbers of metaphase figures from kideny cells of teleosts[J].Journal of Fisheries of China,1982,6(3):201-208.(in Chinese)
[17] LIU L J,WANG Q,ZHANG Z,et al.MATO:an updated tool for capturing and analyzing cytotaxonomic and morphological data[J].The Innovation Life,2023,1(1):100010.
[18] LEVAN A,FREDGA K,SANDBERG A A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[19] 高杰,郭华阳,刘明鉴,等.尖翅燕鱼染色体核型分析[J].海洋渔业,2022,44(5):535-542.GAO J,GUO H Y,LIU M J,et al.Analysis on karyotype of Platax Teira[J].Marine Fisheries,2022,44(5):535-542.(in Chinese)
[20] 董烁,谢振兴.浅谈人体外周血淋巴细胞染色体的制备[J].食品工程,2008(2):25-27.DONG S,XIE Z X.On the preparation of chromosome of peripheral blood lymphocyte of human body[J].Food Engineering,2008(2):25-27.(in Chinese)
[21] 杨秋月,赵俊鹏,蔡超,等.秋水仙素对染色体制备的影响研究[J].医学动物防制,2019,35(3):267-270.YANG Q Y,ZHAO J P,CAI C,et al.Research on the influence of colchicine on the chromosome preparation[J].Journal of Medical Pest Control,2019,35(3):267-270.(in Chinese)
[22] 于瑞海,王昭萍,赵雪琳,等.虾夷扇贝雌雄同体自体受精繁殖生物学的研究[J].中国海洋大学学报(自然科学版),2011,41(11):23-26,56.YU R H,WANG Z P,ZHAO X L,et al.Reproductive biology of self fertilization in hermaphrodite Japanese scallops(Patinopecten yessoensis)[J].Periodical of Ocean University of China(Natural Science Edition),2011,41(11):23-26,56.(in Chinese)
[23] CHANG C F,YUEH W S.Annual cycle of gonadal histology and steroid profiles in the juvenile males and adult females of the protandrous black porgy,Acanthopagrus schlegeli[J].Aquaculture,1990,91(1/2):179-196.
[24] 陈淑吟,张志勇,刘海林,等.池养黑鲷性逆转组织学观察[J].海洋科学,2017,41(7):51-58.CHEN S Y,ZHANG Z Y,LIU H L,et al.Histological observation of sex change in the cultivated black porgy,Acanthopagrus schlegeli[J].Marine Sciences,2017,41(7):51-58.(in Chinese)
[25] 柴晓燕.自交与自由交配的辨析与应用[J].理科考试研究,2020,27(14):64-65.CHAI X Y.Discrimination and application of selfing and free mating[J].Journal for Middle School Science Exam Preparation,2020,27(14):64-65.(in Chinese)
[26] 林勉,苗亮,李明云,等.真鲷、黑鲷及其杂交子代的染色体构成与AFLP分析[J].海洋学报,2014,36(8):117-121.LIN M,MIAO L,LI M Y,et al.Chromosome composition and AFLP analysis of Pagrosomus major,Spraus macrocephalus and the hybirds[J].Acta Oceanologica Sinica,2014,36(8):117-121.(in Chinese)
[27] 李安,李高俊,王世锋,等.海南南渡江唇![]() 染色体核型和银染分析[J].渔业科学进展,2020,41(2):95-102.LI A,LI G J,WANG S F,et al.The karyotype and Ag-NORs of Hemibarbus labeo from nandujiang river of Hainan[J].Progress in Fishery Sciences,2020,41(2):95-102.(in Chinese)
染色体核型和银染分析[J].渔业科学进展,2020,41(2):95-102.LI A,LI G J,WANG S F,et al.The karyotype and Ag-NORs of Hemibarbus labeo from nandujiang river of Hainan[J].Progress in Fishery Sciences,2020,41(2):95-102.(in Chinese)
[28] FERGUSON-SMITH M.Satellite chromosomes[M]//Reference Module in Life Sciences.Amsterdam:Elsevier,2023
[29] 范瑞,姜志强,李雅娟,等.太平洋鳕染色体核型及银染分析[J].水生生物学报,2014,38(1):115-120.FAN R,JIANG Z Q,LI Y J,et al.Chromosome karyotypic analysis and Ag-NORs of Pacific cod Gadus macrocephalus[J].Acta Hydrobiologica Sinica,2014,38(1):115-120.(in Chinese)
[30] 施立明.银染色方法及其在细胞遗传学中的应用[J].遗传,1980,2(4):29-32,49.SHI L M.Method of silver-staining and it’s application in cytogenetics[J].Hereditas(Beijing),1980,2(4):29-32,49.(in Chinese)
[31] 叶玉珍,吴清江,陈荣德.草鱼和鲤杂交的细胞学研究:鱼类远缘杂交核质不同步现象[J].水生生物学报,1989,13(3):234-239,299-300.YE Y Z,WU Q J,CHEN R D.Studies on cytology of crosses between grass carp and carp:asynchronization between nucleus and cytoplasm in distant hybridization of fishes[J].Acta Hydrobiologica Sinica,1989,13(3):234-239,299-300.(in Chinese)
[32] 陈紫辉.长鳍鲤(C.carpiovar.longfin)、锦鲤(C.carpiovar.koi)与正反交子代遗传差异分析[D].上海:上海海洋大学,2014.CHEN Z H.Analysis of genetic differences between C.carpiovar.longfin,C.carpiovar.koi and their reciprocal progenies[D].Shanghai:Shanghai Ocean University,2014.(in Chinese)
[33] LIU Q Z,XIAO J,LUO K K,et al.Genetic,gonadal development and shape characteristics researches of gynogenetic orange ornamental carp(Cyprinus carpio L.)[J].Journal of Fisheries of China,2013,37(3):390.
[34] 孙远东,袁志栋,谭树华,等.人工诱导湘云金鳙雌核发育的研究[J].水产学报,2015,39(1):8-15.SUN Y D,YUAN Z D,TAN S H,et al.Induction of gynogenesis in red bighead carp (Aristichthys nobilis red var.)[J].Journal of Fisheries of China,2015,39(1):8-15.(in Chinese)
[35] 刘静,尤锋,王新成,等.人工诱导雌核发育牙鲆的染色体及核型证明[J].海洋与湖沼,1999,30(1):68-72.LIU J,YOU F,WANG X C,et al.Chromosome and karyotype evidence of artificial-induced gynogenesis in the olive flounder Paralichthys olivaceus[J].Oceanologia et Limnologia Sinica,1999,30(1):68-72.(in Chinese)
[36] 牛文涛,蔡泽平,林荣澄.平鲷不同发育类型的染色体核型分析[J].应用海洋学学报,2014,33(3):337-342.NIU W T,CAI Z P,LIN R C.Studies on chromosome karyotypes of different developments of Rhabdosargus sarba[J].Journal of Applied Oceanography,2014,33(3):337-342.(in Chinese)
[37] 王晓清,王志勇,谢中国,等.大黄鱼(♀)与鮸(♂)杂交的遗传分析[J].水产学报,2008,32(1):51-57.WANG X Q,WANG Z Y,XIE Z G,et al.Genetic analysis of the intergenus hybridization of Pseudosciaena crocea(♀)×Miichthys miiuy(♂)[J].Journal of Fisheries of China,2008,32(1):51-57.(in Chinese)
[38] 杨娜,曹建萌,刘志刚,等.吉富罗非鱼(♀)与翘嘴鳜(♂)远缘杂交子代的遗传特征分析[J].淡水渔业,2021,51(5):60-69.YANG N,CAO J M,LIU Z G,et al.Analysis of genetic characteristics of distant hybridization progenies of Oreochromis niloticus,GIFT(♀) and Siniperca chuatsi(♂)[J].Freshwater Fisheries,2021,51(5):60-69.(in Chinese)
[39] 曹广勇.黑鲷、真鲷及其杂交子代的遗传特性比较研究[D].上海:上海海洋大学,2020.CAO G Y.Comparative research of genetic characterization in Acanthopagrus schlegelii,Pagrus major and their hybrid offsprings[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)