唇![]() (Hemibarbus labeo)隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)唇
(Hemibarbus labeo)隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)唇![]() 属(Hemibarbus),中国各大水系均有分布,在鸭绿江流域又被称为“重唇”“重重”,在钱塘江水系称“黄竹”“桃花竹”[1-2]。辽宁地区以鸭绿江、辽河支流[3]等地为主要栖息地。唇
属(Hemibarbus),中国各大水系均有分布,在鸭绿江流域又被称为“重唇”“重重”,在钱塘江水系称“黄竹”“桃花竹”[1-2]。辽宁地区以鸭绿江、辽河支流[3]等地为主要栖息地。唇![]() 多生活在江河水流中的中下层,具有适应力强、生长快、肉质细嫩、味道鲜美等优点,深受消费者喜爱,为中国的主要经济鱼类之一,养殖前景十分广阔[4]。唇
多生活在江河水流中的中下层,具有适应力强、生长快、肉质细嫩、味道鲜美等优点,深受消费者喜爱,为中国的主要经济鱼类之一,养殖前景十分广阔[4]。唇![]() 亲鱼繁殖期短,野生资源渐少,因此,其优质种质资源的保存显得尤为重要。目前,唇
亲鱼繁殖期短,野生资源渐少,因此,其优质种质资源的保存显得尤为重要。目前,唇![]() 的基础生物学[5-7]、人工繁殖[8-9]、人工养殖[10-11]和营养需求[12-13]等方面已开展相关研究,但关于唇
的基础生物学[5-7]、人工繁殖[8-9]、人工养殖[10-11]和营养需求[12-13]等方面已开展相关研究,但关于唇![]() 精子的低温和超低温保存研究尚不多见。
精子的低温和超低温保存研究尚不多见。
低温保存是将鱼类精子置于0 ℃~4 ℃的环境中,通过低温降低精子的代谢活动来提高精子的寿命。此种方法的保存时间较超低温保存而言时间较短,通常只有几天到十几天不等,在实际生产中对外界条件要求简单,适合大规模应用[14]。暗纹东方鲀(Fuguobscurus)精子的低温保存研究发现,精子活力随冷藏保存时间的延长呈指数下降,保存1~4 d后人工授精受精率和孵化率与新鲜精液相比下降不显著,5~7 d后明显下降;保存8 d的精液不适用于生产[15]。鞍带石斑鱼(EpinepHelus lanceolatus)精子活力在0 ℃~4 ℃低温保存6 h后仍未显著降低,精子活力随保存时间的延长呈现下降趋势,保存120 h后仍能保持2.3 min的快速运动时间和3.3%的精子激活率[16]。
精子超低温保存是指精子在超低温(液氮-196 ℃)条件下,利用超低温抑制细胞的新陈代谢,降低精子的能耗,使其长期保存,且复苏后也能保持活性[17]。超低温冷冻会对精子造成不可逆转的损伤,但通过筛选在液氮中最佳的熏蒸高度、熏蒸时间、解冻温度、解冻时间等可以一定程度上减少精子的受损伤程度,同时使用不同的抗冻剂如甲醇(MeOH)、二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)等也能降低冰晶对精子的结构损伤。英国学者Blaxter[18]早在20世纪50年代就采用干冰(-79 ℃)冷冻保存太平洋鲱(Clupea pallasii)精子,在保存6个月后受精率仍能达80%,由此奠定了鱼类精液冷冻保存技术研究的基础。程顺等[19]研究发现,采用D-15为稀释液、10%乙二醇(EG)为抗冻剂,对翘嘴鲌(Culter alburnus)精子进行超低温保存,复苏后能保持较高的精子活力,其激活率、运动时间和寿命分别可达62.67%、63.33 min和83.67 min。刘光霞等[20]研究发现,圆口铜鱼(Coreius guichenoti)精子以10%甲醇作为抗冻剂,测得精子激活率最高可达78.11%±14.74%,与鲜精无显著性差异(P>0.05),精子快速运动时间和寿命分别为(8.67±1.15) s、(33.33±5.00) s。目前,草鱼(Ctenopharyngodon idellus)、鲢(Hypophthalmichthys molitrix)、小黄鱼[21](Larimichthys polyactis)、翘嘴鲌、黑鲷[22](Acanthopagrus schlegelii)等许多鱼类精子冷冻保存技术已经相继成熟,并且建立了重要经济鱼类和濒危鱼类的精子库。
本研究中以辽宁省辽阳县兴大养殖场成熟的唇![]() 亲鱼精子为材料,以三步降温法[23]研究了不同种类和浓度的稀释液、抗冻剂及不同降温程序对唇
亲鱼精子为材料,以三步降温法[23]研究了不同种类和浓度的稀释液、抗冻剂及不同降温程序对唇![]() 精子活力的影响,以期为唇
精子活力的影响,以期为唇![]() 精子低温和超低温冻存技术的系统建立及人工繁殖生产提供基础数据。
精子低温和超低温冻存技术的系统建立及人工繁殖生产提供基础数据。
1.1.1 试验鱼来源及规格 试验鱼来源于辽阳市兴大养殖场人工养殖性腺发育成熟的唇![]() (鸭绿江水系),于2024年5月期间在此养殖场进行试验,试验均采用体表无病无伤、健康状况好且性成熟的雄鱼6尾,平均体长为(42.3±5.2) cm,平均体质量为(482.25±48.50) g;雌鱼4尾,平均体长为(49.3±5.2) cm,平均体质量为(532.25±34.33) g。雌雄比例为2∶3。
(鸭绿江水系),于2024年5月期间在此养殖场进行试验,试验均采用体表无病无伤、健康状况好且性成熟的雄鱼6尾,平均体长为(42.3±5.2) cm,平均体质量为(482.25±48.50) g;雌鱼4尾,平均体长为(49.3±5.2) cm,平均体质量为(532.25±34.33) g。雌雄比例为2∶3。
1.1.2 稀释液配置
1)D-20。采用sartorius电子天平称取NaCl 0.80 g、KCl 0.1 g、葡萄糖1.50 g溶于100 mL纯水,pH和渗透压分别为5.24、348 mmol/kg。
2)D-15。采用电子天平称取NaCl 0.80 g、KCl 0.05 g、葡萄糖1.50 g溶于100 mL纯水,pH和渗透压分别为5.18、360 mmol/kg。
3)L-1。采用电子天平称取NaCl 0.80 g、KCl 0.05 g、葡萄糖0.50 g溶于100 mL纯水,pH和渗透压分别为5.48、295 mmol/kg。
4) D-1。采用电子天平称取NaCl 0.78 g、KCl 0.05 g、葡萄糖1.50 g溶于100 mL纯水,pH和渗透压分别为6.88、345 mmol/kg。
5)医用生理盐水(0.9%NaCl)。前4种稀释液现配现用,第5种保存于4 ℃冰箱中。
1.1.3 抗冻剂及浓度的选取 抗冻剂选择MeOH、DMF、DMSO 3种,设置浓度梯度分别为5%、10%、15%。
1.2.1 精液采集 选取成熟的亲鱼,注射促排卵素2号(LHRH-A2)+地欧酮(DOM)和绒毛膜促性腺激素(HCG),二次注射,雄鱼剂量减半,所有激素均为宁波第二激素厂生产,具体注射剂量参考骆小年等[24]方法,然后置于4 m×5 m车间水泥池暂养,注射12 h后取精液,24 h后取卵粒。
在采集精液时用干毛巾擦干水分,保持鱼体腹部干燥,轻度挤压鱼体腹部,使用1 mL注射器针管收集2 mL精液并置于2.5 mL的冻存管中。将鲜精与D-15以1∶1 000比例混匀,取一滴滴于血球计数板(计数区16×25格,总体积为0.1 mm3)上,于显微镜下观察测定精子密度。不同的鱼采样重复试验3次。
1.2.2 精子活力检测 将精子与激活液混匀后,在Optec显微镜下观察精子活力。本文根据Lu等[25]的方法,以精子激活率(activation rate,AR)、快速运动时间(fast motility time,FT)及精子寿命(life time,LT)作为评价精子活力的指标。其中,精子激活率是指随机视野中运动的精子占该视野全部精子的百分比,快速运动时间是指从精子激活到70%精子转入慢速运动的时间,精子寿命是指从精子激活开始运动到90%精子停止运动的全部时间。每次观测试验重复三次并取其平均值。
1.2.3 不同稀释液及稀释比例对精子活力的影响 将精子用移液枪加入不同稀释液中,设置精子与稀释液的比例为1∶3,置于4 ℃冰箱中,在24、48、72 h后分别观察精子活力,每次观测试验重复3次。
选用前一步筛选出的最佳稀释液,设置精液与稀释液为1∶3、1∶5、1∶7,混合后置于4 ℃冰箱中,在24、48、72 h后再分别观察精子活力,每次观测试验重复3次。
1.2.4 抗冻剂种类及浓度的筛选 首先用显微镜观察鲜精精子活力,以其作为对照组。按照“1.2.3节”中低温保存的方法,采用最佳稀释液和稀释比例制成样品,将样品装入2.5 mL的冻存管中(每只约0.2 mL),并分别加入3种相同浓度抗冻剂(10%MeOH、10%DMSO、10%DMF)。在冰面上平衡3 min,然后在液氮面上方5 cm处熏蒸3 min,最后置于液氮中冻存,24 h后将冻存后的样品放入37 ℃水中解冻20 s,激活后在显微镜下观察复苏精子活力,每次观测试验重复3次。
选用前一步中的DMSO作为抗冻剂,用稀释液L-1以1∶5的比例对新鲜精液进行试验,分别加入浓度为5%、10%、15%的DMSO,将精液分别装进2.5 mL的冻存管中,按照前一步中冷冻程序进行冷冻和复苏,显微镜下观察复苏精子活力,每次观测试验重复3次。筛选出最佳的抗冻剂浓度。
1.2.5 液氮熏蒸高度及时间的优化 将新鲜精子和稀释液L-1按1∶5的比例进行稀释,然后加入10%DMSO,将精液分装进2.5 mL的冻存管中,在冰面上熏蒸3 min后,在液氮面上方3 cm(-192 ℃)、5 cm(-185 ℃)、7 cm(-175 ℃)处分别熏蒸3 min,熏蒸结束后置于液氮中冻存24 h,冻存结束后37 ℃水浴锅解冻20 s,显微镜下观察复苏精子活力,每次观测试验重复3次。
将新鲜精液按“1.2.4节”中步骤加入稀释液和抗冻剂,在冰面上熏蒸3 min后,在液氮面上方3 cm处分别熏蒸3、5、7 min,熏蒸结束后放入液氮中冻存24 h,冻存结束后37 ℃水浴锅解冻20 s,显微镜下观察复苏精子活力,每次观测试验重复3次。
1.2.6 解冻温度及时间的优化 将新鲜精液按“1.2.5节”中方法进行冻存24 h,冻存结束后在34 ℃、37 ℃、40 ℃水浴锅中分别解冻20 s,显微镜下观察复苏精子活力,每次观测试验重复3次。
将新鲜精液按“1.2.5节”中方法进行冻存24 h,冻存结束后分别以37 ℃水浴锅解冻10、20、30 s,显微镜下观察复苏精子活力,每次观测试验重复3次。
1.2.7 超低温保存解冻后精液人工授精试验 通过筛选出超低温精子最佳保存条件,将鲜精进行24 h冷冻保存,将冻存精子按照冷冻程序进行复苏,选取暂养的性成熟雌鱼,轻压腹部挤出鱼卵,取150粒卵分装到3个10 cm培养皿中,每个培养皿放置40~50粒卵。培养皿中加入解冻后的精液,加清水搅拌混合2 min后,加清水冲洗掉杂质,14 ℃~20 ℃水温下孵化。胚胎发育至原肠中期时统计受精率,出膜后统计孵化率。
受精率=(原肠期胚胎数/卵总数)×100%,
(1)
孵化率=(孵出鱼苗数/受精卵总数)×100%。
(2)
试验数据采用平均值±标准差(mean±S.D.)表示,采用Excel 2023和SPSS 20.0软件对数据进行统计和差异显著性分析,显著性差异设为0.05,极显著性差异设为0.01,采用Turkey检验法对数据进行多重比较,并采用Origin (2021b)软件对所得数据做柱状图。
2.1.1 不同稀释液对精子活力的影响 经测定,唇![]() 亲鱼新鲜精子的精浆渗透压为292 mmol/kg,精子浓度为(1.4±2.2)×1010 cells/mL。不同稀释液在不同保存时长中对精子活力的影响如图1所示。随着保存时间的延长,精子的激活率、快速运动时间、寿命均随保存时间的延长而降低。从图1(a)可见,稀释液L-1的精子激活率在组间具有显著性差异(P<0.05),明显优于其他稀释液,在24、48 h时,达到76.667%±2.887%和71.667%±2.887%,72 h后观察无显著性差异。而D-20在48 h观察时已经失去活性,生理盐水(0.9%NaCl)在72 h观察时失去活性,所有种类稀释液的精子在96 h观察时完全失活。从图1(b)可见,在24 h观察时,稀释液L-1与D-1无显著性差异(P>0.05),在48 h时出现显著性差异,L-1稀释液优于其他稀释液,达到(21.667±1.528) s,其中D-20在24 h时观察不到精子的快速运动,D-15在48 h时观察不到精子的快速运动,所有稀释液在72 h后观察不到精子快速运动。从图1(c)可见,稀释液L-1的精子寿命在各个观察点均显著优于其他稀释液(P<0.05),在24、48、72 h分别达到(51.000±1.000)、(41.000±1.000)、(25.000±1.000) s,D-20在48 h观察时已经完全失活,生理盐水(0.9%NaCl)在72 h观察时完全失活,所有稀释液精子在96 h观察时完全失活。
亲鱼新鲜精子的精浆渗透压为292 mmol/kg,精子浓度为(1.4±2.2)×1010 cells/mL。不同稀释液在不同保存时长中对精子活力的影响如图1所示。随着保存时间的延长,精子的激活率、快速运动时间、寿命均随保存时间的延长而降低。从图1(a)可见,稀释液L-1的精子激活率在组间具有显著性差异(P<0.05),明显优于其他稀释液,在24、48 h时,达到76.667%±2.887%和71.667%±2.887%,72 h后观察无显著性差异。而D-20在48 h观察时已经失去活性,生理盐水(0.9%NaCl)在72 h观察时失去活性,所有种类稀释液的精子在96 h观察时完全失活。从图1(b)可见,在24 h观察时,稀释液L-1与D-1无显著性差异(P>0.05),在48 h时出现显著性差异,L-1稀释液优于其他稀释液,达到(21.667±1.528) s,其中D-20在24 h时观察不到精子的快速运动,D-15在48 h时观察不到精子的快速运动,所有稀释液在72 h后观察不到精子快速运动。从图1(c)可见,稀释液L-1的精子寿命在各个观察点均显著优于其他稀释液(P<0.05),在24、48、72 h分别达到(51.000±1.000)、(41.000±1.000)、(25.000±1.000) s,D-20在48 h观察时已经完全失活,生理盐水(0.9%NaCl)在72 h观察时完全失活,所有稀释液精子在96 h观察时完全失活。
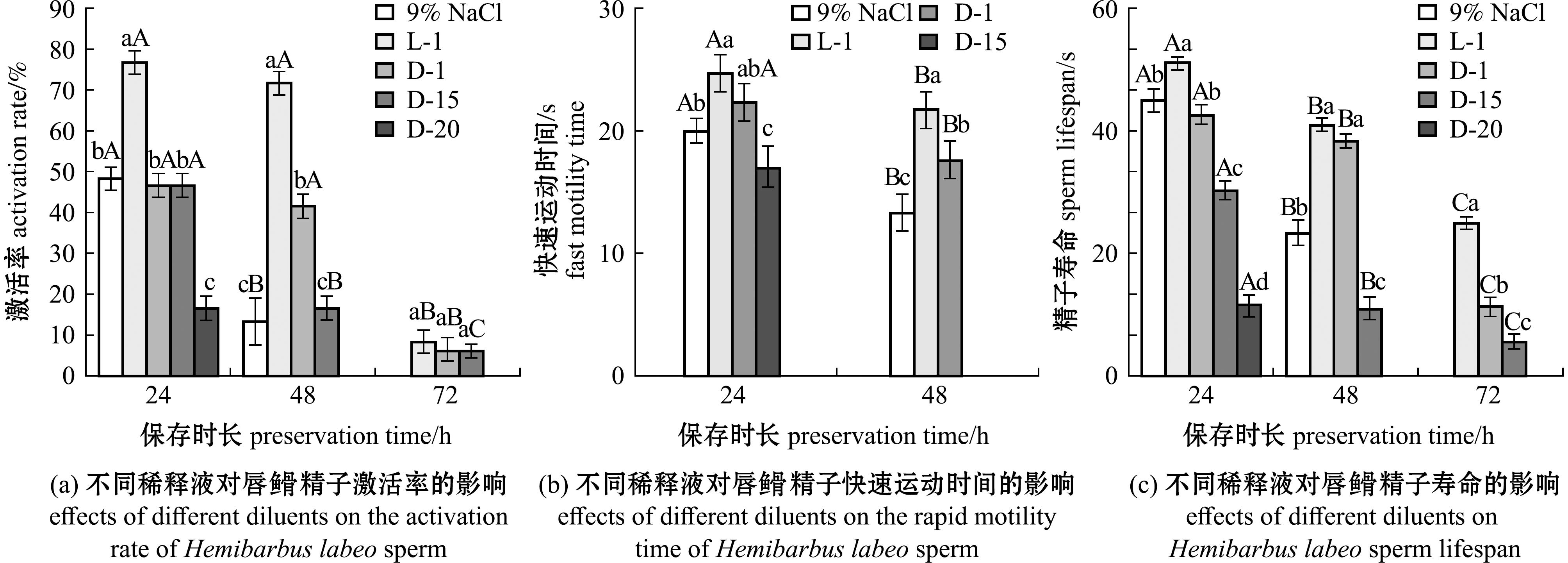
标有不同大写字母者表示组间有显著性差异(P<0.05);标有不同小写字母者表示组内有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)(n=3),下同。
The means with different capital letters at the same time are significantly different at different salinities and temperatures at the 0.05 probability level;the means with different letters in different time at the same temperture and salinity being significantly different at the 0.05 probability level,and the means with the same letter are not significant differences,(n=3),et sequentia.
图1 不同稀释液对唇![]() 精子保存的激活率、快速运动时间和精子寿命的影响
精子保存的激活率、快速运动时间和精子寿命的影响
Fig.1 Effects of different diluents on activation rate of Hemibarbus labeo sperm preservation,rapid motility time and sperm lifespan
2.1.2 不同稀释比例对精子活力的影响 不同稀释液比例在不同保存时间对精子活力的影响如图2所示,随着保存时间延长,精子的激活率、快速运动时间、寿命均随保存时间的延长而降低。从图2(a)可以看出,当精液与稀释液比例为1∶5时,其激活率显著高于其他稀释液比例(P<0.05),在24、48、72 h观察时激活率可达91.667%±2.887%、76.667%±2.887%、13.333%±2.887%,比例为1∶7时,在72 h观察时精子已经失去活力。所有稀释比例均在96 h观察时失去活力。从图2(b)可见,精液与稀释液比例为1∶5与1∶3时的快速运动时间在24 h观察时无显著性差异(P>0.05),在48 h观察时,比例为1∶5时的快速运动时间显著高于其他稀释液比例(P<0.05),达到(24.000±2.000) s,所有稀释比例均在72 h观察时不再快速运动。此外,在24 h观察时并未观察到稀释比例为1∶7的处理组精子在快速运动,所有稀释比例均在72 h观察时失去活力。从图2(c)可见,精液与稀释液比例为1∶5时,精子寿命在各个观察点均显著高于其他组(P<0.05),达到(84.333±4.726)、(39.333±1.528)、(29.667±2.082) s,精液与稀释液比例为1∶7时精子寿命最低,在72 h观察时完全失活,所有精子均在96 h观察时完全失活。
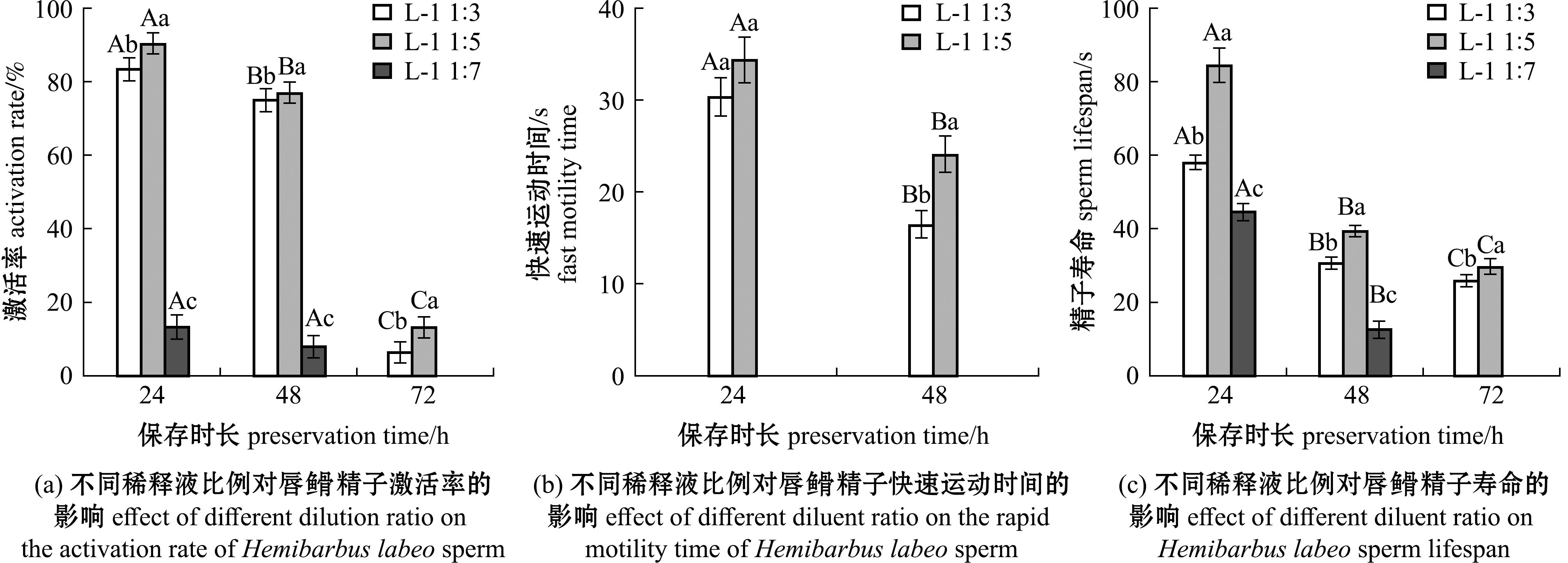
图2 不同稀释液比例对唇![]() 精子的激活率、快速运动时间和精子寿命的影响
精子的激活率、快速运动时间和精子寿命的影响
Fig.2 Effects of different diluent ratios on the activation rate of Hemibarbus labeo sperm,rapid motility time and sperm lifespan
2.2.1 不同抗冻剂对精子活力的影响 不同种类抗冻剂超低温保存后对精子活力的影响如图3所示,在经过24 h超低温保存后,以DMSO作为抗冻剂的处理组在精子激活率、快速运动时间、精子寿命等方面均显著高于其他处理组(P<0.05),分别可达71.667%±2.887%,(33.000±1.733) s和(46.667±2.517) s,其中,10%MeOH和10%DMF处理组在复苏后已经无法观测到精子的快速运动,仅缓慢运动。
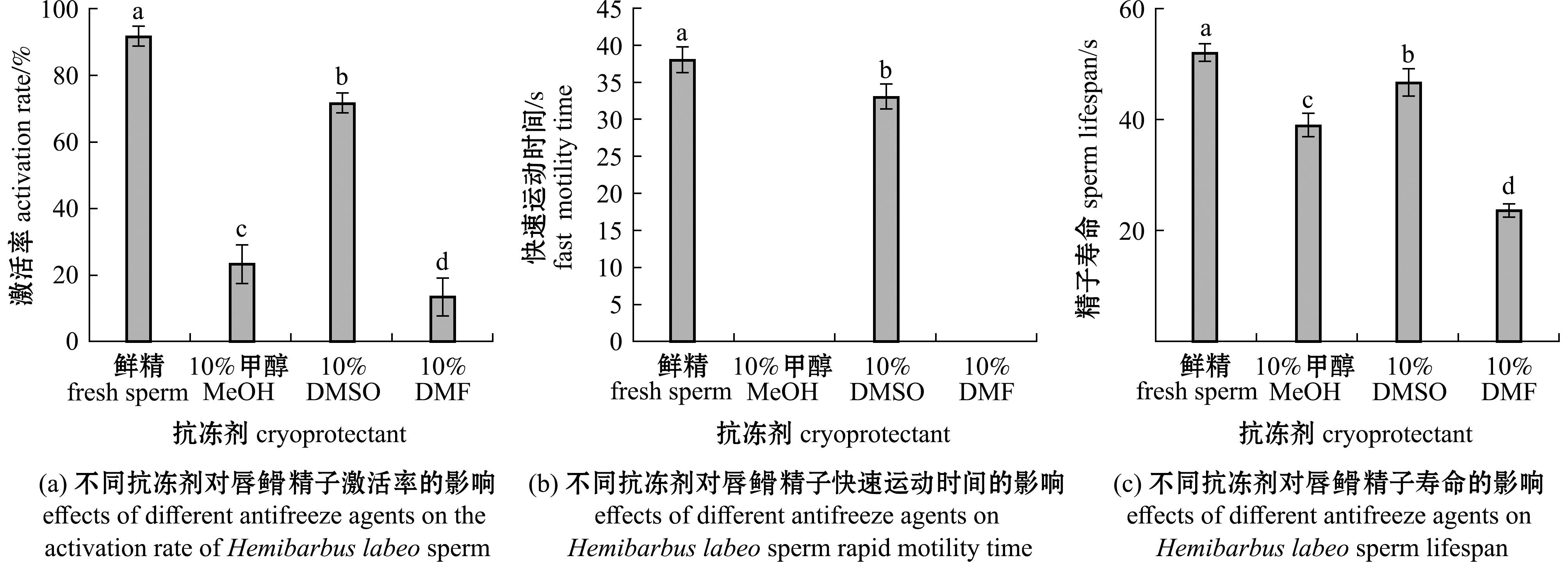
图3 不同抗冻剂对唇![]() 精子的激活率、快速运动时间和精子寿命的影响
精子的激活率、快速运动时间和精子寿命的影响
Fig.3 Effects of different antifreeze agents on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
2.2.2 不同抗冻剂浓度对精子活力的影响 不同浓度抗冻剂超低温保存后对精子活力的影响如图4所示,精子的激活率和寿命随抗冻剂浓度的升高呈现先升高后下降的趋势,其中5%浓度和15%浓度DMSO的精子在复苏后观察不到快速运动,精子仅在缓慢运动,10%浓度DMSO抗冻剂处理组在精子激活率、快速运动时间和精子寿命方面均显著高于其他处理组(P<0.05),分别可以达到73.333%±2.887%,(31.000±1.000) s,(50.333±0.577) s。
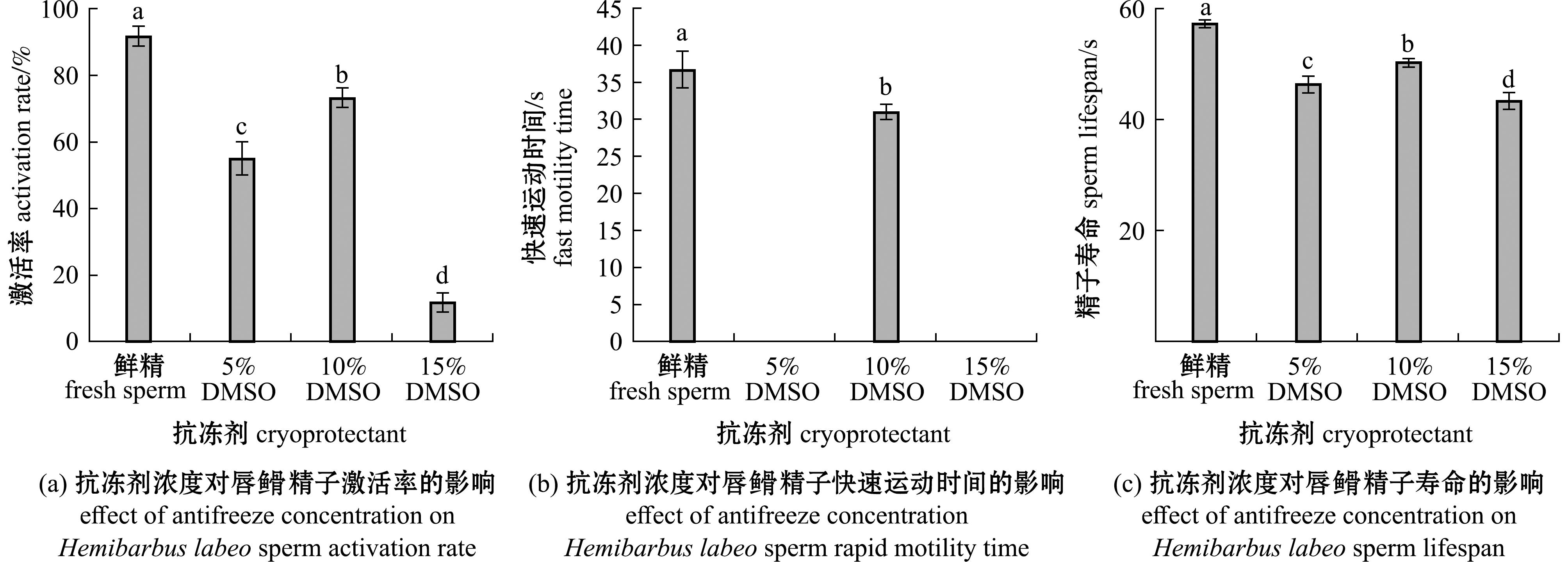
图4 不同浓度抗冻剂对唇![]() 精子激活率、快速运动时间和精子寿命的影响
精子激活率、快速运动时间和精子寿命的影响
Fig.4 Effects of different concentrations of antifreeze on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
2.3.1 熏蒸时间对精子活力的影响 不同熏蒸时间对超低温保存后精子活力的影响如图5所示,熏蒸时间分别为3、7 min的精子在复苏后观察不到快速运动,仅在缓慢运动。当熏蒸时间为5 min时,在激活率、快速运动时间、精子寿命方面均显著高于其他熏蒸时间(P<0.05),分别可达73.333%±2.887%,(29.667±0.557) s,(47.667±1.528) s。
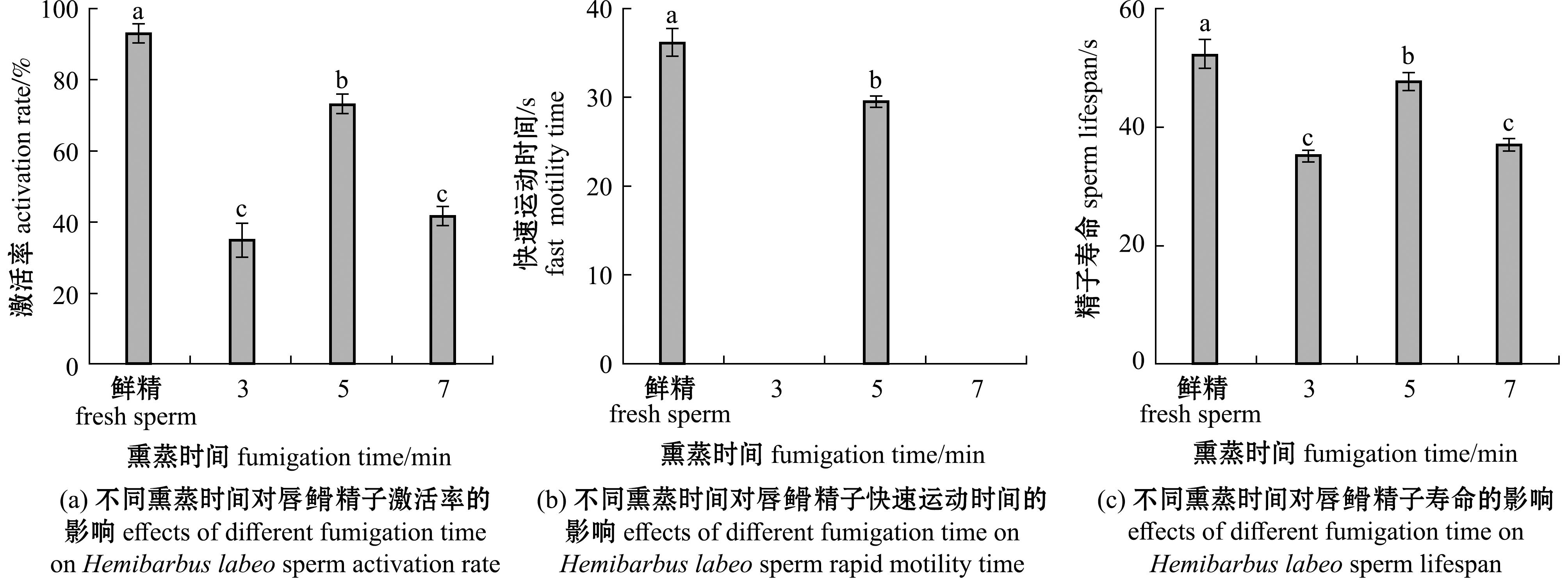
图5 不同熏蒸时间对唇![]() 精子激活率、快速运动时间和精子寿命的影响
精子激活率、快速运动时间和精子寿命的影响
Fig.5 Effects of different fumigation time on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
2.3.2 熏蒸高度对精子活力的影响 不同熏蒸高度对超低温保存后精子活力的影响如图6所示,在熏蒸高度在3 cm时,唇![]() 精子的激活率、快速运动时间和精子寿命方面均显著高于其他两组(P<0.05),其中经过冷冻保存复苏后精子快速运动时间与鲜精近似,无显著性差异(P>0.05),达83.333%±2.887%,(36.667±1.155) s,在精子寿命上,更是高于鲜精的寿命,达(119.667±3.056) s。
精子的激活率、快速运动时间和精子寿命方面均显著高于其他两组(P<0.05),其中经过冷冻保存复苏后精子快速运动时间与鲜精近似,无显著性差异(P>0.05),达83.333%±2.887%,(36.667±1.155) s,在精子寿命上,更是高于鲜精的寿命,达(119.667±3.056) s。
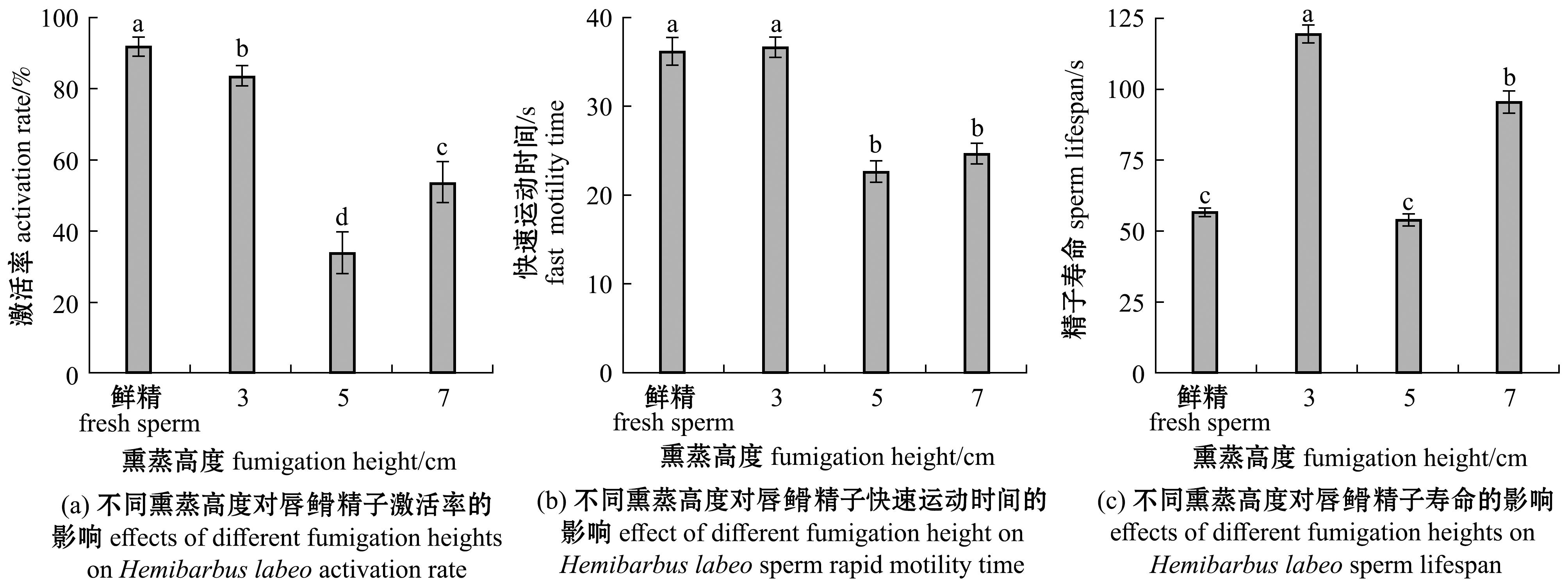
图6 不同熏蒸高度对唇![]() 精子激活率、快速运动时间和精子寿命的影响
精子激活率、快速运动时间和精子寿命的影响
Fig.6 Effects of different fumigation heights on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
2.4.1 解冻温度对精子活力的影响 不同解冻温度对超低温保存后精子活力的影响如7所示。当解冻温度为37 ℃时,其精子激活率、快速运动时间均显著高于其他处理组(P<0.05),与鲜精近似(P>0.05),分别为81.667%±5.774%,(36.333±1.528) s。当解冻温度分别为34 ℃、40 ℃时,无法观察到复苏后精子的快速运动。从图7(c)可见,当解冻温度为37 ℃时,精子寿命均显著高于其他处理组(P<0.05),为(108.667±2.517) s,且所有复苏后的精子寿命均高于鲜精。
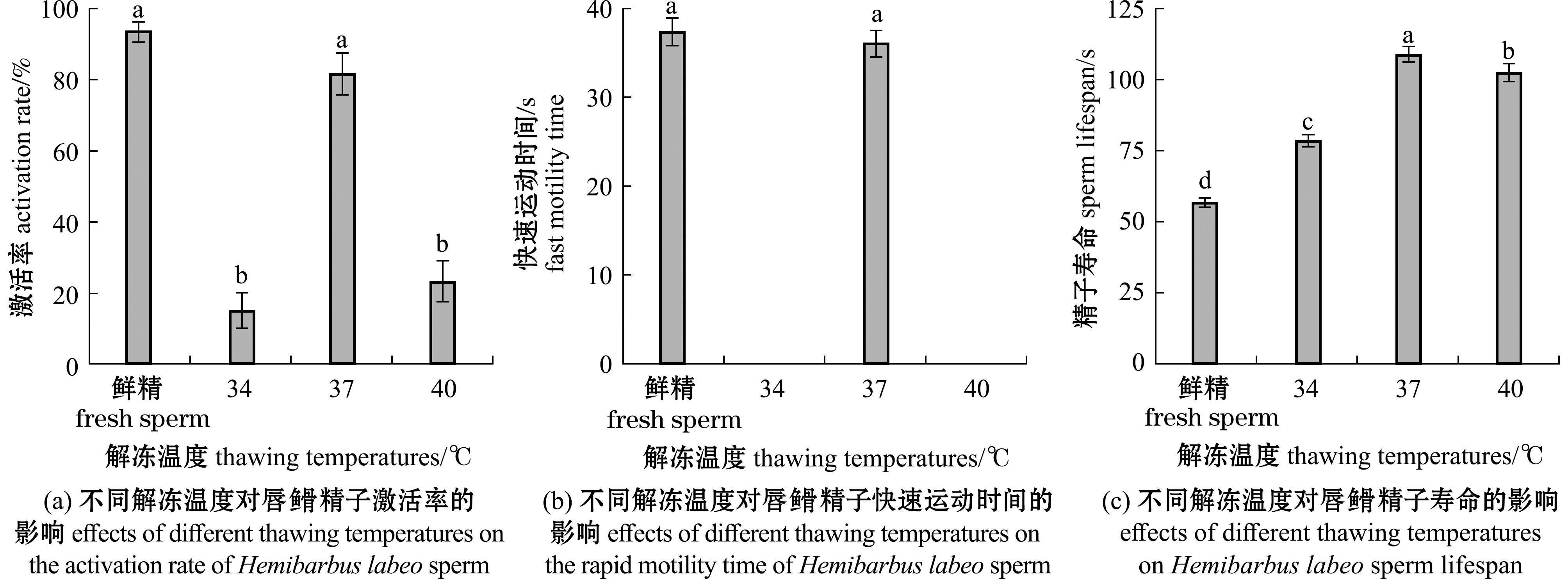
图7 不同解冻温度对唇![]() 精子激活率、快速运动时间和精子寿命的影响
精子激活率、快速运动时间和精子寿命的影响
Fig.7 Effects of different thawing temperatures on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
2.4.2 解冻时间对精子活力的影响 不同解冻时间对超低温保存后精子活力的影响如8所示。当解冻时间为20 s时,其精子激活率、快速运动时间显著高于其他处理组(P<0.05),且与鲜精近似(P>0.05),分别达80.000%±8.667%、(37.000±1.733) s。研究结果表明,当解冻时间分别为10、30 s时,已无法观察到复苏后精子的快速运动,仅存在缓慢运动。从图8(c)可见,当解冻时间为20 s时,精子寿命显著高于其他处理组(P<0.05),达到(102.333±3.215) s,且所有复苏后精子寿命均高于鲜精。
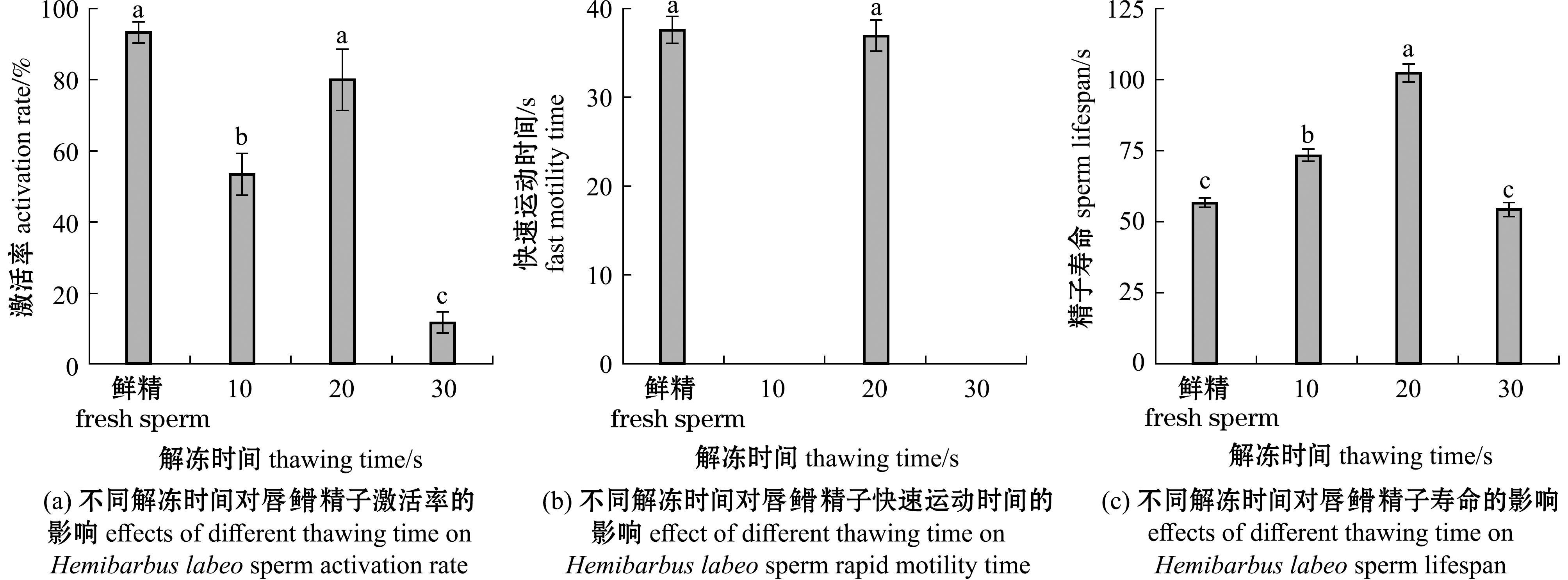
图8 不同解冻时间对唇![]() 精子激活率、快速运动时间和精子寿命的影响
精子激活率、快速运动时间和精子寿命的影响
Fig.8 Effects of different thawing time on Hemibarbus labeo sperm activation rate,rapid motility time and sperm lifespan
唇![]() 精子采用稀释液L-1,稀释比例为1∶5,以10%DMSO作为抗冻剂,在液氮上方3 cm处熏蒸5 min后保存24 h,通过37 ℃水浴解冻20 s,取150粒卵经过人工授精后,受精率和孵化率分别为70.667%±1.154%和72.000%±4.583%,获仔鱼76尾,仔鱼形态如图9所示。
精子采用稀释液L-1,稀释比例为1∶5,以10%DMSO作为抗冻剂,在液氮上方3 cm处熏蒸5 min后保存24 h,通过37 ℃水浴解冻20 s,取150粒卵经过人工授精后,受精率和孵化率分别为70.667%±1.154%和72.000%±4.583%,获仔鱼76尾,仔鱼形态如图9所示。

图9 唇![]() 冷冻精子复温孵化后仔鱼形态
冷冻精子复温孵化后仔鱼形态
Fig.9 Morpholoty of hatched larve by frozen sperm of Hemibarbus labeo
3.1.1 稀释液对唇![]() 精子活力的影响 针对不同种类的鱼类精子,稀释液具体成分选择也有所不同,但都有一定的基本要求。首先稀释液本身不能具有较大的毒性,其次需要能提供与精子相似的环境,为精子提供保护,延长保存时间,最后要减轻抗冻剂对精子的毒性。Horton等[26]认为,稀释液在尽可能满足精子所需元素基础上应该尽可能简单化,目前并未在鱼类中发现统一的精子稀释液。现在,常用的精子稀释液有Hank’s、Ringer’s、D-15,BSMIS等,D-15一般应用于草鱼、鲤和团头鲂等淡水鲤科鱼类的精子冷冻保存中,李鑫等[27]研究发现,将BSMIS稀释液用于稀有鮈鲫精液冷冻保存复苏后,精子活力最高可达46%左右,显著优于其他稀释液。
精子活力的影响 针对不同种类的鱼类精子,稀释液具体成分选择也有所不同,但都有一定的基本要求。首先稀释液本身不能具有较大的毒性,其次需要能提供与精子相似的环境,为精子提供保护,延长保存时间,最后要减轻抗冻剂对精子的毒性。Horton等[26]认为,稀释液在尽可能满足精子所需元素基础上应该尽可能简单化,目前并未在鱼类中发现统一的精子稀释液。现在,常用的精子稀释液有Hank’s、Ringer’s、D-15,BSMIS等,D-15一般应用于草鱼、鲤和团头鲂等淡水鲤科鱼类的精子冷冻保存中,李鑫等[27]研究发现,将BSMIS稀释液用于稀有鮈鲫精液冷冻保存复苏后,精子活力最高可达46%左右,显著优于其他稀释液。
稀释液对精子的保护效果受渗透压、pH和离子成分等各个方面的影响,其中pH和渗透压等应该与鱼类原本的体液环境相近,本文采用的稀释液L-1渗透压为295 mmol/kg,与唇![]() 的精子渗透压292 mmol/kg相近。同时稀释液离子成分也至关重要,钠离子(Na+)、钾离子(K+)可以维持渗透压;钙离子(Ca2+)能抑制精子活动,降低精子活力,葡萄糖可以延长精子寿命[28]。不同鱼类低温保存的稀释液不同,将几种鱼类低温保存稀释液成分及低温保存时长汇总发现(表1),不同鱼类稀释液成分差异极大,大部分鱼类精子的低温保存时长均较短,未能做到长期保存。本研究中采用L-1为稀释液,与其他鱼类稀释液相比成分简单,更容易制备,稀释液比例达到1∶5,低温保存48 h后精子激活率达76.667%±2.887%。
的精子渗透压292 mmol/kg相近。同时稀释液离子成分也至关重要,钠离子(Na+)、钾离子(K+)可以维持渗透压;钙离子(Ca2+)能抑制精子活动,降低精子活力,葡萄糖可以延长精子寿命[28]。不同鱼类低温保存的稀释液不同,将几种鱼类低温保存稀释液成分及低温保存时长汇总发现(表1),不同鱼类稀释液成分差异极大,大部分鱼类精子的低温保存时长均较短,未能做到长期保存。本研究中采用L-1为稀释液,与其他鱼类稀释液相比成分简单,更容易制备,稀释液比例达到1∶5,低温保存48 h后精子激活率达76.667%±2.887%。
表1 几种鱼类精子低温保存结果比较
Tab.1 Different low temperature preservation methods for different fish sperms and results
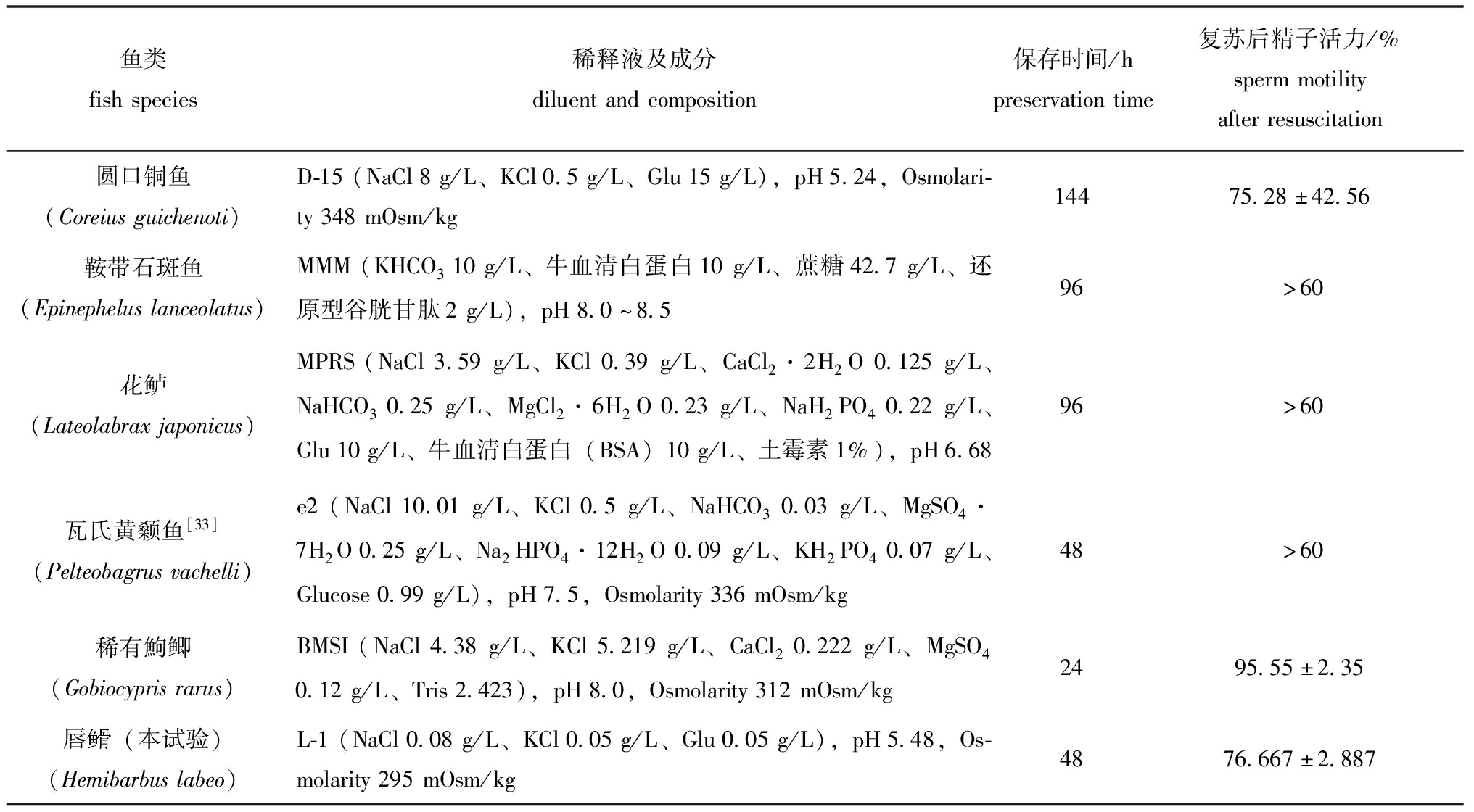
鱼类fishspecies稀释液及成分diluentandcomposition保存时间/hpreservationtime复苏后精子活力/%spermmotilityafterresuscitation圆口铜鱼(Coreiusguichenoti)D-15(NaCl8g/L、KCl0.5g/L、Glu15g/L),pH5.24,Osmolari-ty348mOsm/kg14475.28±42.56鞍带石斑鱼(Epinepheluslanceolatus)MMM(KHCO310g/L、牛血清白蛋白10g/L、蔗糖42.7g/L、还原型谷胱甘肽2g/L),pH8.0~8.596>60花鲈(Lateolabraxjaponicus)MPRS(NaCl3.59g/L、KCl0.39g/L、CaCl2·2H2O0.125g/L、NaHCO30.25g/L、MgCl2·6H2O0.23g/L、NaH2PO40.22g/L、Glu10g/L、牛血清白蛋白(BSA)10g/L、土霉素1%),pH6.6896>60瓦氏黄颡鱼[33](Pelteobagrusvachelli)e2(NaCl10.01g/L、KCl0.5g/L、NaHCO30.03g/L、MgSO4·7H2O0.25g/L、Na2HPO4·12H2O0.09g/L、KH2PO40.07g/L、Glucose0.99g/L),pH7.5,Osmolarity336mOsm/kg48>60稀有鮈鲫(Gobiocyprisrarus)BMSI(NaCl4.38g/L、KCl5.219g/L、CaCl20.222g/L、MgSO40.12g/L、Tris2.423),pH8.0,Osmolarity312mOsm/kg2495.55±2.35唇(本试验)(Hemibarbuslabeo)L-1(NaCl0.08g/L、KCl0.05g/L、Glu0.05g/L),pH5.48,Os-molarity295mOsm/kg4876.667±2.887
3.1.2 稀释比例对唇![]() 精子活力的影响 稀释液比例通常采用1∶1~1∶20的体积比,过高或者过低均会导致精子活力的降低,甚至死亡,因此选择一个适宜的稀释比例能更好地保持精子活力,提高精子寿命。张崇英等[29]研究发现,胭脂鱼(Myxocyprinus asiaficus)精子保存中,以D-17为稀释液时,最佳稀释比例为1∶3;以D-20为稀释液时,最佳稀释比例为1∶3与1∶6,且两者均有较好的保存效果,并无显著性差异。王晓爱等[30]在对软鳍新光唇鱼(Neolissochilus benasi)进行精子超低温冷冻保存研究中发现,在精液与稀释液比例为1∶4、1∶5与1∶7时,3组间保存效果无显著性差异,但明显优于其他比例,其中比例为1∶7时解冻后的精子活力最高,高达19.67%±1.25%。贾濮元等[31]研究发现,黄鳍棘鲷(Acanthopagrus latus)精子解冻后的活力、运动时间和寿命均随稀释比例的增加,呈现先升高后降低的趋势,在稀释比例为1∶2时精子活力达到峰值,达89.67%±4.63%,同时随着稀释比例继续升高,精子活力呈现显著降低趋势;这与乔瑞峰等[32]对大鳞副泥鳅(Paramisgurnus dabryanus)精子超低温保存研究中总结的规律一致,也与本研究结果一致,但与其他鲷科鱼类的稀释比例有所区别,这可能是不同操作程序导致的。本研究中显示,以L-1作为稀释液,稀释比例为1∶5时,能够保持最高的精子活力,在48 h时激活率达76.667%±2.887%。
精子活力的影响 稀释液比例通常采用1∶1~1∶20的体积比,过高或者过低均会导致精子活力的降低,甚至死亡,因此选择一个适宜的稀释比例能更好地保持精子活力,提高精子寿命。张崇英等[29]研究发现,胭脂鱼(Myxocyprinus asiaficus)精子保存中,以D-17为稀释液时,最佳稀释比例为1∶3;以D-20为稀释液时,最佳稀释比例为1∶3与1∶6,且两者均有较好的保存效果,并无显著性差异。王晓爱等[30]在对软鳍新光唇鱼(Neolissochilus benasi)进行精子超低温冷冻保存研究中发现,在精液与稀释液比例为1∶4、1∶5与1∶7时,3组间保存效果无显著性差异,但明显优于其他比例,其中比例为1∶7时解冻后的精子活力最高,高达19.67%±1.25%。贾濮元等[31]研究发现,黄鳍棘鲷(Acanthopagrus latus)精子解冻后的活力、运动时间和寿命均随稀释比例的增加,呈现先升高后降低的趋势,在稀释比例为1∶2时精子活力达到峰值,达89.67%±4.63%,同时随着稀释比例继续升高,精子活力呈现显著降低趋势;这与乔瑞峰等[32]对大鳞副泥鳅(Paramisgurnus dabryanus)精子超低温保存研究中总结的规律一致,也与本研究结果一致,但与其他鲷科鱼类的稀释比例有所区别,这可能是不同操作程序导致的。本研究中显示,以L-1作为稀释液,稀释比例为1∶5时,能够保持最高的精子活力,在48 h时激活率达76.667%±2.887%。
3.2.1 抗冻剂对唇![]() 精子活力的影响 精子超低温保存的过程中,超低温度形成的冰晶会破坏精子细胞结构,造成细胞损伤,通过加入抗冻剂降低冰点,减少冰晶的产生,可减轻对精子的结构损伤。同时抗冻剂具有毒性,抗冻剂浓度与精子的毒性呈现正相关,其浓度越高,对精子的危害越大。目前常用的抗冻剂种类有MeOH、DMF、DMSO、甘油(Glycerine,Gly)[34]等。在其他的鱼类精子冷冻中,也曾使用乙二醇(ethylene glycol,EG)作为抗冻剂[19]。
精子活力的影响 精子超低温保存的过程中,超低温度形成的冰晶会破坏精子细胞结构,造成细胞损伤,通过加入抗冻剂降低冰点,减少冰晶的产生,可减轻对精子的结构损伤。同时抗冻剂具有毒性,抗冻剂浓度与精子的毒性呈现正相关,其浓度越高,对精子的危害越大。目前常用的抗冻剂种类有MeOH、DMF、DMSO、甘油(Glycerine,Gly)[34]等。在其他的鱼类精子冷冻中,也曾使用乙二醇(ethylene glycol,EG)作为抗冻剂[19]。
1949年,英国Polge等[34]首次采用Gly冷冻保存牛精子获得成功,随后得到广泛应用,如今Gly一般用于花鲈(Lateolabrax maculatus)、大黄鱼(Larimichthys crocea)等鱼类的精子保存。而DMSO则在鲤、大鳞副泥鳅、光唇鱼(Acrossocheilus fasciatus)、虹鳟(Oncorhynchus mykiss)[35]等鱼类中取得较好的保存效果。乔瑞峰等[32]研究发现,DMSO在大鳞副泥鳅精子的保存中取得最为理想的效果,显著优于其他抗冻剂种类,解冻后精子活力能达到40.7%±2.5%。邢露梅等[36]研究发现,兰州鲇(Silurus lanzhouensis)精液以10%DMSO为抗冻剂,其保护效果显著高于DMF和MeOH,经过超低温保存并解冻后,冻精复苏的激活率达75.56%±3.91%。将几种鱼类超低温保存抗冻剂及浓度汇总(表2)发现,不同鱼类超低温保存使用的抗冻剂与浓度各不相同,并无统一的抗冻剂类型,且同科鱼类的最佳抗冻剂也并不相同。本文选用简单易得的DMSO作为抗冻剂,与邢露梅等[36]研究结果相似,具有较好的保存效果。当浓度为10%时,保护效果最好,激活率达73.333%±2.887%。
表2 几种鱼类精子超低温保存结果比较
Tab.2 Different ultra-low temperature preservation methods for different fish sperm and their results
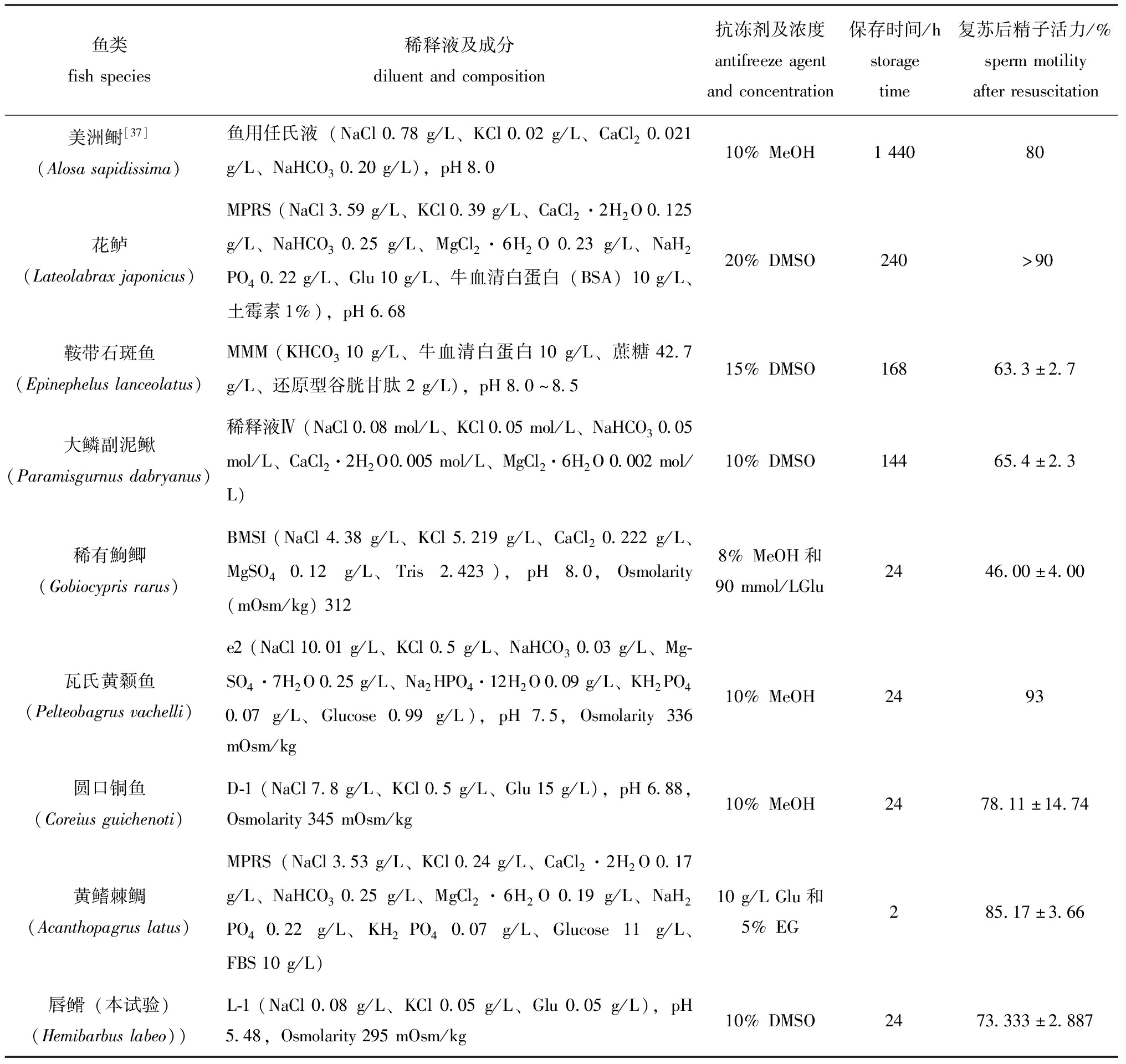
鱼类fishspecies稀释液及成分diluentandcomposition抗冻剂及浓度antifreezeagentandconcentration保存时间/hstoragetime复苏后精子活力/%spermmotilityafterresuscitation美洲鲥[37](Alosasapidissima)鱼用任氏液(NaCl0.78g/L、KCl0.02g/L、CaCl20.021g/L、NaHCO30.20g/L),pH8.010%MeOH144080花鲈(Lateolabraxjaponicus)MPRS(NaCl3.59g/L、KCl0.39g/L、CaCl2·2H2O0.125g/L、NaHCO30.25g/L、MgCl2·6H2O0.23g/L、NaH2PO40.22g/L、Glu10g/L、牛血清白蛋白(BSA)10g/L、土霉素1%),pH6.6820%DMSO240>90鞍带石斑鱼(Epinepheluslanceolatus)MMM(KHCO310g/L、牛血清白蛋白10g/L、蔗糖42.7g/L、还原型谷胱甘肽2g/L),pH8.0~8.515%DMSO16863.3±2.7大鳞副泥鳅(Paramisgurnusdabryanus)稀释液Ⅳ(NaCl0.08mol/L、KCl0.05mol/L、NaHCO30.05mol/L、CaCl2·2H2O0.005mol/L、MgCl2·6H2O0.002mol/L)10%DMSO14465.4±2.3稀有鮈鲫(Gobiocyprisrarus)BMSI(NaCl4.38g/L、KCl5.219g/L、CaCl20.222g/L、MgSO40.12g/L、Tris2.423),pH8.0,Osmolarity(mOsm/kg)3128%MeOH和90mmol/LGlu2446.00±4.00瓦氏黄颡鱼(Pelteobagrusvachelli)e2(NaCl10.01g/L、KCl0.5g/L、NaHCO30.03g/L、Mg-SO4·7H2O0.25g/L、Na2HPO4·12H2O0.09g/L、KH2PO40.07g/L、Glucose0.99g/L),pH7.5,Osmolarity336mOsm/kg10%MeOH2493圆口铜鱼(Coreiusguichenoti)D-1(NaCl7.8g/L、KCl0.5g/L、Glu15g/L),pH6.88,Osmolarity345mOsm/kg10%MeOH2478.11±14.74黄鳍棘鲷(Acanthopagruslatus)MPRS(NaCl3.53g/L、KCl0.24g/L、CaCl2·2H2O0.17g/L、NaHCO30.25g/L、MgCl2·6H2O0.19g/L、NaH2PO40.22g/L、KH2PO40.07g/L、Glucose11g/L、FBS10g/L)10g/LGlu和5%EG285.17±3.66唇(本试验)(Hemibarbuslabeo))L-1(NaCl0.08g/L、KCl0.05g/L、Glu0.05g/L),pH5.48,Osmolarity295mOsm/kg10%DMSO2473.333±2.887
3.2.2 冷冻程序对唇![]() 精子活力的影响 鱼类精子适宜的降温程序与鱼类精子生理特性、抗冻剂种类及浓度、冻存体积大小等因素有关,适宜的降温程序能有效减少冰晶对精子结构的损伤。郑学斌等[38]研究发现,小黄鱼(Larimichthys polyactis)精子超低温保存,选择HBSS溶液为稀释液,10%DMSO及15%丙二醇(PG)为抗冻剂,降温程序为液氮面3.5 cm处降温5 min后投入液氮保存效果最佳,冻精解冻后运动速率能与鲜精近似。本研究中结果表明,唇
精子活力的影响 鱼类精子适宜的降温程序与鱼类精子生理特性、抗冻剂种类及浓度、冻存体积大小等因素有关,适宜的降温程序能有效减少冰晶对精子结构的损伤。郑学斌等[38]研究发现,小黄鱼(Larimichthys polyactis)精子超低温保存,选择HBSS溶液为稀释液,10%DMSO及15%丙二醇(PG)为抗冻剂,降温程序为液氮面3.5 cm处降温5 min后投入液氮保存效果最佳,冻精解冻后运动速率能与鲜精近似。本研究中结果表明,唇![]() 精子最佳冷冻程序为:液氮上方3 cm处熏蒸5 min,24 h冻存结束后,在37 ℃水浴解冻20 s。精子的激活率、运动时间和寿命可达80.000%±8.667%、(37.000±1.733) s、(102.333±3.215) s。同时发现,在调整降温程序后,出现冻精精子快速运动时间低于新鲜精子,精子寿命高于鲜精的现象,猜测可能是稀释液中某些物质能作为精子的能量来源,同时超低温抑制了精子的活动,降低了能量消耗,在一定时间上延长了精子寿命,但具体原因还需要进一步研究。
精子最佳冷冻程序为:液氮上方3 cm处熏蒸5 min,24 h冻存结束后,在37 ℃水浴解冻20 s。精子的激活率、运动时间和寿命可达80.000%±8.667%、(37.000±1.733) s、(102.333±3.215) s。同时发现,在调整降温程序后,出现冻精精子快速运动时间低于新鲜精子,精子寿命高于鲜精的现象,猜测可能是稀释液中某些物质能作为精子的能量来源,同时超低温抑制了精子的活动,降低了能量消耗,在一定时间上延长了精子寿命,但具体原因还需要进一步研究。
1)本研究中对4种稀释液对唇![]() 精子的低温和超低温的保存效果进行了优化筛选,研究表明,在0 ℃~4 ℃低温保存时,稀释液L-1在稀释比例为1∶5时对唇
精子的低温和超低温的保存效果进行了优化筛选,研究表明,在0 ℃~4 ℃低温保存时,稀释液L-1在稀释比例为1∶5时对唇![]() 精子的保存效果最佳。
精子的保存效果最佳。
2)超低温保存时,在低温保存筛选出的最佳稀释液与稀释比例基础上,以10%浓度DMSO作为抗冻剂,液氮面上方3 cm处熏蒸5 min,冻存24 h后的精子在37 ℃水浴解冻20 s,解冻后仍能保持较高的精子活力。复苏精子进行人工授精试验也能获得较高的受精率和孵化率。
3)本研究中对唇![]() 冷冻精子库的建立及种质资源的保存提供了技术支持,为实际生产提供了数据参考。同时受试验条件等限制,针对唇
冷冻精子库的建立及种质资源的保存提供了技术支持,为实际生产提供了数据参考。同时受试验条件等限制,针对唇![]() 精子保存是否存在更好的稀释液、抗冻剂及冷冻程序还待进一步完善。
精子保存是否存在更好的稀释液、抗冻剂及冷冻程序还待进一步完善。
[1] 伍献文.中国鲤科鱼类志-下卷[M].上海:上海人民出版社,1977:443-446.WU X W.Fishes of Cyprinidae in china-volume Ⅱ[M].Shanghai:Shanghai People’s Publishing House,1977:443-446.(in Chinese)
[2] 解玉浩.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:148-150.XIE Y H.Freswater fishes in northeast region of China[M].Shenyang:Liaoning Science and Technology Press,2007:148-150.(in Chinese)
[3] 刘建康,何碧梧.中国淡水鱼类养殖学[M].3版.北京:科学出版社,1992:39.LIU J K,HE B W.Cultivation of the Chinese freshwater fishes[M].3rd ed.Beijing:Science Press,1992:39.(in Chinese)
[4] 骆小年,赵兴文,段友健.辽宁省淡水土著鱼类开发利用研究进展[J].大连海洋大学学报,2020,35(2):155-160.LUO X N,ZHAO X W,DUAN Y J.Exploitation and utilization of freshwater indigenous fishes in Liaoning Province:a review[J].Journal of Dalian Ocean University,2020,35(2):155-160.(in Chinese)
[5] 何登伟,马春瑜,段景伟,等.寒地唇![]() 生物学特性及人工繁育技术要点[J].黑龙江水产,2022,41(1):52-54.HE D W,MA C Y,DUAN J W,et al.Biological characteristics and key points of artificial breeding of Hemibarbus labeo[J].Northern Chinese Fisheries,2022,41(1):52-54.(in Chinese)
生物学特性及人工繁育技术要点[J].黑龙江水产,2022,41(1):52-54.HE D W,MA C Y,DUAN J W,et al.Biological characteristics and key points of artificial breeding of Hemibarbus labeo[J].Northern Chinese Fisheries,2022,41(1):52-54.(in Chinese)
[6] 骆小年,徐忠源,韩如政,等.唇![]() 养殖生物学研究进展[J].辽东学院学报(自然科学版),2016,23(2):97-103.LUO X N,XU Z Y,HAN R Z,et al.Biological research progress of Hemibarbus labeo cultivation:a review[J].Journal of Eastern Liaoning University (Natural Science Edition),2016,23(2):97-103.(in Chinese)
养殖生物学研究进展[J].辽东学院学报(自然科学版),2016,23(2):97-103.LUO X N,XU Z Y,HAN R Z,et al.Biological research progress of Hemibarbus labeo cultivation:a review[J].Journal of Eastern Liaoning University (Natural Science Edition),2016,23(2):97-103.(in Chinese)
[7] 甘光明,张耀光.唇![]() 受精卵的皮层反应及其引发机制[J].水生生物学报,2005,29(5):479-487.GAN G M,ZHANG Y G.The solicitation mechanism of the cortical reaction in Hemibarbus labeo egg[J].Acta Hydrobiologica Sinica,2005,29(5):479-487.(in Chinese)
受精卵的皮层反应及其引发机制[J].水生生物学报,2005,29(5):479-487.GAN G M,ZHANG Y G.The solicitation mechanism of the cortical reaction in Hemibarbus labeo egg[J].Acta Hydrobiologica Sinica,2005,29(5):479-487.(in Chinese)
[8] 王枫,陈栋,张永库,等.唇![]() 的人工繁殖及养殖技术[J].中国水产,2011(12):32-33.WANG F,CHEN D,ZHANG Y K,et al.Artificial propagation and cultivation techniques of lips[J].China Fisheries,2011(12):32-33.(in Chinese)
的人工繁殖及养殖技术[J].中国水产,2011(12):32-33.WANG F,CHEN D,ZHANG Y K,et al.Artificial propagation and cultivation techniques of lips[J].China Fisheries,2011(12):32-33.(in Chinese)
[9] 骆小年.鱼类人工繁育[M].北京:科学出版社,2023.LUO X N.Artificial propagation and breeding of fish[M].Beijing:Science Press,2023.(in Chinese)
[10] 蒋湘辉,骆小年,刘刚,等.池塘主养唇![]() 试验[J].水产科学,2013,32(12):738-740.JIANG X H,LUO X N,LIU G,et al.The experimental culture of Hemibarbus labeo in ponds[J].Fisheries Science,2013,32(12):738-740.(in Chinese)
试验[J].水产科学,2013,32(12):738-740.JIANG X H,LUO X N,LIU G,et al.The experimental culture of Hemibarbus labeo in ponds[J].Fisheries Science,2013,32(12):738-740.(in Chinese)
[11] 李文龙.高寒地区唇![]() 苗种池塘培育技术[J].水产养殖,2015,36(8):31-32.LI W L.Cultivation techniques of lip seedlings in pond in alpine region[J].Journal of Aquaculture,2015,36(8):31-32.(in Chinese)
苗种池塘培育技术[J].水产养殖,2015,36(8):31-32.LI W L.Cultivation techniques of lip seedlings in pond in alpine region[J].Journal of Aquaculture,2015,36(8):31-32.(in Chinese)
[12] 李军,骆小年,李敬伟,等.鸭绿江水系唇![]() 肌肉营养成分与品质的评价[J].沈阳农业大学学报,2011,42(1):59-64.LI J,LUO X N,LI J W,et al.Evaluation of nutritive quality and nutrient components in the muscle of Hemibarbus labeo Pallas[J].Journal of Shenyang Agricultural University,2011,42(1):59-64.(in Chinese)
肌肉营养成分与品质的评价[J].沈阳农业大学学报,2011,42(1):59-64.LI J,LUO X N,LI J W,et al.Evaluation of nutritive quality and nutrient components in the muscle of Hemibarbus labeo Pallas[J].Journal of Shenyang Agricultural University,2011,42(1):59-64.(in Chinese)
[13] 张家松,张志鹏,陈伟强,等.饲料中碳水化合物水平对唇![]() 生长和饲料利用的影响[J].水产学杂志,2015,28(1):34-38.ZHANG J S,ZHANG Z P,CHEN W Q,et al.Effects of dietary carbohydrate level on growth and feed utilization in skin carp Hemibarbus labeo[J].Chinese Journal of Fisheries,2015,28(1):34-38.(in Chinese)
生长和饲料利用的影响[J].水产学杂志,2015,28(1):34-38.ZHANG J S,ZHANG Z P,CHEN W Q,et al.Effects of dietary carbohydrate level on growth and feed utilization in skin carp Hemibarbus labeo[J].Chinese Journal of Fisheries,2015,28(1):34-38.(in Chinese)
[14] 李金灿.二甲双胍对齐口裂腹鱼精子低温保存效果及作用机理研究[D].陕西:西北农林科技大学,2023.LI J C.Study on the effect and mechanism of metformin on cryopreservation of Schizothorax prenanti sperm[D].Shanxi:Northwest A &F University,2023.(in Chinese)
[15] 赵强,赵清良,殷宁.暗纹东方鲀精液冷藏对精子活力、受精率和孵化率的影响[J].南京农业大学学报,1999,22(4):57-60.ZHAO Q,ZHAO Q L,YIN N.The effect of sperm cooling on the sperm activity,fertilization and incubation rate of Fugu obscurus[J].Journal of Nanjing Agricultural University,1999,22(4):57-60.(in Chinese)
[16] 梁伟峰,张海发,王云新,等.几种因子对鞍带石斑鱼精子活力的影响[J].广东海洋大学学报,2009,29(3):29-32.LIANG W F,ZHANG H F,WANG Y X,et al.Effect of several factors on motility of sperm of Epinephelus lanceolatus[J].Journal of Guangdong Ocean University,2009,29(3):29-32.(in Chinese)
[17] NAGY S T,KAKASI B,P L L,et al.Effects of high ambient temperature on fish sperm plasma membrane integrity and mitochondrial activity-A flow cytometric study[J].Acta Biologica Hungarica,2016,67(2):125-132.
L L,et al.Effects of high ambient temperature on fish sperm plasma membrane integrity and mitochondrial activity-A flow cytometric study[J].Acta Biologica Hungarica,2016,67(2):125-132.
[18] BLAXTER J H S.Sperm storage and cross-fertilization of spring and autumn spawning herring[J].Nature,1953,172:1189-1190.
[19] 程顺,顾志敏,刘士力,等.翘嘴鲌精子生理特性及超低温冷冻的研究[J].江苏农业科学,2019,47(7):175-179.CHENG S,GU Z M,LIU S L,et al.Study on physiological characteristics and ultra-low temperature freezing of Culter alburnus sperm[J].Jiangsu Agricultural Sciences,2019,47(7):175-179.(in Chinese)
[20] 刘光霞,吴兴兵,何勇凤,等.圆口铜鱼精子超低温冷冻保存[J].中国水产科学,2020,27(1):44-52.LIU G X,WU X B,HE Y F,et al.Cryopreservation and its effects on spermatozoa quality of Coreius guichenoti[J].Journal of Fishery Sciences of China,2020,27(1):44-52.(in Chinese)
[21] 王肇霖,陈睿毅,楼宝,等.小黄鱼精液超低温冷冻保存技术的试验研究[J].浙江海洋学院学报(自然科学版),2016,35(1):15-18.WANG Z L,CHEN R Y,LOU B,et al.The study of Larimichthys polyactis spermatozoa cryopreservation[J].Journal of Zhejiang Ocean University (Natural Science Edition),2016,35(1):15-18.(in Chinese)
[22] PAN J M,ZHU K C,LIU J,et al.Cryopreservation of black seabream (Acanthopagrus schlegelii) sperm[J].Theriogenology,2023,210:182-191.
[23] IRAWAN H,VUTHIPHANDCHAI V,NIMRAT S.The effect of extenders,cryoprotectants and cryopreservation methods on common carp (Cyprinus carpio) sperm[J].Animal Reproduction Science,2010,122(3/4):236-243.
[24] 骆小年,李军,夏大明,等.唇![]() 人工繁殖试验[J].水产学杂志,2011,24(2):9-12.LUO X N,LI J,XIA D M,et al.The artificial propagation of skin carp Hemibarbus labeo[J].Chinese Journal of Fisheries,2011,24(2):9-12.(in Chinese)
人工繁殖试验[J].水产学杂志,2011,24(2):9-12.LUO X N,LI J,XIA D M,et al.The artificial propagation of skin carp Hemibarbus labeo[J].Chinese Journal of Fisheries,2011,24(2):9-12.(in Chinese)
[25] LU D C,FU C J,LIU X T,et al.Biological characteristics of semen of main freshwater fishes in China[J].Freshwater Fisheries,1989,19(2):34-37.
[26] HORTON H F,OTT A G.Cryopreservation of fish spermatozoa and Ova[J].Journal of the Fisheries Research Board of Canada,1976,33(4):995-1000.
[27] 李鑫,叶欢,何勇凤,等.稀有鮈鲫精子超低温冷冻保存[J].水生生物学报,2024,48(10):1745-1757.LI X,YE H,HE Y F,et al.Sperm cryopreservation of Gobiocypris rarus[J].Acta Hydrobiologica Sinica,2024,48(10):1745-1757.(in Chinese)
[28] 苏德学,严安生,田永胜,等.钠、钾、钙和葡萄糖对白斑狗鱼精子活力的影响[J].动物学杂志,2004,39(1):16-20.SU D X,YAN A S,TIAN Y S,et al.Effects of Na+,K+,Ca2+ and glucose on sperm mobility in northern Pike,esoxlucius[J].Chinese Journal of Zoology,2004,39(1):16-20.(in Chinese)
[29] 张崇英,陈脊宇,周亚,等.胭脂鱼(Myxocyprinus asiaficus)精液超低温冷冻保存及酶活性测定[J].基因组学与应用生物学,2020,39(4):1556-1564.ZHANG C Y,CHEN J Y,ZHOU Y,et al.Sperm cryopreservation and enzyme activities detection in Myxocyprinus asiaficus[J].Genomics and Applied Biology,2020,39(4):1556-1564.(in Chinese)
[30] 王晓爱,杨君兴,陈小勇,等.软鳍新光唇鱼精子的超低温冷冻保存[J].动物学研究,2012,33(3):283-289.WANG X A,YANG J X,CHEN X Y,et al.Cryopreservation of sperm from Neolissochilus benasi[J].Zoological Research,2012,33(3):283-289.(in Chinese)
[31] 贾濮元,郭华阳,朱克诚,等.黄鳍棘鲷精子冷冻保存方法探究[J].南方水产科学,2021,17(6):58-65.JIA P Y,GUO H Y,ZHU K C,et al.Cryopreservation of sperm of Acanthopagrus latus[J].South China Fisheries Science,2021,17(6):58-65.(in Chinese)
[32] 乔瑞峰,陆专灵,高爽爽,等.大鳞副泥鳅精液超低温冷冻保存方法的优化[J].广东农业科学,2020,47(7):142-147.QIAO R F,LU Z L,GAO S S,et al.Optimization of method for ultra-low temperature cryopreservation of Paramisgurnus dabryanus Semen[J].Guangdong Agricultural Sciences,2020,47(7):142-147.(in Chinese)
[33] 金佳利,许金娇,杜明润,等.瓦氏黄颡鱼精子冷冻保存技术[J].中国水产科学,2023,30(11):1301-1310.JIN J L,XU J J,DU M R,et al.Cryopreservation technique for sperm of darkbarbel catfish(Pelteobagrus vachelli)[J].Journal of Fishery Sciences of China,2023,30(11):1301-1310.(in Chinese)
[34] POLGE C,SMITH A U,PARKES A S.Revival of spermatozoa after vitrification and dehydration at low temperatures[J].Nature,1949,164(4172):666.
[35] BABIAK I,GLOGOWSKI J,GORYCZKO K,et al.Effect of extender composition and equilibration time on fertilization ability and enzymatic activity of rainbow trout cryopreserved spermatozoa[J].Theriogenology,2001,56(1):177-192.
[36] 邢露梅,肖伟,李兰兰,等.兰州鲇精液超低温冷冻保存技术研究及细胞损伤检测[J].水生生物学报,2021,45(3):547-556.XING L M,XIAO W,LI L L,et al.Study of sperm cryopreservation in Silurus lanzhouensis and detection of cell damages after cryopreservation[J].Acta Hydrobiologica Sinica,2021,45(3):547-556.(in Chinese)
[37] 王明华,陈友明,丁淑燕,等.美洲鲥鱼精子超低温冷冻保存技术初探[J].江苏农业科学,2015,43(7):250-251.WANG M H,CHEN Y M,DING S Y,et al.Preliminary study on cryopreservation technology of American shad sperm[J].Jiangsu Agricultural Sciences,2015,43(7):250-251.(in Chinese)
[38] 郑学斌,杜晨,王景倩,等.小黄鱼(Larimichthys polyactis)精子的生理特性及超低温冷冻保存研究[J].海洋与湖沼,2020,51(1):193-205.ZHENG X B,DU C,WANG J Q,et al.Physiological characteristics and cryopreservation effect of Larimichthys polyactis sperm[J].Oceanologia et Limnologia Sinica,2020,51(1):193-205.(in Chinese)