海胆(Echinoidea)属于棘皮动物门(Echinodermata)海胆纲(Echinoidea),是海洋里一类常见的无脊椎动物。黄海胆是海胆纲中一种重要的水产养殖经济物种,因其个体大,性腺饱满,在海胆养殖产业中占有重要位置[1]。近年来,黄海胆生殖细胞低温保存方法的研究受到了较多的关注。在水产生物中,精子低温保存技术能解决杂交育种中不能自然交配等遗传育种问题,使水生动物人工授精和远缘杂交可行[2],从而打破地理隔离的影响,增加水产物种杂交组合的数量,促进水生动物种质资源开发与改良[3],并为水生动物遗传育种和生物技术育种研究提供材料,极大地促进了水生动物遗传育种实践研究[4]。截至2015年,约有200种鱼类的精子进行过低温冷冻保存[5],已有研究表明,水产生物如三疣梭子蟹、九孔鲍等也已开展了精子的低温保存[6-7]。目前,中国水产种质资源面临着品质下降和种质退化的双重问题[8],精子的低温保存技术可将优良水生动物的原有良种进行短期保存,在一定程度上避免了长期养殖和近亲交配导致的种质资源退化及变异现象[9]。
精子的寿命、活力与其所处的温度相关,目前,精子低温保存技术广泛应用于畜牧行业中,近年来,水产生物精子低温保存技术研究也得到逐渐发展。在低温条件下,马氏珠母贝、黄颡鱼和中国明对虾等物种的精子会延长活力保鲜期[10-12]。在精子低温保存过程中通常添加抗生素使细菌失活,降低原生动物的活力[13],有研究表明,在低温保存过程中将抗生素添加到含有墨吉明对虾精子中,精子存活率显著改善,同时在贮藏过程中还抑制了弧菌的生长,且对精子的活力无不良影响[10]。添加青霉素对黄颡鱼精子进行低温保存效果显著,可明显延长精子保存时间且对精子质量无影响[11]。
低温条件会极大程度地降低精子腐败变质的可能,升高温度则可以将精子从沉默状态激活。目前,对于低温沉默海胆精子且滴加海水复苏过程中精子活性的调控机制研究尚不多见,为此本研究中应用RNA-Seq测序技术对黄海胆新鲜精子、低温沉默精子及滴加海水复苏后的精子进行转录组测序并进行转录图谱比较分析,分别获得与精子低温沉默和海水复苏相关的差异表达基因及其富集通路,以期为黄海胆精子低温保存及海水复苏的调控机制研究提供基础数据和科学参考。
1 材料与方法
1.1 材料
试验选取壳径为7.5~8.5 cm,体质量为60~65 g的黄海胆进行精子采集,试验前将黄海胆置于18 ℃条件下暂养7 d,每日15∶00进行投喂。
1.2 方法
1.2.1 精子收集及活性测定 通过注射1 mL 0.5 mol/L氯化钾溶液对黄海胆进行催产,提取的黄海胆精子样品共分为3个试验组,分别记为HX组(黄海胆新鲜精子)、HC组(黄海胆沉默精子)与HJ组(黄海胆激活精子)。
HX组精子收集:挑选15只健康且活力强的雄性黄海胆,每只注射1.0 mL氯化钾溶液,从中挑选9只性腺饱满、生产精子数量多的海胆,用吸管收集排出的精子,将9只黄海胆精子分别吸取至10 mL离心管中,4 ℃下以3 000 r/min离心,弃上清液,保留沉淀,吸取3管黄海胆精子转移至1.5 mL离心管中,每管加入0.5 mL精子并分别标记为HX1、HX2、HX3,同时添加1 mL过滤海水。
HC组精子收集:在剩余6只黄海胆的精子中加入1.0 mL 20 μg/mL氟苯尼考海水溶液后摇匀,再次离心后弃上清,吸取0.5 mL精子至1.5 mL离心管中,每管加入1.0 mL氟苯尼考溶液,置于4 ℃冰箱中保存,低温保存3 d后,取3支离心管分别标记为HC1、HC2、HC3。
HJ组精子收集:将剩余3支离心管中上层溶液倒出并分别滴加1 mL海水后摇匀,标记为HJ1、HJ2、HJ3。
以上样品均需放入液氮中冷冻后转移至-80 ℃冰箱中保存,待测送检。
精子活性测定:吸取1 mL离心后的黄海胆精子至10 mL离心管中,添加不同浓度的氟苯尼考溶液并置于4 ℃低温条件下保存,分别在1、3、5、7、10、15、20 d取出部分溶液并滴加海水复苏进行精子活性的观察和数量统计。
1.2.2 黄海胆精子文库构建及上机测序 RNA-Seq测序文库构建由北京诺禾致源科技股份有限公司提供技术服务,通过Oligo(dT)磁珠富集带有polyA尾的mRNA,以片段化的mRNA为模板,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第一条链,随后用RNaseH降解RNA链,并在DNA polymerase I体系下,以dNTPs为原料合成cDNA第二条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,采用AMPure XP beads筛选250~300 bp的cDNA,进行PCR扩增并再次采用AMPure XP beads纯化PCR产物,最终获得文库。
1.2.3 文库质检 文库构建完成后,先采用Qubit 2.0 Fluorometer进行初步定量,稀释文库至1.5 ng/μL,随后采用Agilent 2100 bioanalyzer对文库的insert size进行检测,insert size符合预期后,采用qRT-PCR对文库有效浓度进行准确定量(文库有效浓度高于2 nmol/L),以保证文库质量。
1.2.4 GO和KEGG功能注释 通过对原始数据进行标准化,采用统计学模型进行假设检验概率(P值)的计算,最后进行多重假设检验校正得到FDR(False discovery rate)值,即矫正后的P值,以|log2(FoldChange)|>1且P<0.05为基因差异表达筛选标准。采用clusterProfiler软件对差异表达基因(DEGs)进行基因本体(Gene Ontology,GO)功能富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。
采用Primer 5设计荧光定量PCR引物,用于Catsper2、NKAa1、Spe-8、Spe-12基因表达水平的验证。采用TRizol法提取黄海胆精子RNA,采用SuperMixFastKing进行反转录。采用FastStart Essential DNA Green Master试剂盒进行荧光定量PCR。采用Bio-Rad CFX96-M实时荧光定量PCR仪(Bio-Rad,USA)进行qPCR定量。
qPCR反应程序为95 ℃下预孵育600 s,60 ℃下孵育60 s,共进行45次循环,97 ℃下熔化1 s,37 ℃下冷却30 s。以18S作为内参基因计算各基因的相对表达量。以空白组样本的基因表达相对值为对照,将对照值设为1。计算公式为
-ΔΔCt=[Ct(样本)-Ct(内参)]-[Ct(控制)-Ct(内参)],
(1)
基因相对表达量=2-ΔΔCt。
(2)
式中:Ct为循环阈值。
表1 实时荧光定量PCR引物序列
Tab.1 Primers sequence of real-time fluorescent quantitative PCR

基因gene引物序列primersequence(5′-3′)Catsper2F:GAAUAUUCCCGUUCAACUATTR:UAGUUGAACGGGAAUAUUCTTNKAa1F:TGGCGGGTTGGCATTACTTCTTGR:CCATGACTTGGAGTGGTGAAGCCSpe-8F:AGCCCATAGCGACGAGR:TCCGTGGGAAGGCATASpe-12F:GGAGGCTATGTTCAAGATGGGCTACR:TGTCCAGATAGATGACGAGGTGAGG18SF:CTTCGAAGGCGATCAGATACR:CTGTCAATCCTCACTGTGTC
表2 荧光定量反应体系
Tab.2 Fluorescence quantitative reaction system

试剂reagent体积volume/μLFastStartEssentialDNAGreenMaster10.0引物F0.6引物R0.6cDNA模板2.0ddH2O6.4
2 结果与分析
2.1 不同浓度下氟苯尼考对黄海胆精子低温保存的影响
在一定浓度范围内,黄海胆精子保存效果随氟苯尼考浓度的升高而升高,其中浓度为20 μg/mL氟苯尼考溶液的保存效果最好,在第20天时仍有80%左右的精子保持活性(表3)。
表3 低温条件下不同浓度氟苯尼考对黄海胆精子活性的影响
Tab.3 Effects of different concentrations of flufenicol on sperm motility of yellow sea urchin at low temperature %
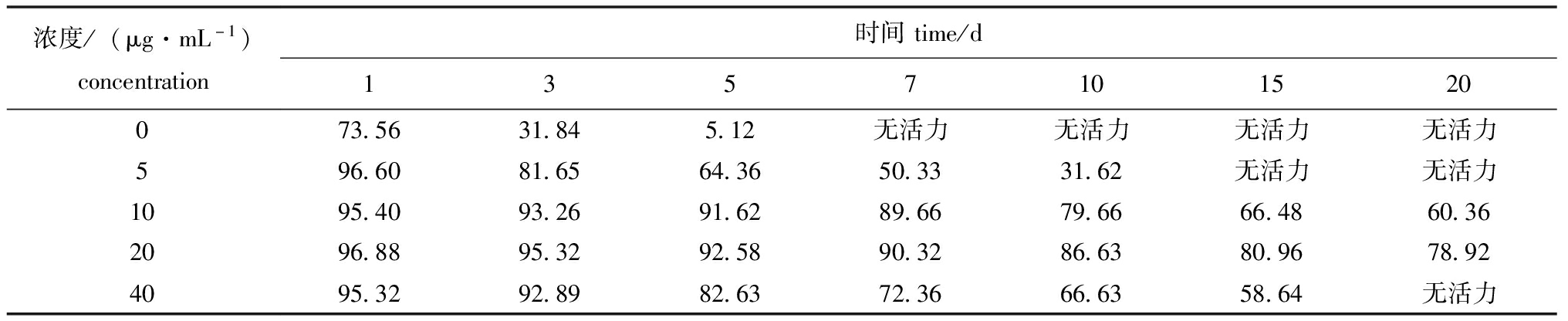
浓度/(μg·mL-1)concentration时间time/d1357101520073.5631.845.12无活力无活力无活力无活力596.6081.6564.3650.3331.62无活力无活力1095.4093.2691.6289.6679.6666.4860.362096.8895.3292.5890.3286.6380.9678.924095.3292.8982.6372.3666.6358.64无活力
2.2 转录组测序数据质量评估
IlluminaHiSeqTM测序分析,获得原始数据后,对raw reads进行过滤,删除低质量的短序列后,得到高质量的短序列。转录组测序数据质量评估结果见表4,HX、HJ、HC的平均碱基含量GC%分别为46.26%、45.65%、46.00%,表明测序结果碱基随机性良好;测序碱基质量分析得出碱基质量值Q20和Q30均达到90%以上的标准,说明测序数据质量良好,可以进行注释工作。
表4 转录组测序数据质量评估情况
Tab.4 Quality assessment of transcriptome sequencing data
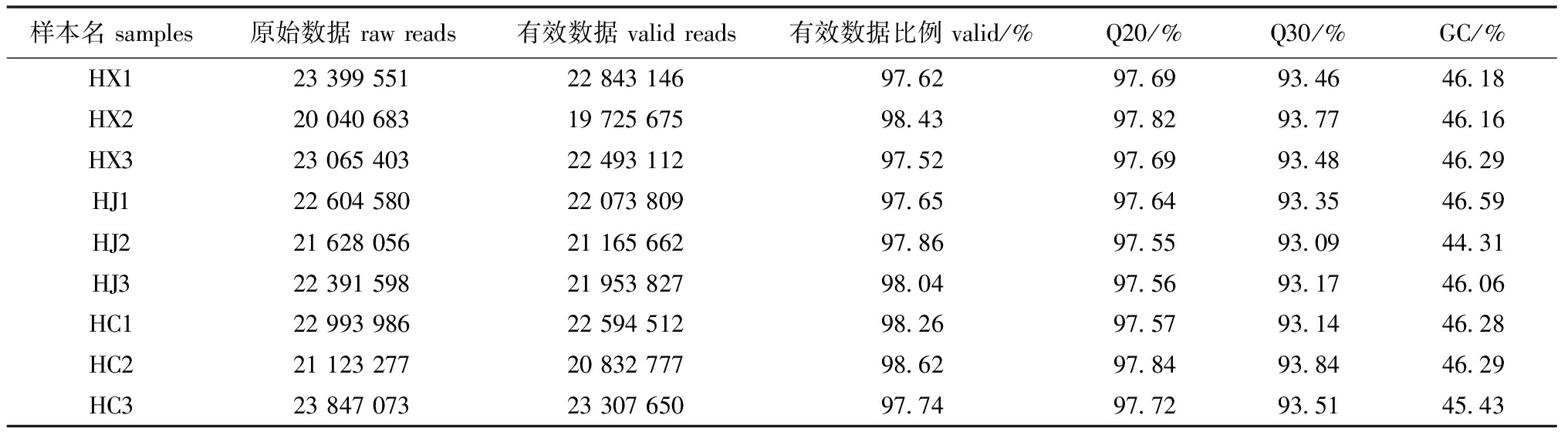
样本名samples原始数据rawreads有效数据validreads有效数据比例valid/%Q20/%Q30/%GC/%HX1233995512284314697.6297.6993.4646.18HX2200406831972567598.4397.8293.7746.16HX3230654032249311297.5297.6993.4846.29HJ1226045802207380997.6597.6493.3546.59HJ2216280562116566297.8697.5593.0944.31HJ3223915982195382798.0497.5693.1746.06HC1229939862259451298.2697.5793.1446.28HC2211232772083277798.6297.8493.8446.29HC3238470732330765097.7497.7293.5145.43
2.3 差异表达基因比较
为了对差异表达基因做进一步的基因功能挖掘,对差异表达基因进行分析鉴定,本试验中显著性差异表达标准为P<0.05或|log2(FoldChange)|>1。将HX组、HC组、HJ组精子基因的表达量相互比较,每个比较组的差异表达基因如图1所示,HC组与HX组差异表达基因共有7 223个,其中上调基因数目为3 534个,下调的基因数目为3 689个;HJ组与HC组差异表达基因共有1 683个,其中上调基因数目为1 005个,下调基因数目为678个;HJ组与HX组差异表达基因共有3 275个,其中上调基因数目为1 930个,下调基因数目为1 345个。
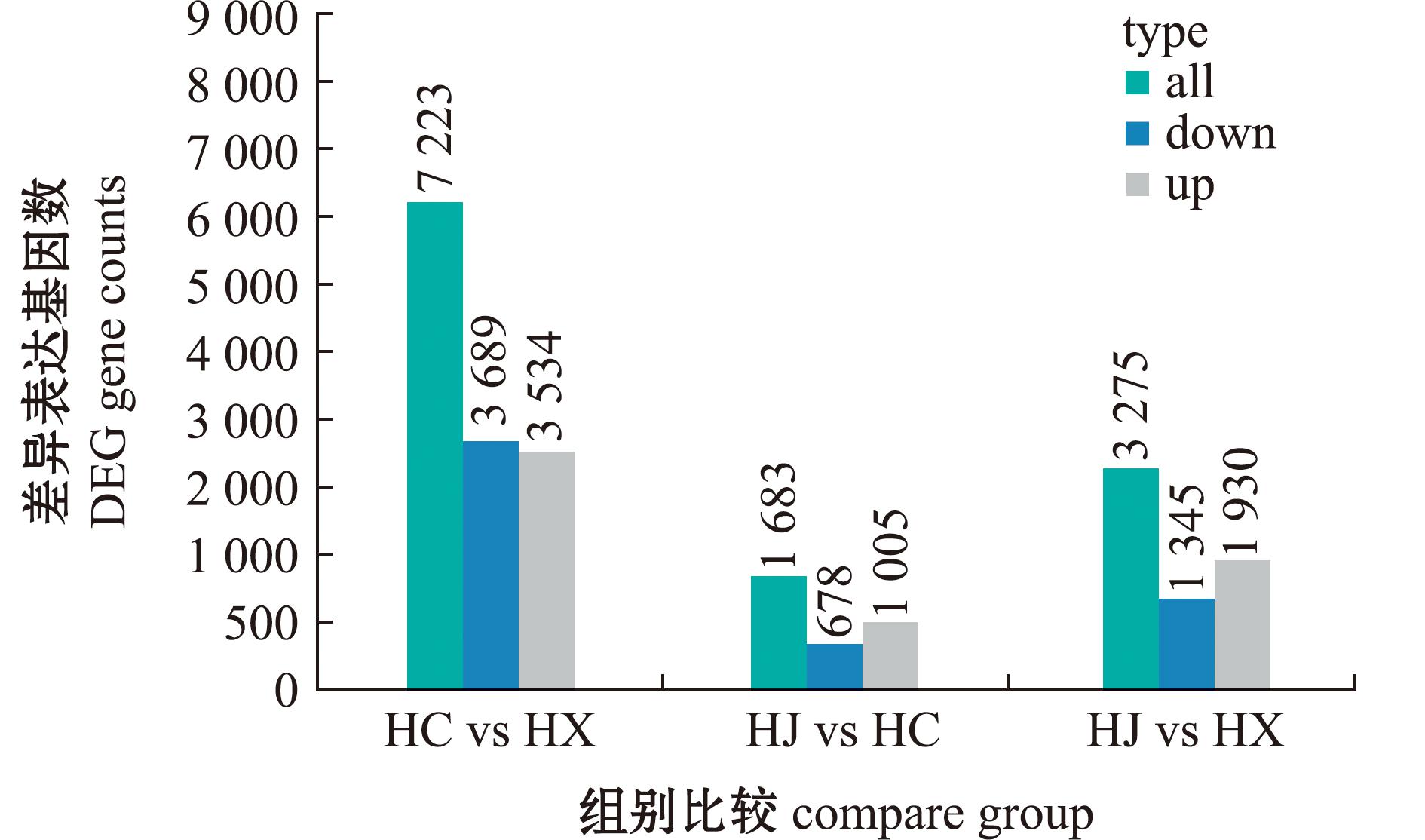
图1 各组差异表达基因比较
Fig.1 Comparison among differentially expressed genes in each group
2.4 差异表达基因GO分析
为解析低温沉默与海水复苏过程中可能的生物学作用机制,并进一步挖掘差异表达基因的功能,对3个试验组(A vs HX,HC vs HX,HJ vs HC)间的差异表达基因(DEGs)进行了GO富集分析,将富集分析结果分为3大类:生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)。
HC组与HX组进行差异表达基因分析比较,结果如图2所示,两组比较共有14 033条单基因(unigenes)(69.26%)参与到生物过程,包含肽生物合成过程、肽代谢过程、酰胺生物合成、细胞酰胺代谢过程、有机氮化合物生物合成过程、细胞组成、组织或生物发生、细胞氮化合物生物合成过程、有机物生物合成过程、大分子生物合成过程、细胞大分子生物合成过程和细胞氮化合物生物合成过程等,其中细胞氮化合物生物合成过程占比最高;共有4 789条unigenes(23.64%)参与到核糖体、细胞内非膜结合细胞器、胞内细胞器、细胞解剖结构、DNA包装复合物、细胞色素复合物、线粒体内膜蛋白复合物、呼吸酶、线粒体内膜、呼吸链复合物、核小体和线粒体包膜中,其中细胞解剖结构、细胞内非膜结合细胞器和胞内细胞器占比较高;有1 329条unigenes(6.56%)参与到分子功能中,差异表达基因富集较多的通路为核糖体结构成分通路、分子结构活性通路、几丁质结合通路、单价无机阳离子跨膜转运蛋白活性通路、质子跨膜转运蛋白活性通路和翻译伸长因子活性通路等。
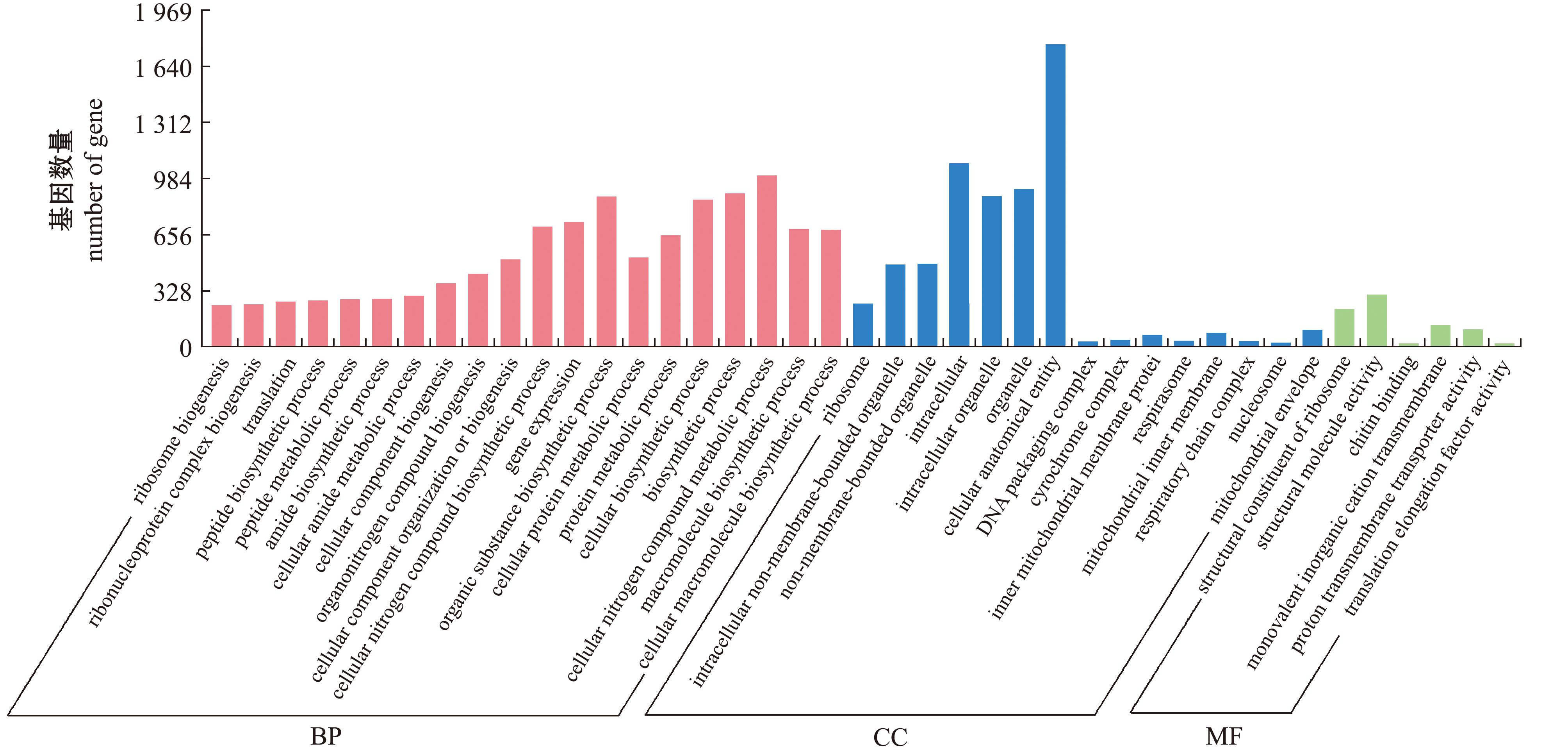
图2 沉默精子与新鲜精子GO富集直方图
Fig.2 Histogram of GO enrichment of silent sperm and fresh sperm
HJ组与HX组进行差异表达基因分析比较,结果如图3所示,共有5 928条unigenes(71.24%)参与到生物过程,包括核糖体蛋白复合体生物合成、肽生物合成过程、肽代谢过程、酰胺生物合成、细胞酰胺代谢过程、有机氮化合物生物合成过程、细胞组成、组织或生物发生、细胞氮化合物生物合成过程、有机物生物合成过程、大分子生物合成过程、细胞大分子生物合成过程、细胞氮化合物生物合成过程和有机氮化合物代谢过程等,其中细胞氮化合物生物合成过程、大分子生物合成过程和有机氮化合物代谢过程占比较多;共有1 423条unigenes(17.10%)参与到细胞组分中,其中细胞解剖结构、细胞器和胞内细胞器合成比例较高;有970条unigenes(11.66%)参与到分子功能中,分子结构活性、几丁质结合、多糖结合和核糖体RNA结合相关的unigenes所占比例较高。
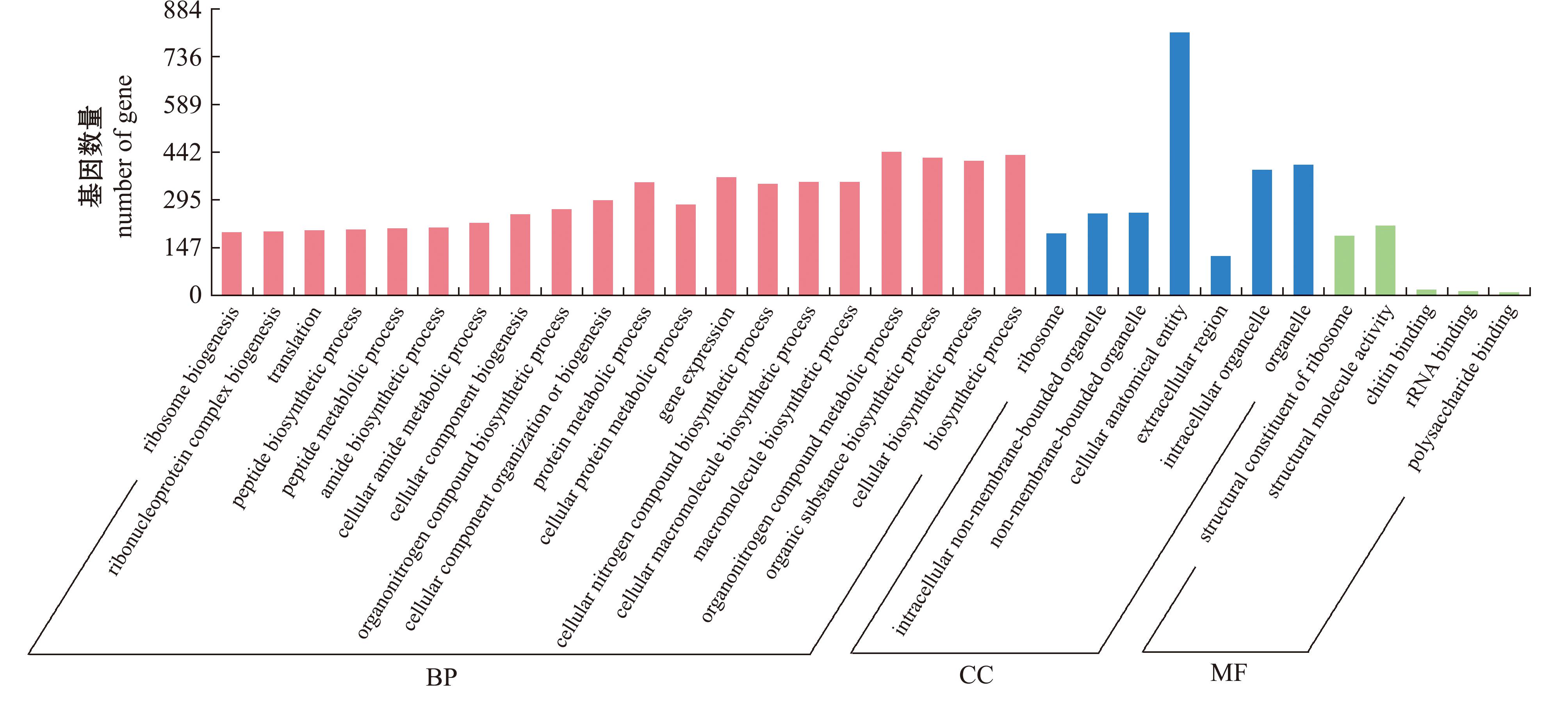
图3 激活精子与新鲜精子GO富集直方图
Fig.3 Histogram of GO enrichment of activated sperm and fresh sperm(HJ vs HX)
HJ组与HC组进行差异表达基因分析比较,结果如图4所示,共有645条unigenes(31.52%)参与到生物过程,包括碳水化合物分解代谢过程、磷酸戊糖分流、NADPH再生、葡萄糖6-磷酸代谢过程、碳水化合物生物合成过程、丙酮酸代谢过程、NADP代谢过程、糖异生、己糖生物合成过程和单糖生物合成过程相关的unigenes占比较高;有1 362条unigenes(66.56%)参与到分子功能中,包括细胞因子活性、焦磷酸酶活性、水解酶活性、核糖体的结构成分和果糖二磷酸醛缩酶活性,其中水解酶活性占比最高;共有39条unigenes(1.90%)参与到细胞组分中。
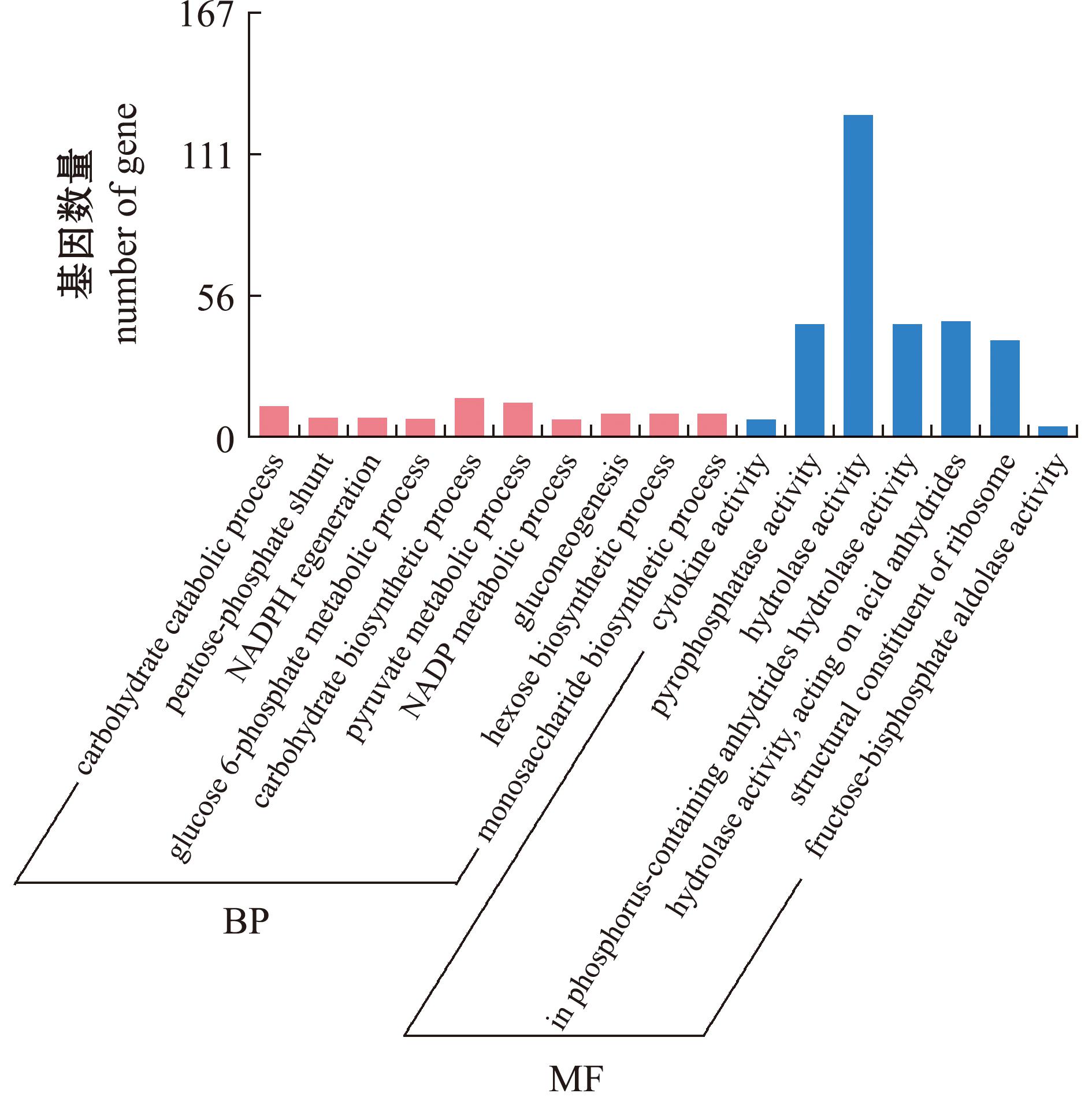
图4 激活精子与沉默精子GO富集直方图
Fig.4 Histogram of GO enrichment of activated sperm and silent sperm
综上所述,沉默状态的精子差异表达基因参与肽代谢过程、酰胺生物合成、细胞酰胺代谢过程和有机氮化合物生物合成过程等,低温环境使得精子内基因富集于化合物的合成等通路。同时,在重新激活的精子中有差异表达基因参与碳水化合物分解代谢过程、磷酸戊糖分流、NADPH再生、葡萄糖6-磷酸代谢过程、碳水化合物生物合成过程、丙酮酸代谢过程、NADP代谢过程、糖异生、水解酶活性和果糖二磷酸醛缩酶活性,这些过程与能量合成、呼吸代谢相关,表明滴加海水复苏促进精子内相关基因富集于能量和代谢等通路。以上差异说明,相较低温保存精子,新鲜和重新复苏的精子能量代谢和活性催化过程变得活跃,焦磷酸酶活性和细胞因子活性占据较大部分比例,表明黄海胆精子复苏与精子内酶活和能量合成存在密切关系。
2.5 差异表达基因KEGG富集分析
通过对比不同处理组黄海胆精子差异表达基因KEGG富集图,HC组与HX组KEGG富集分析结果如图5所示,其中基因富集到284条通路,对应4 739个基因,其中富集最显著的有抗原加工呈递和细胞间隙连接通讯。HJ组与HC组KEGG富集分析结果如图6所示,对应的基因数目为1 028个,基因富集到211个通路,其中富集最显著的通路细胞间隙连接通讯、抗原处理与呈递等通路。HJ组与HX组比较,有2 228个差异表达基因富集在261个通路中,富集结果如图7所示,其中主要为核糖体、吞噬酶、蛋白多糖、抗原处理和呈递等通路。
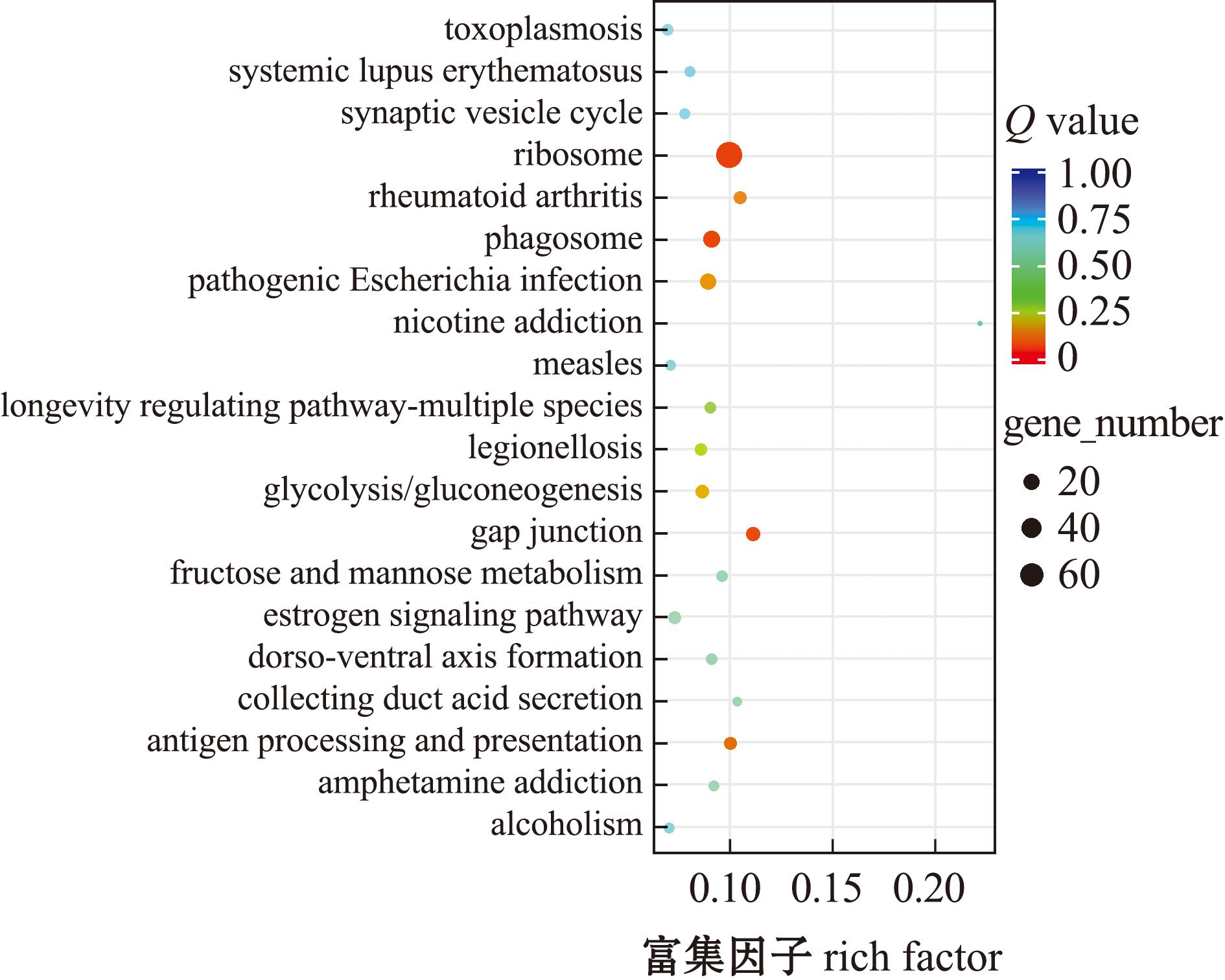
图5 HC组与HX组差异表达基因KEGG富集
Fig.5 KEGG enrichment map of differentially expressed genes in HC group and HX group
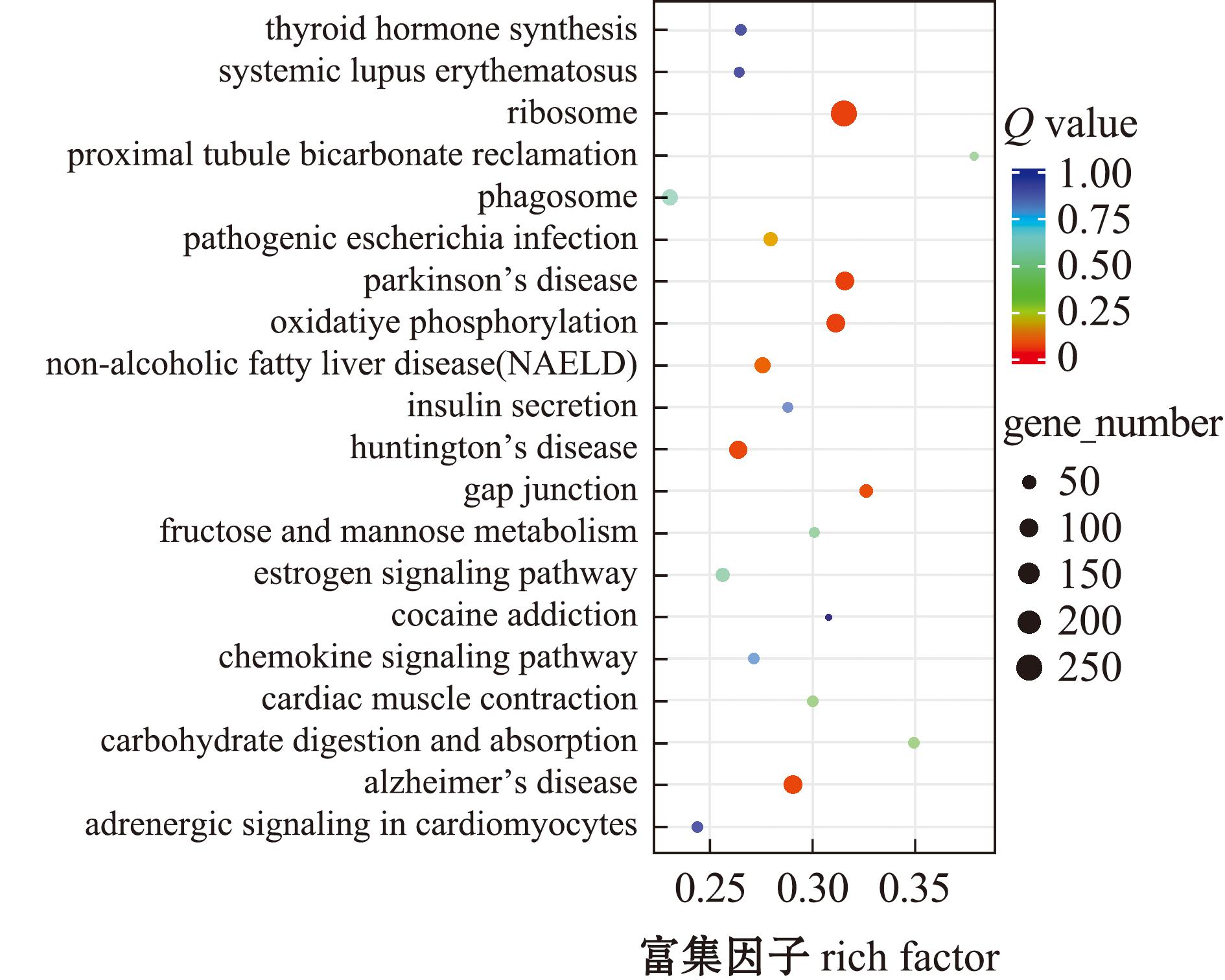
图6 HJ组与HC组差异表达基因KEGG富集
Fig.6 KEGG enrichment map of differentially expressed genes in HJ group and HC group
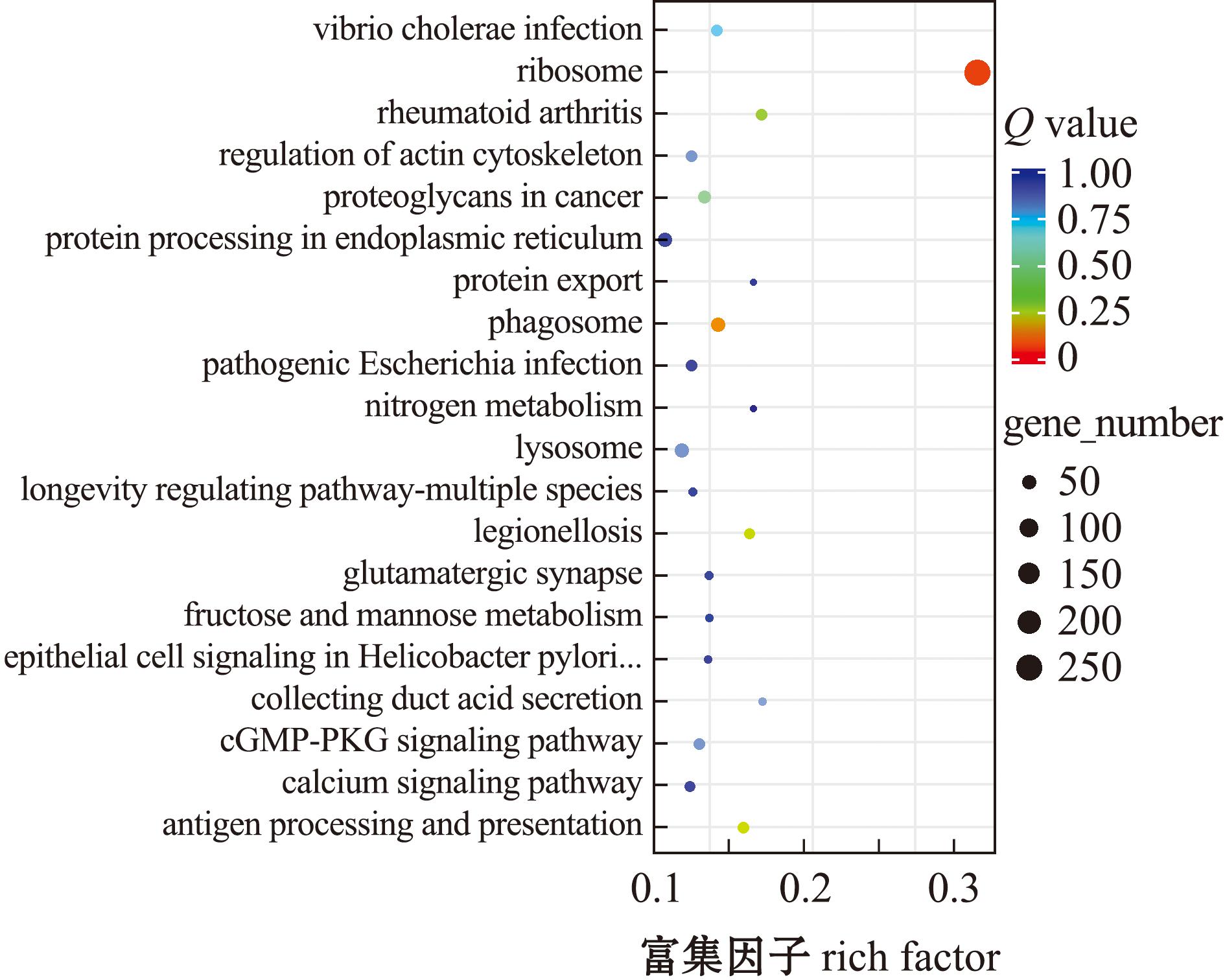
图7 HJ组与HX组差异表达基因KEGG富集
Fig.7 KEGG enrichment map of differentially expressed genes in HJ group and HX group
综上结果显示,沉默状态精子抑制了与能量合成和呼吸代谢相关的通路,当处于低温时精子减缓呼吸过程以达到减少能量消耗的作用。新鲜和重新复苏的精子差异表达基因富响应的通路中大多与体内能量合成或代谢相关,说明当精子接触海水时,海水的存在使得精子细胞体内开始合成能量并进行运动,使精子活跃度提高。
2.6 差异表达基因筛选与表达分析
为进一步分析精子活性调控的分子机制,筛选出4个与精子活力相关的显著差异表达基因NKAa1、Catsper2、Spe-8和Spe-12,对4个基因进行qRT-PCR验证试验。结果如图8所示,以上4个基因在HJ组中均表现出显著上调(P<0.05),在HC组中均表现出显著下调(P<0.05),PCR结果与转录组结果基本一致。
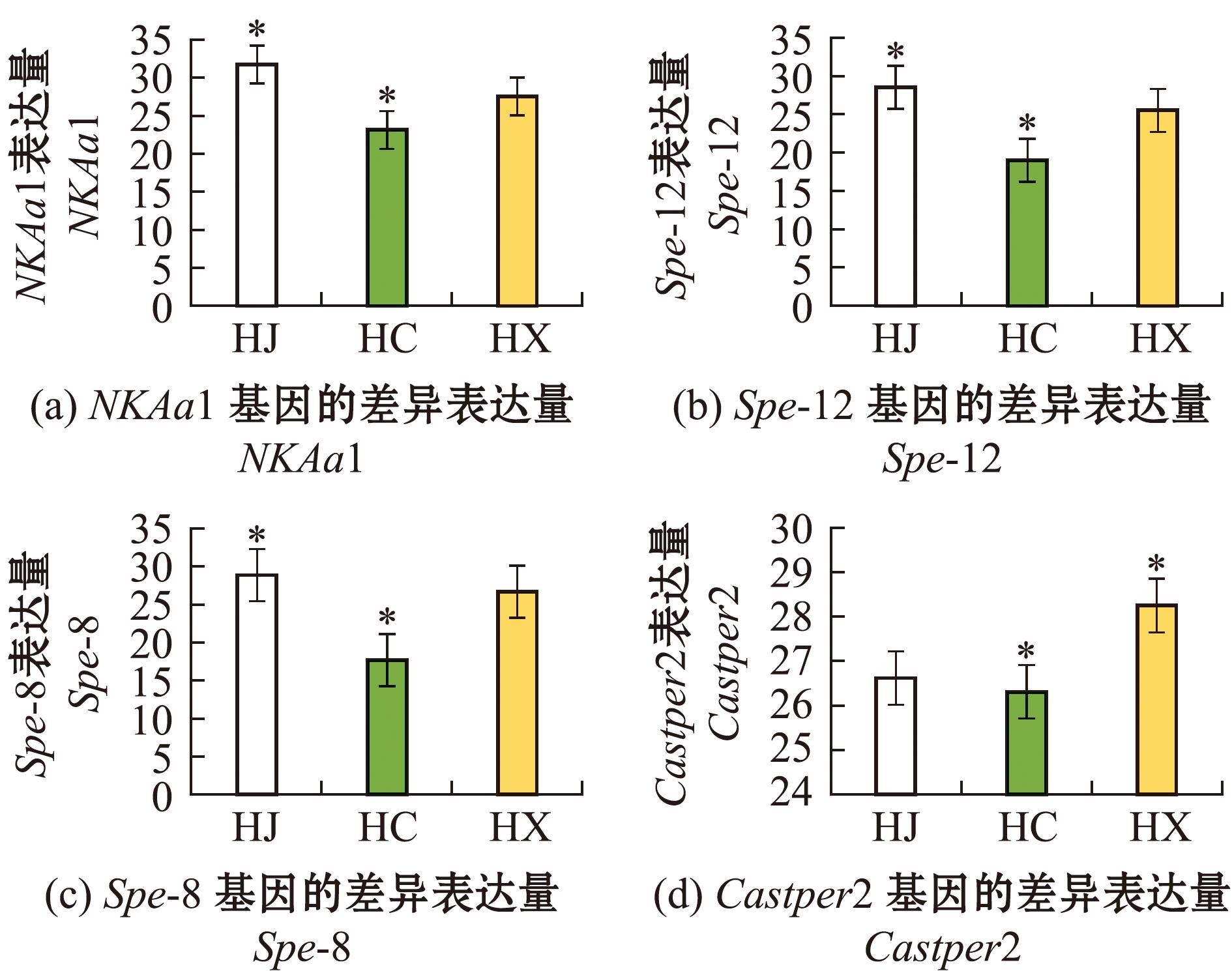
*表示单一基因在不同组间具有显著性差异。
*indicates that a single gene has significant differences among different groups.
图8 HJ vs HC vs HX差异表达基因荧光定量验证
Fig.8 Fluorescence quantification results of HJ vs HC vs HX differentially expressed gene
研究表明Na+/K+-ATPase通过主动运输逆浓度梯度跨膜转运Na+和K+[14],在合浦珠母贝精子激活过程中Na+是最重要的阳离子,其次是K+[15]。在黄海胆精子中NKAa1在海水激活影响下表达量相较于沉默状态下显著增加,表明在黄海胆中有类似的精子激活机制。
Ca2+是精子超活性启动和维持的关键调节因子[16]。有研究表明,在小鼠精子的活化运动中,Catsper蛋白在Ca2+胞间流动中起到关键的作用,这与本试验发现的Catsper2在低温沉默条件下表达量降低与滴加海水复苏后表达量显著升高的差异表达反应一致,说明Catsper2对于黄海胆精子的复苏具有重要作用。
Spe家族基因具有掌控精子运动参与受精的功能,研究发现,Spe蛋白会与多种蛋白进行互作作用,多种蛋白相互协同调控精子的受精作用,使精子活动并与卵子结合[17]。Spe-8与Spe-12掌控Spe蛋白合成同时协调精子的受精作用,本研究中发现,调控精子发生的Spe-8、Spe-12等在低温保存后表达量降低,在海水复苏后表达量显著升高。
3 讨论
3.1 黄海胆精子保存和复苏的影响因素
体外保存精子的首要原则是尽可能的保持其活力和形态并延长精子的寿命,低温保存过程中精子所处环境的渗透压、pH值、离子浓度和温度等均会对精子活力造成影响[18]。已有研究发现,温度对日本囊对虾、中国明对虾和南美白对虾3种对虾精子的保存具有显著影响[19]。精子在体外的保存寿命与保存温度有着紧密联系,温度影响着能量代谢过程,温度变化会导致水生生物精子酶活性发生改变,温度掌控着细胞呼吸作用及细胞能量代谢,20 ℃条件下拉氏鱥精子活力最高,精子快速运动时间及寿命最长[20]。随着温度升高,细胞体内的呼吸作用及能量代谢会加剧,而胞内能量的快速消耗也会缩短精子的保存时间[21]。在低温环境中保存时,精子不会做出激烈运动,而是转变为沉默状态,避免剧烈运动造成的能量消耗过多[22]。精子在低温保存过程中,细菌及微生物会对精子产生严重影响,有研究表明,精子极易受到细菌及微生物的污染。20 μg/mL浓度下氟苯尼考可延长黄海胆精子低温保存时间。通常认为海水与体液的pH值、渗透压和溶解氧等差异会使进入海水的精子激活[15],因此,在保存过程中要综合考虑抗生素、温度和单价阳离子浓度等多重因素。
3.2 黄海胆精子基因转录水平分析
GO注释及KEGG富集结果显示,黄海胆精子在低温沉默后,大部分调控细胞运动及代谢的基因表达量显著降低,但抗原加工呈递、糖酵解、细胞间隙连接通讯和吞噬酶等通路反响强烈,上调基因富集在抗原合成及吞噬酶通路,可能是由于低温环境使精子通过信息传递开始合成相关抗原以抵消低温造成的影响。有研究表明,低温情况有利于精子的保存,而高温状态会使精子中糖代谢酶的活性增加,从而促进分解精子体内的能量物质,不利于精子长期保存[23]。
新鲜精子和滴加海水复苏后精子基因转录组中能量基础代谢、蛋白多糖合成、氧化应激反应及有机物质合成通路响应强烈,由于温度变化使精子呼吸代谢增强并合成能量恢复运动,温度变化主要通过控制腺苷三磷酸影响精子活性及寿命,不同温度下精子活力不同。滴加海水复苏过程也伴随着温度的升高,研究表明,当温度从4 ℃升高至20 ℃时,生活在冷水域中的利文鳟(Salmo trutta)和江鳕(Lota lota)精子糖酵解和三羧酸循环关键酶活力逐渐下降[24]。研究表明,ATP在精子中的含量是衡量精子活力的指标之一,ATP含量与精子活力呈正相关[25]。
3.3 低温保存环境下精子活性调控基因功能分析
已有研究表明,Spe家族基因与秀丽隐杆线虫精子运动相关[26]。低温处理后的精子活性降低,同时Spe-8和Spe-12表达量降低,致使合成Spe蛋白的速度下降,导致精子活性降低。NKAa1在海水激活影响下表达量相较于沉默状态下显著增加,NKAa1参与调控钠钾离子通道中Na+和K+的传递,从而导致精子活性差异的变化。Catsper蛋白家族所介导的Ca2+直接参与精子超活化的调控过程[27],Catsper2调节钙离子通道,被证明在精子尾部的主要部分特异性表达,维持精子稳态及参与受精前作用,如细胞获能、精子活力的过度激活和顶体反应。在接触低温环境时海胆精子通过降低钙、钠和钾等离子的传递和运输速度,起到保存能量,延长存活时间的作用。以上报道的参与精子活性调控及其受精作用的基因,均在新鲜海胆和海水激活海胆精子中表达量显著升高,在低温沉默的黄海精子中表达量降低。本研究中表明,黄海胆精子具备类似的分子调控机制,这将为深入研究黄海胆精子调控机制提供线索。
4 结论
1)本研究初步确定黄海胆精子在4 ℃低温存在的研究中,最适氟苯尼考保存浓度为20 μg/mL。
2)比较转录组分析结果显示,低温情况下精子抗原加工呈递、吞噬酶、肽代谢过程、酰胺生物合成、细胞酰胺代谢过程和有机氮化合物生物合成过程增强,低温促进精子内化合物的合成以抵御低温,同时细胞间隙连接通讯、氧化磷酸化等通路被抑制,精子进入沉默状态。
3)新鲜精子和复苏精子细胞间隙连接通讯及氧化磷酸化等通路增强,海水激活后离子通道信号促进,启动精子活性调控,同时,筛选出的差异表达基因Spe-8、Spe-12、Catsper2、NKAa1在其他物种中已报道参与精子的活性调控,其可能在黄海胆精子复苏过程中也发挥重要作用。
[1] 王艳,周培根,戚晓玉.海洋生物中毒素的研究进展[J].上海水产大学学报,2002,11(3):283-288.WANG Y,ZHOU P G,QI X Y.Advances in the study on toxin in halobios[J].Journal of Shanghai Fisheries University,2002,11(3):283-288.(in Chinese)
[2] 田永胜,陈松林,季相山,等.半滑舌鳎精子冷冻保存[J].渔业科学进展,2009,30(6):97-102.TIAN Y S,CHEN S L,JI X S,et al.Cryopreservation of tongue sole Cynoglossus semilaevis sperm[J].Progress in Fishery Sciences,2009,30(6):97-102.(in Chinese)
[3] QI W S.Sperm cryopreservation of kelp grouper Epinephelus moara[J].Progress in Fishery Sciences,2014,35(1):26-33
[4] 贾濮元,郭华阳,朱克诚,等.黄鳍棘鲷精子冷冻保存方法探究[J].南方水产科学,2021,17(6):58-65.JIA P Y,GUO H Y,ZHU K C,et al.Cryopreservation of sperm of Acanthopagrus latus[J].South China Fisheries Science,2021,17(6):58-65.(in Chinese)
[5] LIU Y B,LI X X,ROBINSON N,et al.Sperm cryopreservation in marine mollusk:a review[J].Aquaculture International,2015,23(6):1505-1524.
[6] 蔡明夷,柯才焕,王桂忠,等.九孔鲍精子短期保存技术研究[J].海洋科学,2008,32(1):1-5.CAI M Y,KE C H,WANG G Z,et al.Sperm short-term storage of the small abalone[J].Marine Sciences,2008,32(1):1-5.(in Chinese)
[7] 周帅,朱冬发,王春琳,等.三疣梭子蟹精子保存研究[J].海洋科学,2007,31(7):37-42.ZHOU S,ZHU D F,WANG C L,et al.Preservation of spermatozoa of blue crab Portunus trituberculatus[J].Marine Sciences,2007,31(7):37-42.(in Chinese)
[8] 杨文波,曹坤,李继龙,等.我国水产种质资源保护浅析[J].中国水产,2020(8):24-26.YANG W B,CAO K,LI J L,et al.Analysis on the protection of aquatic germplasm resources in China[J].China Fisheries,2020(8):24-26.(in Chinese)
[9] 邹仕成,李万,周亚.水生动物精子低温保存研究进展[J].黑龙江畜牧兽医,2014(23):201-203.ZOU S C,LI W,ZHOU Y.Research progress on cryopreservation of aquatic animal sperm[J].Heilongjiang Animal Science and Veterinary Medicine,2014(23):201-203.(in Chinese)
[10] NIMRAT S,SONWAT S,MATHARATANUKUL B,et al.Chilled and cryopreserved spermatophores of banana shrimp (Fenneropenaeus merguiensis):Effects of antibiotics on sperm quality and bacterial abundance[J].Aquaculture,2022,560:738551.
[11] 赵钦,陈校辉,潘建林.黄颡鱼精子低温保存方法的初步研究及应用[J].水产科学,2008,27(12):615-618.ZHAO Q,CHEN X H,PAN J L.Preservation of sperm of yellow catfish Pelteobagrus fulvidraco at low temperature[J].Fisheries Science,2008,27(12):615-618.(in Chinese)
[12] 王弢,郑兴,杨金灵,等.马氏珠母贝精子低温条件下的活力保鲜期[J].海南热带海洋学院学报,2019,26(5):1-5.WANG T,ZHENG X,YANG J L,et al.The quality guarantee period of spermatozoa from Pinctadafucatamartensii sperm under refrigerator temperature condition[J].Journal of Hainan Tropical Ocean University,2019,26(5):1-5.(in Chinese)
[13] 陈燕飞.pH对微生物的影响[J].太原师范学院学报(自然科学版),2009,8(3):121-124,131.CHEN Y F.Influences of pH on microorganism[J].Journal of Taiyuan Normal University (Natural Science Edition),2009,8(3):121-124,131.(in Chinese)
[14] 肖义军,俞如旺.细胞膜信号蛋白Na+/K+ATPase作为强心苷抗肿瘤靶点的研究进展[J].生物学教学,2016,41(10):4-6.XIAO Y J,YU R W.Research progress of cell membrane signal protein Na+/K+ATPase as anticancer target of cardiac glycoside[J].Biology Teaching,2016,41(10):4-6.(in Chinese)
[15] 喻达辉,江世贵,苏天凤,等.海水主要离子在合浦珠母贝精子激活中的作用[J].海洋学报,1999,21(6):134-137.YU D H,JIANG S G,SU T F,et al.Role of ions in the process of activation of Japanesepearl oyster’s spermatozoa[J].Acta Oceanologica Sinica,1999,21(6):134-137.(in Chinese)
[16] SUAREZ S S,VINCENTI L,CEGLIA M W.Hyperactivated motility induced in mouse sperm by calcium ionophore A23187 is reversible[J].The Journal of Experimental Zoology,1987,244(2):331-336.
[17] ZANETTI N,MAYORGA L S.Acrosomal swelling and membrane docking are required for hybrid vesicle formation during the human sperm acrosome reaction[J].Biology of Reproduction,2009,81(2):396-405.
[18] MORISAWA M,OKUNO M,SUZUKI K,et al.Initiation of sperm motility in teleosts[J].Journal of Submicroscopic Cytology,1983,15(1):61-65.
[19] 王文琪,杨敬昆,徐世宏,等.3种对虾精子超低温冷冻保存技术研究[J].海洋科学,2017,41(9):81-86.WANG W Q,YANG J K,XU S H,et al.Cryopreservation of spermatozoa of three prawn species[J].Marine Sciences,2017,41(9):81-86.(in Chinese)
[20] 吴晨,骆小年,段友健,等.不同离子浓度、温度、pH对拉氏鱥精子活力的影响[J].水产科学,2022,41(2):210-217.WU C,LUO X N,DUAN Y J,et al.Effects of different metal concentrations,temperature and pH on sperm motility of fat minnow Phoxinus lagowskii[J].Fisheries Science,2022,41(2):210-217.(in Chinese)
[21] 赵会宏,刘晓春,林浩然,等.斜带石斑鱼精子超微结构及盐度、温度、pH对精子活力及寿命的影响[J].中国水产科学,2003,10(4):286-292.ZHAO H H,LIU X C,LIN H R.Ultrastructure of spermatozoa and effects of salinity,temperature and pH on spermatozoa motility in Epiniphelus coioides[J].Journal of Fishery Sciences of China,2003,10(4):286-292.(in Chinese)
[22] 牛迪,刘艳军,郭敏,等.不同保存温度对蓝狐精子活率的影响[J].黑龙江畜牧兽医,2018(10):215-217.NIU D,LIU Y J,GUO M,et al.Effects of different storage temperatures on sperm viability of blue fox[J].Heilongjiang Animal Science and Veterinary Medicine,2018(10):215-217.(in Chinese)
[23] 王展,王林龙,李文涛,等.温度和溶解氧对金乌贼精子能量代谢和活性的影响[J].中国水产科学,2019,26(1):183-192.WANG Z,WANG L L,LI W T,et al.Effects of temperature and dissolved oxygen on sperm energy metabolism and motility in the golden cuttlefish,Sepia esculenta[J].Journal of Fishery Sciences of China,2019,26(1):183-192.(in Chinese)
[24] LAHNSTEINER F,MANSOUR N.The effect of temperature on sperm motility and enzymatic activity in brown trout Salmo trutta,burbot Lota lota and grayling Thymallus thymallus[J].Journal of Fish Biology,2012,81(1):197-209.
[25] SAKS V,MONGE C,ANMANN T,et al.Integrated and organized cellular energetic systems:theories of cell energetics,compartmentation,and metabolic channeling[M].Wiley‐VCH Verlag GmbH &Co.KGaA,2007.
[26] 唐娇,谭剑斌,茅莉娜,等.双酚S对秀丽隐杆线虫精子生成相关基因表达的影响[J].癌变·畸变·突变,2023,35(3):183-186.TANG J,TAN J B,MAO L N,et al.Effects of bisphenol S on expression of spermiogenesis genes in C.elegans[J].Carcinogenesis,Teratogenesis &Mutagenesis,2023,35(3):183-186.(in Chinese)
[27] REN D J,NAVARRO B,PEREZ G,et al.A sperm ion channel required for sperm motility and male fertility[J].Nature,2001,413:603-609.