长春鳊(Parabramis pekinensis),俗称“鳊鱼”“鳊花鱼”“草鳊”等,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲌亚科(Culterinae)鳊属(Parabramis)。长春鳊为广布性种类,分布于中国主要水系如黑龙江、长江、珠江等江河、湖泊中,国外见于朝鲜及俄罗斯。长春鳊产漂流性卵,兴建水利工程对种群繁育影响较大,其他因素如围湖造田、过度捕捞、不恰当的人工驯养及缺乏科学管理等,致使中国长春鳊天然资源处于严重衰退之中,其基因库也受到了严重威胁[1]。
2009年江苏省泰州市滨江水产良种场与中国水产科学研究院淡水渔业中心合作开展长春鳊亲鱼培育和苗种繁育等试验,首次在长江中下游地区开展长春鳊人工繁殖取得成功。随后,通过开展长春鳊亲本的采集、驯养、人工繁殖和人工养殖等系列技术研究,掌握了长春鳊苗种规模化繁育技术[2]。黑龙江长春鳊是黑龙江、松花江名产“三花五罗”之一,生长较快,其肉质嫩滑,味道鲜美,营养价值高,是淡水鱼中的佳品。随着生活水平的提高,野生黑龙江长春鳊远远满足不了市场需求,故其具有良好的市场开发前景[3],然而,黑龙江流域的长春鳊养殖规模较小,苗种来源不清楚,对野生资源的开发利用尚且不足。
目前,长春鳊研究主要集中在形态特征[4]、繁育技术[2]、性腺发育[5]和养殖技术[6]等方面,对种质资源的系统研究较少。缪凌鸿等[7]分析了长春鳊和三角鲂(Megalobrama terminalis)的肌肉成分,结果显示,长春鳊蛋白质含量(19.38%)高于三角鲂(18.19%),脂肪含量(2.89%)低于三角鲂(3.06%)。李建林等[1]用RAPD标记和mtDNA D-loop区序列评估了长江下游长春鳊遗传多样性,结果表明,长江长春鳊群体的遗传多样性处于中等水平。为了深入系统地了解长春鳊的种质特征,本研究中从该鱼的外部形态、肌肉营养成分和遗传结构三方面评估了长江和黑龙江流域长春鳊养殖群体的种质特征,以便更好地开展长春鳊繁育和遗传选育,为其资源合理利用提供参考。
1 材料和方法
1.1 材料
试验用长江长春鳊(WB)样本采自江苏省泰州市靖江市滨江水产良种场,黑龙江长春鳊(FB)样本采自黑龙江省佳木斯市抚远东龙鲟业有限公司,各30尾,均为2龄。试验鱼进行形态学测量;每尾取5 g背部肌肉样本,保存于-80 ℃超低温冰箱中,用于肌肉营养成分分析;剪取鱼的尾鳍,保存于95%乙醇中,用于遗传多样性分析。
1.2 方法
1.2.1 外部形态特征测量 试验参照《GB/T 18654.3—2008养殖鱼类种质检验》第三部分:性状测定,采用电子游标卡尺测量长春鳊的外部形态指标,包括全长(TL)、体长(SL)、体高(BH)、头长(HL)、吻长(WL)、眼径(EB)、眼间距(EC)、尾柄长(FL)和尾柄高(FH)(精确到0.01 mm)。采用电子天平称量鱼体质量(BW),精确到0.01 g。
1.2.2 肌肉营养成分测定 将冷冻的肌肉样品于4 ℃冰箱解冻后,10尾混合为1个样本(50 g),参照《国家食品安全》,采用马弗炉灼烧法、直接干燥法、索氏抽提法、凯氏定氮法分别测定粗灰分、水分、粗脂肪和粗蛋白质;采用氨基酸自动分析仪L-8900测定肌肉中氨基酸含量(参照GB 5009.124—2016);采用7 890 A气相色谱仪测定肌肉中脂肪酸相对含量(参照GB 5009.168—2016)。
1.2.3 遗传多样性分析 采用基因组提取试剂盒(天根生物)提取基因组DNA,采用10 g/L的琼脂糖凝胶电泳检测基因组DNA样品是否有降解和杂质,采用紫外分光光度计(Thermo Scientific,Nanodrop 8000)检测基因组DNA纯度和浓度,建库和测序由长沙哆点生物公司完成,简要步骤如下:对检测合格的DNA样品进行随机打断(fragmentation),筛选符合要求的、适合大小的DNA片段(size selection),经纯化(End repair and A-tailing)后的DNA片段连接测序接头(adaptor ligation),滚环扩增(PCA)制备DNB,然后使用MGISEQ系列测序仪进行测序。采用BWA mem(v0.7.17-r1188)[8]进行Reads比对,采用BCFtools(v1.15.1)[9]进行群体SNP检测和过滤,最后进行群体遗传数据计算和结构分析。
1.3 数据处理
1.3.1 形态学数据 试验数据均以平均值±标准差表示(mean±S.D.),采用SPSS 26软件分析长江和黑龙江长春鳊的10项形态数据,进行描述统计和相关性分析,并对形态比例性状进行独立样本t检验以及主成分分析,显著性水平设为0.05,极显著水平设为0.01。
1.3.2 肌肉营养成分数据 参照孙志鹏等[10]方法进行统计,包括肌肉基本营养成分、肌肉氨基酸、肌肉脂肪酸指标。
1.3.3 遗传多样性数据 采用VCFtools软件及本地化脚本分别计算两个群体的SNP标记密度(SNP density,SNP/Kb)、单核苷酸多态性(nucleotide diversity,π)、近交系数(inbreeding coefficient,FHOM)、观测杂合度(observed heterozygosity,Ho)、多态信息含量(polymorphism information content,PIC)、遗传距离(genetic distance,DR)、遗传分化系数(Fst)和基因流(Nm),群体结构分析首先采用PLINK[11]计算两个群体IBD距离矩阵,然后采用R包ape[12]构建邻接树(neighbor-joining tree)。采用EIGENSOFT中的smartpca[13]模块进行主成分分析,用变异解释度最大的2个主成分进行绘图展示。采用ADMIXTURE[14]进行群体结构分析,以K=2作为最佳K值进行展示。
2 结果与分析
2.1 外部形态测量
2.1.1 描述统计与相关性分析 对10项形态学数据进行描述统计分析(表1),结果WB群体的平均体质量为(527.88±108.14) g,平均全长为(367.74±19.23) mm,平均体长为(308.37±16.99) mm,平均体高为(106.48±8.58) mm。FB群体的平均体质量为(427.58±52.80) g,平均全长为(348.51±14.70) mm,平均体长为(281.69±12.61) mm,平均体高为(112.89±5.16) mm。性状间相关性分析结果,长春鳊WB群体性状间相关性系数(r)为-0.216~0.952,其中对体质量贡献最大的为体长(r=0.934),最小的为眼径(r=0.112);FB群体性状间相关性系数为-0.086~0.949,其中对质量贡献最大的为体高(r=0.904),最小的为吻长(r=0.022)。
表1 WB和FB群体10项外部形态性状的描述统计
Tab.1 Descriptive statistics of ten morphological traits of WB and FB population
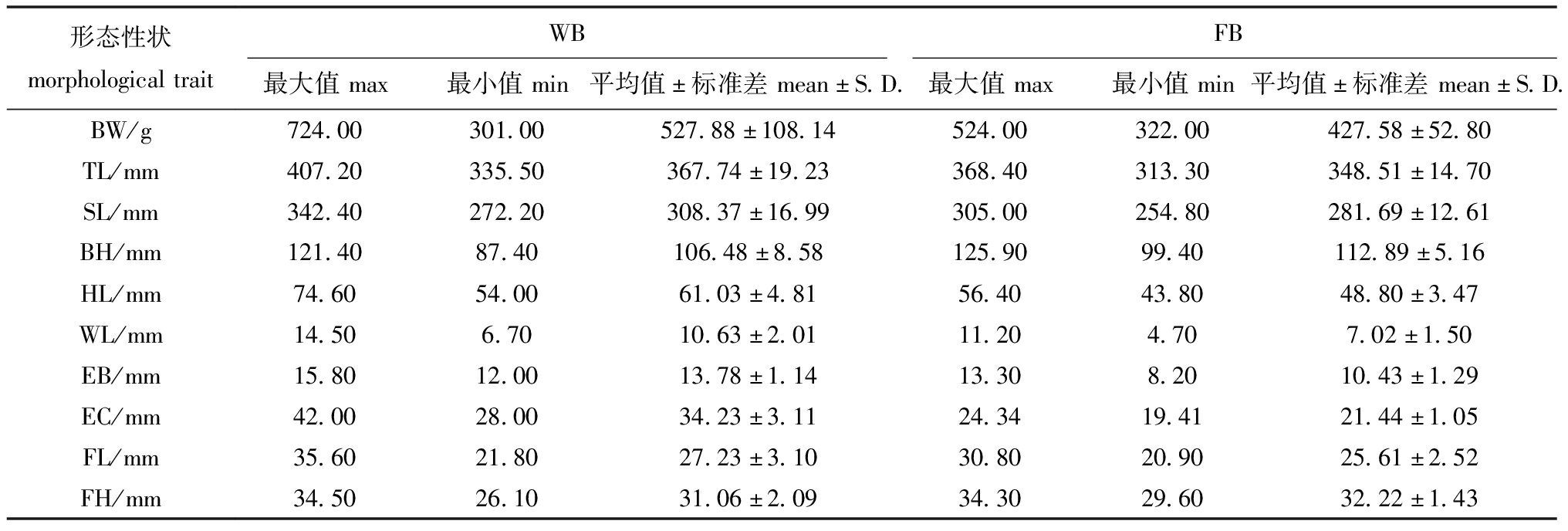
形态性状morphologicaltraitWBFB最大值max最小值min平均值±标准差mean±S.D.最大值max最小值min平均值±标准差mean±S.D.BW/g724.00301.00527.88±108.14524.00322.00427.58±52.80TL/mm407.20335.50367.74±19.23368.40313.30348.51±14.70SL/mm342.40272.20308.37±16.99305.00254.80281.69±12.61BH/mm121.4087.40106.48±8.58125.9099.40112.89±5.16HL/mm74.6054.0061.03±4.8156.4043.8048.80±3.47WL/mm14.506.7010.63±2.0111.204.707.02±1.50EB/mm15.8012.0013.78±1.1413.308.2010.43±1.29EC/mm42.0028.0034.23±3.1124.3419.4121.44±1.05FL/mm35.6021.8027.23±3.1030.8020.9025.61±2.52FH/mm34.5026.1031.06±2.0934.3029.6032.22±1.43
表2 WB和FB群体10项形态性状间的相关系数
Tab.2 Correlation coefficients among ten morphological traits of WB and FB population
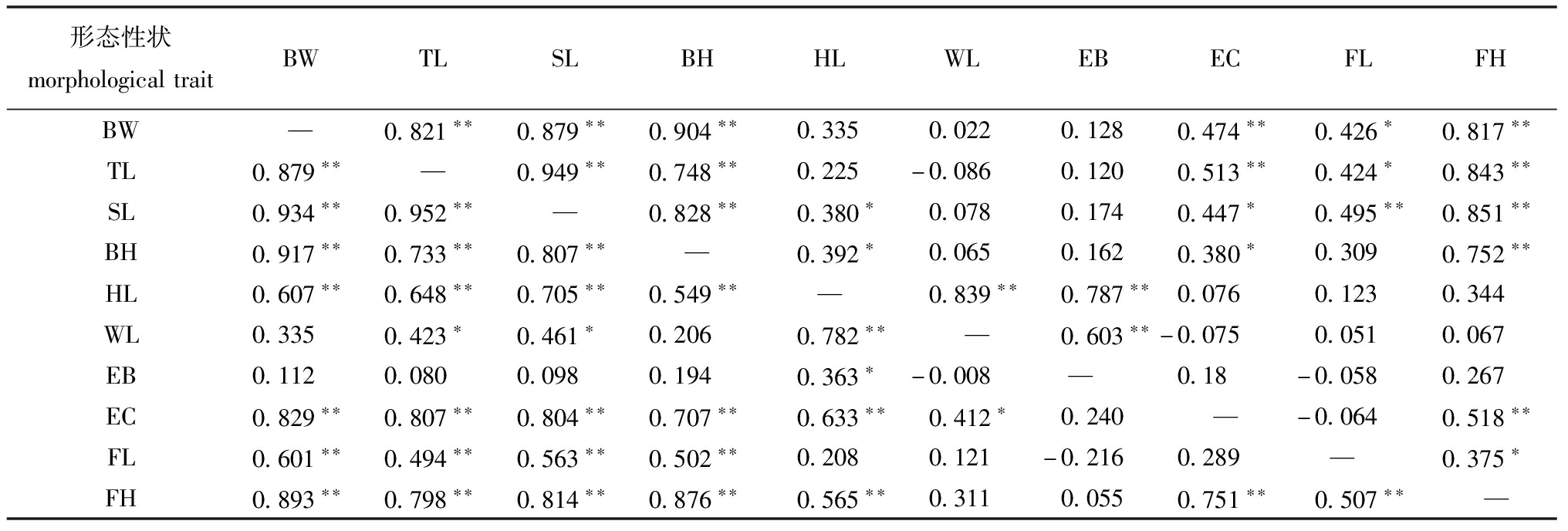
形态性状morphologicaltraitBWTLSLBHHLWLEBECFLFHBW—0.821∗∗0.879∗∗0.904∗∗0.3350.0220.1280.474∗∗0.426∗0.817∗∗TL0.879∗∗—0.949∗∗0.748∗∗0.225-0.0860.1200.513∗∗0.424∗0.843∗∗SL0.934∗∗0.952∗∗—0.828∗∗0.380∗0.0780.1740.447∗0.495∗∗0.851∗∗BH0.917∗∗0.733∗∗0.807∗∗—0.392∗0.0650.1620.380∗0.3090.752∗∗HL0.607∗∗0.648∗∗0.705∗∗0.549∗∗—0.839∗∗0.787∗∗0.0760.1230.344WL0.3350.423∗0.461∗0.2060.782∗∗—0.603∗∗-0.0750.0510.067EB0.1120.0800.0980.1940.363∗-0.008—0.18-0.0580.267EC0.829∗∗0.807∗∗0.804∗∗0.707∗∗0.633∗∗0.412∗0.240—-0.0640.518∗∗FL0.601∗∗0.494∗∗0.563∗∗0.502∗∗0.2080.121-0.2160.289—0.375∗FH0.893∗∗0.798∗∗0.814∗∗0.876∗∗0.565∗∗0.3110.0550.751∗∗0.507∗∗—
注:下三角为长江长春鳊群体,上三角为黑龙江长春鳊群体;*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
Note:The lower triangle is the WB population,the upper triangle is the FB population;* means significant correlations(P<0.05),**means very significant correlations(P<0.01).
2.1.2 比例性状特征 统计分析全长、体高等8项性状与体长性状的比例,同时独立样本t检验结果显示,两个群体多数形态比例性状有显著性差异(P<0.05),其中,WB群体多数形态比例性状高于FB群体,仅全长/体长(TL/SL)、体高/体长(BH/SL)、尾柄长/体长(FH/SL)小于FB群体,但尾柄长/体长(FL/SL)无显著性差异(P>0.05),表明黑龙江长春鳊群体体型偏高,长江群体体型偏长,两个群体形态有较大差异(表3)。
表3 WB和FB群体8项形态比例性状平均值
Tab.3 Average values of eight morphological proportional traits of WB and FB population
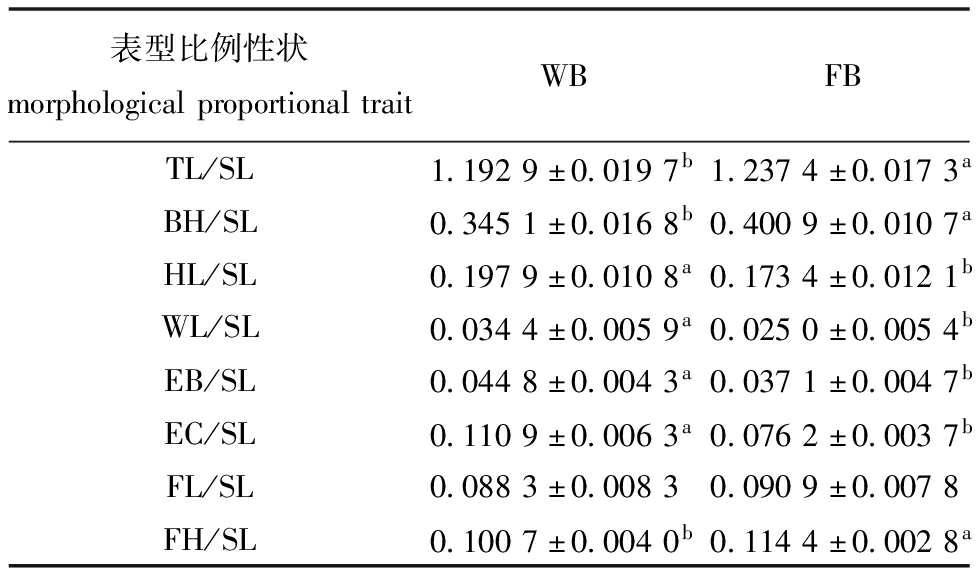
表型比例性状morphologicalproportionaltraitWBFBTL/SL1.1929±0.0197b1.2374±0.0173aBH/SL0.3451±0.0168b0.4009±0.0107aHL/SL0.1979±0.0108a0.1734±0.0121bWL/SL0.0344±0.0059a0.0250±0.0054bEB/SL0.0448±0.0043a0.0371±0.0047bEC/SL0.1109±0.0063a0.0762±0.0037bFL/SL0.0883±0.00830.0909±0.0078FH/SL0.1007±0.0040b0.1144±0.0028a
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column(line) are not significant differences,et sequentia.
2.1.3 形态比例主成分分析 对两个群体的形态比例性状分别进行主成分分析(表4),结果显示:WB群体提取的4个主成分累计贡献率为79.344%,FB群体提取的3个主成分累计贡献率为72.614%。WB群体第一主成分主要显示头部的特征,第二主成分主要显示体高和尾柄高,第三和第四主成分主要显示全长和眼径。FB群体第一主成分主要显示头部的特征,第二主成分主要显示全长和眼径,第三主成分主要显示体高。
表4 WB和FB群体的主成分载荷矩阵以及主成分对总变异的贡献率
Tab.4 Components matrix and contribution of principal components to total variance of WB and FB population
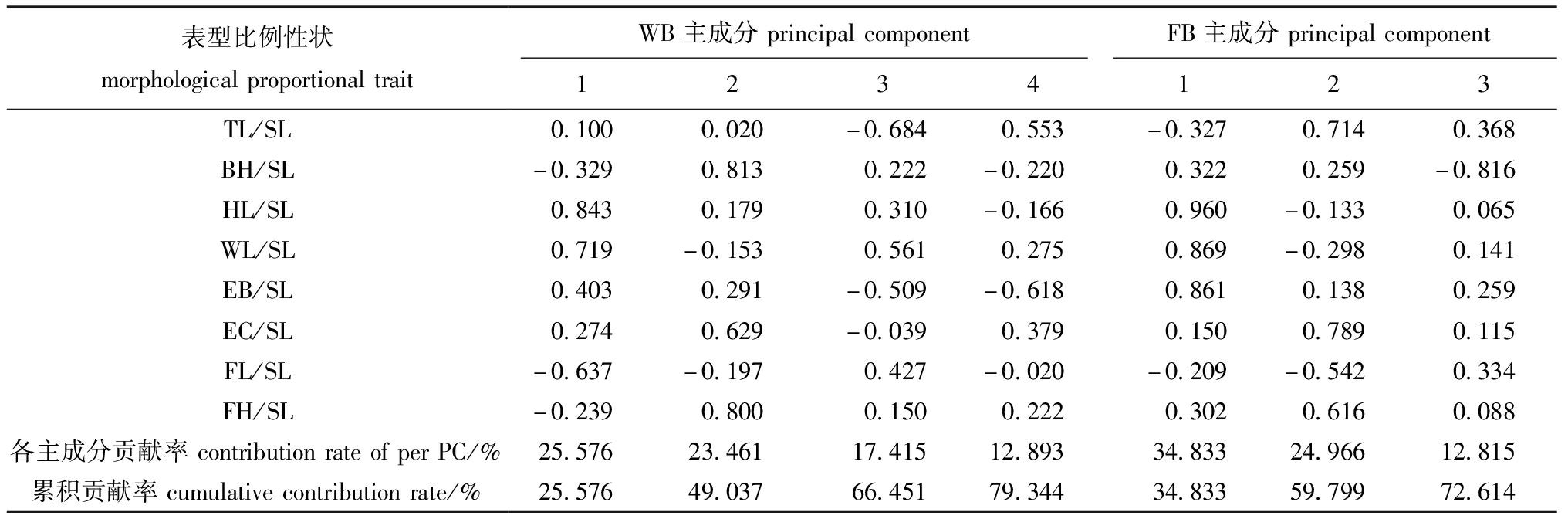
表型比例性状morphologicalproportionaltraitWB主成分principalcomponentFB主成分principalcomponent1234123TL/SL0.1000.020-0.6840.553-0.3270.7140.368BH/SL-0.3290.8130.222-0.2200.3220.259-0.816HL/SL0.8430.1790.310-0.1660.960-0.1330.065WL/SL0.719-0.1530.5610.2750.869-0.2980.141EB/SL0.4030.291-0.509-0.6180.8610.1380.259EC/SL0.2740.629-0.0390.3790.1500.7890.115FL/SL-0.637-0.1970.427-0.020-0.209-0.5420.334FH/SL-0.2390.8000.1500.2220.3020.6160.088各主成分贡献率contributionrateofperPC/%25.57623.46117.41512.89334.83324.96612.815累积贡献率cumulativecontributionrate/%25.57649.03766.45179.34434.83359.79972.614
表5 WB和FB群体与其他养殖鱼类肌肉中基本营养成分比较
Tab.5 Comparison of essential nutrients in the muscle of WB and FB population and other cultured fish
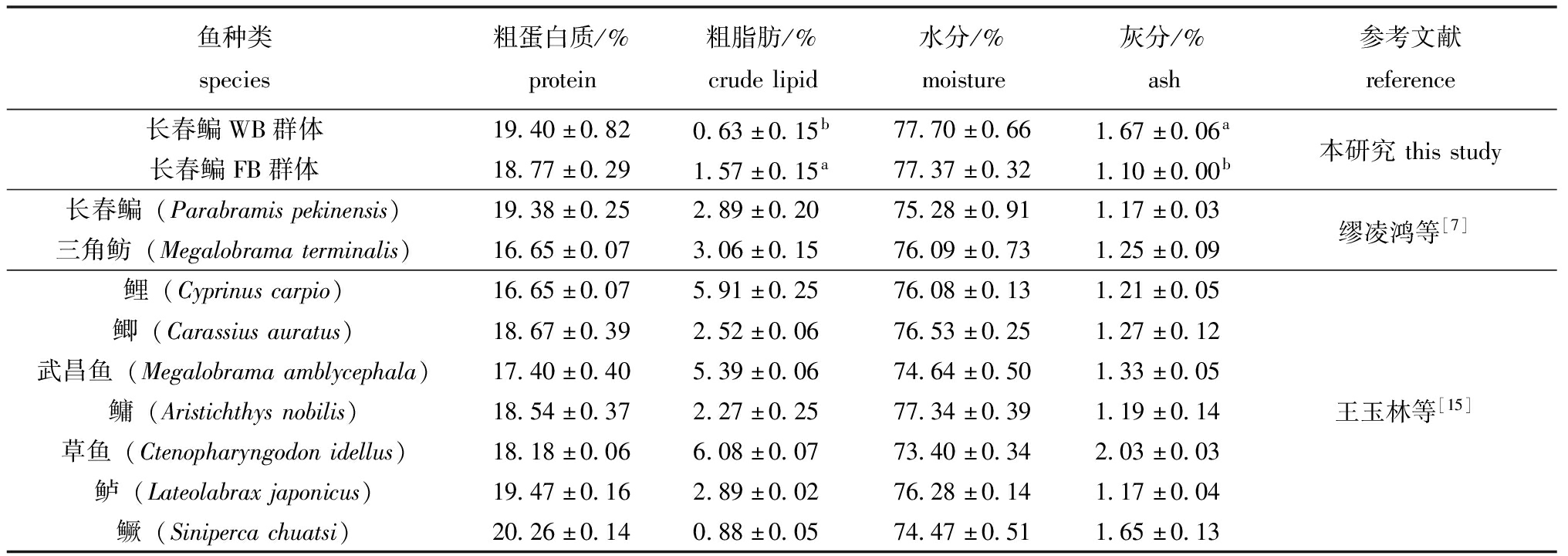
鱼种类species粗蛋白质/%protein粗脂肪/%crudelipid水分/%moisture灰分/%ash参考文献reference长春鳊WB群体19.40±0.820.63±0.15b77.70±0.661.67±0.06a本研究thisstudy长春鳊FB群体18.77±0.291.57±0.15a77.37±0.321.10±0.00b长春鳊(Parabramispekinensis)19.38±0.252.89±0.2075.28±0.911.17±0.03缪凌鸿等[7]三角鲂(Megalobramaterminalis)16.65±0.073.06±0.1576.09±0.731.25±0.09鲤(Cyprinuscarpio)16.65±0.075.91±0.2576.08±0.131.21±0.05鲫(Carassiusauratus)18.67±0.392.52±0.0676.53±0.251.27±0.12武昌鱼(Megalobramaamblycephala)17.40±0.405.39±0.0674.64±0.501.33±0.05鳙(Aristichthysnobilis)18.54±0.372.27±0.2577.34±0.391.19±0.14王玉林等[15]草鱼(Ctenopharyngodonidellus)18.18±0.066.08±0.0773.40±0.342.03±0.03鲈(Lateolabraxjaponicus)19.47±0.162.89±0.0276.28±0.141.17±0.04鳜(Sinipercachuatsi)20.26±0.140.88±0.0574.47±0.511.65±0.13
两个长春鳊群体的PC1与PC2主成分散点图如图1所示,从图1可见,两个主成分能够将长江和黑龙江群体完全区分开来,群体间几乎无重叠,表明群体间具有较大的形态差异。
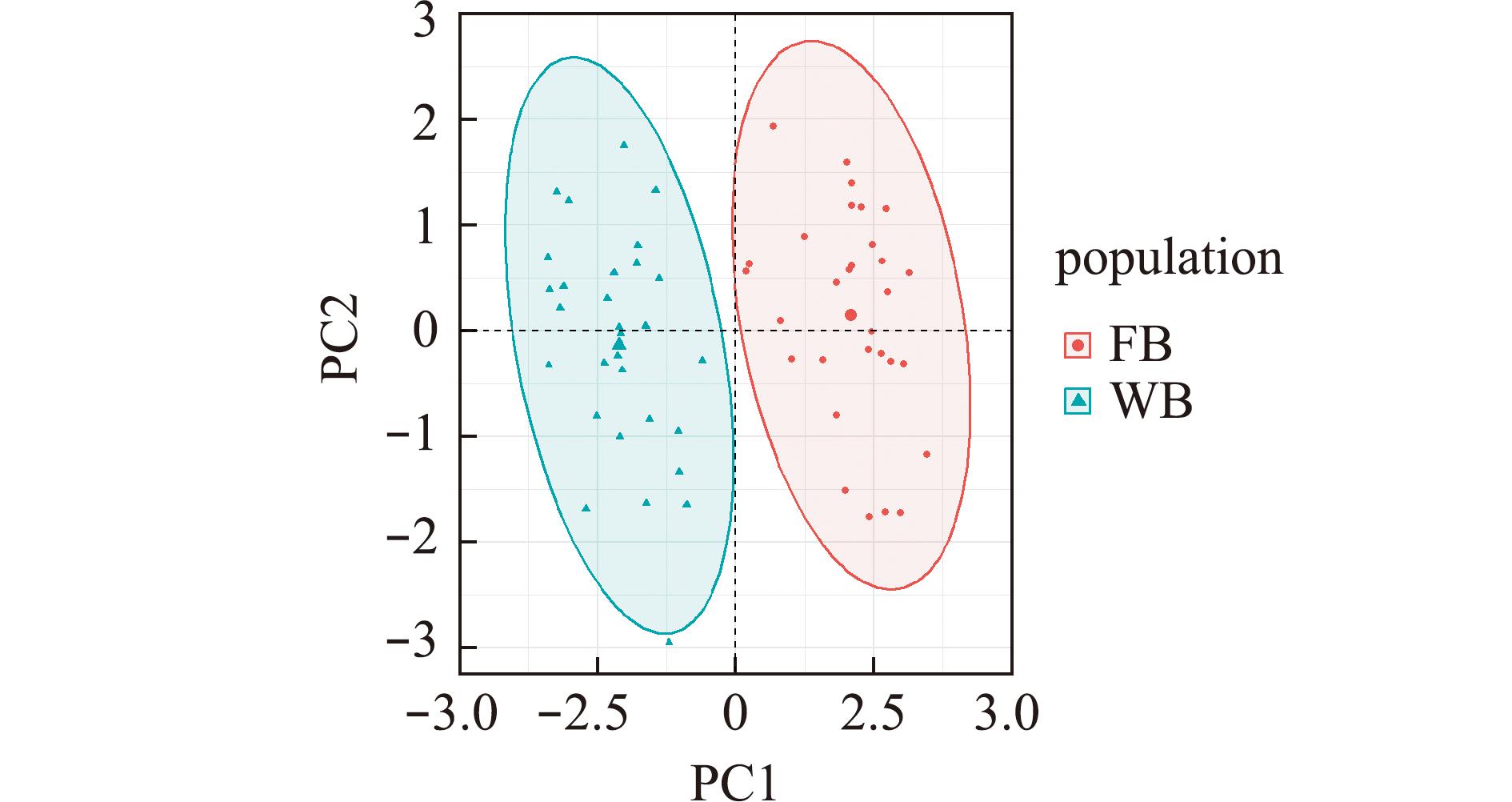
图1 WB和FB群体(PC1与PC2)主成分因子散点图
Fig.1 Scatter plots of principal component factors of WB and FB population (PC1 and PC2)
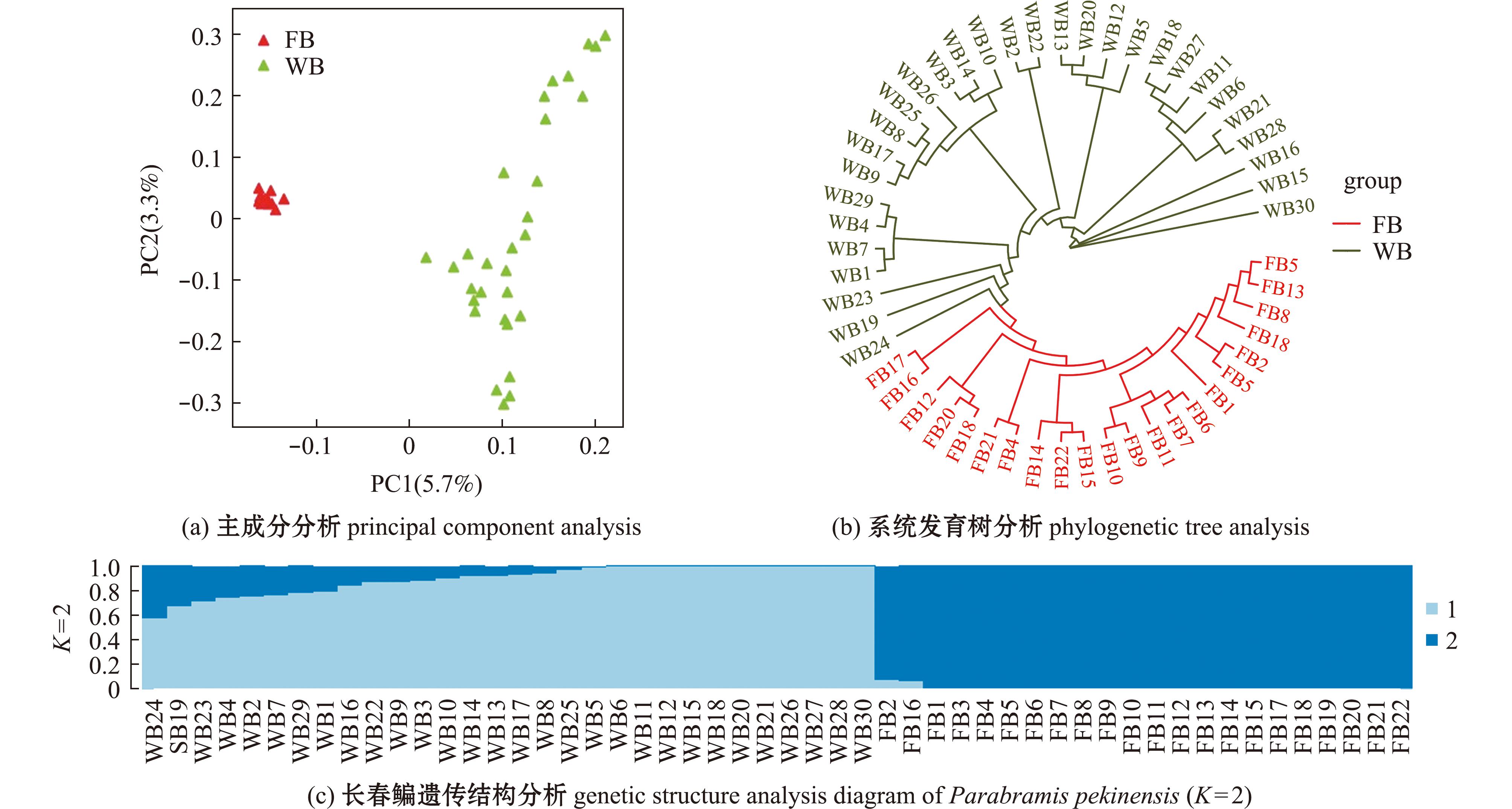
图2 长春鳊群体结构
Fig.2 Population structure of Parabramis pekinensis
2.2 肌肉营养成分
2.2.1 基本营养成分 长春鳊WB群体粗蛋白质含量(19.40%)高于FB群体(18.77%),粗脂肪含量(0.63%)显著低于FB群体(1.57%)(P<0.05)。长春鳊两个群体肌肉中粗蛋白质含量与缪凌鸿等[7]研究的长春鳊粗蛋白质含量相当,均高于三角鲂、鲤(Cyprinus carpio)、鲫(Carassius auratus)、武昌鱼(Megalobrama amblycephala)、鳙(Aristichthys nobilis)、草鱼(Ctenopharyngodon idellus),低于两种肉食性鱼类鲈(Lateolabrax japonicus)和鳜(Siniperca chuatsi)[7,15]。
2.2.2 氨基酸组成及含量 两个群体共检出氨基酸17种,包括7种必需氨基酸(EAA)、2种半必需氨基酸(SEAA)和8种非必需氨基酸(NEAA)(表6)。NEAA中包含4种鲜味氨基酸(DAA)Asp、Glu、Gly和Ala,占总氨基酸的37.8%~39.7%;Glu、Asp、Leu和Lys含量较高,占总氨基酸的44.7%~46.1%;Cys、Met、Tyr和His含量较低,占总氨基酸的8.30%~9.50%;含量最高的EAA均为Lys(1.70%、1.48%)和Leu(1.39%、1.22%);含量最高的NEAA均为Glu (2.51%、2.13%)和Asp (1.75%、1.58%);WB群体的总氨基酸(TAA)、EAA、SEAA、NEAA、DAA均显著高于FB群体。
表6 WB和FB群体肌肉氨基酸组成及含量 Tab.6 Muscle amino acid composition and content of WB and FB population g/100 g,湿质量
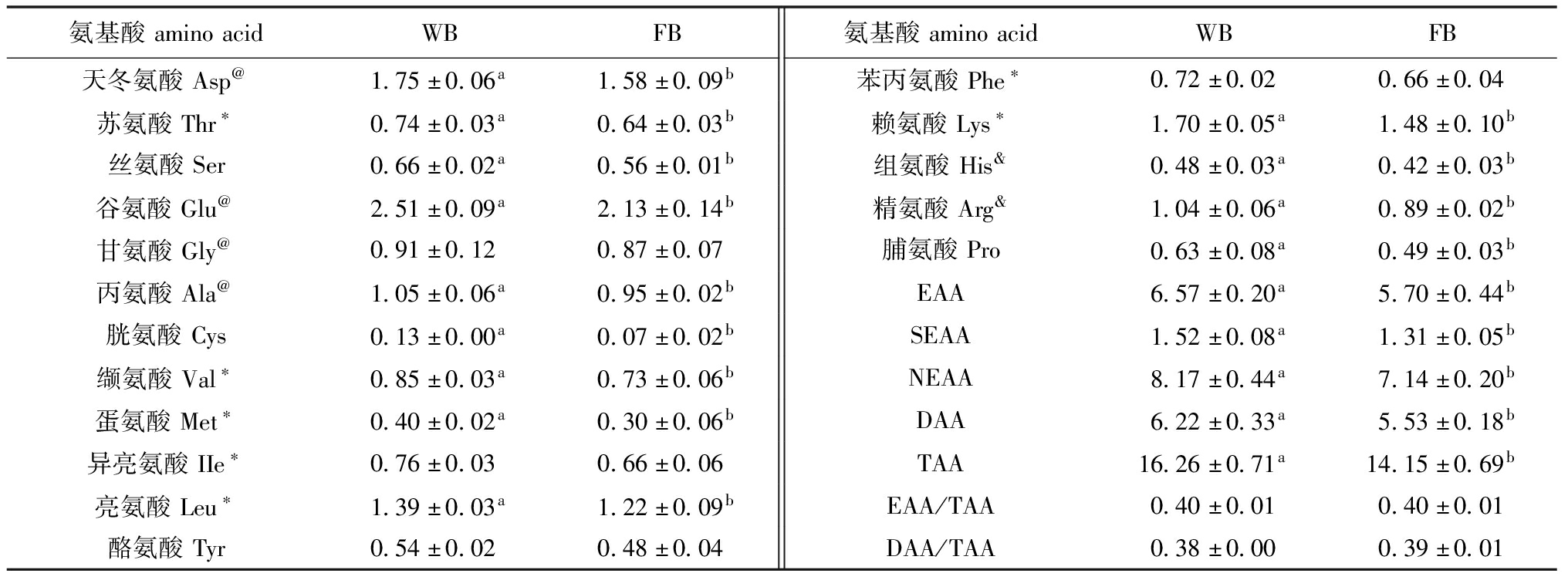
氨基酸aminoacidWBFB氨基酸aminoacidWBFB天冬氨酸Asp@1.75±0.06a1.58±0.09b苯丙氨酸Phe∗0.72±0.020.66±0.04苏氨酸Thr∗0.74±0.03a0.64±0.03b赖氨酸Lys∗1.70±0.05a1.48±0.10b丝氨酸Ser0.66±0.02a0.56±0.01b组氨酸His&0.48±0.03a0.42±0.03b谷氨酸Glu@2.51±0.09a2.13±0.14b精氨酸Arg&1.04±0.06a0.89±0.02b甘氨酸Gly@0.91±0.120.87±0.07脯氨酸Pro0.63±0.08a0.49±0.03b丙氨酸Ala@1.05±0.06a0.95±0.02bEAA6.57±0.20a5.70±0.44b胱氨酸Cys0.13±0.00a0.07±0.02bSEAA1.52±0.08a1.31±0.05b缬氨酸Val∗0.85±0.03a0.73±0.06bNEAA8.17±0.44a7.14±0.20b蛋氨酸Met∗0.40±0.02a0.30±0.06bDAA6.22±0.33a5.53±0.18b异亮氨酸IIe∗0.76±0.030.66±0.06TAA16.26±0.71a14.15±0.69b亮氨酸Leu∗1.39±0.03a1.22±0.09bEAA/TAA0.40±0.010.40±0.01酪氨酸Tyr0.54±0.020.48±0.04DAA/TAA0.38±0.000.39±0.01
注:*表示必需氨基酸;@表示鲜味氨基酸;&表示半必需氨基酸。EAA—总必需氨基酸;SEAA—总半必需氨基酸;NEAA—总非必需氨基酸;DAA—总鲜味氨基酸;TAA—总氨基酸。
Note:* indicates essential amino acids;@ indicates flavor amino acids;&show semi-essential amino acids.EAA—total essential amino acid;SEAA—total semi-essential amino acid;NEAA—total non-essential amino acid;DAA—total flavorful amino acid;TAA—total amino acid.
2.2.3 脂肪酸组成及含量 在长春鳊两个群体中共检出脂肪酸24种(表7),其中包括9种饱和脂肪酸(SFA)、5种单不饱和脂肪酸(MUFA)和10种多不饱和脂肪酸(PUFA)(表8)。WB群体及FB群体饱和脂肪酸总含量分别为183.91、314.61 mg/100 g;单不饱和脂肪酸含量分别为181.94、409.95 mg/100 g;多不饱和脂肪酸总含量分别为216.85、392.62 mg/100 g;n-3 多不饱和脂肪酸(PUFA)的含量分别为57.91、232.98 mg/100 g;n-6多不饱和脂肪酸(PUFA)的含量分别为152.39、149.95 mg/100 g。两个群体间C20:3n6、C18:2n6c、C22:1n9、C18:0、C24:0、C22:6n3脂肪酸含量无显著性差异,其他脂肪酸含量有显著性差异(P<0.05),WB群体的SFA、MUFA、PUFA含量均显著低于FB群体(P<0.05)。
表7 WB和FB群体肌肉脂肪酸组成及含量 Tab.7 Composition and content of fatty acids in muscle of WB and FB population mg/100 g,湿质量
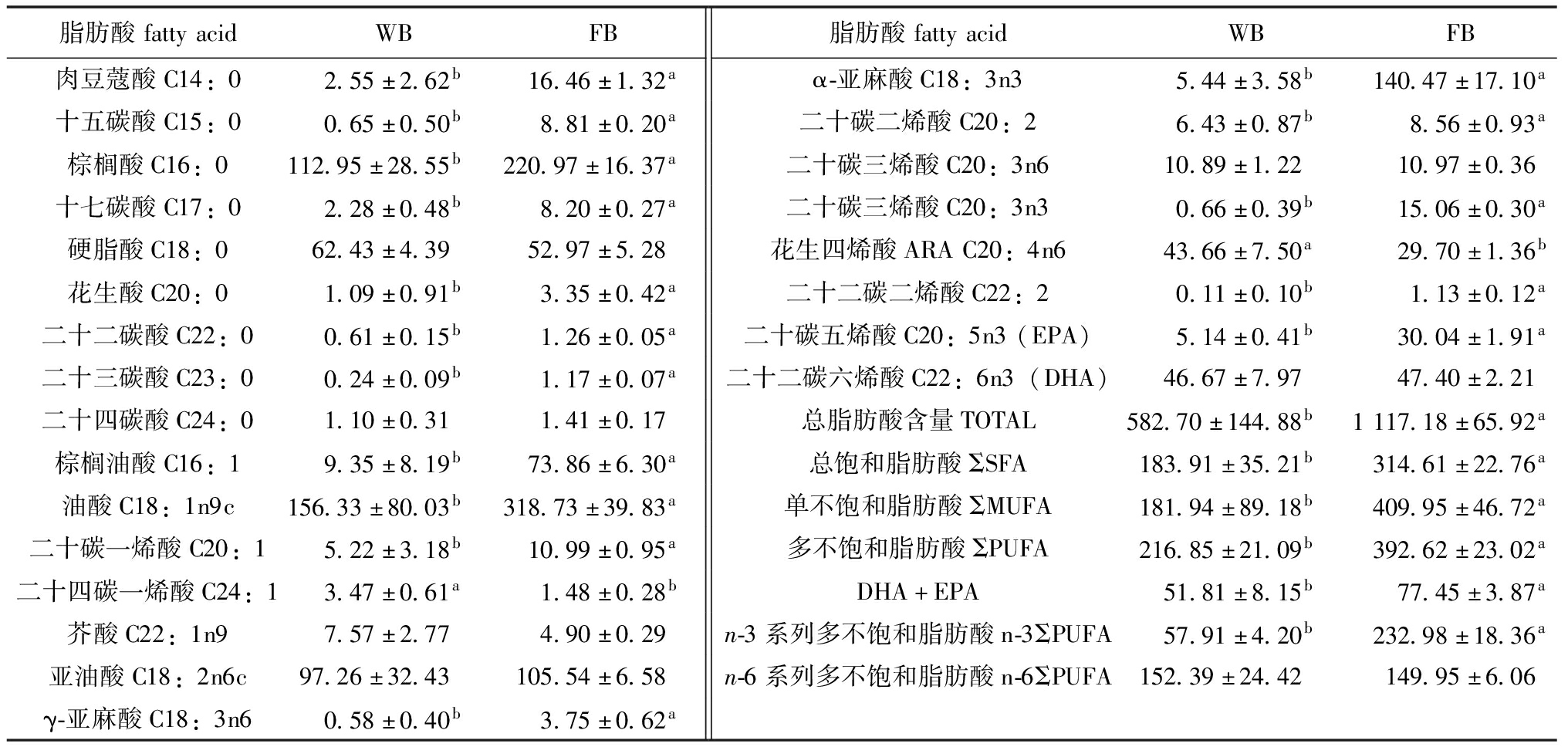
脂肪酸fattyacidWBFB脂肪酸fattyacidWBFB肉豆蔻酸C14:02.55±2.62b16.46±1.32aα-亚麻酸C18:3n35.44±3.58b140.47±17.10a十五碳酸C15:00.65±0.50b8.81±0.20a二十碳二烯酸C20:26.43±0.87b8.56±0.93a棕榈酸C16:0112.95±28.55b220.97±16.37a二十碳三烯酸C20:3n610.89±1.2210.97±0.36十七碳酸C17:02.28±0.48b8.20±0.27a二十碳三烯酸C20:3n30.66±0.39b15.06±0.30a硬脂酸C18:062.43±4.3952.97±5.28花生四烯酸ARAC20:4n643.66±7.50a29.70±1.36b花生酸C20:01.09±0.91b3.35±0.42a二十二碳二烯酸C22:20.11±0.10b1.13±0.12a二十二碳酸C22:00.61±0.15b1.26±0.05a二十碳五烯酸C20:5n3(EPA)5.14±0.41b30.04±1.91a二十三碳酸C23:00.24±0.09b1.17±0.07a二十二碳六烯酸C22:6n3(DHA)46.67±7.9747.40±2.21二十四碳酸C24:01.10±0.311.41±0.17总脂肪酸含量TOTAL582.70±144.88b1117.18±65.92a棕榈油酸C16:19.35±8.19b73.86±6.30a总饱和脂肪酸ΣSFA183.91±35.21b314.61±22.76a油酸C18:1n9c156.33±80.03b318.73±39.83a单不饱和脂肪酸ΣMUFA181.94±89.18b409.95±46.72a二十碳一烯酸C20:15.22±3.18b10.99±0.95a多不饱和脂肪酸ΣPUFA216.85±21.09b392.62±23.02a二十四碳一烯酸C24:13.47±0.61a1.48±0.28bDHA+EPA51.81±8.15b77.45±3.87a芥酸C22:1n97.57±2.774.90±0.29n-3系列多不饱和脂肪酸n-3ΣPUFA57.91±4.20b232.98±18.36a亚油酸C18:2n6c97.26±32.43105.54±6.58n-6系列多不饱和脂肪酸n-6ΣPUFA152.39±24.42149.95±6.06γ-亚麻酸C18:3n60.58±0.40b3.75±0.62a
表8 WB和FB群体遗传多样性参数统计
Tab.8 Population genetic diversity parameters statistics of WB and FB population
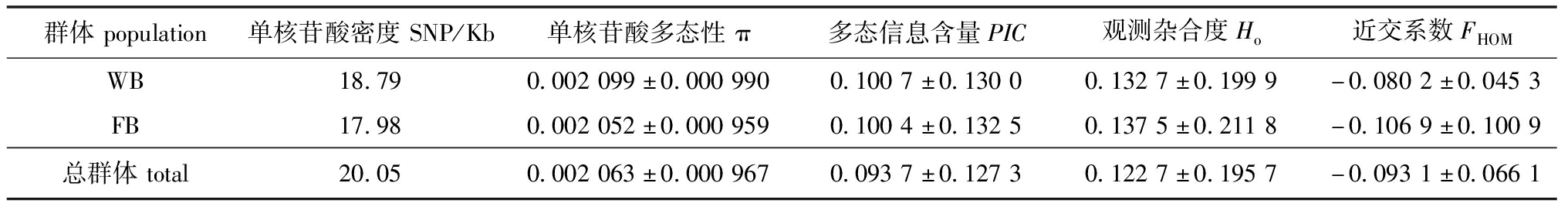
群体population单核苷酸密度SNP/Kb单核苷酸多态性π多态信息含量PIC观测杂合度Ho近交系数FHOMWB18.790.002099±0.0009900.1007±0.13000.1327±0.1999-0.0802±0.0453FB17.980.002052±0.0009590.1004±0.13250.1375±0.2118-0.1069±0.1009总群体total20.050.002063±0.0009670.0937±0.12730.1227±0.1957-0.0931±0.0661
2.3 遗传多样性和遗传结构分析
2.3.1 遗传多样性指标 基于长春鳊52个样本(FB群体剔除8个质检不合格样本)的全基因组重测序筛选SNPs,结果52个样本的SNP标记密度为20.05 SNP/Kb,单核苷酸多态性(π)为0.002 063,多态信息含量(PIC)为0.093 7,观测杂合度(Ho)为0.122 7。WB群体的π和PIC略高于FB群体,而Ho略低于FB群体,两个群体均处于低度多态水平(PIC<0.25)。基于基因组杂合度计算的近交系数(FHOM)分别为-0.080 2和-0.106 9,两个群体均存在杂合子过剩的现象。
两个群体间遗传分化系数(Fst)为0.030 5,遗传距离(DR)为0.031,基因流(Nm)为7.942 8。表明群体间存在着广泛的基因交换,也可能是苗种交换导致的。
2.3.2 群体遗传结构 基于52个长春鳊样本全基因组SNPs绘制主成分分析图和系统发育树,以评估群体遗传结构(图1)。PCA聚类图显示,FB群体相对集中,表明黑龙江群体种质来源较为狭窄;WB群体较为分散,表明长江群体建群种质资源比较丰富(图1(a))。基于个体基因组水平的系统发育树,将群体分为2个分支,第1支主要由FB组成,第2支主要由WB组成(图1(b))。群体遗传结构分析显示FB群体种源比较单一,WB群体部分个体为杂合个体(图1(c))。
3 讨论
3.1 长春鳊两个不同地域群体间形态差异
群体(population)通常指同一物种具有相同形态特征的类群,鱼类群体间的变异可以为其群体结构的划分和群体鉴定提供基础资料和依据[16]。形态学方法至今仍是判明群体间差异的主要手段[17]。目前,框架性状度量评价方法虽已广泛应用,但是传统形态学方法并未过时,且有时能起到更好的效果[18]。由于形态指标众多,使得物种形态的差异程度度量复杂,主成分分析法可以更直观地了解形态差异程度,而被引入形态差异研究,并得到广泛运用[19-20]。
形态差异由基因决定并与环境密切相关[21],本研究中两个长春鳊群体所处地理位置环境差距较大,且t检验结果显示两个群体在形态上有较大差异,可以推测造成这种差异与环境相关。宋文等[22] 在探讨4个地理群体的4种鲂属鱼类种内及种间形态差异时,同样发现在不同地理群体间有明显的形态差异。本研究中,主成分分析显示,WB群体在尾柄高上有较大变异,而FB群体在眼径和眼间距上有更明显的变异,这些差异可能反映了两个群体在生活习性或生长环境上的差异,两个群体地理分布不同,所受到的环境因子影响不同,这可能导致了形态上的差异。
3.2 肌肉营养成分
肌肉是鱼体主要的可食部分,基本营养成分包括粗蛋白质、粗脂肪、灰分和水分。其中蛋白质是生命的物质基础,其含量水平是衡量营养价值的关键。本研究中的两个长春鳊群体肌肉蛋白质含量并无显著性差异,平均含量约为19%,高于鲤、鲫、武昌鱼等6种常见的鲤科鱼类,有较高的蛋白质水平。脂肪是动物生命活动中能量的主要来源,在代谢中起着重要作用[23]。本研究中黑龙江群体脂肪含量显著高于长江群体(P<0.05),推测可能与生长环境、食物来源有关。一方面黑龙江长春鳊群体生长温度低于长江群体,代谢能力小于长江群体,所消耗的能量要低于长江群体,从而有更多的脂肪储存起来;另一方面,黑龙江群体需要储存更多的脂肪来维持正常的生理活动,从而脂肪含量相对较高。肌肉中适宜的脂肪含量也能够为肉质增加鲜嫩的口感,长春鳊脂肪含量与鲤、鲫、武昌鱼和草鱼等常见淡水鱼类相比偏低[15],可见该鱼是一种高蛋白、低脂肪的淡水鱼类。
水产食品中氨基酸营养组成在很大程度上决定了蛋白质营养水平,鱼类肌肉的美味程度与其鲜味氨基酸的组成和含量密切相关[24-25]。本研究中,两种长春鳊肌肉中谷氨酸含量最高(2.13%~2.51%),其次为天冬氨酸(1.58%~1.75%)和赖氨酸(1.48%~1.70%),这与三角鲤(Cyprinus multitaeniata)[26]、草鱼[27]肌肉氨基酸含量高低排序一致。长春鳊长江和黑龙江养殖群体肌肉中鲜味氨基酸含量分别占氨基酸总量的38%和39%,表明长春鳊的鲜味氨基酸比较稳定且有较高的味觉体验。根据FAO/WHO的氨基酸理想模式,质量较好的蛋白质组成氨基酸EAA/TAA为40%左右,EAA/NEAA为60%以上。本研究中,长江和黑龙江养殖群体肌肉的EAA/TAA分别为40.41%和40.28%,EAA/NEAA分别为80.42%和79.83%,符合FAO/WHO的标准模式,说明两个养殖群体的蛋白质氨基酸平衡均比较好,具有较高的营养价值和较好的鱼肉风味。
脂肪酸是维持细胞正常生理功能必不可少的营养物质。饱和脂肪酸(SFA)易导致血清胆固醇的升高,不饱和脂肪酸(MUFA和PUFA)具有降低胆固醇、甘油酯的作用[28]。本研究中,黑龙江群体的不饱和脂肪酸含量显著大于长江群体(P<0.05),因黑龙江群体生活水域平均温度较低,造成肌纤维更加紧密,为了维持细胞流动性,不饱和脂肪酸浓度在较低温度下会适量增加[29]。根据联合国粮农组织和世界卫生组织提出的脂肪酸平衡要求,膳食中SFA∶MUFA∶PUFA=1∶1∶1最有助于人体营养均衡[30],长江养殖群体SFA∶MUFA∶PUFA=1.8∶1.8∶2.1,接近1∶1∶1,黑龙江养殖群体SFA∶MUFA∶PUFA=3.1∶4.1∶3.9接近3∶4∶4,据此推断长春鳊的脂肪酸平衡较好,且长江养殖群体要优于黑龙江养殖群体;FAO/WHO的膳食标准认为,Σ(n-3)/Σ(n-6)PUFA比值应高于0.1~0.2,且高于此值的脂肪酸组成具有降低血脂及预防心血管疾病的功能,本研究中的两个长春鳊群体均高于此推荐比值,说明其具有优质的脂肪酸组成和健康食品价值。结果表明,长江与黑龙江群体长春鳊脂肪酸组成差异不大,但含量有一定差异,且均含有较高的营养价值。
3.3 长春鳊遗传结构分析
遗传多样性是生物多样性的核心,物种的遗传多样性越高对环境的适应就越强。多态信息含量(PIC)主要是衡量群体基因位点多态性的重要指标,它能够反映群体的遗传变异程度,并分为低度多态性位点(PIC<0.25)、中度多态性位点(0.25<PIC≤0.5)和高度多态性位点(PIC>0.5)[31]。本研究中基于全基因组SNP标记评估长春鳊长江和黑龙江群体多态信息含量(PIC)分别为0.100 7、0.100 4,表明群体处于低度多态水平;群体间遗传分化系数(Fst)为0.030 5,表明两个群体未分化,可能来源于相似的种源,不同养殖场之间存在苗种规模化流通,长江群体的苗种可能在北方地区进行养殖。目前,黑龙江流域长春鳊资源开发较少,尚未建立选育种群,加之野生的长春鳊离水易死,培育出的亲本性情暴躁,注射催产剂后应激反应强烈,产后受伤程度较高,返塘死亡率达50%[2],故诸多因素限制了对长春鳊野生群体的开发,目前仅有滨江水产良种场能大规模提供种苗,推测全国各地养殖种苗来源于长江群体。
目前,对长春鳊遗传结构的研究较少,张倩倩等[32]用18个团头鲂微卫星标记分析了长江江苏靖江段长春鳊群体的遗传多样性,结果显示,群体处于高度多态水平(PIC=0.517 0>0.5)。而本研究中使用全基因组SNP标记的评估结果显示,长江和黑龙江养殖群体均处于低度多态水平(PIC<0.25),这可能是源于所使用的标记类型不同。微卫星标记在筛选的过程中,剔除了大量单态或低度多态标记,在用于群体分析中选取等位基因大于4的标记更有利于群体遗传结构的评估[33];而SNP标记是基于全基因组中单个核苷酸的变异,包括转换和颠换两种类型[34],能够更全面地评估群体遗传结构。张芹等[35]采用18个团头鲂微卫星标记分析两个团头鲂的群体遗传多样性,平均PIC为0.624;而陈柏湘等[36]采用5个团头鲂低氧耐受相关的SNP标记分析团头鲂低氧耐受群体和敏感群体,平均PIC分别为0.311和0.265,从侧面反映了微卫星标记和SNP标记评估群体结果的差异。进一步研究将基于全基因组进行长春鳊微卫星标记的开发,从不同层次评价长春鳊的遗传结构,以便更好地开发利用。
4 结论
1)长江和黑龙江流域的2个长春鳊养殖群体在外部形态上有较大差异,黑龙江群体脂肪含量显著高于长江群体,可能与生长环境、食物来源有关。
2)遗传结构分析显示,2个群体间有广泛的基因交换,推测黑龙江养殖群体的种源来自长江群体。
3)目前长春鳊的野生资源开发利用较低,急需开展长江、黑龙江、珠江等主要水系长春鳊的种质资源调查和评估,为种质资源的保护和合理利用提供理论基础。
[1] 李建林,唐永凯,俞菊华.用RAPD及mtDNA D-loop区序列揭示长江下游长春鳊遗传多样性[J].上海水产大学学报,2008,17(2):145-151.LI J L,TANG Y K,YU J H.Genetic diversity inParabramis pekinensis from the lower reaches of the Yangtze River from RAPD analysis and mitochondrial D-loop sequences[J].Journal of Shanghai Ocean University,2008,17(2):145-151.(in Chinese)
[2] 朱爱奇,展翠芬,朱爱琴,等.长春鳊苗种规模化繁育技术研究[J].水产养殖,2017,38(12):1-3.ZHU A Q,ZHAN C F,ZHU A Q,et al.Research on large-scale breeding technology of juvenile Parabramis pekinensis[J].Journal of Aquaculture,2017,38(12):1-3.(in Chinese)
[3] 陶桂庆,徐正东,展翠芬.长春鳊池塘主养示范试验[J].科学养鱼,2015(4):21.TAO G Q,XU Z D,ZHAN C F.Demonstration test of Parabramis pekinensis pond main culture[J].Scientific Fish Farming,2015(4):21.(in Chinese)
[4] 王洪波,孙志鹏,郑先虎,等.黑龙江野生长春鳊生物学特征与人工繁育技术[J].黑龙江水产,2017(6):15-16.WANG H B,SUN Z P,ZHENG X H,et al.Biological characteristics and artificial breeding techniques of wild Parabramis pekinensis in Heilongjiang[J].Northern Chinese Fisheries,2017(6):15-16.(in Chinese)
[5] 顾海龙,冯亚明,杨智景,等.长春鳊性腺发育组织学观察[J].水产学杂志,2022,35(3):44-50.GU H L,FENG Y M,YANG Z J,et al.Histological observation of gonadal development of white bream Parabramis pekinensis[J].Chinese Journal of Fisheries,2022,35(3):44-50.(in Chinese)
[6] 刘襄河,孔江红,李修峰.长春鳊的生物学特性及人工养殖技术[J].湖北农业科学,2017,56(9):1699-1701.LIU X H,KONG J H,LI X F.Biological characteristics and artificial feeding technique of white Amur bream (Parabramis pekinensis)[J].Hubei Agricultural Sciences,2017,56(9):1699-1701.(in Chinese)
[7] 缪凌鸿,戈贤平,刘波,等.三角鲂和长春鳊肌肉营养成分分析与品质评价[J].动物学杂志,2013,48(1):87-94.MIAO L H,GE X P,LIU B,et al.Nutritive quality and nutritional component in the muscle of Megalobrama tarminalis and Parabramis pekinensis[J].Chinese Journal of Comparative Medicine,2013,48(1):87-94.(in Chinese)
[8] LI H.Aligning sequence reads,clone se quences and assembly contigs with BWA-MEM[J].arXiv:Genomics,2013:1-3.
[9] LI H.A statistical framework for SNP calling,mutation discovery,association mapping and population genetical parameter estimation from sequencing data[J].Bioinformatics,2011,27(21):2987-2993.
[10] 孙志鹏,曹顶臣,裴玥,等.野生和养殖梭鲈肌肉营养组成分析与评价[J].水产学杂志,2020,33(4):15-22.SUN Z P,CAO D C,PEI Y,et al.Analysis and evaluation of nutritional composition in muscle of wild and farmed pikeperch Sander lucioperca[J].Chinese Journal of Fisheries,2020,33(4):15-22.(in Chinese)
[11] PURCELL S,NEALE B,TODD-BROWN K,et al.PLINK:a tool set for whole-genome association and population-based linkage analyses[J].American Journal of Human Genetics,2007,81(3):559-575.
[12] PARADIS E,CLAUDE J,STRIMMER K.APE:analyses of phylogenetics and evolution in R language[J].Bioinformatics,2004,20(2):289-290.
[13] PATTERSON N,PRICE A L,REICH D.Population structure and eigenanalysis[J].PLoS Genetics,2006,2(12):e190.
[14] ALEXANDER D H,NOVEMBRE J,LANGE K.Fast model-based estimation of ancestry in unrelated individuals[J].Genome Research,2009,19(9):1655-1664.
[15] 王玉林,林婉玲,李来好,等.4目13种淡水鱼肌肉基本营养成分分析[J].食品工业科技,2019,40(11):277-283.WANG Y L,LIN W L,LI L H,et al.Basic nutrient composition analysis of freshwater fish muscles based on four orders and thirteen species[J].Science and Technology of Food Industry,2019,40(11):277-283.(in Chinese)
[16] 杨慧荣,欧阳徘徊,李桂峰,等.珠江流域3个野生大眼鳜群体的形态差异[J].中国水产科学,2016,23(2):447-457.YANG H R,OUYANG P H,LI G F,et al.Morphological differentiation among three wild populations of Siniperca kneri in Pearl River[J].Journal of Fishery Sciences of China,2016,23(2):447-457.(in Chinese)
[17] 陈杰,李福贵,黄创新,等.不同鳊鲂属鱼类群体的形态差异分析[J].上海海洋大学学报,2014,23(3):388-394.CHEN J,LI F G,HUANG C X,et al.Morphological variations of Genera Parabramis and Megalobrama teleost populations[J].Journal of Shanghai Ocean University,2014,23(3):388-394.(in Chinese)
[18] 徐丹丹,王志坚,王永明,等.中华沙鳅和宽体沙鳅形态差异及其物种有效性分析[J].水生生物学报,2017,41(4):827-834.XU D D,WANG Z J,WANG Y M,et al.Morphological variation between sinibotia superciliaris and Sinibotia Reevesae with notes on their validities[J].Acta Hydrobiologica Sinica,2017,41(4):827-834.(in Chinese)
[19] 吴水清,罗辉玉,张哲,等.不同月龄云龙石斑鱼表型性状的主成分与通径分析[J].大连海洋大学学报,2019,34(5):680-687.WU Q S,LUO H Y,ZHANG Z,et al.Principal component and path analysis of phenotypic traits of Yunlong grouper with different month ages[J].Journal of Dalian Ocean University,2019,34(5):680-687.(in Chinese)
[20] 蔡鸣俊,张敏莹,曾青兰,等.鲂属鱼类形态度量学研究[J].水生生物学报,2001,25(6):631-635.CAI M J,ZHANG M Y,ZENG Q L,et al.A Study on morphometrics of the genus Megalobrama[J].Acta Hydrobiologica Sinica,2001,25(6):631-635.(in Chinese)
[21] SALINI J P,MILTON D A,RAHMAN M J,et al.Allozyme and morphological variation throughout the geographic range of the tropical shad,hilsa Tenualosa ilisha[J].Fisheries Research,2004,66(1):53-69.
[22] 宋文,王艺舟,祝东梅,等.鲂属鱼类形态差异分析[J].淡水渔业,2013,43(3):21-27.SONG W,WANG Y Z,ZHU D M,et al.Morphological variations among the genus Megalobrama[J].Freshwater Fisheries,2013,43(3):21-27.(in Chinese)
[23] 黄海,杨宁,张希.淡水石斑鱼含肉率和肌肉营养成分分析[J].水产科技情报,2012,39(2):87-91.HUANG H,YANG N,ZHANG X.Analysis on meat rate and nutritional composition in muscle of Cichlasoma managuense[J].Fisheries Science &Technology Information,2012,39(2):87-91.(in Chinese)
[24] 王峰,雷霁霖.工厂化循环水养殖模式放养密度对半滑舌鳎成鱼生长和肌肉营养成分的影响[J].中国工程科学,2015,17(1):19-26.WANG F,LEI J L.Effect of stocking density on growth and quality in muscles of Cynoglossus semilaevis Günther adult fish in industrial recirculating aquaculture[J].Strategic Study of CAE,2015,17(1):19-26.(in Chinese)
[25] 蒋文枰,程顺,贾永义,等.两种养殖模式太湖鲂鲌肌肉营养特性及食用品质的比较分析[J].水产学杂志,2022,35(6):30-36.JIANG W P,CHENG S,JIA Y Y,et al.Comparative analysis of muscle nutritional characteristics and edible quality of (Culter alburnus♀ ×Megalobrama terminalis♂) under two culture models[J].Chinese Journal of Fisheries,2022,35(6):30-36.(in Chinese)
[26] 赵何勇,温守欧,韦玲静,等.三角鲤肌肉营养成分及品质评价[J].养殖与饲料,2024,23(3):1-6.ZHAO H Y,WEN S O,WEI L J,et al.Nutrient composition and quality evaluation of Cyprinus multitaeniata[J].Animals Breeding and Feed,2024,23(3):1-6.(in Chinese)
[27] 程辉辉,谢从新,李大鹏,等.种青养鱼模式下的草鱼肌肉营养成分和品质特性[J].水产学报,2016,40(7):1050-1059.CHENG H H,XIE C X,LI D P,et al.The study of muscular nutritional components and fish quality of grass carp (Ctenopharyngodon idella) in ecological model of cultivating grass carp with grass[J].Journal of Fisheries of China,2016,40(7):1050-1059.(in Chinese)
[28] 何周玲,刘少军,肖军,等.翘嘴鳊及其亲本肌肉营养成分分析[J].水产学报,2014,38(10):1786-1792.HE Z L,LIU S J,XIAO J,et al.Muscle nutrients of the backcross progeny of female diploid F1 hybrid (blunt snout bream × topmouth culter) × male blunt snout bream and its parents[J].Journal of Fisheries of China,2014,38(10):1786-1792.(in Chinese)
[29] 葛一笑,邹昊博,夏邦华,等.黑龙江水域5个群体翘嘴鲌肌肉质构及营养成分比较分析[J].大连海洋大学学报,2022,37(6):977-984.GE Y X,ZOU H B,XIA B H,et al.Comparative analysis of muscular texture and nutritional compositions in five populations of topmouth Culter alburnus in Heilongjiang River[J].Journal of Dalian Ocean University,2022,37(6):977-984.(in Chinese)
[30] 苏宜香,郭艳.膳食脂肪酸构成及适宜推荐比值的研究概况[J].中国油脂,2003,28(1):31-34.SU Y X,GUO Y.A review of dietary fatty acid composition and recommended optimal ratio[J].China Oils and Fats,2003,28(1):31-34.(in Chinese)
[31] 郑义,鲁翠云,郑先虎,等.基于微卫星分析大银鱼移植群体的遗传多样性和遗传结构[J].中国水产科学,2023,30(12):1417-1428.ZHENG Y,LU C Y,ZHENG X H,et al.Genetic diversity and genetic structure analysis of introduced clearhead icefish (Protosalanx chinensis) populations using microsatellite markers[J].Journal of Fishery Sciences of China,2023,30(12):1417-1428.(in Chinese)
[32] 张倩倩,陈杰,蒋霞云,等.不同鳊鲂鱼类群体微卫星DNA指纹图谱的构建和遗传结构分析[J].水产学报,2014,38(1):15-22.ZHANG Q Q,CHEN J,JIANG X Y,et al.Establishment of DNA fingerprinting and analysis on genetic structure of different Parabramis and Megalobrama populations with microsatellite[J].Journal of Fisheries of China,2014,38(1):15-22.(in Chinese)
[33] 鲁翠云,曹顶臣,孙效文,等.微卫星分子标记辅助镜鲤家系构建[J].中国水产科学,2008,15(6):893-901.LU C Y,CAO D C,SUN X W,et al.Families construction assisted by microsatellite markers in mirror carp Cyprinus carpio L[J].Journal of Fishery Sciences of China,2008,15(6):893-901.(in Chinese)
[34] 孙效文,张晓锋,赵莹莹,等.水产生物微卫星标记技术研究进展及其应用[J].中国水产科学,2008,15(4):689-703.SUN X W,ZHANG X F,ZHAO Y Y,et al.Development and application of microsatellite markers in aquatic species[J].Journal of Fishery Sciences of China,2008,15(4):689-703.(in Chinese)
[35] 张芹,王延晖,王冰柯,等.基于基因组微卫星的团头鲂养殖群体遗传多样性分析和指纹图谱构建[J].安徽农业科学,2023,51(8):99-104.ZHANG Q,WANG Y H,WANG B K,et al.Genetic diversity analysis and fingerprint construction for two cultured populations of Megalobrama amblycephala on genomic microsatellites[J].Journal of Anhui Agricultural Sciences,2023,51(8):99-104.(in Chinese)
[36] 陈柏湘,王伟峰,王卫民,等.团头鲂低氧耐受相关SNPs标记的开发[J].华中农业大学学报,2019,38(2):23-29.CHEN B X,WANG W F,WANG W M,et al.Single nucleotide polymorphisms and its association with disease resistant trait of hepcidin gene in Megalobrama amblycephala[J].Journal of Huazhong Agricultural University,2019,38(2):23-29.(in Chinese)