循环水养殖系统(recirculating aquaculture systems,RAS)是一种高效利用水资源,且能自动化控制的水产养殖系统,具有节水、节能和减排的优点[1]。循环水养殖系统在养殖过程中利用物理过滤、生物过滤等方法去除养殖水体中的有害污染物,为养殖对象提供了优质、稳定的水体环境,以确保养殖对象可以健康生长发育,同时减少养殖对象的发病几率[2]。如刺参(Apostichopus japonicus)肠道中的乳酸片球菌属(Pediococcus)能够产生多肽类抗菌活性物质,这类活性物质对病原菌具有显著的抑制作用[3]。与传统的流水、池塘养殖模式相比,工厂化循环水养殖技术具有节约水资源、省时省力、高效管理、占用土地面积小、水温可控和不受周围环境影响等优点,符合当前中国提倡的节能减排及转变经济发展模式的策略需求[4-5]。随着工厂化循环水养殖系统的不断发展,循环水养殖的水产物种的多样性显著增加。目前,中国工厂化循环水养殖在鲆鲽类、鲟(Acipenser sinensis)、虹鳟(Oncorhynchus mykiss)、石斑鱼(Epinephelussp)和对虾(Penaeus orientalis)等水产养殖业中取得了较好的成果,提高了饵料利用率和养殖产量[6]。
微生物是水产生态系统的重要的组成要素,参与养殖水体和沉积物中营养物质的代谢,在维持水质和生物疾病防控等方面起着重要作用[7-8]。循环水养殖系统中微生物组成和变化与养殖品种密切相关,其微生物组成会与其周围环境产生交互影响,从而影响养殖生态系统的微生物群系[9]。如金刚虾(Penaeus monodon)工厂化养殖水体中门水平上的优势菌为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)[10],而中华鳖(Pelodiscus sinensis)工厂化养殖水体中优势菌则以变形菌门、髌骨细菌门(Patescibacteria)和绿弯菌门(Chlorofiexi)为主[11]。养殖环境中微生物的变化在宿主肠道微生物组装和环境适应的机制中起着重要作用[12],李存玉等[13]研究了池塘养殖和工厂化养殖两种模式下牙鲆(Paralichthys olivaceus)的肠道微生物,发现肠道菌群丰度和多样性的差别较大,且菌群结构与组成差异显著,说明不同养殖环境对牙鲆肠道微生物造成了差异性的影响。
本研究中,采用16S rRNA高通量测序技术,以刺参养殖池塘水体及沉积物为对象,对刺参循环水养殖池塘中微生物群落进行分析,以期为刺参循环水养殖系统提供全面充分的微生物群落物种组成和时间动态变化规律,并为刺参循环水养殖系统的推广及应用提供有益参考,同时为刺参病害发生提供科学预警。
1 材料与方法
1.1 材料
试验在山东海阳市黄海水产有限公司开展,循环水由回水管道、回水池、滚筒微滤机、蛋白质泡沫分离器+臭氧发生器、一级固定床截污生物净化池、二级及三级移动床生物净化池、紫外消毒渠、增氧池和净水管组成,附属设施包括充气系统、加温系统组成,系统运行稳定,日换水量约占总体积的5%,循环次数为12 次/d(图1)。样品采集前,采用水质监测仪测量温度、盐度、亚硝酸盐等水质参数,养殖期间水体溶解氧维持在 8 mg/L,总氮浓度为0.048~0.093 mg/L,总磷为0.146~0.332 mg/L,活性磷为0.139 1~0.149 5 mg/L,COD为0.841 6~1.365 6 mg/L,亚硝酸盐为0.070 7~0.856 1。刺参循环水养殖的水温为15 ℃,刺参饲料与海泥的饲喂比例按照1∶4进行投喂,饲喂频率为每2 d一次。刺参初始平均体质量为(29.00±1.23) g,养殖密度为8.6 kg/m2。
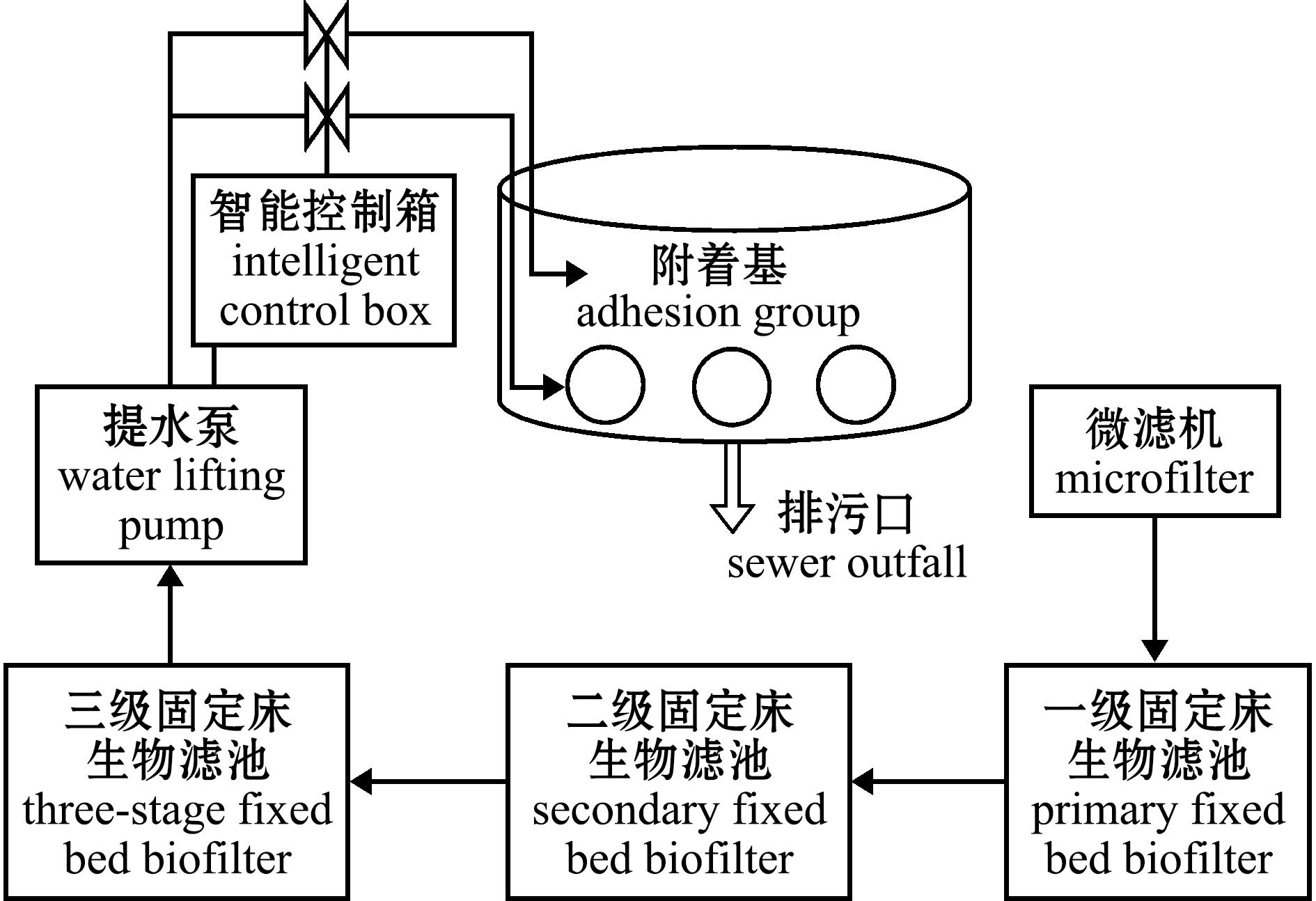
图1 刺参循环水养殖模式中水处理工艺
Fig.1 Water treatment process of Apostichopus japonicus by circulating water culture mode
1.2 方法
1.2.1 样品采集 池塘水样采集。水样采集参照《国家海洋调查规范》海洋生物调查标准中规定的方法进行,采用5 L无菌手持式柱状玻璃采水器采集,将采集水样用0.22 μm的无菌滤膜进行真空抽滤,每个样本抽滤得到3张滤膜,将滤膜用无菌镊子取出后迅速置于15 mL的无菌冷冻管中,然后立即放入液氮中保存。最后将水样过滤的滤膜送检,3张滤膜混合检测。其中每个月份采集两个池塘的水样样品,5月采集水样编号分别为W5171、W5174,6月采集水样编号为W6181、W6184,7月采集水样编号为W0751、W0754,9月采集水样编号为W9131、W9134,10月采集水样编号为W10251、W10254。
用虹吸法采集池底的池塘沉积物,采集点在池塘底部的排污口附近,采集后的池塘沉积物放置于15 mL的无菌冷冻管中,立即放入液氮中保存。将采集的沉积物样品送检。其中5月采集沉积物编号为P51722,6月采集沉积物编号为P61822,7月采集沉积物编号为P07522,9月采集沉积物编号为P91322,10月采集沉积物编号为P102522。
1.2.2 基因组DNA的提取和高通量测序 对样本的全基因组DNA提取,采用CTAB方法[14],DNA的纯度和浓度用10 g/L琼脂糖凝胶电泳进行检测,条带清晰、完整和无拖尾为合格。在离心管中加入适量上述提取的样本DNA,采用无菌水将其稀释至1 ng/μL。以稀释后的基因组DNA为模板,选取细菌16S rRNAV3~V4片段,使用带Barcode的特异引物341F(5′CCTACGGGNGGCWGCAG 3′)和805R(5′GACTACHVGGGTATCTAATCC 3′),采用New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer,高效高保真酶进行PCR,以确保扩增效率和准确性。
PCR产物经过20 g/L浓度的琼脂糖凝胶电泳检测合格后,剪切回收目的条带。采用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,将构建好的文库经过Qubit和Q-PCR定量,再对文库评估,最后采用NovaSeq 6000对文库进行测序。
1.3 数据处理
将测序所得的原始数据使用 Trimmomatic 软件进行质控,过滤并去掉片段长度<50 bp 的reads。将各样本质控后的Clean Data进行Metagenome组装,并采用Diamond Blastx算法对质控后的高质量序列clean reads进行比对和物种注释。以上述得到的结果为基础进行OTUs(operational taxonomic units )聚类和物种分类分析。对所得OTUs在数据库中进行分类对比,由此获得各样本中微生物的物种组成及丰度分布。对所有样本的序列总数进行随机抽样,得到每个深度下的序列数及OTUs数,由此绘制稀释曲线,并对每个样本计算Alpha多样性指数(Shannon、Simpson、Ace、Chao和Coverage),以得到所有样本的丰富度和均匀度信息。基于样本间的差异绘制Venn图和花瓣图,得到不同样本或分组间的OTU特异性信息等。通过对各样本进行PCoA、PCA和NMDS等降维分析,获得各样本群落结构特征的差异。进一步分析分组样本的物种组成和群落结构差异,选用T test、LEfSe和ANOVA等统计分析方法对其进行差异显著性检验。采用PICRUST软件对样本中的微生物群落进行功能预测分析,根据样品在数据库中的功能注释及丰度信息,选取丰度排名前35的功能及它们在每个样品中的丰度信息绘制热图,并从功能差异层面进行聚类。
2 结果与分析
2.1 水体和沉积物高通量测序
对各样本进行Reads拼接,结果显示平均每个样本测得89 815条tags,经过质控后每个样本平均得到83 939条有效数据,基于97%序列一致性获得其OTU稀释曲线(图2)。从图2可见,随着序列数的不断增加,OTU数目趋于平坦,微生物群落的检测比率接近饱和,说明测序数据满足后续生物信息学分析,测序结果可以真实反映样本信息。从图3可见,水体与沉积物15个样本中共有的OTU数目为279个,其中水体样本W9131特有OTU数目(104)最多,沉积物样本P61822特有OTU数目(26)最少(图3(a))。水体10个样本中共有的OTU为429个,其中水体样本W0754和W9131特有OTU数目较多,W5171和W6181特有OTU数目较少(图3(b))。沉积物5个样本中共有的OTU有430个,其中沉积物样本P51722和P07522特有OTU数目较多,P61822特有OTU数目较少(图3(c))。
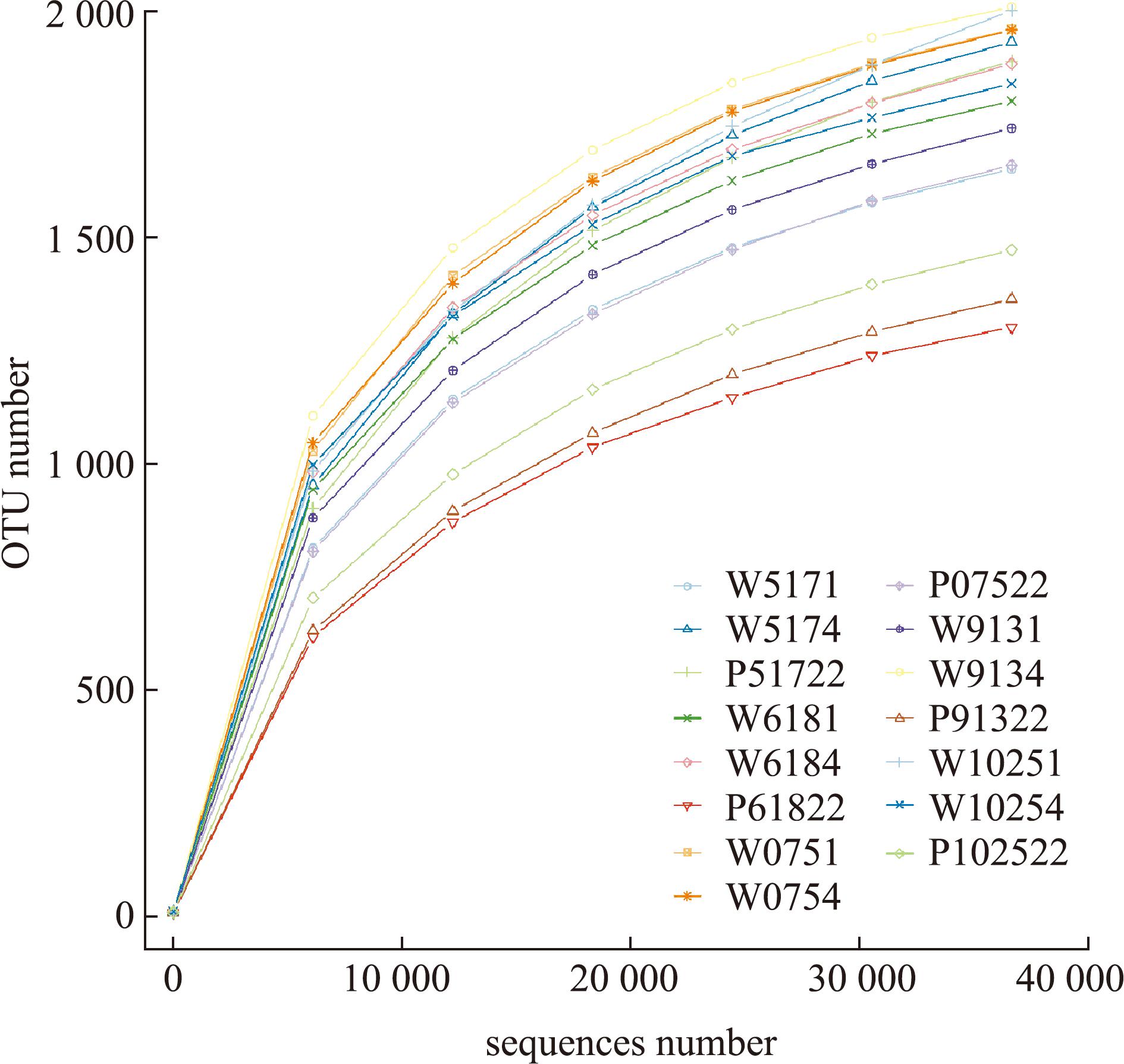
图2 水体和沉积物稀释曲线
Fig.2 Curves of water and sediment dilution
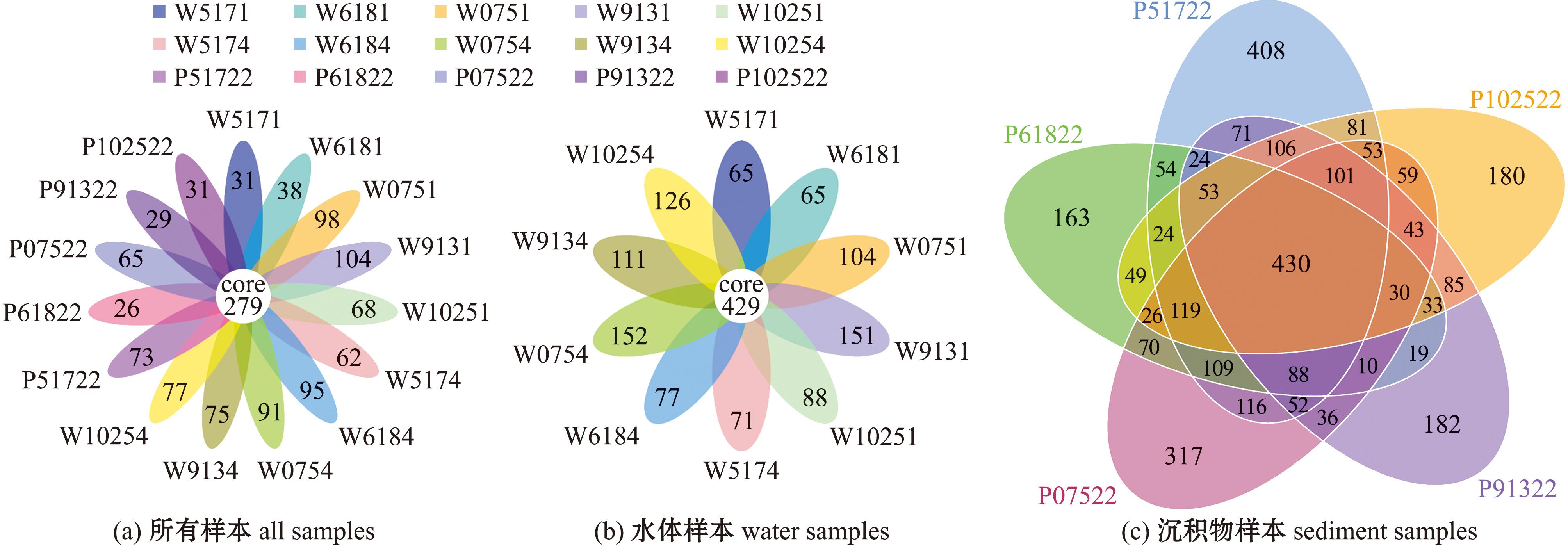
图3 水体和沉积物OTU分布Venn图
Fig.3 Venn diagram of OTU distribution of water and sediment
2.2 水体和沉积物Alpha多样性分析
对各样本的测序序列数进行Alpha多样性指数分析,结果显示,所有样品覆盖率为0.985~0.991,表明各样本中未被检测细菌可能性较小,结果真实可靠。Shannon、Simpson、Ace及Chao指数表明,不同月份水体及沉积物中微生物物种丰富度高,其中水体(W组)的多样性及丰富度高于沉积物(P组),且存在显著性差异(P<0.05)。10月水体(W1025)中微生物的Ace和Chao指数明显高于其他月份。5月沉积物(P51722)中微生物的Ace和Chao指数明显高于其他月份,7月沉积物(P07522)中微生物的Shannon和Simpson指数明显高于其他月份沉积物。多样性分析结果显示,刺参循环水养殖池塘水体和沉积物微生物的多样性及丰富度存在时间空间异质性(表1)。
表1 不同月份水体和沉积物Alpha多样性指数表
Tab.1 Alpha diversity index table of water and sediment in different months
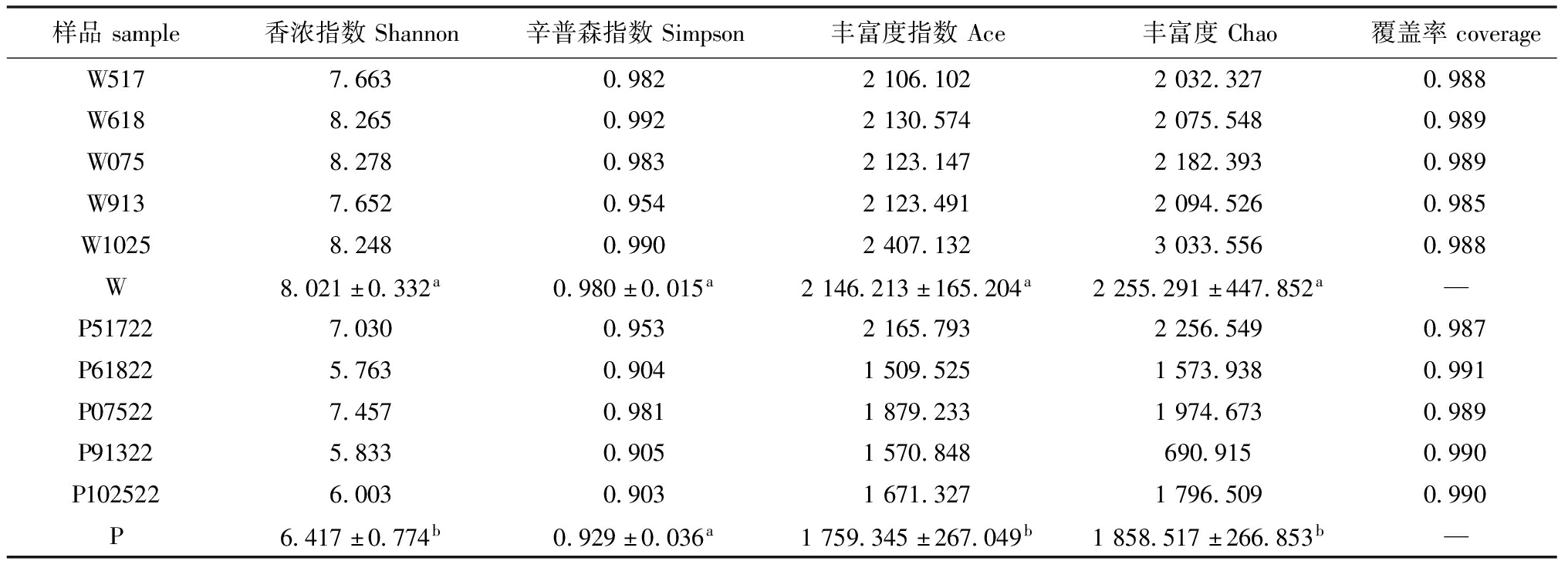
样品sample香浓指数Shannon辛普森指数Simpson丰富度指数Ace丰富度Chao覆盖率coverageW5177.6630.9822106.1022032.3270.988W6188.2650.9922130.5742075.5480.989W0758.2780.9832123.1472182.3930.989W9137.6520.9542123.4912094.5260.985W10258.2480.9902407.1323033.5560.988W8.021±0.332a0.980±0.015a2146.213±165.204a2255.291±447.852a—P517227.0300.9532165.7932256.5490.987P618225.7630.9041509.5251573.9380.991P075227.4570.9811879.2331974.6730.989P913225.8330.9051570.848690.9150.990P1025226.0030.9031671.3271796.5090.990P6.417±0.774b0.929±0.036a1759.345±267.049b1858.517±266.853b—
注:表中的数据以平均值±标准差(mean±S.D.)表示,同列中标有不同字母者表示组间有显著性差异(P<0.05)。
Note:The data in the table are expressed as mean±S.D.,the means with different letters within the same columnare significantly different in the groups at the 0.05 probability level.
2.3 水体和沉积物Beta多样性分析
OTU依据加权Unifrac距离对刺参循环水养殖池塘水体和沉积物样本进行主成分分析(图4)。进一步比较两组在门水平微生物群落结构发现,两组相对丰度最高的均为变形菌门,主成分分析结果表明,第1主成分贡献率为15.11%,第2主成分贡献率为10.43%,总贡献率为25.54%。W10251组和W10254组距离较近,物种组成结构相似,但与其他各组样本间距离较远,群落差异较大;W9134组和W9131组距离较远,且与其他各组样本间距离也较远,因此,W9134组与剩余的所有样本群落差异较大。
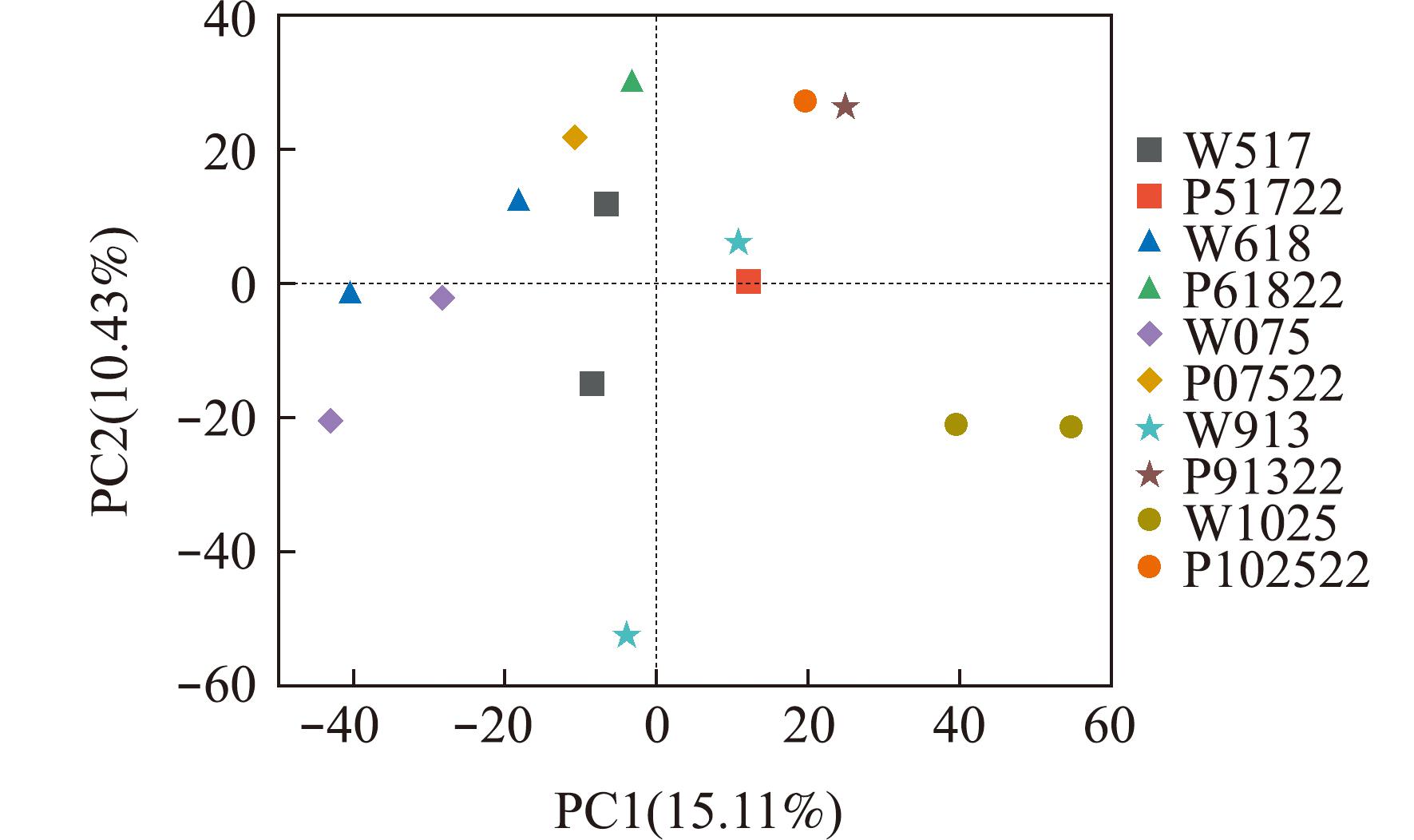
样本距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样本倾向于聚集在一起,群落差异较大的样本则会远远分开。
The closer the distance between samples,the more similar the species composition structure,so samples with high community structure similarity tend to cluster together,and samples with large community differences will be far apart.
图4 水体和沉积物主成分分析图
Fig.4 Analysis diagram Water and sediment component
2.4 水体和沉积物微生物群落组成分析
刺参循环水养殖池塘水体和沉积物微生物在门水平上主要由变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、unidentified_Bacteria、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、蓝细菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)及酸杆菌门(Acidobacteria)组成(图5(a))。进一步比较两组在门水平微生物群落结构发现,两组相对丰度最高的均为变形菌门,所占百分比分别为60.75%和48.39%;两组相对丰度第二的均为拟杆菌门,所占百分比分别为12.74%和29.18%;水体(W组)相对丰度第三的为放线菌门,所占百分比为8.96%,沉积物(P组)相对丰度第三的为unidentified_Bacteria,所占百分比为4.81%。通过ANOVA分析结果显示,沉积物样本中拟杆菌门相对丰度高于水体样本,且两者间存在极显著性差异(P<0.001);水体样本中放线菌门相对丰度高于沉积物样本,且两者间存在显著性差异(P<0.05)。
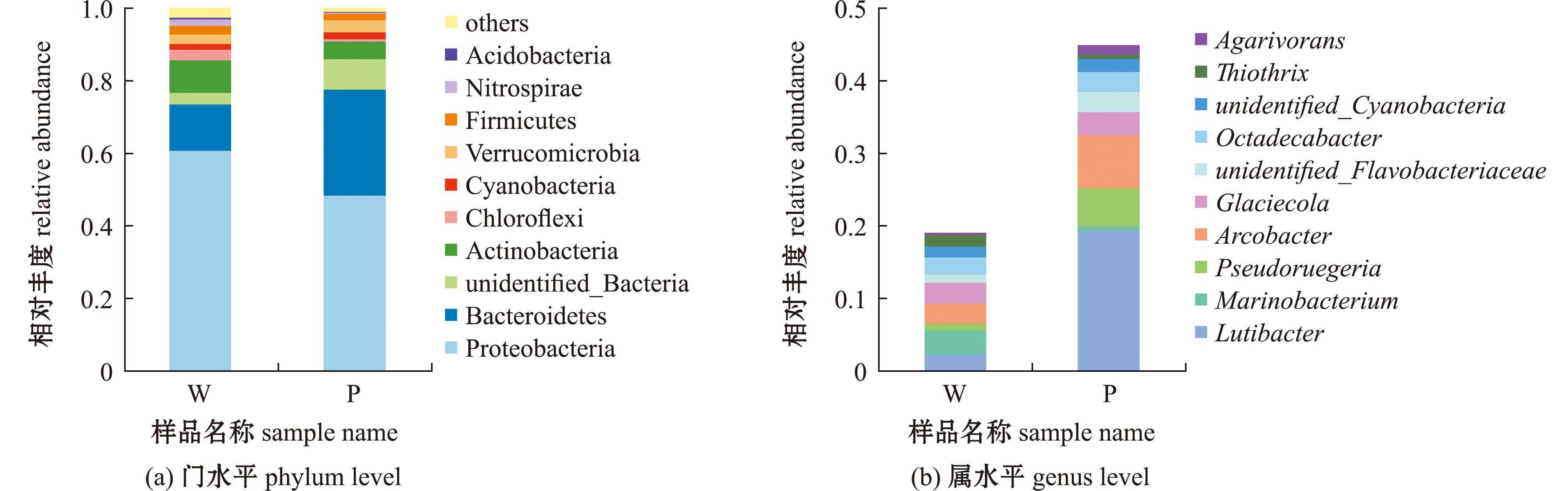
属水平列举出相对丰度前十的物种,下同。
Only the top ten species in relative abundance are listed at the genus level,et sequentia.
图5 水体及沉积物在门水平和属水平的相对丰度
Fig.5 Relative abundance of water and sediment at phylum and genus levels
刺参循环水养殖池塘水体和沉积物微生物在属水平上的主要组成为Lutibacter、海生杆菌属(Marinobacterium)、假鲁杰氏菌属(Pseudoruegeria)、弓形杆菌属(Arcobacter)、冰居菌属(Glaciecola)、unidentified_Flavobacteriaceae、十八杆菌属(Octadecabacter)、unidentified_Cyanobacteria、丝硫菌属(Thiothrix)及噬琼胶菌属(Agarivorans)10个菌属(图5(b))。进一步比较两组在属水平的微生物群落结构发现,水体(W组)相对丰度最高的为海生杆菌属,所占百分比为3.36%,沉积物(P组)相对丰度最高的为Lutibacter,所占百分比为19.39%;水体(W组)相对丰度第二的为冰居菌属,所占百分比为2.89%,沉积物(P组)相对丰度第二的为弓形杆菌属,所占百分比为7.24%;水体(W组)相对丰度第三的为弓形杆菌属,所占百分比为2.74%,沉积物(P组)相对丰度第三的为假鲁杰氏菌属,所占百分比为5.25%。通过ANOVA分析结果显示,沉积物样本中Lutibacter相对丰度高于水体样本,且两者间存在显著性差异(P<0.05);沉积物样本中假鲁杰氏菌属相对丰度高于水体样本,且两者间存在显著性差异(P<0.05)。
2.5 水体和沉积物微生物群落功能预测
刺参循环水养殖池塘水体及沉积物中微生物经过KEGG数据库注释,结果如图6所示。刺参循环水养殖池塘中水体及沉积物中微生物在数据库中注释数量前三的通路是新陈代谢通路(51%~53%)、遗传信息处理(14%~17%)和环境信息处理(13%~15%)(图6(a))。对刺参循环水养殖池塘水体及沉积物中的微生物进行KEGG数据库二级注释发现,水体和沉积物中微生物主要富集在膜运输、氨基酸代谢、碳水化合物代谢、复制与修复、能量代谢、辅助因子与维生素代谢、翻译、生物降解与代谢和脂质代谢途径(图6(b))。
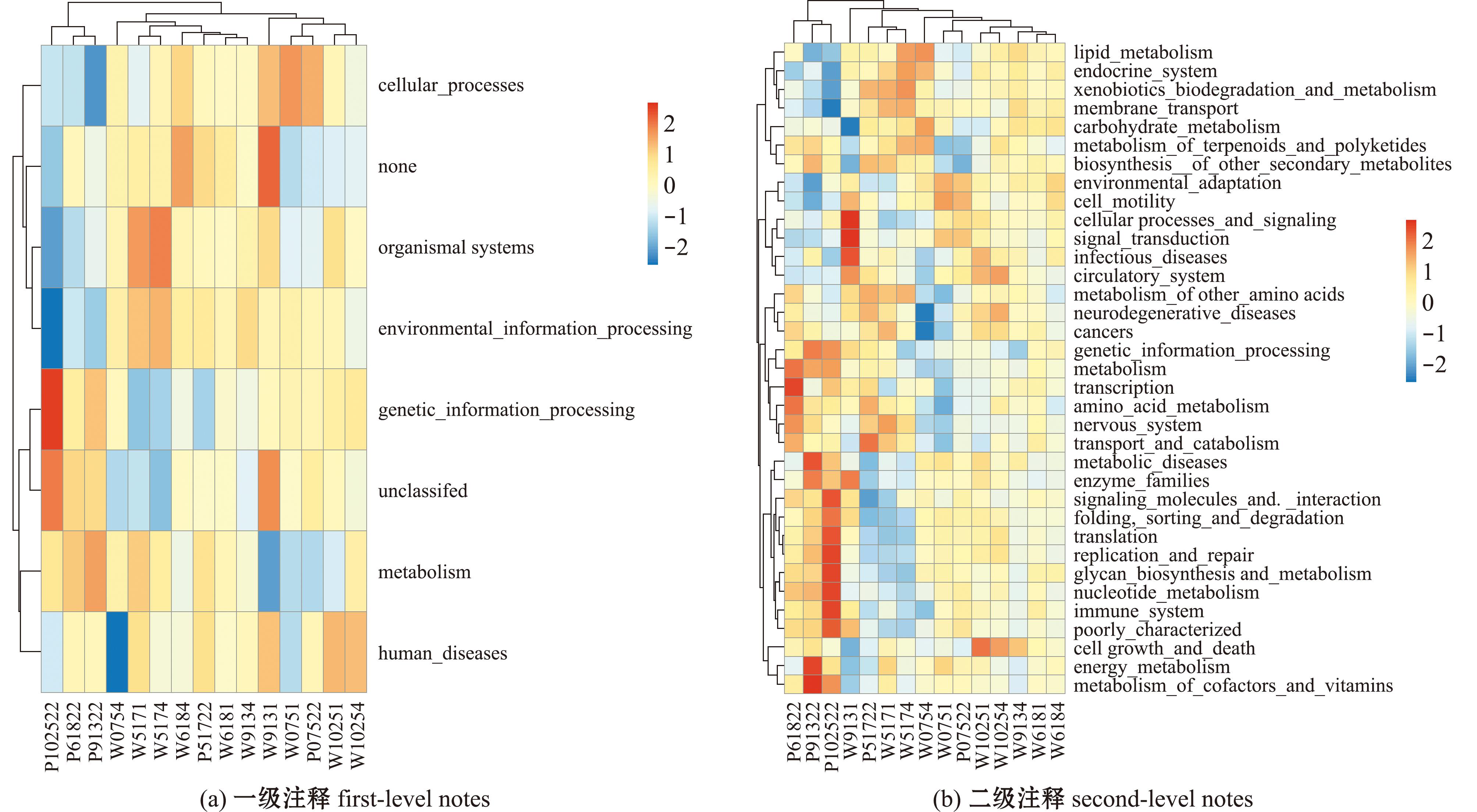
图6 基于KEGG 注释得到的水体和沉积物细菌群落功能相对丰度
Fig.6 Functional heat maps of bacterial communities in water and sediment based on KEGG annotations
2.6 不同月份水体微生物群落的变化分析
选取相对丰度前十的物种,分析不同月份刺参循环水养殖池塘水体在门水平上的微生物种类及其相对丰度变化,得到群落组成的柱形图(图7(a))。水体中微生物在门水平上,不同月份相对丰度最高的均为变形菌门;7月(W075)相对丰度第二的为放线菌门,其他月份相对丰度第二的均为拟杆菌门;7月(W075)相对丰度第三的为拟杆菌门,其他月份相对丰度第三的均为放线菌门。比较不同月份水体在门水平上的差异发现,蓝细菌门在5月(W517)中所占比例明显高于其他月份,unidentified_Bacteria和绿弯菌门在7月(W075)中所占比例明显高于其他月份。
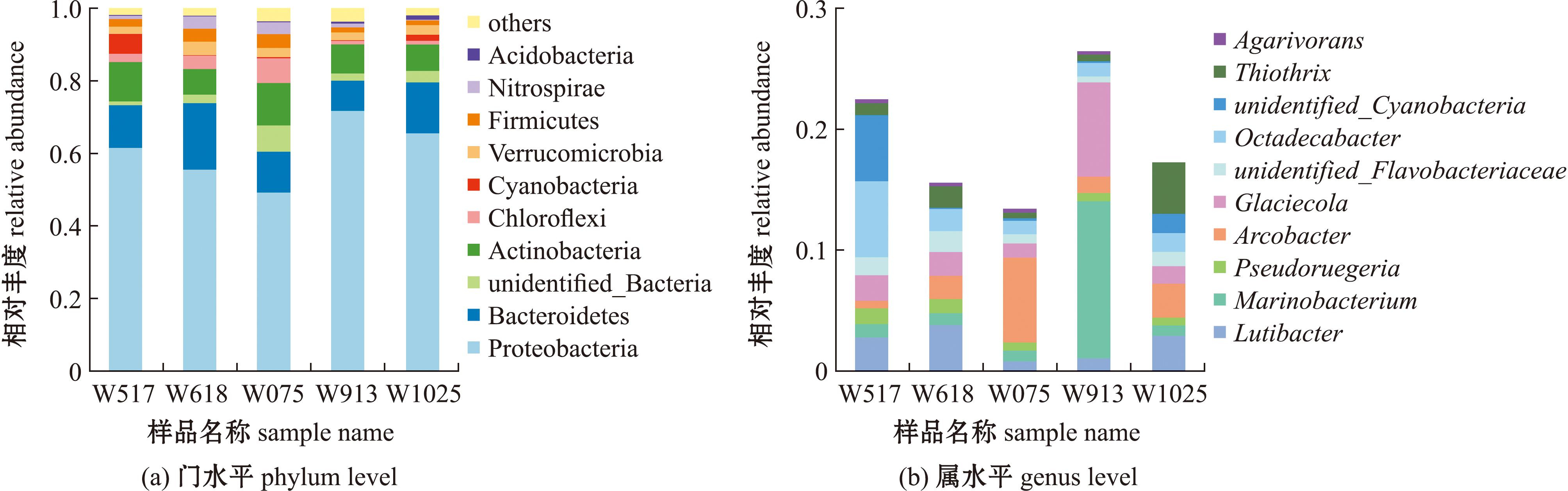
图7 不同月份水体在门水平和属水平的相对丰度
Fig.7 Relative abundance of water at phylum and genus level in different months
不同月份水体微生物组成在属水平上存在较大差异(图7(b)),5月(W517)优势菌属为十八杆菌属、unidentified_Cyanobacteria和Lutibacter;6月(W618)优势菌属为Lutibacter;7月(W075)优势菌属为弓形杆菌属;9月(W913)优势菌属为海生杆菌属和冰居菌属;10月(W1025)优势菌属为丝硫菌属、Lutibacter和弓形杆菌属。比较不同月份水体在属水平上的差异发现,十八杆菌属和unidentified_Cyanobacteria在5月(W517)中所占比例明显高于其他月份,弓形杆菌属在7月(W075)中所占比例明显高于其他月份,海生杆菌属和冰居菌属在9月(W913)中所占比例明显高于其他月份。
2.7 不同月份沉积物微生物群落的变化分析
选取相对丰度前十的物种,分析不同月份刺参循环水养殖池塘沉积物在门水平上的微生物种类及其相对丰度变化,得到群落组成的柱形图(图8(a))。沉积物中微生物在门水平上,10月(P102522)相对丰度最高的为拟杆菌门,其他月份相对丰度最高的均为变形菌门;7月(P07522)相对丰度第二的为unidentified_Bacteria,10月(P102522)相对丰度第二的为变形菌门,其他月份相对丰度第二的均为拟杆菌门;5月(P51722)相对丰度第三的为放线菌门,7月(P07522)相对丰度第三的为拟杆菌门,9月(P91322)相对丰度第三的为蓝细菌门,其他月份相对丰度第三的为unidentified_Bacteria。比较不同月份沉积物在门水平上的差异发现,蓝细菌门在9月(P91322)中所占比例明显高于其他月份。
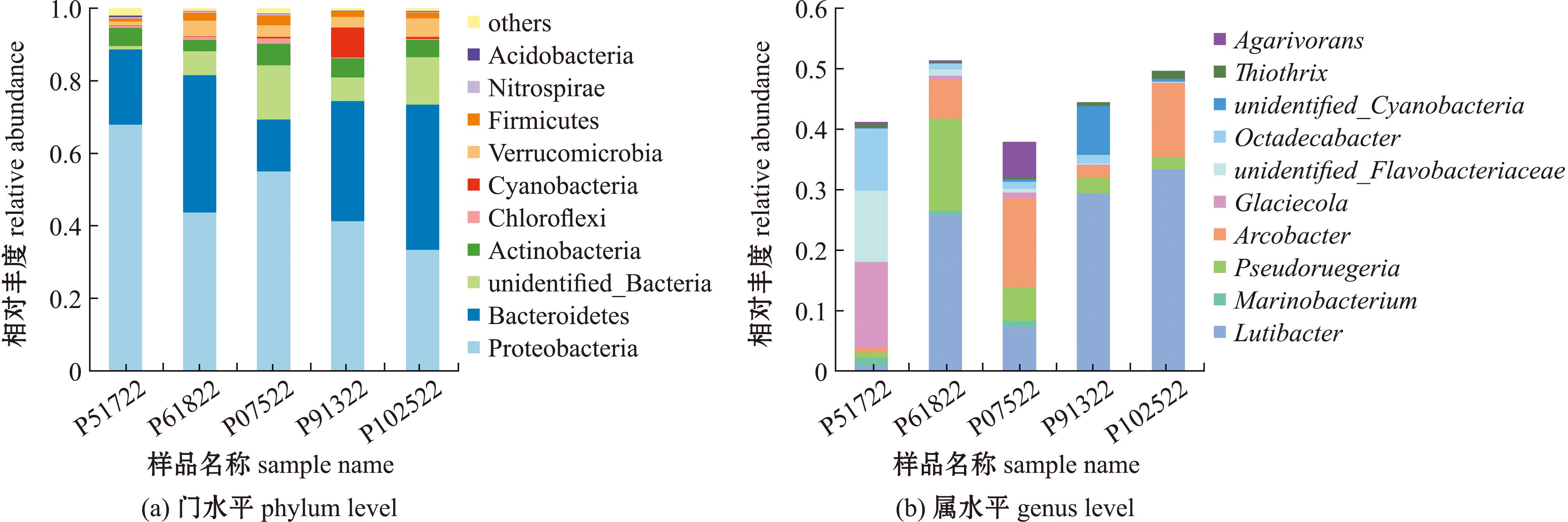
图8 不同月份沉积物在门水平和属水平的相对丰度
Fig.8 Relative abundance of sediment at phylum and genus level in different months
不同月份沉积物微生物组成在属水平上存在较大的差异(图8(b)),5月(P51722)优势菌属为冰居菌属、unidentified_Flavobacteriaceae和十八杆菌属;6月 (P61822)优势菌属为Lutibacter、假鲁杰氏菌属和弓形杆菌属;7月(P07522)优势菌属为弓形杆菌属、Lutibacter、假鲁杰氏菌属和噬琼胶菌属;9月(P91322)优势菌属为Lutibacter和unidentified_Cyanobacteria;10月(P102522)优势菌属为Lutibacter和弓形杆菌属。比较不同月份沉积物在属水平上的差异发现,冰居菌属、unidentified_Flavobacteriaceae和十八杆菌属在5月(P51722)中所占比例明显高于其他月份,弓形杆菌属和噬琼胶菌属在7月(P07522)中所占比例明显高于其他月份,unidentified_Cyanobacteria在9月(P91322)中所占比例明显高于其他月份。
3 讨论
3.1 刺参循环水养殖池塘水体和沉积物菌群多样性分析
微生物是养殖池塘生态系统的重要组成部分,关系着整个池塘生态系统的平衡,参与生态系统中物质循环和能量流动过程,并对该系统具有重要影响[15-16]。本研究结果显示,刺参循环水养殖池塘水体菌群多样性和丰富度均高于沉积物。而Zhao等[17]研究发现,刺参养殖池塘底泥中细菌群落的丰富度和多样性显著高于池塘水体;窦妍等[18]研究黄、渤海刺参养殖池塘秋、冬季海水和沉积物菌群结构与特征发现,冬季沉积物中细菌多样性最高。这些结果与本试验结果不一致,推测可能是由于养殖模式的不同,传统的刺参池塘养殖模式会不定期地换水和更换池塘,会在池塘底部留存大量微生物,而循环水养殖模式中养殖水体经尾水水处理单元处理后回流到养殖单元[19],该养殖模式下养殖池塘水体中微生物会相对较多,而沉积物则相对较少,导致循环水养殖系统中水体菌群多样性和丰富度均高于沉积物。同时养殖环境的不同也会造成微生物群落结构的不同,这些微生物群落的多样性差异可为刺参不同养殖模式提供数据支撑。
3.2 刺参循环水养殖池塘水体和沉积物微生物群落组成分析
本研究结果表明,刺参循环水养殖池塘中水体和沉积物的第一优势菌门均为变形菌门(图5(a))。有研究表明,刺参作为底栖生物,其生活水体及沉积泥中的最优势菌是变形菌门[20],这与本试验研究结果一致。变形菌门参与池塘生态系统氮循环和碳循环,在池塘养殖生态系统中占据着重要的生态学地位[21]。本研究结果表明,刺参循环水养殖池塘中水体和沉积物的次优势菌门均为拟杆菌门(图5(a))。拟杆菌门的细菌对蛋白质、脂类和DNA等有机物质的转换发挥着重要作用,并且可以利用含氮物质,对宿主来源的多糖代谢作出了非常重要的贡献[22-23]。刺参养殖过程中产生的残饵及粪便等有机质的分解,需要拟杆菌门参与其代谢过程,使其成为刺参养殖池塘水体和沉积物的次优势菌门。本研究中除上述两大优势菌外,还在刺参循环水水体及沉积物中获得了放线菌门、绿弯菌门、蓝细菌门、疣微菌门、厚壁菌门、硝化螺旋菌门及酸杆菌门(图5(a))。绿弯菌门因具备独特的3-羟基丙酸双循环(3-hydroxypropionate bicycle,3-HP)途径来固定CO2,也是一个代谢多样的细菌门类,在生物体的化学循环中扮演着重要的角色[24]。疣微菌门细菌可以分解多糖类物质,如黏多糖和纤维素等[25]。绿弯菌门和疣微菌门在刺参循环水养殖系统中丰度高,可能预示其在刺参代谢中发挥重要的功能。厚壁菌门的细菌能分泌多种消化酶和抗生素,且能直接利用水中硝酸盐和亚硝酸盐从而净化水质[26]。硝化螺旋菌门可将亚硝酸盐氧化成硝酸盐。厚壁菌门和硝化螺旋菌门在刺参循环水系统中高丰度,可能对刺参的水质净化起到一定作用。
进一步比较刺参循环水养殖池塘水体和沉积物微生物的差异发现,在门水平上,沉积物样本中拟杆菌门相对丰度显著高于水体;水体样本中放线菌门相对丰度显著高于沉积物(图5(a))。微生物群落在底栖碳循环中起着至关重要的作用,当有机物到达沉积物表面时,它们往往是有机物的主要降解者,拟杆菌对于初始有机物降解很重要,会分解复杂的聚合物[27]。放线菌作为动物肠道内的主要细菌之一,可以在水生动物的消化道中不断繁殖和代谢,产生脂肪酶、淀粉酶等消化酶,水体中高丰度的放线菌能够提高饵料中营养的吸收率,从而提高个体增重和饵料转化率[28]。在属水平上,沉积物样本中Lutibacter和假鲁杰氏菌属相对丰度显著高于水体样本(图5(b))。Lutibacter是一类兼性厌氧细菌,进行无氧呼吸时可以利用硝酸盐作为电子受体,具有潜在多糖降解功能[29],在刺参养殖池塘沉积物中高丰度的存在有益于刺参对营养物质的利用。假鲁杰氏菌属隶属于变形菌门的红杆菌科(Rhodobacteraceae),可以利用水体中的多种有机物碳源进行异养的代谢反应,降低水体中的生化耗氧量[30],本研究中沉积物中假鲁杰氏菌属丰度高于水体,说明沉积物中有机物含量相较于水体而言更加丰富。
3.3 不同月份刺参循环水养殖池塘水体和沉积物微生物群落组成变化分析
不同月份水体和沉积物在门水平上的优势菌门为变形菌门、拟杆菌门和放线菌门,而在属水平上的优势菌属在水体和沉积物间及不同月份间均存在明显差异。裴泓霖等[31]研究发现,不同季节刺参养殖池塘沉积物第一优势菌门均为变形菌门,次优势菌门存在显著性差异,优势菌属呈现出显著的季节性差异。Zhao等[17]对刺参养殖池塘水体和沉积物一年共12个月的优势菌进行研究发现,变形菌门、拟杆菌门和放线菌门是刺参养殖池塘所有样品中最主要的3个门。本试验结果与这些结果在门水平上存在一定的相似性,但在属水平上存在较大差异,推测是养殖品种、养殖模式及地区不同所导致。
在门水平上,绿弯菌门在7月水体中所占比例明显高于其他月份(图7(a))。绿弯菌门的细菌能通过光合作用产生能量[32],7月温度相对较高,且阳光充足,有利于绿弯菌门的光合作用。蓝细菌门在5月水体和9月沉积物中所占比例明显高于其他月份(图7(a)、图8(a))。蓝细菌在氮、磷含量丰富时生长旺盛、繁殖迅速,可作为水体富营养化的指示生物[33]。因此,5月水体和9月沉积物可能存在富营养化现象,可以通过加入其他微生态制剂来改善水体环境。在属水平上,十八杆菌属在5月水体和沉积物中所占比例明显高于其他月份,冰居菌属在5月沉积物中所占比例明显高于其他月份(图7(b)、图8(b))。冰居菌属细菌在海冰、极区海水、海洋沉积物等海洋低温环境广泛存在,是海洋低温环境的优势微生物[34]。十八杆菌属菌株中均存在代表黄视紫红质新亚群以适应冰冷环境的基因[35]。5月的温度相对于其他4个月份是最低的,刺参刚从越冬状态中恢复,5月样本中高丰度的冰居菌属和十八杆菌属有利于刺参进行越冬后的恢复。但本研究中还发现,冰居菌属在9月水体中所占比例较高(图7(b)),这一现象的原因有待进一步探究。unidentified_Flavobacteriaceae在5月沉积物中所占比例明显高于其他月份(图8(b))。有研究表明,黄杆菌科细菌对养殖池塘起到积极的作用,能转化养殖池塘中的氨、亚硝酸盐和硝酸盐,可作为健康池塘的指示科[36],说明5月循环水养殖系统中的刺参健康状况良好。弓形杆菌属在7月水体和沉积物中所占比例明显高于其他月份(图7(b)、图8(b))。弓形杆菌属被认为是新兴的肠道病原体的潜在患病因子[37]。7月水体和沉积物中高丰度的弓形杆菌属可能会引起刺参的疾病,应及时关注刺参健康状态。噬琼胶菌属在7月沉积物中所占比例明显高于其他月份(图8(b))。琼胶是很多藻类细胞壁的主要成分,琼脂糖是琼胶的主要成分,琼胶酶(agarase) 是能够降解琼脂糖的水解酶,而噬琼胶菌属细菌能分泌琼胶酶,是一类重要的琼胶降解细菌[38]。7月气温高,光照充足,藻类大量繁殖和生长,当藻类死亡以后都沉积到池塘底部,因此导致该菌属丰度增加。9月海生杆菌属水体中所占比例明显高于其他月份(图7(b))。海生杆菌属成员能够在限制氧气条件下固定氮[39],刺参循环水养殖池塘9月水体中高丰度的存在可能有助于刺参利用其氮源进行营养代谢。
4 结论
1)水体中微生物的多样性及丰富度高于沉积物,且不同月份水体和沉积物中微生物的多样性及丰富度存在差异,因此刺参循环水养殖池塘水体和沉积物微生物多样性及丰富度存在时间空间异质性。
2)刺参循环水养殖池塘水体和沉积物微生物群落结构存在明显差异,假鲁杰氏菌属和Lutibacter是主要差异微生物,在沉积物中富集最高。
3)不同月份的刺参循环水养殖池塘水体微生物群落结构存在明显差异,十八杆菌属和unidentified_Cyanobacteria在5月水体中富集最高,弓形杆菌属在7月水体中富集最高,海生杆菌属和冰居菌属在9月水体中富集最高。
4)不同月份的刺参循环水养殖池塘沉积物微生物群落结构存在明显差异,冰居菌属、unidentified_Flavobacteriaceae和十八杆菌属在5月沉积物中最高,弓形杆菌属和噬琼胶菌属在7月沉积物中最高,unidentified_Cyanobacteria在9月沉积物中最高。
[1] 唐茹霞,史策,刘鹰.循环水养殖系统管理运行存在主要问题调查分析[J].广东海洋大学学报,2018,38(1):100-106.TANG R X,SHI C,LIU Y.Analysis on the major problems in the management and operation of recirculating aquaculture system[J].Journal of Guangdong Ocean University,2018,38(1):100-106.(in Chinese)
[2] 刘鹰.海水工业化循环水养殖技术研究进展[J].中国农业科技导报,2011,13(5):50-53.LIU Y.Research progress on marine industrial recirculating aquaculture technology[J].Journal of Agricultural Science and Technology,2011,13(5):50-53.(in Chinese)
[3] 王伟,丛丽娜,黄君,等.海参肠道中乳酸菌的分离鉴定及活性物质研究[J].工业微生物,2018,48(4):24-29.WANG W,CONG L N,HUANG J,et al.Isolation and identification of lactic acid bacteria in sea cucumber and analysis of active substances[J].Industrial Microbiology,2018,48(4):24-29.(in Chinese)
[4] BADIOLA M,BASURKO O C,PIEDRAHITA R,et al.Energy use inrecirculating aquaculture systems (RAS):a review[J].Aquacultural Engineering,2018,81:57-70.
[5] 蔡青霖,韩庆富.国内外工厂化循环水养殖技术发展现状及趋势[J].南方农业,2023,17(17):247-251.CAI Q L,HAN Q F.Development status and trend of industrial circulating water aquaculture technology at home and abroad[J].South China Agriculture,2023,17(17):247-251.(in Chinese)
[6] 熊向英,王志成,刘旭佳,等.工厂化循环水养殖系统微生物群落结构和功能分析[J].水产科学,2022,41(5):810-819.XIONG X Y,WANG Z C,LIU X J,et al.Analysis of microbial community structure and function in industrial recirculating aquaculture system[J].Fisheries Science,2022,41(5):810-819.(in Chinese)
[7] NI J J,LI X J,CHEN F,et al.Community structure and potential nitrogen metabolisms of subtropical aquaculture pond microbiota[J].Applied Ecology and Environmental Research,2018,16(6):7687-7697.
[8] LI Z F,YU E M,ZHANG K,et al.Water treatment effect,microbial community structure,and metabolic characteristics in a field-scale aquaculture wastewater treatment system[J].Frontiers in Microbiology,2020,11:930.
[9] 张旭,周丽,蔡敏,等.基于宏基因组学的中华绒螯蟹养殖池塘水体微生物群落结构和功能组成分析[J].渔业科学进展,2024,45(4):112-124.ZHANG X,ZHOU L,CAI M,et al.Metagenomics-based analysis of microbial community structure and function composition in aquaculture pond for Chinese Mitten Crab(Eriocheir sinensis)[J].Progress in Fishery Sciences,2024,45(4):112-124.(in Chinese)
[10] 王伟,崔茜,蔡章印,等.不同模式金刚虾养殖水体和肠道微生物菌群变化分析[J].西昌学院学报(自然科学版),2023,37(3):7-14.WANG W,CUI Q,CAI Z Y,et al.Analysis of changes in the waterflora and intestinal microflora of Penaeus monodon in different cultural models[J].Journal of Xichang University (Natural Science Edition),2023,37(3):7-14.(in Chinese)
[11] 苏俊宇,陈辰,李伟,等.2种充气模式中华鳖工厂化养殖水体水质及微生物群落结构[J].广东海洋大学学报,2022,42(5):45-53.SU J Y,CHEN C,LI W,et al.Water quality and microbial community structure of indoor industrial aquaculture system for Chinese softshell turtles (Pelodiscus sinensis) under two aeration methods[J].Journal of Guangdong Ocean University,2022,42(5):45-53.(in Chinese)
[12] JING X J,SU S Y,ZHANG C F,et al.Dynamic changes in microbial community structure in farming pond water and their effect on the intestinal microbial community profile in juvenile common carp (Cyprinus carpio L.)[J].Genomics,2021,113(4):2547-2560.
[13] 李存玉,徐永江,柳学周,等.池塘和工厂化养殖牙鲆肠道菌群结构的比较分析[J].水产学报,2015,39(2):245-255.LI C Y,XU Y J,LIU X Z,et al.Comparative analysis of composition,diversity and origin of intestinal bacterial community in pond-and indoor tank-culture Japanese flounder(Paralichthys olivaceus)[J].Journal of Fisheries of China,2015,39(2):245-255.(in Chinese)
[14] 左欣欣,陈泽宇,马腾,等.从动物组织中提取总RNA的CTAB法[J].中国西部科技,2011,10(2):35-36,76.ZUO X X,CHEN Z Y,MA T,et al.A modified CTAB method to extract total RNA from animal tissues[J].Science and Technology of West China,2011,10(2):35-36,76.(in Chinese)
[15] RUNGRASSAMEE W,KLANCHUI A,MAIBUNKAEW S,et al.Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J].Journal of Invertebrate Pathology,2016,133:12-19.
[16] XIONG J B,DAI W F,LI C H.Advances,challenges,and directions in shrimp disease control:the guidelines from an ecological perspective[J].Applied Microbiology and Biotechnology,2016,100(16):6947-6954.
[17] ZHAO Z L,JIANG J W,PAN Y J,et al.Temporal dynamics of bacterial communities in the water and sediments of sea cucumber (Apostichopus japonicus) culture ponds[J].Aquaculture,2020,528:735498.
[18] 窦妍,丁君,曲凌云,等.秋、冬季刺参养殖池塘菌群的多样性分析[J].大连海洋大学学报,2015,30(2):143-148.DOU Y,DING J,QU L Y,et al.Flora diversity in sea cucumber Apostichopus japonicus culture ponds in autumn and winter[J].Journal of Dalian Ocean University,2015,30(2):143-148.(in Chinese)
[19] 张健.海参循环水养殖系统建立及曝气生物滤池细菌多样性分析[D].哈尔滨:哈尔滨工业大学,2013.ZHANG J.Establishment of circulating water culture system for sea cucumber and analysis of bacterial diversity in biological aerated filter[D].Harbin:Harbin Institute of Technology,2013.(in Chinese)
[20] 李晓龙.正常和发病刺参养殖池塘沉积环境中细菌群落变化的研究[D].保定:河北农业大学,2014.LI X L.Study on the changes of bacterial community in the sedimentary environment of normal and diseased Stichopus japonicus culture ponds[D].Baoding:Hebei Agricultural University,2014.(in Chinese)
[21] LU H P,WANG Y B,HUANG S W,et al.Metagenomic analysis reveals a functional signature for biomass degradation by cecal microbiota in the leaf-eating flying squirrel (Petaurista alborufus Lena)[J].BMC Genomics,2012,13:466.
[22] O’SULLIVAN L A,WEIGHTMAN A J,FRY J C.New degenerate Cytophaga-Flexibacter-Bacteroides-specific 16S ribosomal DNA-targeted oligonucleotide probes reveal high bacterial diversity in River Taff epilithon[J].Applied and Environmental Microbiology,2002,68(1):201-210.
[23] 刘洋,宋志文,李凌志,等.微生态制剂-生物膜对虾养殖系统水质净化效果研究[J].水生态学杂志,2020,41(1):92-99.LIU Y,SONG Z W,LI L Z,et al.Water purification by probiotic biofilms in shrimp culture systems[J].Journal of Hydroecology,2020,41(1):92-99.(in Chinese)
[24] NARSING RAO M P,LUO Z H,DONG Z Y,et al.Metagenomic analysis further extends the role of Chloroflexi in fundamental biogeochemical cycles[J].Environmental Research,2022,209:112888.
[25] 冯希.海洋疣微菌的分离、鉴定及疣微菌门分类体系整理[D].济南:山东大学,2021.FENG X.Isolation and identification of marine verrucous microorganisms and sorting out the classification system of verrucous microorganisms[D].Jinan:Shandong University,2021.(in Chinese)
[26] 陶诗,王健鑫,刘雪珠,等.(鲵)鱼消化道细菌群落结构及多样性初步研究[J].南方水产科学,2013,9(4):8-15.TAO S,WANG J X,LIU X Z,et al.Preliminary research on bacterial community structure and diversity in digestive tract of Miichthys miiuy[J].South China Fisheries Science,2013,9(4):8-15.(in Chinese)
[27] TEELING H,FUCHS B M,BECHER D,et al.Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom[J].Science,2012,336(6081):608-611.
[28] 王蓉,何晓娜,刘维,等.海洋放线菌作为益生菌在水产养殖中的潜在应用[J].安徽农业科学,2013,41(24):10007-10009.WANG R,HE X N,LIU W,et al.Potential use of marine Actinobacteria as probiotics in aquaculture[J].Journal of Anhui Agricultural Sciences,2013,41(24):10007-10009.(in Chinese)
[29] BOH RQUEZ J,MCGENITY T J,PAPASPYROU S,et al.Different types of diatom-derived extracellular polymeric substances drive changes in heterotrophic bacterial communities from intertidal sediments[J].Frontiers in Microbiology,2017,8:245.
RQUEZ J,MCGENITY T J,PAPASPYROU S,et al.Different types of diatom-derived extracellular polymeric substances drive changes in heterotrophic bacterial communities from intertidal sediments[J].Frontiers in Microbiology,2017,8:245.
[30] 张海耿,马绍赛,李秋芬,等.循环水养殖系统(RAS)生物载体上微生物群落结构变化分析[J].环境科学,2011,32(1):231-239.ZHANG H G,MA S S,LI Q F,et al.Analysis of the changes of microbial community structure on bio-carrier of recirculating aquaculture systems(RAS)[J].Environmental Science,2011,32(1):231-239.(in Chinese)
[31] 裴泓霖,王荦,谭八梅,等.不同季节刺参养殖池塘沉积物菌群结构及其影响因素[J].渔业科学进展,2021,42(3):89-99.PEI H L,WANG L,TAN B M,et al.Environmental factors influence the seasonal characteristics of bacterial community in the sediment of Apostichopus japonicus culture ponds[J].Progress in Fishery Sciences,2021,42(3):89-99.(in Chinese)
[32] BJÖRNSSON L,HUGENHOLTZ P,TYSON G W,et al.Filamentous Chloroflexi (green non-sulfur bacteria) are abundant in wastewater treatment processes with biological nutrient removal[J].Microbiology,2002,148(Pt 8):2309-2318.
[33] 俞翔.二氯甲烷和二氯乙烷对蛋白核小球藻的毒性影响研究[D].杭州:浙江工业大学,2010.YU X.Toxic effects of dichloromethane and dichloroethane on Chlorella pyrenoidosa[D].Hangzhou:Zhejiang University of Technology,2010.(in Chinese)
[34] CHEN L P,XU H Y,FU S Z,et al.Glaciecola lipolytica sp.nov.,isolated from seawater near Tianjin city,China[J].International Journal of Systematic and Evolutionary Microbiology,2009,59(Pt 1):73-76.
[35] VOLLMERS J,VOGET S,DIETRICH S,et al.Poles apart:Arctic and Antarctic Octadecabacter strains share high genome plasticity and a new type of xanthorhodopsin[J].PLoS One,2013,8(5):e63422.
[36] MICHAUD L,GIUDICE A L,TROUSSELLIER M,et al.Phylogenetic characterization of the heterotrophic bacterial communities inhabiting a marine recirculating aquaculture system[J].Journal of Applied Microbiology,2009,107(6):1935-1946.
[37] HO H T K,LIPMAN L J A,GAASTRA W.Arcobacter,what is known and unknown about a potential foodborne zoonotic agent![J].Veterinary Microbiology,2006,115(1/2/3):1-13.
[38] 林伯坤,陆国永,宋燕,等.海洋细菌Agarivorans sp.HZ105的琼胶降解酶系[J].生物技术通报,2015(1):160-166.LIN B K,LU G Y,SONG Y,et al.The Agar-degrading enzymatic system of marine bacterium Agarivorans sp.HZ105[J].Biotechnology Bulletin,2015(1):160-166.(in Chinese)
[39] DUR N-VISERAS A,CASTRO D J,REINA J C,et al.Taxogenomic and metabolic insights into Marinobacterium ramblicola sp.nov.,a new slightly halophilic bacterium isolated from rambla salada,Murcia[J].Microorganisms,2021,9(8):1654.
N-VISERAS A,CASTRO D J,REINA J C,et al.Taxogenomic and metabolic insights into Marinobacterium ramblicola sp.nov.,a new slightly halophilic bacterium isolated from rambla salada,Murcia[J].Microorganisms,2021,9(8):1654.