刺参(Apostichopus japonicus)具有较高的经济价值和药用价值,是中国重要的海水养殖品种[1-2]。近年来,随着刺参产业的不断发展,形成了南北接力的养殖模式,以福建霞浦为代表的“北参南养”刺参养殖模式在中国水产业占据重要地位。霞浦作为中国冬季刺参主养区,在养殖过程中大多利用芽孢杆菌(Bacillus)、酵母菌(yeast)及光合细菌(photosynthetic bacteria)浸泡的方法发酵海带为主要成分,再配合海泥作为饵料。这种粗糙的发酵过程,环境因素常常不可控,导致大量的有害菌滋生[3]。受污染的饵料进入刺参肠道,会诱发肠道炎症,甚至会导致刺参患病。同时,还会引起养殖水质恶化等环境污染问题[4]。因此,研发一种安全、健康及稳定的人工配合饲料,有效提高饲料利用率、提升生长性能、改善健康状况及保护环境显得尤为重要。
肠道菌群是一个复杂且动态变化的微生态系统,其稳定平衡在宿主食物消化、营养吸收和免疫反应等基本功能中起重要作用[5-6]。而益生菌作为一种活性微生物细胞,能够通过饲料直接提供给养殖动物,从而有效促进宿主肠道的微生态平衡[7-8]。已有研究表明,饲料中添加从健康刺参肠道中分离出的嗜酸乳酸杆菌(Lactobacillus acidophilus)能够优化刺参肠道菌群结构,并有效提高刺参的饲料利用率[9]。饲料中添加枯草芽孢杆菌(Bacillus subtilis)能够参与调节刺参肠道菌群结构组成,并显著提高刺参的特定生长率[10]。使用屎肠球菌(Enterococcus faecium)和植物乳杆菌(Lactobacillus plantarum)投喂刺参能够有效减少其肠道内弧菌(Vibrio)和大肠杆菌(Escherichia)的相对丰度,并刺激机体免疫反应[11]。饲料中添加鼠李糖乳杆菌(Lactobacillus rhamnosus M2-4)能够提高Haloferula、红细菌科(Rhodobacteraceae)和乳杆菌(Lactobacillus)等潜在益生菌相对丰度,并降低Vibrio等条件致病菌的相对丰度[12]。综上所述,通过饵料源能够调节机体肠道菌群组成,从而间接影响养殖生物的生长及健康[13-14]。
为调查不同饵料对刺参肠道组织及菌群结构的影响,本研究中以福建霞浦海域网箱养殖刺参为研究对象,利用肠道组织学和高通量测序技术,系统性解析了传统海带饵料和益生菌颗粒饲料对刺参肠道组织及肠道菌群结构特征的变化,以期为刺参网箱养殖精细化管理提供科学参考。
1 材料与方法
1.1 材料
2022年11月15日,于福建省霞浦县开展了不同饵料对刺参肠道组织及菌群结构的影响试验。试验材料均选自于同一批次体质量无显著性差异刺参,分别投喂传统海带饵料(HD组)和颗粒饲料(SL组),每个组别设置3个重复,每3天投喂1次,试验持续90 d。养殖期间,水深5 m以上,盐度为29,水温为13 ℃~20 ℃。试验结束后,每组随机采集9只体质量为(49.75±1.09)g刺参,在无菌条件下进行肠道组织取样。将组织切片样品固定在新鲜制备的体积分数为4%多聚甲醛溶液中;肠道菌群高通量测序样品收集至1.5 mL灭菌离心管内,液氮速冻,置于-80 ℃超低温冰箱中冷冻保存。
1.2 方法
1.2.1 饲料制作方式及营养成分测定 传统海带饵料组选用干制海带浸泡后与海泥、鱼糜混匀搅拌,添加0.1%的酵母菌发酵2 d后用于投喂。颗粒饲料由鱼粉、海泥及豆粕等多种原料并添加益生菌枯草芽孢杆菌制成。饲料中的粗蛋白质含量参照GB/T 6432—2018方法测定,粗脂肪含量参照GB/T 6433—2006方法测定,粗灰分含量参照GB/T 6438—2007方法测定,磷含量参照GB/T6437—2018方法测定,钙含量参照GB/T 6436—2018方法测定,赖氨酸、苏氨酸、缬氨酸和蛋氨酸含量参照GB/T 18246—2019方法测定。
1.2.2 生长性能测定 饲养期间记录刺参的喂料量、初始体质量和终末体质量,计算试验刺参各阶段的日增重(DWG,g)、特定生长率(SGR,%)和增重率(WGR,%)。计算公式为
(1)
(2)
(3)
表1 不同饵料组成及营养水平(干基)
Tab.1 Different food components and nutrient level(air-dry basis)

成分component组1海带饵料/gkelpfeed组2颗粒饲料/ggranulatedfeed鱼粉fishmeal-12.0鱼糜surimi5.0-鼠尾藻粉sargassomeal-5.0海泥seamud54.928.0全麦粉wholewheatmeal-15.0豆粕soybeanmeal-10.9浒苔粉enteromorphameal-28.0无机盐inorganicsalt-1.0海带渣kelpresidue40.0-益生菌probiotics--枯草芽孢杆菌(Bacillussubtilis)-0.1酵母菌yeast0.1-合计total营养水平nutrientlevel100.0100.0粗蛋白质crudeprotein/%24.77.4粗脂肪crudelipid/%11.45.1粗灰分crudeash/%73.863.5磷P/%0.20.1钙Ca/%0.91.4赖氨酸Lys/(g·kg-1)7.32.5苏氨酸Thr/(g·kg-1)6.41.8缬氨酸Val/(g·kg-1)8.62.2蛋氨酸Mel/(g·kg-1)3.11.2
1.2.3 切片制备 将固定在4%多聚甲醛溶液的肠道组织样品依次在50%(12 h)、70%(5 h)、80%(2 h)、90%(2 h)95%(1 h)和100%(连续脱水30 min两次)的乙醇下脱水,然后转移到二甲苯中透明,处理并嵌入石蜡。采用常规石蜡切片方法,切片厚度为10 μm,用苏木精染色,在Zeiss显微镜下观察并拍照,采用CaseViewer测量切片中至少12次肌层与黏膜层厚度。
1.2.4 高通量测序与肠道菌群分析 取100 mg液氮研磨的组织样本,置于EP管中,采用CTAB方法对样本的基因组DNA进行提取,之后采用20 g/L的琼脂糖凝胶电泳检测DNA的纯度和浓度,确保DNA质量符合要求。取适量的样本DNA于离心管中,采用无菌水稀释样本至1 ng/μL。以稀释后基因组DNA为模板,测序区域以细菌16S rRNA基因V3~V4片段的扩增引物515F(5′GTGCCAGCMGCCGCGG 3′)和806R(5′AGGGTATCTAATCCT 3′)进行PCR扩增。最后采用TruSeq® DNAPCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,采用NovaSeq 6000平台进行高通量测序。
1.2.5 肠道菌群分析 参照Qiime(v1.9.1)Tags质量控制流程,对原始数据进行优化,得到高质量的Tags数据。通过GitHub与物种注释数据库进行比对检测嵌合体序列,并去除其中的嵌合体序列,得到最终的有效数据Effective Tags。利用Uparse算法(v7.0.1001)对所有样本的全部Effective Tags进行聚类,默认以97%的一致性(identity)将序列聚类成为OTUs。
1.3 数据处理
采用Qiime软件(v1.9.1)计算肠道菌群Alpha多样性。Alpha多样性指数均以平均值±标准差表示,采用SPSS 20.0软件进行差异性分析。采用R软件(v2.15.3)绘制稀释Rank abundance曲线、物种累积曲线并采用R软件进行Alpha多样性指数组间差异分析。采用Qiime软件(v1.9.1)计算Unifrac距离并构建UPGMA样本聚类树。采用R软件(v2.15.3)绘制PCoA图。并进行Beta多样性指数组间差异分析。通过LEfSe分析发现差异菌群,识别各组别OTU水平的不同特征,默认设置LDA Score的筛选值为3.5,当LDA得分大于3.5时,评估这些菌群对组间差异的影响。
所有数据均以平均值±标准差(mean±S.D.)表示。所有数据的正态性采用Kolmogorov-Smirnov检验,卡方检验采用Levene检验。采用SPSS软件进行t检验分析,显著性差异设为0.05。
2 结果与分析
2.1 生长性能
从表2可见,与HD组相比,SL组刺参90 d日增重、特定生长率和增重率显著性提升(P<0.01)。由此可见,颗粒饲料相较于传统发酵海带饵料可提高刺参生长性能,并提高刺参饵料摄食量与利用率,有助于刺参营养吸收和机体生长。
表2 不同饵料投喂下刺参生长性能
Tab.2 Different feed sea cucumber on growth performance
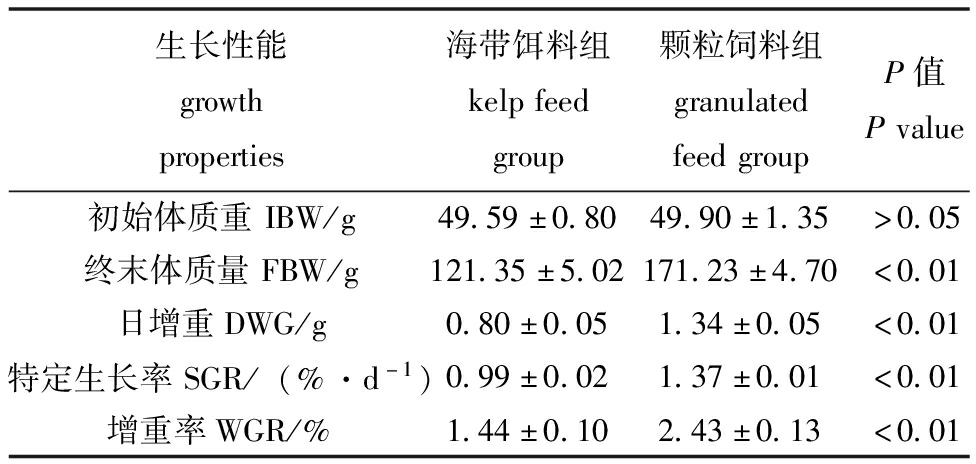
生长性能growthproperties海带饵料组kelpfeedgroup颗粒饲料组granulatedfeedgroupP值Pvalue初始体质重IBW/g49.59±0.8049.90±1.35>0.05终末体质量FBW/g121.35±5.02171.23±4.70<0.01日增重DWG/g0.80±0.051.34±0.05<0.01特定生长率SGR/(%·d-1)0.99±0.021.37±0.01<0.01增重率WGR/%1.44±0.102.43±0.13<0.01
2.2 刺参肠道组织切片
不同饵料下刺参肠道形态结构如图1所示。整体上,SL组刺参肠道结构正常,细胞边界清晰,接触紧密,肌肉层连续(图1(a))。而HD组刺参肠道存在组织学损伤,具体表现为肠道结构不完整,细胞间接触松散,肌肉层出现断裂现象,这与解剖时观测到的肠道断裂现象相符(图1(b))。刺参肠道组织由内向外依次为黏膜层、黏膜下层、肌层和浆膜层,黏膜下层紧挨着黏膜层,黏膜下层主要为疏松的结缔组织。肌肉由两层肌肉组织组成。浆膜层位于最外层,由较为疏松的结缔组织组成。通过30×视野观察测量切片中至少12次肌层与黏膜层厚度,结果显示,SL组黏膜层平均长度为(204.9±17.1)μm,显著性高于HD组黏膜层平均长度为(194.4±21.0)μm(P<0.05)(图1(c))。同时,SL组肌肉层平均厚度为(6.3±1.9)μm,同样表现为显著性高于HD组肌肉层平均厚度为(5.2±1.6)μm(P<0.05)(图1(d))。综上所述,相较于传统海带饵料,投喂颗粒饲料能够改善刺参肠道组织结构,促进机体的消化吸收能力。
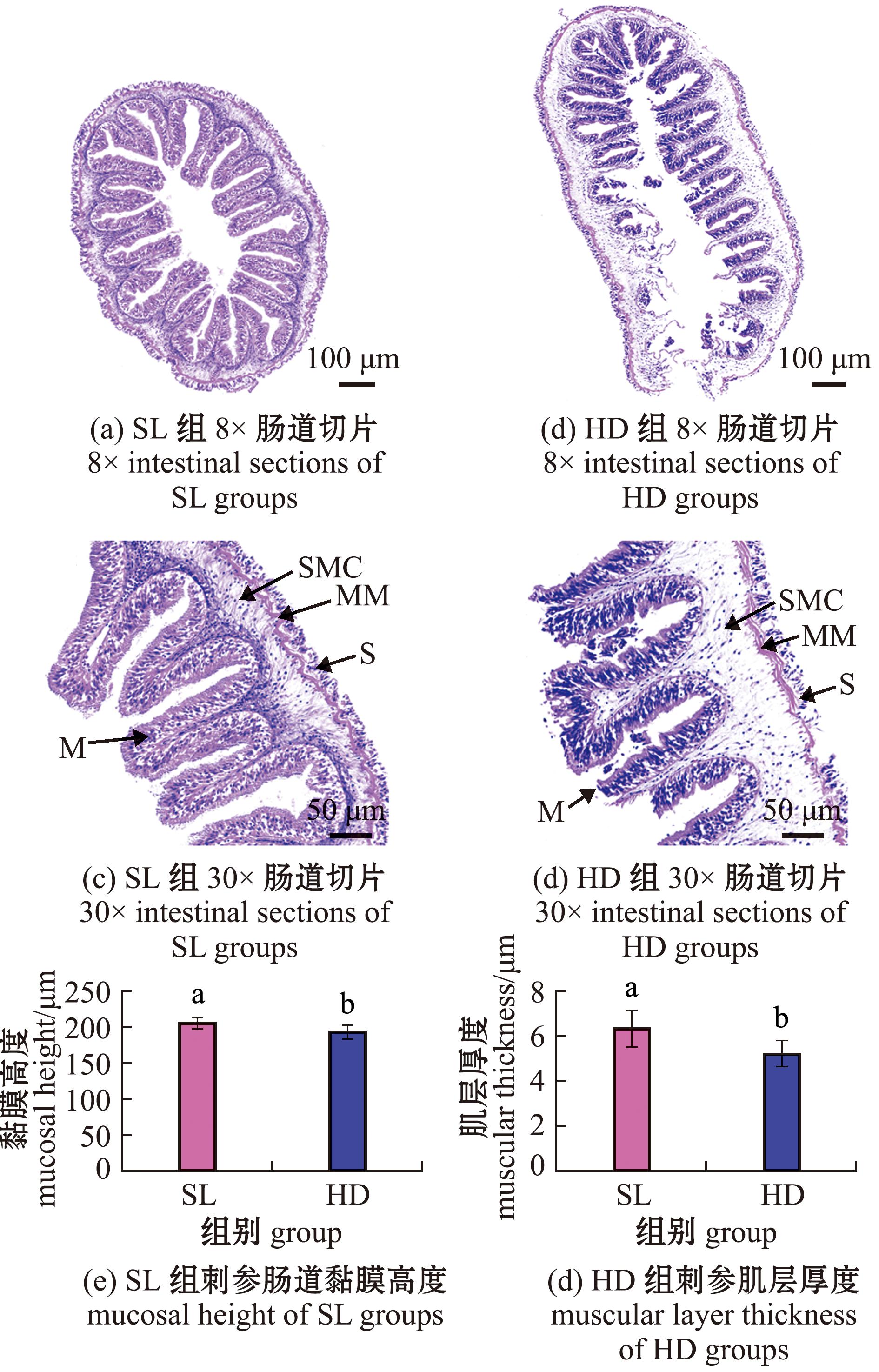
M—黏膜层;SMC—黏膜下层;MM—肌层;S—浆膜层。标有不同小写字母者表示组间有显著性差异(P<0.05)。
M—mucosal layer;SMC—submucosal layer;MM—muscular layer;S—plasma layer.The means with different letters being significantly different at the 0.05 probability level.
图1 不同饵料下刺参肠道切片
Fig.1 Gut tissues of sea cucumber under different food sources
2.3 高通量测序结果
从表3可见,不同饵料投喂下刺参肠道内容物样品经高通量测序共得原始序列123 274~134 288条,有效序列110 294~123 505条。样品有效率达85.41%~94.25%,表明测序结果能够真实反映样品信息。
表3 高通量测序结果
Tab.3 Results of high-throughput sequencing
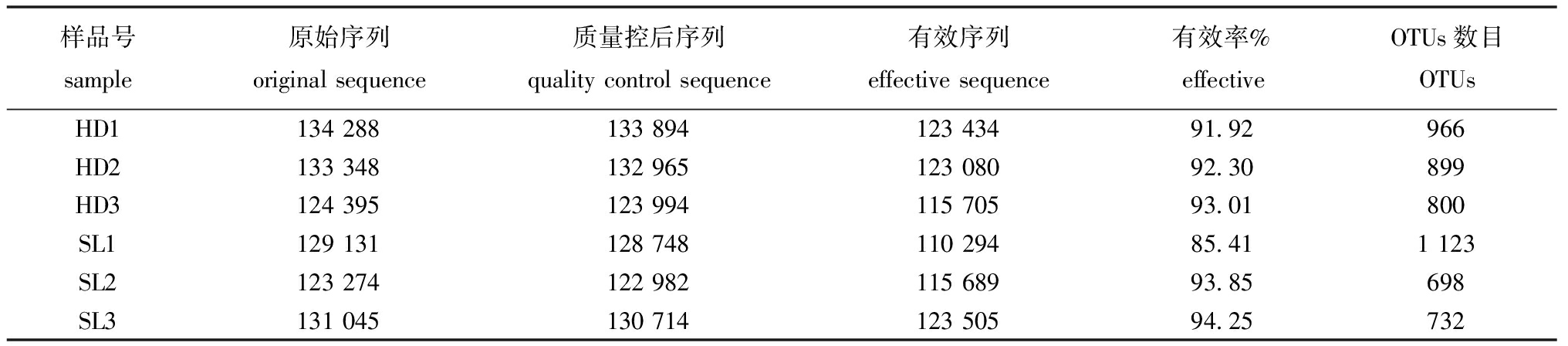
样品号sample原始序列originalsequence质量控后序列qualitycontrolsequence有效序列effectivesequence有效率%effectiveOTUs数目OTUsHD113428813389412343491.92966HD213334813296512308092.30899HD312439512399411570593.01800SL112913112874811029485.411123SL212327412298211568993.85698SL313104513071412350594.25732
2.4 Alpha多样性分析
ACE和Chao1指数常用于估算样品中菌群的丰度;Shannon和Simpson指数常用于估算样品中菌群的多样性。比较Alpha多样性指数得出(图2(a)~(d)),SL组菌群丰度呈现下降趋势,而菌群多样性表现为上升趋势,但不同饵料投喂下刺参肠道菌群丰度和多样性均不存在显著性差异(P>0.05)。
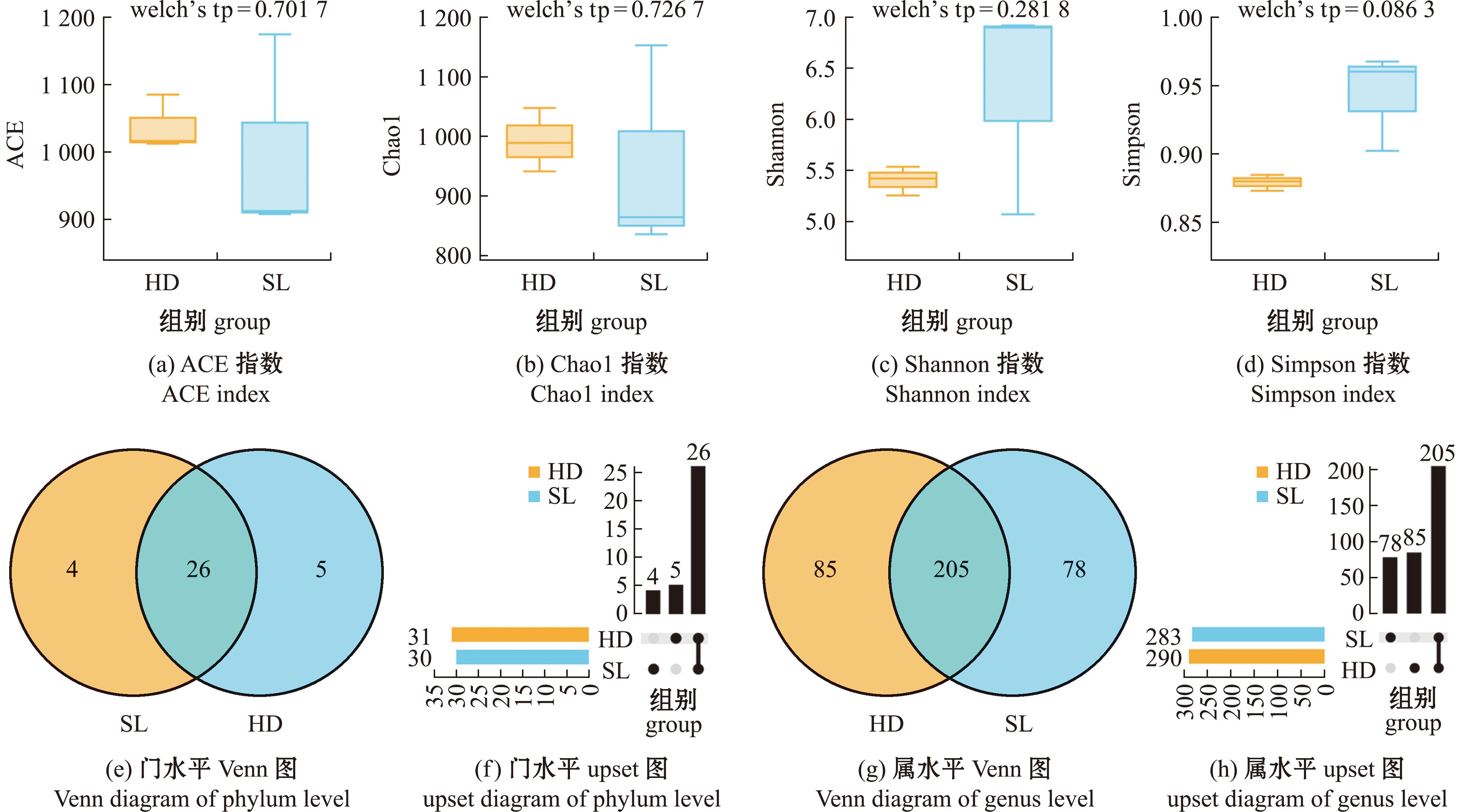
图2 不同饵料投喂下刺参肠道菌群结构
Fig.2 Gut microbiota structure of sea cucumber under different feeding sources
从图2(e)~(h)可见,门水平上,SL与HD组分别鉴定到30与31个微生物门类,其中共有微生物门类有26个,SL组特有门类4个,HD组特有门类5个。属水平上,SL组和HD组分别鉴定到283和290个菌属,其中共有菌属205个,SL组特有菌属78个,HD组特有菌属85个。
2.5 Beta多样性分析
在OTU水平上,根据加权Unifrac距离对不同样本进行偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)。其中,PC1(principal component)的贡献率为47.2%,PC2的贡献率为25.8%,总贡献率为73.0%(图3)。相同组别样品聚集在一起,表现出较好的生物重复性。不同饵料投喂组样品分布分散,说明组间群落结构存在一定差异。
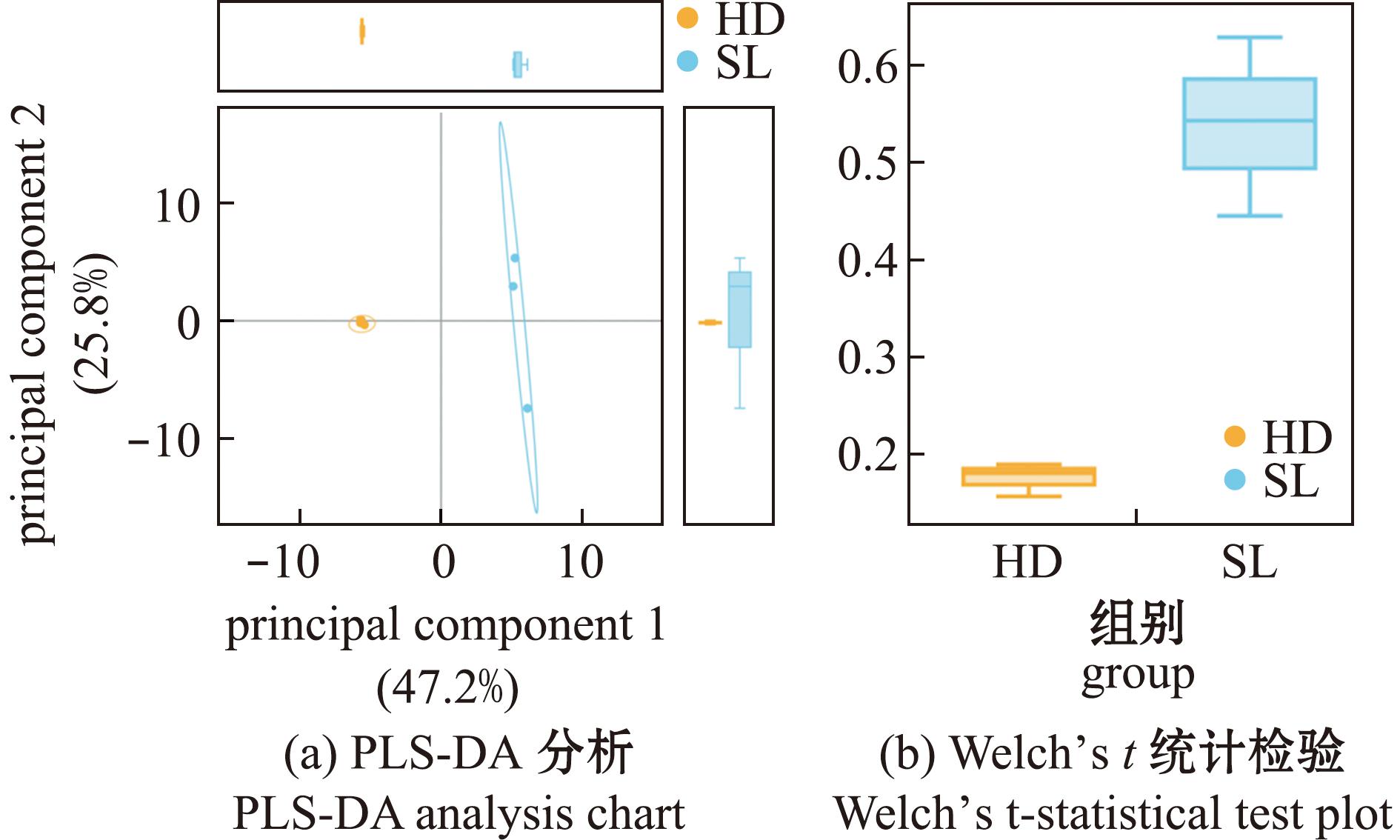
图3 不同饵料下刺参肠道菌群β分析
Fig.3 Intestinal microbiota of sea cucumber under different food sources β analysis
2.6 菌群结构特征分析
从图4可见,门水平下不同饵料刺参肠道第一优势菌门均为变形菌门(Proteobacteria),相对丰度占比为34.28%~47.75%。次优势菌门则呈现出显著差异,HD组与SL组次优势菌门分别为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),相对丰度占比分别为23.22%与31.80%。可以看出,投喂颗粒饲料后,厚壁菌门的优势地位随之提高,而拟杆菌门则呈现下降趋势。
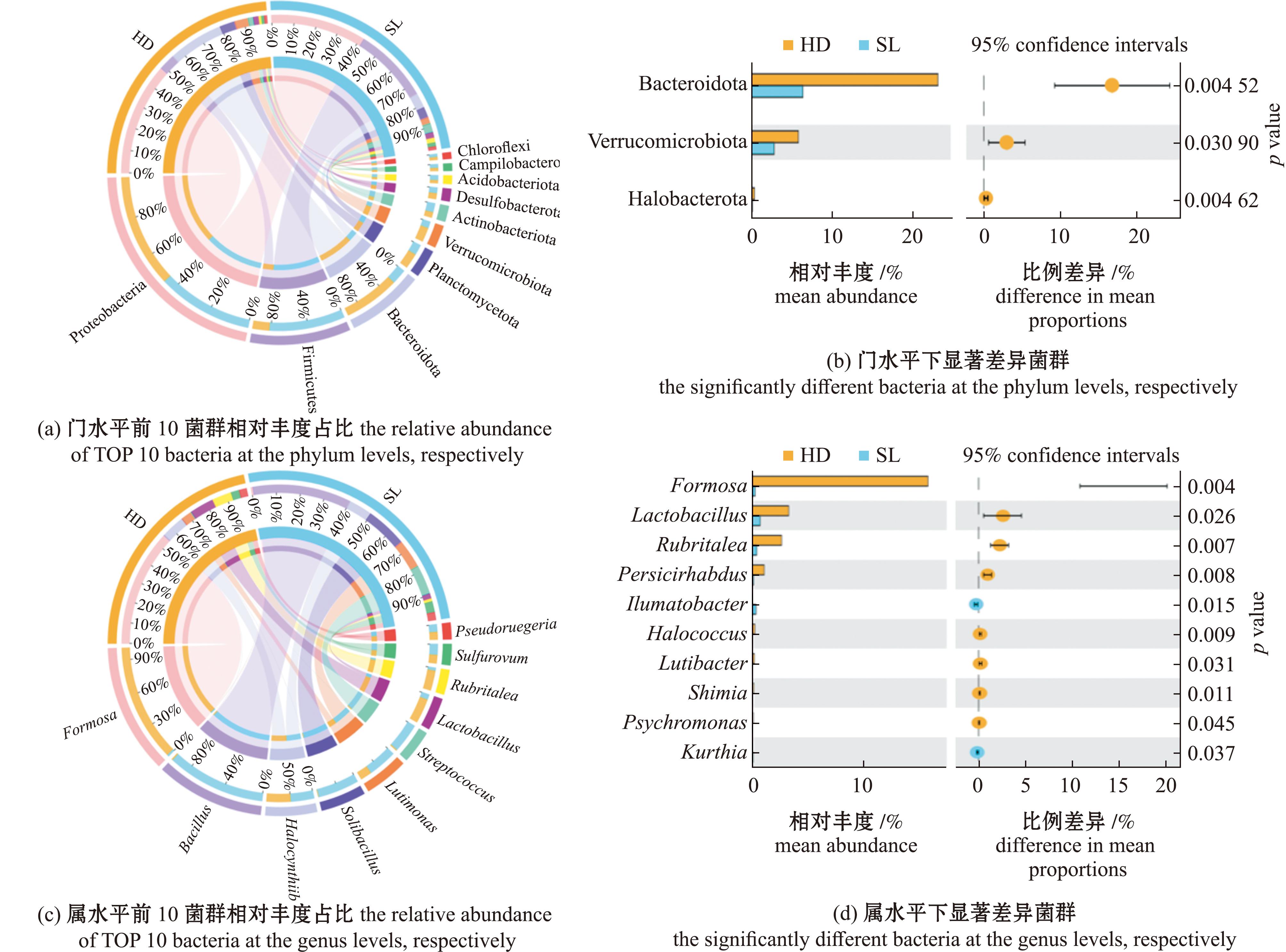
图4 不同饵料下刺参肠道菌群相对丰度
Fig.4 Relative abundance of gut microbiota in sea cucumber under different food sources
在属水平中,HD组与SL组的第一优势菌属呈现差异,分别为华美菌属(Formosa)与芽孢杆菌,相对丰度占比分别为15.82%和13.40%。而第二优势菌属一致,均为Halocynthiibacter,相对丰度占比分别为3.20%和3.19%。可以看出,投喂颗粒饲料改变了刺参肠道优势菌属的主导地位。根据线性判别法LEfSe分析显示(图5),SL组刺参肠道差异菌群主要为隶属于厚壁菌门下的芽孢杆菌和盐生枝芽孢杆菌(Virgibacillus),以及隶属于拟杆菌门下的Lutimonas;HD组刺参肠道差异菌群主要为隶属于变形菌门下的摩根氏菌属(Morganella)、土微菌属(Pedomicrobium)和Rubripirellula,疣微菌门(Verrucomicrobiota)下的 Persicirhabdus和Rubritalea,厚壁菌门下的魏斯氏菌(Weissella)和乳杆菌,以及隶属于拟杆菌门的华美菌属。
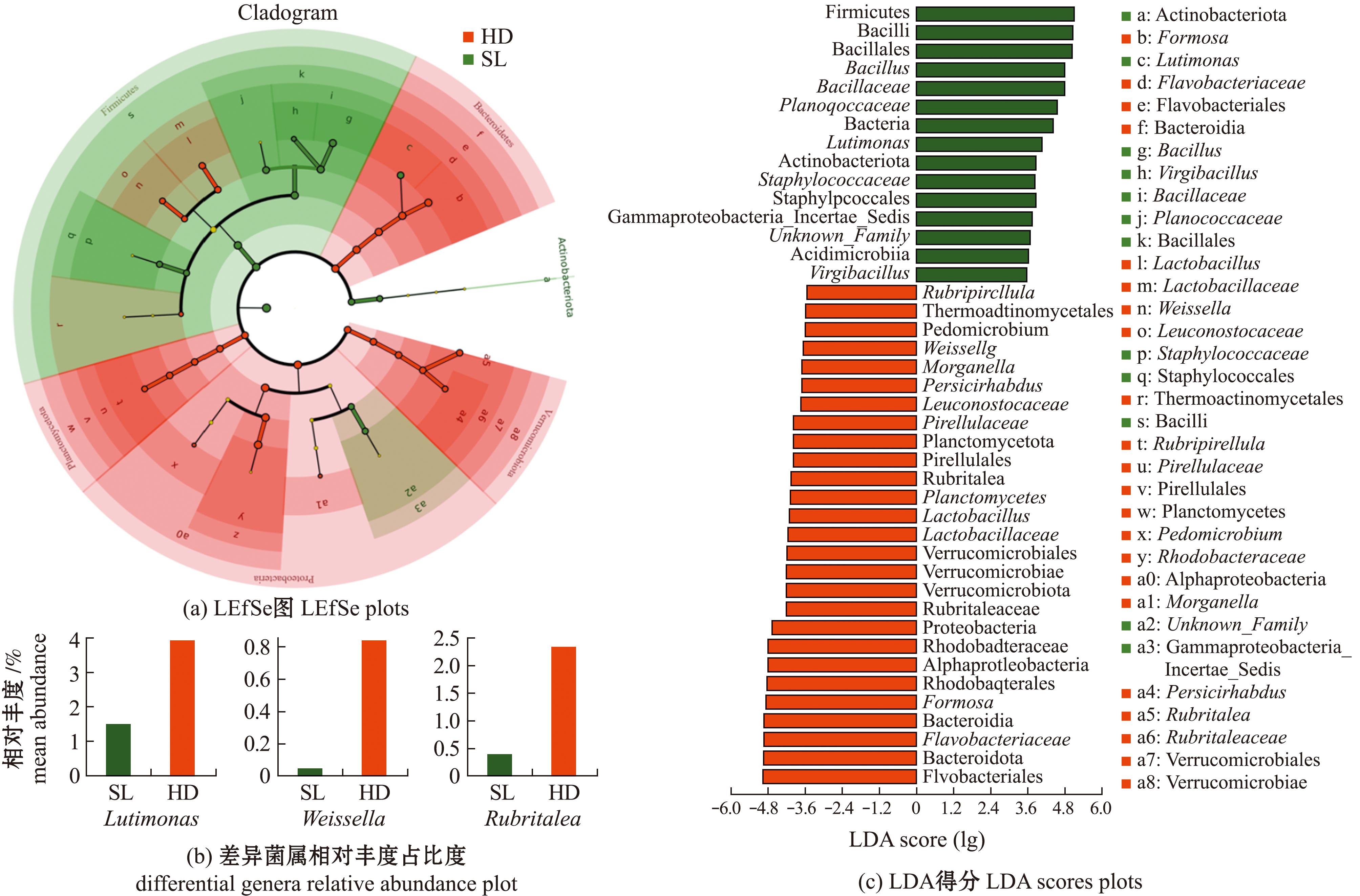
图5 不同饵料下刺参肠道菌群LEfSe分析
Fig.5 LEfSe analysis of gut microbiota in sea cucumber under different food sources
3 讨论
3.1 不同饵料投喂下刺参肠道组织结构特征
肠道组织形态学特征是一种快速诊断动物肠道结构状态的方法[15]。刺参肠道黏膜层上分布有微绒毛和分泌黏液的黏液细胞,富含各种消化酶,黏膜层是消化吸收的主要部位,其长度直接影响食物与肠道接触面积,间接影响着营养物质吸收和转运扩散的速度[16]。肠壁内发达的肌肉层可以有效促进食物与肠道消化酶充分接触,辅助消化吸收功能且推动食物团在肠道中移动。本研究中,HD组刺参局部肠道组织结构存在不完整的现象,对食物消化吸收具有一定负面影响。而SL组刺参肠道组织结构完整,接触紧密,表明投喂颗粒饲料更利于刺参肠道组织健康。同时,相较于HD组,SL组肠道黏膜层和肌肉层长度分别提高5.4%和21.2%,更长的黏膜层能够有效提高食物与肠道消化酶的充分接触效率,更厚的肌肉层有利于促进肠道蠕动,从而推动食物团在肠道中移动。因此,投喂颗粒饲料有助于提高刺参对于营养物质的吸收能力。
3.2 不同饵料投喂下刺参肠道菌群多样性特征
刺参具有独特的消化系统,体腔内只有一条简单的肠道,是研究肠道微生物变化的理想生物。肠道微生态系统是机体肠道内微生物与生境彼此相互作用和依赖的统一整体,肠道微生态是否处于一个平衡稳定的状态对动物机体健康生长具有较大影响[17]。本研究中,不同饲料源改变了刺参肠道菌群结构特征,具体表现为菌属间优势地位的变化,但该变化未对刺参肠道菌群丰度及多样性产生显著性影响(P>0.05)。目前,针对益生菌对动物肠道菌群的影响报道较多,如在刺参日粮中添加益生菌Paracoccus marcusii DB11和Bacillus cereus G19造成刺参肠道中Flavobacteriaceae相对丰度显著变化,但未对其肠道菌群丰度和多样性产生显著改变(P>0.05)[18]。在刺参日粮中添加益生菌鼠李糖乳杆菌投喂30 d后,刺参肠道次优势菌门发生显著变化,而核心微生物群与对照组保持不变,且菌群丰度和多样性均未发生显著性变化(P>0.05)[12]。在大西洋鲑(Salmo salar)饲料中添加乳杆菌能造成其肠道微生物谱发生改变,但其肠道菌群与多样性均未发生显著性变化(P>0.05)。以上结论在人类肠道菌群研究中也得到相似结果[19]。综上所述,饲料中添加益生菌能够促进刺参肠道微生物的稳定共生,有助于维持肠道微生物群落的平衡状态,同时不会大幅改变宿主固有的肠道菌群结构。
3.3 不同饵料投喂下刺参肠道菌群组成特征
饲料是改变宿主肠道细菌群落最重要的因素之一[20]。本研究结果显示,颗粒饲料参与调节了刺参肠道菌群组成,然而,相比于传统海带饲料,并未改变刺参肠道第一优势菌门(变形菌门)的优势地位,这与已有的调查结论相一致[9]。颗粒饲料中添加芽孢杆菌显著改变了厚壁菌门与拟杆菌门的比例,其中厚壁菌门的相对丰度提高了24.89%,而拟杆菌门相对丰度降低了16.83%,厚壁菌门相对丰度显著上调是由于隶属于该门类的芽孢杆菌显著增加(P<0.05)。芽孢杆菌作为一种益生菌,在饲料中添加能够促进刺参生长,提高免疫能力和抗病能力[21]。如在饲料中添加Bacillus sp.BC26投喂刺参56 d后,显著提高了刺参的生长性能,以及胃蛋白酶、脂肪酶和胰蛋白酶等消化酶的活性,并提高了刺参的免疫能力[22]。饲料中添加Bacillus amyloliquefaciens CQN-12和CQN-2能够提高刺参生长性能,改善免疫能力,并改变了刺参肠道微生物的定植[23]。本试验中,使用富含芽孢杆菌益生菌颗粒饲料投喂90 d后,芽孢杆菌相对丰度在刺参肠道显著性提高了13.31%,说明该菌属成功在刺参肠道中定植。
投喂传统海带饵料组刺参肠道次优势菌门为拟杆菌门,主要原因是因为隶属于其门下的华美菌属相对丰度(15.82%)的优势地位所决定,这与先前报道的刺参肠道群落优势菌属相吻合[24]。华美菌属是一种革兰氏阴性菌,首次从角质褐藻(Fucus evanescens)中被分离出来[25]。研究表明,华美菌属具有多糖利用点位和多糖降解相关的核心基因簇,在多糖降解方面起着重要作用[26]。华美菌属基因功能解释了其在海带饲料投喂下占据优势地位的原因,由于海带富含多种海带多糖成分,如岩藻聚糖、褐藻胶及褐藻淀粉等[27]。华美菌属的优势地位有利于刺参更高效地利用海带饲料。
不同饵料还导致一些差异菌属的存在,如益生菌颗粒饲料投喂组中产生了部分益生差异菌属,如盐生枝芽孢杆菌和Lutimonas。其中,盐生枝芽孢杆菌具有分泌蛋白酶的功能,有助于刺参消化食物,为其生长提供必要的营养[28]。Lutimonas作为一种有益菌,可能参与毒素降解和有益代谢物的产生[29]。这些潜在益生菌在宿主肠道中定植,有助于提高宿主消化吸收及免疫能力,并形成新的肠道微生态,从而在宿主生理机能方面发挥更好作用。而传统海带饲料组中的差异菌属包括摩根氏菌属和Rubritalea。其中,摩根氏菌属是一种兼性厌氧杆状革兰氏阴性肠道微生物,该属的Morganii被认为是一种较为罕见的条件致病菌,能够引起多种感染[30]。该条件致病菌在刺参肠道中被发现,可能是粗糙的浸泡海带制作工艺及廉价易腐烂的海带原料导致饲料中滋生大量有害细菌,刺参摄食后进入肠道,并在刺参肠道中定植。有害菌能够破坏刺参肠道组织、诱发肠道炎症反应,影响宿主消化吸收能力,甚至造成刺参染病,导致宿主生长性能降低,甚至死亡。而选择投喂新型益生菌颗粒饲料后,该菌属消失,说明益生菌颗粒饲料具有更安全可靠的性质,能够保证刺参肠道中益生菌的定植,促进刺参肠道微生态稳定。Rubritalea在海洋环境中广泛存在,具有多种多糖降解基因,能够显著提高多糖的降解[31]。使用传统海带饵料的刺参肠道中具有更多促进多糖分解的微生物,说明肠道菌群在辅助宿主对食物消化中具有重要作用,而当食物类型发生变化时,肠道菌群组成也会随之变化。
4 结论
1)在刺参养殖过程中,采用颗粒饲料能够有效提高刺参的生长效率。
2)颗粒饲料能在不破坏原有刺参肠道菌群多样性和丰度的前提下,改变刺参肠道微生物群落组成,促进微生态稳定及益生菌在肠道中定植,并降低潜在条件致病菌的相对丰度。
[1] WANG Z C,CUI J,SONG J,et al.Integration of small RNAs and mRNAs by high-throughput sequencing reveals a complex regulatory network in Chinese sea cucumber,Russian sea cucumber and their hybrids[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2019,29:1-13.
[2] 姜森颢,任贻超,唐伯平,等.我国刺参养殖产业发展现状与对策研究[J].中国农业科技导报,2017,19(9):15-23.JIANG S H,REN Y C,TANG B P,et al.Development status and countermeasures of Apostichopus japonicus culture industry in China[J].Journal of Agricultural Science and Technology,2017,19(9):15-23.(in Chinese)
[3] SØRENSEN J S,MADSEN S K,BANG-BERTHELSEN C H,et al.Quality and safety aspects in fermentation of winged kelp (Alaria esculenta) and sugar kelp (Saccharina latissima) by the natural microbiota with or without addition of a Lactiplantibacillus plantarum starter culture[J].Food Research International,2021,150:110800.
[4] 荣小军.刺参肠道菌群结构对环境变化的响应及其与疾病发生的相关性[D].青岛:中国海洋大学,2012.RONG X J.Response of intestinal flora structure of Stichopus japonicus to environmental changes and its correlation with disease occurrence[D].Qingdao:Ocean University of China,2012.(in Chinese)
[5] 于悦,任昕淼,付晓丹,等.刺参肠道菌群的研究进展[J].安徽农业科学,2022,50(7):19-22.YU Y,REN X M,FU X D,et al.Research progress on intestinal microbiota of Apostichopus japonicus[J].Journal of Anhui Agricultural Sciences,2022,50(7):19-22.(in Chinese)
[6] 郭超,张东升,林青,等.3种水质调控方式下春季参池环境及刺参肠道的细菌群落结构[J].大连海洋大学学报,2019,34(3):338-344.GUO C,ZHANG D S,LIN Q,et al.Bacterial flora structures in intestinal tract and pond environment of sea cucumber under three water quality regulation methods in spring[J].Journal of Dalian Ocean University,2019,34(3):338-344.(in Chinese)
[7] 包鹏云,李璐瑶,陈炜,等.饲料中添加混合益生菌对幼参生长、消化酶活力和体壁营养组成的影响[J].大连海洋大学学报,2018,33(1):52-56.BAO P Y,LI L Y,CHEN W,et al.Effects of dietary supplementation of probiotcs on growth,digestive enzyme activity and nutrient profile of body wall in juvenile sea cucumber Apostichopus japonicus[J].Journal of Dalian Ocean University,2018,33(1):52-56.(in Chinese)
[8] 唐曼玉,王晚晴,强敬雯,等.益生菌与肠道菌群、免疫调节的相互作用与机制研究进展[J].食品工业科技,2022,43(16):486-493.TANG M Y,WANG W Q,QIANG J W,et al.Interaction and mechanism of probiotics with gut flora and immune regulation:a review[J].Science and Technology of Food Industry,2022,43(16):486-493.(in Chinese)
[9] WANG X D,ZHOU Z C,GUAN X Y,et al.Effects of dietary Lactobacillus acidophilus and tussah immunoreactive substances supplementation on physiological and immune characteristics of sea cucumber (Apostichopus japonicus)[J].Aquaculture,2021,542:736897.
[10] ZHANG Q,MA H M,MAI K S,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus[J].Fish &Shellfish Immunology,2010,29(2):204-211.
[11] KU G.The influence of lactic acid bacteria and metabolites on intestinal microflora and nonspecific immunity of juvenile sea cucumber (Apostichopus japonicus)[J].Marine Sciences,2013,37:7-12.
[12] LI Y,ZHAO Y C,LIU X,et al.Effects of endogenous potential probiotic Lactobacillus rhamnosus M2-4 on intestinal microflora and metabonomics in juvenile sea cucumber Apostichopus japonicus[J].Aquaculture,2022,555:738247.
[13] HUBER I,SPANGGAARD B,APPEL K F,et al.Phylogenetic analysis andin situ identification of the intestinal microbial community of rainbow trout (Oncorhynchus mykiss,Walbaum)[J].Journal of Applied Microbiology,2004,96(1):117-132.
[14] SAVA![]() S,KUBILAY A,BASMAZ N.Effect of bacterial load in feeds on intestinal microflora of seabream (Sparus surata) larvae and juveniles[J].Israeli Journal of Aquaculture-Bamidgeh,2005,57:3-9.
S,KUBILAY A,BASMAZ N.Effect of bacterial load in feeds on intestinal microflora of seabream (Sparus surata) larvae and juveniles[J].Israeli Journal of Aquaculture-Bamidgeh,2005,57:3-9.
[15] 张家荣,高云涛,高云红,等.大型围栏适养海水鱼类肠道组织学比较[J].水产学报,2024,48(8):102-113.ZHANG J R,GAO Y T,GAO Y H,et al.Comparison of fish intestinal histology in offshore aquaculture net pen[J].Journal of Fisheries of China,2024,48(8):102-113.(in Chinese)
[16] 王涵,王浩娜,赵业.刺参肠道组织结构及消化酶活性分析[J].大连海洋大学学报,2022,37(5):823-829.WANG H,WANG H N,ZHAO Y.Histological structure and digestive enzyme activity of intestine in sea cucumber Apostichopus japonicus[J].Journal of Dalian Ocean University,2022,37(5):823-829.(in Chinese)
[17] 刘美如,王力,叶仕根,等.刺参肠道菌群的研究进展[J].黑龙江畜牧兽医,2018(3):81-84.LIU M R,WANG L,YE S G,et al.Research progress on intestinal flora of Stichopus japonicus[J].Heilongjiang Animal Science and Veterinary Medicine,2018(3):81-84.(in Chinese)
[18] YANG G,PENG M,TIAN X L,et al.Molecular ecological network analysis reveals the effects of probiotics and florfenicol on intestinal microbiota homeostasis:an example of sea cucumber[J].Scientific Reports,2017,7(1):4778.
[19] KRISTENSEN N B,BRYRUP T,ALLIN K H,et al.Alterations in fecal microbiota composition by probiotic supplementation in healthy adults:a systematic review of randomized controlled trials[J].Genome Medicine,2016,8(1):52.
[20] 麦浩彬,郭鑫伟,王金港,等.摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼幼鱼肠道组织形态和菌群组成的影响[J].大连海洋大学学报,2020,35(1):63-70.MAI H B,GUO X W,WANG J G,et al.Effects of dietary protein levels on intestinal tract histomorphology and microflora composition in juvenile pearl gentian grouper (Epinephelus lanceolatu♂×E.fuscoguttatus♀)[J].Journal of Dalian Ocean University,2020,35(1):63-70.(in Chinese)
[21] 郭庆丰,陈林,马经纬.凝结芽孢杆菌益生机制及应用研究进展[J].食品研究与开发,2018,39(18):208-213.GUO Q F,CHEN L,MA J W.Research advances in the probiotics mechanism and application of Bacillus coagulans[J].Food Research and Development,2018,39(18):208-213.(in Chinese)
[22] MA Y X,LI L Y,BAO P Y,et al.Effects of combined dietary administration of Rhodotorula sp.H26 and Bacillus sp.BC26 on growth,immunity and intestinal microbiota in juvenile sea cucumber,Apostichopus japonicus[J].Aquaculture Research,2018,49(12):3792-3803.
[23] LU Z,YANG Q H,LIN Q,et al.Effects of Bacillus spp.on growth,gut microbiota compositions and immunity of sea cucumber (Apostichopus japonicus)[J].Aquaculture Research,2021,52(8):3978-3990.
[24] ZHANG J J,ZHOU Y Q,WANG L,et al.Asymmetry evaluation of sea cucumber (Apostichopus japonicus) gut and its surrounding environment in the bacterial community[J].Symmetry,2022,14(6):1199.
[25] IVANOVA E P,ALEXEEVA Y V,FLAVIER S,et al.Formosa algae gen.nov.,sp.nov.,a novel member of the family flavobacteriaceae[J].International Journal of Systematic and Evolutionary Microbiology,2004,54(3):705-711.
[26] TERAVEST M A,HE Z,ROSENBAUM M A,et al.Regulated expression of polysaccharide utilization and capsular biosynthesis loci in biofilm and planktonic Bacteroides thetaiotaomicron during growth in chemostats[J].Biotechnology and Bioengineering,2014,111(1):165-173.
[27] KIM S K,BHATNAGAR I.Chapter 7 physical,chemical,and biological properties of wonder kelp:Laminaria[J].Advances in Food and Nutrition Research,2011,64:85-96.
[28] LI F H,GAO F,TAN J,et al.Characterization and identification of enzyme-producing microflora isolated from the gut of sea cucumber Apostichopus japonicus[J].Chinese Journal of Oceanology and Limnology,2016,34(1):153-162.
[29] DUAN Y F,WANG Y,LIU Q S,et al.Changes in the intestine microbial,digestion and immunity of Litopenaeus vannamei in response to dietary resistant starch[J].Scientific Reports,2019,9(1):6464.
[30] LIU H,ZHU J M,HU Q W,et al.Morganella morganii,a non-negligent opportunistic pathogen[J].International Journal of Infectious Diseases,2016,50:10-17.
[31] MARTINEZ-GARCIA M,BRAZEL D M,SWAN B K,et al.Capturing single cell genomes of active polysaccharide degraders:an unexpected contribution of Verrucomicrobia[J].PLoS One,2012,7(4):e35314.